Method Article
استجواب علم الأحياء الميكانيكي البصري الشامل للبروتين المرتبط ب Yes في السرطان البشري والخلايا الطبيعية باستخدام نظام متعدد الوظائف
* These authors contributed equally
In This Article
Summary
تقدم هذه الورقة بروتوكولا مفصلا تدريجيا حول كيفية استخدام نظام متكامل متعدد الوظائف وقابل للبرمجة من قبل المستخدم يمكن التصوير التلقائي متعدد القنوات والتحليل الميكانيكي البيولوجي لتوضيح الحساسية الميكانيكية للبروتين المرتبط ب Yes (YAP).
Abstract
يتطلب التصوير والتحليل متعدد الوظائف طويل الأجل للخلايا الحية تنسيقا مبسطا ووظيفيا لمختلف منصات الأجهزة والبرمجيات. ومع ذلك ، فإن التحكم اليدوي في المعدات المختلفة التي تنتجها مختلف الشركات المصنعة يتطلب عمالة كثيفة وتستغرق وقتا طويلا ، مما قد يقلل من دقة البيانات المكتسبة وقابليتها للتكرار وجودتها. لذلك ، فإن النظام المتكامل والقابل للبرمجة من قبل المستخدم والذي يتيح الحصول على صور تلقائية ومتعددة الوظائف وطويلة الأجل ومتوافق مع معظم منصات الفحص المجهري الفلوري يمكن أن يفيد المجتمع العلمي. تقدم هذه الورقة بروتوكولات التشغيل الكاملة لاستخدام نظام برمجي متكامل جديد يتكون من (1) برنامج برمجي محلي الصنع ، بعنوان "برنامج التكامل التلقائي متعدد الوظائف (AMFIP)" ، والذي يتيح الحصول التلقائي على التصوير متعدد القنوات ، و (2) مجموعة من التحليل الكمي للتصوير وحزم حساب الجر الخلوي.
يتم تطبيق هذا النظام المتكامل للكشف عن العلاقة غير المعروفة سابقا بين التوزيع المكاني والزماني للبروتين المرتبط ب Yes الحساس للميكانو (YAP) وميكانيكا الخلايا ، بما في ذلك انتشار الخلايا والجر ، في الخلايا الطبيعية البشرية المهندسة CRISPR / Cas9 (B2B) وخلايا سرطان الرئة (PC9). وبالاستفادة من قدرة هذا النظام على التحكم والقراءة متعددة القنوات، تظهر النتيجة ما يلي: (1) تظهر الخلايا الطبيعية B2B والخلايا السرطانية PC9 علاقة متميزة بين التعبير YAP والجر وديناميكيات الخلايا أثناء عمليات انتشار الخلايا وهجرها؛ و (2) تطبق الخلايا السرطانية PC9 قوى ملحوظة شبه نووية على الركائز. باختصار ، تقدم هذه الورقة بروتوكولا مفصلا تدريجيا حول كيفية استخدام نظام متكامل قابل للبرمجة من قبل المستخدم يمكن التصوير والتحليل التلقائي متعدد الوظائف لتوضيح حساسية ميكانو YAP. تفتح هذه الأدوات إمكانية الاستكشافات التفصيلية لديناميكيات الإشارات متعددة الأوجه في سياق فسيولوجيا الخلية وعلم الأمراض.
Introduction
الهدف العام لهذه الطريقة هو تمكين التصوير البصري متعدد الوظائف وتحليل الخلايا الحية. برنامج التصوير الكل في واحد الذي يتيح التنسيق التلقائي للأجهزة الإلكترونية البصرية متعددة الوظائف سيقلل من العمليات اليدوية كثيفة العمالة والمعرضة للخطأ وهو ضروري للباحثين لإجراء تصوير طويل الأجل للخلايا الحية1،2،3،4. ومع ذلك ، فإن معظم البرامج العامة الحالية في مجتمع البحوث الطبية الحيوية إما تنطبق فقط على الأجهزة الإلكترونية البصرية المحدودة أو تتطلب أجهزة إضافية لتنسيق المعدات المختلفة5،6،7،8،9. في الآونة الأخيرة ، تم تطوير برنامج مفتوح المصدر وقائم على البرمجيات ، بعنوان "برنامج التكامل التلقائي متعدد الوظائف (AMFIP)" ، مما يتيح التصوير متعدد القنوات والفاصل الزمني. استنادا إلى لغة Java وواجهة برمجة التطبيقات (API) الخاصة ب μManager11,12 ، تم تطوير AMFIP كمكون إضافي في μManager يقوم بتنفيذ نصوص Java مخصصة لإنجاز الاتصالات القائمة على البرامج للعديد من الأجهزة الإلكترونية البصرية ومنصات البرامج ، بما في ذلك على سبيل المثال لا الحصر تلك الموجودة في Nikon. ويتيح إنشاء هذا البرنامج إمكانية إجراء استجواب قابل للبرمجة ومتعدد الوظائف لسلوكيات الخلايا. تم تطوير نظام تجريبي وحسابي متكامل في هذه الورقة ويجمع بين AMFIP وتحليل التصوير الرقمي والفحص المجهري لقوة الجر الخلوي. يتيح النظام توضيح البيولوجيا الميكانيكية YAP المميزة في خطوط الخلايا الطبيعية B2B البشرية (الشكل 1) وسرطان الرئة PC9 (الشكل 2) المهندسة من قبل CRISPR / Cas9. يوفر النظام للمجتمع العلمي حلا شاملا يتجنب الطلب على شراء أجهزة تحكم إضافية قد لا تكون متاحة و / أو متوافقة مع كل نظام تصوير.
تقدم البروتوكولات المقدمة في هذه الورقة كيفية (1) تطبيق AMFIP لإجراء تصوير تلقائي طويل الأجل لكل من خطوط الخلايا المصممة بواسطة CRISPR / Cas9 والتي تعبر عن YAP الموسومة ب mNEonGreen2 ؛ و (2) الجمع بين فيجي ImageJ و MATLAB و Origin للتحليل الكمي لنسبة YAP النووية / السيتوبلازم (N / C) بناء على شدتها الفلورية (الشكل 3 والشكل 4) ، ومجال الإزاحة الخلوية (الشكل 1C والشكل 2C) ، ومجال الجر الخلوي (الشكل 1D والشكل 2D ). تشير النتائج إلى أنه (1) خلال أول 10 ساعات من انتشار الخلايا على الركائز التي لها صلابة ميكانيكية ذات صلة فسيولوجية13،14،15،16،17،18 ، تظهر نسبة YAP N / C للخلايا B2B المفردة تباينا وتقلبا أكثر وضوحا يعتمد على الوقت مقارنة بخلايا PC9 المفردة (الشكل 5 والشكل 6 ); و (2) تولد الخلايا السرطانية PC9 قوة جذب ملحوظة في مناطقها المحيطة بالطاقة النووية (الشكل 7). يتجاوز النظام المتكامل والمنهجيات الموصوفة في هذا البروتوكول الأنواع المحددة من الخلايا والجزيئات البصرية الوراثية. يمكن للباحثين تطبيق البروتوكولات لتخصيص تجارب استجواب الخلايا الحية المحددة الخاصة بهم وتوضيح ديناميكيات الإشارات متعددة الأوجه في سياق فسيولوجيا الخلية وعلم الأمراض.
Protocol
1. توليد خط خلايا سرطان الرئة البشري المستقر CRISPR / Cas9 (PC9) وخط الخلايا الظهارية القصبية البشرية (Beas2B) الذي يعبر داخليا عن بروتين YAP الموسومة mNeonGreen21-10/11
- قم بإجراء تفاعل البوليميراز المتسلسل (PCR) لتضخيم تسلسل الحمض النووي الذي يرمز إلى الشريط 11th من البروتين الفلوري ، mNeonGreen2 ، باستخدام بوليميراز الحمض النووي عالي الدقة (انظر جدول المواد).
- أدخل تسلسل الحمض النووي المضخم في الموقع الجينومي YAP لخطوط خلايا PC9 و B2B باستخدام نظام تحرير الجينات CRISPR-Cas9.
ملاحظة: يكمل تسلسل الحمض النووي هذا الخيوط 1-10 من mNeonGreen2 لإصدار التألق. خريطة التسلسل الجينومي ل YAP-mNeonGreen21-10/11 موضحة في الشكل التكميلي S1. تحتوي الخريطة على تسلسلات الجينوم والمتبرع وmNeonGreen2 المسماة. - تحقق من تعبير mNeonGreen2 المصمم بواسطة CRISPR/Cas9 باستخدام مجهر فوق فلوري (انظر جدول المواد). نظرا لأن mNeonGreen2 يتم وضع علامة عليه إلى YAP كلما عبرت الخلايا عن YAP في سياق شبكتها التنظيمية الجينية الأصلية ، تحقق من وجود كثافة التألق في كل من الخلايا المهندسة CRISPR / Cas9 ومقارنتها بتلك الموجودة في الخلايا الأبوية (التحكم).
ملاحظة: لاتباع هذا البروتوكول، استخدم (1) ليزر 488 نانومتر (47.5 مللي واط/مم2) للإثارة، و(2) هدف 40x (فتحة العددية (NA) = 0.95) ومرشح انبعاث تمرير النطاق (ET525/50 نانومتر) لقياس التألق، و(3) برنامج ImageJ لقياس شدة التألق وتحديدها كميا ومقارنتها. - تأكيد التكامل الصحيح ل mNeonGreen211 عن طريق استخراج الحمض النووي الجيني من خطوط الخلايا المعدلة بواسطة CRISPR / Cas9 ؛ إجراء تفاعل البوليميراز المتسلسل باستخدام الاشعال التي تحيط بالإدراج الجينومي والتسلسل لتأكيد الإدخال في الموقع الجينومي الصحيح19,20.
- قم بهدم mNeonGreen211 باستخدام نظام تحرير الجينات CRISPR / Cas9 ، وتحقق من انخفاض كثافة التألق في الخلايا باستخدام نفس أنظمة المجهر ومعلمات التصوير الموضحة في الخطوة 1.3.
ملاحظة: تؤكد هذه الخطوة التكامل الصحيح ل mNeonGreen211 من خلال مقارنة شدة التألق. يتم استخدام الخلايا المصممة بواسطة CRISPR / Cas9 بدون ضربة قاضية والخلايا الأبوية كعنصر تحكم. - جمع الخلايا مع البروتين الموسوم من الاهتمام من خلال فرز الخلايا المنشطة بالتألق (FACS).
- لإعداد الخلايا لفرز FACS ، قم بتثبيتها وإعادة تعليقها في محلول ملحي مخزن بالفوسفات (PBS).
- جمع الخلايا مع التألق mNeonGreen2 فوق مستوى الخلفية من خطوط الخلايا الأبوية في جولتين إثراء من فرز FACS.
ملاحظة: المخطط الزمني لإنشاء خطوط الخلايا التي تم تحريرها بواسطة CRISPR/Cas9 الموضحة هنا هو في حدود 1-2 أشهر. يتم توفير جميع خطوط الخلايا للجمهور عند الطلب حتى تتمكن مختبرات الأبحاث الأخرى من إعادة إنتاج النتائج.
2. صيانة خلايا PC9 و B2B
- الحفاظ على كلا الخطين الخلويين في حاضنات زراعة الأنسجة الرطبة مع 5٪ CO2 عند 37 درجة مئوية.
- ثقافة 106 خلايا PC9 و Beas2B الموسومة داخليا في قوارير 75 سم 2 مع 12 مل من RPMI-1640 المتوسطة تستكمل مع 10 ٪ مصل البقر الجنين و 100 ميكروغرام / مل البنسلين الستربتومايسين. الزراعة الفرعية كلا الخطين الخلويين عندما يصل التقاء الخلية إلى ~ 80٪.
- اختبر كلا الخطين الخلويين بحثا عن الميكوبلازما كل 3 أشهر باستخدام مجموعة أدوات الكشف عن الميكوبلازما ، باتباع جميع البروتوكولات الموصى بها من قبل الشركة المصنعة بدقة.
- قم بتخزين خطوط الخلايا في ثلاجة -80 درجة مئوية.
- استخدم خطوط الخلايا التي <20 مقطعا من ذوبان الجليد لجميع التجارب.
3. إعداد بيئة الأجهزة والبرامج
- إعداد بيئة الأجهزة للتجربة
- قم بتوصيل وحدة التحكم البؤرية والمجهر المقلوب بالكمبيوتر (انظر جدول المواد).
- قم بتثبيت منصة البرنامج (جدول المواد).
- قم بتشغيل وحدة التحكم البؤرية والمجهر المقلوب. بعد ذلك ، قم بتشغيل العناصر.
- افتح لوحات التحكم الخاصة بالمجهر الكونفوكال والليزر والمجهر المقلوب في Elements. بعد ذلك ، تحقق مما إذا كانت الألواح الثلاثة تعمل بشكل صحيح عن طريق اختبار حركة المرحلة الآلية ، وتبديل أهداف المجهر ، والمسح المكاني لخطوط الليزر.
- إعداد بيئة البرامج الخاصة ب AMFIP
- قم بتثبيت IntelliJ و Java Development Kit 14.0 و μManager الإصدار 2.0 gamma و Fiji ImageJ على الكمبيوتر.
- افتح مشروع AMFIP الذي تم تنزيله من GitHub (الرابط: https://github.com/njheadshotz/AMFIP) في IntelliJ.
- انقر على إعدادات | | المترجم معالجات التعليقات التوضيحية وتحقق من تمكين معالجة التعليقات التوضيحية.
- انقر على | هيكل المشروع القطع الأثرية وإنشاء ملف JAR. قم بتعيين دليل الإخراج إلى mmplugins ضمن دليل μManager .
- انقر على | هيكل المشروع المكتبات وإضافة mmplugins والمكونات الإضافية ضمن دليل μManager.
- انقر فوق إضافة تكوين ضمن القائمة المنسدلة تشغيل وقم بإنشاء تطبيق.
- أدخل ij. ImageJ في الصف الرئيسي.
- أدخل - Xmx3000m -Dforce.annotation.index=true in VM option.
- تعيين الدليل μManager إلى دليل العمل.
- انقر فوق تشغيل لتنشيط μManager باستخدام المكون الإضافي AMFIP.
- قم بتوصيل μManager بالمجهر المقلوب.
- إضافة برنامج التشغيل التكيفي للمجهر المقلوب21 إلى الدليل μManager .
- افتح μManager. انقر على الأجهزة | معالج تكوين الأجهزة وإنشاء تكوين جديد.
- أضف برنامج تشغيل Ti2 ضمن الأجهزة المتوفرة.
- حدد جميع الأجهزة الطرفية واحفظ ملف التكوين الجديد.
- أعد تشغيل μManager وحدد ملف التكوين في الخطوة 3.2.4 في تكوين بدء تشغيل Micro-Manager.
4. إعداد هلام
- عالج الغطاء الزجاجي ب 3-aminopropyltrymethoxysilane لمدة 7 دقائق في درجة حرارة الغرفة (24 درجة مئوية).
- استخدم الماء منزوع الأيونات (DI) لشطف الغطاء الزجاجي وتجفيف الغطاء لمدة 20 دقيقة عند 160 درجة مئوية.
- عالج الغطاء الزجاجي ب 0.5٪ glutaraldehyde لمدة 30 دقيقة وشطفه بالماء DI.
- امزج محلول الأكريلاميد ، محلول N,N′-methylenebisacrylamide (bis) ، وخرز الفلورسنت المعلق في محلول ملحي مخزن مؤقتا ب 10 mM HEPES. استخدم محلول بيرسلفات الأمونيوم بنسبة 10٪ (ث / خامسا) و N ، N ، N ′ ، N ′ - رباعي ميثيل إيثيلين ديامين (TEMED) كمبادرين للبلمرة. تغيير النسبة المئوية لكل مكون لتحقيق الصلابة الميكانيكية المطلوبة من هيدروجيل بولي أكريلاميد (PAA) وفقا للبروتوكولات المعمول بها الموضحة سابقا13,14.
ملاحظة: في هذا البروتوكول ، 2 كيلو باسكال جل: الأكريلاميد = 12.5 ٪ و ثنائي الاكريلاميد = 6.5 ٪ ؛ 5 كيلو باسكال جل: الأكريلاميد = 12.5 ٪ وثنائي الأكريلاميد = 21.5 ٪ ؛ وهلام 40 كيلوباسكال: أكريلاميد = 12.5٪ وثنائي أكريلاميد = 31.5٪. جميع النسبة المئوية المدرجة هي نسبة الحجم. - بعد 35 دقيقة ، قشر الغطاء الزجاجي من هيدروجيل PAA المتصلب واغسل الهيدروجيل بمحلول ملحي مخزن ب 50 mM HEPES مرتين (5 دقائق في كل مرة).
- عالج سطح الهيدروجيل بمحلول هيدرازين هيدرات لمدة 6 ساعات.
- شطف الهيدروجيل مع حمض الخليك لمدة 30 دقيقة. إزالة حمض الخليك وشطف مع PBS لمدة 30 دقيقة.
- أكسدة محلول الفيبرونيكتين (50 ميكروغرام / مل في PBS) مع فترة الصوديوم لمدة 30 دقيقة.
- قم بتغطية سطح الهيدروجيل بمحلول الفيبرونيكتين المؤكسد وانتظر لمدة 35 دقيقة.
- أضف PBS لغمر الهيدروجيل وتخزينه على درجة حرارة 4 درجات مئوية. قم بتغطية جميع أطباق بتري التي تحتوي على الهيدروجيل بورق الألومنيوم لتجنب أي تعرض خفيف للهيدروجيلات.
5. زراعة الخلايا
ملاحظة: قم بإجراء زراعة الخلايا باستخدام تقنية التعقيم.
- اربط الغطاء الزجاجي بالهلاميات المائية PAA بطبق بتري ذو القاع الزجاجي مقاس 35 مم لتجنب الانجراف المادي للمواد الهلامية أثناء عمليات بذر الخلايا وتصويرها.
- باستخدام ملاقط نظيفة معقمة ، ارفع الغطاء (مع هيدروجيل PAA في الأعلى) من طبق بتري الذي يحتوي على المواد الهلامية المحضرة.
- استخدم منديلا جافا لتنظيف قطرات الماء على السطح السفلي للغطاء الزجاجي.
- استخدم الملقط المعقم لحمل الغطاء الزجاجي.
- ضع قطرات صغيرة (1-5 ميكرولتر) من غراء سيانواكريليت في الزاويتين القطريتين على السطح السفلي.
- استخدم مناديل معقمة لإزالة الغراء الزائد.
- استخدم الملقط المعقم لاستبدال الغطاء في طبق بتري ذي القاع الزجاجي. اضغط قليلا على زوايا الغطاء للتأكد من أن قطرات الغراء تتلامس بشكل كامل مع سطح طبق بتري.
- ضع الغطاء مرة أخرى على طبق بتري لتقليل تبخر PBS في الهلاميات المائية PAA. انتظر لمدة 3 دقائق للسماح للغراء بالتصلب والجفاف في طبق بتري.
- املأ طبق بتري ب 4 مل من PBS.
- كرر الخطوات المذكورة أعلاه 5.1.1-5.1.8 لعينات هيدروجيل PAA المتبقية في أطباق Petri المستخدمة في التصوير.
- استخدم 75٪ من الإيثانول لتعقيم السطح الخارجي لجميع أطباق بتري ونقلها إلى خزانة السلامة البيولوجية لزراعة الأنسجة. قم بتشغيل الأشعة فوق البنفسجية لمدة 5 دقائق وقم بتعقيم العينات.
- زرع الخلايا على السطح العلوي من الجل.
- أطفئ الأشعة فوق البنفسجية. أخرج القارورة (التي تحتوي على خلايا B2B / PC9) من الحاضنة 37 درجة مئوية إلى خزانة السلامة الأحيائية. استخدم ماصة متصلة بمضخة تفريغ لشفط كل وسط الاستزراع وإضافة 5 مل من PBS لغسل القارورة.
- أضف 2 مل من 0.05٪ من التربسين لفصل الخلايا من أسفل القارورة.
- ضع القارورة في الحاضنة. انتظر لمدة 5 دقائق.
- انقل القارورة إلى خزانة السلامة الأحيائية. أضف 8 مل من وسط الثقافة الطازجة إلى القارورة وماصة لأعلى ولأسفل عدة مرات لتعليق الخلايا بشكل متجانس.
- انقل كل 10 مل من تعليق الخلية إلى أنبوب 15 مل وأجهزة طرد مركزي عند 300 × جم لمدة 5 دقائق.
- تحقق من بيليه الخلية في الجزء السفلي من الأنبوب. قم بإمالة الأنبوب أفقيا ببطء واستخدم ماصة الشفط لإزالة كل وسط المزرعة من الأنبوب دون لمس حبيبات الخلية. بعد ذلك ، أضف 8 مل من وسط الثقافة الطازجة وماصة لأعلى ولأسفل عدة مرات حتى يتم خلط جميع الخلايا بشكل متجانس مع الوسط.
- قم بإيداع 100 ميكرولتر من تعليق الخلية (150 خلية / ميكرولتر) على سطح الجل وانتظر لمدة 5 دقائق. بعد ذلك ، أضف ببطء 4 مل من وسط الثقافة الطازجة إلى أطباق Petri ؛ تجنب إضافة الوسط الطازج مباشرة إلى الجل.
- ضع طبق بتري في الحاضنة التي تبلغ درجة حرارتها 37 درجة مئوية. انتظر للسماح للخلايا بالالتصاق بسطح الجل (B2B: 0.5-1 h ؛ PC9: 4-5 ساعة).
6. تصوير الخلايا
ملاحظة: يتيح AMFIP التصوير التلقائي والمتعدد القنوات والطويل الأجل من خلال التنسيق مع أنظمة الأجهزة والبرامج المختلفة: (1) يتلاعب AMFIP ب μManager لنقل المرحلة الآلية من المجهر Ti2-E تلقائيا إلى مجالات رؤية متعددة (FOVs) والحصول على صور ذات مجال ساطع من خلال كاميرا أحادية اللون (جدول المواد) ؛ و (2) يقوم AMFIP بتنشيط ملفات ماكرو متعددة داخل Elements باستخدام جافا سكريبت مخصص لإنجاز العمليات التلقائية لتصوير z-stack البؤري وتبديل قنوات الليزر المختلفة (405 نانومتر و 488 نانومتر).
- تهيئة البيئة للتصوير على المدى الطويل.
- ضع غرفة البيئة على المرحلة الآلية للمجهر المقلوب. اضبط معدل تدفق CO2 على 160 مل / دقيقة واضبط درجة حرارة الغرفة (الأعلى: 44 درجة مئوية ؛ الحمام: 42 درجة مئوية ؛ المرحلة: 40 درجة مئوية). بعد ذلك ، أضف 40 مل من الماء النقي إلى حمام الغرفة.
- أخرج طبق بتري ذو القاع الزجاجي مع خلايا من الحاضنة وضعه في غرفة البيئة.
- قم بتشغيل وحدة التحكم البؤرية والمجهر المقلوب. قم بتبديل مسار الضوء إلى اليمين وراقب الخلايا المرفقة باستخدام μManager. إذا كانت الخلايا الكافية قد تعلقت بالجل ، فانقل طبق بتري مرة أخرى إلى الحاضنة. إذا لم تكن هناك خلايا كافية متصلة بالجل ، فاستمر في حضانة الخلايا لمدة 30 دقيقة أخرى ل B2B و 60 دقيقة لخلايا PC9.
- قطع قطعتين صغيرتين من الشريط اللاصق ولصقها على الغرفة حول الثقب الدائري. بعد ذلك ، ضع القليل من الغراء اللاصق على الشريط (فقط على المنطقة التي سيغطيها طبق Petri).
- أخرج طبق بتري من الحاضنة. بعد ذلك ، ضع طبق بتري ببطء في الغرفة واترك الجزء السفلي من الطبق يتلامس مع الغراء.
- اضغط على غطاء طبق بتري لمدة 1 دقيقة للسماح للغراء بالاتصال الكامل مع طبق بتري وتصلبه. بعد ذلك ، ادفع طبق بتري برفق أفقيا للتأكد من أن طبق بتري غير متحرك في الغرفة.
- أغلق غطاء الغرفة.
- اضبط معلمات الحصول على الصور للتصوير بالمجال الساطع.
- افتح IntelliJ وقم بتعيين معلمة T1 (على سبيل المثال، 120 ثانية) في السطر 93 من Elements_script.java الملف. تأكد من أن هذه القيمة أكبر من وقت تشغيل الماكرو في العناصر المستخدمة للتصوير البؤري لمجال رؤية واحد (FOV). انقر فوق الزر " تشغيل" لبدء مشروع AMFIP IntelliJ.
- انقر فوق الزر Live و Multi-D Acq . على الواجهة الرئيسية ل μManager. بعد ذلك ، قم بتبديل مسار الضوء للمجهر المقلوب إلى اليمين للتصوير في المجال الساطع ، وقم بالتبديل إلى هدف 10x ، وافتح ضوء الصمام الثنائي الباعث للضوء (LED) (مصدر الضوء للتصوير في المجال الساطع ؛ الكثافة: 5٪).
- انقر على مسار الضوء وهدف المجهر وزر مصباح LED في لوحة Elements Ti2 أو اضغط يدويا على الأزرار المقابلة على المجهر.
- اضبط عصا التحكم XY ومقبض الطائرة Z للعثور على الموضع الصحيح ومستوى التركيز البؤري للهلام على طبق Petri. استخدم هدف 10x للعثور على FOVs المناسبة لخلايا مفردة متعددة متصلة بالجل.
- حدد المربع مواضع متعددة (XY) في نافذة الاستحواذ متعدد الأبعاد . انقر فوق الزر تحرير قائمة المواضع ... وراقب نافذة قائمة مواقع المرحلة التي تنبثق. بعد ذلك ، قم بتغيير الهدف إلى 40x ، وقم بزيادة شدة ضوء LED إلى 15٪ ، وأعد ضبط المرحلة الآلية XY لتحديد موقع FOVs ، وسجل الإحداثيات بالنقر فوق الزر Mark في نافذة قائمة مواقع المرحلة .
- سجل 67 FOVs المطلوبة. انقر فوق الزر حفظ باسم... في نافذة قائمة مواقع المرحلة لتسجيل الإحداثيات. أدخل T1 (المعلمة، على سبيل المثال، 120 ثانية، المعرفة في الخطوة 6.2.1) في الفاصل الزمني لاكتساب التصوير إلى T1 في قسم النقاط الزمنية في نافذة الاكتساب متعدد الأبعاد.
- اضبط الحصول على الصور لصور 2D-YAP والخرز.
- افتح Elements ، وقم بتغيير مسار الضوء إلى اليمين للتصوير البؤري وأطفئ ضوء LED. بعد ذلك ، انقر فوق الزر إزالة التعشيق وقم بتشغيل قناة ليزر FITC (لتصوير YAP) عن طريق تحديد مربع FITC .
- اضبط سرعة المسح الضوئي إلى إطار واحد لكل 2 ثانية بالنقر فوق الزر 1/2 وقم بتدوير مقبض المستوى Z للعثور على موضع Z للخلايا المرفقة بسرعة. سجل الحدود الدنيا والعليا للمكدس Z.
- انقر فوق ماكرو على الشريط العلوي ، وحدد محرر الماكرو ضمن القائمة المنسدلة ماكرو ، وأدخل القيم من الخطوة 6.3.2 في ملف ماكرو.
- قم بتشغيل قناة الليزر 4′,6-diamidino-2-phenylindole (DAPI) (لتصوير الخرز) عن طريق تحديد مربع DAPI للعثور على موضع Z المركز للخرز وتسجيله. انتقل إلى محرر الماكرو وأدخل القيم المسجلة في ملف الماكرو .
- قم بتعيين مهمة تحريك المرحلة الآلية باستخدام AMFIP.
- انتقل إلى μManager وانقر على المكونات الإضافية | التشغيل الآلي لفتح واجهة المستخدم الرسومية (GUI) الخاصة ب AMFIP. انقر فوق أزرار إضافة نقطة أو إزالة نقطة للحصول على العدد الدقيق ل FOVs المحددة. أدخل الإحداثيات المسجلة ل FOVs في لوحة الإحداثيات.
- حدد إجمالي وقت التجربة في حقل نص إجمالي وقت التجربة .
- انقر فوق الزر " تكوين الوقت الإضافي" وحدد الفاصل الزمني T2 (على سبيل المثال ، 30 دقيقة) لنقل المرحلة الآلية إلى كل FOV.
- قم بتكبير حجم نافذة Elements واسحب واجهة المستخدم الرسومية الخاصة ب AMFIP إلى الجانب الأيمن من الشاشة لتجنب إزعاج واجهة المستخدم الرسومية للعمليات التلقائية للمؤشر.
- انقر فوق الزر Enter . بعد انتهاء الماكرو الأول ، انقر فوق الزر "اكتساب!" في نافذة الاستحواذ متعدد الأبعاد .
- قم بإذابة الخلايا بعد الحصول على الصورة.
- بعد الانتهاء من التصوير على المدى الطويل ، أوقف مهمة AMFIP بالنقر فوق الزر إيقاف مؤقت في نافذة المكون الإضافي للأتمتة والزر إيقاف في نافذة الاستحواذ متعدد الأبعاد .
- افتح Elements واضبط تصوير Z-stack بالنقر فوق الزرين العلوي والسفلي في نافذة ND Acquisition (اضبط نطاق Z ليكون أكبر من نطاق Z للخرز). قم بتبديل مسار الضوء إلى اليمين وافتح مصباح LED (الكثافة: 15٪).
- قم بإزالة أغطية الغرفة وطبق بتري ببطء وبعناية. وفي الوقت نفسه ، راقب عرض المجال الساطع لأي انحراف في FOV.
- باستخدام ماصة بلاستيكية لامتصاص 0.5 مل من محلول كبريتات دوديسيل الصوديوم (SDS) ، أمسك الماصة البلاستيكية بعناية فوق وسط الاستزراع قليلا في طبق بتري وأضف 1-2 قطرات من محلول SDS إلى وسط الثقافة.
- بمجرد حل الخلايا الموجودة في عرض المجال الساطع ، قم بتبديل مسار الضوء إلى اليسار ، وأغلق ضوء LED ، وانقر فوق الزر إزالة التعشيق .
- قم بتشغيل تصوير Z-stack. احفظ مكدس الصور وقم بتسميته Reference_N (N هو رقم التسلسل لكل FOV).
- انقر فوق الزر " مواضع متعددة" (XY) في نافذة الاستحواذ متعدد الأبعاد . بعد ذلك ، حدد FOV التالي وانقر فوق الزر "الانتقال إلى " لنقل المرحلة الآلية إلى FOV الثانية.
- كرر الخطوة 6.5.7 لكل FOV.
7. قياس نسبة YAP N / C
- قم بإجراء تحليل للصور لقياس نسبة YAP N/C باستخدام برنامج فيجي ImageJ (الشكل 4).
- افتح صورة فيجيJ. استيراد مكدس الصور ذات الحقل الساطع لجميع FOVs التي حصلت عليها μManager.
- افتح القائمة المنسدلة صورة وحدد مكدسات | أدوات | حارس الشريحة. بعد ذلك ، قم بتصدير مكدس صور المجال الساطع لكل FOV.
- قم باستيراد صورة التألق لقناة FITC وتراكب مع صورة المجال الساطع لنفس FOV. للقيام بذلك، اختر صورة الفلورسنت وحدد تراكب | إضافة صورة... (الصورة المراد إضافتها: صورة الحقل الساطع؛ يعتمد موقع X و Y على حجم صورة المجال الساطع التي حصلت عليها كاميرات مختلفة ؛ التعتيم: 60-70).
- افتح القائمة المنسدلة تحليل وحدد تعيين القياسات.... حدد المنطقة; الكثافة المتكاملة ومتوسط القيمة الرمادية.
- انقر على زر التحديدات اليدوية على الواجهة الرئيسية ل ImageJ.
- ارسم الخطوط العريضة لجسم الخلية والنواة المطلوبة. بعد ذلك ، انقر فوق تحليل | قم بالقياس أو اضغط على الزر M على لوحة المفاتيح.
- راقب نافذة النتائج التي تنبثق. لاحظ أن القيم الموجودة أسفل عمود المساحة تمثل مساحة المنطقة المحددة (μm2) وأن القيم الموجودة أسفل عمود IntDen تمثل كثافة التألق للمنطقة المحددة.
- احسب نسبة YAP N/C باستخدام الصيغ التالية (1) و(2) و(3):
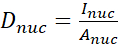 (1)
(1)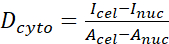 (2)
(2)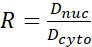 (3)
(3)
حيث يمثل Inuc و Icel الكثافة النسبية للنواة وجسم الخلية ، ويمثل Anuc و Acel منطقة النواة وجسم الخلية. R هي نسبة YAP N / C. - احفظ الخطوط العريضة للحساب المستقبلي لقوة الجر ثنائي القطب والإزاحة حول الخلية / حول النووي. للقيام بذلك ، انقر فوق تحليل | أدوات | حفظ إحداثيات XY...
8. قياس مجال الجر
- تطبيق المجهر قوة الجر من خلال فيجي ImageJ الإضافات22,23.
- افتح صورة فيجيJ.
- استيراد كومة الصور من الخرز ل FOV.
- حدد الشريحة التي تظهر أوضح توزيع للخرز واستخراجها بالنقر فوق الصور | مكدسات | أدوات | حارس الشريحة.
- استيراد مكدس الصورة من المرجع لنفس FOV.
- اختر الشريحة بنفس السطوع والتباين مثل الشريحة في الخطوة 8.1.3. بعد ذلك ، استخرجها كصورة مرجعية.
- حدد الصور | مكدسات | أدوات | تسلسل لدمج الشريحتين من الخطوتين 8.1.3 و8.1.5 (حدد الصورة المرجعية كشريحة أولى).
- حدد المكونات الإضافية | | مطابقة القوالب محاذاة الشرائح في المكدس أو المكونات الإضافية | مثبت الصور لمحاذاة الشريحتين.
- حدد | الصورة مكدسات | قم بتكديس الصور. بعد ذلك، حدد صورة | | جداول البحث أخضر لتحويل لون الشريحة الأولى إلى أخضر وحدد صورة | | جداول البحث أحمر لتحويل لون الشريحة الثانية إلى أحمر.
- حدد | الصورة | الألوان دمج القنوات لدمج الصورتين.
- تداخل الصورة مع صورة المجال الساطع من نفس FOV واستخدم هذه الصورة المتداخلة لمراقبة إزاحة الخرزة.
- حدد المكونات الإضافية | PIV | PIV التكرارية (الأساسية).... تعيين حجم نافذة الاستجواب إلى 128/256 ؛ 64/128; 32/64 (أربع حبات على الأقل لكل نافذة استجواب). اضبط عتبة الارتباط على 0.6.
- انقر فوق موافق. بعد انتهاء الحساب ، احفظ الملف النصي مع البيانات الخام لإزاحة الخرزة في مجلد عادي أنشأه المستخدم.
- حدد المكونات الإضافية | | FTTC FTTC واختر الملف النصي في الخطوة 8.1.9.
- أدخل حجم البكسل (μm) ، ومعامل يونغ للهلام (Pascal) ، وعرض المؤامرة وارتفاعها بناء على التجربة وصورة الخرز.
- انقر فوق موافق لحفظ الملف النصي الذي يحتوي على البيانات الأولية لقوة الجر تلقائيا في نفس الدليل مثل الملف النصي في الخطوة 8.1.12.
- استخدم برنامج الرسوم البيانية (جدول المواد) لرسم حقل الجر بنفس المقياس لخلايا متعددة (الشكل 1B و C والشكل 2B و C).
- أدخل الملف النصي الذي يحتوي على البيانات الأولية للسحب في جدول بيانات.
- قم بإنشاء ورقة جديدة ، وأدخل إحداثيات الجر Y في الصف الأول (الترتيب من القيم العالية إلى القيم المنخفضة) وإحداثيات X في العمود الأول (الترتيب من الأدنى إلى الأعلى).
- أدخل قيمة الجر لكل إحداثي من البيانات الأولية.
- احفظ الورقة في الخطوة 8.2.2 كملف *.csv.
- الأصل المفتوح.
- انقر على ملف | افتح الملف *.csv واستورده في الخطوة 8.2.4. حدد جميع الخلايا وانقر على رسم | كفاف| كفاف - تعبئة اللون.
- في نافذة التآمر: plotvm ، حدد Y عبر الأعمدة لتعيين قيم Y تلقائيا إلى الصف الأول وقيم X إلى العمود الأول. بعد ذلك ، قم بتسمية العنوان وانقر فوق موافق.
- في نافذة الرسم البياني التي تنبثق ، انقر نقرا مزدوجا فوق الخريطة الحرارية.
- انقر على المستويات في نافذة خريطة الألوان/المعالم . بعد ذلك ، قم بتغيير مستوى المقياس إلى نطاق معقول (0300 في هذا التحليل) وانقر فوق موافق.
- انقر فوق خطوط ، وقم بإلغاء تحديد إظهار على المستويات الرئيسية فقط ، وحدد إخفاء الكل. بعد ذلك ، انقر فوق موافق.
- انقر بزر الماوس الأيمن على الرسم البياني وحدد تصدير الرسوم البيانية.... احفظ الصورة في المسار المحدد.
- استخدم MATLAB لحساب جر الخلايا ثنائية القطب.
- احفظ الملف النصي لبيانات الجر الخام (من الخطوة 8.1.12) وملف إحداثيات منطقة حدود الخلية ذات الأهمية (ROI) (من الخطوة 7.1.9) في نفس المجلد المعرف في الخطوة 8.1.12. نقل كافة ملفات MATLAB الموجودة في حزمة AMFIP إلى هذا المجلد.
- افتح MATLAB. افتح المجلد المعرف في الخطوة 8.1.12 وافتح ملف absdipole دالة حساب الجر ثنائي القطب absdipole.m نقله إلى هذا المجلد في الخطوة 8.3.1.
- اقرأ الملفين النصيين/csv في الخطوة 8.3.1 في مساحة عمل MATLAB وقم بتعيين مصفوفة لمتغيرين (على سبيل المثال، الجر وعائد الاستثمار).
- قم بتشغيل وظيفة absdiple (الجر ، عائد الاستثمار).
ملاحظة: العمود الأول من الناتج هو قوة الجر ثنائي القطب في nN (نانو-نيوتن). العمود الثاني من الناتج هو زاوية قوة الجر ثنائي القطب فيما يتعلق بالمحور الأفقي.
النتائج
توزيع وديناميكيات YAP متميزة في سرطان PC9 المصمم بواسطة CRISPR / Cas9 والخلايا الطبيعية B2B أثناء انتشار الخلايا
تظهر الصور الفلورية التمثيلية لتوزيع YAP في خلايا B2B و PC9 المفردة على المواد الهلامية PAA 2 و 5 و 40 kPa والغطاء الزجاجي في الشكل 1A والشكل 2A. زاد التوطين النووي ل YAP في الخلايا B2B مع زيادة صلابة الركيزة (الشكل 1A) ، في حين أظهرت خلايا PC9 تركيزا YAP مشابها في النواة والسيتوبلازم على ركائز متفاوتة الصلابة (الشكل 2A). تظهر الصور الفلورية التمثيلية لتوزيع YAP في خلايا B2B و PC9 المفردة المنتشرة على ركيزة هيدروجيل 5 kPa (من 0th h إلى 10th h بعد الخلايا المرتبطة بالركائز) في الشكل 1B والشكل 2B ، على التوالي. زادت الخلية B2B بشكل رتيب من مساحة الانتشار بمرور الوقت إلى جانب انخفاض في نسبة YAP N / C (الشكل 1B) ، في حين حافظت خلية PC9 على منطقة انتشار الخلية غير المتغيرة نسبيا ، والاتجاه ، ونسبة YAP N / C طوال عملية الانتشار لمدة 10 ساعات (الشكل 2B). خلال مدة 10 ساعات من الانتشار المبكر ، شوهت الخلية B2B التمثيلية بشكل أساسي سطح الركيزة وطبقت الجر الخلوي المتطور زمنيا عبر منطقة الخلية بأكملها (الشكل 1C والشكل 1D).
وعلى النقيض من ذلك، لم تطور الخلية التمثيلية PC9 سوى الإزاحة والجر في طرفي جسم الخلية وتضاءل جرها بعد 7.5 ساعة (الشكل 2C والشكل 2D). يتم توفير المزيد من صور الفاصل الزمني وقياسات الجر لخلايا B2B و PC9 في مرحلة الانتشار المبكرة في الشكل التكميلي S2 والشكل التكميلي S3. كما لوحظت أنماط أخرى من ديناميكيات خلايا PC9 (الشكل 6). بالتوازي مع خصائص الانتشار المختلفة هذه ، أظهرت خلايا B2B و PC9 توزيعا وديناميات YAP متميزة (الشكل 3). على هلام 5 كيلو باسكال ، تم تركيز YAP في خلايا B2B في النواة في الساعة 0 وأصبحت موزعة بشكل أكثر تجانسا عبر جسم الخلية في الساعة 10. ومع ذلك ، أظهرت خلايا PC9 توزيعا أكثر تجانسا ل YAP في النواة والسيتوبلازم طوال 10 ساعات كاملة من عملية الانتشار. لتحليل نشاط YAP كميا ونقله في خلايا B2B و PC9 ، تم حساب نسبة YAP N / C باستخدام الخوارزمية الموضحة في الشكل 4.
لمزيد من التحقيق في ديناميكيات YAP المميزة ، تمت مقارنة التغيرات الزمنية في نسبة YAP N / C ، ومنطقة الخلية / النواة ، وجر خلايا B2B المفردة المتعددة (n = 10) وخلايا PC9 (n = 5) (الشكل 5). وجد أن متوسط نسبة YAP N/C للخلايا B2B انخفض من 2.54 ± 0.22 إلى 1.79 ± 0.21 (n = 10; p = 0.0022**; الشكل 5 ألف)، في حين أن متوسط نسبة YAP N/C لخلايا PC9 تغير من 1.92 ± 0.26 إلى 1.57 ± 0.07 (n = 5؛ p = 0.187 (غير معنوي (ns))؛ الشكل 5 ألف). تغير متوسط الجر ثنائي القطب للخلايا B2B من 256.17 ± 123.69 nN إلى 287.44 ± 99.79 nN (p = 0.7593 (ns) ؛ الشكل 5 باء). تغير متوسط الجر ثنائي القطب لخلايا PC9 من 141.19 ± 33.62 nN إلى 168.52 ± 73.01 nN (p = 0.7137 (ns) ؛ الشكل 5 باء). وزاد متوسط مساحة انتشار الخلايا في الخلايا B2B من 613.89 ± 102.43 ميكرومتر2 إلى 942.51 ± 226.71 ميكرومتر2 (p = 0.0512 (ns)؛ الشكل 5 جيم).
تغير متوسط مساحة انتشار الخلايا في خلايا PC9 من 495.78 ± 97.04 ميكرومتر مربع إلى 563.95 ± 89.92 ميكرومتر مربع (p = 0.5804 (ns) ؛ الشكل 5 جيم). وزاد متوسط مساحة انتشار نواة الخلايا B2B من 181.55 ± 36.18 ميكرومتر2 إلى 239.38 ± 43.12 ميكرومتر2 (p = 0.1217 (ns)؛ الشكل 5 دال) وتغير متوسط مساحة انتشار النواة لخلايا PC9 من 133.31 ± 30.05 ميكرومتر2 إلى 151.93 ± 22.49 ميكرومتر2 (p = 0.5944 (ns)؛ الشكل 5 دال). تشير هذه النتائج إلى أن (1) خلايا B2B تظهر نسبة YAP N / C تعتمد على صلابة الركيزة بشكل تكويني. (2) الجر من الخلايا B2B أعلى من خلايا PC9 ؛ و (3) على النقيض من خلايا B2B ، تظهر خلايا PC9 زيادة محدودة في مساحة الخلية وتغيرات في نسبة YAP N / C خلال عملية الانتشار لمدة 10 ساعات.
ارتباط توزيع YAP وديناميكياته بحالات هجرة الخلايا B2B
تمت مقارنة نسبة YAP N / C والجر ثنائي القطب لجميع خلايا B2B (n = 10) و PC9 (n = 5) كدالة لمنطقة انتشار الخلية ومنطقة انتشار النواة. لم ترتبط نسبة YAP N/C والجر ثنائي القطب لخلايا PC9 ارتباطا واضحا بنطاقات مساحة انتشار الخلايا الصغيرة والنواة (الشكل 6). في المقابل، يبدو أن نسبة YAP N/C والجر ثنائي القطب للخلايا B2B يتبعان اتجاهين متميزين (الشكل 6A والشكل 6C)، مما يشير إلى أنه قد تكون هناك مجموعتان من الخلايا B2B التي تتعايش في هذه التجربة. في المجموعة الأولى ، تزداد نسبة YAP N / C والجر ثنائي القطب جنبا إلى جنب مع توسيع منطقة انتشار الخلية وتصل إلى الحد الأقصى عند ~ 1000 ميكرومتر مربع (الشكل 6C والشكل 6D ، المشار إليه بالخط الأصفر المتقطع). في المجموعة الثانية ، تزداد نسبة YAP N / C والجر ثنائي القطب بمعدل أبطأ مع توسيع منطقة انتشار الخلية والحفاظ على قيم ثابتة تقريبا عندما تستمر منطقة انتشار الخلية في الزيادة (الشكل 6C ، D ، المشار إليه بالخط الأخضر المتقطع).
تولد الخلايا السرطانية PC9 الجر في المناطق المحيطة بالطاقة النووية
تحل خلايا PC9 المفردة المنتشرة محل الركائز في المناطق المحيطة بالطاقة النووية ، بدءا من الساعة السادسة من الزراعة (الشكل 7C). لتصور الإزاحة شبه النووية الناجمة عن جر الخلايا ، قمنا بتداخل صور حبات الفلورسنت الملتقطة قبل (أحمر) وبعد (أخضر) إزالة الخلايا من الركائز (انظر قسم البروتوكول للحصول على التفاصيل). ستظهر الخرز التي لا تحتوي على أي إزاحة باللون الأصفر في الصور المتداخلة ، أي إضافة اللونين الأحمر والأخضر. في المقابل ، فإن الخرز الذي يتم تهجيره من مواضع الراحة بسبب جر الخلايا سيظهر ألوانا خضراء وحمراء منفصلة.
ومن الجدير بالذكر أنه في كل من خلايا PC9 (الشكل 7C و D) و B2B (الشكل 7E) ، لوحظ إزاحة الخرز في السيتوبلازم وداخل النواة ، بالإضافة إلى تلك الموجودة على حدود الخلية. لتسليط الضوء على الإزاحة شبه النووية، تستخدم معادلة بوسينسك من نظرية المرونة الخطية للتنبؤ بالإزاحة النظرية ثنائية الأبعاد الناتجة عن قوة ثنائية القطب افتراضية عند حدود الخلية (خط أسود متقطع في الشكل 7B)24. وبمقارنة هذا المنحنى النظري مع إزاحة الركيزة الحقيقية المقاسة على نفس المحور (الخط الأبيض المتقطع في الشكل 7D)، وجد أن الإزاحات الحقيقية داخل النواة أكبر ب 1.5-8 أضعاف من القيمة النظرية (الشكل 7B)، مما يشير إلى وجود قوة جر في المناطق المحيطة بالمجال النووي.

الشكل 1: التغيرات في تعبير/توزيع YAP ، ومجال إزاحة الركيزة ، ومجال الجر لخلية طبيعية B2B على ركائز متفاوتة الصلابة وأثناء الانتشار المبكر. (A) تعبير YAP لخلية B2B مزروعة على هلام PAA 2 و 5 و 40 kPa وغطاء زجاجي بعد 60 ساعة من مرفق الركيزة الخلوية الأولي. (ب) زرعت الخلية B2B على هلام PAA سعة 5 كيلوباسكال وصورت على مدى 10 ساعات بعد التعلق الأولي بالركيزة الخلوية. يتم تمثيل تعبير YAP بكثافة التألق الأخضر. ملاحظة: تنخفض شدة YAP داخل النواة تدريجيا ولكنها تظل أعلى من تلك الموجودة في السيتوبلازم بمرور الوقت. تشير أشرطة الألوان إلى مستويات تعبير YAP (أخضر = تعبير مرتفع ؛ أسود = تعبير منخفض) في (A) و (B)". (ج) يتم تمثيل تشوه الركيزة (المتداخل مع صورة المجال الساطع) في موقع الخلية بحقل الإزاحة في كل نقطة زمنية. يظهر اتجاه الإزاحة وحجمها حسب اتجاه السهم ولونه، على التوالي. تصبح الإزاحة أكبر في نهايات جسم الخلية B2B مع زيادة مساحة انتشار الخلية. يشير شريط الألوان إلى حجم الإزاحة (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض). (د) حقل الجر (متداخل مع صورة الحقل الساطع) محسوب من حقل الإزاحة. يتركز الجر على حدود الخلايا B2B. تحدد الخطوط العريضة المنقطة البيضاء والصفراء حدود الخلية والنواة ، على التوالي. يشير شريط اللون إلى مقدار الجر (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض). أشرطة المقياس = 20 ميكرومتر. الاختصارات: YAP = البروتين المرتبط بنعم. PAA = بولي أكريلاميد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
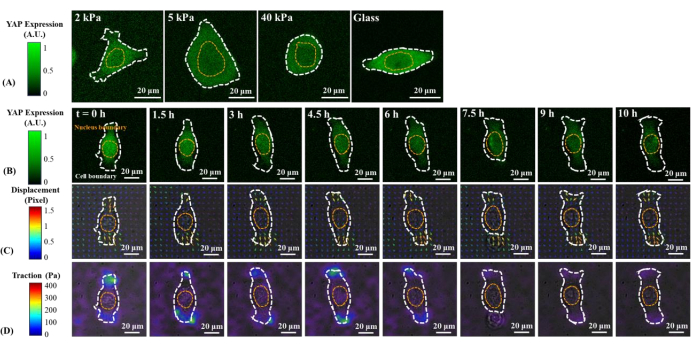
الشكل 2: التغيرات في تعبير/توزيع YAP، ومجال إزاحة الركيزة، ومجال الجر لخلية سرطانية PC9 على ركائز متفاوتة الصلابة وأثناء الانتشار المبكر. (أ) تعبير YAP لخلية PC9 مزروعة على المواد الهلامية PAA 2 و 5 و 40 kPa والغطاء الزجاجي بعد 65 ساعة من مرفق الركيزة الخلوية الأولي. (ب) زرعت خلية PC9 على هلام PAA سعة 5 كيلوباسكال وصورت أكثر من 10 ساعات بعد الإرفاق الأولي للركيزة الخلوية. يتم تمثيل تعبير YAP بكثافة التألق الأخضر. ملاحظة: هضاب كثافة YAP من 1.5 ساعة فصاعدا. تشير أشرطة الألوان إلى مستويات تعبير YAP (أخضر = تعبير مرتفع ؛ أسود = تعبير منخفض) في (A) و (B). (C) يتم تمثيل تشوه الركيزة (المتداخل مع صورة المجال الساطع) في موقع الخلية بواسطة حقل إزاحة حبة الفلورسنت في كل نقطة زمنية. يظهر اتجاه الإزاحة وحجمها حسب اتجاه السهم ولونه، على التوالي. حقل الإزاحة الناجم عن خلايا PC9 أصغر من ذلك الذي تسببه خلية B2B. طوال عملية الانتشار لمدة 10 ساعات ، تظل مساحة خلايا PC9 ثابتة تقريبا. يشير شريط الألوان إلى حجم الإزاحة (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض). (D) حقل الجر (متداخل مع صورة المجال الساطع) محسوب من حقل الإزاحة. ينخفض الجر الناتج عن خلية PC9 التمثيلية هذه تدريجيا من الساعة 6 إلى الساعة 10. تحدد الخطوط العريضة المنقطة البيضاء والصفراء حدود الخلية والنواة ، على التوالي. يشير شريط اللون إلى مقدار الجر (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض). أشرطة المقياس = 20 ميكرومتر. الاختصارات: YAP = البروتين المرتبط بنعم. PAA = بولي أكريلاميد. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: توزيع YAP في خلايا B2B و PC9 في مرحلة الانتشار المبكرة. (أ) يتم قياس شدة YAP للخلية B2B على طول المحور الأحمر المعين عند 0th و 10th h. (B) في الساعة 0th ، تظهر شدة YAP اختلافات كبيرة في التركيز بين النواة والسيتوبلازم. في الساعة 10 ، تصبح شدة YAP أكثر تجانسا عبر جسم الخلية بالكامل. (C) يتم قياس شدة YAP لخلية PC9 على طول المحور الأزرق المعين في 0th و 10th h. (D) في 0th h ، تظهر شدة YAP في النواة أعلى من تلك الموجودة في السيتوبلازم ، على الرغم من أن الفرق ليس ملحوظا كما هو الحال في خلايا B2B. في الساعة 10 ، لا تزال شدة YAP في النواة تظهر أعلى قليلا من تلك الموجودة في السيتوبلازم ، مع اتجاه تباين مماثل لتلك الموجودة في الساعة 0. أشرطة المقياس = 20 ميكرومتر (A، C). اختصار: YAP = البروتين المرتبط بنعم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: قياس نسبة YAP N/C. (1) تطبيق فيجي ImageJ لرسم الخطوط العريضة للنواة وقياس منطقتها المتوقعة 2D Anuc. (2) قياس شدة التألق داخل النواة Inuc. (3) رسم الخطوط العريضة لجسم الخلية وقياس مساحتها المتوقعة Acel. (4) قياس شدة التألق داخل الخلية Icel. (5) حساب كثافة نواة YAP Dnuc ، كثافة السيتوبلازم YAP Dcyto ، ونسبتها R: Dnuc = Inuc / Anuc ؛ Dcyto=(Icel-Inuc)/(Acel-Anuc); R = Dnuc / Dcyto. يشير شريط الألوان إلى مستويات تعبير YAP (أخضر = تعبير مرتفع ؛ أسود = تعبير منخفض). شريط المقياس = 20 ميكرومتر. الاختصارات: YAP = البروتين المرتبط بنعم. N = نواة; C = السيتوبلازم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
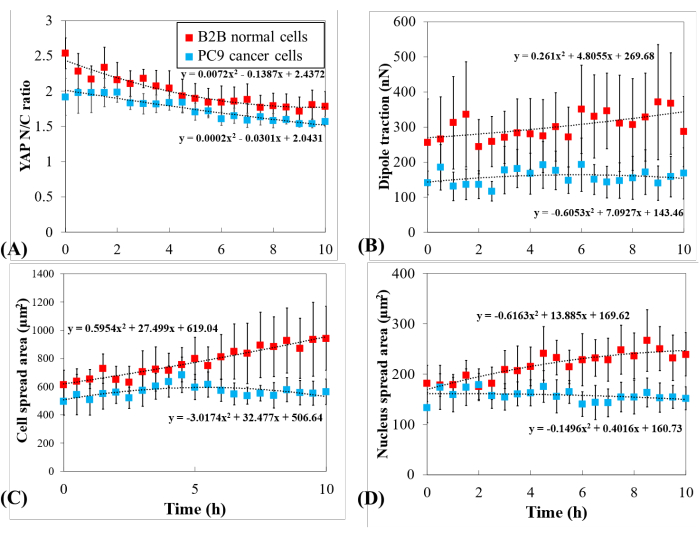
الشكل 5: تعبير YAP المتميز ، مورفولوجيا الخلية / النواة ، والجر الخلوي في سرطان PC9 والخلايا الطبيعية B2B أثناء انتشار الخلايا. (أ) تغير نسبة YAP N/C خلال أول 10 ساعات من انتشار الخلية الواحدة. تغير متوسط نسبة YAP N/C للخلايا B2B (العمود الأحمر؛ n = 10) من 2.54 ± 0.22 إلى 1.79 ± 0.21 (n = 10؛ p = 0.0022**) في حين تغير متوسط نسبة YAP N/C لخلايا PC9 (العمود الأزرق؛ n = 5) من 1.92 ± 0.26 إلى 1.57 ± 0.07 (p = 0.187 (ns)). (ب) متوسط الجر ثنائي القطب كدالة للوقت. تغير متوسط الجر ثنائي القطب للخلايا B2B من 256.17 ± 123.69 nN إلى 287.44 ± 99.79 nN (p = 0.7593 (ns)) وتغير متوسط الجر ثنائي القطب لخلايا PC9 من 141.19 ± 33.62 nN إلى 168.52 ± 73.01 nN (p = 0.7137 (ns)). (ج) متوسط مساحة الخلية كدالة للوقت. ارتفع متوسط مساحة انتشار الخلايا في الخلايا B2B من 613.89 ± 102.43 μm2 إلى 942.51 ± 226.71 μm2 (p = 0.0512 (ns)) وتغير متوسط مساحة انتشار الخلايا لخلايا PC9 من 495.78 ± 97.04 μm2 إلى 563.95 ± 89.92 μm2 (p = 0.5804 (ns)). (د) متوسط مساحة النواة كدالة للزمن. ارتفع متوسط مساحة انتشار النواة للخلايا B2B من 181.55 ± 36.18 ميكرومتر مربع إلى 239.38 ± 43.12 ميكرومتر 2 (p = 0.1217 (ns)) وتغير متوسط مساحة انتشار النواة لخلايا PC9 من 133.31 ± 30.05 ميكرومتر 2 إلى 151.93 ± 22.49 ميكرومتر مربع (p = 0.5944 (ns)). الاختصارات: YAP = البروتين المرتبط بنعم. N = نواة; C = السيتوبلازم; ns = ليست كبيرة. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: نسبة YAP N/C وقوة الجر ثنائية القطب كدالة لمنطقة انتشار الخلية والنواة. يتم حساب نسبة YAP N / C والجر ثنائي القطب للخلايا B2B (n = 10) وخلايا PC9 (n = 5) من h 6th إلى h 10th بعد الربط بالركيزة. (أ) نسبة YAP N/C كدالة لمنطقة انتشار الخلية. تختلف نسب YAP N / C لخلايا B2B من 1.16 إلى 2.53 ، بينما تختلف نسب YAP N / C لخلايا PC9 من 1.27 إلى 1.88. تتراوح مساحة انتشار الخلايا في الخلايا B2B من 391.94 ميكرومتر مربع إلى 1986.40 ميكرومتر مربع. تتراوح مساحة انتشار الخلايا في خلايا PC9 من 284.46 ميكرومتر2 إلى 830.12 ميكرومتر2. (ب) نسبة YAP N/C كدالة لمنطقة انتشار النواة. تتراوح مساحة انتشار نواة الخلايا B2B من 107.09 ميكرومتر2 إلى 514.28 ميكرومتر مربع. تتراوح مساحة انتشار نواة خلايا PC9 من 58.03 ميكرومتر مربع إلى 259.65 ميكرومتر مربع. الجر ثنائي القطب للخلايا B2B كدالة لمنطقة انتشار الخلية (C) ومنطقة انتشار النواة (D). تظهر الخلايا B2B المنتشرة وغير المهاجرة قوة جر أعلى (من 47.50 nN إلى 1051.48 nN) مع انخفاض مساحة الخلية والنواة. أثناء الانتشار والهجرة ، تظهر الخلايا B2B قوة جر أقل (من 105.80 nN إلى 310.28 nN) مع نطاقات أكبر من مساحة الخلية والنواة. الاختصارات: YAP = البروتين المرتبط بنعم. N = نواة; C = السيتوبلازم. يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
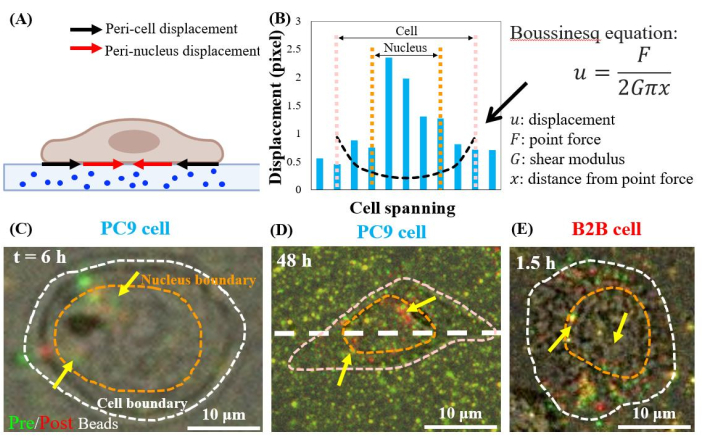
الشكل 7: الإزاحة شبه النووية في خلايا B2B العادية وخلايا PC9 السرطانية. (أ) مخطط تخطيطي للرؤية الجانبية للإزاحة شبه النووية وحول الخلية المقاسة من إزاحة الخرز في الركيزة. (ب) يتم قياس إزاحة الركيزة أسفل خلية PC9 على طول محور الخلية (خط أبيض متقطع في 7D). تظهر الإزاحة النظرية الناتجة عن قوة ثنائي القطب عند حدود الخلية من خلال معادلة بوسينسك (المنحنى الأسود المتقطع). (C) و (D) صور حبة الفلورسنت المتداخلة مع الخلايا (الحمراء) وبدون (الخضراء) لخلايا PC9 في الساعة 6 بعد إرفاق (العرض العلوي). الخرز الأصفر (التداخل الدقيق للألوان الحمراء والخضراء) لا يشير إلى أي إزاحة. تمثل الخرز الأخضر والأحمر المنفصل (المدبب بأسهم صفراء) الإزاحة شبه النووية. تشير الأسهم الصفراء إلى هذه البقع المحيطة بالنواة المتقلصة الموجودة على محيط النواة. (ه) الإزاحة شبه النووية التي تولدها الخلية B2B عند 1.5 ساعة بعد ربط الخلية بالركيزة. أشرطة المقياس = 10 ميكرومتر (C–E). يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل التكميلي S1: خريطة التسلسل الجينومي ل YAP-mNeonGreen21-10/11. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S2: التغيرات في تعبير/توزيع YAP، ومجال إزاحة الركيزة، ومجال الجر للخلايا الطبيعية B2B أثناء الانتشار المبكر. (أ، د، ز، ي، م) تم زرع الخلية B2B على هلام PAA 5 kPa وتصويرها على مدار 10 ساعات بعد مرفق الركيزة الخلوية الأولي. يتم تمثيل تعبير YAP بكثافة التألق الأخضر. ملاحظة: تنخفض شدة YAP داخل النواة تدريجيا ولكنها تظل أعلى مما هي عليه في السيتوبلازم بمرور الوقت. تشير أشرطة الألوان إلى مستويات تعبير YAP (أخضر = تعبير مرتفع ؛ أسود = تعبير منخفض) في (A ، D ، G ، J ، M). (ب، ه، ح، ك، ن) يتم تمثيل تشوه الركيزة (المتداخل مع صورة المجال الساطع) في موقع الخلية بواسطة حقل الإزاحة في كل نقطة زمنية. يظهر اتجاه الإزاحة وحجمها حسب اتجاه السهم ولونه، على التوالي. تصبح الإزاحة أكبر في محيط جسم الخلية B2B مع زيادة مساحة انتشار الخلية. تشير أشرطة الألوان إلى حجم الإزاحة (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض) في (B ، E ، H ، K ، N)). (ج، و، ط، ل، س) حقل الجر (متداخل مع صورة المجال الساطع) محسوب من حقل الإزاحة باستخدام مجهر قوة الجر. يتركز الجر في محيط الخلايا B2B. تشير أشرطة الألوان إلى مقدار الجر (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض) في (C ، F ، I ، L ، O)). أشرطة المقياس = 20 ميكرومتر. الاختصارات: YAP = البروتين المرتبط بنعم. PAA = بولي أكريلاميد. يرجى النقر هنا لتنزيل هذا الملف.
الشكل التكميلي S3: التغيرات في تعبير/توزيع YAP، ومجال إزاحة الركيزة، ومجال الجر للخلايا السرطانية PC9 أثناء الانتشار المبكر. (ألف، دال، ز، ي) تم زرع خلية PC9 على هلام PAA 5 kPa وتصويرها على مدار 10 ساعات بعد مرفق الركيزة الخلوية الأولي. يتم تمثيل تعبير YAP بكثافة التألق الأخضر. ملاحظة: تنخفض شدة YAP داخل النواة تدريجيا ولكنها تظل مشابهة أو أقل قليلا من تلك الموجودة في السيتوبلازم بمرور الوقت. تشير أشرطة الألوان إلى مستويات تعبير YAP (أخضر = تعبير مرتفع ؛ أسود = تعبير منخفض) في (A ، D ، G ، J). (ب، ه، ح، ك) يتم تمثيل تشوه الركيزة (المتداخل مع صورة المجال الساطع) في موقع الخلية بواسطة حقل الإزاحة في كل نقطة زمنية. يظهر اتجاه الإزاحة وحجمها حسب اتجاه السهم ولونه، على التوالي. تصبح الإزاحة أكبر في محيط جسم خلية PC9 مع زيادة مساحة انتشار الخلية. تشير أشرطة الألوان إلى حجم الإزاحة (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض) في (B ، E ، H ، K)). (ج، وو، ط، ل) حقل الجر (متداخل مع صورة الحقل الساطع) محسوب من حقل الإزاحة. يتركز الجر في محيط خلايا PC9. تشير أشرطة الألوان إلى مقدار الجر (قرمزي = حجم مرتفع ؛ أسود = حجم منخفض) في (C ، F ، I ، L). أشرطة المقياس = 20 ميكرومتر. الاختصارات: YAP = البروتين المرتبط بنعم. PAA = بولي أكريلاميد. يرجى النقر هنا لتنزيل هذا الملف.
Discussion
تعد عملية التصوير (الخطوة 6.3) أمرا بالغ الأهمية لضمان أن تكون صور التألق ذات جودة جيدة بما يكفي للحصول على نتائج قياس كمي صالحة. يجب أن تحتوي صور z-stack للبروتين الفلوري أو الخرز على نطاق z كبير بما يكفي لتضمين الصور في التركيز البؤري لجميع مواضع Z التي تمتد عليها العينة. خطوة حاسمة أخرى هي جمع الصور المرجعية للحبات الفلورية بعد إذابة الخلايا (الخطوة 6.5). نظرا لأن الصور المرجعية تحتاج إلى التقاطها في نفس المواضع في الخطوة 6.3 ، فلا ينبغي إحداث إزاحة نسبية بين طبق بتري وغرفة البيئة والمجهر. يجب على المحققين الذين يقومون بخطوة الذوبان أن يكونوا حريصين على إزالة غطاء طبق بتري والتأكد من أن الاضطراب الميكانيكي المطبق ليس كبيرا بما يكفي لتغيير موقع الطبق في غرفة البيئة.
يتم توفير الحلول أدناه لحل بعض الأخطاء التي قد تحدث أثناء التجارب. إذا لم يتم تنشيط أي ماكرو بعد النقر فوق Enter في الخطوة 6.4 ، فمن المرجح أن يكون ذلك لأن المنطقة السفلية اليسرى من الشاشة مشغولة بنافذة غير Element. في مثل هذه الحالة ، يجب مسح المنطقة السفلية اليسرى من النافذة بحيث يمكن تنشيط وحدات الماكرو في Elements. خطأ شائع آخر هو أن صور المجال الساطع تظهر باللون الأسود. تحدث هذه المشكلة بسبب عدم كفاية الفاصل الزمني بين عمليات اكتساب التألق وصور المجال الساطع. يمكن أن تتراكم التأخيرات الطفيفة في حساب وقت التصوير الفلوري بمرور الوقت وتسبب تأخيرات كبيرة وتتداخل مع التصوير الساطع المجال. أحد الحلول هو ضبط مدة دورة تصوير واحدة لجميع المواضع لتكون أقل من (لا تساوي) الفاصل الزمني بين بدء الحركات المتتالية. تقوم هذه العملية بتحديث حساب الوقت وإزالة الخطأ التراكمي في بداية كل دورة تصوير.
تدعم تقنية الاستجواب البصري بالكامل هذه (1) مجموعة واسعة من الأجهزة / البرامج ، بما في ذلك على سبيل المثال لا الحصر نيكون ، (2) أنواع متنوعة من أنظمة الهيدروجيل التي تم التحقق من صحتها ، بما في ذلك الجيلاتين ، و PEG ، و Matrigel ، و collagen I gels ، و (3) التخصيص القابل للبرمجة بناء على الاحتياجات المختلفة للباحثين. ومع ذلك ، إذا لم تكن أي من وظائف التحكم من المستوى السفلي متاحة من المجهر التجاري ، فإن تخصيص الوظائف باستخدام AMFIP يصبح تحديا. هناك قيد آخر لهذه التقنية وهو الانجراف المكاني للعينة في كل من مستوي XY والتركيز البؤري (Z). على الرغم من أنه يمكن التغلب على هذا القيد أثناء المعالجة اللاحقة للصور ، إلا أنه من الضروري تحسين وظيفة التركيز التلقائي لتصحيح انحراف العينات في الوقت الفعلي. سيؤدي هذا التحسين إلى زيادة إنتاجية عملية التصوير وتقليل الخطأ المحتمل الناجم عن الانجراف أثناء التجارب.
قد تكون محولات الطاقة الميكانيكية ، مثل YAP ، بمثابة أهداف علاجية جديدة لتطوير علاجات واعدة للسرطان25،26،27. تشير البيانات الناشئة إلى أن YAP يعزز انتشار وغزو الخلايا السرطانية. ينشط نقل YAP الناجم عن الميكانيكا من السيتوبلازم إلى النواة نسخ الجينات المتعلقة بهجرة الخلايا وانتشارها وغزوها وموت الخلايا المبرمج ، مما يؤدي إلى سلوكيات الخلايا الشاذة28،29،30،31. يهدف هذا العمل إلى استكشاف العلاقة المحتملة لنسبة YAP N / C وميكانيكا الخلايا في اثنين من سرطان الرئة البشري النموذجي وخطوط الخلايا الطبيعية. خلال فترة انتشار الخلايا لمدة 10 ساعات ، تظهر خلايا PC9 تركيزات YAP مماثلة في النواة والسيتوبلازم (الشكل 3D والشكل 5A). تظهر الخلايا B2B تركيز YAP أعلى في النواة منه في السيتوبلازم (الشكل 3C والشكل 5A). تختلف هذه العلاقة التي تم العثور عليها خلال مرحلة الانتشار المبكرة عن غالبية النتائج المنشورة التي تقارن تركيز YAP في النواة بين الخلايا الطبيعية والسرطانية. على الرغم من أنه ليس بالضرورة في مرحلة الانتشار المبكرة ، إلا أن معظم النتائج المنشورة تظهر أن YAP أكثر تركيزا في نواة الخلايا السرطانية منه في نواة الخلايا الطبيعية27,28. ذكرت دراسة واحدة فقط عن سرطان الثدي استثناء32 يظهر أن YAP أكثر تركيزا في السيتوبلازم ، وهو ما يتفق مع ملاحظاتنا الحالية التي تم إجراؤها في خلايا PC9 لسرطان الرئة. على حد علم المؤلفين ، هذا العمل هو الأول الذي يظهر نسبة YAP N / C أقل في خط خلايا سرطان الرئة البشرية. يفترض المؤلفون أن سبب استقرار نسبة YAP N / C في خلايا PC9 قد يكون بسبب التباين المنخفض في منطقة انتشار الخلية / النواة والجر في خلايا PC9 في مرحلة الانتشار المبكرة. تشريح الآليات الجزيئية الأساسية لنسبة YAP N / C المنخفضة في خلايا PC9 و B2B مستمر.
خلال أول 10 ساعات من الانتشار ، يظهر هذان الخطان الخلويان علاقة متميزة بين نسبة YAP N / C ، وجر الخلية ، ومنطقة الانتشار (الشكل 5). بالنسبة للخلايا B2B، ترتبط نسبة YAP N/C الأعلى بمنطقة انتشار أعلى للخلايا والنواة (الشكل 6A,B)، وهو ما يتسق مع البيانات المبلغ عنها للخلايا الطبيعية الأخرى33. ومن المثير للاهتمام ، على الرغم من أن الاتجاه التنموي لهذه العلاقة موجود بشكل عام في جميع الخلايا B2B المسجلة ، إلا أنه تم العثور على درجتين مختلفتين (عالية ومنخفضة) لهذه العلاقة. تظهر الخلايا B2B التي تنتشر وتهاجر في وقت واحد قوة جر أقل ومنطقة انتشار أعلى للخلايا والنواة مع نسبة YAP N / C أعلى (2.05 ± 0.32). بالنسبة للخلايا B2B التي تنتشر وتبقى في نفس الموقع ، فإنها تظهر قوة جر أعلى ومنطقة انتشار أقل للخلايا والنواة مع نسبة YAP N / C أقل (1.74 ± 0.21). وتظهر هاتان الدرجتان من العلاقات في مجموعات البيانات المتناثرة المتشعبة (الشكل 6C,D). كما ورد في الأدبيات ، فإن الخلايا الطبيعية الثابتة ، مثل خلايا الخلايا الليفية الجنينية NIH 3T3 ، لها قوة جر أعلى من الخلايا المهاجرة34. تشير البيانات الواردة في هذه الورقة إلى أن الخلايا B2B المنتشرة وغير المهاجرة طبقت قوة جر أعلى من الخلايا B2B المنتشرة والمهاجرة ، مما يشير على الأرجح إلى أن هناك حاجة إلى قوة جر عالية للخلايا غير المهاجرة لتحقيق الاستقرار على الركيزة.
بالإضافة إلى ذلك ، تظهر هذه البيانات أن الخلايا B2B الطبيعية الثابتة تولد قوة أعلى حول النواة ، في حين أن الأبحاث السابقة التي أجراها باحثون آخرون ذكرت فقط زيادة الجر الخلوي المتولد في محيط الخلايا الثابتة34،35،36،37. يعتقد المؤلفون أن الاختلاف في الميل الجوهري للهجرة في التجارب قد يسبب هذه النتائج المتناقضة. وفي التجارب المنشورة، استخدمت الأنماط الدقيقة المربعة الشكل لتقييد الخلايا المفردة من الانتشار ومنع الهجرة؛ ومن غير المعروف ما إذا كانت الخلايا تميل إلى الهجرة. وبما أن الخلايا المهاجرة غالبا ما تظهر قوة جر عالية في محيط الخلايا38، فمن المرجح أن الخلايا التي تميل إلى الهجرة ستظل تحافظ على قوة جر عالية في المحيط على الرغم من أن هجرتها مقيدة. في هذه الدراسة الحالية ، لا يتم تقييد الخلايا الثابتة بأي نمط مجهري ولكنها لا تهاجر ، مما يشير إلى أن الخلايا تميل إلى الحفاظ على حالتها غير المهاجرة. وهناك احتمال آخر هو أن شكل الخلية الذي يحدده النمط المجهري قد يؤثر على توزيع الالتصاقات البؤرية وقوى الجر39. تم إنشاء النتائج في هذه الدراسة دون أي نمط مجهري مقيد وتمثل توزيع قوة الخلايا الثابتة في شكلها الأصلي.
وعلى حد علم المؤلفين، أفاد منشور واحد فقط حتى الآن على وجه التحديد عن اكتشاف قوى شبه نووية في الخلايا الطبيعية (الخلايا الليفية الجنينية الفئران)، والتي يحتمل أن تكون ناجمة عن غطاء الأكتين الممتد عبر النواة40. ويرتبط نقل السيتوبلازم إلى النواة YAP بزيادة القوة شبه النووية40. لم يسفر البحث الدقيق في الأدبيات ذات الصلة عن أي منشوراتتفيد عن قوة شبه نووية أو غطاء الأكتين في الخلايا السرطانية. أظهرت دراسة غير مباشرة أجريت على خلايا سرطان الجلد أن حافة الأكتين (منظمة أكتين أخرى شبه نووية تقع حول النواة ولكنها لا تغطيها) تقلل من معدلات هجرة الخلايا41، مما يشير بشكل غير مباشر إلى وجود قوة شبه نووية. ومع ذلك ، لا يتم الإبلاغ عن أي بيانات تجريبية مباشرة. في هذه الدراسة ، وجد المؤلفون أن كلا من خلايا PC9 و B2B تظهر الإزاحة والجر المحيطين بالنووي. ولا تزال آليات توليد القوى شبه النووية وآثارها مثيرة للجدل. وفي الخلايا الطبيعية، أفيد بأن غطاء الأكتين يلعب دورا في تنظيم مورفولوجيا النواة وتنظيم الكروماتين42، ونقل الإشارات الميكانيكية من الالتصاقات البؤرية إلى النواة من خلال روابط الهيكل العظمي النووي ومجمع الهيكل الخلوي (LINC)43، وتنظيم هجرة الخلايا44. يرتبط Lamin A/C بتكوين وتعطيل قبعة الأكتين40,41,42,43,44. ومع ذلك ، فإن التقرير الذي ادعى أن غطاء الأكتين يولد قوة شبه نووية لم يأخذ في الاعتبار الدور المحتمل للأكتين rim40. في الخلايا السرطانية ، يسهل الإفراط في التعبير عن Lamin A تكوين حافة الأكتين ويقيد هجرة الخلايا السرطانية. الإفراط في التعبير عن Lamin B يقلل من تكوين حافة الأكتين ويعزز الهجرة. وقد تشارك القوة شبه النووية في هذه العملية بسبب وجود تنظيم للأكتين شبه النووي وتأثير لامين ألف. ومع ذلك ، لم تظهر نتائج هذه الدراسة أي دليل على القوى شبه النووية المقاسة أو سلوك غطاء الأكتين. لذلك ، فإن اكتشاف القوى شبه النووية في خلايا PC9 في هذه الدراسة الحالية هو أول تقرير يظهر القوى شبه النووية والإزاحات في خلايا سرطان الرئة. يقوم المؤلفون حاليا بالتحقيق في الآليات والوظائف الجزيئية للقوى شبه النووية في خلايا PC9 و B2B المصممة بواسطة CRISPR / Cas9.
بالإضافة إلى استجواب علم الأحياء الميكانيكي البصري بالكامل الذي تم توضيحه في هذه الورقة ، يمكن تطبيق النظام المتكامل متعدد الوظائف للتحقيق بصريا في عدد لا يحصى من الإشارات الفسيولوجية والمرضية الأساسية الأخرى في الأنظمة الحية. على سبيل المثال ، أنشأ مختبر المؤلفين مؤخرا العديد من خطوط الخلايا السرطانية البشرية المحولة بثبات والتي تشترك في التعبير عن ثلاثة بروتينات غشائية مستجيبة للضوء: مؤشر جهد الغشاء QuasAr2 (الإثارة: 640 نانومتر ؛ الانبعاثات: 660 نانومتر - 740 نانومتر) ، مزيل الاستقطاب جهد الغشاء CheRiff (الإثارة: 488 نانومتر) ، وفرط الاستقطاب جهد الغشاء eNpHR3 (الإثارة: 590 نانومتر). يمكن تنشيط هذه البروتينات الوظيفية الثلاثة بواسطة خطوط الليزر المتعامدة الطيف بطريقة خالية من الأحاديث المتقاطعة ، مما يتيح اتصالات إشارات بصرية ثنائية الاتجاه (القراءة والتحكم) للفيزيولوجيا الكهربية الغشائية. باستخدام نظام إلكتروني بصري متكامل ومشبك رقعة يدوي ، قام المؤلفون بالتحقق من صحة التحكم البصري الكامل وقراءة جهد الغشاء (Vm) في الخلايا السرطانية البشرية المفردة وكرويات الورم متعددة الخلايا. يفتح استجواب الفيزيولوجيا الكهربية البصرية بالكامل إمكانية إجراء استكشافات مفصلة للكهرباء الحيوية التي كان يتعذر الوصول إليها سابقا في الخلايا السرطانية ، مما قد يساعد في تطوير بيولوجيا الورم من محور جديد.
Disclosures
لا يوجد تضارب في المصالح للإعلان.
Acknowledgements
يتم دعم هذا المشروع ماليا من خلال جائزة السرطان التجريبية من مركز UF Health Cancer Center (X. T. و D. S.) وحزمة بدء التشغيل لجائزة Gatorade (X. T). يقدر المؤلفون بصدق المناقشات الفكرية والدعم الفني من الدكتور جوناثان ليخت (UFHCC) ، والدكتور رولف رين (UFHCC) ، والدكتور جي هيون لي (الإحصاء الحيوي ، UF) ، والدكتور هيو فان (MAE ، UF) ، والدكتور وارن ديكسون (MAE ، UF) ، والدكتور غاتو سوبهاش (MAE ، UF) ، والدكتور مارك شيبلاك (MAE & ECE ، UF) ، والدكتورة ماليسا سارنتينورانون (MAE ، UF) ، والدكتور سكوت بانكس (MAE ، UF) ، والدكتور ماثيو تراوم (MAE ، UF) ، والدكتور ديفيد هان (جامعة أريزونا) ، والدكتور Weihong Wang (شركة Oracle) ، والدكتور Youhua Tan (جامعة هونغ كونغ للفنون التطبيقية) ، وفريق الدعم من نيكون (الدكاترة خوسيه سيرانو فيليز ، لاري كوردون ، وجون إيكمان). يشعر المؤلفون بالامتنان العميق للدعم السخي والفعال من جميع أعضاء مختبرات أبحاث تانغ وسيمان وجوان وجميع موظفي أقسام MAE و ECE والفيزياء وعلم الأورام الإشعاعي ، UF.
Materials
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
References
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved