Method Article
다기능 시스템을 사용하여 인간 암 및 정상 세포에 있는 예 관련 단백질의 모든 광학 Mechanobiology 심문
* 이 저자들은 동등하게 기여했습니다
요약
이 논문은 자동 다중 채널 이미징 및 메카노생물학적 분석을 가능하게 하는 통합다기능 및 사용자 프로그래밍 가능한 시스템을 활용하여 예관련 단백질(YAP)의 메카노 민감도를 해명하는 방법에 대한 상세한 단계별 프로토콜을 제시합니다.
초록
라이브 셀의 장기적인 다기능 이미징 및 분석은 다양한 하드웨어 및 소프트웨어 플랫폼의 능률적이고 기능적인 조정이 필요합니다. 그러나, 다른 제조 업체에 의해 생산 된 다양한 장비의 수동 제어는 노동 집약적이고 시간이 많이 소요, 잠재적으로 획득 된 데이터의 정확성, 재현성 및 품질을 감소. 따라서 자동, 다기능 및 장기 이미지 수집을 가능하게 하고 대부분의 형광 현미경 플랫폼과 호환되는 올인원 및 사용자 프로그래밍 가능한 시스템은 과학 계에 도움이 될 수 있습니다. 이 백서는 (1) 자동 다중 채널 이미징 수집을 가능하게 하는 "자동 다기능 통합 프로그램(AMFIP)"이라는 홈 빌트 소프트웨어 프로그램, (2) 양적 이미징 분석 및 셀 트랙션 계산 패키지 제품군으로 구성된 새로운 통합 소프트웨어 시스템을 활용하는 완전한 운영 프로토콜을 소개합니다.
이러한 통합 시스템은 CRISPR/Cas9-엔지니어링 인간 정상 세포(B2B) 및 폐암 세포(PC9)에서 세포 확산 및 견인을 포함한 메카노 에민감한 예관련 단백질(YAP)과 세포 역학의 공간-측두형 분포 사이의 이전에 알려지지 않은 관계를 드러내기 위해 적용된다. 다중 채널 제어 및 판독의 이 시스템의 기능을 활용, 결과 보여줍니다: (1) B2B 정상 세포와 PC9 암 세포는 세포 확산 및 이동 과정 동안 YAP 발현, 견인 및 세포 역학 사이의 뚜렷한 관계를 보여줍니다; 및 (2) PC9 암세포는 기판에 눈에 띄는 페리 핵력을 적용한다. 요약하자면, 이 백서는 자동 다기능 이미징 및 분석을 가능하게 하는 통합된 사용자 프로그래밍 시스템을 활용하는 방법에 대한 상세한 단계별 프로토콜을 제시하여 YAP 메카노 민감도를 해명합니다. 이 공구는 세포 생리학 및 병리학의 맥락에서 다각적인 신호 역학의 상세한 탐구를 위한 가능성을 엽니다.
서문
이 방법의 전반적인 목표는 살아있는 세포의 모든 광학 다기능 화상 진찰 및 분석을 가능하게 하는 것입니다. 다기능 광전자 장치의 자동 조정을 가능하게 하는 올인원 이미징 프로그램은 노동 집약적이고 오류가 발생하기 쉬운 수동 작업을 줄이고 연구원이 장기 라이브 셀 이미징1,2,3,4를 수행하는 데 필수적입니다. 그러나, 생물 의학 연구 커뮤니티에 있는 대부분의 기존 공공 프로그램은 제한된 광전자 장치에만 적용하거나 다른 장비의 조정을 위한 추가 하드웨어를 요구합니다5,6,7,8,9. 최근에는 멀티 채널 및 시간 경과 이미징을 가능하게 하는 "자동 다기능 통합 프로그램(AMFIP)"이라는 제목의 오픈 소스 및 소프트웨어 기반 프로그램이 개발되었습니다. μManager11,12의 Java 언어와 애플리케이션 프로그래밍 인터페이스(API)를 기반으로 AMFIP는 사용자 지정 Java 스크립트를 실행하여 Nikon의 전자 하드웨어 및 소프트웨어 플랫폼의 소프트웨어 기반 통신을 수행하는 데 플러그인으로 개발되었습니다. AMFIP의 설립은 세포 행동의 프로그래밍 가능하고 다기능 적인 심문에 대한 가능성을 엽니 다. 이 백서에서 통합 된 실험 및 계산 시스템은 AMFIP와 디지털 이미징 분석 및 세포 견인력 현미경 을 결합합니다. 이 시스템은 CRISPR/Cas9가 설계한 인간 정상 B2B(도 1) 및 폐암 PC9(도 2) 세포주에서 뚜렷한 YAP 메카노생물학의 용해성을 가능하게 한다. 이 시스템은 과학 계에 모든 이미징 시스템과 호환되지 않을 수 있는 추가 제어 장치를 구매해야 하는 요구를 피하는 포괄적인 솔루션을 제공합니다.
이 논문에 제시된 프로토콜은 (1) AMFIP를 적용하여 mNEonGreen2 태그가 지정된 YAP를 표현하는 CRISPR/Cas9 엔지니어링 셀주 모두에 대한 자동 장기 이미징을 수행하는 방법을 소개합니다. (2) 피지 이미지J, MATLAB 및 Origin을 결합하여 형광 강도(그림 3 및 도 4), 세포 변위 필드(도 1C 및 도 2C), 셀룰러 견인력 필드(도 1D 및 도 2D)를 기반으로 YAP 핵/세포질(N/C) 비율의 정량적 분석을 위해 ). 결과는 (1) 생리적으로 관련된 기계적 강성을 갖는 기판에 퍼지는 세포의 첫 10 시간 동안 제안13,14,15,16,17,18, 단일 B2B 세포의 YAP N /C 비율은 단일 PC9 세포의 것과 비교하여 더 눈에 띄는 시간 의존적 변화와 변동을 보여줍니다 (그림 5 및 도 6 그림 6 ); (2) PC9 암세포는 페리 핵 영역에서 눈에 띄는 견인력을 생성한다(그림 7). 이 프로토콜에 기술된 통합된 체계 및 방법론은 세포와 광유전학 분자의 특정 모형을 초월합니다. 연구원은 그들의 특정 살아있는 세포 심문 실험을 커스터마이징하기 위하여 프로토콜을 적용하고 세포 생리학 및 병리학의 맥락에서 다각적인 신호 역학을 해명할 수 있습니다.
프로토콜
1. 안정적인 CRISPR/Cas9 편집 된 인간 폐암 세포주 (PC9) 및 인체 기관지 상피 세포주 (Beas2B)의 생성은 내인성 으로 mNeonGreen21-10/11 태그 YAP 단백질을 발현합니다.
- 고충실도 DNA 폴리머라제(재료표 참조)를 이용하여 형광 단백질, mNeonGreen2의 11가닥을 코딩하는 DNA 서열을 증폭시키기 위해 폴리머라제 연쇄 반응(PCR)을 수행한다.
- CRISPR-Cas9 유전자 편집 시스템을 사용하여 PC9 및 B2B 세포주YAP 게놈 궤적내증폭 DNA 서열을 노크한다.
참고: 이 DNA 서열은 형광을 방출하기 위해 mNeonGreen2의 가닥 1-10을 보완합니다. YAP-mNeonGreen21-10/11 의 게놈 서열 맵은 보충 도서 S1에 도시되어 있다. 지도에는 표지된 게놈, 기증자 및 mNeonGreen2 시퀀스가 포함되어 있습니다. - EPIfluorescence 현미경을 사용하여 CRISPR/Cas9 설계 mNeonGreen2 발현을 확인하십시오( 재료표 참조). mNeonGreen2는 세포가 네이티브 유전자 조절 네트워크의 맥락에서 YAP를 발현할 때마다 YAP에 태그되기 때문에 CRISPR/Cas9 엔지니어링 세포 모두에서 형광 강도의 존재를 확인하고 보호자 세포(control)에서 이와 비교합니다.
참고: 이 프로토콜을 따르려면 (1) 488nm 레이저(47.5mW/mm2)를 외생용, (2) 40배 목표(숫자 조리개(NA) = 0.95) 및 형광 측정을 위한 대역패스 방출 필터(ET525/50 nm) 및 (3) 이미지J 소프트웨어가 형광 측정, 정수, 비교를 한다. - CRISPR/Cas9 편집 세포주로부터 게놈 DNA를 추출하여 mNeonGreen211의 올바른 통합을 확인; 올바른 게놈 loci19,20에서 삽입을 확인하기 위해 게놈 인서트 및 시퀀싱을 측면에 있는 프라이머를 사용하여 PCR을 수행한다.
- CRISPR/Cas9 유전자 편집 시스템을 사용하여 mNeonGreen211을 노크하고, 1.3단계에서 설명된 동일한 현미경 시스템 및 이미징 파라미터를 사용하여 세포의 형광 강도 감소를 확인한다.
참고: 이 단계는 형광 강도의 비교에 의해 mNeonGreen211의 정확한 통합을 확인합니다. 노크 다운 및 부모 세포없이 CRISPR / Cas9 엔지니어링 셀은 제어로 사용됩니다. - 형광 활성화 세포 선별 (FACS) 정렬을 통해 관심의 태그 단백질을 가진 세포를 수집합니다.
- FACS 정렬을 위한 세포를 준비하려면 이를 트립시화하고 인산염 완충식식염(PBS)으로 다시 보습합니다.
- MCCS 분류의 두 개의 농축 라운드에서 부모 세포주 배경 수준 이상의 mNeonGreen2 형광으로 세포를 수집합니다.
참고: 여기에 설명된 CRISPR/Cas9 편집된 세포주를 생성하는 타임라인은 1-2개월의 순서에 있습니다. 모든 세포주는 요청 시 공개적으로 제공되므로 다른 연구 실험실이 결과를 재현할 수 있습니다.
2. PC9 및 B2B 셀의 유지 보수
- 37°C에서 5% CO2 로 가습된 조직 배양 인큐베이터에서 두 세포주를 모두 유지한다.
- 배양 106 내인성 태그 PC9 및 Beas2B 세포 75 cm2 플라스크에 RPMI-1640 배지 12 mL10% 태아 소 혈 청 및 100 μg/mL 페니실린-연쇄 절제술. 세포 수렴이 ~80%에 도달하면 두 세포주를 배양합니다.
- 마이코플라즈마 검출 키트를 사용하여 3개월마다 모든 제조업체의 권장 프로토콜에 따라 두 세포주를 테스트합니다.
- 셀주를 -80°C 냉동고에 보관합니다.
- 모든 실험에 대해 해동에서 <20개의 구절인 세포주를 사용하십시오.
3. 하드웨어 및 소프트웨어 환경 설정
- 실험의 하드웨어 환경 설정
- 공초점 컨트롤러와 반전된 현미경을 컴퓨터에 연결합니다( 재료 표 참조).
- 소프트웨어 플랫폼(재료 표)을 설치합니다.
- 공초점 컨트롤러와 반전 된 현미경을 켭니다. 다음으로 요소를 시작합니다.
- 공초점, 레이저 및 요소의 반전 된 현미경의 제어판을 엽니 다. 다음으로, 전동 단계의 움직임, 현미경 목표의 전환 및 레이저 라인의 공간 스캐닝을 테스트하여 3개의 패널이 제대로 작동하는지 확인합니다.
- AMFIP의 소프트웨어 환경 설정
- 컴퓨터에 IntelliJ, 자바 개발 키트 14.0, μManager 버전 2.0 감마 및 피지 이미지J를 설치합니다.
- IntelliJ에서 GitHub(링크: https://github.com/njheadshotz/AMFIP)에서 다운로드한 AMFIP 프로젝트를 엽니다.
- 설정 | 클릭 컴파일러 | 어노션 프로세서및 사용 성어 처리를 확인합니다.
- 프로젝트 구조 | 클릭하십시오. JAR 파일을 아티팩트하고 만듭니다. μManager 디렉토리 아래에 출력 디렉토리를 mmplugins로 설정합니다.
- 프로젝트 구조 | 클릭하십시오. μManager 디렉토리 아래에 mmplugins와 플러그인을 추가합니다.
- 드롭다운 실행 메뉴 에서 구성 추가를 클릭하고 응용 프로그램을 만듭니다.
- ij를 입력합니다. 이미지J 메인 클래스로.
- -Xmx3000m -Dforce.annotation.index=VM 옵션에 true를 입력합니다.
- 작업 디렉터리에 μManager 디렉터 리 설정합니다.
- AMFIP 플러그인으로 μManager를 활성화하려면 실행을 클릭합니다.
- 반전된 현미경으로 μManager를 연결합니다.
- 반전된 현미경의 적응 형 드라이버를 추가21 μManager 디렉토리에 넣습니다.
- 열 림 μManager. 장치 | 클릭 하드웨어 구성 마법사 및 새 구성을 만듭니다.
- 사용 가능한 장치에서 Ti2 드라이버를 추가합니다.
- 모든 주변 장치를 선택하고 새 구성 파일을 저장합니다.
- μManager를 다시 시작하고 마이크로 관리자 시작 구성에서 3.2.4 단계에서 구성 파일을 선택합니다.
4. 젤 준비
- 유리 커버슬립을 3-아미노프로필트리메톡실레인으로 실온(24°C)에서 7분 간 치료한다.
- 탈이온화(DI) 물을 사용하여 유리 커버슬립을 헹구고 160°C에서 20분 동안 커버슬립을 건조시키십시오.
- 유리 커버슬립을 0.5% 글루타랄데히드로 30분 동안 치료하고 DI 물로 헹구세요.
- 아크릴아미드 용액, N,N'N'-메틸레네비사크라이알라미드(bis) 용액, 10mM HEPES 완충식식라인에 힌광비드를 혼합한다. 10% (w/v) 암모늄 아설페이트 용액과 N,N,N',N′-테트라메틸레틸렌디아민(TEMED)을 중합의 개시자로 사용하십시오. 이전에 설명된 확립된 프로토콜에 따라 폴리아크릴아미드(PAA) 하이드로겔의 원하는 기계적 강성을 달성하기 위해 각 성분의 백분율을 변경한다13,14.
참고 : 이 프로토콜에서 2 kPa 젤 : 아크릴 아미드 = 12.5 % 및 비스 아크릴라미드 = 6.5 %; 5 kPa 젤: 아크릴아미드 = 12.5% 및 비스 아크릴아미드 = 21.5%; 및 40 kPa 젤: 아크릴아미드 = 12.5% 및 비스 아크릴아미드 = 31.5%. 나열된 모든 백분율은 볼륨 백분율입니다. - 35분 후, 고형화된 PAA 하이드로겔에서 유리 커버슬립을 껍질을 벗기고 하이드로겔을 50m HEPES 버퍼링 식염수로 두 번(매번 5분)으로 세척한다.
- 하이드로겔 표면을 수드라진 수화 용액으로 6시간 동안 처리합니다.
- 하이드로겔을 아세트산으로 30분 동안 헹구는 다. 아세트산을 제거하고 PBS로 헹구고 30분 동안 헹구습니다.
- 30분 동안 나트륨 주기체로 섬유네틴 용액(PBS내 50 μg/mL)을 산화한다.
- 하이드로겔 표면을 산화 된 자궁 근종 용액으로 코팅하고 35 분 동안 기다립니다.
- PBS를 추가하여 하이드로겔을 담그고 4°C에 보관하십시오. 하이드로겔에 대한 가벼운 노출을 피하기 위해 하이드로겔을 알루미늄 호일로 포함하는 모든 페트리 접시를 덮습니다.
5. 세포 배양
참고: 무균 기술을 사용하여 세포 배양을 수행합니다.
- 파A 하이드로겔과 유리 커버립을 35mm 유리 바닥 페트리 접시에 결합하여 세포 파종 및 이미징 프로세스 동안 젤의 물리적 드리프트를 방지합니다.
- 멸균 된 깨끗한 핀셋을 사용하여 준비 된 젤이 들어있는 페트리 접시에서 커버 슬립 (PAA 하이드로겔 상단)을 들어 올립니다.
- 드라이 와이프를 사용하여 유리 덮개 슬립의 하단 표면에 물방울을 청소하십시오.
- 멸균 핀셋을 사용하여 유리 커버슬립을 잡습니다.
- 하단 표면에 있는 두 개의 대각선 모서리에 시아노아크라일트 접착제의 작은 물방울(1-5 μL)을 놓습니다.
- 멸균 된 물티슈를 사용하여 과도한 접착제를 제거하십시오.
- 멸균 핀셋을 사용하여 유리 바닥 페트리 접시의 커버슬립을 교체하십시오. 접착제 방울이 페트리 접시표면과 완전히 접촉할 수 있도록 커버슬립의 모서리를 약간 누릅니다.
- 뚜껑을 페트리 접시에 다시 놓아 PAA 하이드로겔의 PBS 증발을 최소화합니다. 페트리 접시에서 접착제가 고화되고 건조할 수 있도록 3분 간 기다립니다.
- 페트리 접시를 PBS 4mL로 채웁니다.
- 이미징에 사용되는 페트리 접시에 나머지 PAA 하이드로겔 샘플에 대해 위의 단계 5.1.1-5.1.8을 반복한다.
- 75% 에탄올을 사용하여 모든 페트리 접시의 바깥쪽 표면을 살균하고 조직 배양 생물 안전 캐비닛으로 옮길 수 있습니다. 자외선을 5분 동안 켜고 시료를 살균합니다.
- 젤의 상단 표면에 세포를 시드.
- 자외선을 끕니다. 37°C 인큐베이터에서 플라스크(B2B/PC9 세포 포함)를 생체 안전 캐비닛으로 꺼내십시오. 진공 펌프에 연결된 파이펫을 사용하여 모든 배양 배지를 흡인하고 PBS 5mL을 추가하여 플라스크를 세척합니다.
- 플라스크 의 바닥에서 세포를 분리하기 위해 0.05 % 트립신의 2 mL을 추가합니다.
- 플라스크를 인큐베이터에 놓습니다. 5 분 기다립니다.
- 플라스크를 생물 안전 캐비닛으로 옮기습니다. 8mL의 신선한 배양 배지를 플라스크에 넣고 파이펫을 여러 번 위아래로 추가하여 세포를 균일하게 중단시합니다.
- 셀 서스펜션의 모든 10mL를 15mL 튜브로 옮기고 원심분리기는 300 × g 에서 5분 동안 전송한다.
- 튜브 의 바닥에 있는 세포 펠릿을 확인합니다. 천천히 튜브를 수평으로 기울이고 지각 파이펫을 사용하여 세포 펠릿을 만지지 않고 튜브에서 모든 배양 매체를 제거합니다. 다음으로, 모든 세포가 매질과 균일하게 혼합될 때까지 신선한 배양 배지 및 파이펫8mL을 여러 번 위아래로 추가한다.
- 셀 서스펜션(150μL)의 100μL를 젤 표면에 기탁하고 5분 동안 기다립니다. 다음으로, 페트리 요리에 4mL의 신선한 문화 매체를 천천히 추가합니다. 젤에 직접 신선한 매체를 추가하지 마십시오.
- 페트리 접시를 37°C 인큐베이터에 놓습니다. 세포가 젤 표면에 부착할 수 있도록 기다립니다(B2B: 0.5-1 h; PC9: 4-5 h).
6. 세포 이미징
참고: AMFIP는 다양한 하드웨어 및 소프트웨어 시스템과 조정하여 자동, 멀티 채널 및 장기 이미징을 가능하게 합니다: (1) AMFIP는 ΜManager를 조작하여 Ti2-E 현미경의 전동 단계를 여러 필드-뷰(FOV)로 자동으로 이동하고 흑백 카메라(재료 의 표)를 통해 밝은 필드 이미지를 획득합니다. (2) AMFIP는 사용자 정의 자바 스크립트와 요소 내부의 여러 매크로 파일을 활성화하여 공초점 z 스택 이미징 및 다른 레이저 채널 (405 nm 및 488 nm)의 전환에 대한 자동 작업을 수행합니다.
- 장기 이미징 환경을 설정합니다.
- 환경 챔버를 반전 된 현미경의 전동 단계에 놓습니다. CO2 유량을 160mL/min으로 설정하고 챔버의 온도를 조정합니다(상단: 44°C; 목욕: 42°C; 단계: 40°C). 다음으로, 40mL의 정제수를 챔버의 욕조에 넣습니다.
- 인큐베이터의 셀이 있는 유리 바닥 페트리 접시를 꺼내 환경 챔버에 넣습니다.
- 공초점 컨트롤러와 반전 된 현미경을 켭니다. 라이트 경로를 오른쪽으로 전환하고 μManager를 사용하여 부착되는 셀을 관찰합니다. 충분한 세포가 젤에 부착된 경우 페트리 접시를 인큐베이터로 다시 옮기게 합니다. 충분한 세포가 젤에 부착되지 않은 경우, B2B에 대한 또 다른 30 분 및 PC9 세포에 대한 60 분 동안 세포 배양을 계속합니다.
- 접착제 테이프의 두 개의 작은 조각을 잘라 원형 구멍 주위 챔버에 붙입니다. 다음으로, 테이프에 약간의 접착제 접착제를 적용하십시오 (페트리 접시가 덮는 부위에만 해당).
- 인큐베이터에서 페트리 요리를 꺼내라. 다음으로 페트리 접시를 천천히 챔버에 넣고 접시 바닥이 접착제와 접촉하게 합니다.
- 페트리 접시 뚜껑을 1분 간 눌러 접착제가 페트리 접시와 완전히 접촉하고 굳어지도록 합니다. 다음으로 페트리 접시를 수평으로 가볍게 밀어 주어 페트리 접시가 챔버에서 움직일 수 없는지 확인합니다.
- 챔버뚜껑을 닫습니다.
- 밝은 필드 이미징을 위해 이미지 수집 매개 변수를 설정합니다.
- IntelliJ를 열고 파일 Elements_script.java 93줄에 매개 변수 T1(예: 120s)을 설정합니다. 이 값이 한 시야(FOV)의 공초점 이미징에 사용되는 요소의 매크로 실행 시간보다 큰지 확인합니다. AMFIP IntelliJ 프로젝트를 시작하려면 실행 버튼을 클릭합니다.
- μManager의 메인 인터페이스에서 라이브 및 멀티 D Acq. 버튼을 클릭합니다. 다음으로, 반전된 현미경의 광 경로를 오른쪽으로 전환하여 밝은 필드 이미징을 위해 오른쪽으로 전환하고, 10배 목표로 전환하고, 발광 다이오드(LED) 광(밝은 필드 이미징을 위한 광원; 강도: 5%)을 엽니다.
- 요소 Ti2 패널의 광 경로, 현미경 목표 및 LED 램프 버튼을 클릭하거나 현미경의 해당 버튼을 수동으로 누릅니다.
- XY 조이스틱과 Z-평면노브를 조정하여 페트리 접시에 젤의 올바른 위치와 초점 평면을 찾습니다. 10x 목표를 사용하여 젤에 부착된 여러 단일 세포의 적절한 FOV를 찾습니다.
- 다차원 수집 창에서 여러 위치(XY) 상자를 확인합니다. 위치 편집 목록을 클릭하고 버튼으로 팝업되는 스테이지 위치 목록 창을 관찰합니다. 다음으로 목표를 40배로 변경하고 LED 라이트의 강도를 15%로 늘리고 XY 전동 스테이지를 다시 조정하여 FOV를 찾고 스테이지 위치 목록 창의 마크 버튼을 클릭하여 좌표를 기록합니다.
- 67 원하는 FOV를 기록합니다. 스테이지 위치 목록 창의 저장 으로 버튼을 클릭하여 좌표를 기록합니다. 입력 T1(예: 6.2.1 단계에서 정의된 매개 변수)이 다차원 획득 창의 타임포인트 섹션에서 T1에 대한 이미징 수집 시간 간격으로 한다.
- 2D-YAP 및 비드 이미지에 대한 이미지 수집을 설정합니다.
- 요소를 열고, 공초점 이미징을 위해 오른쪽으로 라이트 경로를 변경하고 LED 조명을 끕니다. 다음으로, 인터록 제거 버튼을 클릭하고 FITC 상자 (YAP 이미징의 경우)를 켭니다.
- 1/2 버튼을 클릭하여 2s당 1프레임으로 스캔 속도를 조정하고 Z 평면의 노브를 회전하여 연결된 셀의 Z 위치를 빠르게 찾습니다. Z 스택의 하부 및 상한을 기록합니다.
- 상단 리본의 매크로를 클릭하고 매크로 드롭다운 메뉴에서 매크로 편집기를 선택하고 6.3.2 단계에서 값을 매크로 파일에 입력합니다.
- DAPI 상자를 확인하여 4′,6-diamidino-2-phenylindole (DAPI) 레이저 채널 (비드 이미징용)을 켜 고 구슬의 집중 된 Z 위치를 찾아 기록하십시오. 매크로 편집기로 이동하여 기록된 값을 매크로 파일에 입력합니다.
- AMFIP를 사용하여 전동 스테이지를 이동하는 작업을 설정합니다.
- μManager로 이동하여 플러그인 | 클릭하십시오. AMFIP의 그래픽 사용자 인터페이스(GUI)를 열기 위한 자동화. 포인트 추가 또는 포인트 제거 버튼을 클릭하여 선택한 정확한 FOV 수를 얻습니다. 기록된 FOV 좌표를 좌표 패널에 입력합니다.
- 총 실험 시간 텍스트 필드에서 총 실험 시간을 정의합니다.
- 추가 시간 구성 버튼을 클릭하고 전동 스테이지를 각 FOV로 이동하는 시간 간격 T2(예: 30분)를 정의합니다.
- 요소의 창 크기를 최대화하고 AMFIP의 GUI를 화면 오른쪽으로 드래그하여 GUI가 커서의 자동 작동을 방해하지 않도록 합니다.
- Enter 버튼을 클릭합니다. 첫 번째 매크로가 끝나면 다차원 수집 창에서 획득! 버튼을 클릭합니다.
- 이미지 수집 후 셀을 용해합니다.
- 장기 이미징을 완료한 후 자동화 플러그인 창의 일시 중지 버튼과 다차원 수집 창의 중지 버튼을 클릭하여 AMFIP 작업을 중지합니다.
- 요소를 열고 ND 획득 창의 상단 및 아래쪽 단추를 클릭하여 Z 스택 이미징을 설정합니다(Z-range가 구슬의 Z 범위보다 더 큰 것으로 설정). 라이트 경로를 오른쪽으로 전환하고 LED 표시등(강도: 15%)을 엽니다.
- 챔버와 페트리 접시의 뚜껑을 천천히 조심스럽게 제거합니다. 한편, FOV의 드리프트에 대한 밝은 필드 보기를 모니터링합니다.
- 플라스틱 파이펫을 사용하여 0.5mL의 나트륨 도데킬 황산염(SDS) 용액을 섭취하고, 페트리 접시의 배양 배지보다 플라스틱 파이펫을 조심스럽게 잡고 SDS 용액의 1-2 방울을 배양 매체에 추가한다.
- 밝은 필드 뷰의 셀이 용해되면 라이트 경로를 왼쪽으로 전환하고 LED 라이트를 닫고 인터록 제거 버튼을 클릭합니다.
- Z 스택 이미징을 실행합니다. 이미지 스택을 저장하고 Reference_N 이름을 지정합니다(N은 각 FOV의 시퀀스 번호입니다).
- 다차원 수집 창의 여러 위치(XY) 버튼을 클릭합니다. 다음으로 다음 FOV를 선택하고 이동 버튼을 클릭하여 전동 스테이지를 두 번째 FOV로 이동합니다.
- 각 FOV에 대해 6.5.7 단계를 반복합니다.
7. YAP N/C 비율 측정
- 피지 ImageJ 소프트웨어를 사용하여 YAP N/C 비율을 측정하기 위해 이미지 분석을 수행합니다(그림 4).
- 오픈 피지 이미지J. μManager에서 획득한 모든 FOV에 대해 밝은 필드 이미지 스택을 가져옵니다.
- 이미지 드롭다운 메뉴를 열고 스택 | 선택 도구 | 슬라이스 키퍼. 다음으로 각 FOV에 대해 밝은 필드 이미지 스택을 내보냅니다.
- FITC 채널의 형광 이미지를 가져오고 동일한 FOV에 대한 밝은 필드 이미지와 오버레이합니다. 이렇게 하려면 형광 이미지를 선택하고 오버레이 | 선택합니다. 이미지 추가... (추가할 이미지: 밝은 필드 이미지; X 및 Y 위치는 다른 카메라에 의해 획득 된 밝은 필드 이미지의 크기에 따라 달라집니다; 불투명도: 60-70).
- 드롭다운 분석 메뉴를 열고 측정 설정을 선택합니다.... 통합 밀도 및 평균 회색 값입니다.
- ImageJ의 메인 인터페이스 에서 프리핸드 선택 버튼을 클릭합니다.
- 원하는 세포 체와 핵의 윤곽을 그립니다. 다음으로 분석 | 클릭합니다. 키보드의 M 버튼을 측정하거나 누릅니다.
- 나타나는 결과 창을 관찰합니다. 영역 열 아래의 값은 선택한 영역(μm2)의 영역을 나타내고 IntDen 열 아래의 값은 선택한 영역의 형광 강도를 나타냅니다.
- 다음 공식(1), (2) 및 (3)를 사용하여 YAP N/C 비율을 계산합니다.
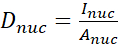 (1)
(1)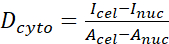 (2)
(2)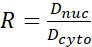 (3)
(3)
이누크와 이셀이 핵과 세포 체의 상대적 강도를 나타내는 경우, 아누크와 아셀은 핵과 세포 체의 영역을 나타낸다. R은 YAP N/C 비율입니다. - 이폴 견인력과 페리 셀/페리 핵 변위의 향후 계산을 위한 개요를 저장합니다. 이렇게 하려면 | 분석하려면 클릭 하십시오. 도구 | XY 좌표를 저장 ...
8. 견인력 장 측정
- 피지 ImageJ 플러그인22,23을 통해 견인력 현미경 검사를 적용합니다.
- 오픈 피지 이미지J.
- FOV용 구슬의 이미지 스택을 가져옵니다.
- 구슬의 가장 명확한 분포를 보여 주는 슬라이스를 선택하고 이미지를 클릭하여 추출 | 스택 | 도구 | 슬라이스 키퍼.
- 동일한 FOV에 대한 참조의 이미지 스택을 가져옵니다.
- 8.1.3 단계의 슬라이스와 동일한 밝기와 대비를 가진 슬라이스를 선택합니다. 그런 다음 참조 이미지로 추출합니다.
- 이미지 | 선택 스택 | 도구 | 8.1.3 및 8.1.5 단계에서 두 조각을 결합하려면 결합합니다(참조 이미지를 첫 번째 슬라이스로 선택).
- 플러그인 | 선택 템플릿 일치 | 슬라이스를 스택 또는 플러그인 | 정렬 이미지 안정기는 두 조각을 정렬합니다.
- 이미지 | 선택 스택 | 이미지에 스택합니다. 다음으로 이미지 | 선택 조회 테이블 | 녹색은 첫 번째 슬라이스의 색상을 녹색으로 변환하고 이미지 | 선택합니다. 조회 테이블 | 빨간색으로 두 번째 슬라이스의 색상을 빨간색으로 변환합니다.
- 이미지 | 선택 색상 | 채널을 병합하여 두 이미지를 병합합니다.
- 이미지를 동일한 FOV의 밝은 필드 이미지와 겹치고 이 겹치는 이미지를 사용하여 비드 변위를 관찰합니다.
- 플러그인 | 선택 PIV | 반복적 인 PIV (기본).... 심문 창 크기를 128/256으로 설정합니다. 64/128; 32/64 (심문 창당 적어도 4개의 구슬). 상관 관계 임계값을 0.6으로 설정합니다.
- 확인을 클릭 합니다. 계산이 끝나면 사용자가 만든 일반 폴더에 비드 변위의 원시 데이터와 함께 텍스트 파일을 저장합니다.
- 플러그인 | 선택 FTTC | FTTC 및 8.1.9 단계에서 텍스트 파일을 선택합니다.
- 픽셀 크기(μm), 젤(파스칼)의 영계, 그리고 비드의 실험과 이미지를 기반으로 플롯 폭과 높이를 입력합니다.
- 확인을 클릭하여 8.1.12 단계의 텍스트 파일과 동일한 디렉토리에 견인력의 원시 데이터가 포함된 텍스트 파일을 자동으로 저장합니다.
- 그래프 소프트웨어(재료 테이블)를 사용하여 여러 셀에 대해 동일한 배율로 견인력 필드를 플롯합니다(그림 1B, C 및 그림 2B, C).
- 견인의 원시 데이터가 포함된 텍스트 파일을 스프레드시트에 삽입합니다.
- 새 시트를 만들고 견인의 Y 좌표를 첫 번째 행에 입력하고(높은 값에서 낮은 값으로 정렬) X 좌표가 첫 번째 열에 입력합니다(낮은 값에서 높은 값까지 정렬).
- 원시 데이터에서 각 좌표에 견인 값을 입력합니다.
- *.csv 파일로 8.2.2 단계에서 시트를 저장합니다.
- 오픈 오리진.
- 파일 | 클릭 8.2.4 단계에서 *.csv 파일을 열고 가져옵니다. 모든 셀을 선택하고 플롯 | 클릭 윤곽| 윤곽 - 색상 채우기.
- 플롯: 플롯: 플롯vm 창에서 열 에서 Y를 선택하여 Y 값을 첫 번째 행으로, X 값을 첫 번째 열로 자동으로 설정합니다. 다음으로 제목이름을 지정하고 확인을 클릭합니다.
- 팝업 그래프 창에서 히트맵을 두 번 클릭합니다.
- 컬러맵/윤곽 창의 레벨을 클릭합니다. 다음으로 배율 수준을 합리적인 범위(이 분석의 0300)로 변경하고 확인을 클릭합니다.
- 줄을 클릭하고 주요 레벨만 에서만 표시를 선택 취소하고 모두 숨기기 확인합니다. 다음으로 확인을 클릭합니다.
- 그래프를 마우스 오른쪽 단추로 클릭하고 내보내기 그래프를 선택합니다 .
- MATLAB을 사용하여 다극지 세포 견인력을 계산합니다.
- 8.1.12 단계에서 정의된 동일한 폴더에 견인 원시 데이터 텍스트 파일(8.1.12 단계부터) 및 ROI(셀 경계 영역)를 좌표(단계 7.1.9단계에서)를 저장합니다. AMFIP 패키지에 있는 모든 MATLAB 파일을 이 폴더로 전송합니다.
- MATLAB을 엽니다. 8.1.12 단계에서 정의된 폴더를 열고 다극견 계산 함수 파일 absdipole.m 8.3.1 단계에서이 폴더로 전송합니다.
- 8.3.1 단계에서 두 개의 텍스트/csv 파일을 MATLAB 작업 공간에 읽고 두 변수(예: 견인 및 roi)에 행렬을 할당합니다.
- 함수 absdiple (견인, roi)를 실행합니다.
참고: 출력의 첫 번째 컬럼은 nN(나노 뉴턴)의 이폴 견인력입니다. 출력의 두 번째 열은 수평 축에 대하여 다극 견인력의 각도입니다.
결과
CRISPR/Cas9 가 설계PC9 암 및 B2B 정상 세포에서 세포 확산 시 뚜렷한 YAP 분포 및 역학
단일 B2B 및 PC9 세포에서 YAP 분포의 대표적인 형광 이미지는 도 1A 및 도 2A에 도시된다. B2B 세포에서 YAP의 핵 국소화는 기질 강성 증가(도 1A)로 증가한 반면, PC9 세포는 다양한 강성의 기판에 핵 및 세포질에서 유사한 YAP 농도를 보였다(도 2A). 5kPa 하이드로겔 기판에 B2B 및 PC9 세포를 확산시키는 단일에서 YAP 분포의 대표적인 형광 영상(기판에 부착된 세포 후 0h에서 10h까지)은 각각 도 1B 및 도 2B로 도시된다. B2B 셀은 YAP N/C 비율(도 1B)의 감소와 함께 시간이 지남에 따라 스프레드 영역을 모노톤으로 증가시켰으며, PC9 셀은 10h 확산 공정(도 2B)에 걸쳐 비교적 변하지 않는 세포 확산 영역, 방향 및 YAP N/C 비율을 유지하였다. 10시간 동안 조기 확산을 지속하는 동안, 대표적인 B2B 세포는 기판 표면을 구성적으로 변형시키고 전체 세포 영역에 걸쳐 시간 진화하는 세포 견인력을 적용하였다(도 1C 및 도 1D).
대조적으로, 대표적인 PC9 셀은 세포 체의 양끝에서 변위 및 견인력을 개발하고 그 견인력은 7.5h(도 2C 및 도 2D) 후에 감소하였다. 초기 확산 단계에서 B2B 및 PC9 세포의 더 많은 시간 경과 이미지와 견인력 측정은 보충 도도 S2 및 보충 도서 S3에 제공됩니다. PC9 셀 역학의 다른 모드도 관찰하였다(도 6). 이러한 상이한 확산 특성과 병행하여, B2B 및 PC9 세포는 뚜렷한 YAP 분포 및 역학을 보였다(그림 3). 5 kPa 겔에서, B2B 세포에서 YAP는 0h 에 핵에 집중되고 10시에 세포 체전체에 더 균질하게 분포되었다. 그러나, PC9 세포는 확산 과정의 전체 10 h에 걸쳐 핵및 세포질에서 YAP의 보다 균일한 분포를 보였다. B2B 및 PC9 셀에서 YAP 활동 및 전좌를 정량적으로 분석하기 위해 YAP N/C 비율은 도 4에 설명된 알고리즘을 사용하여 계산되었다.
뚜렷한 YAP 역학을 추가로 조사하기 위해, YAP N/C 비율, 세포/핵 영역 및 다중 단일 B2B 세포(n=10) 및 PC9 세포(n=5)의 견인력의 측두각을 비교하였다(도 5). B2B 세포의 평균 YAP N/C 비율이 0.22± 0.22에서 1.79 ±로 0.21(n = 10; p = 0.0022**)로 감소한 것으로 나타났습니다. 도 5A), PC9 세포의 평균 YAP N/C 비율은 0.07(n= 5; p = 0.187(중요하지 않음)± 0.26± 0.26에서 1.57로 변경되었습니다. 그림 5A). B2B 세포의 평균 이폴 견인은 256.17 ± 123.69 nN에서 287.44 ± 99.79 nN (p = 0.7593 (ns); 그림 5B). PC9 세포의 평균 이폴 견인은 141.19 ± 33.62 nN에서 168.52 ±로 73.01 nN (p = 0.7137(ns)으로 변경되었습니다. 그림 5B). B2B 세포의 평균 세포 확산 면적은 613.89 ± 102.43 μm2 에서 942.51 ± 226.71 μm2 (p = 0.0512(ns) 증가했습니다. 그림 5C).
PC9 세포의 평균 세포 확산 면적은 495.78 ± 97.04 μm2 에서 563.95 ± 89.92 μm2 (p = 0.5804 (ns); 그림 5C). B2B 세포의 평균 핵 확산 면적은 181.55 ± 36.18 μm2 에서 239.38로 43.12 μm2 (p = 0.1217 (ns) ± 증가했습니다. 그림 5D) PC9 세포의 평균 핵 확산 면적은 133.31 ± 30.05 μm2 에서 151.93± 22.49 μm2 (p = 0.5944(ns) 변경됨); 그림 5D). 이러한 결과는 (1) B2B 세포가 구성적으로 기판 강성-의존적인 YAP N/C 비율을 보여 준다; (2) B2B 세포의 견인력은 PC9 세포의 견인력보다 높다; (3) B2B 세포와 는 달리, PC9 세포는 10h 확산 과정에서 세포 영역및 YAP N/C 비율의 변화가 제한된 증가를 보여준다.
B2B 셀의 마이그레이션 상태에 대한 YAP 분포 및 역학의 상관 관계
모든 B2B(n=10) 및 PC9(n=5) 세포의 YAP N/C 비및 이폴 견인체를 세포 확산 영역 및 핵 확산 영역의 함수로서 비교하였다. PC9 세포의 YAP N/C 비율 및 이폴 견인은 그들의 작은 세포 및 핵 퍼짐 영역 범위와 명확하게 상관관계가 없었다(그림 6). 대조적으로, B2B 세포의 YAP N/C 비율 및 이폴 견인은 이 실험에서 공존하는 B2B 세포의 2개의 단이 있을지도 모른다는 것을 건의하는 2개의 명백한 동향 (그림 6A 및 도 6C)를 따르는 것처럼 보였습니다. 제1군에서는, YAP N/C 비및 이폴 견인력이 세포 확산 영역의 확대와 함께 증가하고 ~ 1000 μm2(도 6C 및 도 6D, 노란색 대시 선으로 표시)에서 최대군에 도달한다. 두 번째 그룹에서는, YAP N/C 비율 및 이폴 견인은 세포 확산 영역의 확대와 함께 느린 속도로 증가하고 셀 스프레드 영역이 계속 증가할 때 거의 일정한 값을 유지한다(도 6C,D, 녹색 대시 선으로 표시).
PC9 암세포는 페리 핵 지역에서 견인력을 생성합니다.
단일, 확산 PC9 세포는 배양의 6 h 에서 시작하여 peri-nuclear 영역에서 기판을 대체한다(도 7C). 세포 견인에 의한 경핵 변위를 시각화하기 위해, 우리는 기판에서 세포의 제거(빨간색) 및 후(녹색) 촬영한 형광 구슬의 이미지를 겹쳤다(자세한 내용은 프로토콜 섹션 참조). 변위가 없는 구슬은 겹치는 이미지, 즉 빨간색과 녹색 색상의 추가에 노란색으로 표시됩니다. 대조적으로, 셀 견인로 인해 휴식 위치에서 변위되는 구슬은 분리 된 녹색과 빨간색 색상을 표시합니다.
특히, 두 PC9(도 7C,D) 및 B2B(도 7E) 세포에서, 비드 변위는 세포 경계에 있는 세포질 및 핵 내의 관찰되었다. 페리-핵 변위를 강조하기 위해 선형 탄성 이론의 부신세크 방정식은 셀 경계(도 7B의 검은 파선)24에서 가상 의 상극 힘에 의해 생성된 2D 이론적 변위를 예측하는 데 사용됩니다. 이러한 이론적 곡선과 동일한 축(도 7D의 흰색 파선)을 따라 측정된 실제 기판 변위와 비교하면 핵 내의 실제 변위는 이론적 값(도 7B)보다 1.5-8배 더 큰 것으로 나타났으며, 이는 페리 핵 영역에서 견인력의 존재를 나타낸다.

도 1: YAP 발현/분포, 기판 변위 필드 및 다양한 강성의 기판및 조기 확산 시 B2B 정상 셀의 견인 장 변경. (A) 2, 5, 40 kPaA 젤에 시드된 B2B 세포의 YAP 발현 및 초기 세포 기판 부착기로부터 60시간 후 유리 커버슬립. (B) B2B 셀은 5kPaPaA 젤에 시드되고 초기 세포 기판 부착 후 10시간 이상 심화되었다. YAP 발현은 녹색 형광 강도로 표현됩니다. 참고: 핵 내부의 YAP 강도는 점차 감소하지만 시간이 지남에 따라 세포질에서 보다 높게 유지됩니다. 색상 막대는 YAP 식(녹색 = 높은 표현식; 검은색 = 낮은 표현식)의 수준을 나타냅니다(A) 및 (B). (C) 셀 위치에서 기판 변형(밝은 필드 이미지와 겹쳐)은 각 시점에서 변위 필드로 표시됩니다. 변위 방향과 크기는 각각 화살표 방향과 색상으로 표시됩니다. 변위는 세포 확산 영역이 증가함에 따라 B2B 세포 체의 끝에서 더 커집니다. 색상 막대는 변위 크기를 나타냅니다(진홍색 = 진도; 검은색 = 낮은 크기). (D) 변위 필드에서 계산된 견인력 필드(밝은 필드 이미지와 겹친다). 견인은 B2B 세포의 경계에 집중된다. 흰색과 노란색 점선 은 각각 세포와 핵의 경계를 설명합니다. 색상 막대는 견인력 크기를 나타냅니다(진홍색 = 진도; 검은색 = 낮은 크기). 스케일 바 = 20 μm. 약어: YAP = 예 관련 단백질; PAA = 폴리 아크릴아미드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
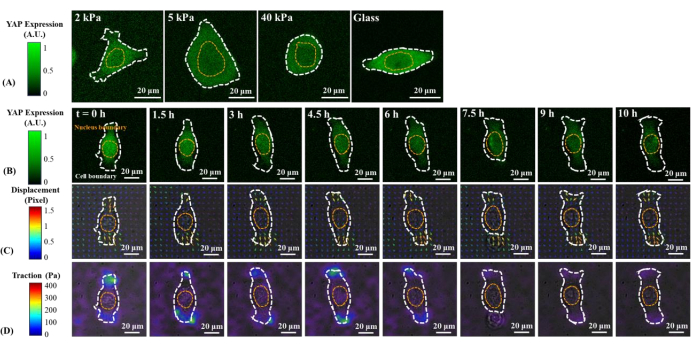
그림 2: 다양한 강성의 기판과 조기 확산 시 PC9 암세포의 YAP 발현/분포, 기판 변위 필드 및 견인 분야의 변화. (A) 초기 세포 기판 부착으로부터 65h 후 2, 5, 40kPa PAA 젤 및 유리 커버슬립에 시드된 PC9 셀의 YAP 발현. (B) PC9 셀은 5kPa PAA 젤에 시드되고 초기 세포 기판 부착 후 10 시간 이상 심화되었다. YAP 발현은 녹색 형광 강도로 표현됩니다. 참고: YAP 강도 고원은 1.5h 이후입니다. 색상 막대는 (A)에서 YAP 표현식(녹색 = 높은 발현; 검은색 =낮은 발현)의 수준을 나타내고 (B) 기판 변형(밝은 필드 이미지와 겹쳐있음)은 각 시점에서 형광 비드 변위 필드로 표현된다. 변위 방향과 크기는 각각 화살표 방향과 색상으로 표시됩니다. PC9 셀에 의한 변위 필드는 B2B 셀에 의한 것보다 작습니다. 10 h 확산 과정 전반에 걸쳐, PC9 세포의 영역은 거의 일정하게 남아. 색상 막대는 변위 크기를 나타냅니다(진홍색 = 진도; 검은색 = 낮은 크기). (D) 배기 필드에서 계산된 견인력 필드(밝은 필드 이미지와 겹친다). 이 대표적인 PC9 셀에 의해 생성된 견인력은 6h에서 10h로 점차 감소합니다. 흰색과 노란색 점선 은 각각 세포와 핵의 경계를 설명합니다. 색상 막대는 견인력 크기를 나타냅니다(진홍색 = 진도; 검은색 = 낮은 크기). 스케일 바 = 20 μm. 약어: YAP = 예 관련 단백질; PAA = 폴리 아크릴아미드. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 초기 확산 단계에서 B2B 및 PC9 셀에서 YAP 분포. (A) B2B 세포의 YAP 강도는 0과 10h.(B)에서 할당된 적축을 따라 측정되며, YAP 강도는 핵과 세포질 사이의 극적인 농도 차이를 나타낸다. 10시에, YAP 강렬은 전신에 걸쳐 더 균일하게 된다. (C) PC9 세포의 YAP 강도는 0과 10h.(D)에서 할당된 청색축을 따라 측정되며, 0h에서 핵의 YAP 강도는 세포질에서 보다 높게 나타나지만, B2B 세포에서만큼 눈에 띄는 차이는 아니다. 10h에서, 핵에 있는 YAP 강도는 아직도 0h에서 그와 유사한 변화 추세와 함께, 세포질에서 그보다는 약간 높게 나타납니다. 스케일 바 = 20 μm(A, C). 약어: YAP = 예 관련 단백질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 4: YAP N/C 비율 측정. (1) 피지 ImageJ를 적용하여 핵의 윤곽을 그리고 2D 예상 면적 아누크를 측정합니다. (2) 핵 이누크 내부의 형광 강도를 측정한다. (3) 세포 체의 윤곽을 그리고 예상 된 영역 Acel을 측정합니다. (4) 세포 Icel 내부의 형광 강도를 측정합니다. (5) YAP 핵 밀도 Dnuc, YAP 세포질 밀도 디키토 및 그 비율 R: Dnuc=Inuc/Anuc을 계산; 디토=(이셀 이누크)/(아셀-아누크); R=Dnuc/Dcyto. 색상 막대는 YAP 식의 수준을 나타냅니다(녹색 = 높은 표현식; 검정 = 낮은 식). 스케일 바 = 20 μm. 약어: YAP = 예 관련 단백질; N = 핵; C = 세포질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
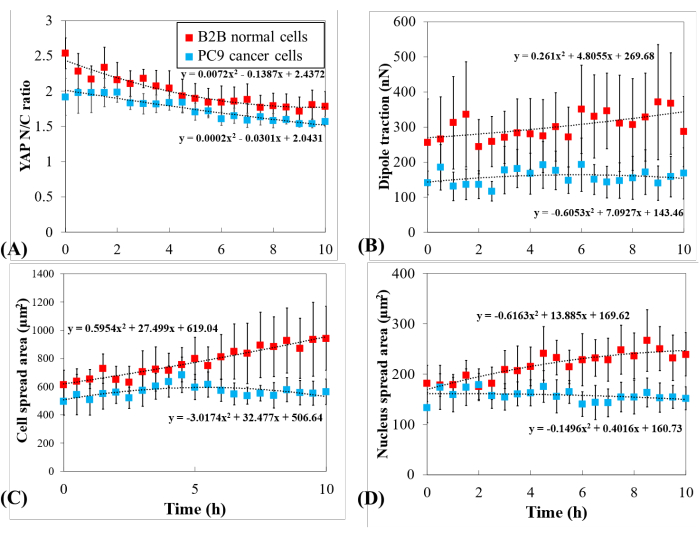
그림 5: 세포 확산 중 PC9 암 및 B2B 정상 세포에서 뚜렷한 YAP 발현, 세포/핵 형태 및 세포 견인. (A) 단일 셀 확산의 첫 10h 동안 YAP N/C 비율 변경. B2B 세포의 평균 YAP N/C 비율(적색 기둥; n = 10) ± 0.22에서 1.79 ± 0.21 (n = 10; p = 0.0022**)으로 변경된 반면 PC9 셀의 평균 YAP N/C 비율(파란색 열; n =5)은 0.26 ±에서 1.57 ± 0.07(p=18)로 변경되었습니다. (B) 시간의 함수로서 평균 이폴 견인. B2B 세포의 평균 이폴 견인은 256.17 ± 123.69 nN에서 287.44 ± 99.79 nN (p = 0.7593 (ns)로 변경되었습니다. PC9 세포의 평균 이폴 견인은 141.19 ± 33.62 nN에서 168.52 ± 73.01 nN (p = 0.7137 (ns)으로 변경되었습니다. (C) 시간의 함수로서 평균 세포 영역. B2B 세포의 평균 세포 확산 면적은 102.43 μm2 ± 613.89에서 942.51 ± 226.71 μm2 (p = 0.0512(ns)로 증가했습니다. PC9 세포의 평균 세포 확산 면적은 495.78 ± 97.04 μm2 에서 563.95 ± 89.92 μm2 (p = 0.5804(ns)로 변경되었다. (D) 시간의 함수로서 평균 핵 영역. B2B 세포의 평균 핵 확산 면적은 181.55 ± 36.18 μm2 에서 239.38± 43.12 μm2 (p = 0.1217(ns)로 증가하였으며 PC9 세포의 평균 핵 확산 면적은 133.31 ± 30.05 μm2 에서 151.93± 22.49 μm2 (p = 0.5944(ns)로 변경되었다. 약어: YAP = 예 관련 단백질; N = 핵; C = 세포질; ns = 중요하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 6: 세포 및 핵의 확산 영역의 함수로서 YAP N/C 비율 및 이폴 견인력. B2B 셀(n=10) 및 PC9 세포의 YAP N/C 비율 및 이폴 견인(n=10)은 기판에 부착한 후 6h 에서 10h 로 계산된다. (A) 세포 확산 영역의 함수로서 YAP N/C 비율. B2B 세포의 YAP N/C 비율은 1.16에서 2.53사이로 다르며, PC9 세포의 YAP N/C 비율은 1.27에서 1.88사이로 다양합니다. B2B 전지의 전지 확산 면적은 391.94 μm2 에서 1986.40 μm2로 다양합니다. PC9 셀의 셀 확산 면적은 284.46 μm2 에서 830.12 μm2사이입니다. (B) 핵 확산 영역의 함수로서 YAP N/C 비율. B2B 세포의 핵 확산 면적은 107.09 μm2 에서 514.28 μm2로 다양합니다. PC9 세포의 핵 확산 면적은 58.03 μm2 에서 259.65 μm2사이입니다. 세포 확산 영역(C)과 핵 확산 영역(D)의 기능으로서 B2B 세포의 다폴 견인. 확산 및 비마이그레이션 B2B 세포는 더 낮은 세포 및 핵 영역을 가진 더 높은 견인(47.50 nN에서 1051.48 nN까지)을 보여줍니다. 확산 및 마이그레이션하는 동안 B2B 세포는 세포 및 핵 영역의 더 큰 범위와 낮은 견인 (105.80 nN에서 310.28 nN)을 보여줍니다. 약어: YAP = 예 관련 단백질; N = 핵; C = 세포질. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
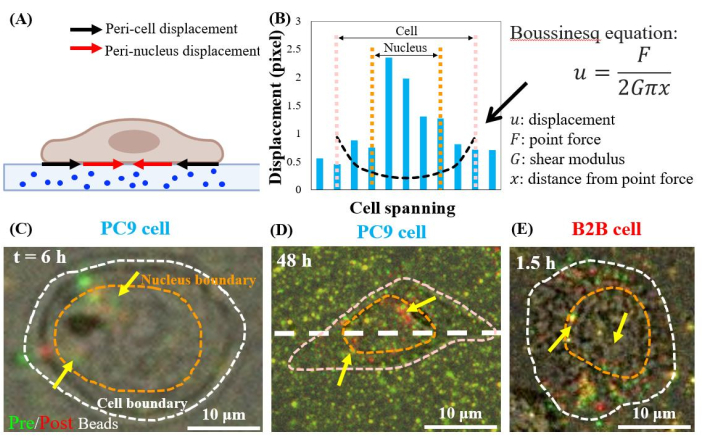
그림 7: 정상적인 B2B 및 암 PC9 세포의 페리 핵 변위. (A) 기판의 비드 변위로부터 측정된 페리 핵 및 페리 세포 변위의 회로도 측뷰 다이어그램. (b) PC9 셀 아래기질 변위는 세포축(7D의 백색 파선)을 따라 측정된다. 세포 경계에서 이폴 힘에 의해 생성된 이론적 변위는 부신세크 방정식(검정 파선 곡선)에 의해 도시된다. (C) 및 (D) 부착 후 6h에서 PC9 셀에 대한 (빨간색) 및 (녹색) 셀이 없는(녹색) 및 과중형 비드 이미지를 부착(Top view). 노란색(빨간색과 녹색 색상의 정확한 겹침) 구슬은 변위를 나타내지 않습니다. 분리된 녹색 구슬과 빨간색 구슬(노란색 화살표로 가리키기)은 페리 핵 변위를 나타냅니다. 노란색 화살표는 핵 의 주변에 위치한 이러한 수축 된 페리 핵 반점을 나타냅니다. (E) 세포기판 부착 후 1.5h에서 B2B 셀에 의해 생성된 페리 핵 변위. 스케일 바 = 10 μm(C-E). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 도서 S1: YAP-mNeonGreen21-10/11의 게놈 서열지도. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보조 도서 S2: YAP 발현/분포, 기판 변위 필드 및 조기 확산 시 B2B 정상 세포의 견인 필드의 변화. (A, D, G, J, M) B2B 셀은 5kPa PAA 젤에 시드되고 초기 세포 기판 부착 후 10시간 이상 심화되었다. YAP 발현은 녹색 형광 강도로 표현됩니다. 참고: 핵 내부의 YAP 강도는 점차 감소하지만 시간이 지남에 따라 세포질보다 높게 유지됩니다. 색상 막대는 YAP 표현식(녹색 = 하이표현, 검은색 = 낮은 표현식)의 수준을 나타냅니다 (A, D, G, J, M). (B, E, H, K, N) 셀 위치에서 기판 변형(밝은 필드 이미지와 겹쳐있음)은 각 시점에서 변위 필드로 표시됩니다. 변위 방향과 크기는 각각 화살표 방향과 색상으로 표시됩니다. 변위는 세포 확산 영역이 증가함에 따라 B2B 세포 체내 의 주변에서 더 커집니다. 색상 막대는 변위 크기(진홍색 = 높은 크기; 검은색 = 낮은 크기)를 나타냅니다 (B, E, H, K, N). (C, F, I, L, O) 견인력 현미경을 사용하여 변위 필드에서 계산된 견인력 필드(밝은 필드 이미지와 겹쳐) 견인력은 B2B 세포의 주변에 집중되어 있습니다. 색상 막대는 견인 크기(진홍색 = 높은 크기; 검은색 = 낮은 크기)를 나타냅니다 (C, F, I, L, O). 스케일 바 = 20 μm. 약어: YAP = 예 관련 단백질; PAA = 폴리 아크릴아미드. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 도 S3: YAP 발현/분포, 기판 변위 필드 및 조기 확산 시 PC9 암세포의 견인 분야의 변화. (A, D, G, J) PC9 셀은 5kPa PAA 젤에 시드되고 초기 세포 기판 부착 후 10 시간 이상 심화되었다. YAP 발현은 녹색 형광 강도로 표현됩니다. 참고: 핵 내부의 YAP 강도는 점차 감소하지만 시간이 지남에 따라 세포질에서와 비슷하거나 약간 낮게 유지됩니다. 색상 막대는 YAP 식(녹색 = 높은 표현식; 검은색 = 낮은 표현식)의 수준을 나타냅니다 (A, D, G, J). (B, E, H, K) 셀 위치에서 기판 변형(밝은 필드 이미지와 겹쳐있음)은 각 시점에서 변위 필드로 표시됩니다. 변위 방향과 크기는 각각 화살표 방향과 색상으로 표시됩니다. 세포 확산 영역이 증가함에 따라 PC9 세포 체내 의 주변에서 변위가 커집니다. 색상 막대는 변위 크기(진홍색 = 높은 크기; 검은색 = 낮은 크기) 를 나타냅니다(B, E, H, K). (C, F, I, L) 변위 필드에서 계산된 견인 필드(밝은 필드 이미지와 겹칩니다). 견인력은 PC9 세포의 주변에 집중되어 있습니다. 색상 막대는 견인 크기(진홍색 = 높은 크기; 검은색 = 낮은 크기)를 나타냅니다 (C, F, I, L). 스케일 바 = 20 μm. 약어: YAP = 예 관련 단백질; PAA = 폴리 아크릴아미드. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이미징 프로세스(Step 6.3)는 형광 이미지가 유효한 정량화 결과를 산출하기에 충분한 품질인지 확인하는 데 매우 중요합니다. 형광 단백질 또는 구슬의 z 스택 이미지는 샘플이 스위퍼하는 모든 Z 위치에 대한 초점 이미지를 포함할 만큼 충분히 큰 z-range가 있어야 합니다. 또 다른 중요한 단계는 세포를 용해 한 후 형광 구슬의 참조 이미지를 수집하는 것입니다 (단계 6.5). 참조 이미지는 6.3 단계에서 동일한 위치에서 촬영해야 하기 때문에 페트리 접시, 환경 챔버 및 현미경 사이에 상대적 변위가 유도되어서는 안됩니다. 용해 단계를 수행하는 조사관은 페트리 접시의 뚜껑을 제거하고 적용 된 기계적 교란이 환경 챔버에서 접시의 위치를 변경할 만큼 충분히 크지 않도록주의해야합니다.
실험 중에 발생할 수 있는 몇 가지 오류를 해결하기 위해 솔루션이 아래에 제공됩니다. 6.4 단계에서 Enter 를 클릭한 후 매크로가 활성화되지 않으면 화면의 왼쪽 하단 영역이 요소가 아닌 창에 의해 점유되기 때문일 수 있습니다. 이러한 경우 요소에서 매크로를 활성화할 수 있도록 창의 왼쪽 아래쪽 영역을 지워야 합니다. 또 다른 일반적인 오류는 밝은 필드 이미지가 검은색으로 표시된다는 것입니다. 이 문제는 형광및 밝은 필드 이미지의 수집 사이의 시간 간격이 부족하여 발생합니다. 형광 화상 진찰 시간 계산에 있는 약간 지연은 시간이 지남에 따라 축적하고 상당한 지연을 일으키는 원인이 되고 밝은 필드 화상 진찰을 방해할 수 있습니다. 한 가지 해결책은 연속 모션의 시작 사이의 시간 간격보다 적게 (동일하지 않음)하는 모든 위치의 하나의 이미징 주기의 지속 시간을 조정하는 것입니다. 이 작업은 시간 계산을 새로 고치고 각 이미징 주기의 시작 부분에서 누적 오류를 제거합니다.
이 모든 광학 심문 기술은 (1) 니콘을 포함하되 이에 국한되지 않는 광범위한 하드웨어/소프트웨어를 지원하며, (2) 젤라틴, PEG, Matrigel 및 콜라겐 I 젤을 포함한 다양한 유형의 검증된 하이드로겔 시스템, (3) 연구원의 다양한 요구에 따라 프로그래밍 가능한 사용자 정의를 지원합니다. 그러나, 상용 현미경으로부터 하부 수준의 제어 기능을 사용할 수 없는 경우 AMFIP를 사용하는 기능의 사용자 지정이 어려워집니다. 이 기술의 또 다른 제한은 XY 및 초점(Z) 평면 모두에서 샘플의 공간 드리프트입니다. 이러한 제한은 이미지의 후처리 중에 극복할 수 있지만, 샘플의 실시간 드리프트를 보정하기 위해 자동 초점 기능을 개선하는 것이 필수적입니다. 이러한 개선은 이미징 프로세스의 처리량을 증가시키고 실험 중 드리프트로 인한 잠재적 인 오류를 줄일 수 있습니다.
YAP와 같은 메카노트랜스듀서는 유망한 암 치료의 개발을 위한 새로운 치료 목표역할을 할 수 있습니다25,26,27. 신흥 데이터는 YAP가 암세포의 증식 그리고 침략을 승진시키는 것을 건의합니다. 역학 유도된 YAP 전좌는 세포질에서 핵으로의 YAP 전좌를 활성화하여 세포 이동, 증식, 침략 및 세포멸과 관련된 유전자의 전사를 활성화하여 비정상적인 세포 거동을 유도28,29,30,31로 이어집니다. 이 작품은 2개의 전형적인 인간 적인 폐암 및 일반적인 세포주에서 YAP N/C 비율 및 세포 역학의 잠재적인 상관관계를 탐구하는 것을 목표로 했습니다. 10h 세포 확산 기간 동안, PC9 세포는 핵 및 세포질에서 유사한 YAP 농도를 나타내게 한다(도 3D 및 도 5A). B2B 세포는 세포질(도 3C 및 도 5A)보다 핵에서 더 높은 YAP 농도를 나타내고 있다. 초기 퍼지는 단계에서 찾아낸 이 관계는 정상과 암세포 사이 핵에 있는 YAP 사격을 비교하는 간행된 사실 인정의 대다수와 다릅니다. 비록 반드시 초기 확산 단계에서, 대부분의 출판 된 사실 인정은 YAP정상 세포의 핵에서 보다는 암세포의 핵에 더 집중되어 있다는 것을 보여줍니다27,28. 유방암에 대한 단 하나의 연구는 예외를보고32 YAP가 폐암 PC9 세포에서 만든 우리의 현재 관찰에 동의 세포질에 더 집중되어 있음을 보여줍니다. 저자의 지식의 최고에, 이 작품은 인간 폐암 세포주에서 더 낮은 YAP N/C 비율을 보여주는 첫번째입니다. 저자는 PC9 세포에서 안정적인 YAP N/C 비율에 대한 이유가 초기 확산 단계에서 PC9 세포에서 세포/핵 확산 영역 및 견인의 낮은 변이 때문일 수 있다고 가설. PC9 및 B2B 세포에서 낮은 YAP N/C 비율의 기초 분자 메커니즘의 해부는 진행 중이다.
확산의 처음 10h 동안, 이들 두 세포주들은 YAP N/C 비율, 세포 견인력 및 퍼짐 영역(도 5)과 뚜렷한 관계를 보여준다. B2B 세포의 경우, 더 높은 YAP N/C 비율은 다른 정상 세포의 보고된 데이터와 일치하는 더 높은 세포 및 핵 확산 영역(도 6A,B)과 상관관계가 있다33. 흥미롭게도, 이 관계의 발달 추세는 일반적으로 기록된 모든 B2B 세포에서 발견되더라도, 이 관계의 2개의 다른 도 (높고 낮은) 찾아낸다. 동시에 퍼지고 이동하는 B2B 세포는 더 높은 YAP N/C 비율 (2.05 ± 0.32)을 가진 더 낮은 견인및 더 높은 세포 및 핵 퍼짐 영역을 보여줍니다. 동일한 위치에 퍼지고 남아있는 B2B 세포의 경우, 더 낮은 YAP N/C 비율(1.74 ± 0.21)을 가진 더 높은 견인력과 낮은 세포 및 핵 확산 영역을 보여줍니다. 이러한 두 가지 관계는 분산된 분산 된 데이터 그룹(그림 6C,D)에서 보여 지립니다. 문헌에 보고된 바와 같이, 배아 섬유아세포 NIH 3T3 세포와 같은 고정된 정상 세포는 철새 세포34보다 더 높은 견인력을 갖는다. 이 논문에 보고된 데이터는 확산 및 비 마이그레이션 B2B 세포가 B2B 세포를 퍼지고 마이그레이션하는 것보다 더 높은 견인력을 적용했다는 것을 건의하며, 이는 기판에서 안정화하기 위해 비마이그레이션 셀에 높은 견인력이 필요하다는 것을 시사합니다.
또한, 이러한 데이터는 고정된 정상 B2B 세포가 더 높은 페리 핵력을 생성한다는 것을 보여주고, 다른 연구원에 의해 수행된 이전 연구는 고정 된 세포의 주변에서 생성 된 단지 더 높은 세포 견인을보고하는 반면34,35,36,37. 저자는 실험에서 마이그레이션의 본질적인 경향의 차이가 이러한 모순된 결과를 일으킬 수 있다고 생각합니다. 발표된 실험에서, 사각형 모양의 마이크로패터닝은 단일 세포가 확산되는 것을 제한하고 이동을 억제하는 데 사용되었습니다. 세포가 이동하는 경향이 있었는지 여부는 알 수 없습니다. 철새 세포는 종종 셀38의 주변에서 높은 견인력을 나타내기 때문에 마이그레이션하는 경향이있는 세포는 마이그레이션이 제한되어 있어도 여전히 높은 주변 견인력을 유지할 가능성이 높습니다. 이 본 연구에서, 고정 된 세포는 어떤 micropattern에 의해 제한 되지 않습니다 하지만 마이그레이션 하지 않습니다., 세포 그들의 비 마이그레이션 상태를 유지 하는 경향이 나타내는. 또 다른 가능성은 마이크로패턴에 의해 정의된 세포 형상이 초점 접착력 및 견인력39의 분포에 영향을 줄 수 있다는 것입니다. 이 연구의 결과는 어떤 고정 마이크로 패턴없이 생성되고 원래 모양의 고정 된 세포의 힘 분포를 나타냅니다.
저자의 지식의 최고에, 현재까지 단 하나의 간행물은 특히 정상 세포에서 peri-nuclear 힘의 발견을 보고 (마우스 배아 섬유 아 세포), 잠재적으로 핵을 가로 질러 액틴 캡에 의해 발생 40. YAP 세포질-핵 전좌는 페리 핵무력40의 증가와 상관관계가 있다. 관련 문헌에 대한 철저한 수색은 암세포에서 페리 핵력 또는 액틴 캡을 보고하는 출판물을 산출하지 못했습니다. 흑색종 암세포에 대한 간접적인 연구는 액틴 림(핵을 덮지 않고 주변에 위치하지만 핵을 커버하지 않는 또 다른 페리 핵 액틴 조직)이 세포 이동률41을 감소시키고, 간접적으로 페리 핵력의 존재를 시사한다는 것을 입증하였다. 그러나 직접 실험 데이터는 보고되지 않습니다. 이 연구에서, 저자는 PC9와 B2B 세포 모두 peri-nuclear 변위와 견인을 보여줍니다 발견. 페리 핵군 세대의 메커니즘과 그 효과는 여전히 논란의 여지가 있다. 정상 세포에서, 액틴 캡은 핵 형태와 크로마틴 조직(42)을 조절하고, 뉴클레오골격 및 세포골격(LINC) 복합체(LINC)의 링커를 통해 초점 접착으로부터 핵으로 기계적 신호를 전송하고, 세포 마이그레이션444를 조절하는 역할을 하는 것으로 보고되었다. 라빈 A/C는 액틴 캡40,41,42,43,44의 형성과 중단과 관련이 있다. 그러나 액틴 캡이 페리 핵력을 생성한다고 주장한 보고서는 액틴 림40의 잠재적 역할을 고려하지 않았다. 암세포에서 Lamin A의 과발현은 액틴 림의 형성을 용이하게 하고 암세포 이동을 제한합니다. Lamin B의 과발현은 액틴 림 형성을 줄이고 마이그레이션을 촉진합니다. 페리 핵 행위의 존재와 라빈 A의 효과로 인해 이 과정에 페리 핵무력이 관여할 수 있다. 그러나, 이 연구 결과는 측정된 페리 핵군의 증거 또는 액틴 캡의 행동을 보여주지 않았다. 따라서, 본 연구에서 PC9 세포에서 페리 핵군의 발견은 폐암 세포에 있는 peri-nuclear 힘 및 변위를 보여주는 첫번째 보고입니다. 저자는 현재 CRISPR/Cas9 엔지니어링 PC9 및 B2B 세포에 있는 peri-nuclear 힘의 분자 기계장치 그리고 기능을 조사하고 있습니다.
이 논문에서 입증되는 모든 광학 메카노생물학 심문을 넘어, 통합다기능 시스템은 생체 시스템의 다른 필수 생리및 병리학 적 신호를 광학적으로 탐사하기 위해 적용 될 수 있습니다. 예를 들어, 저자의 실험실은 최근 3개의 빛 반응형 멤브레인 단백질을 공동 발현하는 여러 개의 안정적으로 트랜스포송된 인간 암 세포주를 설치했습니다: 멤브레인 전압 표시기 QuasAr2 (흥분: 640 nm; 방출: 660 nm-740 nm), 멤브레인 전압 탈극기 CheRiff (여기: 488 nm), 및 멤브레인 전압 과극제 (nNP3). 이 세 가지 기능성 단백질은 교차토크가 없는 방식으로 스펙트럼 직교 레이저 라인에 의해 활성화될 수 있으며, 멤브레인 전기 생리학의 모든 광학 양방향 신호 통신(readout 및 제어)을 가능하게 합니다. 통합 된 광전자 시스템과 수동 패치 클램프를 사용하여 저자는 단일 인간 암 세포 및 다세포 종양 스페로이드에서 멤브레인 전압 (Vm)의 모든 광학 제어 및 판독을 검증했습니다. 모든 광학 전기 생리학 심문은 암세포에서 이전에 접근할 수 없었던 바이오 전기의 상세한 탐사 가능성을 열어주며, 이는 새로운 축에서 종양 생물학을 발전시키는 데 도움이 될 수 있습니다.
공개
선언할 이해 상충은 없습니다.
감사의 말
이 프로젝트는 UF 건강 암 센터 (X. T. 및 D.S.)와 게토레이 상 스타트업 패키지 (X. T.)의 암 파일럿 어워드에 의해 재정적으로 지원됩니다. 저자는 진심으로 박사와의 지적 토론과 기술 적 지원을 주셔서 감사합니다. 조나단 리히트 (UFHCC), 롤프 렌 박사 (UFHCC), 박사. 이지현 (생물 통계, UF), 박사 휴 팬 (MAE, UF), 박사 워렌 딕슨 (MAE, UF), 박사 가투 수바시 (MAE, UF), 박사 마크 셰락 (MAE & ECE, UF), 박사 Malisa 사렌토란 (매, ECE, UF), 박사 말리사 사렌토란트 (매, 박사. UF), 매튜 트라움 박사(MAE, UF), 데이비드 한 박사(애리조나 대학교), 웨이홍 왕 박사(오라클 코퍼레이션), 유화탄 박사(홍콩 폴리테크닉 대학), 니콘 지원팀(호세 세라노-벨레즈, 래리 코돈, 존 에크만). 저자는 탕의 모든 구성원에서 관대 하고 효과적인 지원에 깊이 감사, Siemann's, 관의 연구 실험실 및 MAE & ECE 및 물리학 및 방사선 종양학 부서의 모든 직원, UF.
자료
| Name | Company | Catalog Number | Comments |
| (3-Aminopropyl)triethoxysilane | Sigma-aldrich | 440140 | |
| 0.05 % Trypsin | Corning | 25-051-CI | |
| 75 cm2 flask | Corning | 430641U | |
| 8 Benchtop Centrifuge | Thermo | 75007210 | |
| A1R confocal system | Nikon | HD25 | |
| Acetic acid | Sigma-aldrich | 695092 | glacial, ACS reagent, ≥99.7% |
| BEAS-2B (B2B) cells | Sigma-aldrich | 95102433 | human epithelial cells from lung tissue |
| Carboxylate-Modified Microspheres | Invitrogen | F8797 | |
| Culture medium (RPMI-1640) | Gibco | 11875093 | |
| Desktop Computer | Dell | 2018 | with Windows 10 operating system |
| Environmental chamber TIZB | Tokai Hit | TIZB | |
| Fetal bovine serum (FBS) | Gibco | 26140 | |
| Fibronectin Human Protein, Plasma | Gibco | 33016015 | |
| Fiji ImageJ | National Institutes of Health and the Laboratory for Optical and Computational Instrumentation | 1.53k | |
| Glass-bottom petri dish | MatTek | P35G-1.5-14-C | |
| HEPES buffered saline | Sigma-aldrich | 51558 | |
| Hydrazine hydrate solution | Sigma-aldrich | 53847 | |
| IntelliJ IDEA | JetBrains | 2020 | Java development platform |
| Java Development Kit | Oracle | 14.0 | |
| Kimwipe | Kimtech Science | 3066-05 | |
| MATLAB | MathWorks | 2020b | |
| Monochrome Camera | FLIR | BFS-U3-70S7M-C | |
| MycoAlert Mycoplasma Detection Kit | Lonza | LT07-218 | |
| N,N′-Methylenebisacrylamide solution | Sigma-aldrich | M1533 | |
| NIS-Elements software platform | Nikon | 4.50 | software platform |
| Origin | OriginLab | OriginPro 2017 (Learning Edition) | data analysis and graphing software |
| Penicillin-streptomycin | Gibco | 15140122 | |
| PC9 cells | Sigma-aldrich | 90071810 | human adenocarcinoma cells from lung tissue |
| Phosphate buffered saline (PBS) | Gibco | 10010023 | |
| Phusion High-Fidelity DNA Polymerase | New England Biolabs | F-553S | high-fidelity DNA polymerase |
| Scotch tape | Scotch | adhesive tape | |
| Sodium dodecyl sulfate solution | Sigma-aldrich | 05030 | |
| Super glue | Gorilla | cyanoacrylate glue | |
| Ti2-E inverted microscope | Nikon | MEA54000 | |
| TI2-S-SE-E Motorized Stage with Encoder | Nikon | MEC56120 | |
| μManager | version 2.0 gamma | open source microscopy software (https://micro-manager.org/) |
참고문헌
- Werley, C., Boccardo, S., Rigamonti, A., Hansson, E., Cohen, A. Multiplexed optical sensors in arrayed islands of cells for multimodal recordings of cellular physiology. Nature Communications. 11 (1), 3881 (2020).
- Yang, B., et al. Epi-illumination SPIM for volumetric imaging with high spatial-temporal resolution. Nature Methods. 16 (6), 501-504 (2019).
- Saraswathibhatla, A., Galles, E. E., Notbohm, J. Spatiotemporal force and motion in collective cell migration. Scientific Data. 7 (1), 197 (2020).
- Saraswathibhatla, A., Henkes, S., Galles, E. E., Sknepnek, R., Notbohm, J. Coordinated tractions control the size of a collectively moving pack in a cell monolayer. Extreme Mechanics Letters. 48, 101438 (2021).
- Wang, W., Kim, C. K., Ting, A. Y. Molecular tools for imaging and recording neuronal activity. Nature Chemical Biology. 15 (2), 101-110 (2019).
- Eliceiri, K. W., et al. Biological imaging software tools. Nature Methods. 9 (7), 697-710 (2012).
- Carpenter, A. E., Kamentsky, L., Eliceiri, K. W. A call for bioimaging software usability. Nature Methods. 9 (7), 666-670 (2012).
- Skylaki, S., Hilsenbeck, O., Schroeder, T. Challenges in long-term imaging and quantification of single-cell dynamics. Nature Biotechnology. 34 (11), 1137-1144 (2016).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Luo, Q., et al. Automatic multi-functional integration program (AMFIP) towards all-optical mechanobiology interrogation. bioRxiv. , (2021).
- Edelstein, A., Amodaj, N., Hoover, K., Vale, R., Stuurman, N. Computer control of microscopes using manager. Current Protocols in Molecular Biology. 92 (1), 14-20 (2010).
- Tulpule, A., et al. Kinase-mediated RAS signaling via membraneless cytoplasmic protein granules. Cell. 184 (10), 2649-2664 (2021).
- Tang, X., Tofangchi, A., Anand, S. V., Saif, T. A. A novel cell traction force microscopy to study multi-cellular system. PLOS Computational Biology. 10 (6), 1003631 (2014).
- Tang, X., et al. Mechanical force affects expression of an in vitro metastasis-like phenotype in HCT-8 cells. Biophysical Journal. 99 (8), 2460-2469 (2010).
- Guimarães, C. F., Gasperini, L., Marques, A. P., Reis, R. L. The stiffness of living tissues and its implications for tissue engineering. Nature Reviews Materials. 5, 351-370 (2020).
- Phelps, E. A., et al. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reaction kinetics and cross-linking for cell encapsulation and in situ delivery. Advanced Materials. 24 (1), 64-70 (2012).
- Bajaj, P., Tang, X., Saif, T. A., Bashir, R. Stiffness of the substrate influences the phenotype of embryonic chicken cardiac myocytes. Journal of Biomedical Materials Research. Part A. 95 (4), 1261-1269 (2010).
- Temples, M. N., Adjei, I. M., Nimocks, P. M., Djeu, J., Sharma, B. Engineered three-dimensional tumor models to study natural killer cell suppression. ACS Biomaterials Science & Engineering. 6 (7), 4179-4199 (2020).
- Feng, S., et al. Improved split fluorescent proteins for endogenous protein labeling. Nature Communications. 8, 370 (2017).
- Guan, J., Liu, H., Shi, X., Feng, S., Huang, B. Tracking multiple genomic elements using correlative CRISPR imaging and sequential DNA FISH. Biophysical Journal. 112 (6), 1077-1084 (2017).
- . Micro-Manager Available from: https://micro-manager.org/wiki/NikonTi2 (2021)
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Martiel, J. L., et al. Measurement of cell traction forces with ImageJ. Methods in Cell Biology. 125, 269-287 (2015).
- Okumurai, I. A. On the generalization of Cerruti's problem in an elastic half-space. Doboku Gakkai Ronbunshu. 1995, 1-10 (1995).
- Piccolo, S., Dupont, S., Cordenonsi, M. The biology of YAP/TAZ: hippo signaling and beyond. Physiological Reviews. 94 (4), 1287-1312 (2014).
- Hong, W. W., Guan, K. L. The YAP and TAZ transcription co-activators: Key downstream effectors of the mammalian Hippo pathway. Seminars in Cell and Developmental Biology. 23 (7), 785-793 (2012).
- Zanconato, F., Cordenonsi, M., Piccolo, S. YAP/TAZ at the roots of cancer. Cancer Cell. 29 (6), 783-803 (2016).
- Wang, Y., et al. Overexpression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer. Cancer Science. 101 (5), 1279-1285 (2010).
- Li, H., et al. Inhibition of YAP suppresses CML cell proliferation and enhances efficacy of imatinib in vitro and in vivo. Journal of Experimental & Clinical Cancer Research. 35 (1), 134 (2016).
- Tang, X., et al. A mechanically-induced colon cancer cell population shows increased metastatic potential. Molecular Cancer. 13, 131 (2014).
- Panciera, T., Azzolin, L., Cordenonsi, M., Piccolo, S. Mechanobiology of YAP and TAZ in physiology and disease. Nature Reviews Molecular Cell Biology. 18 (12), 758-770 (2017).
- Yuan, M., et al. Yes-associated protein (YAP) functions as a tumor suppressor in breast. Cell Death and Differentiation. 15 (11), 1752-1759 (2008).
- Koushki, N., et al. Lamin A redistribution mediated by nuclear deformation determines dynamic localization of YAP. bioRxiv. , (2020).
- Chang, S. S., Rape, A. D., Wong, S. A., Guo, W. H., Wang, Y. L. Migration regulates cellular mechanical states. Molecular Biology of the Cell. 30 (26), 3104-3111 (2019).
- Lee, J., Abdeen, A. A., Tang, X., Saif, T. A., Kilian, K. A. Geometric guidance of integrin mediated traction stress during stem cell differentiation. Biomaterials. 69, 174-183 (2015).
- Lee, J., Abdeen, A., Tang, X., Saif, T. A., Kilian, K. A. Matrix directed adipogenesis and neurogenesis of mesenchymal stem cells derived from adipose tissue and bone marrow. Acta Biomaterialia. 42, 46-55 (2016).
- Tang, X., Bajaj, P., Bashir, R., Saif, T. A. How far cardiac cells can see each other mechanically. Soft Matter. 7 (13), 6151-6158 (2011).
- Dembo, M., Wang, Y. L. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Rape, A., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Shiu, J. Y., Aires, L., Lin, Z., Vogel, V. Nanopillar force measurements reveal actin-cap-mediated YAP mechanotransduction. Nature Cell Biology. 20 (3), 262-271 (2018).
- Fracchia, A., Asraf, T., Salmon-Divon, M., Gerlitz, G. Increased lamin B1 levels promote cell migration by altering perinuclear actin organization. Cells. 9 (10), 2161 (2020).
- Ramdas, N. M., Shivashankar, G. V. Cytoskeletal control of nuclear morphology and chromatin o1rganization. Journal of Molecular Biology. 427 (3), 695-706 (2015).
- Khatau, S. B., et al. A perinuclear actin cap regulates nuclear shape. Proceedings of the National Academy of Sciences of the United States of America. 106 (45), 19017-19022 (2009).
- Kim, D. H., Cho, S., Wirtz, D. Tight coupling between nucleus and cell migration through the perinuclear actin cap. Journal of Cell Science. 127 (11), 2528-2541 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유