Method Article
质量敏感颗粒跟踪,用于表征膜相关的高分子动力学
摘要
该协议描述了一种基于iSCAT的图像处理和单粒子跟踪方法,可以同时研究与脂质膜相互作用的大分子的分子质量和扩散行为。在提供样品制备、质量到对比度转换、电影采集和后处理的分步说明的同时,还提供了相应的说明,以防止潜在的陷阱。
摘要
大分子在脂质膜上以及与脂质膜(发生大量重要生物反应的界面)处的短期或瞬时相互作用本质上难以用标准生物物理方法进行评估。质量敏感粒子跟踪(MSPT)的引入是朝着对此类过程进行彻底定量表征迈出的重要一步。从技术上讲,这是通过基于干涉散射显微镜(iSCAT)的质量光度法(MP)的出现而实现的。当背景去除策略得到优化以揭示膜相关颗粒的二维运动时,该技术可以实时分析生物膜上未标记大分子的扩散和分子质量。在这里,描述了一个详细的协议,用于执行和分析膜相关系统的质量敏感颗粒跟踪。在商用质量光度计上进行的测量可在毫秒范围内实现时间分辨率,并且根据MP系统的不同,质量检测限低至50 kDa。为了展示MSPT在深入分析膜催化的大分子动力学方面的潜力,提出了为示例性蛋白质系统(如天然膜相互作用物膜联蛋白V)获得的结果。
引言
生物膜曾经仅仅被视为抵御各种环境物理条件的屏障,现在被认为是功能实体和催化平台1,2。基于它们定位,放大和引导信号以响应膜相关大分子反应的能力,脂质界面构成了各种细胞过程(如膜运输和信号级联)的关键元件3,4,5。作为稳定复合物组装的成核位点,膜附着通常依赖于膜相关和细胞质形式的大分子之间的动态平衡,因此具有瞬态性质6,7。
尽管它们在生物学中非常重要,但到目前为止,开发能够实时获得膜相关大分子反应的组成,空间和时间异质性的方法一直具有挑战性7,8。为了解决潜在的分子过程,两个实验方面是决定性的:足够的时间分辨率和单颗粒灵敏度。因此,诸如光漂白后荧光恢复(FRAP)以及更灵敏的荧光相关光谱(FCS)等集成平均技术确实存在局限性,因为它们在很大程度上将空间信息与时间信息分离9。因此,表征单个分子动力学的一个重要步骤是单粒子跟踪(SPT)与高灵敏度显微镜相结合的出现。特别是,在这方面,有两种防范小组委员会办法证明是有效的。首先,利用荧光团作为标记和相应的荧光检测系统为纳米精度和毫秒时间分辨率10,11,12铺平了道路。其次,使用金纳米颗粒进行基于散射的检测将定位精度和时间分辨率分别提高到亚纳米和微秒范围内,分别为13,14,15,16。尽管这两种方法的许多优点以及它们对膜相关系统的机械理解的重大贡献17,18,但到目前为止,这两种技术都受到限制:它们需要标记感兴趣的分子,这可能扰乱它们的天然行为并且对膜相关颗粒的分子组成不敏感19,20。
最近,通过引入一种基于干涉散射(iSCAT)的新型方法克服了这两个限制,该方法称为质量光度法(MP)21,22,23。该技术允许在落地到玻璃界面时根据其iSCAT对比度确定生物分子的溶液内质量分布。然而,为了检测和表征在脂质膜上扩散的移动分子,必须开发一种更复杂的图像分析方法。这同时已经成功地实现,并允许检测,跟踪和确定在脂质界面24,25上扩散的单个未标记生物分子的分子质量。该技术被称为动态质量光度法或质量敏感粒子跟踪(MSPT),现在可以通过直接记录跟踪实体的分子质量的变化来评估复杂的大分子相互作用,从而为膜相关分子动力学的机理分析开辟了新的可能性。
在这里,介绍了MSPT所需的样品制备,成像和数据分析管道的详细方案。特别是,讨论了样品要求以及在测量和分析过程中可能发生的潜在问题。此外,通过各种代表性结果展示了分析膜相互作用高分子系统的无与伦比的潜力。
研究方案
1. 样品制备
- 多层囊泡 (MLV) 的生成
- 根据所需的脂质混合物和所需的悬浮液体积计算氯仿溶解脂质的量。
注意:建议将最终囊泡浓度为4 mg / mL脂质用于重悬(反应)缓冲液。 - 使用配备玻璃吸头的容积式移液器将计算体积的脂质移液到1.5 mL玻璃瓶中。
- 在微弱的氮气流下蒸发脂质溶剂,并不断旋转小瓶以确保脂质在玻璃壁上的均匀分布。
- 通过将小瓶置于稳定的氮气流下15分钟,确保完全溶剂蒸发。
- 通过在真空干燥器中真空干燥一小时,去除残留的氯仿痕迹。
- 在所需的重悬(反应)缓冲液中重新水合脂质混合物,并彻底涡旋悬浮液,直到脂质膜从小瓶壁溶解。
注意:反应缓冲液应确保蛋白质活性和稳定性。本研究中使用的反应缓冲液含有50 mM Tris-HCl(pH = 7.5),150 mM KCl和5 mM MgCl2。请注意,任何用于稀释脂质或蛋白质的缓冲液都需要过滤以除去干扰颗粒杂质(参见步骤5)。
- 根据所需的脂质混合物和所需的悬浮液体积计算氯仿溶解脂质的量。
- 小单层囊泡(SUV)的产生
- 对于脂质重悬的连续冻融循环(步骤1.1.6),在热板上(70°C至99°C之间)的烧杯中煮沸500mL水,并制备液氮容器。
- 冲击冻结脂质在液氮中的重悬。将小瓶用热水转移到烧杯中,直到溶液完全解冻。重复此冻融循环8-10次或直到先前浑浊的混合物看起来清澈。
注意:使用适当的安全服和设备,如护目镜、手套和镊子,以防止与液氮、冷冻脂质瓶或沸水直接接触。 - 为了产生单分散囊泡分布,组装脂质挤出机并用反应缓冲液测试其完整性,以确保它不会泄漏。
注意:如果观察到泄漏,请小心地重新组装脂质挤出机,直到没有明显的缓冲液溢出。 - 挤出脂质悬浮液37通过孔径为50nm26的核孔膜。通过次数应该是不均匀的,以确保最终的SUV混合物穿过核孔膜,因此没有脂质聚集体或多层囊泡。挤出的囊泡稍后将用于形成受支撑的脂质双层(参见步骤6和7)。
注意:SUV同样可以通过再水合脂质混合物的超声处理形成。然而, 通过 挤出制备提供了SUV的单分散分布,这有利于在支持的脂质双层形成过程中囊泡破裂。挤出的囊泡可以在冰箱中储存最多3天。
2. 显微镜载玻片的清洁
- 在聚四氟乙烯(PTFE)显微镜支架中分配等量的显微镜载玻片(编号#1.5;厚度0.17 mm),尺寸为24 mm x 60 mm和24 mm x 24 mm。
- 将PTFE支架转移到含有超纯水的烧杯中,并在室温下超声处理15分钟。
注意:根据烧杯的不同,需要调整水量以完全覆盖PTFE支架。 - 使用镊子从烧杯中取出支架,并用超纯异丙醇代替水。将支架插入含有异丙醇的烧杯中,并再次超声处理15分钟。
注意:根据烧杯的不同,需要调整异丙醇的体积以完全覆盖PTFE支架。 - 用超纯水代替异丙醇,并将含有支架的烧杯超声处理15分钟。
- 从烧杯中取出PTFE支架,并在稳定的氮气或压缩空气流下将支架中的显微镜载玻片吹干。
注意:使用手套、清洁烧杯和石蜡膜覆盖每个烧杯,确保正确清洁盖玻片。否则,在MSPT测量期间,残留的灰尘可能会导致明显的背景波动。
3. 显微镜载玻片的亲水
注意:为了获得均匀且流体支撑的脂质双分子层,载玻片的亲水性处理是必不可少的,必须在流动室组装之前进行。
- 将仅含有24 mm x 60 mm显微镜载玻片的PTFE支架放置在以氧气作为工艺气体的等离子体清洁器中,并用等离子体清洁显微镜载玻片(本工作中使用的参数:30%功率,0.3 mbar氧气压力30秒;有关所用等离子体清洁器的详细信息,请参见 材料表 )。
注意:要获得流体膜,必须为每个仪器调整等离子体清洗参数,如功率、氧气压力和清洗时间。为此,建议使用荧光标记的脂质以确保膜的流动性,其可以通过光漂白(FRAP)实验后的荧光回收来量化27。如果未针对相应设置优化参数,则膜扩散可能会由于膜流动性降低而受损。
4. 流动室的组装
- 在装配流动室之前,请准备好以下组件:清洁的显微镜载玻片(24 mm x 24 mm),亲水显微镜载玻片(24 mm x 60 mm),铝箔,平板纸板,手术刀和双面胶带。
- 用铝箔包裹扁平纸板。
- 将清洁的24 mm x 24 mm显微镜载玻片铺在铝箔上,彼此之间保持足够的距离。
- 将双面胶带连接到载玻片的上边缘和下边缘。
- 用手术刀切除每个显微镜载玻片,使其可以从铝箔上取下。因此,每张载玻片的上边缘和下边缘应有双面胶带条纹(请参阅 图 1)。
- 将带有两条双面胶带条的24 mm x 24 mm载玻片连接到水亲24 mm x 60 mm载玻片上,以在较小和较大的显微镜载玻片之间形成流路。
注:为确保流动室清洁,请始终佩戴手套并确保工作台无尘。
5. 反应缓冲液的过滤
- 无菌过滤所有反应缓冲液,通过0.45μm醋酸纤维素膜,以确保MSPT测量期间的背景信号最小。
注意:如果核苷酸(如ATP)的存在对于成功的实验至关重要,请注意背景信号的潜在增加。建议仅使用仍然确保蛋白质活性的最小量。
6. 支持脂质双层 (SLB) 形成
注意:建议在质量光度计上执行支撑脂质双层的形成,以直观地确保成功的囊泡扩散和未融合的囊泡的完全去除。
- 在所需的反应缓冲液中将新鲜挤出的SUV(参见步骤1了解更多详情)稀释至最终浓度为0.4mg / mL。任选地,为了促进囊泡破裂,向囊泡悬浮液中加入2mM CaCl 2。
注意:二价阳离子可能导致某些脂质的聚集,例如PiP2。对于含有这种脂质的混合物,避免使用CaCl2 促进重悬缓冲液中的囊泡破裂或其他二价阳离子。如果实验需要,可以在成功形成负载脂质双分子层后添加二价阳离子。 - 将50μL囊泡悬浮液冲洗到流动室(步骤4)中,并在室中孵育2分钟。
注意:缓冲液,囊泡或蛋白质溶液可以通过一小块浸泡组织的流动室冲洗。但是,也可以使用机械泵系统。 - 每次用200μL反应缓冲液重复(至少三次)洗涤流动室以除去未熔融的囊泡。
注意:囊泡需要彻底冲洗出流动室,以确保在MSPT测量期间获得稳定的背景信号。
7. 生成校准曲线
注意:为了将检测到的颗粒的对比度转换为分子质量,需要使用已知大小的蛋白质来校准其信号。建议调整标准蛋白质大小方案,以覆盖目标系统预期的分子质量范围。
- 标准蛋白质与半胱氨酸残基的生物素化
- 根据制造商的说明计算标准蛋白质的适当量的马来酰亚胺生物素。
- 将标准蛋白与确定体积的马来酰亚胺生物素在室温下孵育1小时。
- 为了从偶联生物素 - 蛋白质复合物中除去未结合的马来酰亚胺 - 生物素,请在适合于目标蛋白质的色谱柱上进行尺寸排阻色谱。
- 使用布拉德福德测定法测定蛋白质浓度。
注意:为了储存标准蛋白质以进行进一步测量,请将蛋白质在液氮中的一次性等分试样中冷冻,并将其储存在-80°C。
- 测量校准曲线的标准蛋白
- 在流动室中,用含有0.01 mol%(v / v) 生物素基帽PE(1,2-二油酰基-sn-甘油-3-磷酸乙醇胺-N-cap生物素基)的0.4mg / mL挤出SUV(参见步骤1和6)制备负载的脂质双层。
- 在流动室中加入50μL2.5nM二价链霉亲和素到双层中并孵育10分钟。
注意:二价链霉亲和素已被表达和纯化,如Howarth等人28所述。四价链霉亲和素同样可以使用。然而,使用二价链霉亲和素可以减少生物素化脂质与与生物素部分偶联的标准蛋白质之间可能的反应化学计量,以促进物种的分配。 - 用100μL反应缓冲液除去未结合的二价链霉亲和素。
- 向流动室中的双层中加入50μL100nM生物素偶联的标准蛋白并孵育2分钟。
注意:根据生物素化效率以及是否使用二价或四价链霉亲和素,生物素偶联标准蛋白和链霉亲和素的最佳浓度可能会有所不同。 - 根据步骤 8 中概述的详细信息执行 MSPT 测量。
注意:样品和校准标准的成像条件必须相同。
8. 成像
- 负载均衡的形成和样品制备
- 如步骤6中更详细地描述的那样,将所需脂质混合物(25μL)的SUV引入样品流动室并形成负载的脂质双层。用100μL反应缓冲液彻底洗涤腔室(三次),以除去所有未熔融的囊泡。
- 向样品室中加入50μL目标蛋白质。
注意:由于MSPT是一种单颗粒方法,蛋白质浓度必须保持在pM至nM范围内,以便不受干扰的颗粒检测和跟踪。
- 视频采集
- 在采集软件中设置所需的成像条件,例如视场大小(FOV)、帧速率、曝光时间和采集时间。
注意:以下设置已被证明适用于商用质量光度计上的MSPT(参见 材料表):FOV为128像素x 35像素,帧速率为1 kHz,在随后的5倍帧平均后,大约每秒200帧,曝光时间为0.95毫秒。 - 自动或手动调整对焦。如有必要,使用横向控制将FOV移动到具有均匀膜的位置。
- 创建项目文件夹并开始录制影片。录制完成后,在采集软件提示的对话框中指定文件名。然后,影片将作为 MP 文件自动保存到项目文件夹中,以供后续分析。
注意:在不同的流动室中记录至少三个重复,以确保单个膜的完整性和结果的可重复性。电影持续时间可以提前设置,具体取决于实验类型。在大多数情况下,建议采集时间在5分钟到7分钟之间。
注意:默认情况下,商用质量光度计采集软件上的动画记录在保存之前会进行压缩,以减少存储空间。但是,需要关闭文件压缩才能启用自定义数据分析,如此协议中所述。有关如何关闭文件压缩的详细信息,请参阅制造商的用户手册。
- 在采集软件中设置所需的成像条件,例如视场大小(FOV)、帧速率、曝光时间和采集时间。
9. 数据分析
注意:数据分析管道附带两个交互式Jupyter笔记本(MSPT analysis.ipynb,Movie visualization.ipynb)。Jupyter笔记本和相关的自定义编写的Python模块是执行下面概述的MSPT分析所必需的,可以在公共存储库中找到:https://github.com/MSPT-toolkit/MSPT-toolkit。有关以下分析的详细说明,请参阅使用上述链接访问的MSPT analysis.ipynb 。
- 视频处理
- 使用 image_processing.mp_reader 函数的像素级背景估计算法消除光的主要静态散射。
- 要应用背景删除,请选择参数模式continuous_median选项,并为笔记本分区 B.1 中的滑动中位数窗口 (window_length) 设置适当的长度。(可选)在背景删除后保存影片,以用于粒子检测和轨迹链接(通过将参数 save_processed_movies 设置为 True)。
注意:根据膜上的颗粒密度、预期扩散系数、采集帧速率和所需的处理速度,将窗口大小 (window_length) 调整为 101 和 2001 之间的值。
注意:如果膜不是太密集,并且颗粒的扩散足够快(即,每个像素大部分时间都没有被颗粒占据),则背景去除策略效果很好。否则,粒子的对比度将被系统地低估,因为它们无法与背景信号正确区分。这可以通过以计算速度为代价增加中位数窗口大小来补偿。但是,请注意,由于样本漂移,将窗口大小设置得太大可能会对输出产生负面影响。对处理后的视频进行目视检查至关重要。
- 要应用背景删除,请选择参数模式continuous_median选项,并为笔记本分区 B.1 中的滑动中位数窗口 (window_length) 设置适当的长度。(可选)在背景删除后保存影片,以用于粒子检测和轨迹链接(通过将参数 save_processed_movies 设置为 True)。
- 使用 particle_fitting.particle_fitter函数检测粒子及其在整部电影中各自的位置(参见笔记本B.2部分)。
- 使用阈值参数(脱粒;请参阅笔记本 B.1 部分)调整粒子检测的灵敏度,该参数用于通过图像二值化突出显示候选点。变化阈值参数对现场检测灵敏度的影响可以在单独的笔记本(Movie visualization.ipynb)中进行检查。粒子检测的结果会自动保存到影片文件子目录中的 CSV 文件中。
注意:不建议将阈值参数任意设置为低(例如,对于使用过的质量光度计拍摄的电影,不建议将阈值参数设置为低于0.0005),因为候选点将以杂散噪声为主,从而延长处理时间。
- 使用阈值参数(脱粒;请参阅笔记本 B.1 部分)调整粒子检测的灵敏度,该参数用于通过图像二值化突出显示候选点。变化阈值参数对现场检测灵敏度的影响可以在单独的笔记本(Movie visualization.ipynb)中进行检查。粒子检测的结果会自动保存到影片文件子目录中的 CSV 文件中。
- 使用 image_processing.mp_reader 函数的像素级背景估计算法消除光的主要静态散射。
- 使用Python包 trackpy(v.0.5.0)将连续帧中的粒子链接到轨迹中29。
注意:轨迹链接在点检测后动态执行。因此,包含轨迹信息的附加 CSV 文件存储在粒子检测 CSV 文件的子目录中。- 使用参数 minimum_trajectory_length (参见笔记本 B.1 部分)删除点太少的轨迹,以便可靠地确定扩散系数。有关 trackpy 函数的其他参数的详细说明,请参阅 trackpy 的文档。
- 轨迹分析
- 在笔记本分区 C.1 中,指定用于影片采集的帧速率(frame_rate)和像素大小(以 nm 为单位pixel_size)。使用trajectory_analysis.get_csv_files函数(笔记本部分C.2)创建包含trackpy返回的轨迹信息的CSV文件列表(请参阅步骤9.2)。
- 此外,指定 HDF5 容器的输出文件名,该文件名用于将拟合结果存储在磁盘上(笔记本部分 C.3)。使用笔记本 C.4 部分中的 trajectory_analysis.fit_trajectories 函数分析所有轨迹,该函数循环访问 CSV 文件列表。此函数使用跳跃距离分布 (JDD)30 和均方位移 (MSD)31 分析来估计每个轨迹的扩散系数。
- 通过使用从MSPT校准中获得的对比度-质量关系,将每个轨迹的中位数对比度转换为其相应的质量(见第7节)。指定校准线的斜率(斜率)和 y 截距(偏移),这将 iSCAT 对比度与分子质量相关联(函数 trajectory_analysis.apply_calibration;请参阅笔记本第 C.5 节)。此函数将轨迹中位数质量的列添加到每个数据帧。
- 使用函数 trajectory_analysis.membrane_density 评估膜上的表观粒子密度,该函数根据检测到的粒子返回中值,并将每帧期间的轨迹作为数据框中的附加列呈现(参见笔记本第 C.6 节)。
注意:由于在检测和轨迹链接过程中都会丢失一部分颗粒,因此实际的颗粒密度可能会更高。为了获得有关粒子密度和质量直方图的可靠结果,请目视检查具有代表性的电影快照,以验证测量条件是否适用于单粒子跟踪(请参阅步骤9.1.1)。
10. 数据可视化
- 说明质量和扩散系数与二维核密度估计(KDE)的相关性,二维核密度估计(KDE)基于Python包 fastkde(v.1.0.19; https://pypi.org/project/fastkde/)。
- 要生成绘图,请指定包含 MSPT 结果的 HDF5 文件(请参阅步骤 9.3.2 和笔记本部分 D.1),并选择单个(笔记本部分 D.2)或串联数据框(笔记本部分 D.3)作为 plotting.generate_2D_KDE 功能的输入数据(笔记本部分 D.4)。
注意:理想情况下,每个绘制的数据集应包含超过1,000个轨迹,以获得可靠的2D-KDE。
结果
按照本文中用于在流动室中制备受支持脂质双层(SLB)的详细方案(图1),可以在所有显示条件的本机视图中清楚地识别斑点状图案(图2)。这种效应是由玻璃的表面粗糙度引起的,其通常主导散射信号并导致视觉上无法区分的条件(玻璃,具有SLB的玻璃或具有SLB和附着蛋白质的玻璃)。然而,由于囊泡的大散射横截面,囊泡的存在是明显不同的,并且能够观察到囊泡破裂和融合成均匀的膜(图2B 和 补充电影1)。当使用比例法去除玻璃表面的静态散射信号时,强调视场24,25内的动态元素,可以发现未标记的蛋白质扩散在膜上(图2D),而空的SLB(图2C)或玻璃本身(图2A)显示为噪声图像。
MSPT测量的固有背景可以通过将每个像素值除以电影在相同图像位置的前后 n个 像素的中位数来局部估计(图3)。结果,大分子表现为各向同性点扩散函数(PSF),其在膜上的运动可以被观察,跟踪和量化。事实上,对比和动态行为的可用性使颗粒的分子大小与其各自的扩散行为直接相关,所有这些都不需要标记颗粒。然而,为了解释在MSPT实验期间确定的iSCAT对比度,必须进行校准,将信号幅度转换为分子量。这可以通过 生物 素 - 链霉亲和素 - 生物素复合物将已知质量的生物分子附着到SLB上来实现(图4A)。作为一种示例性策略,可以使用牛血清白蛋白(BSA),蛋白A(prA),碱性磷酸酶(AP)和纤连蛋白(FN)的生物素化变体,其与链霉亲和素(STP)结合,链霉亲和素本身与膜中含生物素的脂质(生物素酰帽PE)结合。如图 4A所示,这些示例性大分子的日益明显的对比度反映了各个生物素化标准品分子量的增加。通过将造影剂直方图的每个峰(图4B)分配给标准蛋白的低聚物状态的相应质量,揭示了造影剂和质量之间的线性关系21,22 ,随后可用于分析未知的大分子系统(图4C)。
一个很好的例子证明了MSPT在分析分子量并因此研究低聚物状态和寡聚化事件的适用性和能力方面,是考虑生物素化醛缩酶和生物素化IgG(图5)。醛缩酶通常被报道为同源四聚体32。然而,MSPT解决的质量分布具有四个不同的峰,这突出了多个种群的存在(图5A)。虽然第一个次要峰对应于未占据的链霉亲和素,并且由于这种实验中的构型而可以预期,但同样可以检测到仅具有两个亚基(2SU)或六个亚基(6SU)的醛缩酶复合物(图5B)。有趣的是,与单独使用二聚体醛缩醛酶和链霉亲和素相比,四聚体和六聚体醛缩酶 - 链霉亲和素复合物显示出降低的扩散系数,表明粘性阻力增加,例如, 通过 第二个生物素化脂质连接到链霉亲和素。类似地,生物素化的IgG在质量分布中表现出三个峰,第一个峰再次与单个链霉亲和素的质量相匹配。最丰富的峰的质量对应于一个轻链和一个重链(1SU)的质量,即IgG抗体的一半。在约11%的病例中检测到具有两半相同(2SU)的完整抗体。随着复杂尺寸的增加,扩散系数的降低表明链霉亲和素与一种以上的生物素化脂质的相互作用或由附着的IgG引起的额外阻力,或两者兼而有之。
除了对膜依赖性低聚物状态的唯一分析外,MSPT还具有将目标大分子的扩散行为与其低聚物状态相关联的特殊优势。这种类型的分析的代表性结果显示了膜联蛋白V(AnV)和霍乱毒素亚基B(CTxB),它们分别与膜中的二油酰磷脂酰丝氨酸(DOPS)或鞘糖脂(GM1)结合(图6A)。两种核密度估计(KDE)均具有质量和扩散的单峰分布特征,表明具有相似扩散行为的单一丰富物种。结果表明,对于AnV,分子质量和扩散系数的峰位分别为49.8±2.2 kDa和1.4±0.1 μm 2/s,CTxB的峰值位置分别为62.7±3.1 kDa和0.4±0.1 μm2/s。测量的扩散系数与先前报告的从高速AFM和FRAP33,34获得的值相当。与预期大分子的质量(AnV三聚体为52 kDa,CTxB五聚体为65 kDa)相比,质量略有降低,这可能表明集合中存在具有较少亚基的较小复合物。虽然蛋白质之间的质量差很小,接近显微镜的指定检测限(≈50 kDa),但它们的扩散系数差异很大。例如,在等摩尔混合物中,通过将混合物的扩散与AnV和CTxB的分布进行比较,可以得出结论,AnV在膜上比CTxB更丰富(图6B)。然而,如果与AnV的浓度相比,CTxB的浓度加倍,则平衡会向CTxB转移,作为膜上的主要蛋白质。如AnV和CTxB混合物所示,MSPT不仅允许根据其分子量区分膜相关大分子,而且还能够根据其扩散行为区分不同的大分子群体。
与所有显微镜技术一样,为了实现所需的数据质量,一些实验要求至关重要。在这种情况下,一个重要的例子是彻底清洁的盖玻片。一般来说,这被认为是显微镜相关单分子实验的先决条件,但MSPT对样品杂质特别敏感。来自未清洁盖玻片玻璃表面的散射增加,阻止了任何定量的iSCAT测量。值得注意的是,即使清洁不充分的玻璃上残留的污垢或灰尘颗粒也会导致明显的图像失真,在原生成像模式下可识别为亮点(图7A)。虽然这些缺陷由于其静态性质而被背景估计消除,但颗粒对比度的准确测定可能会受到损害,从而对其定量分析产生负面影响。MSPT实验中遇到的另一个常见问题是剩余的囊泡要么漂浮(以橙色包围)穿过视野,要么未融合的囊泡卡在膜上的特定位置(以蓝色包围)并显示为大的脉动散射体(图7B)。为了尽量减少它们的发生和对电影采集的干扰,建议在添加蛋白质之前彻底清洗SLB,并使用新鲜制备的小单层囊泡(SUV)和二价阳离子的混合物。
在设计质量敏感颗粒跟踪实验时必须考虑的一个因素是与膜界面相关的大分子的密度。膜上的高颗粒密度实际上会导致问题,原因有两个:i)从连续帧到轨迹的粒子检测链接变得模糊,从而增加了错误和错误判断扩散系数的可能性。ii)从其相应PSF拟合的幅度中提取的粒子质量被系统地低估并且质量峰值变宽,因为静态背景信号与动态粒子信号的分离越来越困难(图7C)。目前,在现有的商用显微镜上,在采集MSPT视频的过程中很难对数据质量进行视觉评估,因为在采集软件中实现的比例视图使用的是为质量光度测定21 建立的背景去除,而不是这里和参考文献24,25 中描述的基于中位数的算法(图7D).用于在质量光度测量中可视化着陆分子的基于平均值的连续背景去除导致扩散粒子显示为具有明亮尾部的暗锋,这使得斑点看起来高度各向异性,并在检测过程中干扰PSF拟合。因此,在采集软件中使用实现的基于平均值的图像处理不适用于分析膜上的扩散生物分子。
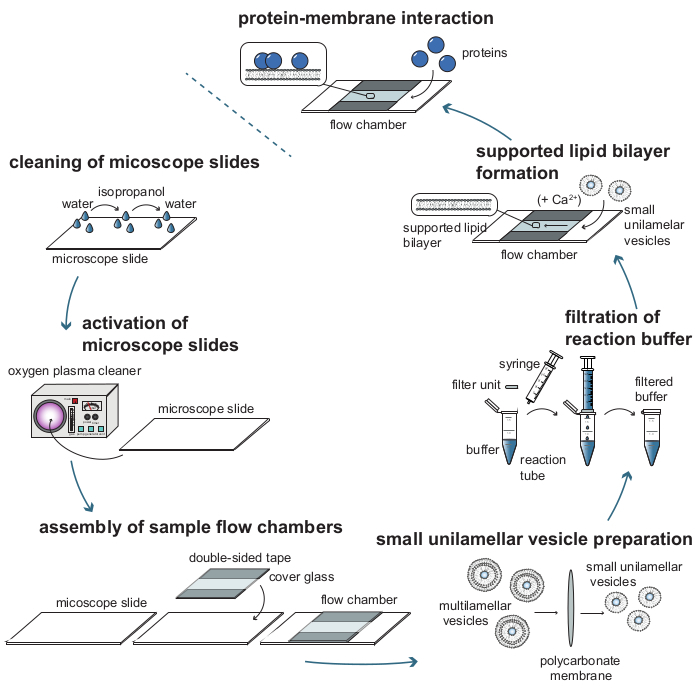
图 1:使用质量敏感颗粒跟踪 (MSPT) 分析蛋白质-膜相互作用所需的各个步骤的工艺流程图。 为了制备用于MSPT测量的样品,必须彻底清洁玻璃盖玻片并用氧等离子体激活。在组装到样品流动室后,准备小单层囊泡(SUV)以形成负载脂质双层(SLB),并过滤所有反应缓冲液以减少背景散射。添加SUV以在流动室中形成脂质双层。任选地,可以将二价阳离子(例如Ca2 + 离子)添加到SUV中以促进囊泡破裂。最后,将低浓度的目标蛋白质冲入反应室。 请点击此处查看此图的大图。
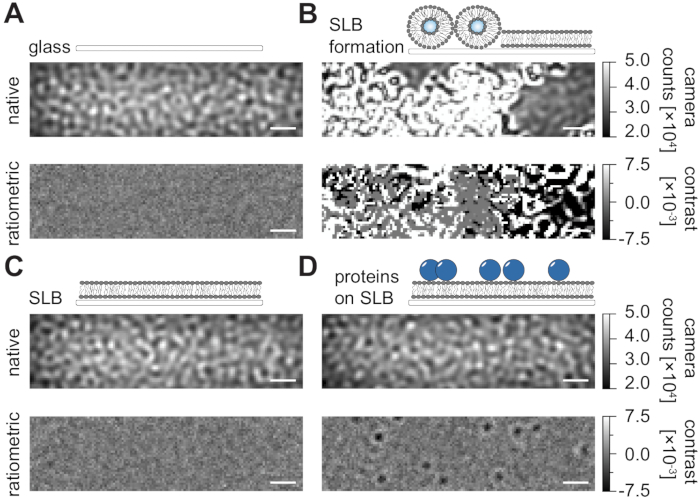
图 2:与 MSPT 测量相关的示例性表面的原生和比例视图。在形成支撑脂质双层(B),在形成完整的支撑脂质双层(C)和在SLB上重建的示例性蛋白质期间,玻璃盖玻片(A)的表面粗糙度的代表性图像。所有四个示例都以原生模式显示,可以在测量期间访问,也可以在基于中位数的背景删除后作为处理的比例图像显示。比例尺表示 1 μm。对于数据分析(参见随附的Jupyter笔记本;步骤9),使用以下参数:中位数窗口大小(window_length)= 1001。请点击此处查看此图的大图。
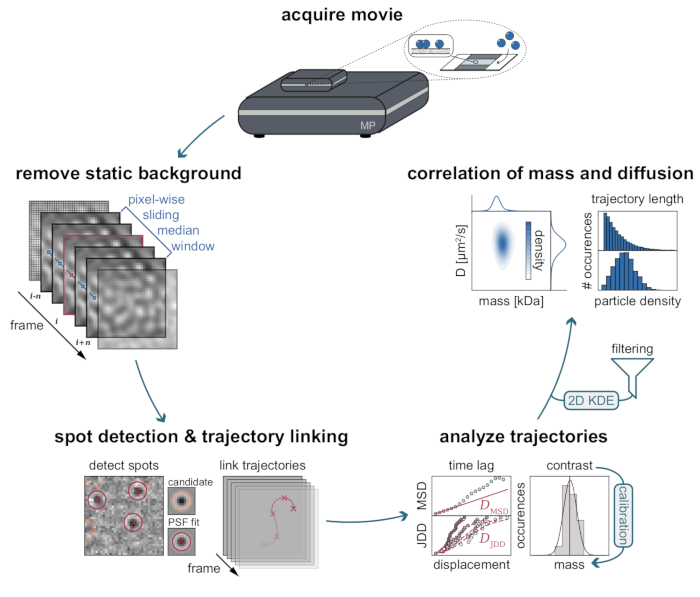
图3:MSPT数据收集和分析所需阶段的分步图。 在质量光度计上对感兴趣的样品进行数据采集后,通过逐像素滑动中位数方法处理短片以去除静态背景。此后,候选粒子在链接到粒子轨迹之前,由点扩散函数(PSF)进行识别和拟合。为了能够确定每个粒子的扩散系数,采用均方位移(MSD)或跳跃距离分布(JDD)分析。在此阶段,根据通过校准策略确定的对比度 - 质量 - 关系,可以将对比度值转换为分子质量。作为最后一步,轨迹可以根据它们的长度或膜颗粒密度进行过滤,并通过二维核密度估计(2D-KDE)进行可视化。 请点击此处查看此图的大图。
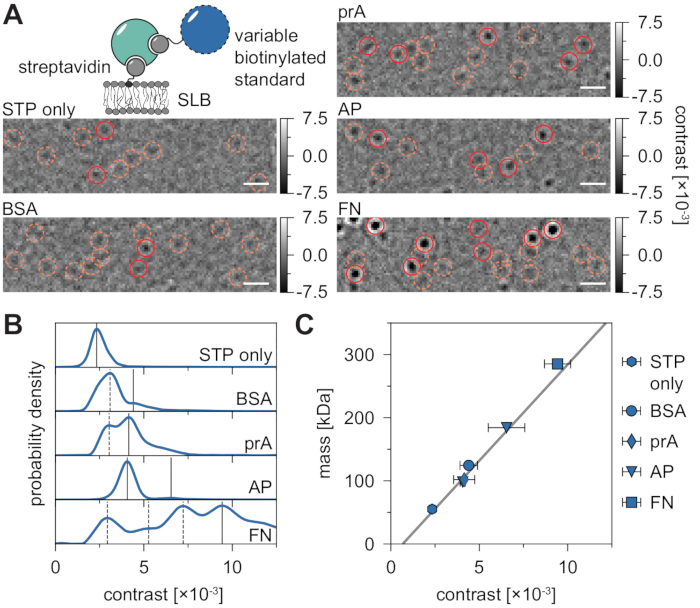
(A)为示例性链霉亲和素 - 标准蛋白质复合物在含有少量生物素化脂质的负载脂质双层上扩散而获得的代表性比例框架(DOPC:DOPG:Biotinyl Cap PE比为70:29.99:0.01 mol%)。作为模型分子量标准,显示单价链霉亲和素28(仅STP)或二价链霉亲和素28与生物素化牛血清白蛋白(BSA),生物素化蛋白A(prA),生物素化碱性磷酸酶(AP)或生物素化纤连蛋白(FN)复合物。候选点以橙色(虚线圆圈)突出显示,成功的粒子检测以红色(实心圆圈)突出显示。比例尺表示 1 μm.(B) 为五个模型标准蛋白获得的对比度值的概率密度分布。所有显示的数据表示每个条件三个独立实验的合并分布:STP仅n = 82,719;BSA n = 9,034;prA n = 22,204;AP n = 69,065,FN n = 71,759 轨迹。与为含有蛋白质的膜确定的颗粒数相比,在中等膜密度下在空双层上检测到的颗粒数可以忽略不计(补充图1)。考虑用于质量校准的对比度峰通过连续线标记,而虚线表示未考虑的低聚物状态。(C)从图D中的峰值对比度和配合物的相应序列质量得出的对比度质量校准曲线。误差线显示通过自举估计的峰值位置的标准误差(100 次重采样,每次重采样 1,000 条轨迹)。对于数据分析(参见Jupyter笔记本;步骤9),使用以下参数:中值窗口大小(window_length)= 1,001帧,检测阈值(thresh)= 0.00055,搜索范围(dmax)= 4像素,内存(max_frames_to_vanish)= 0帧,最小轨迹长度(minimum_trajectory_length)= 7帧(仅STP),9帧(BSA / FN),15帧(prA),10帧(AP)。请点击此处查看此图的大图。
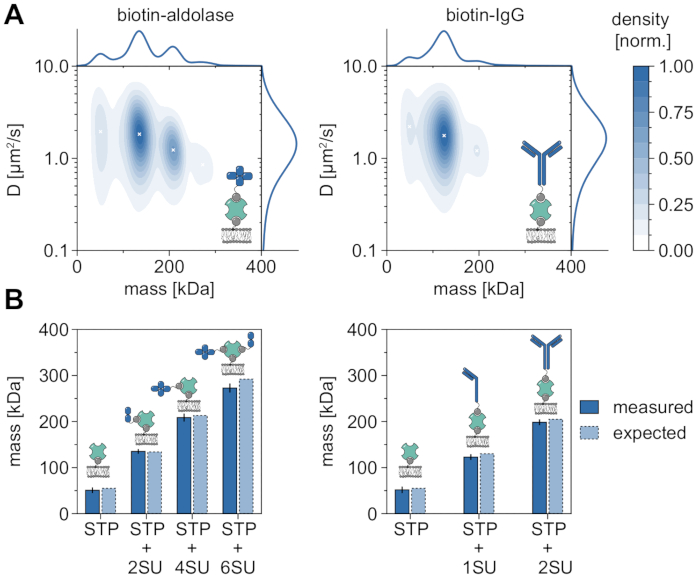
图5:破译膜相关蛋白质的低聚物状态。(A)四价链霉亲和素与生物素化醛缩酶复合物(左图)或生物素修饰的山羊抗兔IgG抗体(右图)的复合物的质量和扩散系数的2D核密度估计。两种复合物的重构均在含有DOPC,DOPG和生物素帽PE的负载脂质双层上分别以70:29.99:0.01 mol%的比例进行。总共,链霉亲和素-醛缩酶复合物(颗粒密度为0.1μm-2)和链霉亲和素-IgG复合物(颗粒密度为0.1μm-2)的348,405个独立重复的轨迹被包括在内。仅包含轨道长度至少为五帧的粒子。给出了分子质量(上图)和扩散系数(右图)的边际概率分布。两个面板中的黑色 x 标记了 KDE 各自的局部最大值。(B)根据序列质量,将四价链霉亲和素与生物素修饰醛缩酶(左图)或生物素化IgG(右图)的复合物的确定低聚物质量与预期分子量进行比较。缩写SU代表利益亚基的蛋白质引入。误差线显示通过自举估计的峰值位置的标准误差(100 次重采样,每次重采样 1,000 条轨迹)。对于数据分析(参见随附的Jupyter笔记本;步骤9),使用以下参数:中位数窗口大小(window_length)= 1,001帧,检测阈值(thresh)= 0.00055,搜索范围(dmax)= 4像素,内存(max_frames_to_vanish)= 0帧,最小轨迹长度(minimum_trajectory_length)= 5。请点击此处查看此图的大图。
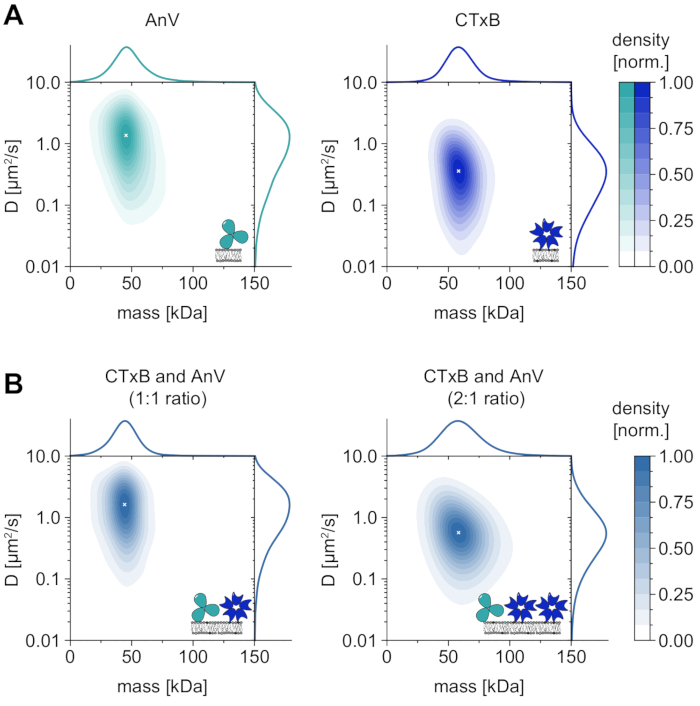
图6:溶解天然膜相互作用蛋白膜联蛋白V(AnV)和霍乱毒素亚基B(CTxB)的扩散行为。(A)膜联蛋白V的质量和扩散系数的2D核密度估计(左图)和霍乱毒素亚基B(右图)。对于AnV和CTxB膜的重构,分别使用80∶20 mol%DOPC至DOPS和99.99∶0.01 mol%DOPC至GM1的脂质组合物。AnV(颗粒密度为0.1μm-2)总共包括了206,819个三个独立重复轨迹,CTxB(颗粒密度为0.2μm-2)的142,895个轨迹。(B)CTxB和AnV混合物的二维核密度估计分别为1:1(左图)或2:1(右图)。在含有DOPC,DOPS和GM1脂质的负载脂质双层上以80:19.99:0.01 mol%的比例进行蛋白质混合物的重组。对于1:1混合物(颗粒密度为0.1μm-2)总共包括了42,696个轨迹和2:1比例(颗粒密度为0.3μm-2)的264,561个轨迹。对于(A)和(B),仅包含轨道长度至少为五帧的粒子。给出了分子质量(上图)和扩散系数(右图)的边际概率分布。每个面板中的白色 x 标记 KDE 的相应全局最大值。对于数据分析(参见随附的Jupyter笔记本;步骤9),使用以下参数:中位数窗口大小(window_length)= 1,001帧,检测阈值(thresh)= 0.00055,搜索范围(dmax)= 4像素,内存(max_frames_to_vanish)= 0帧,最小轨迹长度(minimum_trajectory_length)= 5。请点击此处查看此图的大图。
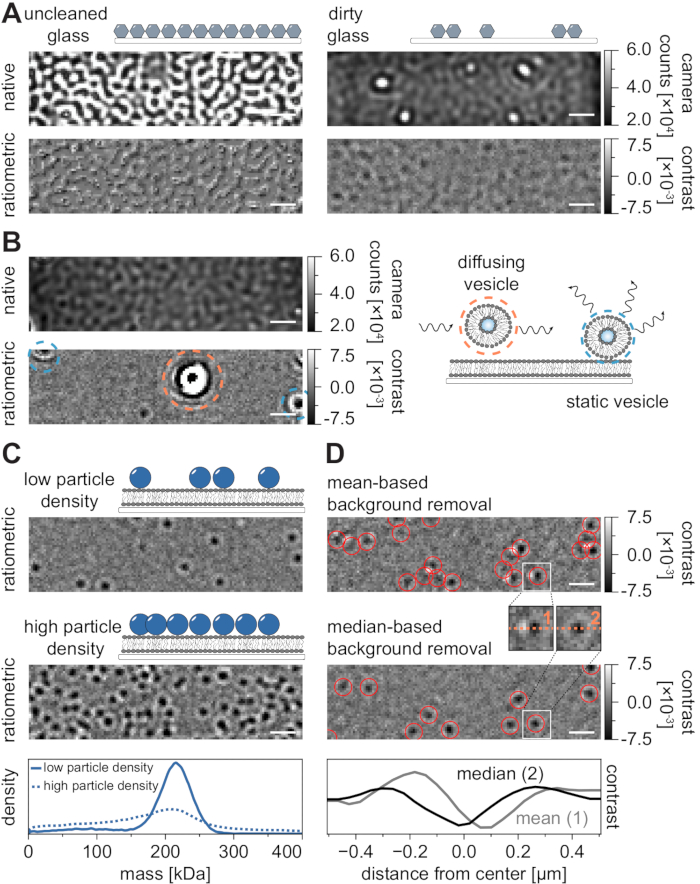
图7:MSPT测量过程中或数据分析过程中的潜在并发症。 (A)在未清洁的盖玻片的原生和处理(基于中值的背景去除)比例视图中显示的表面粗糙度的代表性图像。在这两种情况下,亮点都会构成残留的表面杂质,从而阻碍无伪影的测量。(B)膜洗涤不足后视场中残留囊泡的示例性图像。静态(以蓝色突出显示)和扩散(以橙色突出显示)囊泡都会分别由于脉动和摆动或由于其方向运动而损害测量质量。(C)作为一种单粒子技术,MSPT需要低粒子密度(代表性图像,上图)才能对每个粒子进行适当的链接和质量测定。在高膜颗粒密度(中间面板)的情况下,颗粒拟合受损,这会影响质量测定(参见下图)。(D)基于均值(上图)或基于中位数的背景去除后,颗粒在膜界面上扩散的代表性比例图像。对于漫射粒子,基于均值的背景去除策略会产生粒子 PSF 的扭曲图像,如上面板和中间面板之间的小插图所示。相比之下,未失真的粒子PSF可以通过基于中位数的方法获得。下图:通过基于平均值或中位数的背景去除后获得的PSF中心的线轮廓比较。对于此图中显示的所有原始图像和比例图像,比例尺表示 1 μm。对于数据分析(参见随附的Jupyter笔记本;步骤9),使用以下参数:中位数窗口大小(window_length)= 1,001帧,检测阈值(thresh)= 0.00055,搜索范围(dmax)= 4像素,内存(max_frames_to_vanish)= 0帧,最小轨迹长度(minimum_trajectory_length)= 5。 请点击此处查看此图的大图。
补充图1:无蛋白膜和占用膜的比较。 在(A)和(B)加入纯化的链霉亲和素(STP)之前和之后完整支持的脂质双层的代表性图像。成功拟合到模型 PSF 的候选点以红色包围。(C)在空膜(膜背景,灰色)和双层上检测到的颗粒与扩散链霉亲和素颗粒(蓝色)的概率分布进行对比。两种概率分布都表示具有相同电影采集和分析参数的三个独立实验的汇总数据。对于数据分析(参见随附的Jupyter笔记本;步骤9),使用以下参数:中值窗口大小(window_length)= 1,001帧,检测阈值(thresh)= 0.00055,搜索范围(dmax)= 4像素,内存(max_frames_to_vanish)= 0帧,最小轨迹长度(minimum_trajectory_length)= 7帧。 请点击此处下载此文件。
补充电影1:示例性电影,显示囊泡破裂和融合成用质量光度计记录的均匀膜。图像处理中值窗口大小 (window_length) = 1,001 帧。比例尺:1 μm。相机计数范围:黑色 = 16,892;白色 = 65,408。 请点击这里下载这部电影。
补充电影2:示例性电影,显示从MSPT测量获得的双层上膜联蛋白V(顶部)和生物素化醛缩酶(底部)复合物的扩散。图像处理中值窗口大小 (window_length) = 1,001 帧。比例尺:1 μm。干涉散射对比度范围:黑色=-0.0075;白色 = 0.0075。 请点击这里下载这部电影。
讨论
所提出的方案将质量光度测定21(一种分析吸附在玻璃上的单个生物分子质量的技术)扩展到一种更通用的工具,能够同时测量未标记的膜相互作用生物分子的质量和扩散。这种分析扩展是通过实施适应分子24,25的横向运动的改进的背景去除策略来实现的。通常,背景去除对于基于iSCAT的方法至关重要,因为玻璃表面粗糙度的强烈散射是主要的分析障碍,并且准确确定每个像素的局部背景对于量化颗粒质量和位置至关重要。除了适应粒子运动的图像分析外,随后的粒子检测,轨迹链接和数据分析完成了MP向质量敏感粒子跟踪(MSPT)的新颖扩展。
一般来说,彻底清洁的玻璃盖玻片和清洁的工作环境是MSPT实验成功的关键要求。由于没有大分子标记,获得的信号本质上是非选择性的。因此,清洁样品以及适当的样品处理对于确保观察结果不被误解至关重要。特别是,当检查低分子量分子时,支持无蛋白膜的对照测量以评估背景贡献(补充图1)。因此,除了包含控制测量值外,还建议遵循 图2 中所示的每个流动室的制备步骤。当这些安全措施组合在一起时,将确保检测到的信号来自感兴趣的生物分子,而不是例如受污染的流动室,缓冲液或膜。
除了有关实验设计的注意事项外,在MSPT图像处理过程中还需要小心。在视频处理过程中,应仔细选择三个参数的值以确保结果正确:i)用于背景删除的中位数窗口的长度,ii)粒子检测的阈值,以及iii)链接分配期间的最大搜索半径。较大的中值窗口(i)通常有助于将扩散粒子与叠加的准常数背景分离。然而,对于过大的窗口大小,样本漂移最终会变得明显,并降低背景估计的准确性。最佳设置在很大程度上取决于样品特性和测量条件。但是,值 1,001 可以用作可靠的起点。阈值参数(ii)必须根据样品中预期的最低分子量进行调整。对于使用本研究中使用的质量光度计进行的测量,不建议使用低于0.0005的值。为了加快分析时间,如果预计样品具有高分子量,则可以选择更高的值。轨迹链接中的搜索半径 (iii) 指定了在连续帧中搜索粒子的偏移位置的最大径向距离(以像素为单位)。它应该适应样本中最快的粒子,如果受到青睐,可以使用自适应搜索范围(参见 trackpy的文档)来减少计算时间。特别是在项目的初始阶段,建议重新分析具有不同参数的电影以验证获得的结果。
鉴于MSPT的单分子性质,应避免在高膜颗粒密度下进行测量,因为这些会干扰精确的对比度和质量测定。已经表明,低于每平方微米一个颗粒的密度有利于MSPT测量24。另一个考虑因素是样品中的预期扩散系数。虽然适用于广泛的扩散系数,但MSPT具有可访问扩散系数的下限。在中值窗口周期的很大一部分期间,局部限制为几个像素的区域会将粒子与静态背景合并。对于该协议中使用的成像条件,不建议测量低于0.01μm2 / s的扩散系数。例如,在这种扩散速度下,粒子在中值窗口半尺寸期间的平均平方位移约为4像素,因此大小与PSF的范围相似。因此,静态背景估计可能包含来自粒子本身的信号贡献,这导致粒子的对比度明显降低,直到它最终接近噪声水平。然而,可以清楚地解决0.05至10μm2 / s之间的大分子扩散系数。
为了进一步扩展MSPT应用的范围,可以设想通过消除暂时被粒子占据的像素,或者通过样本漂移校正实现更大的中位数窗口尺寸,来改进基于中位数的背景算法。这两种方法都将缓解在高颗粒密度和缓慢扩散下进行测量的问题。新一代质量光度计有望在降低质量灵敏度方面进行改进,这些光度计可以提供小于50 kDa的生物分子。因此,未来的MSPT实验将能够研究单分子动力学和膜相关相互作用,以用于更广泛的膜模拟物,如缓冲双分子层和高分子系统。
披露声明
作者没有利益冲突。
致谢
我们衷心感谢Philipp Kukura,Gavin Young和Refeyn软件团队的支持,并通过共享部分图像分析代码来感谢他们的帮助。我们感谢Cryo-EM MPIB核心设施提供对商用Refeyn质量光度计的访问。F.S.感谢Jürgen Plitzko和Wolfgang Baumeister给予的支持和资助。T.H.和PS通过Deutsche Forschungsgemeinschaft(DFG,德国研究基金会)获得资金 - 项目ID 201269156 - SFB 1032(A09)。N.H.得到了DFG返回补助金HU 2462/3-1的支持。P.S.通过研究网络MaxSynBio 通过 德国联邦教育和研究部(BMBF)和Max Planck Society的联合资助计划获得支持。
材料
| Name | Company | Catalog Number | Comments |
| annexin V | Sigma Aldrich | #SRP8026 | examplary membrane-interacting protein |
| Bio-Rad Protein Assay | Bio-Rad Laboratories Inc. | #5000006 | bradford assay kit to determine protein stock concentrations |
| biotin labeled bovine albumin | Sigma Aldrich | #A8549 | examplary protein that can be used as standard protein for MSPT |
| cholera toxin subunit B | Sigma Aldrich | #SAE0069 | examplary membrane-interacting protein |
| cover glasses, #1.5, 24 x 24 mm | Paul Marienfeld GmbH & Co. KG | #0102062 | |
| cover glasses, #1.5, 24 x 60 mm | Paul Marienfeld GmbH & Co. KG | #0102242 | |
| dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | #850375 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoethanolamine-N-cap biotinyl (18:1 Biotinyl Cap PE | Avanti Polar Lipids | #870273 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoglycerol (DOPG) | Avanti Polar Lipids | #840475 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) | Avanti Polar Lipids | #840035 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| double-sided tape | tesa | #57912-00000-02 | needed for the assembly of glass sample chambers |
| Extruder | Avanti Polar Lipids | #610023 | Lipid extruder to enable monodisperse vesicle distributions |
| EZ-Link Maleimide-PEG2-Biotin | Thermo Fisher Scientific | #A39261 | maileimide-fused biotin that can be used to biotinylate standard proteins for MSPT |
| Fibronectin (Biotinylated) | Cytoskeleton Inc. | #FNR03-A | examplary protein that can be used as standard protein for MSPT |
| Gel Filtration HMW Calibration Kit | Cytiva | #28403842 | standard proteins, e.g. aldolase that can be biotinylated and used as molecular weight standards for MSPT |
| GM1 Ganglioside (Brain, Ovine-Sodium Salt) | Avanti Polar Lipids | #860065 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Biotin | Thermo Fisher Scientific, Waltham, USA) | #31820 | examplary protein to highlight the existence of different protein states |
| Isopropanol, 99.5%, for spectroscopy | Thermo Fisher Scientific | #10003643 | |
| Low Autofluorescence Immersion Oil | Olympus K.K. | #IMMOIL-F30CC | |
| pET21a-Streptavidin-Alive | Addgene | #20860 | required to express and purify divalent streptavidin in combination with each other |
| pET21a-Streptavidin-Dead | Addgene | #20859 | required to express and purify divalent streptavidin in combination with each other |
| Pierce Alkaline Phosphatase, biotinylated | Thermo Fisher Scientific | #29339 | examplary protein that can be used as standard protein for MSPT |
| Pierce Protein A, Biotinylated | Thermo Fisher Scientific | #29989 | examplary protein that can be used as standard protein for MSPT |
| Refeyn Acquire | Refeyn Ltd. | control software for Refeyn OneMP | |
| Refeyn One | Refeyn Ltd. | - | mass photometer |
| sterile syringe filters 0.45 µm cellulose acetate membrane | VWR International | #514-0063 | needed to filter particles from the buffer of interest |
| tetravalent streptavidin | Thermo Fisher Scientific | #SNN1001 | tetravalent streptavidin to enable the presence of several biotin binding sites |
| Whatman Nuclepore Hydrophilic Membrane, 0.05 µm Pore Size, 25 mm Circle | Cytiva | #110603 | a pore size of 50 nm is recommended for supported lipid bilayer formation in the context of MSPT |
| Zepto model 2 plasma cleaner | Diener electronic GmbH | - |
参考文献
- Robertson, J. L. The lipid bilayer membrane and its protein constituents. Journal of General Physiology. 150 (11), 1472-1483 (2018).
- Grecco, H. E., Schmick, M., Bastiaens, P. I. H. Signaling from the Living Plasma Membrane. Cell. 144 (6), 897-909 (2011).
- Cho, W., Stahelin, R. V. Membrane-protein interactions in cell signaling and membrane trafficking. Annual Review of Biophysics and Biomolecular Structure. 34, 119-151 (2005).
- Whited, A. M., Johs, A. The interactions of peripheral membrane proteins with biological membranes. Chemistry and Physics of Lipids. 192, 51-59 (2015).
- Gonzalez, L., Scheller, R. H. Regulation of membrane trafficking: Structural insights from a Rab/effector complex. Cell. 96 (6), 755-758 (1999).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- Bagheri, Y., Ali, A. A., You, M. Current methods for detecting cell membrane transient interactions. Frontiers in Chemistry. 8, 603259 (2020).
- Miller, H., Zhou, Z., Shepherd, J., Wollman, A. J. M., Leake, M. C. Single-molecule techniques in biophysics: A review of the progress in methods and applications. Reports on Progress in Physics. 81 (2), 024601 (2018).
- Manzo, C., Garcia-Parajo, M. F. A review of progress in single particle tracking: From methods to biophysical insights. Reports on Progress in Physics. 78 (12), 124601 (2015).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331 (6155), 450-453 (1988).
- Funatsu, T., Harada, Y., Tokunaga, M., Saito, K., Yanagida, T. Imaging of single fluorescent molecules and individual ATP turnovers by single myosin molecules in aqueous solution. Nature. 374 (6522), 555-559 (1995).
- Schmidt, T., Schütz, G. J., Baumgartner, W., Gruber, H. J., Schindler, H. Imaging of single molecule diffusion. Proceedings of the National Academy of Sciences of the United States of America. 93 (7), 2926-2929 (1996).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Kukura, P., et al. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Ueno, H., et al. Simple dark-field microscopy with nanometer spatial precision and microsecond temporal resolution. Biophysical Journal. 98 (9), 2014-2023 (2010).
- Loose, M., Fischer-Friedrich, E., Herold, C., Kruse, K., Schwille, P. Min protein patterns emerge from rapid rebinding and membrane interaction of MinE. Nature Structural and Molecular Biology. 18 (5), 577-583 (2011).
- Bezeljak, U., Loya, H., Kaczmarek, B., Saunders, T. E., Loose, M. Stochastic activation and bistability in a Rab GTPase regulatory network. Proceedings of the National Academy of Sciences of the United States of America. 117 (12), 6504-6549 (2020).
- Ha, T., Tinnefeld, P. Photophysics of fluorescent probes for single-molecule biophysics and super-resolution imaging. Annual Review of Physical Chemistry. 63 (1), 595-617 (2012).
- Garcia-Parajo, M. F., Segers-Nolten, G. M. J., Veerman, J. A., Greve, J., Van Hulst, N. F. Real-time light-driven dynamics of the fluorescence emission in single green fluorescent protein molecules. Proceedings of the National Academy of Sciences of the United States of America. 97 (13), 7237-7242 (2000).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Heermann, T., Steiert, F., Ramm, B., Hundt, N., Schwille, P. Mass-sensitive particle tracking to elucidate the membrane-associated MinDE reaction cycle. Nature Methods. 18 (10), 1239-1246 (2021).
- Foley, E. D. B., Kushwah, M. S., Young, G., Kukura, P. Mass photometry enables label-free tracking and mass measurement of single proteins on lipid bilayers. Nature Methods. 18 (10), 1247-1252 (2021).
- Voss, O. H., Lee, H. N., Tian, L., Krzewski, K., Coligan, J. E. Liposome preparation for the analysis of lipid-receptor interaction and efferocytosis. Current Protocols in Immunology. 120, 1-21 (2018).
- Pincet, F., et al. FRAP to characterize molecular diffusion and interaction in various membrane environments. PLoS ONE. 11 (7), 0158457 (2016).
- Howarth, M., et al. A monovalent streptavidin with a single femtomolar biotin binding site. Nature Methods. 3 (4), 267-273 (2006).
- Allan, D., et al. soft-matter/trackpy: Trackpy v.0.5.0. Zenodo. , (2021).
- Weimann, L., et al. A quantitative comparison of single-dye tracking analysis tools using Monte Carlo simulations. PLoS ONE. 8 (5), 64287 (2013).
- Michalet, X. Mean square displacement analysis of single-particle trajectories with localization error: Brownian motion in an isotropic medium. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 82 (4), 041914 (2010).
- Sygusch, J., Beaudry, D., Allaire, M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution. Proceedings of the National Academy of Sciences of the United States of America. 84 (22), 7846-7850 (1987).
- Heath, G. R., Scheuring, S. High-speed AFM height spectroscopy reveals µs-dynamics of unlabeled biomolecules. Nature Communications. 9 (1), 4983 (2018).
- Day, C. A., Kenworthy, A. K. Mechanisms underlying the confined diffusion of cholera toxin B-subunit in intact cell membranes. PLOS ONE. 7 (4), 34923 (2012).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。