Method Article
Membranla İlişkili Makromolekül Dinamiğini Karakterize Etmek için Kütleye Duyarlı Partikül İzleme
Bu Makalede
Özet
Bu protokol, moleküler kütlenin ve lipit membranlarla etkileşime giren makromoleküllerin difüzyon davranışının eşzamanlı olarak araştırılmasını sağlayan iSCAT tabanlı bir görüntü işleme ve tek parçacık izleme yaklaşımını açıklar. Numune hazırlama, kütleden kontrasta dönüştürme, film edinme ve son işleme için adım adım talimatlar, olası tuzakları önlemek için talimatlarla birlikte sağlanır.
Özet
Çok sayıda esansiyel biyolojik reaksiyonun gerçekleştiği bir arayüz olan lipit membranlarında ve membranlarda makromoleküllerin kısa ömürlü veya geçici etkileşimleri, standart biyofiziksel yöntemlerle değerlendirilmesi doğal olarak zordur. Kütleye duyarlı parçacık izlemenin (MSPT) tanıtılması, bu tür işlemlerin kapsamlı bir nicel karakterizasyonuna yönelik önemli bir adımı oluşturmaktadır. Teknik olarak, bu, interferometrik saçılma mikroskobu (iSCAT) tabanlı kütle fotometrisinin (MP) ortaya çıkmasıyla mümkün olmuştur. Arka plan kaldırma stratejisi, membranla ilişkili parçacıkların iki boyutlu hareketini ortaya çıkarmak için optimize edildiğinde, bu teknik, biyolojik membranlar üzerindeki etiketlenmemiş makromoleküllerin hem difüzyonunun hem de moleküler kütlesinin gerçek zamanlı analizine izin verir. Burada, membranla ilişkili sistemlerin kütleye duyarlı parçacık takibini gerçekleştirmek ve analiz etmek için ayrıntılı bir protokol açıklanmaktadır. Ticari bir kütle fotometresinde yapılan ölçümler, milisaniye rejiminde zaman çözünürlüğüne ve MP sistemine bağlı olarak 50 kDa'ya kadar bir kütle algılama sınırına ulaşır. MSPT'nin genel olarak membran katalizörlü makromolekül dinamiklerinin derinlemesine analizi için potansiyelini göstermek için, doğal membran interaktör ek V gibi örnek protein sistemleri için elde edilen sonuçlar sunulmuştur.
Giriş
Bir zamanlar sadece çok çeşitli ortam fiziksel koşullarına karşı bir bariyer olarak algılanan biyolojik membranlar, günümüzde fonksiyonel varlıklar ve katalitik platformlar olarak kabul edilmektedir 1,2. Membranla ilişkili makromolekül reaksiyonlarına yanıt olarak sinyalleri lokalize etme, yükseltme ve yönlendirme yeteneklerine dayanarak, lipit arayüzleri, membran kaçakçılığı ve sinyal kaskadları 3,4,5 gibi çok çeşitli hücresel süreçler için çok önemli bir unsur oluşturur. Kararlı komplekslerin montajı için bir çekirdeklenme bölgesi olarak hizmet veren membran ataşmanı, genellikle makromoleküllerin membranla ilişkili ve sitozolik formları arasındaki dinamik bir dengeye dayanır ve bu nedenle geçici niteliktedir 6,7.
Biyolojideki büyük önemlerine rağmen, membranla ilişkili makromolekül reaksiyonlarının bileşimsel, mekansal ve zamansal heterojenliklerine gerçek zamanlı 7,8'de erişim sağlayabilecek yöntemler geliştirmek şimdiye kadar zor olmuştur. Altta yatan moleküler süreçleri çözmek için, iki deneysel yön belirleyicidir: yeterli zaman çözünürlüğü ve tek parçacık duyarlılığı. Bu nedenle, fotobeyazlatma sonrası floresan geri kazanımı (FRAP) gibi topluluk ortalama tekniklerinin yanı sıra çok daha hassas floresan korelasyon spektroskopisi (FCS) de zamansal bilgiden mekansal bilgiyi büyük ölçüde ayırdıkları için sınırlamaları vardır9. Bireysel molekül dinamiklerinin karakterizasyonuna yönelik önemli bir adım, bu nedenle, yüksek hassasiyetli mikroskopi ile kombinasyon halinde tek parçacık izlemenin (SPT) ortaya çıkması olmuştur. Özellikle, iki SPT yaklaşımının bu konuda etkili olduğu kanıtlanmıştır. İlk olarak, floroforların etiket olarak kullanılması ve buna karşılık gelen floresan algılama sistemleri, nanometre hassasiyetinin ve milisaniye zaman çözünürlüğü 10,11,12'nin yolunu açtı. İkincisi, altın nanopartikülleri kullanarak saçılma tabanlı algılama, hem lokalizasyon hassasiyetini hem de zaman çözünürlüğünü sırasıyla13,14,15,16 alt nanometre ve mikrosaniye aralığına geliştirdi. Her iki yaklaşımın birçok avantajına ve membranla ilişkili sistemlerin mekanik anlayışına ilişkin önemli katkılarına rağmen17,18, her iki teknik de şimdiye kadar sınırlı kalmıştır: doğal davranışlarını potansiyel olarak bozan ve membranla ilişkili parçacıkların moleküler bileşimine duyarsız olan ilgili moleküllerin etiketlenmesini gerektirirler 19,20.
Her iki sınırlama da yakın zamanda kütle fotometrisi (MP)21,22,23 olarak adlandırılan yeni bir interferometrik saçılma (iSCAT) tabanlı yaklaşımın tanıtılmasıyla aşılmıştır. Bu teknik, bir cam arayüze iniş yaparken biyomoleküllerin iSCAT kontrastına göre çözelti içi kütle dağılımlarının belirlenmesini sağlar. Bununla birlikte, lipit membranlara yayılan hareketli moleküllerin tespiti ve karakterizasyonu için, daha sofistike bir görüntü analizi yaklaşımının geliştirilmesi gerekiyordu. Bu arada bu başarılı bir şekilde uygulanmıştır ve bir lipit arayüzü24,25 üzerinde yayılan tek etiketsiz biyomoleküllerin moleküler kütlesini tespit etmeye, izlemeye ve belirlemeye izin verir. Dinamik kütle fotometrisi veya kütleye duyarlı parçacık izleme (MSPT) olarak adlandırılan bu teknik, şimdi izlenen varlıkların moleküler kütlesindeki değişiklikleri doğrudan kaydederek karmaşık makromolekül etkileşimlerinin değerlendirilmesini sağlar ve böylece membranla ilişkili moleküler dinamiklerin mekanik analizi için yeni olanaklar sunar.
Burada, örnek hazırlama, görüntüleme ve MSPT için gereken veri analizi işlem hattı için ayrıntılı bir protokol sunulmaktadır. Özellikle numune gereksinimleri ve ölçüm ve analiz sırasında oluşabilecek olası sorunlar tartışılmaktadır. Ayrıca, membranla etkileşime giren makromolekül sistemlerini analiz etmek için eşsiz potansiyel, çeşitli temsili sonuçlarla sergilenmektedir.
Protokol
1. Numune hazırlama
- Çok katmanlı veziküllerin (MLV'ler) üretimi
- İstenilen lipit karışımına ve gerekli süspansiyon hacmine göre kloroform çözünmüş lipit (ler) miktarını hesaplayın.
NOT: Resüspansiyon (reaksiyon) tamponu için 4 mg/mL lipidlerin son vezikül konsantrasyonu önerilir. - Hesaplanan lipit hacmini, cam uçlarla donatılmış pozitif yer değiştirmeli pipetler kullanarak 1,5 mL'lik bir cam şişeye pipetleyin.
- Lipid çözücüyü soluk bir azot akışı altında buharlaştırın ve lipitlerin cam duvarlarda eşit dağılımını sağlamak için şişeyi sürekli döndürün.
- Şişeyi 15 dakika boyunca sabit bir azot akışının altına yerleştirerek tam çözücü buharlaşmasını sağlayın.
- Artık kloroform izlerini, bir vakumlu kurutucuda bir saat daha vakumla kurutarak çıkarın.
- Lipid karışımını istenen resüsitasyon (reaksiyon) tamponunda rehidre edin ve lipit filmi şişenin duvarlarından çözülene kadar süspansiyonu iyice vorteksleyin.
NOT: Reaksiyon tamponu protein aktivitesini ve stabilitesini sağlamalıdır. Bu çalışmada kullanılan reaksiyon tamponu 50 mM Tris-HCl (pH = 7.5), 150 mM KCl ve 5 mM MgCl2 içerir. Lipitleri veya proteinleri seyreltmek için kullanılan herhangi bir tamponun, müdahale eden partikül safsızlıklarını gidermek için filtrelenmesi gerektiğini unutmayın (bkz. adım 5).
- İstenilen lipit karışımına ve gerekli süspansiyon hacmine göre kloroform çözünmüş lipit (ler) miktarını hesaplayın.
- Küçük unilamellar veziküllerin (SUV'lar) üretimi
- Lipid süspansiyonunun ardışık donma-çözülme döngüleri için (adım 1.1.6), 500 mL suyu sıcak bir plaka üzerindeki bir beherde kaynatın (70 ° C ila 99 ° C arasında) ve sıvı azotlu bir kap hazırlayın.
- Sıvı azottaki lipit süspansiyonunu şok dondurun. Çözelti tamamen çözülene kadar şişeyi sıcak suyla beherin içine aktarın. Bu donma-çözülme döngüsünü 8-10 kez veya daha önce bulanık karışım berrak görünene kadar tekrarlayın.
DİKKAT: Sıvı azot, dondurulmuş lipit şişesi veya kaynar su ile doğrudan teması önlemek için gözlük, eldiven ve cımbız gibi uygun güvenlik giysileri ve ekipmanları kullanın. - Bir monodispers vezikül dağılımının oluşturulması için, bir lipit-ekstrüder monte edin ve sızıntı yapmadığından emin olmak için bütünlüğünü reaksiyon tamponu ile test edin.
NOT: Sızıntı gözlenirse, tampon dökülmesi belirgin olmayana kadar lipit ekstrüderini dikkatlice yeniden monte edin. - 37 için lipit süspansiyonunu ekstrüzyon, gözenek boyutu 50 nm26 olan bir nükleopore membrandan geçer. Son SUV karışımının nükleopore membranını geçtiğinden ve dolayısıyla lipit agregalarından veya çok katmanlı veziküllerden arındırılmış olduğundan emin olmak için geçiş sayısı eşit olmamalıdır. Ekstrüde veziküller daha sonra desteklenen lipit çift katmanları oluşturmak için kullanılacaktır (bkz. adım 6 ve 7).
NOT: SUV'lar da rehidrate lipit karışımının sonikasyonu ile oluşturulabilir. Bununla birlikte, ekstrüzyon yoluyla hazırlık, SUV'ların daha monodispers bir dağılımını sağlar ve bu da desteklenen lipit çift katmanlı oluşum sırasında vezikül kopmasını kolaylaştırır. Ekstrüde veziküller buzdolabında en fazla 3 gün saklanabilir.
2. Mikroskop slaytlarının temizlenmesi
- Politetrafloretilen (PTFE) mikroskop tutucularında 24 mm x 60 mm ve 24 mm x 24 mm boyutlarında eşit sayıda mikroskop slaytı (No. #1.5; 0.17 mm kalınlıkta) dağıtın.
- PTFE tutucuları ultra saf su içeren beherlere aktarın ve oda sıcaklığında 15 dakika boyunca sonikleştirin.
NOT: Beher'e bağlı olarak, su hacminin PTFE tutucuyu tamamen kaplayacak şekilde ayarlanması gerekir. - Tutucuları beherden çıkarmak için cımbız kullanın ve suyu ultra saf izopropanol ile değiştirin. Tutucuyu izopropanol içeren beherin içine yerleştirin ve 15 dakika boyunca tekrar sonikleştirin.
NOT: Beher'e bağlı olarak, izopropanolün hacminin PTFE tutucuyu tamamen kaplayacak şekilde ayarlanması gerekir. - İzopropanolü ultra saf suyla değiştirin ve tutucuları içeren beheri 15 dakika boyunca sonikleştirin.
- PTFE tutucuları beherlerden çıkarın ve tutucudaki mikroskop kızaklarını sabit bir azot gazı veya basınçlı hava akışı altında üfle kurutun.
NOT: Her bir beheri örtmek için eldivenler, temiz beherler ve parafin film kullanarak kapak slaytlarının uygun şekilde temizlendiğinden emin olun. Aksi takdirde, artık toz MSPT ölçümleri sırasında önemli arka plan dalgalanmalarına neden olabilir.
3. Mikroskop slaytlarının hidrofilizasyonu
NOT: Homojen ve sıvı destekli bir lipit çift katmanı elde etmek için, slaytların hidrofilizasyonu esastır ve akış odası montajından hemen önce yapılmalıdır.
- Sadece 24 mm x 60 mm mikroskop slaytları içeren PTFE tutucuları, proses gazı olarak oksijenli bir plazma temizleyiciye yerleştirin ve mikroskop slaytlarını plazma ile temizleyin (bu çalışmada kullanılan parametreler: 30 s için% 30 güç, 0,3 mbar oksijen basıncı; kullanılan plazma temizleyicinin ayrıntıları için Malzemeler Tablosuna bakınız).
NOT: Sıvı membranları elde etmek için, güç, oksijen basıncı ve temizleme süresi gibi plazma temizleme parametreleri her cihaz için ayarlanmalıdır. Bu amaçla, fotobeyazlatma (FRAP) deneylerinden sonra floresan geri kazanımı ile ölçülebilen membran akışkanlığını sağlamak için floresan etiketli lipitlerin kullanılması önerilmektedir27. Parametreler ilgili kurulum için optimize edilmezse, membran akışkanlığının azalması nedeniyle membran difüzyonu bozulabilir.
4. Akış odalarının montajı
- Akış odası montajından önce, aşağıdaki bileşenleri hazır bulundurun: temizlenmiş mikroskop slaytları (24 mm x 24 mm), hidrofilize mikroskop slaytları (24 mm x 60 mm), alüminyum folyo, düz karton, neşter ve çift taraflı bant.
- Düz kartonu alüminyum folyo ile sarın.
- Temizlenmiş 24 mm x 24 mm mikroskop kızaklarını alüminyum folyo üzerine birbirleri arasında yeterli mesafe olacak şekilde yayın.
- Çift taraflı bant şeritlerini slaytların üst ve alt kenarlarına takın.
- Her mikroskop slaytını neşterle birlikte tüketin, böylece alüminyum folyodan çıkarılabilir. Sonuç olarak, her slaytta slaytın üst ve alt kenarlarına tutturulmuş çift taraflı bant şeritleri bulunmalıdır (bkz. Şekil 1).
- Daha küçük ve daha büyük mikroskop slaytları arasında bir akış yolu oluşturmak için 24 mm x 24 mm slaytı iki çift taraflı bant şeridi ile hidrofilize 24 mm x 60 mm slaydına takın.
NOT: Akış odalarının temiz olmasını sağlamak için sürekli eldiven giyin ve tezgahın tozsuz olduğundan emin olun.
5. Reaksiyon tamponlarının filtrasyonu
- MSPT ölçümleri sırasında minimum arka plan sinyali sağlamak için tüm reaksiyon tamponlarını 0,45 μm selüloz asetat membranlardan steril olarak filtreleyin.
NOT: ATP gibi nükleotidlerin varlığı başarılı bir deney için gerekliyse, arka plan sinyalindeki potansiyel bir artışın farkında olun. Sadece protein aktivitesini sağlayan minimum miktarların kullanılması önerilir.
6. Desteklenen lipit çift katmanlı (SLB) oluşumu
NOT: Başarılı vezikül yayılımını ve kaynaşmamış veziküllerin tamamen çıkarılmasını görsel olarak sağlamak için kütle fotometresinde desteklenen lipit çift katmanlarının oluşumunun yapılması önerilir.
- Yeni ekstrüde edilmiş SUV'ları (daha fazla ayrıntı için adım 1'e bakın) gerekli reaksiyon tamponunda 0,4 mg/mL'lik son konsantrasyona kadar seyreltin. İsteğe bağlı olarak, vezikül kopmasını teşvik etmek için, vezikül süspansiyonuna 2 mM CaCl2 ekleyin.
NOT: Divalent katyonlar, PiP2 gibi bazı lipitlerin toplanmasına neden olabilir. Bu tür lipitleri içeren karışımlar için, vezikül rüptürünün veya resüsitasyon tamponundaki diğer iki değerli katyonların teşviki için CaCl2 kullanmaktan kaçının. Deney için gerekliyse, desteklenen lipit çift katmanının başarılı bir şekilde oluşturulmasından sonra iki değerli katyonlar eklenebilir. - Vezikül süspansiyonunun 50 μL'sini akış odasına yıkayın (adım 4) ve odayı 2 dakika boyunca inkübe edin.
NOT: Tamponlar, veziküller veya protein çözeltileri, akış odasından küçük bir ıslatma dokusu parçası ile yıkanabilir. Bununla birlikte, mekanik bir pompa sistemi kullanmak da mümkündür. - Kaynaşmamış vezikülleri, akış odasının her seferinde 200 μL reaksiyon tamponu ile tekrar tekrar (en az üç kez) yıkanmasıyla çıkarın.
NOT: MSPT ölçümleri sırasında sabit bir arka plan sinyali sağlamak için veziküllerin akış odasından iyice yıkanması gerekir.
7. Kalibrasyon eğrisinin oluşturulması
NOT: Tespit edilen parçacıkların kontrastını moleküler kütleye dönüştürmek için, sinyallerinin bilinen boyutlardaki proteinler kullanılarak kalibre edilmesi gerekir. Standart protein boyutu rejiminin, ilgilenilen sistem için beklenen moleküler kütle aralığını kapsayacak şekilde ayarlanması önerilir.
- Standart proteinlerin sistein kalıntısı ile biyotinilasyonu
- Üreticinin talimatlarına göre standart protein için uygun miktarda maleimid-biyotin hesaplayın.
- Standart proteini, oda sıcaklığında 1 saat boyunca belirlenen maleimid-biyotin hacmiyle inkübe edin.
- Konjuge edilmemiş maleimid-biyotin'i konjuge biyotin-protein kompleksinden çıkarmak için, ilgilenilen protein için uygun bir kolon üzerinde boyut dışlama kromatografisi yapın.
- Bradford Testi kullanarak protein konsantrasyonunu belirleyin.
NOT: Standart proteini daha ileri ölçümler için saklamak için, proteini sıvı azotta tek kullanımlık alikotlarda dondurun ve -80 ° C'de saklayın.
- Kalibrasyon eğrisi için standart proteinlerin ölçümü
- Bir akış odasında, % 0.01 mol (v / v) Biyotinil Kapak PE (1,2-dioleoyl-sn-glisero-3-fosfoetanolamin-N-cap biyotinil) içeren 0.4 mg / mL ekstrüde SUV'larla (daha fazla ayrıntı için adım 1 ve 6'ya bakın) desteklenen bir lipit çift katmanı hazırlayın.
- Akış odasındaki çift katmana 50 μL 2,5 nM iki değerli streptavidin ekleyin ve 10 dakika boyunca inkübe edin.
NOT: Divalent streptavidin, Howarth ve ark.28'de belirtildiği gibi ifade edilmiş ve saflaştırılmıştır. Dört değerlikli streptavidin de aynı şekilde kullanılabilir. Bununla birlikte, iki değerli streptavidin kullanımı, türlerin atanmasını kolaylaştırmak için biyotinile lipitler ve bir biyotin parçasına konjuge edilen standart proteinler arasındaki olası reaksiyon stokiyometrilerini azaltabilir. - İlişkisiz iki değerli streptavidini 100 μL reaksiyon tamponu ile çıkarın.
- Akış odasındaki çift katmana 50 μL 100 nM biyotin konjuge standart protein ekleyin ve 2 dakika boyunca inkübe edin.
NOT: Biyotinilasyon verimliliğine ve di- veya dört değerlikli streptavidinin kullanılıp kullanılmadığına bağlı olarak, biyotin konjuge standart protein ve streptavidinin optimum konsantrasyonları değişebilir. - MSPT ölçümünü adım 8'de özetlenen ayrıntılara göre gerçekleştirin.
DİKKAT: Görüntüleme koşullarının hem numune hem de kalibrasyon standartları için aynı olması gerekir.
8. Görüntüleme
- SLB oluşumu ve numune hazırlama
- Adım 6'da daha ayrıntılı olarak açıklandığı gibi, istenen lipit karışımının (25 μL) SUV'larını numune akış odasına tanıtın ve desteklenen bir lipit çift katmanı oluşturun. Tüm kaynaşmamış vezikülleri çıkarmak için odayı (üç kez) 100 μL reaksiyon tamponu ile iyice yıkayın.
- Numune odasına ilgilenilen proteinin 50 μL'sini ekleyin.
NOT: MSPT tek parçacıklı bir yöntem olduğundan, bozulmamış partikül algılama ve izleme için protein konsantrasyonu pM'den nM'ye kadar aralıkta tutulmalıdır.
- Video çekimi
- Edinme yazılımında görüş alanının boyutu (FOV), kare hızı, pozlama süresi ve edinme süresi gibi istenen görüntüleme koşullarını ayarlayın.
NOT: Aşağıdaki ayarların ticari kütle fotometresinde MSPT için çalıştığı kanıtlanmıştır ( bkz. Malzeme Tablosu): 128 piksel x 35 piksel FOV, sonraki 5 kat kare ortalamasından sonra saniyede yaklaşık 200 kare ile sonuçlanan 1 kHz kare hızı ve 0,95 ms'lik pozlama süresi. - Netlemeyi otomatik veya manuel olarak ayarlayın. Gerekirse, yanal kontrolü kullanarak FOV'u homojen bir membranlı bir konuma getirin.
- Bir proje klasörü oluşturun ve filmi kaydetmeye başlayın. Kayıt tamamlandıktan sonra, edinme yazılımı tarafından istenen iletişim kutusunda bir dosya adı belirtin. Film daha sonra sonraki analizler için otomatik olarak proje klasörüne MP dosyası olarak kaydedilir.
NOT: Tek tek membranların bütünlüğünü ve sonuçların tekrarlanabilirliğini sağlamak için farklı akış odalarına en az üç replikasyonu kaydedin. Film süresi önceden ayarlanabilir ve denemenin türüne bağlıdır. Çoğu durumda, 5 dakika ile 7 dakika arasında bir satın alma süresi önerilir.
DİKKAT: Varsayılan olarak, ticari kütle fotometre toplama yazılımındaki film kayıtları, depolama alanını azaltmak için kaydedilmeden önce sıkıştırılır. Ancak, bu protokolde açıklandığı gibi özel veri analizini etkinleştirmek için dosya sıkıştırmanın kapatılması gerekir. Dosya sıkıştırmanın nasıl kapatılacağına ilişkin ayrıntılar üreticinin kullanım kılavuzunda bulunabilir.
- Edinme yazılımında görüş alanının boyutu (FOV), kare hızı, pozlama süresi ve edinme süresi gibi istenen görüntüleme koşullarını ayarlayın.
9. Veri analizi
NOT: Veri analizi işlem hattına iki etkileşimli Jupyter not defteri eşlik eder (MSPT analysis.ipynb, Movie visualization.ipynb). Aşağıda özetlenen MSPT analizini gerçekleştirmek için gerekli olan Jupyter not defterleri ve ilişkili özel olarak yazılmış Python modülleri genel bir depoda mevcuttur: https://github.com/MSPT-toolkit/MSPT-toolkit. Aşağıdaki analizle ilgili ayrıntılı talimatlar için, okuyucular yukarıdaki bağlantı kullanılarak erişilen MSPT analysis.ipynb adresine yönlendirilir.
- Video işleme
- image_processing.mp_reader işlevini kullanarak piksel tabanlı arka plan tahmin algoritması ile ışığın baskın statik saçılımını ortadan kaldırın.
- Arka plan kaldırma işlemini uygulamak için, parametre modu continuous_median seçeneğini belirleyin ve not defteri B.1 bölümünde kayan medyan penceresi (window_length) için uygun bir uzunluk ayarlayın. İsteğe bağlı olarak, parçacık algılama ve yörünge bağlantısı için kullanılmak üzere arka plan kaldırıldıktan sonra filmleri kaydedin (parametre save_processed_movies Doğru olarak ayarlayarak).
NOT: Membran üzerindeki partikül yoğunluğuna, beklenen difüzyon katsayısına, elde edilen kare hızına ve gerekli işleme hızına bağlı olarak pencere boyutunu (window_length) 101 ile 2001 arasındaki değerlere ayarlayın.
DİKKAT: Arka plan kaldırma stratejisi, membran çok yoğun bir şekilde paketlenmemişse ve parçacıkların difüzyonu yeterince hızlıysa (yani, her piksel çoğu zaman bir parçacıkla meşgul değilse) iyi çalışır. Aksi takdirde, parçacıkların kontrastı, arka plan sinyalinden düzgün bir şekilde ayırt edilemedikleri için sistematik olarak hafife alınacaktır. Bu, hesaplama hızı pahasına medyan pencere boyutunu artırarak telafi edilebilir. Ancak, pencere boyutunu çok büyük ayarlamanın, numune kayması nedeniyle çıktıyı olumsuz yönde etkileyebileceğini unutmayın. İşlenen videoların görsel olarak incelenmesi çok önemlidir.
- Arka plan kaldırma işlemini uygulamak için, parametre modu continuous_median seçeneğini belirleyin ve not defteri B.1 bölümünde kayan medyan penceresi (window_length) için uygun bir uzunluk ayarlayın. İsteğe bağlı olarak, parçacık algılama ve yörünge bağlantısı için kullanılmak üzere arka plan kaldırıldıktan sonra filmleri kaydedin (parametre save_processed_movies Doğru olarak ayarlayarak).
- Film boyunca parçacıkları ve bunların konumlarını particle_fitting.particle_fitter işlevini kullanarak algılayın (bkz. not defteri bölüm B.2).
- Parçacık algılamanın hassasiyetini, görüntü ikilileştirme ile aday noktaları vurgulamak için kullanılan eşik parametresiyle (harman; bkz. defter bölümü B.1) ayarlayın. Değişen eşik parametrelerinin nokta algılama hassasiyeti üzerindeki etkisi ayrı bir defterde incelenebilir (Movie visualization.ipynb). Parçacık algılama sonuçları otomatik olarak film dosyasının bir alt dizinindeki CSV dosyalarına kaydedilir.
NOT: Eşik parametresinin keyfi olarak düşük ayarlanması (örneğin, kullanılan kütle fotometresi ile çekilen filmler için, 0,0005'in altında bir eşik parametresi) aday noktalara sahte gürültü hakim olacağından ve dolayısıyla işlem süresini uzatacağından önerilmez.
- Parçacık algılamanın hassasiyetini, görüntü ikilileştirme ile aday noktaları vurgulamak için kullanılan eşik parametresiyle (harman; bkz. defter bölümü B.1) ayarlayın. Değişen eşik parametrelerinin nokta algılama hassasiyeti üzerindeki etkisi ayrı bir defterde incelenebilir (Movie visualization.ipynb). Parçacık algılama sonuçları otomatik olarak film dosyasının bir alt dizinindeki CSV dosyalarına kaydedilir.
- image_processing.mp_reader işlevini kullanarak piksel tabanlı arka plan tahmin algoritması ile ışığın baskın statik saçılımını ortadan kaldırın.
- Python paketi trackpy (v.0.5.0)29'u kullanarak ardışık çerçevelerdeki parçacıkları yörüngelere bağlayın.
NOT: Yörünge bağlantısı, nokta tespitinden sonra anında gerçekleştirilir. Sonuç olarak, yörünge bilgilerini içeren ek bir CSV dosyası, parçacık algılama CSV dosyasının bir alt dizininde saklanır.- Difüzyon katsayılarının sağlam bir şekilde belirlenmesini sağlamak için parametre minimum_trajectory_length kullanarak çok az noktaya sahip yörüngeleri kaldırın (bkz. not defteri bölüm B.1). Trackpy fonksiyonlarının diğer parametreleri ile ilgili ayrıntılı açıklamalar için, trackpy'nin belgelerine bakın.
- Yörünge analizi
- Not defteri C.1 bölümünde, film çekimi için kullanılan kare hızını (frame_rate) ve piksel boyutunu nm (pixel_size) cinsinden belirtin. trajectory_analysis.get_csv_files işleviyle (not defteri bölümü C.2) trackpy tarafından döndürülen yörünge bilgilerini içeren CSV dosyalarının bir listesini oluşturun (bkz. adım 9.2).
- Ayrıca, HDF5 kapsayıcısı için, sığdırma sonuçlarını diskte depolamak için kullanılan bir çıktı dosyası adı belirtin (dizüstü bilgisayar bölümü C.3). CSV dosyaları listesinde yineleme yapan not defteri bölümü C.4'teki trajectory_analysis.fit_trajectories işleviyle tüm yörüngeleri analiz edin. Bu işlev, her yörüngenin difüzyon katsayısını tahmin etmek için atlama mesafesi dağılımı (JDD)30 ve ortalama kare yer değiştirme (MSD)31 analizini kullanır.
- MSPT kalibrasyonundan elde edilen kontrast-kütle ilişkisini kullanarak her yörüngenin medyan kontrastını karşılık gelen kütlesine dönüştürün (bkz. bölüm 7). iSCAT kontrastını moleküler kütle ile ilişkilendiren kalibrasyon hattının eğimini (eğimini) ve y-kesişimini (ofset) belirtin (fonksiyon trajectory_analysis.apply_calibration; bkz. defter bölümü C.5). Bu işlev, her veri çerçevesine yörüngenin medyan kütlesine sahip bir sütun ekler.
- Membran üzerindeki görünür parçacık yoğunluğunu, algılanan parçacıklar açısından medyan yoğunluk değerini döndüren ve her kare sırasında yörüngeleri veri çerçevesindeki ek sütunlar olarak sunan trajectory_analysis.membrane_density işleviyle değerlendirin (bkz. defter bölümü C.6).
NOT: Hem algılama hem de yörünge bağlama işlemi sırasında parçacıkların bir kısmı kaybolacağından, gerçek parçacık yoğunlukları daha yüksek olabilir. Partikül yoğunlukları ve kütle histogramları ile ilgili güvenilir sonuçlar için, ölçüm koşullarının tek parçacık izleme için makul olduğunu doğrulamak üzere temsili film anlık görüntülerini görsel olarak inceleyin (bkz. adım 9.1.1).
10. Veri görselleştirme
- Kütle ve difüzyon katsayısının Python paketi fastkde'ye (v.1.0.19; https://pypi.org/project/fastkde/) dayanan iki boyutlu çekirdek yoğunluğu tahmini ( KDE) ile korelasyonunu gösterin.
- Grafiği oluşturmak için, MSPT sonuçlarını içeren HDF5 dosyasını belirtin (bkz. adım 9.3.2 ve not defteri bölümü D.1) ve plotting.generate_2D_KDE işlevi (not defteri bölümü D.4) için giriş verileri olarak tek bir (not defteri bölümü D.2) veya birleştirilmiş bir veri çerçevesi (not defteri bölümü D.3) seçin.
NOT: Çizilen her veri kümesi, güvenilir bir 2D-KDE için ideal olarak 1.000'den fazla yörünge içermelidir.
Sonuçlar
Akış odacıklarında desteklenen lipit çift katmanlarının (SLB'ler) hazırlanması için buradaki ayrıntılı protokolü takiben (Şekil 1), görüntülenen tüm koşulların doğal görünümünde benek benzeri bir desen açıkça tanınabilir (Şekil 2). Bu etki, genellikle saçılma sinyaline hakim olan ve görsel olarak ayırt edilemeyen koşullara (cam, SLB'li cam veya SLB ve bağlı proteinler) yol açan camın yüzey pürüzlülüğünden kaynaklanır. Bununla birlikte, veziküllerin varlığı, veziküllerin geniş saçılma kesiti nedeniyle açıkça belirgindir ve vezikül kopmasının ve homojen membranlara füzyonun gözlemlenmesini sağlar (Şekil 2B ve Ek Film 1). Cam yüzeyin statik saçılma sinyalini, görüş alanı 24,25 içindeki dinamik elemanları vurgulayan oranmetrik bir yaklaşımla ortadan kaldırırken, boş bir SLB (Şekil 2C) veya camın kendisi (Şekil 2A) gürültülü bir görüntü olarak görünürken, membran üzerinde yayılan etiketsiz proteinler (Şekil 2D) ortaya çıkarılabilir.
MSPT ölçümlerinin doğal arka planı, her piksel değerinin aynı görüntü konumunda filmin önceki ve sonraki piksellerinin medyanı boyunca bölünmesiyle yerel olarak tahmin edilebilir (Şekil 3). Sonuç olarak, makromoleküller, membran üzerindeki hareketi gözlemlenebilen, izlenebilen ve nicelleştirilebilen izotropik nokta yayılma fonksiyonları (PSF'ler) olarak ortaya çıkar. Aslında, hem kontrastın hem de dinamik davranışın mevcudiyeti, bir parçacığın moleküler boyutunun, parçacığı etiketlemeye gerek kalmadan, ilgili difüzyon davranışıyla doğrudan ilişkisini sağlar. Bununla birlikte, MSPT deneyleri sırasında belirlenen iSCAT kontrastını yorumlamak için, sinyal genliğini moleküler kütleye çeviren bir kalibrasyon yapmak önemlidir. Bu, bilinen kütlenin biyomoleküllerinin bir biyotin-streptavidin-biyotin kompleksi aracılığıyla bir SLB'ye bağlanmasıyla elde edilebilir (Şekil 4A). Örnek bir strateji olarak, sığır serum albümini (BSA), protein A (prA), alkalen fosfataz (AP) ve fibronektinin (FN) biyotinile varyantları kullanılabilir; bunlar, membrandaki biyotin içeren lipitlere (Biotinyl Cap PE) bağlı olan streptavidin'e (STP) bağlanır. Şekil 4A'da gösterildiği gibi, bu örnek makromoleküllerin giderek daha belirgin hale gelen kontrastı, ilgili biyotinillenmiş standartların artan moleküler ağırlığını yansıtmaktadır. Kontrast histogramlarının her bir tepe noktasının (Şekil 4B) standart proteinin oligomer durumunun karşılık gelen kütlesine atanmasıyla, kontrast ve kütle arasındaki doğrusal bir ilişki21,22 ortaya çıkar ve daha sonra bilinmeyen makromolekül sistemlerinin analizi için kullanılabilir (Şekil 4C).
MSPT'nin moleküler ağırlıkları analiz etmek ve dolayısıyla oligomer durumlarını ve oligomerizasyon olaylarını incelemek için uygulanabilirliğini ve yeteneklerini gösteren iyi bir örnek, biyotinillenmiş aldolaz ve biyotinillenmiş IgG'nin dikkate alınmasıdır (Şekil 5). Aldolazın yaygın olarak homotetramer32 olduğu bildirilmektedir. Bununla birlikte, MSPT tarafından çözülen kütle dağılımı, çoklu popülasyonların varlığını vurgulayan dört ayrı tepe noktasına sahiptir (Şekil 5A). İlk minör tepe noktası boş streptavidin'e karşılık gelir ve bu tür deneylerdeki konfigürasyon nedeniyle beklenebilirken, sadece iki alt birim (2SU) veya altı alt birim (6SU) içeren aldolaz kompleksleri de aynı şekilde tespit edilebilir (Şekil 5B). İlginçtir ki, tetra ve heksamerik aldolaz-streptavidin kompleksleri, tek başına dimerik aldolaz ve streptavidin ile karşılaştırıldığında, örneğin ikinci bir biyotinile lipitin streptavidin'e bağlanması yoluyla artan viskoz bir sürüklenmeyi gösteren azaltılmış bir difüzyon katsayısı gösterir. Benzer şekilde, biyotinile IgG, kütle dağılımında üç tepe noktası sergiler ve ilk tepe yine tek bir streptavidinin kütlesiyle eşleşir. En bol zirvenin kütlesi, bir hafif ve bir ağır zincirin (1SU) kütlesine, yani bir IgG antikorunun yarısına karşılık gelir. İki özdeş yarıya (2SU) sahip tam antikor, vakaların yaklaşık% 11'inde tespit edilir. Difüzyon katsayısının artan karmaşık boyutlarla azalması, streptavidinin birden fazla biyotinile lipit veya ekli IgG'nin neden olduğu ek sürtünme veya her ikisi ile etkileşimlerini gösterir.
Membrana bağımlı oligomer durumlarının tek analizinin yanı sıra, MSPT ayrıca ilgilenilen bir makromolekülün difüzyon davranışını oligomer durumuyla ilişkilendirmenin özel avantajını da sağlar. Bu tip analizler için temsili sonuçlar, membrana dahil edilen sırasıyla dioleoylfosfatidilserin (DOPS) veya glikozfingolipidlere (GM1) bağlanan ek V (AnV) ve kolera toksini alt birimi B (CTxB) için gösterilmiştir (Şekil 6A). Her iki çekirdek yoğunluğu tahmini (KDE'ler), benzer difüzyon davranışına sahip tek bir bol türü gösteren tek modal kütle ve difüzyon dağılımlarına sahiptir. Moleküler kütle ve difüzyon katsayısının tepe pozisyonu, AnV için sırasıyla 49.8 ± 2.2 kDa ve 1.4 ± 0.1 μm 2 / s ve CTxB için sırasıyla 62.7 ± 3.1 kDa ve 0.4 ± 0.1 μm2 / s olarak bulunmuştur. Ölçülen difüzyon katsayıları, yüksek hızlı AFM ve FRAP33,34'ten elde edilen daha önce bildirilen değerlerle karşılaştırılabilir. Beklenen makromolekülün kütlesine kıyasla hafifçe azalmış kütle (bir AnV trimeri için 52 kDa, bir CTxB pentamer için 65 kDa), toplulukta daha az alt birime sahip daha küçük komplekslerin varlığını gösterebilir. Proteinler arasındaki kütle farkı küçük ve mikroskobun belirtilen tespit sınırına (≈50 kDa) yakın olsa da, difüzyon katsayıları önemli ölçüde farklılık gösterir. Örneğin, bir equimolar karışımda, karışımın difüzyonunu yalnızca AnV ve CTxB'nin dağılımıyla karşılaştırarak, AnV'nin membran üzerinde CTxB'den daha bol olduğu sonucuna varılabilir (Şekil 6B). Bununla birlikte, CTxB konsantrasyonu AnV konsantrasyonuna kıyasla iki katına çıkarsa, denge membran üzerindeki baskın protein olarak CTxB'ye doğru kaydırılır. AnV ve CTxB karışımları için gösterildiği gibi, MSPT sadece membranla ilişkili makromolekülleri moleküler ağırlıklarına göre ayırt etmekle kalmaz, aynı zamanda farklı makromolekül popülasyonlarının difüzyon davranışlarına göre ayırt edilmesini de sağlar.
Tüm mikroskopi tekniklerinde olduğu gibi, istenen veri kalitesini elde etmek için bazı deneysel gereksinimler çok önemlidir. Bu bağlamda önemli bir örnek, iyice temizlenmiş örtü fişleridir. Genel olarak, bu mikroskopi ile ilgili tek moleküllü deneyler için bir ön koşul olarak kabul edilir, ancak MSPT numune safsızlıklarına karşı özellikle hassastır. Temizlenmemiş kapak kapaklarının cam yüzeyinden kaynaklanan artan saçılma, herhangi bir nicel iSCAT ölçümünü önler. Özellikle, yeterince temizlenmemiş cam üzerindeki artık kir veya toz parçacıkları bile, doğal görüntüleme modunda parlak noktalar olarak tanınabilen kayda değer görüntü bozulmalarına neden olabilir (Şekil 7A). Bu kusurlar, statik doğaları nedeniyle arka plan tahmini ile giderilse de, bir parçacığın kontrastının doğru bir şekilde belirlenmesi bozulabilir ve bu nedenle nicel analizini olumsuz yönde etkileyebilir. MSPT deneylerinde karşılaşılan bir diğer yaygın sorun, görüş alanı boyunca yüzen (turuncu ile çevrelenmiş) kalan veziküller veya membran üzerinde belirli bir konumda sıkışmış (mavi ile çevrelenmiş) ve büyük titreşimli saçılımcılar olarak görünen kaynaşmamış veziküllerdir (Şekil 7B). Film edinimine olan oluşumlarını ve girişimlerini en aza indirmek için, proteini eklemeden önce SLB'yi iyice yıkamanız ve taze hazırlanmış küçük unilamellar veziküller (SUV'lar) ve iki değerli katyon karışımlarının kullanılması önerilir.
Kütleye duyarlı parçacık izleme deneylerinin tasarımı için dikkate alınması gereken bir faktör, membran arayüzü ile ilişkili makromoleküllerin yoğunluğudur. Membran üzerindeki yüksek parçacık yoğunlukları aslında iki nedenden dolayı sorunlara neden olabilir: i) Partikül algılamalarının ardışık çerçevelerden yörüngelere bağlanması belirsiz hale gelir ve bu nedenle hata olasılığını ve yanlış değerlendirilmiş difüzyon katsayılarını artırır. ii) Karşılık gelen PSF uyumlarının genliğinden çıkarılan parçacıkların kütlesi sistematik olarak hafife alınır ve statik arka plan sinyalinin dinamik parçacık sinyalinden ayrılması giderek zorlaştığı için kütle zirveleri genişler (Şekil 7C). Şu anda, MSPT videolarının elde edilmesi sürecinde veri kalitesinin görsel olarak değerlendirilmesi mevcut ticari mikroskoplarda zordur, çünkü edinme yazılımında uygulanan oranmetrik görünüm, burada ve referanslarda açıklanan medyan tabanlı algoritma yerine kütle fotometrisi21 için oluşturulan arka plan kaldırma işlemini kullanmaktadır24,25 (Şekil 7D) ). İniş moleküllerini kütle fotometrisinde görselleştirmek için kullanılan ortalama tabanlı sürekli arka plan kaldırma, yayılan parçacıkların parlak kuyruklara sahip karanlık cepheler olarak görünmesine neden olur, bu da lekelerin oldukça anizotropik görünmesini sağlar ve algılama prosedürü sırasında PSF uyumuna müdahale eder. Bu nedenle, elde etme yazılımında uygulanan ortalama tabanlı görüntü işlemenin kullanılması, membranlar üzerindeki difüzyon biyomoleküllerinin analizi için uygun değildir.
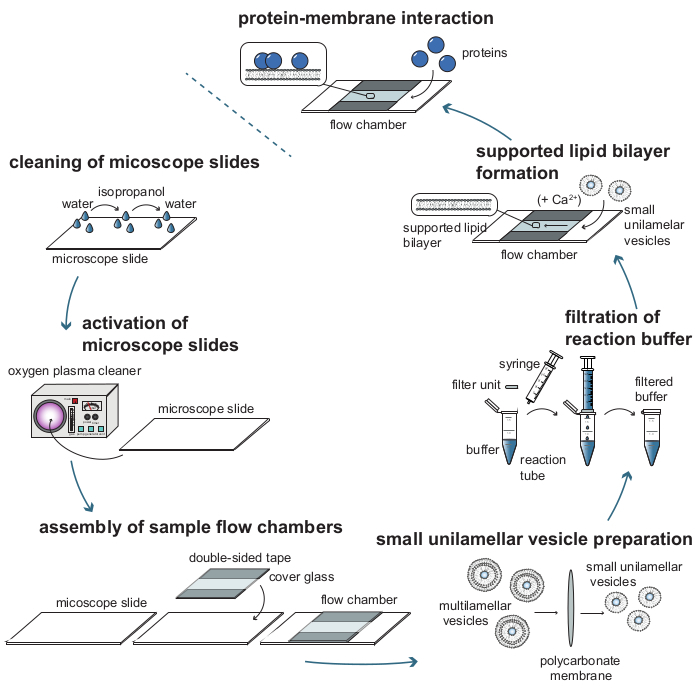
Şekil 1: Kütleye duyarlı parçacık izleme (MSPT) ile protein-membran etkileşimlerini analiz etmek için gereken bireysel adımların proses akış diyagramı. MSPT ölçümlerine numune hazırlamak için, cam kapak slaytları iyice temizlenmeli ve bir oksijen plazması ile etkinleştirilmelidir. Numune akış odalarına monte edildikten sonra, desteklenen lipit çift katmanlı (SLB) oluşumu için küçük unilamellar veziküller (SUV'lar) hazırlanır ve arka plan saçılımını azaltmak için tüm reaksiyon tamponları filtrelenir. SUV'lar, akış odalarında lipit çift katmanları oluşturmak için eklenir. İsteğe bağlı olarak, vezikül rüptürünü teşvik etmek için SUV'lara Ca2 + iyonları gibi iki değerli katyonlar eklenebilir. Sonunda, ilgilenilen proteinin düşük konsantrasyonları reaksiyon odasına yıkanır. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
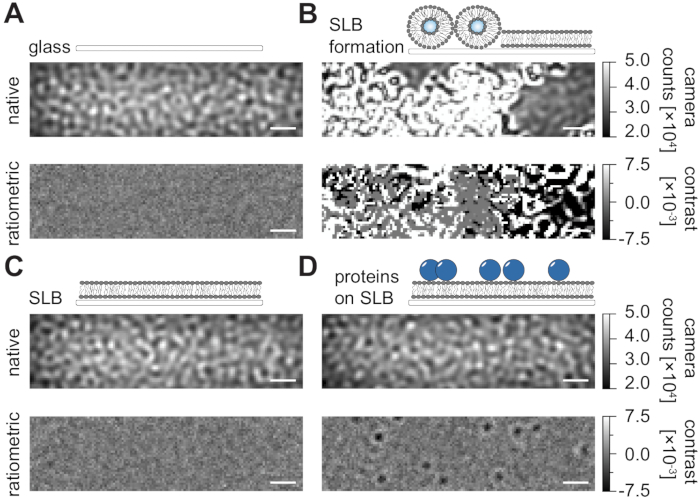
Şekil 2: MSPT ölçümleriyle ilgili örnek yüzeylerin doğal ve oranmetrik görünümü. Bir cam örtü slaytının (A) yüzey pürüzlülüğünün temsili görüntüleri, desteklenen bir lipit çift katmanının (B) oluşumu sırasında, sağlam bir desteklenen lipit çift katmanlı (C) ve bir SLB (D) üzerinde yeniden oluşturulan örnek proteinlerin oluşumu sırasında. Dört örneğin tümü, ölçümün kendisi sırasında erişilebilen yerel modda ve medyan tabanlı arka plan kaldırma işleminden sonra işlenmiş oranmetrik görüntüler olarak görüntülenir. Ölçek çubukları 1 μm'yi temsil eder. Veri analizi için (bkz. eşlik eden Jupyter not defteri; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1001. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
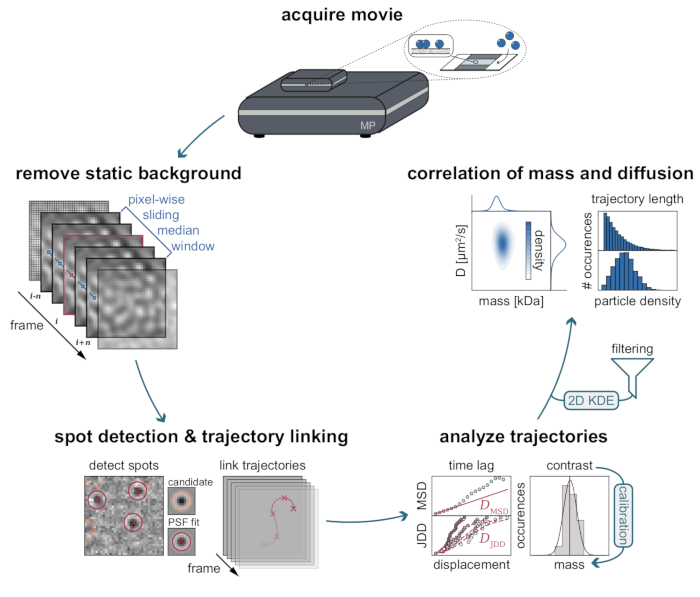
Şekil 3: MSPT veri toplama ve analizi için gereken aşamaların adım adım diyagramı. Kütle fotometresinde ilgilenilen örnek için veri toplanmasından sonra, filmler statik arka planı piksel bazında kayan medyan yaklaşımıyla kaldırmak için işlenir. Bundan sonra, aday parçacıklar, parçacık yörüngelerine bağlanmadan önce bir nokta yayılma fonksiyonu (PSF) ile tanımlanır ve takılır. Her parçacık için difüzyon katsayısının belirlenmesini sağlamak için, ortalama kare yer değiştirme (MSD) veya atlama mesafesi dağılımı (JDD) analizi kullanılır. Bu aşamada kontrast değerleri, kalibrasyon stratejisi ile belirlenen kontrast-kütle-ilişkisine göre moleküler kütlelere dönüştürülebilir. Son adım olarak, yörüngeler uzunluklarına veya membran parçacık yoğunluğuna göre filtrelenebilir ve iki boyutlu çekirdek yoğunluğu tahmini (2D-KDE) ile görselleştirilebilir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
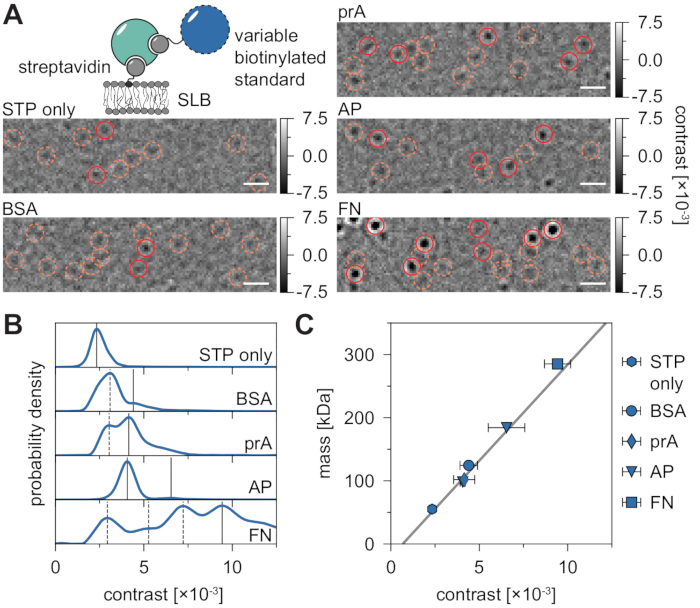
Şekil 4: MSPT ölçümleri için kütle-kontrast ilişkisinin kalibrasyonu. (A) Biyotinile lipitlerin küçük bir yüzdesini içeren desteklenen bir lipit çift katmanı üzerine yayılan örnek streptavidin standardı protein kompleksleri için elde edilen temsili oranmetrik çerçeveler (DOPC: DOPG: Biotinyl Cap PE oranı% 70: 29.99: 0.01 mol). Model moleküler ağırlık standartları olarak, biyotinile sığır serumalbümini (BSA), biyotinile protein A (prA), biyotinile alkalen alkalen fosfataz (AP) veya biyotinile fibronektin (FN) ile kompleks halinde monovalan streptavidin 28 (sadece STP) veya iki değerli streptavidin28 gösterilmiştir. Aday noktalar turuncu (kesikli daireler) ile vurgulanır ve başarılı parçacık algılamaları kırmızı (düz daireler) ile vurgulanır. Ölçek çubukları 1 μm. (B) Beş model standart protein için elde edilen kontrast değerlerinin olasılık yoğunluk dağılımlarını temsil eder. Görüntülenen tüm veriler, koşul başına üç bağımsız deneyin havuzlanmış dağılımlarını temsil eder: STP yalnızca n = 82.719; BSA n = 9.034; prA n = 22.204; AP n = 69.065 ve FN n = 71.759 yörünge. Proteinli membranlar için belirlenen partikül sayılarıyla karşılaştırıldığında, boş bir çift katmanda tespit edilen parçacık sayısı orta derecede membran yoğunluklarında ihmal edilebilir düzeydedir (Ek Şekil 1). Kütle kalibrasyonu için dikkate alınan kontrast zirveleri sürekli çizgilerle işaretlenirken, kesikli olanlar dikkate alınmayan oligomer durumlarını temsil eder. (C) Panel D'deki tepe kontrastlarından ve komplekslerin ilgili dizi kütlelerinden türetilen kontrast-kütle kalibrasyon eğrisi. Hata çubukları, önyükleme ile tahmin edilen en yüksek konumların standart hatasını görüntüler (her biri 1.000 yörüngeye sahip 100 yeniden örnekleme). Veri analizi için (bkz. Jupyter notebook; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1.001 kare, algılama eşiği (harman) = 0,00055, arama aralığı (dmax) = 4 piksel, bellek (max_frames_to_vanish) = 0 kare, minimum yörünge uzunluğu (minimum_trajectory_length) = 7 kare (yalnızca STP), 9 kare (BSA/FN), 15 kare (prA), 10 kare (AP). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
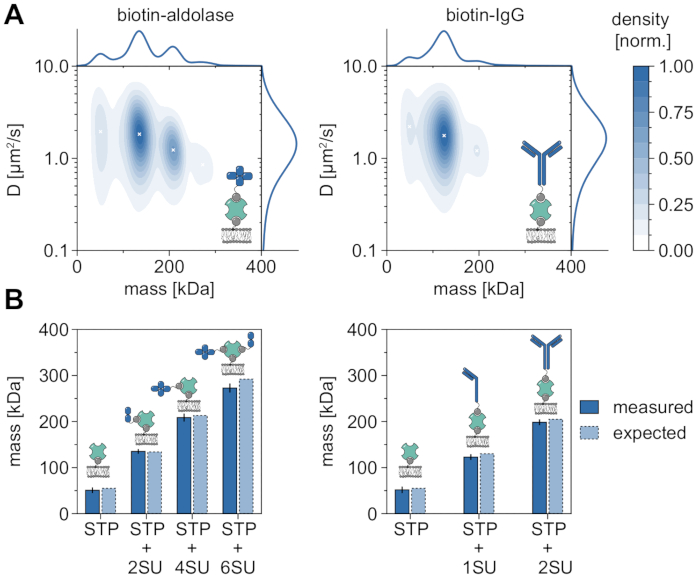
Şekil 5: Membranla ilişkili proteinlerin oligomer durumlarının deşifre edilmesi . (A) Biyotinile aldolaz (sol panel) veya biyotin modifiye edilmiş keçi anti-Tavşan IgG antikoru (sağ panel) ile kompleks halinde tetravalan streptavidinin hem kütlesinin hem de difüzyon katsayısının 2D çekirdek yoğunluğu tahminleri. Her iki kompleksin sulandırılması, DOPC, DOPG ve Biotinyl Cap PE içeren desteklenen bir lipit çift katmanı üzerinde sırasıyla% 70:29.99: 0.01 mol oranında gerçekleştirilmiştir. Toplamda, streptavidin-aldolaz kompleksi (0.1 μm-2 parçacık yoğunluğu) ve streptavidin-IgG kompoziti (0.1 μm-2 parçacık yoğunluğu) için 348.405 bağımsız replikanın 116.787 yörüngesi dahil edilmiştir. Sadece iz uzunluğu en az beş kare olan parçacıklar dahil edildi. Hem moleküler kütlenin (üstte) hem de difüzyon katsayısının (sağda) marjinal olasılık dağılımları sunulmuştur. Her iki paneldeki siyah x, KDE'nin ilgili yerel maksimumunu işaretler. (B) Tetravalan streptavidin kompleksi için biyotin modifiye aldolaz (sol panel) veya biyotinile IgG (sağ panel) kompleksi için belirlenen oligomer kütlelerinin, dizi kütlelerine göre beklenen moleküler ağırlıklarla karşılaştırılması. SU kısaltması, çıkarların proteini alt birimi adına tanıtılmıştır. Hata çubukları, önyükleme ile tahmin edilen en yüksek konumların standart hatasını görüntüler (her biri 1.000 yörüngeye sahip 100 yeniden örnekleme). Veri analizi için (bkz. eşlik eden Jupyter not defteri; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1.001 kare, algılama eşiği (harman) = 0,00055, arama aralığı (dmax) = 4 piksel, bellek (max_frames_to_vanish) = 0 kare, minimum yörünge uzunluğu (minimum_trajectory_length) = 5. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
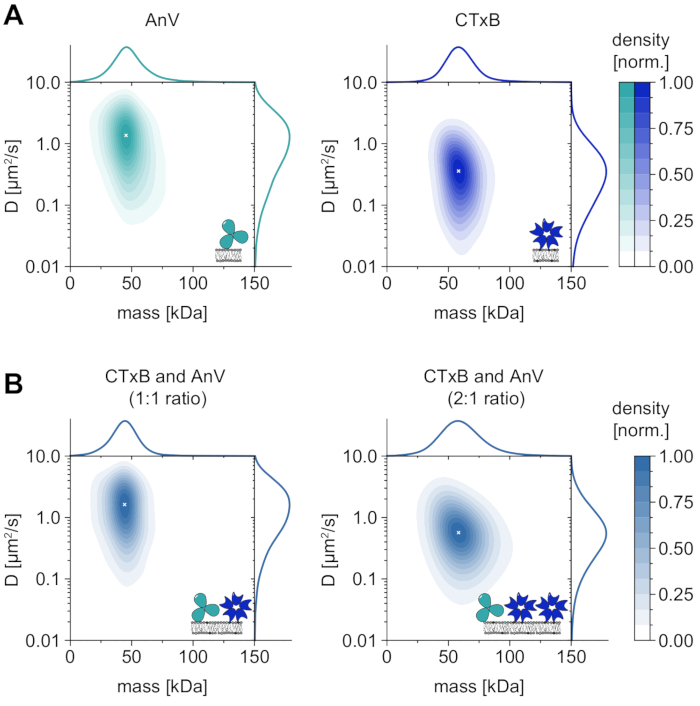
Şekil 6: Doğal membranla etkileşen proteinlerin ek V (AnV) ve kolera toksini alt birimi B'nin (CTxB) difüzyon davranışının çözülmesi. (A) Ek V (sol panel) ve kolera toksini alt birimi B'nin (sağ panel) hem kütle hem de difüzyon katsayısının 2D çekirdek yoğunluğu tahminleri. AnV ve CTxB membran sulandırması için, sırasıyla DOPS'a %80:20 mol DOPC ve GM1'e %99.99:0.01 mol DOPC lipid bileşimleri kullanılmıştır. AnV (0.1 μm-2 parçacık yoğunluğu) ve CTxB (0.2 μm-2 parçacık yoğunluğu) için toplam üç bağımsız replikanın 206.819 yörüngesi (0.2 μm-2 parçacık yoğunluğu) dahil edilmiştir. (B) CTxB ve AnV karışımlarının sırasıyla 1:1 (sol panel) veya 2:1 (sağ panel) oranında 2B çekirdek yoğunluğu tahminleri. Protein karışımlarının sulandırılması, DOPC, DOPS ve GM1 lipitleri içeren desteklenen bir lipit çift katmanı üzerinde% 80:19.99: 0.01 mol oranında gerçekleştirildi. 1:1 karışımı (0,1 μm-2 partikül yoğunluğu) için üç bağımsız replikanın toplam 42.696 yörüngesi ve 2:1 oranı (0,3 μm-2 parçacık yoğunluğu) için 264.561 yörünge dahil edilmiştir. Hem (A) hem de (B) için, yalnızca iz uzunluğu en az beş kare olan parçacıklar dahil edildi. Hem moleküler kütlenin (üstte) hem de difüzyon katsayısının (sağda) marjinal olasılık dağılımları sunulmuştur. Her paneldeki beyaz x, KDE'nin ilgili global maksimumunu gösterir. Veri analizi için (bkz. eşlik eden Jupyter not defteri; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1.001 kare, algılama eşiği (harman) = 0,00055, arama aralığı (dmax) = 4 piksel, bellek (max_frames_to_vanish) = 0 kare, minimum yörünge uzunluğu (minimum_trajectory_length) = 5. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
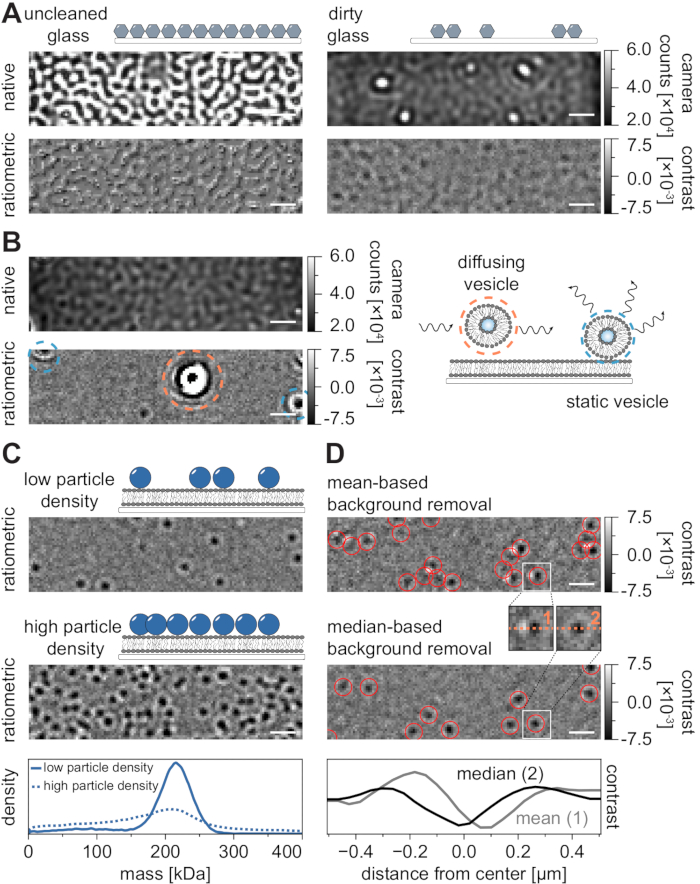
Şekil 7: MSPT ölçümleri sırasında veya veri analizi sırasında olası komplikasyonlar . (A) Temizlenmemiş bir kapak camı slaytının hem doğal hem de işlenmiş (medyan tabanlı arka plan kaldırma) oranmetrik görünümünde görüntülenen yüzey pürüzlülüğünün temsili görüntüleri. Her iki durumda da, parlak noktalar, artefaktsız ölçümleri engelleyen artık yüzey safsızlıklarını oluşturur. (B) Yetersiz membran yıkamasından sonra görüş alanındaki artık veziküllerin örnek görüntüleri. Hem statik (mavi renkle vurgulanmış) hem de dağınık (turuncu renkle vurgulanmış) veziküller, sırasıyla titreşim ve kıpırdanma veya yönlü hareketleri nedeniyle ölçüm kalitesini bozacaktır. (C) Tek parçacıklı bir teknik olarak MSPT, her parçacığın uygun şekilde bağlanmasını ve kütle tayini sağlamak için düşük parçacık yoğunlukları (temsili görüntü, üst panel) gerektirir. Yüksek membran-partikül yoğunlukları (orta panel) durumunda, kütle tayinini etkileyen partikül uyumu bozulur (bkz. alt panel). (D) Ortalama tabanlı (üst panel) veya medyan tabanlı arka plan çıkarılmasından sonra bir membran arayüzüne yayılan parçacıkların temsili oranmetrik görüntüleri. Parçacıkları dağıtmak için, ortalama tabanlı arka plan kaldırma stratejisi, üst ve orta panel arasındaki küçük iç kısımlarda görülebileceği gibi, parçacığın PSF'sinin bozuk görüntülerini üretir. Buna karşılık, bozulmamış parçacık PSF'leri medyan tabanlı yaklaşımla elde edilebilir. Alt panel: Ortalama veya medyan tabanlı arka plan kaldırma işleminden sonra elde edilen PSF'nin ortasından çizgi profillerinin karşılaştırılması. Bu şekilde görüntülenen tüm yerel ve oranmetrik görüntüler için, ölçek çubukları 1 μm'yi temsil eder. Veri analizi için (bkz. eşlik eden Jupyter not defteri; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1.001 kare, algılama eşiği (harman) = 0,00055, arama aralığı (dmax) = 4 piksel, bellek (max_frames_to_vanish) = 0 kare, minimum yörünge uzunluğu (minimum_trajectory_length) = 5. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Ek Şekil 1: Proteinsiz ve işgal edilmiş membranların karşılaştırılması. Saflaştırılmış streptavidin (STP) ilavesinden önce (A) ve sonra (B) sağlam bir desteklenen lipit çift katmanının temsili görüntüleri. PSF modeline başarıyla uyan aday noktalar kırmızı renkle çevrilidir. (C) Boş bir zarda (membran arka planı, gri) ve yayılan streptavidin parçacıkları (mavi) olan bir çift katmanda tespit edilen parçacıkların kontrast olasılık dağılımları. Her iki olasılık dağılımı da aynı film toplama ve analiz parametrelerine sahip üç bağımsız deneyin havuzlanmış verilerini temsil eder. Veri analizi için (bkz. eşlik eden Jupyter not defteri; adım 9), aşağıdaki parametreler kullanılmıştır: medyan pencere boyutu (window_length) = 1.001 kare, algılama eşiği (harman) = 0,00055, arama aralığı (dmax) = 4 piksel, bellek (max_frames_to_vanish) = 0 kare, minimum yörünge uzunluğu (minimum_trajectory_length) = 7 kare. Bu Dosyayı indirmek için lütfen tıklayınız.
Ek Film 1: Veziküllerin kopmasını ve kütle fotometresi ile kaydedilen homojen bir zara kaynaşmasını gösteren örnek film. Görüntü işleme medyan pencere boyutu (window_length) = 1.001 kare. Ölçek çubuğu: 1 μm. Kamera sayım aralığı: siyah = 16.892; beyaz = 65.408. Bu Filmi indirmek için lütfen tıklayınız.
Ek Film 2: MSPT ölçümlerinden elde edilen ek V (üst) ve biyotinillenmiş aldolaz (alt) komplekslerinin bir çift katman üzerinde difüzyonunu gösteren örnek filmler. Görüntü işleme medyan pencere boyutu (window_length) = 1.001 kare. Ölçek çubuğu: 1 μm. İnterferometrik saçılma kontrast aralığı: siyah = -0,0075; beyaz = 0.0075. Bu Filmi indirmek için lütfen tıklayınız.
Tartışmalar
Sunulan protokol, cam üzerinde adsorbe olan tek biyomoleküllerin kütlesini analiz eden bir teknik olan kütle fotometrisi21'i, etiketlenmemiş membranla etkileşime giren biyomoleküllerin kütlesini ve difüzyonunu aynı anda ölçebilen daha çok yönlü bir araca genişletmektedir. Bu analiz uzantısı, moleküllerin yanal hareketine uyarlanmış değiştirilmiş bir arka plan kaldırma stratejisinin uygulanmasıyla elde edilir24,25. Genel olarak, cam yüzey pürüzlülüğünün güçlü saçılması ana analiz engelini temsil ettiğinden ve her pikselin yerel arka planının doğru bir şekilde belirlenmesi, parçacık kütlesinin ve konumunun ölçülmesi için gerekli olduğundan, iSCAT tabanlı yaklaşımlar için arka planın kaldırılması son derece önemlidir. Partikül hareketine uyarlanmış görüntü analizinin yanı sıra, müteakip parçacık algılama, yörünge bağlantısı ve veri analizi, MP'nin kütleye duyarlı parçacık izlemesine (MSPT) yeni genişlemesini tamamlar.
Genel olarak, iyice temizlenmiş cam kapak slaytları ve temiz bir çalışma ortamı, MSPT deneylerinin başarılı bir şekilde gerçekleştirilmesi için kritik gereksinimlerdir. Makromolekül etiketlemesinin yokluğu nedeniyle, elde edilen sinyal doğal olarak seçici değildir. Bu nedenle, temiz numunelerin yanı sıra uygun numune işleme, gözlemlerin yanlış yorumlanmamasını sağlamak için çok önemlidir. Özellikle, düşük moleküler ağırlıklı moleküller incelendiğinde, arka plan katkılarını değerlendirmek için proteinsiz membranların kontrol ölçümleri onaylanmıştır (Ek Şekil 1). Bu nedenle, kontrol ölçümlerinin dahil edilmesinin yanı sıra, her akış odası için Şekil 2'de gösterilen hazırlık adımlarının izlenmesi önerilir. Birleştirildiğinde, bu güvenlik önlemleri, tespit edilen sinyalin, örneğin kontamine bir akış odası, tampon veya membrandan değil, ilgili biyomolekülden kaynaklanmasını sağlayacaktır.
Deneysel tasarıma ilişkin önlemlerin yanı sıra, MSPT görüntü işleme sırasında da dikkatli olunmalıdır. Video işleme sırasında, doğru sonuçları sağlamak için üç parametrenin değeri dikkatlice seçilmelidir: i) arka planın kaldırılması için medyan pencerenin uzunluğu, ii) parçacık algılama eşiği ve iii) bağlantı ataması sırasında maksimum arama yarıçapı. Daha büyük bir medyan pencere (i) genellikle dağınık parçacıkların üst üste bindirilmiş yarı-sabit arka plandan ayrılmasını kolaylaştırır. Bununla birlikte, çok büyük pencere boyutları için örnek kayması sonunda fark edilir hale gelir ve arka plan tahmininin doğruluğunu azaltır. Optimum ayarlar büyük ölçüde numune özelliklerine ve ölçüm koşullarına bağlıdır. Bununla birlikte, 1.001'lik bir değer sağlam bir başlangıç noktası olarak kullanılabilir. Eşik parametresi (ii), numunede beklenen en düşük moleküler kütleye bağlı olarak ayarlanmalıdır. Bu çalışmada kullanılan kütle fotometresi ile alınan ölçümler için 0.0005'in altında bir değer önerilmemektedir. Analiz sürelerini hızlandırmak için, yüksek moleküler ağırlığa sahip bir numune bekleniyorsa daha yüksek değerler seçilebilir. Yörünge bağlantısındaki arama yarıçapı (iii), parçacığın kaydırılan konumunun ardışık karelerde aranacağı piksel cinsinden maksimum radyal mesafeyi belirtir. Numunedeki en hızlı parçacığa uyarlanmalıdır ve tercih edilirse, hesaplama süresini azaltmak için uyarlanabilir bir arama aralığı ( trackpy belgelerine bakın) kullanılabilir. Özellikle bir projenin ilk aşamasında, elde edilen sonuçları doğrulamak için filmlerin değişen parametrelerle yeniden analiz edilmesi önerilir.
MSPT'nin tek moleküllü doğası ışığında, yüksek membran parçacık yoğunluklarında ölçüm yapmaktan kaçınılmalıdır, çünkü bunlar doğru kontrast ve kütle tayinine müdahale edebilir. Kare mikrometre başına bir parçacığın altındaki yoğunlukların MSPT ölçümleri için elverişli olduğu gösterilmiştir24. Ek bir husus, numunede beklenen difüzyon katsayılarıdır. Çok çeşitli difüzyon katsayılarına uygulanabilir olmasına rağmen, MSPT erişilebilir difüzyon katsayılarının daha düşük bir sınırına sahiptir. Medyan pencere periyodunun önemli bir bölümünde birkaç piksellik bir bölgeye yerel olarak hapsedilme, parçacığı statik arka planla birleştirir. Bu protokolde kullanılan görüntüleme koşulları için, 0.01 μm2/s'nin altındaki difüzyon katsayılarının ölçülmesi önerilmez. Bu difüzyon hızında, örneğin, medyan pencere yarım boyutu sırasında bir parçacığın ortalama kare yer değiştirmesi yaklaşık 4 pikseldir ve bu nedenle PSF'nin kapsamı ile benzer boyuttadır. Sonuç olarak, statik arka plan tahmininin, parçacığın kendisinden gelen sinyal katkılarını içermesi muhtemeldir, bu da sonunda gürültü seviyesine yaklaşana kadar parçacığın görünüşte azaltılmış bir kontrastı ile sonuçlanır. Bununla birlikte, 0.05 ila 10 μm2 / s arasında değişen makromolekül difüzyon katsayıları açıkça çözülebilir.
MSPT uygulamalarının aralığını daha da genişletmek için, geçici olarak bir parçacıkla işgal edilen piksellerin ortadan kaldırılması veya daha büyük medyan pencere boyutlarına olanak tanıyan örnek sürüklenme düzeltmesi yoluyla medyan tabanlı arka plan algoritmasının ilerlemesi öngörülebilir. Her iki yaklaşım da yüksek parçacık yoğunluklarında ve yavaş difüzyonda ölçümlerle ilgili sorunları hafifletecektir. Düşük kütle duyarlılığı açısından gelişmeler, 50 kDa'dan daha küçük biyomoleküllere erişim sağlayabilecek yeni nesil kütle fotometreleri ile ufuktadır. Bu nedenle, gelecekteki MSPT deneyleri, yastıklı çift katmanlar ve makromoleküler sistemler gibi daha geniş bir membran taklitleri yelpazesi için tek moleküllü dinamikleri ve membranla ilgili etkileşimleri inceleyebilecektir.
Açıklamalar
Yazarların çıkar çatışması yoktur.
Teşekkürler
Philipp Kukura, Gavin Young ve Refeyn yazılım ekibinin desteğini içtenlikle takdir ediyor ve görüntü analiz kodunun bazı bölümlerini paylaşarak yardımlarını kabul ediyoruz. Ticari Refeyn kütle fotometresine erişim sağladığı için Cryo-EM MPIB Çekirdek Tesisi'ne teşekkür ederiz. F.S., Jürgen Plitzko ve Wolfgang Baumeister tarafından verilen destek ve finansmanı minnetle kabul eder. T.H. ve PS, Deutsche Forschungsgemeinschaft (DFG, Alman Araştırma Vakfı) - Proje Kimliği 201269156 - SFB 1032 (A09) aracılığıyla finansman aldı. N.H., DFG iade hibesi HU 2462/3-1 tarafından desteklenmiştir. Not: Alman Federal Eğitim ve Araştırma Bakanlığı (BMBF) ve Max Planck Derneği'nin ortak finansman girişimi aracılığıyla MaxSynBio araştırma ağı aracılığıyla desteği kabul ediyor.
Malzemeler
| Name | Company | Catalog Number | Comments |
| annexin V | Sigma Aldrich | #SRP8026 | examplary membrane-interacting protein |
| Bio-Rad Protein Assay | Bio-Rad Laboratories Inc. | #5000006 | bradford assay kit to determine protein stock concentrations |
| biotin labeled bovine albumin | Sigma Aldrich | #A8549 | examplary protein that can be used as standard protein for MSPT |
| cholera toxin subunit B | Sigma Aldrich | #SAE0069 | examplary membrane-interacting protein |
| cover glasses, #1.5, 24 x 24 mm | Paul Marienfeld GmbH & Co. KG | #0102062 | |
| cover glasses, #1.5, 24 x 60 mm | Paul Marienfeld GmbH & Co. KG | #0102242 | |
| dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | #850375 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoethanolamine-N-cap biotinyl (18:1 Biotinyl Cap PE | Avanti Polar Lipids | #870273 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoglycerol (DOPG) | Avanti Polar Lipids | #840475 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) | Avanti Polar Lipids | #840035 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| double-sided tape | tesa | #57912-00000-02 | needed for the assembly of glass sample chambers |
| Extruder | Avanti Polar Lipids | #610023 | Lipid extruder to enable monodisperse vesicle distributions |
| EZ-Link Maleimide-PEG2-Biotin | Thermo Fisher Scientific | #A39261 | maileimide-fused biotin that can be used to biotinylate standard proteins for MSPT |
| Fibronectin (Biotinylated) | Cytoskeleton Inc. | #FNR03-A | examplary protein that can be used as standard protein for MSPT |
| Gel Filtration HMW Calibration Kit | Cytiva | #28403842 | standard proteins, e.g. aldolase that can be biotinylated and used as molecular weight standards for MSPT |
| GM1 Ganglioside (Brain, Ovine-Sodium Salt) | Avanti Polar Lipids | #860065 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Biotin | Thermo Fisher Scientific, Waltham, USA) | #31820 | examplary protein to highlight the existence of different protein states |
| Isopropanol, 99.5%, for spectroscopy | Thermo Fisher Scientific | #10003643 | |
| Low Autofluorescence Immersion Oil | Olympus K.K. | #IMMOIL-F30CC | |
| pET21a-Streptavidin-Alive | Addgene | #20860 | required to express and purify divalent streptavidin in combination with each other |
| pET21a-Streptavidin-Dead | Addgene | #20859 | required to express and purify divalent streptavidin in combination with each other |
| Pierce Alkaline Phosphatase, biotinylated | Thermo Fisher Scientific | #29339 | examplary protein that can be used as standard protein for MSPT |
| Pierce Protein A, Biotinylated | Thermo Fisher Scientific | #29989 | examplary protein that can be used as standard protein for MSPT |
| Refeyn Acquire | Refeyn Ltd. | control software for Refeyn OneMP | |
| Refeyn One | Refeyn Ltd. | - | mass photometer |
| sterile syringe filters 0.45 µm cellulose acetate membrane | VWR International | #514-0063 | needed to filter particles from the buffer of interest |
| tetravalent streptavidin | Thermo Fisher Scientific | #SNN1001 | tetravalent streptavidin to enable the presence of several biotin binding sites |
| Whatman Nuclepore Hydrophilic Membrane, 0.05 µm Pore Size, 25 mm Circle | Cytiva | #110603 | a pore size of 50 nm is recommended for supported lipid bilayer formation in the context of MSPT |
| Zepto model 2 plasma cleaner | Diener electronic GmbH | - |
Referanslar
- Robertson, J. L. The lipid bilayer membrane and its protein constituents. Journal of General Physiology. 150 (11), 1472-1483 (2018).
- Grecco, H. E., Schmick, M., Bastiaens, P. I. H. Signaling from the Living Plasma Membrane. Cell. 144 (6), 897-909 (2011).
- Cho, W., Stahelin, R. V. Membrane-protein interactions in cell signaling and membrane trafficking. Annual Review of Biophysics and Biomolecular Structure. 34, 119-151 (2005).
- Whited, A. M., Johs, A. The interactions of peripheral membrane proteins with biological membranes. Chemistry and Physics of Lipids. 192, 51-59 (2015).
- Gonzalez, L., Scheller, R. H. Regulation of membrane trafficking: Structural insights from a Rab/effector complex. Cell. 96 (6), 755-758 (1999).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- Bagheri, Y., Ali, A. A., You, M. Current methods for detecting cell membrane transient interactions. Frontiers in Chemistry. 8, 603259(2020).
- Miller, H., Zhou, Z., Shepherd, J., Wollman, A. J. M., Leake, M. C. Single-molecule techniques in biophysics: A review of the progress in methods and applications. Reports on Progress in Physics. 81 (2), 024601(2018).
- Manzo, C., Garcia-Parajo, M. F. A review of progress in single particle tracking: From methods to biophysical insights. Reports on Progress in Physics. 78 (12), 124601(2015).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331 (6155), 450-453 (1988).
- Funatsu, T., Harada, Y., Tokunaga, M., Saito, K., Yanagida, T. Imaging of single fluorescent molecules and individual ATP turnovers by single myosin molecules in aqueous solution. Nature. 374 (6522), 555-559 (1995).
- Schmidt, T., Schütz, G. J., Baumgartner, W., Gruber, H. J., Schindler, H. Imaging of single molecule diffusion. Proceedings of the National Academy of Sciences of the United States of America. 93 (7), 2926-2929 (1996).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Kukura, P., et al. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405(2006).
- Ueno, H., et al. Simple dark-field microscopy with nanometer spatial precision and microsecond temporal resolution. Biophysical Journal. 98 (9), 2014-2023 (2010).
- Loose, M., Fischer-Friedrich, E., Herold, C., Kruse, K., Schwille, P. Min protein patterns emerge from rapid rebinding and membrane interaction of MinE. Nature Structural and Molecular Biology. 18 (5), 577-583 (2011).
- Bezeljak, U., Loya, H., Kaczmarek, B., Saunders, T. E., Loose, M. Stochastic activation and bistability in a Rab GTPase regulatory network. Proceedings of the National Academy of Sciences of the United States of America. 117 (12), 6504-6549 (2020).
- Ha, T., Tinnefeld, P. Photophysics of fluorescent probes for single-molecule biophysics and super-resolution imaging. Annual Review of Physical Chemistry. 63 (1), 595-617 (2012).
- Garcia-Parajo, M. F., Segers-Nolten, G. M. J., Veerman, J. A., Greve, J., Van Hulst, N. F. Real-time light-driven dynamics of the fluorescence emission in single green fluorescent protein molecules. Proceedings of the National Academy of Sciences of the United States of America. 97 (13), 7237-7242 (2000).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495(2014).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Heermann, T., Steiert, F., Ramm, B., Hundt, N., Schwille, P. Mass-sensitive particle tracking to elucidate the membrane-associated MinDE reaction cycle. Nature Methods. 18 (10), 1239-1246 (2021).
- Foley, E. D. B., Kushwah, M. S., Young, G., Kukura, P. Mass photometry enables label-free tracking and mass measurement of single proteins on lipid bilayers. Nature Methods. 18 (10), 1247-1252 (2021).
- Voss, O. H., Lee, H. N., Tian, L., Krzewski, K., Coligan, J. E. Liposome preparation for the analysis of lipid-receptor interaction and efferocytosis. Current Protocols in Immunology. 120, 1-21 (2018).
- Pincet, F., et al. FRAP to characterize molecular diffusion and interaction in various membrane environments. PLoS ONE. 11 (7), 0158457(2016).
- Howarth, M., et al. A monovalent streptavidin with a single femtomolar biotin binding site. Nature Methods. 3 (4), 267-273 (2006).
- Allan, D., et al. soft-matter/trackpy: Trackpy v.0.5.0. Zenodo. , (2021).
- Weimann, L., et al. A quantitative comparison of single-dye tracking analysis tools using Monte Carlo simulations. PLoS ONE. 8 (5), 64287(2013).
- Michalet, X. Mean square displacement analysis of single-particle trajectories with localization error: Brownian motion in an isotropic medium. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 82 (4), 041914(2010).
- Sygusch, J., Beaudry, D., Allaire, M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution. Proceedings of the National Academy of Sciences of the United States of America. 84 (22), 7846-7850 (1987).
- Heath, G. R., Scheuring, S. High-speed AFM height spectroscopy reveals µs-dynamics of unlabeled biomolecules. Nature Communications. 9 (1), 4983(2018).
- Day, C. A., Kenworthy, A. K. Mechanisms underlying the confined diffusion of cholera toxin B-subunit in intact cell membranes. PLOS ONE. 7 (4), 34923(2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır