Method Article
Массочувствительное отслеживание частиц для характеристики мембраноассоциированной динамики макромолекул
В этой статье
Резюме
Этот протокол описывает подход к обработке изображений на основе iSCAT и отслеживанию одной частицы, который позволяет одновременно исследовать молекулярную массу и диффузное поведение макромолекул, взаимодействующих с липидными мембранами. Пошаговые инструкции по подготовке образцов, преобразованию массы в контраст, получению фильмов и постобработке приведены вместе с инструкциями по предотвращению потенциальных ловушек.
Аннотация
Кратковременные или переходные взаимодействия макромолекул на липидных мембранах и с ними, интерфейс, где происходит множество существенных биологических реакций, по своей природе трудно оценить стандартными биофизическими методами. Внедрение массочувствительного отслеживания частиц (MSPT) представляет собой важный шаг на пути к тщательной количественной характеристике таких процессов. Технически это стало возможным благодаря появлению интерферометрической рассеивающей микроскопии (iSCAT) на основе массовой фотометрии (MP). Когда стратегия удаления фона оптимизирована для выявления двумерного движения частиц, связанных с мембраной, этот метод позволяет в режиме реального времени анализировать как диффузию, так и молекулярную массу немаркированных макромолекул на биологических мембранах. Здесь описан подробный протокол выполнения и анализа массочувствительного отслеживания частиц мембранно-ассоциированных систем. Измерения, выполняемые на коммерческом массовом фотометре, достигают временного разрешения в миллисекундном режиме и, в зависимости от системы MP, предела обнаружения массы до 50 кДа. Чтобы продемонстрировать потенциал MSPT для углубленного анализа динамики макромолекул, катализируемых мембраной в целом, представлены результаты, полученные для образцовых белковых систем, таких как нативный мембранный интеракторный аннексин V.
Введение
Когда-то просто воспринимаемые как барьер против широкого спектра физических условий окружающей среды, биологические мембраны в настоящее время считаются функциональными сущностями и каталитическими платформами 1,2. Основываясь на своей способности локализовать, усиливать и направлять сигналы в ответ на мембранно-ассоциированные макромолекулярные реакции, липидные интерфейсы представляют собой важнейший элемент для широкого спектра клеточных процессов, таких как мембранный трафик и сигнальные каскады 3,4,5. Служа местом зарождения для сборки стабильных комплексов, прикрепление мембраны часто опирается на динамическое равновесие между мембраноассоциированной и цитозольной формами макромолекул и, следовательно, имеет переходную природу 6,7.
Несмотря на их большое значение в биологии, до сих пор было сложно разработать методы, которые могут обеспечить доступ к композиционным, пространственным и временным неоднородностям мембранно-ассоциированных макромолекулных реакций в режиме реального времени 7,8. Для разрешения лежащих в основе молекулярных процессов решающее значение имеют два экспериментальных аспекта: достаточное разрешение по времени и чувствительность к одной частице. Таким образом, методы ансамблевого среднего уровня, такие как восстановление флуоресценции после фотоотбеливания (FRAP), а также гораздо более чувствительная флуоресцентная корреляционная спектроскопия (FCS), имеют ограничения, поскольку они в значительной степени отделяют пространственную информацию от временной информации9. Таким образом, важным шагом на пути к характеристике динамики отдельных молекул стало появление отслеживания одной частицы (SPT) в сочетании с высокочувствительной микроскопией. В частности, два подхода ППП доказали свою эффективность в этом отношении. Во-первых, использование флуорофоров в качестве меток и соответствующих систем обнаружения флуоресценции проложило путь к нанометровой точности и миллисекундному временному разрешению 10,11,12. Во-вторых, обнаружение на основе рассеяния с использованием наночастиц золота улучшило как точность локализации, так и временное разрешение до субнанометрового и микросекундного диапазона соответственно 13,14,15,16. Несмотря на многочисленные преимущества обоих подходов и их значительный вклад в механистическое понимание мембраноассоциированных систем17,18, оба метода до сих пор были ограничены: они требуют маркировки интересующих молекул, что потенциально нарушает их собственное поведение и нечувствительно к молекулярному составу мембраноассоциированных частиц19,20.
Оба эти ограничения были недавно преодолены введением нового подхода на основе интерферометрического рассеяния (iSCAT), называемого массовой фотометрией (MP)21,22,23. Этот метод позволяет определить распределение массы биомолекул в растворе в соответствии с их контрастностью iSCAT при посадке на стеклянную границу. Однако для обнаружения и характеристики подвижных молекул, диффундирующих на липидных мембранах, необходимо было разработать более сложный подход к анализу изображений. Это тем временем успешно реализовано и позволяет обнаруживать, отслеживать и определять молекулярную массу одиночных немаркированных биомолекул, диффундирующих на липидном интерфейсе24,25. Этот метод, называемый динамической массовой фотометрией или массочувствительным отслеживанием частиц (MSPT), теперь позволяет оценивать сложные макромолекулярные взаимодействия путем непосредственной регистрации изменений молекулярной массы отслеживаемых объектов и, следовательно, открывает новые возможности для механистического анализа молекулярной динамики, связанной с мембраной.
Здесь представлен подробный протокол подготовки образцов, визуализации и конвейера анализа данных, необходимых для MSPT. В частности, обсуждаются требования к образцам и потенциальные проблемы, которые могут возникнуть во время измерения и анализа. Кроме того, беспрецедентный потенциал для анализа мембранно-взаимодействующих макромолекулярных систем демонстрируется различными репрезентативными результатами.
протокол
1. Пробоподготовка
- Генерация многоламелярных везикул (MLV)
- Рассчитайте количество растворенных хлороформом липидов в соответствии с желаемой липидной смесью и требуемым объемом суспензии.
ПРИМЕЧАНИЕ: Конечная концентрация везикул 4 мг/мл липидов рекомендуется для буфера ресуспензии (реакции). - Пипетка расчетного объема липидов в стеклянный флакон объемом 1,5 мл с помощью пипеток с положительным смещением, оснащенных стеклянными наконечниками.
- Испаряйте липидный растворитель под слабым потоком азота и постоянно вращайте флакон, чтобы обеспечить равное распределение липидов на стеклянных стенках.
- Обеспечьте полное испарение растворителя, поместив флакон под постоянный поток азота в течение 15 минут.
- Удалите остаточные следы хлороформа методом вакуумной сушки в вакуумном осушителе в течение дополнительного часа.
- Регидратируйте липидную смесь в желаемом буфере ресуспензии (реакции) и тщательно вращайте суспензию до тех пор, пока липидная пленка не будет растворена со стенок флакона.
ПРИМЕЧАНИЕ: Реакционный буфер должен обеспечивать активность и стабильность белка. Реакционный буфер, используемый в этом исследовании, содержит 50 мМ Tris-HCl (pH = 7,5), 150 мМ KCl и 5 мМMgCl2. Обратите внимание, что любой буфер, используемый для разбавления липидов или белков, должен быть отфильтрован для удаления мешающих примесей твердых частиц (см. шаг 5).
- Рассчитайте количество растворенных хлороформом липидов в соответствии с желаемой липидной смесью и требуемым объемом суспензии.
- Генерация малых одноламеллярных везикул (внедорожников)
- Для последовательных циклов замораживания-оттаивания липидной ресуспензии (стадия 1.1.6) вскипятите 500 мл воды в стакане на конфорке (от 70 °C до 99 °C) и подготовьте контейнер с жидким азотом.
- Шок-замораживание липидной ресуспензии в жидком азоте. Переложите флакон в стакан с горячей водой до полного размораживания раствора. Повторите этот цикл замораживания-оттаивания 8-10 раз или до тех пор, пока ранее мутная смесь не станет прозрачной.
ВНИМАНИЕ: Используйте надлежащую защитную одежду и оборудование, такое как очки, перчатки и пинцет, чтобы предотвратить любой прямой контакт с жидким азотом, замороженным липидным флаконом или кипятком. - Для получения монодисперсного везикулярного распределения соберите липид-экструдер и проверьте его целостность с помощью реакционного буфера, чтобы убедиться, что он не протекает.
ПРИМЕЧАНИЕ: Если наблюдается утечка, тщательно соберите липидный экструдер до тех пор, пока не будет обнаружено разлива буфера. - Экструдировать липидную суспензию в течение 37 проходит через нуклеопоральную мембрану с размером пор 50 нм26. Количество проходов должно быть неравномерным, чтобы гарантировать, что конечная смесь SUV пересекла нуклеопоральную мембрану и, следовательно, не содержит липидных агрегатов или многоламеллярных везикул. Экструдированные везикулы будут использоваться позже для образования поддерживаемых липидных бислоев (см. шаги 6 и 7).
ПРИМЕЧАНИЕ: Внедорожники также могут быть образованы ультразвуком регидратированной липидной смеси. Однако подготовка путем экструзии обеспечивает более монодисперсное распределение внедорожников, что облегчает разрыв пузырьков во время образования поддерживаемого липидного бислоя. Экструдированные везикулы можно хранить в холодильнике максимум 3 дня.
2. Очистка слайдов микроскопа
- Распределите равное количество слайдов микроскопа (No 1,5; толщина 0,17 мм) с размерами 24 мм х 60 мм и 24 мм х 24 мм в держателях для микроскопов из политетрафторэтилена (PTFE).
- Переложите держатели ptfe в стаканы, содержащие сверхчистую воду, и храните их ультразвуком в течение 15 минут при комнатной температуре.
ПРИМЕЧАНИЕ: В зависимости от стакана, объем воды должен быть отрегулирован, чтобы полностью покрыть держатель PTFE. - Используйте пинцет, чтобы снять держатели с стакана и заменить воду сверхчистым изопропанолом. Вставьте держатель в стакан, содержащий изопропанол, и снова обжайте ультразвуком в течение 15 минут.
ПРИМЕЧАНИЕ: В зависимости от стакана, объем изопропанола должен быть отрегулирован, чтобы полностью покрыть держатель PTFE. - Замените изопропанол сверхчистой водой и обработайте стакан, содержащий держатели, ультразвуком в течение 15 мин.
- Извлеките держатели из PTFE из стаканов и высушите феном предметные стекла микроскопа в держателе под постоянным потоком газообразного азота или сжатого воздуха.
ПРИМЕЧАНИЕ: Обеспечьте надлежащую очистку горок крышки, используя перчатки, чистые стаканы и парафиновую пленку, чтобы покрыть каждый стакан. В противном случае остаточная пыль может вызвать значительные фоновые колебания во время измерений MSPT.
3. Гидрофилизация предметных стекол микроскопа
ПРИМЕЧАНИЕ: Для получения однородного и поддерживаемого жидкостью липидного бислоя гидрофилизация слайдов необходима и должна проводиться непосредственно перед сборкой проточной камеры.
- Поместите держатели PTFE, содержащие только слайды микроскопа размером 24 мм х 60 мм, в плазмоочиститель с кислородом в качестве технологического газа и очистите слайды микроскопа плазмой (параметры, используемые в этой работе: мощность 30%, давление кислорода 0,3 мбар в течение 30 с; см. Таблицу материалов для деталей используемого плазмоочистителя).
ПРИМЕЧАНИЕ: Для получения жидких мембран параметры плазменной очистки, такие как мощность, давление кислорода и время очистки, должны быть отрегулированы для каждого прибора. С этой целью рекомендуется использовать флуоресцентно меченые липиды для обеспечения текучести мембраны, которая может быть количественно определена с помощью восстановления флуоресценции после экспериментов по фотоотбеливанию (FRAP)27. Если параметры не оптимизированы для соответствующей установки, мембранная диффузия может быть нарушена из-за снижения текучести мембраны.
4. Сборка проточных камер
- Перед сборкой проточной камеры держите наготове следующие компоненты: очищенные слайды микроскопа (24 мм x 24 мм), слайды гидрофилизированного микроскопа (24 мм x 60 мм), алюминиевая фольга, плоский картон, скальпель и двусторонняя лента.
- Оберните плоский картон алюминиевой фольгой.
- Распределите очищенные слайды микроскопа размером 24 мм х 24 мм на алюминиевую фольгу с достаточным расстоянием между собой.
- Прикрепите двусторонние ленточные полоски к верхнему и нижнему краям слайдов.
- Иссейте каждый слайд микроскопа скальпелем, чтобы его можно было извлечь из алюминиевой фольги. В результате каждый слайд должен иметь полосы двусторонней ленты, прикрепленные к верхнему и нижнему краям слайда (см. Рисунок 1).
- Прикрепите затвор размером 24 мм x 24 мм двумя двусторонними ленточными полосами к гидрофилизированному слайду размером 24 мм x 60 мм, чтобы сформировать траекторию потока между меньшими и большими предметными стеклами микроскопа.
ПРИМЕЧАНИЕ: Чтобы обеспечить чистоту проточных камер, постоянно надевайте перчатки и убедитесь, что верстак свободен от пыли.
5. Фильтрация реакционных буферов
- Стерильная фильтрация всех реакционных буферов через мембраны ацетата целлюлозы 0,45 мкм для обеспечения минимального фонового сигнала во время измерений MSPT.
ПРИМЕЧАНИЕ: Если присутствие нуклеотидов, таких как АТФ, необходимо для успешного эксперимента, знайте о потенциальном увеличении фонового сигнала. Рекомендуется использовать только минимальные количества, которые все еще обеспечивают активность белка.
6. Поддерживаемое образование липидного бислоя (SLB)
ПРИМЕЧАНИЕ: Рекомендуется выполнять формирование поддерживаемых липидных бислоев на массовом фотометре для визуального обеспечения успешного распространения пузырьков и полного удаления несросшихся пузырьков.
- Разбавляйте свежеэкструдированные внедорожники (более подробную информацию см. на этапе 1) до конечной концентрации 0,4 мг/мл в требуемом реакционном буфере. Необязательно, чтобы способствовать разрыву пузырьков, добавьте 2 мМ CaCl2 к суспензии пузырька.
ПРИМЕЧАНИЕ: Двухвалентные катионы могут вызывать агрегацию некоторых липидов, таких как PiP2. Для смесей, содержащих такие липиды, воздержитесь от использования CaCl2 для стимулирования разрыва пузырьков или других двухвалентных катионов в буфере ресуспензии. При необходимости проведения эксперимента двухвалентные катионы могут быть добавлены после успешного образования поддерживаемого липидного бислоя. - Промывайте 50 мкл везикулярной суспензии в проточную камеру (стадия 4) и инкубируйте камеру в течение 2 мин.
ПРИМЕЧАНИЕ: Буферы, везикулы или белковые растворы могут быть промыты через проточную камеру небольшим кусочком замачивающей ткани. Тем не менее, также возможно использование механической насосной системы. - Удаляют несмешанные везикулы путем повторной (по меньшей мере, три раза) промывки проточной камеры с 200 мкл реакционного буфера каждый раз.
ПРИМЕЧАНИЕ: Везикулы должны быть тщательно вымыты из проточной камеры, чтобы обеспечить стабильный фоновый сигнал во время измерений MSPT.
7. Генерация калибровочной кривой
ПРИМЕЧАНИЕ: Для преобразования контраста обнаруженных частиц в молекулярную массу их сигнал необходимо откалибровать с использованием белков известных размеров. Рекомендуется скорректировать стандартный режим размера белка, чтобы охватить диапазон молекулярных масс, ожидаемых для интересующей системы.
- Биотинилирование стандартных белков с цистеиновым остатком
- Рассчитайте соответствующее количество малеимид-биотина для стандартного белка согласно инструкции производителя.
- Инкубировать стандартный белок с определенным объемом малеимид-биотина в течение 1 ч при комнатной температуре.
- Чтобы удалить неконъюгированный малеимид-биотин из конъюгированного биотин-белкового комплекса, выполняют размерно-эксклюзионную хроматографию на колонке, подходящей для интересующего белка.
- Определите концентрацию белка с помощью анализа Брэдфорда.
ПРИМЕЧАНИЕ: Для хранения стандартного белка для дальнейших измерений заморозьте белок в одноразовых аликвотах в жидком азоте и храните их при -80 °C.
- Измерение стандартных белков для калибровочной кривой
- В проточной камере готовят поддерживаемый липидный бислой с экструдированными внедорожниками 0,4 мг/мл (см. этапы 1 и 6 для получения более подробной информации), содержащий 0,01 моль% (v/v) Biotinyl Cap PE (1,2-диолеоил-sn-glycero-3-фосфоэтаноламин-N-cap биотинил).
- Добавьте 50 мкл 2,5 нМ двухвалентного стрептавидина к бислою в проточной камере и инкубируйте в течение 10 мин.
ПРИМЕЧАНИЕ: Двухвалентный стрептавидин был выражен и очищен, как описано в Howarth et al.28. Также может использоваться четырехвалентный стрептавидин. Однако применение двухвалентного стрептавидина может уменьшить возможную реакцию стехиометрии между биотинилированными липидами и стандартными белками, которые конъюгируются с фрагментом биотина, чтобы облегчить распределение видов. - Удаляют несвязанный двухвалентный стрептавидин со 100 мкл реакционного буфера.
- Добавьте 50 мкл 100 нМ биотин-конъюгированного стандартного белка в бислой в проточной камере и инкубируйте в течение 2 мин.
ПРИМЕЧАНИЕ: В зависимости от эффективности биотинилирования и от того, используется ли ди- или четырехвалентный стрептавидин, оптимальные концентрации биотин-конъюгированного стандартного белка и стрептавидина могут варьироваться. - Выполните измерение MSPT в соответствии с деталями, описанными в шаге 8.
ВНИМАНИЕ: Условия визуализации должны быть идентичными как для образцов, так и для калибровочных стандартов.
8. Визуализация
- Формирование SLB и пробоподготовка
- Как более подробно описано на этапе 6, вводят внедорожники желаемой липидной смеси (25 мкл) в камеру потока образца и образуют поддерживаемый липидный бислой. Тщательно промыть камеру (три раза) 100 мкл реакционного буфера, чтобы удалить все несросшиеся везикулы.
- Добавьте 50 мкл интересующего белка в камеру образца.
ПРИМЕЧАНИЕ: Поскольку MSPT является методом с одной частицей, концентрация белка должна поддерживаться в диапазоне от pM до nM, чтобы обеспечить обнаружение и отслеживание ненарушенных частиц.
- Видеосъемка
- Задайте требуемые условия обработки изображений, такие как размер поля зрения (FOV), частота кадров, время экспозиции и время получения в программном обеспечении для сбора данных.
ПРИМЕЧАНИЕ: Следующие настройки доказали свою эффективность для MSPT на коммерческом массовом фотометре (см. Таблицу материалов): FOV 128 пикселей x 35 пикселей, частота кадров 1 кГц, что приводит к примерно 200 кадрам в секунду после последующего 5-кратного усреднения кадра, и время экспозиции 0,95 мс. - Отрегулируйте фокус автоматически или вручную. При необходимости переместите FOV в положение с однородной мембраной с помощью бокового управления.
- Создайте папку проекта и начните запись фильма. По завершении записи укажите имя файла в диалоговом окне, запрашиваемом программным обеспечением для сбора данных. Затем фильм автоматически сохраняется в папке проекта в виде MP-файла для последующего анализа.
ПРИМЕЧАНИЕ: Запишите по меньшей мере три реплики в разных проточных камерах для обеспечения целостности отдельных мембран и воспроизводимости результатов. Продолжительность фильма может быть установлена заранее и зависит от типа эксперимента. В большинстве случаев рекомендуется время приобретения от 5 до 7 минут.
ВНИМАНИЕ: По умолчанию видеозаписи на коммерческом программном обеспечении для массового фотометра сжимаются перед сохранением, чтобы уменьшить пространство для хранения. Однако сжатие файлов необходимо отключить, чтобы включить пользовательский анализ данных, как описано в этом протоколе. Подробную информацию о том, как отключить сжатие файлов, можно найти в руководстве пользователя производителя.
- Задайте требуемые условия обработки изображений, такие как размер поля зрения (FOV), частота кадров, время экспозиции и время получения в программном обеспечении для сбора данных.
9. Анализ данных
ПРИМЕЧАНИЕ: Конвейер анализа данных сопровождается двумя интерактивными блокнотами Jupyter (MSPT analysis.ipynb, Movie visualization.ipynb). Записные книжки Jupyter и связанные с ними пользовательские модули Python, необходимые для выполнения анализа MSPT, описанного ниже, доступны в общедоступном репозитории: https://github.com/MSPT-toolkit/MSPT-toolkit. Для получения подробных инструкций по анализу ниже, читатели направляются на MSPT analysis.ipynb , доступ к которому осуществляется по ссылке выше.
- Обработка видео
- Удалите доминирующее статическое рассеяние света с помощью алгоритма оценки фона по пикселям с помощью функции image_processing.mp_reader .
- Чтобы применить удаление фона, выберите параметр continuous_median для режима параметра и задайте соответствующую длину скользящего медианного окна (window_length) в разделе B.1 записной книжки. При необходимости сохраните фильмы после удаления фона для использования для обнаружения частиц и связывания траектории (установив для параметра save_processed_movies значение True).
ПРИМЕЧАНИЕ: Отрегулируйте размер окна (window_length) до значений между 101 и 2001 годами в зависимости от плотности частиц на мембране, ожидаемого коэффициента диффузии, частоты кадров сбора и требуемой скорости обработки.
ВНИМАНИЕ: Стратегия удаления фона хорошо работает, если мембрана не слишком плотно упакована и если диффузия частиц достаточно быстрая (т. Е. Каждый пиксель большую часть времени не занят частицей). В противном случае контраст частиц будет систематически недооцениваться, так как их нельзя правильно отличить от фонового сигнала. Это можно компенсировать за счет увеличения медианного размера окна за счет вычислительной скорости. Однако имейте в виду, что установка слишком большого размера окна может негативно повлиять на вывод из-за дрейфа выборки. Визуальный осмотр обработанных видео имеет решающее значение.
- Чтобы применить удаление фона, выберите параметр continuous_median для режима параметра и задайте соответствующую длину скользящего медианного окна (window_length) в разделе B.1 записной книжки. При необходимости сохраните фильмы после удаления фона для использования для обнаружения частиц и связывания траектории (установив для параметра save_processed_movies значение True).
- Обнаружение частиц и их соответствующего положения на протяжении всего фильма с помощью функции particle_fitting.particle_fitter (см. раздел B.2 для записной книжки).
- Настройте чувствительность обнаружения частиц с помощью порогового параметра (молотилка; см. раздел B.1 для записной книжки), который используется для выделения потенциальных пятен путем бинаризации изображения. Влияние изменяющихся пороговых параметров на чувствительность обнаружения пятен можно рассмотреть в отдельной записной книжке (Movie visualization.ipynb). Результаты обнаружения частиц автоматически сохраняются в CSV-файлы в подкаталоге файла фильма.
ПРИМЕЧАНИЕ: Установка сколь угодно низкого порогового параметра (например, для фильмов, снятых с помощью используемого массового фотометра, пороговый параметр ниже 0,0005) не рекомендуется, так как в пятнах-кандидатах будет преобладать паразитный шум и, следовательно, продлевать время обработки.
- Настройте чувствительность обнаружения частиц с помощью порогового параметра (молотилка; см. раздел B.1 для записной книжки), который используется для выделения потенциальных пятен путем бинаризации изображения. Влияние изменяющихся пороговых параметров на чувствительность обнаружения пятен можно рассмотреть в отдельной записной книжке (Movie visualization.ipynb). Результаты обнаружения частиц автоматически сохраняются в CSV-файлы в подкаталоге файла фильма.
- Удалите доминирующее статическое рассеяние света с помощью алгоритма оценки фона по пикселям с помощью функции image_processing.mp_reader .
- Связывайте частицы в последовательных кадрах в траектории с помощью пакета Python trackpy (v.0.5.0)29.
ПРИМЕЧАНИЕ: Связывание траектории выполняется на лету после обнаружения пятна. В результате дополнительный CSV-файл, содержащий информацию о траектории, хранится в подкаталоге CSV-файла обнаружения частиц.- Удалите траектории со слишком малым количеством точек, используя параметр minimum_trajectory_length (см. раздел B.1 для записной книжки), чтобы обеспечить надежное определение коэффициентов диффузии. Для получения подробных объяснений относительно других параметров функций trackpy обратитесь к документации trackpy .
- Анализ траектории
- В разделе C.1 для записной книжки укажите частоту кадров (frame_rate) и размер пикселя в нм (pixel_size), которые использовались для получения фильмов. Создайте список CSV-файлов, содержащих информацию о траектории, возвращаемую trackpy (см. шаг 9.2), с помощью функции trajectory_analysis.get_csv_files (раздел записной книжки C.2).
- Кроме того, укажите имя выходного файла для контейнера HDF5, который используется для хранения результатов подгонки на диске (раздел C.3 для записной книжки). Анализируйте все траектории с помощью функции trajectory_analysis.fit_trajectories в разделе C.4 записной книжки, которая перебирает список CSV-файлов. Эта функция использует скачкообразное распределение расстояний (JDD)30 и анализ среднего квадратного смещения (MSD)31 для оценки коэффициента диффузии каждой траектории.
- Преобразуйте медианный контраст каждой траектории в соответствующую ей массу, используя отношение контраст-масса, полученное в результате калибровки MSPT (см. раздел 7). Укажите наклон (наклон) и y-перехват (смещение) калибровочной линии, которая связывает контраст iSCAT с молекулярной массой (функция trajectory_analysis.apply_calibration; см. раздел C.5 для записной книжки). Эта функция добавляет столбец со средней массой траектории к каждому кадру данных.
- Оцените кажущуюся плотность частиц на мембране с помощью функции trajectory_analysis.membrane_density, которая возвращает среднее значение плотности в терминах обнаруженных частиц и представляет траектории в течение каждого кадра (см. раздел C.6 для записной книжки) в качестве дополнительных столбцов в кадре данных.
ПРИМЕЧАНИЕ: Поскольку часть частиц будет потеряна как в процессе обнаружения, так и в процессе связывания траектории, фактическая плотность частиц может быть выше. Для получения надежных результатов в отношении плотности частиц, а также гистограмм массы визуально проверьте репрезентативные снимки фильма, чтобы убедиться, что условия измерения правдоподобны для отслеживания одной частицы (см. шаг 9.1.1).
10. Визуализация данных
- Проиллюстрировать корреляцию массы и коэффициента диффузии двумерной оценкой плотности ядра (KDE), которая основана на пакете Python fastkde (v.1.0.19; https://pypi.org/project/fastkde/).
- Чтобы создать график, укажите файл HDF5, содержащий результаты MSPT (см. шаг 9.3.2 и раздел D.1 записной книжки), и выберите один (раздел записной книжки D.2) или сцепленный фрейм данных (раздел записной книжки D.3) в качестве входных данных для функции plotting.generate_2D_KDE (раздел D.4 записной книжки).
ПРИМЕЧАНИЕ: Каждый построенный набор данных должен содержать в идеале более 1000 траекторий для надежного 2D-KDE.
Результаты
Следуя подробному протоколу, описанному в настоящем описании для получения поддерживаемых липидных бислоев (SLB) в проточных камерах (рисунок 1), можно четко распознать спеклоподобный рисунок в нативном представлении всех отображаемых условий (рисунок 2). Этот эффект вызван шероховатостью поверхности стекла, которая обычно доминирует над сигналом рассеяния и приводит к визуально неразличимым условиям (стекло, стекло с SLB или стекло с SLB и прикрепленными белками). Присутствие везикул, однако, четко различимо из-за большого поперечного сечения рассеяния везикул и позволяет наблюдать разрыв везикул и слияние в однородные мембраны (рисунок 2B и дополнительный фильм 1). При удалении статического сигнала рассеяния поверхности стекла с помощью ратиометрического подхода, который подчеркивает динамические элементы в поле зрения24,25, можно обнаружить немаркированные белки, диффундирующие на мембране (рисунок 2D), в то время как пустой SLB (рисунок 2C) или само стекло (рисунок 2A) выглядит как шумное изображение.
Фон, присущий измерениям MSPT, может быть локально оценен путем деления значения каждого пикселя через медиану n предшествующих и последующих пикселей фильма в одном и том же положении изображения (рисунок 3). В результате макромолекулы появляются как изотропные точечные функции распространения (PSF), движение которых на мембране можно наблюдать, отслеживать и количественно определять. Фактически, наличие как контраста, так и динамического поведения позволяет напрямую связать размер молекулы с ее соответствующим диффузным поведением, и все это без необходимости маркировки частицы. Тем не менее, чтобы интерпретировать контраст iSCAT, определенный в ходе экспериментов MSPT, важно выполнить калибровку, которая переводит амплитуду сигнала в молекулярную массу. Это может быть достигнуто путем присоединения биомолекул известной массы к SLB через комплекс биотин-стрептавидин-биотин (рисунок 4A). В качестве примерной стратегии можно использовать биотинилированные варианты бычьего сывороточного альбумина (BSA), белка A (prA), щелочной фосфатазы (AP) и фибронектина (FN), которые связываются со стрептавидином (STP), который сам связан с биотинсодержащими липидами (Biotinyl Cap PE) в мембране. Как показано на фиг.4А, все более выраженный контраст этих образцовых макромолекул отражает увеличение молекулярной массы соответствующих биотинилированных стандартов. При присвоении каждому пику контрастных гистограмм (рисунок 4В) соответствующей массе олигомерного состояния стандартного белка выявляется линейная зависимость между контрастом и массой21,22 и впоследствии может быть использована для анализа неизвестных макромолекулярных систем (рис. 4С).
Хорошим примером, демонстрирующим применимость и возможности MSPT для анализа молекулярных масс и, следовательно, изучения олигомерных состояний и событий олигомеризации, является рассмотрение биотинилированной альдолазы и биотинилированного IgG (рисунок 5). Обычно сообщается, что альдолаза является гомотетрамером32. Тем не менее, распределение массы, разрешенное MSPT, имеет четыре различных пика, что подчеркивает наличие нескольких популяций (рисунок 5A). В то время как первый незначительный пик соответствует незанятому стрептавидину и может быть ожидаем из-за конфигурации в этом виде эксперимента, комплексы альдолазы только с двумя субъединицами (2SU) или шестью субъединицами (6SU) также могут быть обнаружены (рисунок 5B). Интересно, что комплексы тетра- и гексамерной альдолазы-стрептавидина демонстрируют пониженный коэффициент диффузии по сравнению с димерной альдолазой и стрептавидином, что указывает на повышенное вязкое сопротивление, например, через присоединение второго биотинилированного липида к стрептавидину. Аналогичным образом, биотинилированный IgG демонстрирует три пика в распределении массы, причем первый пик снова соответствует массе одного стрептавидина. Масса наиболее распространенного пика соответствует массе одной легкой и одной тяжелой цепи (1SU), т. е. половины антитела IgG. Полное антитело с двумя одинаковыми половинками (2SU) обнаруживается примерно в 11% случаев. Уменьшение коэффициента диффузии с увеличением размеров комплекса указывает на взаимодействие стрептавидина с более чем одним биотинилированным липидом или дополнительным сопротивлением, вызванным присоединенным IgG, или и тем, и другим.
Помимо единственного анализа мембранозависимых олигомерных состояний, MSPT также дает особое преимущество корреляции диффузного поведения макромолекулы, представляющей интерес, с ее олигомерным состоянием. Репрезентативные результаты для этого типа анализа показаны для аннексина V (AnV) и субъединицы токсина холеры B (CTxB), которые связываются с диолеоилфосфатидилсерином (DOPS) или гликосфинголипидами (GM1), соответственно, включенными в мембрану (рисунок 6A). Обе оценки плотности ядра (KDE) отражают унимодальные распределения массы и диффузии, что указывает на один распространенный вид с аналогичным диффузным поведением. Было установлено, что пиковое положение молекулярной массы и коэффициента диффузии составляет соответственно 49,8 ± 2,2 кДа и 1,4 ± 0,1 мкм2/с для AnV, а также 62,7 ± 3,1 кДа и 0,4 ± 0,1мкм2/с соответственно для CTxB. Измеренные коэффициенты диффузии сопоставимы с ранее сообщенными значениями, полученными из высокоскоростных AFM и FRAP 33,34. Незначительно уменьшенная масса по сравнению с массой ожидаемой макромолекулы (52 кДа для тримера AnV, 65 кДа для пентамера CTxB) может указывать на наличие меньших комплексов с меньшим количеством субъединиц в ансамбле. Хотя разность масс между белками мала и близка к заданному пределу детектирования микроскопа (≈50 кДа), их коэффициенты диффузии значительно различаются. Например, в эквимолярной смеси, сравнивая диффузию смеси с распределением только AnV и CTxB, можно сделать вывод, что AnV более распространен на мембране, чем CTxB (рисунок 6B). Однако, если концентрация CTxB удваивается по сравнению с концентрацией AnV, равновесие смещается в сторону CTxB как преобладающего белка на мембране. Как показано для смесей AnV и CTxB, MSPT не только позволяет различать макромолекулы, связанные с мембраной, в соответствии с их молекулярной массой, но также позволяет различать различные популяции макромолекул в соответствии с их диффузным поведением.
Как и во всех методах микроскопии, некоторые экспериментальные требования имеют решающее значение для достижения желаемого качества данных. Важным примером в этом контексте являются тщательно очищенные крышки. В целом, это считается необходимым условием для экспериментов с одной молекулой, связанных с микроскопией, но MSPT особенно чувствителен к примесям образцов. Повышенное рассеяние, происходящее от стеклянной поверхности неочищенных покровных прорезей, предотвращает любое количественное измерение iSCAT. Примечательно, что даже остаточные частицы грязи или пыли на недостаточно очищенном стекле могут вызвать заметные искажения изображения, распознаваемые как яркие пятна в режиме собственного изображения (рисунок 7A). Хотя эти дефекты устраняются фоновой оценкой из-за их статической природы, точное определение контраста частицы может быть нарушено и, таким образом, отрицательно влияет на ее количественный анализ. Другой распространенной проблемой, встречающейся в экспериментах MSPT, являются оставшиеся пузырьки, которые либо плавают (окружены оранжевым) через поле зрения, либо несросшиеся везикулы, которые застряли (окружены синим) в определенном положении на мембране и выглядят как большие пульсирующие рассеиватели (рисунок 7B). Чтобы свести к минимуму их возникновение и вмешательство в получение пленки, рекомендуется тщательно промыть SLB перед добавлением белка и использовать свежеприготовленные смеси небольших одноламеллярных везикул (SUV) и двухвалентных катионов.
Одним из факторов, который необходимо учитывать при разработке экспериментов по отслеживанию чувствительных к массе частиц, является плотность макромолекул, связанных с мембранным интерфейсом. Высокая плотность частиц на мембране может фактически вызвать проблемы по двум причинам: i) Связывание обнаружений частиц из последовательных кадров в траектории становится неоднозначным и, следовательно, увеличивает вероятность ошибок и неправильно оцененных коэффициентов диффузии. ii) Масса частиц, извлекаемая из амплитуды их соответствующего соответствия PSF, систематически недооценивается, а пики массы расширяются, поскольку отделение статического фонового сигнала от сигнала динамической частицы становится все более трудным (рисунок 7C). В настоящее время визуальная оценка качества данных в процессе получения видео MSPT затруднена на доступных коммерческих микроскопах, поскольку реализованное ратиометрическое представление в программном обеспечении для сбора использует удаление фона, установленное для массовой фотометрии21, вместо алгоритма на основе медианы, описанного здесь и в ссылках 24,25 (рисунок 7D). ). Среднее непрерывное удаление фона, используемое для визуализации посадочных молекул в массовой фотометрии, приводит к тому, что диффундирующие частицы выглядят как темные фронты с яркими хвостами, что делает пятна очень анизотропными и мешает установке PSF во время процедуры обнаружения. Таким образом, использование реализованной средней обработки изображений в собирательном программном обеспечении непригодно для анализа диффузных биомолекул на мембранах.
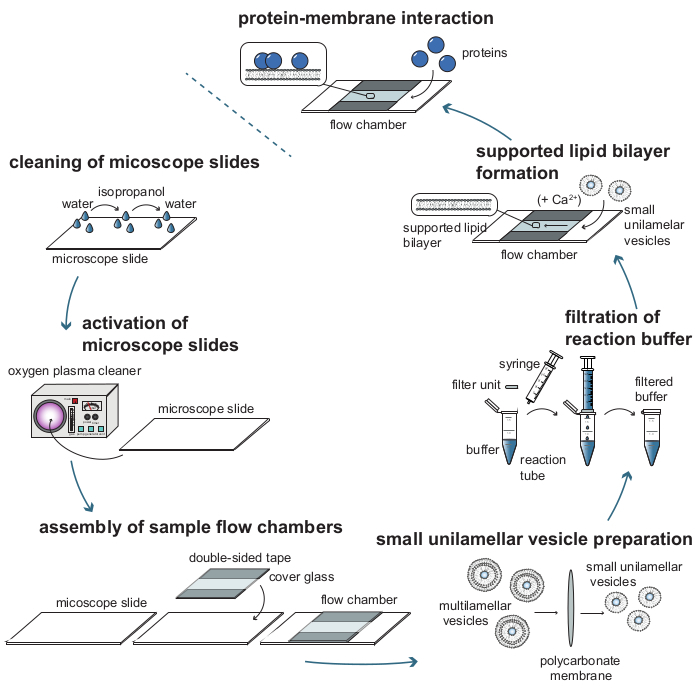
Рисунок 1: Технологическая схема отдельных этапов, необходимых для анализа белково-мембранных взаимодействий с массочувствительным отслеживанием частиц (MSPT). Чтобы подготовить образцы для измерений MSPT, слайды стеклянной крышки должны быть тщательно очищены и активированы кислородной плазмой. После их сборки в камеры потока образцов небольшие одноламеллярные везикулы (SUV) готовятся к образованию поддерживаемых липидных бислоев (SLB) и все реакционные буферы фильтруются для уменьшения фонового рассеяния. Внедорожники добавляются для образования липидных бислоев в проточных камерах. Необязательно, двухвалентные катионы, такие как ионы Ca2+ , могут быть добавлены к внедорожникам для содействия разрыву пузырьков. Наконец, низкие концентрации интересующего белка вымываются в реакционную камеру. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
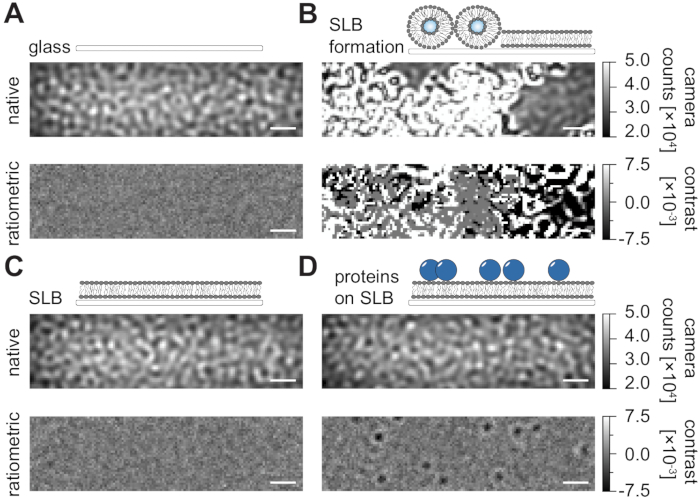
Рисунок 2: Нативный и ратиометрический вид примерных поверхностей, относящихся к измерениям MSPT. Репрезентативные изображения шероховатости поверхности стеклянного покровного слайда (А) во время формирования поддерживаемого липидного бислоя (В) с неповрежденным поддерживаемым липидным бислоем (С) и примерных белков, восстановленных на SLB (D). Все четыре примера отображаются в основном режиме, к которому можно получить доступ во время самого измерения, и в виде обработанных ратиометрических изображений после удаления фона на основе медианы. Шкалы представляют собой 1 мкм. Для анализа данных (см. прилагаемую записную книжку Jupyter; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
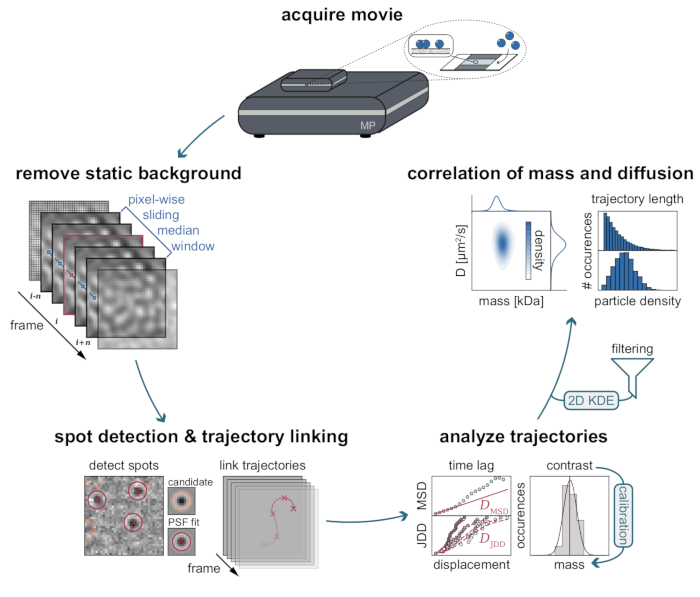
Рисунок 3: Пошаговая диаграмма этапов, необходимых для сбора и анализа данных MSPT. После сбора данных для интересующего образца на массовом фотометре фильмы обрабатываются для удаления статического фона с помощью пиксельного скользящего медианного подхода. После этого частицы-кандидаты идентифицируются и устанавливаются функцией точечного распространения (PSF) до их связывания с траекториями частиц. Для определения коэффициента диффузии для каждой частицы используется анализ среднего квадратичного смещения (MSD) или распределения скачкообразного расстояния (JDD). На этом этапе значения контраста могут быть преобразованы в молекулярные массы в соответствии с отношением контраст-масса,определяемым с помощью калибровочной стратегии. В качестве заключительного этапа траектории могут быть отфильтрованы на основе их длины или плотности мембранных частиц и визуализированы с помощью двумерной оценки плотности ядра (2D-KDE). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
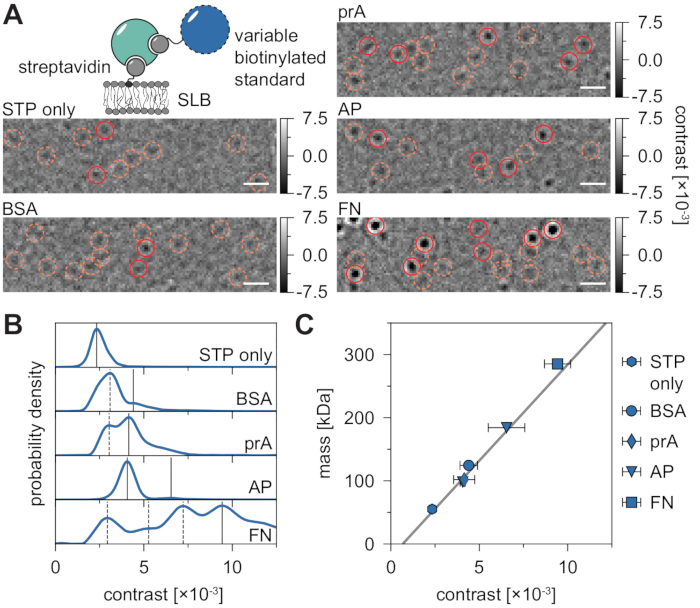
Рисунок 4: Калибровка соотношения массы к контрасту для измерений MSPT. (A) Репрезентативные логометрические кадры, полученные для примерных стрептавидин-стандартных белковых комплексов, диффундирующих на поддерживаемом липидном бислое, содержащем небольшой процент биотинилированных липидов (DOPC:DOPG:Biotinyl Cap PE ratio 70:29.99:0.01 моль%). В качестве модельных стандартов молекулярной массы показаны моновалентный стрептавидин28 (только STP) или двухвалентный стрептавидин28 в комплексе с биотинилированным бычьим сывороточным альбумином (BSA), биотинилированным белком A (prA), биотинилированной щелочной фосфатазой (AP) или биотинилированным фибронектином (FN). Пятна-кандидаты выделены оранжевым цветом (пунктирные круги), а успешные обнаружения частиц выделены красным цветом (сплошные круги). Шкала брусков представляет собой 1 мкм. (B) Распределения плотности вероятности значений контраста, полученные для пяти модельных стандартных белков. Все отображаемые данные представляют собой объединенные распределения трех независимых экспериментов на условие: STP только n = 82,719; BSA n = 9 034; prA n = 22 204; AP n = 69 065, а FN n = 71 759 траекторий. По сравнению с количеством частиц, определенным для мембран с белками, количество частиц, обнаруженных на пустом бислое, ничтожно мало при умеренных плотностях мембран (дополнительный рисунок 1). Пики контраста, рассматриваемые для калибровки массы, отмечены непрерывными линиями, в то время как пунктирные представляют собой олигомерные состояния, которые не учитываются. (C) Калибровочная кривая контрастности к массе, полученная на основе пиковых контрастов на панели D и соответствующих масс последовательностей комплексов. На панелях ошибок отображается стандартная погрешность пиковых местоположений, оцененная при начальной загрузке (100 ресамплей с 1000 траекториями каждая). Для анализа данных (см. Jupyter notebook; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001 кадр, порог обнаружения (молотилка) = 0,00055, диапазон поиска (dmax) = 4 пикселя, память (max_frames_to_vanish) = 0 кадров, минимальная длина траектории (minimum_trajectory_length) = 7 кадров (только STP), 9 кадров (BSA/FN), 15 кадров (prA), 10 кадров (AP). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
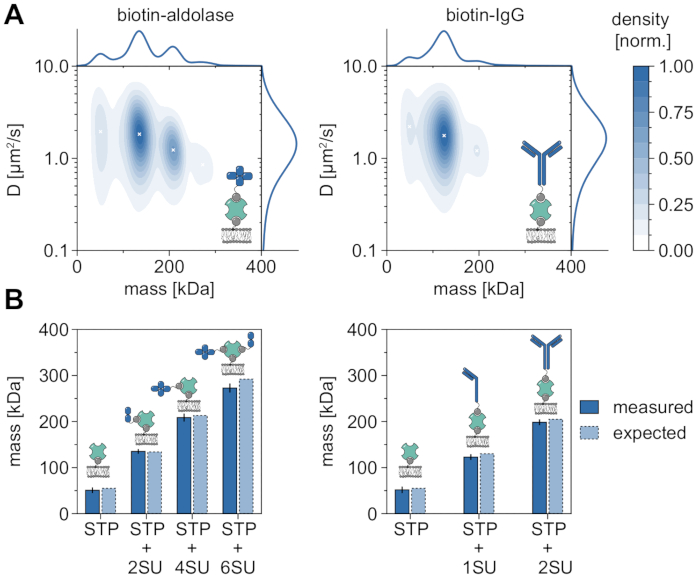
Рисунок 5: Расшифровка олигомерных состояний мембраноассоциированных белков. (A) 2D оценка плотности ядра как массы, так и коэффициента диффузии четырехвалентного стрептавидина в комплексе с биотинилированной альдолазой (левая панель) или с биотин-модифицированным козьим анти-Rabbit IgG антителом (правая панель). Восстановление обоих комплексов проводили на поддерживаемом липидном бислое, содержащем DOPC, DOPG и Biotinyl Cap PE в соотношении 70:29,99:0,01 моль% соответственно. В общей сложности 116 787 траекторий трех независимых реплик были включены для комплекса стрептавидин-альдолаза (плотность частиц 0,1 мкм-2) и 348 405 для композита стрептавидин-IgG (плотность частиц 0,1 мкм-2). Были включены только частицы с длиной трека не менее пяти кадров. Представлены предельные вероятностные распределения как молекулярной массы (вверху), так и коэффициента диффузии (справа). Черный значок x на обеих панелях обозначает соответствующие локальные максимумы KDE. (B) Сравнение определенных масс олигомеров для комплекса четырехвалентного стрептавидина с биотин-модифицированной альдолазой (левая панель) или биотинилированным IgG (правая панель) с ожидаемыми молекулярными массами в соответствии с массами последовательности. Аббревиатура SU вводится от имени субъединицы белка интересов. На панелях ошибок отображается стандартная погрешность пиковых местоположений, оцененная при начальной загрузке (100 ресамплей с 1000 траекториями каждая). Для анализа данных (см. прилагаемый блокнот Jupyter; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001 кадр, порог обнаружения (молотилка) = 0,00055, диапазон поиска (dmax) = 4 пикселя, память (max_frames_to_vanish) = 0 кадров, минимальная длина траектории (minimum_trajectory_length) = 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
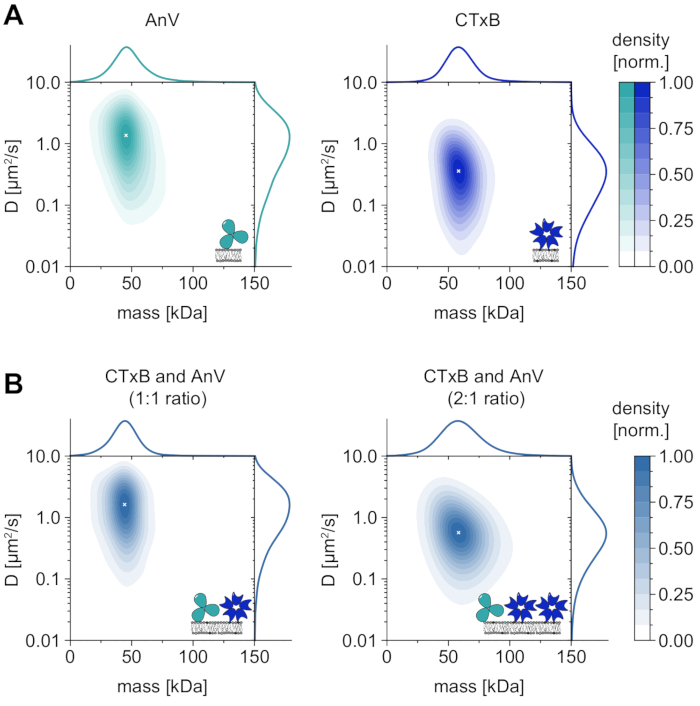
Рисунок 6: Растворение диффузного поведения нативных мембранно-взаимодействующих белков аннексина V (AnV) и субъединицы холерного токсина B (CTxB). (A) 2D оценки плотности ядра как массы, так и коэффициента диффузии приложения V (левая панель) и субъединицы холерного токсина B (правая панель). Для восстановления мембран AnV и CTxB использовались липидные композиции 80:20 моль% DOPC к DOPS и 99,99:0,01 моль% DOPC к GM1 соответственно. В общей сложности 206 819 траекторий трех независимых реплик были включены для AnV (плотность частиц 0,1 мкм-2) и 142 895 траекторий для CTxB (плотность частиц 0,2 мкм-2). (B) 2D оценки плотности ядра смесей CTxB и AnV в соотношении 1:1 (левая панель) или 2:1 (правая панель), соответственно. Восстановление белковых смесей проводили на поддерживаемом липидном бислое, содержащем липиды DOPC, DOPS и GM1 в соотношении 80:19,99:0,01 моль%. В общей сложности 42 696 траекторий трех независимых реплик были включены для смеси 1:1 (плотность частиц 0,1 мкм-2) и 264 561 траектории для соотношения 2:1 (плотность частиц 0,3 мкм-2). Как для (А), так и для (В) были включены только частицы с длиной пути не менее пяти кадров. Представлены предельные вероятностные распределения как молекулярной массы (вверху), так и коэффициента диффузии (справа). Белый значок x на каждой панели обозначает соответствующий глобальный максимум KDE. Для анализа данных (см. прилагаемый блокнот Jupyter; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001 кадр, порог обнаружения (молотилка) = 0,00055, диапазон поиска (dmax) = 4 пикселя, память (max_frames_to_vanish) = 0 кадров, минимальная длина траектории (minimum_trajectory_length) = 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
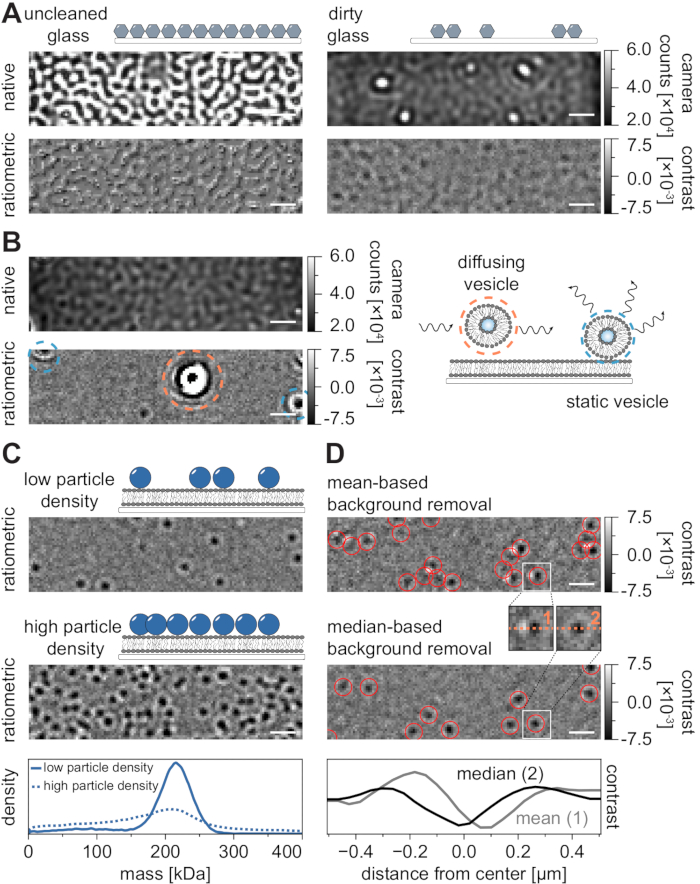
Рисунок 7: Потенциальные осложнения в ходе измерений MSPT или во время анализа данных. (A) Репрезентативные изображения шероховатости поверхности, отображаемые как в нативном, так и в обработанном (на основе медианы удаления фона) ратиометрическом виде неочищенного стекла крышки. В обоих случаях яркие пятна представляют собой остаточные поверхностные примеси, которые препятствуют измерениям без артефактов. (B) Примерные изображения остаточных пузырьков в поле зрения после недостаточной промывки мембраны. Как статические (выделенные синим), так и диффузионные (выделенные оранжевым) везикулы ухудшают качество измерения либо из-за пульсации и покачивания, либо из-за их направленного движения соответственно. (C) В качестве метода, состоящего из одной частицы, MSPT требует низкой плотности частиц (репрезентативное изображение, верхняя панель) для обеспечения надлежащего связывания и определения массы каждой частицы. В случае высокой плотности мембранных частиц (средняя панель) подгонка частиц нарушается, что влияет на определение массы (см. нижнюю панель). (D) Репрезентативные ратиометрические изображения частиц, диффундирующих на мембранной границе раздела после удаления фона на основе среднего значения (верхняя панель) или на основе медианы. Для диффузии частиц средняя стратегия удаления фона создает искаженные изображения PSF частицы, как видно на небольших вставках между верхней и средней панелью. Напротив, неискаженные частицы PSF могут быть получены с помощью медианного подхода. Нижняя панель: сравнение профилей линий через центр PSF, полученных после удаления фона на основе среднего или медианного значения. Для всех нативных и ратиометрических изображений, показанных на этом рисунке, шкала представляет собой 1 мкм. Для анализа данных (см. прилагаемый блокнот Jupyter; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001 кадр, порог обнаружения (молотилка) = 0,00055, диапазон поиска (dmax) = 4 пикселя, память (max_frames_to_vanish) = 0 кадров, минимальная длина траектории (minimum_trajectory_length) = 5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Дополнительный рисунок 1: Сравнение безбелковых и занятых мембран. Репрезентативные изображения интактного поддерживаемого липидного бислоя до (А) и после (В) добавления очищенного стрептавидина (СТП). Пятна-кандидаты, которые были успешно подогнаны к модели PSF, окружены красным цветом. (C) Контрастные вероятностные распределения частиц, обнаруженных на пустой мембране (фон мембраны, серый) и на бислое с диффузными частицами стрептавидина (синий). Оба распределения вероятностей представляют собой объединенные данные трех независимых экспериментов с идентичными параметрами получения и анализа фильмов. Для анализа данных (см. прилагаемый блокнот Jupyter; шаг 9) использовались следующие параметры: медианный размер окна (window_length) = 1001 кадр, порог обнаружения (молотилка) = 0,00055, диапазон поиска (dmax) = 4 пикселя, память (max_frames_to_vanish) = 0 кадров, минимальная длина траектории (minimum_trajectory_length) = 7 кадров. Пожалуйста, нажмите здесь, чтобы загрузить этот файл.
Дополнительный фильм 1: Примерный фильм, показывающий разрыв и слияние везикул в однородную мембрану, записанную с помощью массового фотометра. Медианный размер окна обработки изображений (window_length) = 1 001 кадр. Шкала: 1 мкм. Диапазон количества камер: черный = 16 892; белый = 65 408. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Дополнительный фильм 2: Примерные фильмы, показывающие диффузию комплексов аннексина V (вверху) и биотинилированной альдолазы (снизу) на бислое, полученном из измерений MSPT. Медианный размер окна обработки изображений (window_length) = 1 001 кадр. Шкала: 1 мкм. Интерферометрический диапазон контраста рассеяния: черный = -0,0075; белый = 0,0075. Пожалуйста, нажмите здесь, чтобы скачать этот фильм.
Обсуждение
Представленный протокол расширяет массовую фотометрию21, метод, который анализирует массу одиночных биомолекул, адсорбирующих на стекле, до еще более универсального инструмента, способного одновременно измерять массу и диффузию немаркированных мембранно-взаимодействующих биомолекул. Это расширение анализа достигается за счет реализации модифицированной стратегии удаления фона, адаптированной к боковому движению молекул24,25. В целом, удаление фона имеет первостепенное значение для подходов, основанных на iSCAT, поскольку сильное рассеяние шероховатости поверхности стекла представляет собой основное препятствие для анализа, а точное определение локального фона каждого пикселя имеет важное значение для количественной оценки массы и местоположения частиц. Помимо анализа изображений, адаптированного к движению частиц, последующее обнаружение частиц, связывание траекторий и анализ данных завершают новое расширение MP в массочувствительное отслеживание частиц (MSPT).
В целом, тщательно очищенные слайды стеклянной крышки и чистая рабочая среда являются критическими требованиями для успешного проведения экспериментов MSPT. Из-за отсутствия маркировки макромолекул приобретенный сигнал по своей сути является неселективным. Таким образом, чистые образцы, а также надлежащая обработка образцов имеют решающее значение для обеспечения того, чтобы наблюдения не могли быть неправильно истолкованы. В частности, при исследовании молекул с низкой молекулярной массой подтверждаются контрольные измерения безбелковых мембран для оценки фоновых вкладов (дополнительный рисунок 1). Помимо включения контрольных измерений, поэтому рекомендуется следовать этапам подготовки, показанным на рисунке 2 для каждой проточной камеры. В сочетании эти меры безопасности гарантируют, что обнаруженный сигнал исходит от биомолекулы, представляющей интерес, а не, например, из загрязненной проточной камеры, буфера или мембраны.
Помимо мер предосторожности в отношении экспериментального проектирования, необходимо также соблюдать осторожность во время обработки изображений MSPT. Во время обработки видео значение для трех параметров должно быть тщательно выбрано, чтобы обеспечить правильные результаты: i) длина медианного окна для удаления фона, ii) порог для обнаружения частиц и iii) максимальный радиус поиска во время назначения ссылки. Большее медианное окно (i) обычно облегчает отделение диффузионных частиц от наложенного квазипостоянного фона. Однако для слишком больших размеров окон дрейф выборки в конечном итоге станет заметным и снизит точность фоновой оценки. Оптимальные настройки в значительной степени зависят от свойств образца и условий измерения. Тем не менее, значение 1001 может быть использовано в качестве надежной отправной точки. Пороговый параметр (ii) должен быть настроен в зависимости от наименьшей молекулярной массы, ожидаемой в образце. Значение ниже 0,0005 не рекомендуется для измерений, проводимых с помощью массового фотометра, используемого в этом исследовании. Чтобы ускорить время анализа, можно выбрать более высокие значения, если ожидается образец с высокой молекулярной массой. Радиус поиска в связывании траектории (iii) определяет максимальное радиальное расстояние в пикселях, в котором смещенное местоположение частицы будет искаться в последовательных кадрах. Он должен быть адаптирован к самой быстрой частице в образце, и, если это предпочтительно, адаптивный диапазон поиска (см. документацию trackpy) может быть использован вместо этого для сокращения времени вычислений. Особенно на начальном этапе проекта рекомендуется повторный анализ фильмов с различными параметрами для проверки полученных результатов.
В свете одномолекулярной природы MSPT следует избегать измерения при высокой плотности мембранных частиц, поскольку они могут мешать точному определению контраста и массы. Было показано, что плотности ниже одной частицы на квадратный микрометр благоприятны для измерений MSPT24. Дополнительным соображением являются ожидаемые коэффициенты диффузии в выборке. Хотя MSPT применим к широкому диапазону коэффициентов диффузии, он имеет нижний предел доступных коэффициентов диффузии. Локальное ограничение областью в несколько пикселей в течение значительной части периода среднего окна объединяет частицу со статическим фоном. Для условий визуализации, используемых в этом протоколе, измерение коэффициентов диффузии ниже 0,01 мкм2/с не рекомендуется. При такой скорости диффузии, например, среднее квадратическое смещение частицы во время среднего полуразмера окна составляет около 4 пикселей и, следовательно, имеет такой же размер, как и протяженность PSF. Как следствие, оценка статического фона, вероятно, будет содержать вклад сигнала от самой частицы, что приводит к, по-видимому, снижению контрастности частицы до тех пор, пока она в конечном итоге не приблизится к уровню шума. Однако коэффициенты диффузии макромолекул в диапазоне от 0,05 до 10 мкм2/с могут быть четко разрешены.
Чтобы еще больше расширить диапазон приложений MSPT, можно представить себе продвижение фонового алгоритма на основе медианы путем устранения пикселей, которые временно заняты частицей, или путем коррекции дрейфа выборки, позволяющей увеличить медианные размеры окна. Оба подхода облегчили бы проблемы, связанные с измерениями при высокой плотности частиц и медленной диффузии. Улучшения с точки зрения более низкой массовой чувствительности находятся на горизонте с новым поколением массовых фотометров, которые могут обеспечить доступ к биомолекулам размером менее 50 кДа. Таким образом, будущие эксперименты MSPT смогут изучать динамику одной молекулы и взаимодействия, связанные с мембраной, для еще более широкого спектра мембранных мимикрий, таких как мягкие бислои и макромолекулярные системы.
Раскрытие информации
У авторов нет конфликта интересов.
Благодарности
Мы искренне ценим поддержку филиппа Кукуры, Гэвина Янга и команды разработчиков программного обеспечения Refeyn и признаем их помощь, делясь частями кода анализа изображений. Мы благодарим Cryo-EM MPIB Core Facility за предоставление доступа к коммерческому массовому фотометру Refeyn. F.S. с благодарностью отмечает поддержку и финансирование, предоставленные Юргеном Плицко и Вольфгангом Баумайстером. T.H. и P.S. получили финансирование через Deutsche Forschungsgemeinschaft (DFG, Немецкий исследовательский фонд) - Project-ID 201269156 - SFB 1032 (A09). N.H. был поддержан грантом DFG на возврат HU 2462/3-1. P.S. признает поддержку через исследовательскую сеть MaxSynBio через совместную инициативу финансирования Федерального министерства образования и исследований Германии (BMBF) и Общества Макса Планка.
Материалы
| Name | Company | Catalog Number | Comments |
| annexin V | Sigma Aldrich | #SRP8026 | examplary membrane-interacting protein |
| Bio-Rad Protein Assay | Bio-Rad Laboratories Inc. | #5000006 | bradford assay kit to determine protein stock concentrations |
| biotin labeled bovine albumin | Sigma Aldrich | #A8549 | examplary protein that can be used as standard protein for MSPT |
| cholera toxin subunit B | Sigma Aldrich | #SAE0069 | examplary membrane-interacting protein |
| cover glasses, #1.5, 24 x 24 mm | Paul Marienfeld GmbH & Co. KG | #0102062 | |
| cover glasses, #1.5, 24 x 60 mm | Paul Marienfeld GmbH & Co. KG | #0102242 | |
| dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | #850375 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoethanolamine-N-cap biotinyl (18:1 Biotinyl Cap PE | Avanti Polar Lipids | #870273 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoglycerol (DOPG) | Avanti Polar Lipids | #840475 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) | Avanti Polar Lipids | #840035 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| double-sided tape | tesa | #57912-00000-02 | needed for the assembly of glass sample chambers |
| Extruder | Avanti Polar Lipids | #610023 | Lipid extruder to enable monodisperse vesicle distributions |
| EZ-Link Maleimide-PEG2-Biotin | Thermo Fisher Scientific | #A39261 | maileimide-fused biotin that can be used to biotinylate standard proteins for MSPT |
| Fibronectin (Biotinylated) | Cytoskeleton Inc. | #FNR03-A | examplary protein that can be used as standard protein for MSPT |
| Gel Filtration HMW Calibration Kit | Cytiva | #28403842 | standard proteins, e.g. aldolase that can be biotinylated and used as molecular weight standards for MSPT |
| GM1 Ganglioside (Brain, Ovine-Sodium Salt) | Avanti Polar Lipids | #860065 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Biotin | Thermo Fisher Scientific, Waltham, USA) | #31820 | examplary protein to highlight the existence of different protein states |
| Isopropanol, 99.5%, for spectroscopy | Thermo Fisher Scientific | #10003643 | |
| Low Autofluorescence Immersion Oil | Olympus K.K. | #IMMOIL-F30CC | |
| pET21a-Streptavidin-Alive | Addgene | #20860 | required to express and purify divalent streptavidin in combination with each other |
| pET21a-Streptavidin-Dead | Addgene | #20859 | required to express and purify divalent streptavidin in combination with each other |
| Pierce Alkaline Phosphatase, biotinylated | Thermo Fisher Scientific | #29339 | examplary protein that can be used as standard protein for MSPT |
| Pierce Protein A, Biotinylated | Thermo Fisher Scientific | #29989 | examplary protein that can be used as standard protein for MSPT |
| Refeyn Acquire | Refeyn Ltd. | control software for Refeyn OneMP | |
| Refeyn One | Refeyn Ltd. | - | mass photometer |
| sterile syringe filters 0.45 µm cellulose acetate membrane | VWR International | #514-0063 | needed to filter particles from the buffer of interest |
| tetravalent streptavidin | Thermo Fisher Scientific | #SNN1001 | tetravalent streptavidin to enable the presence of several biotin binding sites |
| Whatman Nuclepore Hydrophilic Membrane, 0.05 µm Pore Size, 25 mm Circle | Cytiva | #110603 | a pore size of 50 nm is recommended for supported lipid bilayer formation in the context of MSPT |
| Zepto model 2 plasma cleaner | Diener electronic GmbH | - |
Ссылки
- Robertson, J. L. The lipid bilayer membrane and its protein constituents. Journal of General Physiology. 150 (11), 1472-1483 (2018).
- Grecco, H. E., Schmick, M., Bastiaens, P. I. H. Signaling from the Living Plasma Membrane. Cell. 144 (6), 897-909 (2011).
- Cho, W., Stahelin, R. V. Membrane-protein interactions in cell signaling and membrane trafficking. Annual Review of Biophysics and Biomolecular Structure. 34, 119-151 (2005).
- Whited, A. M., Johs, A. The interactions of peripheral membrane proteins with biological membranes. Chemistry and Physics of Lipids. 192, 51-59 (2015).
- Gonzalez, L., Scheller, R. H. Regulation of membrane trafficking: Structural insights from a Rab/effector complex. Cell. 96 (6), 755-758 (1999).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- Bagheri, Y., Ali, A. A., You, M. Current methods for detecting cell membrane transient interactions. Frontiers in Chemistry. 8, 603259(2020).
- Miller, H., Zhou, Z., Shepherd, J., Wollman, A. J. M., Leake, M. C. Single-molecule techniques in biophysics: A review of the progress in methods and applications. Reports on Progress in Physics. 81 (2), 024601(2018).
- Manzo, C., Garcia-Parajo, M. F. A review of progress in single particle tracking: From methods to biophysical insights. Reports on Progress in Physics. 78 (12), 124601(2015).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331 (6155), 450-453 (1988).
- Funatsu, T., Harada, Y., Tokunaga, M., Saito, K., Yanagida, T. Imaging of single fluorescent molecules and individual ATP turnovers by single myosin molecules in aqueous solution. Nature. 374 (6522), 555-559 (1995).
- Schmidt, T., Schütz, G. J., Baumgartner, W., Gruber, H. J., Schindler, H. Imaging of single molecule diffusion. Proceedings of the National Academy of Sciences of the United States of America. 93 (7), 2926-2929 (1996).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Kukura, P., et al. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405(2006).
- Ueno, H., et al. Simple dark-field microscopy with nanometer spatial precision and microsecond temporal resolution. Biophysical Journal. 98 (9), 2014-2023 (2010).
- Loose, M., Fischer-Friedrich, E., Herold, C., Kruse, K., Schwille, P. Min protein patterns emerge from rapid rebinding and membrane interaction of MinE. Nature Structural and Molecular Biology. 18 (5), 577-583 (2011).
- Bezeljak, U., Loya, H., Kaczmarek, B., Saunders, T. E., Loose, M. Stochastic activation and bistability in a Rab GTPase regulatory network. Proceedings of the National Academy of Sciences of the United States of America. 117 (12), 6504-6549 (2020).
- Ha, T., Tinnefeld, P. Photophysics of fluorescent probes for single-molecule biophysics and super-resolution imaging. Annual Review of Physical Chemistry. 63 (1), 595-617 (2012).
- Garcia-Parajo, M. F., Segers-Nolten, G. M. J., Veerman, J. A., Greve, J., Van Hulst, N. F. Real-time light-driven dynamics of the fluorescence emission in single green fluorescent protein molecules. Proceedings of the National Academy of Sciences of the United States of America. 97 (13), 7237-7242 (2000).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495(2014).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Heermann, T., Steiert, F., Ramm, B., Hundt, N., Schwille, P. Mass-sensitive particle tracking to elucidate the membrane-associated MinDE reaction cycle. Nature Methods. 18 (10), 1239-1246 (2021).
- Foley, E. D. B., Kushwah, M. S., Young, G., Kukura, P. Mass photometry enables label-free tracking and mass measurement of single proteins on lipid bilayers. Nature Methods. 18 (10), 1247-1252 (2021).
- Voss, O. H., Lee, H. N., Tian, L., Krzewski, K., Coligan, J. E. Liposome preparation for the analysis of lipid-receptor interaction and efferocytosis. Current Protocols in Immunology. 120, 1-21 (2018).
- Pincet, F., et al. FRAP to characterize molecular diffusion and interaction in various membrane environments. PLoS ONE. 11 (7), 0158457(2016).
- Howarth, M., et al. A monovalent streptavidin with a single femtomolar biotin binding site. Nature Methods. 3 (4), 267-273 (2006).
- Allan, D., et al. soft-matter/trackpy: Trackpy v.0.5.0. Zenodo. , (2021).
- Weimann, L., et al. A quantitative comparison of single-dye tracking analysis tools using Monte Carlo simulations. PLoS ONE. 8 (5), 64287(2013).
- Michalet, X. Mean square displacement analysis of single-particle trajectories with localization error: Brownian motion in an isotropic medium. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 82 (4), 041914(2010).
- Sygusch, J., Beaudry, D., Allaire, M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution. Proceedings of the National Academy of Sciences of the United States of America. 84 (22), 7846-7850 (1987).
- Heath, G. R., Scheuring, S. High-speed AFM height spectroscopy reveals µs-dynamics of unlabeled biomolecules. Nature Communications. 9 (1), 4983(2018).
- Day, C. A., Kenworthy, A. K. Mechanisms underlying the confined diffusion of cholera toxin B-subunit in intact cell membranes. PLOS ONE. 7 (4), 34923(2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены