Method Article
膜関連高分子ダイナミクスを特徴付けるための質量感受性粒子追跡
要約
このプロトコルは、iSCATベースの画像処理と単粒子追跡アプローチを記述し、脂質膜と相互作用する高分子の分子量と拡散挙動の同時調査を可能にします。サンプル調製、質量コントラスト変換、ムービー取得、および後処理に関するステップバイステップの手順が、潜在的な落とし穴を防ぐための指示とともに提供されます。
要約
多数の重要な生物学的反応が起こる界面である脂質膜における高分子の短命または一過性の相互作用は、標準的な生物物理学的方法で評価することは本質的に困難である。質量感受性粒子追跡(MSPT)の導入は、そのようなプロセスの徹底的な定量的特性評価に向けた重要なステップを構成する。技術的には、これは干渉散乱顕微鏡(iSCAT)ベースの質量測光法(MP)の出現によって可能になりました。膜関連粒子の2次元運動を明らかにするためにバックグラウンド除去戦略が最適化されると、この技術は、生体膜上の標識されていない巨大分子の拡散および分子質量の両方のリアルタイム分析を可能にする。ここでは、膜関連システムの質量感受性粒子追跡を実行および分析するための詳細なプロトコルが記載されている。市販の質量光度計で実行される測定は、ミリ秒レジームの時間分解能を達成し、MPシステムに応じて、50kDaまでの質量検出限界を達成します。膜触媒巨大分子ダイナミクス全般の詳細な分析のためのMSPTの可能性を示すために、天然の膜相互作用体アネキシンVなどの例示的なタンパク質系について得られた結果が提示される。
概要
かつては、広範囲の周囲の物理的条件に対する障壁として認識されていただけで、生体膜は今日では機能的実体および触媒プラットフォームと考えられている1,2。膜関連巨大分子反応に応答してシグナルを局在化、増幅、および誘導する能力に基づいて、脂質界面は、膜トラフィッキングおよびシグナル伝達カスケードなどの多種多様な細胞プロセスにとって重要な要素を構成する3、4、5。安定な複合体の集合のための核生成部位として機能する膜付着は、しばしば、膜会合型と細胞質ゾル型の巨大分子との間の動的平衡に依存し、したがって一過性の性質を有する6,7。
生物学におけるそれらの大きな重要性にもかかわらず、膜関連巨大分子反応の組成的、空間的、および時間的不均一性へのアクセスをリアルタイムで提供できる方法を開発することは、これまでのところ困難であった7,8。基礎となる分子プロセスを解明するために、2つの実験的側面が決定的である:十分な時間分解能および単一粒子感度。したがって、フォトブリーチング後の蛍光回復(FRAP)だけでなく、はるかに高感度な蛍光相関分光法(FCS)などのアンサンブル平均技術には、空間情報と時間的情報の大部分が切り離されるため、限界があります9。したがって、個々の分子ダイナミクスの特性評価に向けた重要なステップは、高感度顕微鏡法と組み合わせた単一粒子追跡(SPT)の出現であった。特に、2つのSPTアプローチがこの点で有効であることが証明されています。第一に、蛍光色素を標識として利用し、それに対応する蛍光検出システムを利用することで、ナノメートル精度とミリ秒の時間分解能10,11,12への道が開かれました。第二に、金ナノ粒子を用いた散乱ベースの検出は、それぞれ13、14、15、16のサブナノメートルおよびマイクロ秒範囲への局在化精度および時間分解能の両方を改善した。両方のアプローチの多くの利点と、膜関連系の機構的理解に関するそれらの重要な貢献17,18にもかかわらず、両方の技術は、これまでのところ限定的であった:それらは、潜在的にそれらの本来の挙動を摂動させ、膜関連粒子19,20の分子組成に鈍感である、関心のある分子の標識を必要とする。
これらの制限は両方とも、質量測光(MP)21、22、23と呼ばれる新しい干渉散乱(iSCAT)ベースのアプローチの導入によって最近克服されました。この技術により、ガラス界面に着弾したときのiSCATコントラストに従って生体分子の溶液中質量分布を決定することができます。しかし、脂質膜上に拡散する移動分子の検出と特性評価のためには、より洗練された画像解析アプローチを開発する必要がありました。これは、その間、首尾よく実施されており、脂質界面24、25上に拡散している単一の非標識生体分子の分子質量を検出、追跡、および決定することを可能にする。動的質量測光法または質量感受性粒子追跡(MSPT)と呼ばれるこの技術は、追跡された実体の分子量の変化を直接記録することによって複雑な巨大分子相互作用の評価を可能にし、したがって膜関連分子動力学の機構的分析のための新しい可能性を開く。
ここでは、MSPTに必要なサンプル調製、イメージング、およびデータ分析パイプラインのための詳細なプロトコルが提示される。特に、測定および分析中に発生する可能性のあるサンプル要件および潜在的な問題が議論される。さらに、膜相互作用する高分子系を分析する比類のない可能性は、様々な代表的な結果を通して示されています。
プロトコル
1. サンプル調製
- マルチラメラ小胞(MLV)の生成
- クロロホルム溶解脂質の量を、所望の脂質混合物および必要な懸濁液体積に応じて計算する。
注: 再懸濁 (反応) バッファーには、最終小胞濃度 4 mg/mL 脂質を推奨します。 - 計算された脂質の体積を、ガラスチップを備えた容積ピペットを用いて1.5 mLのガラスバイアルにピペットする。
- かすかな窒素の流れの下で脂質溶媒を蒸発させ、バイアルを絶えず回転させて、ガラス壁上の脂質の均等分布を保証する。
- バイアルを窒素の安定した流れの下に15分間置くことによって、完全な溶媒蒸発を確実にする。
- 真空デシケーター中でさらに1時間真空乾燥することにより、残留微量のクロロホルムを除去する。
- 脂質混合物を所望の再懸濁(反応)緩衝液中で再水和し、脂質膜がバイアルの壁から溶解するまで懸濁液を徹底的に渦巻きにする。
注:反応緩衝液は、タンパク質の活性および安定性を保証するべきである。本試験で用いた反応緩衝液は、50 mM トリス塩酸 (pH = 7.5)、150 mM KCl、および 5 mM MgCl2 を含む。脂質またはタンパク質を希釈するために使用される緩衝液は、干渉する粒子状不純物を除去するために濾過する必要があることに注意してください(ステップ5を参照)。
- クロロホルム溶解脂質の量を、所望の脂質混合物および必要な懸濁液体積に応じて計算する。
- 小型単層小胞(SUV)の生成
- 脂質再懸濁液の連続凍結融解サイクル(ステップ1.1.6)のために、ホットプレート上のビーカー(70°C〜99°Cの間)で500mLの水を沸騰させ、液体窒素を含む容器を調製する。
- 脂質再懸濁液を液体窒素中でショック凍結する。溶液が完全に解凍されるまで、バイアルを熱水でビーカーに移す。この凍結融解サイクルを8〜10回繰り返すか、以前に濁っていた混合物が透明になるまで繰り返す。
警告: 液体窒素、凍結脂質バイアル、または沸騰水に直接触れないように、ゴーグル、手袋、ピンセットなどの適切な安全衣服および機器を使用してください。 - 単分散ベシクル分布を生成するには、脂質押出機を組み立て、反応バッファーでその完全性をテストして、漏れがないことを確認します。
メモ: 漏れが観察された場合は、バッファーのこぼれが明確になるまで、脂質押出機を慎重に組み立て直してください。 - 37のための脂質懸濁液を押し出し、孔径50nmの核孔膜26を通過する。最終的なSUV混合物が核孔膜を横切り、したがって脂質凝集体または多層小胞を含まないことを保証するために、パスの数は不均一でなければならない。押し出された小胞は、後で支持された脂質二重層を形成するために使用される(ステップ6および7を参照のこと)。
注:SUVは、同様に、再水和脂質混合物の超音波処理によって形成することができる。しかし、押出 成形による 調製は、SUVのより単分散な分布を提供し、支持された脂質二重層形成中の小胞破裂を促進する。押し出された小胞は、冷蔵庫で最大3日間保存することができます。
2. 顕微鏡スライドの洗浄
- ポリテトラフルオレエチレン(PTFE)顕微鏡ホルダーに、24 mm x 60 mmおよび24 mm x 24 mmの寸法の顕微鏡スライド(No. #1.5、厚さ0.17 mm)を同数配布します。
- PTFEホルダーを超純水を含むビーカーに移し、室温で15分間超音波処理します。
メモ:ビーカーによっては、PTFEホルダーを完全に覆うように水量を調整する必要があります。 - ピンセットを使用してビーカーからホルダーを取り外し、水を超高純度イソプロパノールに置き換えます。ホルダーをイソプロパノールを含むビーカーに挿入し、再度15分間超音波処理する。
注:ビーカーに応じて、PTFEホルダーを完全に覆うようにイソプロパノールの容量を調整する必要があります。 - イソプロパノールを超純水と交換し、ホルダーを含むビーカーを15分間超音波処理する。
- PTFEホルダーをビーカーから取り外し、窒素ガスまたは圧縮空気の安定した流れの下でホルダー内の顕微鏡スライドをブロードライします。
メモ:手袋、清潔なビーカー、およびパラフィンフィルムを使用して各ビーカーを覆って、カバースライドを適切にクリーニングしてください。そうしないと、残留粉塵がMSPT測定中に大きなバックグラウンド変動を引き起こす可能性があります。
3. 顕微鏡スライドの親水化
注:均質で流体支持された脂質二重層を得るためには、スライドの親水化が不可欠であり、フローチャンバアセンブリの直前に行わなければならない。
- 24 mm x 60 mmの顕微鏡スライドのみを含むPTFEホルダーを、酸素をプロセスガスとして含むプラズマクリーナーに入れ、顕微鏡スライドをプラズマで洗浄します(この作業で使用するパラメータ:30%パワー、0.3mbar酸素圧30秒;使用したプラズマクリーナーの詳細については 、材料表 を参照してください)。
メモ:流体膜を得るには、電力、酸素圧力、洗浄時間などのプラズマ洗浄パラメータを機器ごとに調整する必要があります。この目的のために、膜流動性を確保するために蛍光標識脂質の使用が推奨され、これはフォトブリーチング後の蛍光回収(FRAP)実験27で定量することができる。パラメータがそれぞれのセットアップに対して最適化されていない場合、膜の流動性の低下により膜の拡散が損なわれる可能性があります。
4. フローチャンバの組み立て
- フローチャンバーを組み立てる前に、洗浄済みの顕微鏡スライド(24 mm x 24 mm)、親水化顕微鏡スライド(24 mm x 60 mm)、アルミホイル、平らな段ボール、メス、両面テープなどのコンポーネントを準備してください。
- 平らな段ボールをアルミホイルで包みます。
- 洗浄した24 mm x 24 mmの顕微鏡スライドをアルミニウム箔に十分な距離を置いて広げます。
- スライドの上端と下端に両面テープストリップを取り付けます。
- 各顕微鏡スライドをメスで切り取り、アルミ箔から取り除くことができるようにします。そのため、各スライドには、スライドの上端と下端に両面テープのストライプを貼り付ける必要があります( 図1参照)。
- 2 つの両面テープストリップで 24 mm x 24 mm スライドを親水化 24 mm x 60 mm スライドに取り付け、小さい顕微鏡スライドと大きい顕微鏡スライドの間に流路を形成します。
注:フローチャンバを清潔にするために、常に手袋を着用し、作業台にほこりがないことを確認してください。
5. 反応バッファーのろ過
- すべての反応バッファーを 0.45 μm の酢酸セルロース膜で滅菌ろ過し、MSPT 測定中のバックグラウンドシグナルを最小限に抑えます。
注:ATPなどのヌクレオチドの存在が実験の成功に不可欠な場合は、バックグラウンドシグナルの潜在的な増加に注意してください。タンパク質活性を保証する最小限の量のみを使用することをお勧めします。
6. 支持脂質二重層(SLB)形成
注:質量光度計上で支持された脂質二重層の形成を実行して、小胞の拡散と未融合小胞の完全な除去を視覚的に保証することをお勧めします。
- 押し出したばかりのSUV(詳細についてはステップ1を参照)を、必要な反応緩衝液中で最終濃度0.4mg/mLに希釈する。任意選択で、小胞破裂を促進するために、小胞懸濁液に2mM CaCl2 を添加する。
注:2価の陽イオンは、PiP2などの一部の脂質の凝集を引き起こす可能性がある。このような脂質を含む混合物の場合、再懸濁緩衝液中の小胞破裂または他の二 価カチオンの促進のためにCaCl2を使用することを控える。実験に必要な場合、二価カチオンは、支持脂質二重層の形成に成功した後に添加することができる。 - 50μLの小胞懸濁液をフローチャンバに流し(ステップ4)、チャンバを2分間インキュベートする。
注:緩衝液、小胞、またはタンパク質溶液は、浸漬組織の小さな部分でフローチャンバを通してフラッシュすることができます。ただし、機械式ポンプシステムを用いることもできる。 - 毎回200 μLの反応緩衝液によるフローチャンバの反復(少なくとも3回)洗浄によって未融解小胞を除去する。
メモ:MSPT測定中に安定したバックグラウンド信号を確保するために、ベシクルをフローチャンバから完全に洗い流す必要があります。
7. 検量線の作成
注:検出された粒子のコントラストを分子量に変換するには、既知のサイズのタンパク質を使用してシグナルを較正する必要があります。標準タンパク質サイズレジームを調整して、目的のシステムに期待される分子量の範囲をカバーすることをお勧めします。
- システイン残基を有する標準タンパク質のビオチン化
- メーカーの指示に従って、標準タンパク質のマレイミドビオチンの適切な量を計算します。
- 標準タンパク質を、決定された量のマレイミド - ビオチンと共に室温で1時間インキュベートする。
- 共役ビオチン-タンパク質複合体から非結合マレイミド-ビオチンを除去するには、目的のタンパク質に適したカラムでサイズ排除クロマトグラフィーを行います。
- ブラッドフォードアッセイを用いてタンパク質濃度を決定する。
注:さらなる測定のために標準タンパク質を保存するには、液体窒素中の使い捨てアリコートでタンパク質を凍結し、-80°Cで保存します。
- 検量線用標準タンパク質の測定
- フローチャンバー内で、0.01モル%(v/v)ビオチニルキャップPE(1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン-N-キャップビオチニル)を含む0.4mg/mL押出SUV(詳細についてはステップ1および6を参照)で支持脂質二重層を調製する。
- 50 μLの2.5 nM二価ストレプトアビジンをフローチャンバー内の二重層に加え、10分間インキュベートする。
注:二価のストレプトアビジンは、Howarth et al.28に概説されているように発現および精製されている。4価のストレプトアビジンも同様に使用することができる。しかしながら、二価のストレプトアビジンの使用は、種の割り当てを容易にするために、ビオチン化脂質とビオチン部分にコンジュゲートされた標準タンパク質との間の可能な反応化学量論を減少させることができる。 - 未結合の二価ストレプトアビジンを100μLの反応緩衝液で除去する。
- 50 μLの100 nMビオチン結合標準タンパク質をフローチャンバー内の二重層に加え、2分間インキュベートする。
注:ビオチン化効率および2価または4価のストレプトアビジンが使用されるかどうかに応じて、ビオチン結合標準タンパク質およびストレプトアビジンの最適濃度は変化し得る。 - 手順8で概説した詳細に従ってMSPT測定を実行します。
警告: イメージング条件は、サンプル標準と校正標準の両方で同一である必要があります。
8. イメージング
- SLB形成とサンプル調製
- ステップ6でより詳細に説明したように、所望の脂質混合物(25μL)のSUVをサンプルフローチャンバに導入し、支持脂質二重層を形成する。チャンバーを100 μLの反応バッファーで徹底的に洗浄(3回)し、未融合小胞をすべて除去した。
- 50 μLの目的タンパク質をサンプルチャンバーに加える。
注: MSPT は単一粒子法であるため、タンパク質濃度は pM ~ nM の範囲に保たれ、乱れのない粒子の検出と追跡が可能になる必要があります。
- ビデオ取得
- 集録ソフトウェアで視野(FOV)、フレームレート、露光時間、集録時間などの所望の撮影条件を設定します。
注:次の設定は、市販の質量光度計( 材料表を参照)のMSPTで動作することが証明されています:128ピクセルx 35ピクセルのFOV、1kHzのフレームレート、その後の5倍のフレーム平均化後に約200フレーム/秒、および0.95ミリ秒の露光時間。 - フォーカスを自動または手動で調整します。必要に応じて、横方向制御を使用して、FOVを均質な膜を有する位置に移動する。
- プロジェクトフォルダを作成し、ムービーの録画を開始します。記録が完了したら、集録ソフトウェアからプロンプトを出されるダイアログでファイル名を指定します。ムービーは、その後の解析のためにMPファイルとしてプロジェクトフォルダに自動的に保存されます。
注:異なるフローチャンバで少なくとも3つの複製を記録して、個々の膜の完全性と結果の再現性を確保します。ムービーの再生時間は事前に設定でき、実験の種類によって異なります。ほとんどの場合、集録時間は5分~7分を推奨します。
警告: デフォルトでは、市販の質量光度計取得ソフトウェアの動画録画は、保存スペースを減らすために保存される前に圧縮されます。ただし、このプロトコルで説明されているように、カスタムデータ分析を有効にするには、ファイル圧縮をオフにする必要があります。ファイル圧縮をオフにする方法の詳細については、製造元のユーザーマニュアルを参照してください。
- 集録ソフトウェアで視野(FOV)、フレームレート、露光時間、集録時間などの所望の撮影条件を設定します。
9. データ解析
注: データ分析パイプラインには、2 つの対話型 Jupyter ノートブック (MSPT analysis.ipynb、Movie visualization.ipynb) が付属しています。以下に概説する MSPT 分析を実行するために必要な Jupyter ノートブックおよび関連するカスタム記述の Python モジュールは、パブリックリポジトリ https://github.com/MSPT-toolkit/MSPT-toolkit で入手できます。以下の分析に関する詳細な手順については、上記のリンクを使用してアクセスされるMSPT analysis.ipynb を参照してください。
- ビデオ処理
- image_processing.mp_reader 関数を使用したピクセル単位の背景推定アルゴリズムを使用して、光の支配的な静的散乱を除去します。
- 背景の削除を適用するには、パラメーター モードの continuous_median オプションを選択し、ノートブック セクション B.1 のスライド メディアン ウィンドウ (window_length) に適切な長さを設定します。必要に応じて、背景の除去後にムービーを保存して、パーティクル検出と軌道リンクに使用します(パラメータ save_processed_movies を True に設定します)。
メモ: ウィンドウサイズ(window_length)は、膜上の粒子密度、予想される拡散係数、取得フレームレート、および必要な処理速度に応じて、101 ~ 2001 の値に調整します。
警告: バックグラウンド除去戦略は、膜があまりにも密集しておらず、粒子の拡散が十分に速い場合(つまり、各ピクセルがほとんどの場合、粒子で占有されていない場合)にうまく機能します。さもなければ、粒子のコントラストは、バックグラウンド信号と適切に区別できないため、体系的に過小評価される。これは、計算速度を犠牲にしてウィンドウの中央値を大きくすることで補うことができます。ただし、ウィンドウサイズの設定が大きすぎると、サンプルドリフトによって出力に悪影響を及ぼす可能性があることに注意してください。処理されたビデオの目視検査は非常に重要です。
- 背景の削除を適用するには、パラメーター モードの continuous_median オプションを選択し、ノートブック セクション B.1 のスライド メディアン ウィンドウ (window_length) に適切な長さを設定します。必要に応じて、背景の除去後にムービーを保存して、パーティクル検出と軌道リンクに使用します(パラメータ save_processed_movies を True に設定します)。
- particle_fitting.particle_fitter 関数を使用して、ムービー全体のパーティクルとそれぞれの位置を検出します (ノートブックのセクション B.2 を参照)。
- 粒子検出の感度をしきい値パラメーター (thresh; ノートブックのセクション B.1 を参照) で調整します。このパラメーターは、画像の 2 値化によって候補スポットを強調表示するために使用されます。スポット検出感度に対するしきい値パラメーターの変化の影響は、別のノートブック (Movie visualization.ipynb) で調べることができます。パーティクル検出の結果は、ムービーファイルのサブディレクトリにあるCSVファイルに自動的に保存されます。
注:スレッショルドパラメータを任意に低く設定する(たとえば、使用されている質量光度計で撮影したムービーの場合、スレッショルドパラメータを0.0005未満にする)ことは、候補スポットがスプリアスノイズによって支配されるため、処理時間が長くなるため、推奨されません。
- 粒子検出の感度をしきい値パラメーター (thresh; ノートブックのセクション B.1 を参照) で調整します。このパラメーターは、画像の 2 値化によって候補スポットを強調表示するために使用されます。スポット検出感度に対するしきい値パラメーターの変化の影響は、別のノートブック (Movie visualization.ipynb) で調べることができます。パーティクル検出の結果は、ムービーファイルのサブディレクトリにあるCSVファイルに自動的に保存されます。
- image_processing.mp_reader 関数を使用したピクセル単位の背景推定アルゴリズムを使用して、光の支配的な静的散乱を除去します。
- 連続するフレーム内のパーティクルを Python パッケージ trackpy (v.0.5.0)29 を使用して軌道にリンクします。
メモ: 軌道リンクは、スポット検出後にその場で実行されます。その結果、軌跡情報を含む追加のCSVファイルが、粒子検出CSVファイルのサブディレクトリに格納される。- パラメータminimum_trajectory_length(ノートブックのセクションB.1を参照)を使用して点が少なすぎる軌道を削除し、拡散係数の堅牢な決定を可能にします。trackpy 関数の他のパラメータに関する詳細な説明については、trackpy のドキュメントを参照してください。
- 軌道解析
- ノートブックのセクション C.1 で、ムービーの取得に使用したフレームレート (frame_rate) とピクセルサイズを nm (pixel_size) 単位で指定します。 trackpy によって返される軌跡情報を含む CSV ファイルのリストを作成します (手順 9.2 を参照)、 trajectory_analysis.get_csv_files 関数 (ノートブックセクション C.2) を使用します。
- さらに、フィッティング結果をディスクに保存するために使用される HDF5 コンテナの出力ファイル名を指定します (ノートブックセクション C.3)。CSV ファイルのリストを反復処理するノートブック セクション C.4 の trajectory_analysis.fit_trajectories 関数を使用して、すべての軌跡を分析します。この関数は、ジャンプ距離分布 (JDD)30 および平均二乗変位 (MSD)31 解析を使用して、各軌道の拡散係数を推定します。
- MSPTキャリブレーションから得られたコントラスト-質量関係を使用して、各軌道の中央コントラストを対応する質量に変換します(セクション7を参照)。iSCAT のコントラストを分子量に関連付けるキャリブレーションラインの傾き (スロープ) と y 切片 (オフセット) を指定します (関数 trajectory_analysis.apply_calibration; ノートブックのセクション C.5 を参照)。この関数は、軌跡の中央値質量を持つ列を各データ フレームに追加します。
- 関数 trajectory_analysis.membrane_density を使用して膜上の見かけの粒子密度を評価します。この関数は、検出された粒子と各フレーム内の現在の軌跡 (ノートブックのセクション C.6 を参照) に関する中央値の値をデータ フレーム内の追加の列として返します。
注: 検出プロセスと軌道リンク プロセスの両方でパーティクルの一部が失われるため、実際のパーティクル密度が高くなる可能性があります。粒子密度と質量ヒストグラムに関する信頼性の高い結果を得るには、代表的なムービースナップショットを目視で検査して、測定条件が単一粒子トラッキングに妥当であることを確認します(ステップ9.1.1を参照)。
10. データビジュアライゼーション
- 質量係数と拡散係数と、Python パッケージ fastkde (v.1.0.19; https://pypi.org/project/fastkde/) に基づく 2 次元カーネル密度推定 (KDE) との相関関係を示します。
- プロットを生成するには、MSPT結果を含むHDF5ファイルを指定し(ステップ9.3.2およびノートブックセクションD.1を参照)、 plotting.generate_2D_KDE 関数(ノートブックセクションD.4)の入力データとして、単一のデータフレーム(ノートブックセクションD.2)または連結データフレーム(ノートブックセクションD.3)を選択します。
注: プロットされた各データセットには、信頼性の高い 2D-KDE を実現するために、理想的には 1,000 を超える軌道が含まれている必要があります。
結果
フローチャンバ内で支持された脂質二重層(SLB)を調製するための本明細書の詳細なプロトコール(図1)に従って、表示されたすべての条件のネイティブビューにおいてスペックル様パターンを明瞭に認識することができる(図2)。この効果は、一般に散乱信号を支配し、視覚的に区別できない条件(ガラス、SLBを有するガラス、またはSLBおよび付着タンパク質を有するガラス)をもたらすガラスの表面粗さによって引き起こされる。しかし、小胞の存在は、小胞の散乱断面が大きいため明確に区別され、小胞の破裂や均質な膜への融合の観察が可能となる(図2B、補足動画1)。視野24,25内の動的要素を強調するレシオメトリックアプローチでガラス表面の静的散乱信号を除去すると、膜上に拡散している標識されていないタンパク質(図2D)を明らかにすることができますが、空のSLB(図2C)またはガラス自体(図2A)はノイズの多い画像として表示されます。
MSPT測定の固有の背景は、各ピクセル値を同じ画像位置にあるムービーの前後のn個のピクセルの中央値で割ることによって局所的に推定できます(図3)。その結果、高分子は等方性点像分布関数(PSF)として現れ、その膜上の運動を観察、追跡、定量化することができる。実際、コントラストと動的挙動の両方が利用可能であるため、粒子にラベルを付けることなく、粒子の分子サイズをそれぞれの拡散挙動に直接関係させることができます。それにもかかわらず、MSPT実験中に決定されたiSCATコントラストを解釈するためには、シグナル振幅を分子質量に変換する較正を行うことが不可欠である。これは、ビオチン-ストレプトアビジン-ビオチン複合体を介して既知の質量の生体分子をSLBに結合させることによって達成することができる(図4A)。例示的な戦略として、ウシ血清アルブミン(BSA)、プロテインA(prA)、アルカリホスファターゼ(AP)、およびフィブロネクチン(FN)のビオチン化変異体を使用することができ、これらはストレプトアビジン(STP)に結合し、それ自体が膜中のビオチン含有脂質(ビオチニルキャップPE)に結合している。図4Aに示されるように、これらの例示的な巨大分子のますます顕著なコントラストは、それぞれのビオチン化標準物質の分子量の増加を反映している。コントラストヒストグラム(図4B)の各ピークを標準タンパク質のオリゴマー状態の対応する質量に割り当てることにより、コントラストと質量の線形関係が明らかになり21、22、続いて未知の巨大分子系の分析に使用することができる(図4C)。
分子量を分析し、オリゴマーの状態とオリゴマー化イベントを研究するためのMSPTの適用性と能力を実証する良い例は、ビオチン化アルドラーゼとビオチン化IgGの考察です(図5)。アルドラーゼはホモ四量体32であると一般に報告されている。しかし、MSPTによって解決された質量分布は4つの異なるピークを特徴としており、これは複数の集団の存在を強調しています(図5A)。最初のマイナーピークは空いているストレプトアビジンに対応し、この種の実験の構成により期待できますが、2つのサブユニット(2SU)または6つのサブユニット(6SU)のみを有するアルドラーゼ複合体も同様に検出できます(図5B)。興味深いことに、四量体および六量体アルドラーゼ−ストレプトアビジン複合体は、二量体アルドラーゼおよびストレプトアビジン単独と比較して減少した拡散係数を示し、例えば、ストレプトアビジンへの第2のビオチン化脂質の付着 を介して 、増加した粘性抗力を示す。同様に、ビオチン化IgGは質量分布において3つのピークを示し、最初のピークは再び単一のストレプトアビジンの質量と一致する。最も豊富なピークの質量は、1つの軽鎖および1つの重鎖(1SU)、すなわちIgG抗体の半分の質量に対応する。2つの同一の半分(2SU)を有する完全抗体は、症例の約11%で検出される。複合体サイズの増加に伴う拡散係数の減少は、ストレプトアビジンと複数のビオチン化脂質との相互作用、または結合したIgGによって引き起こされる追加の抗力、またはその両方を示す。
膜依存性オリゴマー状態の唯一の分析に加えて、MSPTはまた、目的の巨大分子の拡散挙動をそのオリゴマー状態と相関させるという特定の利点も付与する。このタイプの分析の代表的な結果は、膜に取り込まれたジオレオイルホスファチジルセリン(DOPS)またはスフィンゴ糖脂質(GM1)にそれぞれ結合するアネキシンV(AnV)およびコレラ毒素サブユニットB(CTxB)について示されている(図6A)。どちらのカーネル密度推定(DDE)も、質量と拡散の単峰性分布を特徴とし、同様の拡散挙動を持つ単一の豊富な種を示しています。分子量および拡散係数のピーク位置は、AnV±それぞれ49.8 ± 2.2 kDaおよび1.4 ± 0.1 μm 2/sであり、CTxBではそれぞれ62.7 ± 3.1 kDaおよび0.4 μm2/sであることがわかった。測定された拡散係数は、高速AFMおよびFRAP33、34から得られた以前に報告された値に匹敵する。予想される巨大分子の質量(AnV三量体では52kDa、CTxB五量体では65kDa)と比較してわずかに減少した質量は、アンサンブル中のサブユニットが少ないより小さな複合体の存在を示している可能性がある。タンパク質間の質量差は小さく、顕微鏡の指定された検出限界(≈50kDa)に近いが、それらの拡散係数はかなり異なる。例えば、等モル混合物では、混合物の拡散をAnVおよびCTxB単独の分布と比較することによって、AnVはCTxBよりも膜上に豊富であると結論付けることができる(図6B)。しかし、CTxBの濃度がAnVの濃度と比較して2倍になると、平衡は膜上の優勢なタンパク質としてCTxBに向かってシフトする。AnVとCTxBの混合物について例示されるように、MSPTは、その分子量に応じて膜関連巨大分子を区別することを可能にするだけでなく、それらの拡散挙動に従って異なる巨大分子集団の識別も可能にする。
すべての顕微鏡技術と同様に、望ましい品質のデータを達成するためには、いくつかの実験要件が不可欠です。この文脈における重要な例は、徹底的に清掃されたカバースリップです。一般に、これは顕微鏡関連の単一分子実験の前提条件と考えられていますが、MSPTはサンプル不純物に特に敏感です。洗浄されていないカバースリップのガラス表面から生じる散乱の増加により、定量的なiSCAT測定が妨げられます。特に、洗浄が不十分なガラス上に汚れやほこりの粒子が残留していても、ネイティブイメージングモードでは輝点として認識できる顕著な画像歪みを引き起こす可能性があります(図7A)。これらの欠陥は静的な性質のためにバックグラウンド推定によって除去されますが、粒子のコントラストの正確な決定が損なわれる可能性があるため、定量分析に悪影響を及ぼす可能性があります。MSPT実験で遭遇するもう1つの一般的な問題は、視野を通して浮遊する(オレンジ色で囲まれた)残りの小胞、または膜上の特定の位置にくっついている(青色で囲まれた)融合していない小胞であり、大きな脈動散乱体として現れる(図7B)。それらの発生および映画取得への干渉を最小限に抑えるために、タンパク質を添加する前にSLBを徹底的に洗浄し、小さな単層小胞(SUV)および二価カチオンの新しく調製された混合物を使用することが推奨される。
質量感受性粒子追跡実験の設計に考慮しなければならない1つの要因は、膜界面に関連する高分子の密度である。膜上の高い粒子密度は、実際には2つの理由で問題を引き起こす可能性があります:i)連続したフレームから軌道への粒子検出のリンクはあいまいになり、したがってエラーの可能性と誤った拡散係数の可能性を高めます。ii)対応するPSF適合の振幅から抽出される粒子の質量は、動的粒子信号からの静的バックグラウンド信号の分離がますます困難になるため、体系的に過小評価され、質量ピークが広がる(図7C)。現在、MSPTビデオを取得する過程でのデータ品質の視覚的評価は、取得ソフトウェアに実装されたレシオメトリックビューが、ここおよび参考文献24、25に記載されている中央値ベースのアルゴリズムの代わりに、質量測光21のために確立された背景除去を使用しているため、利用可能な市販の顕微鏡では困難である(図7D).質量測光で着陸分子を視覚化するために使用される平均ベースの連続バックグラウンド除去は、拡散粒子を明るい尾を持つ暗い正面として表示し、スポットを非常に異方性に見せ、検出手順中のPSFフィッティングを妨害する。したがって、取得ソフトウェアにおいて実施された平均ベースの画像処理の使用は、膜上の拡散生体分子の解析には不適当である。
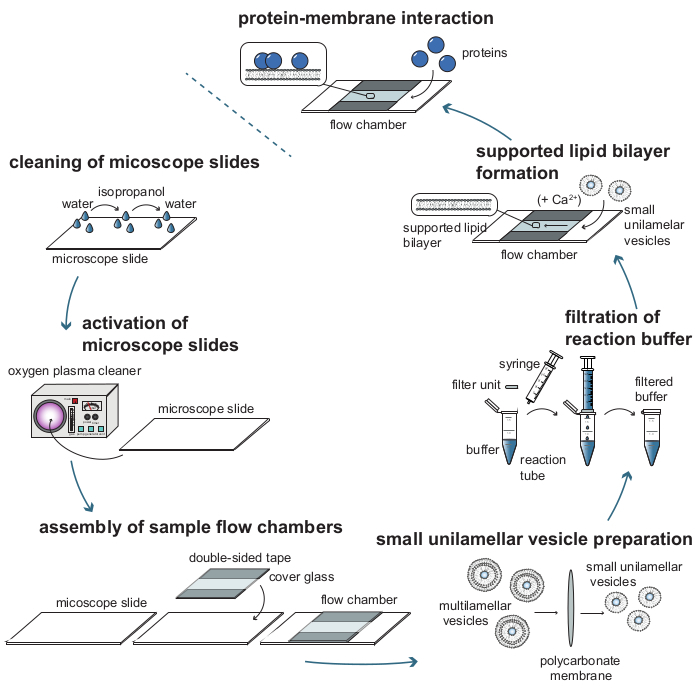
図1:質量感受性粒子追跡(MSPT)によるタンパク質-膜相互作用の解析に必要な個々のステップのプロセスフロー図。MSPT測定用のサンプルを調製するには、ガラスカバースライドを徹底的に洗浄し、酸素プラズマで活性化する必要があります。サンプルフローチャンバに組み立てた後、小さな単層小胞(SUV)を担持脂質二重層(SLB)形成のために調製し、バックグラウンド散乱を低減するためにすべての反応緩衝液を濾過する。SUVは、フローチャンバ内に脂質二重層を形成するために添加される。任意選択で、Ca2+イオンなどの2価の陽イオンをSUVに添加して、小胞破裂を促進してもよい。最後に、低濃度の目的タンパク質が反応チャンバにフラッシュされる。この図の拡大版を表示するには、ここをクリックしてください。
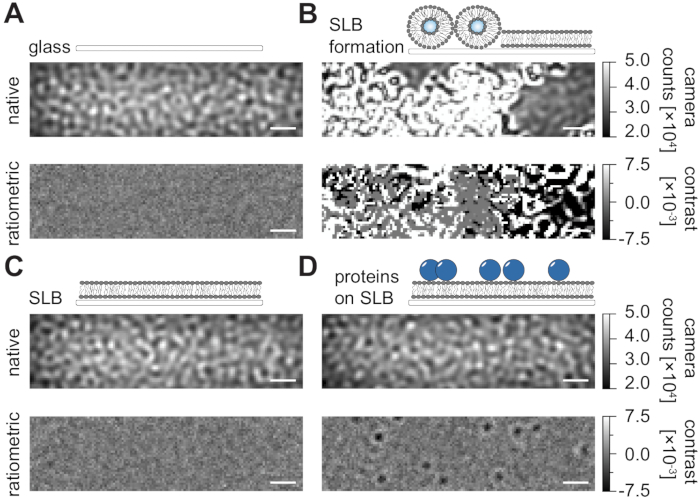
図2:MSPT測定に関連する例示的な表面のネイティブおよびレシオメトリック図。ガラスカバースライド(A)の表面粗さの代表的な画像は、支持脂質二重層(B)の形成中に、無傷の支持脂質二重層(C)およびSLB(D)上に再構成された例示的なタンパク質を有する。4つの例はすべてネイティブモードで表示され、測定自体の間にアクセスでき、中央値ベースの背景除去後に処理されたレシオメトリック画像として表示されます。スケールバーは1μmを表す。データ分析 (付属の Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1001 というパラメーターを使用しました。この図の拡大版を表示するには、ここをクリックしてください。
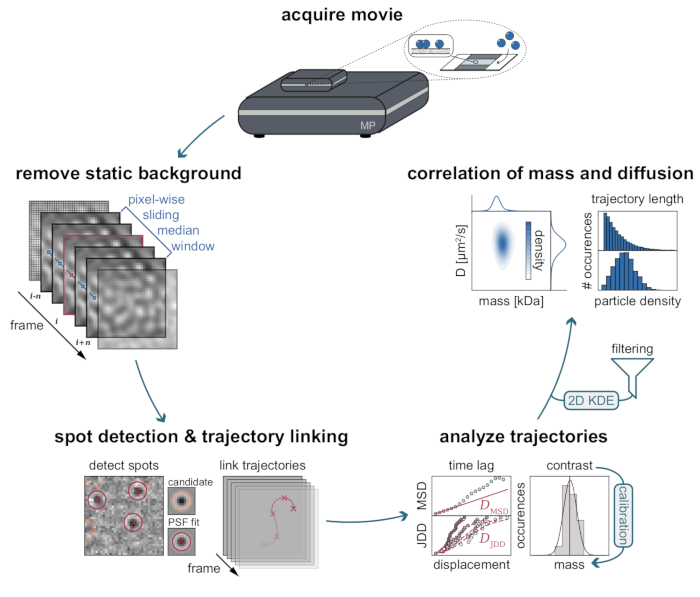
図 3: MSPT データの収集と分析に必要な段階のステップバイステップの図。 質量光度計上の目的のサンプルのデータ取得後、ムービーが処理され、ピクセル単位のスライド中央値アプローチによって静的背景が除去されます。その後、候補粒子は、粒子軌道にリンクする前に、点像分布関数(PSF)によって同定され、適合される。各粒子の拡散係数の決定を可能にするために、平均二乗変位(MSD)またはジャンプ距離分布(JDD)分析が採用される。この段階では、コントラスト値は、較正戦略によって決定されたコントラスト - 質量 - 関係に従って分子質量に変換することができる。最後のステップとして、軌道は、その長さまたは膜粒子密度に基づいてフィルタリングされ、2次元カーネル密度推定(2D-KDE)によって視覚化することができる。 この図の拡大版を表示するには、ここをクリックしてください。
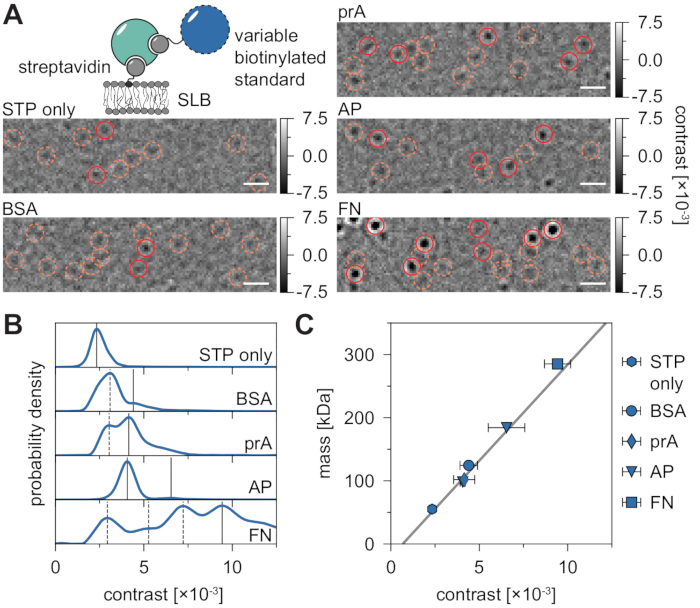
図4:MSPT測定のための質量対コントラスト関係の較正。 (A)少数の割合のビオチン化脂質を含む支持脂質二重層上に拡散する例示的なストレプトアビジン - 標準タンパク質複合体について得られた代表的な比測定フレーム(DOPC:DOPG:Biotinyl Cap PE比70:29.99:0.01モル%)。モデル分子量標準として、ビオチン化ウシ血清アルブミン(BSA)のいずれかとの複合体における1価のストレプトアビジン28(STPのみ)または2価のストレプトアビジン28、ビオチン化プロテインA(prA)、ビオチン化アルカリホスファターゼ(AP)、またはビオチン化フィブロネクチン(FN)が示されている。候補スポットはオレンジ色 (破線の円) で強調表示され、検出されたパーティクルは赤色 (実線の円) で強調表示されます。スケールバーは1μmを表す(B)5つのモデル標準タンパク質について得られたコントラスト値の確率密度分布。表示されたすべてのデータは、条件ごとの3つの独立した実験のプール分布を表しています:STPのみn = 82,719;BSA n = 9,034;prA n = 22,204;AP n = 69,065、FN n = 71,759 軌道。タンパク質を含む膜について決定された粒子数と比較して、空の二重層上で検出される粒子の数は、中程度の膜密度では無視できる程度である(補足図1)。質量較正のために考慮されるコントラストピークは連続した線を通してマークされ、破線のものは考慮されないオリゴマー状態を表す。(c)パネルDにおけるピークコントラストおよび複合体のそれぞれの配列質量から導出されるコントラスト対質量検量線。エラーバーには、ブートストラップによって推定されたピーク位置の標準誤差が表示されます(それぞれ1,000個の軌道を持つ100個のリサンプリング)。データ分析 (Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1,001 フレーム、検出しきい値 (thresh) = 0.00055、検索範囲 (dmax) = 4 ピクセル、メモリ (max_frames_to_vanish) = 0 フレーム、最小軌道長 (minimum_trajectory_length) = 7 フレーム (STP のみ)、9 フレーム (BSA/FN)、15 フレーム (prA)、10 フレーム (AP) のパラメーターを使用しました。この図の拡大版を表示するには、ここをクリックしてください。
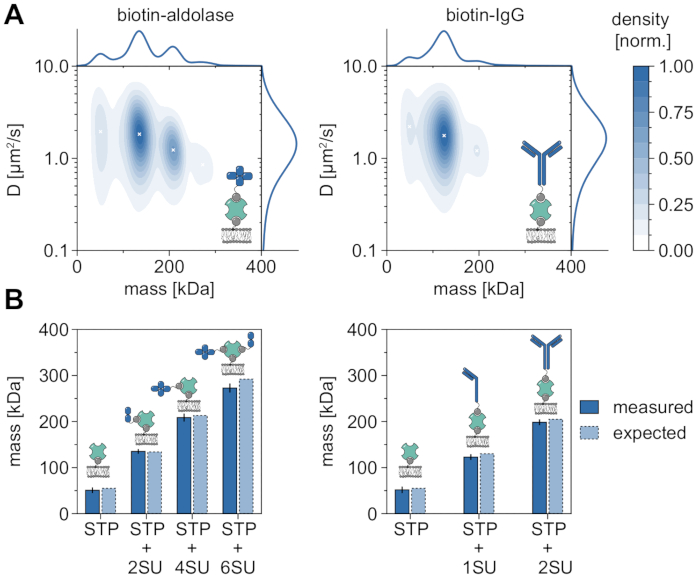
図5:膜関連タンパク質のオリゴマー状態の解読。 (A)ビオチン化アルドラーゼとの複合体における4価ストレプトアビジンの質量および拡散係数の両方の2Dカーネル密度推定(左パネル)またはビオチン修飾ヤギ抗ウサギIgG抗体(右パネル)。両方の複合体の再構成は、DOPC、DOPG、およびビオチニルキャップPEをそれぞれ70:29.99:0.01モル%の比率で含有する支持脂質二重層上で実施された。合計で、ストレプトアビジン-アルドラーゼ複合体(粒子密度0.1μm-2)には3つの独立した反復の116,787の軌道が含まれ、ストレプトアビジン-IgG複合体(粒子密度0.1μm-2)には348,405の軌道が含まれていた。少なくとも5フレームのトラック長を有する粒子のみが含まれていた。分子質量(上)と拡散係数(右)の両方の周辺確率分布を示します。両方のパネルの黒い x は、KDE のそれぞれの局所極大値を示します。(b)4価ストレプトアビジンとビオチン修飾アルドラーゼとの複合体(左パネル)またはビオチン化IgG(右パネル)について決定されたオリゴマー質量の比較、配列質量に応じて、予想される分子量。略語SUは、関心のあるタンパク質'サブユニットに代わって導入される。エラーバーには、ブートストラップによって推定されたピーク位置の標準誤差が表示されます(それぞれ1,000個の軌道を持つ100個のリサンプリング)。データ分析 (付属の Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1,001 フレーム、検出しきい値 (thresh) = 0.00055、検索範囲 (dmax) = 4 ピクセル、メモリ (max_frames_to_vanish) = 0 フレーム、最小軌道長 (minimum_trajectory_length) = 5 のパラメーターを使用しました。この図の拡大版を表示するには、ここをクリックしてください。
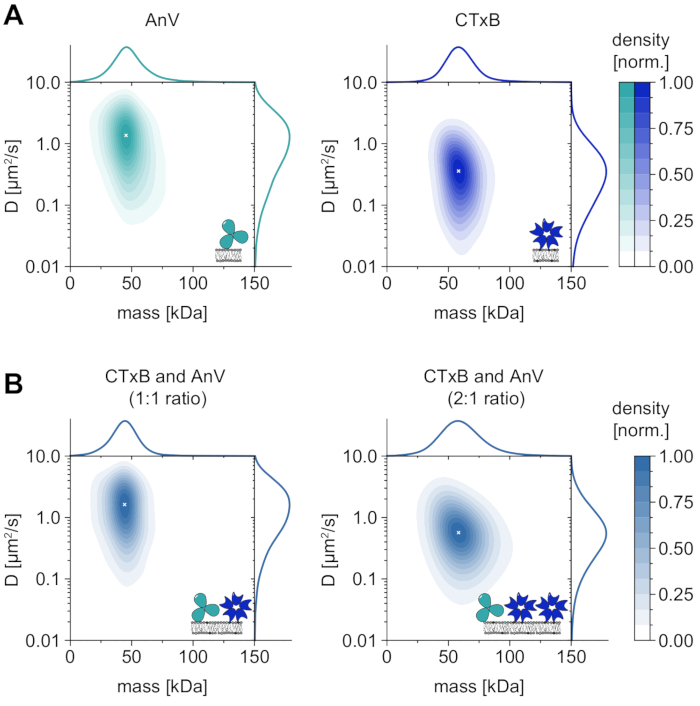
図6:天然の膜相互作用タンパク質アネキシンV(AnV)およびコレラ毒素サブユニットB(CTxB)の拡散挙動の溶解(A)アネキシンV(左パネル)およびコレラ毒素サブユニットB(右パネル)の質量および拡散係数の両方の2Dカーネル密度推定。AnVおよびCTxB膜再構成のために、GM1に対して80:20モル%DOPCおよびGM1に対して99.99:0.01モル%DOPCの脂質組成物がそれぞれ使用されている。AnV(粒子密度0.1μm-2)には合計206,819の3つの独立した反復の軌道が含まれ、CTxB(粒子密度0.2μm-2)には142,895の軌道が含まれています。(B)CTxBおよびAnV混合物の2Dカーネル密度を、それぞれ1:1(左パネル)または2:1(右パネル)の比率で推定する。タンパク質混合物の再構成は、DOPC、DOPS、およびGM1脂質を80:19.99:0.01モル%の比率で含有する支持脂質二重層上で行った。合計で、1:1混合物(粒子密度0.1μm-2)には3つの独立した反復の42,696の軌道が含まれ、2:1比(0.3μm-2の粒子密度)には264,561の軌道が含まれています。(A)および(B)の両方について、少なくとも5フレームのトラック長を有する粒子のみが含まれた。分子質量(上)と拡散係数(右)の両方の周辺確率分布を示します。各パネルの白い x は、KDE のそれぞれのグローバル最大値を示します。データ分析 (付属の Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1,001 フレーム、検出しきい値 (thresh) = 0.00055、検索範囲 (dmax) = 4 ピクセル、メモリ (max_frames_to_vanish) = 0 フレーム、最小軌道長 (minimum_trajectory_length) = 5 のパラメーターを使用しました。この図の拡大版を表示するには、ここをクリックしてください。
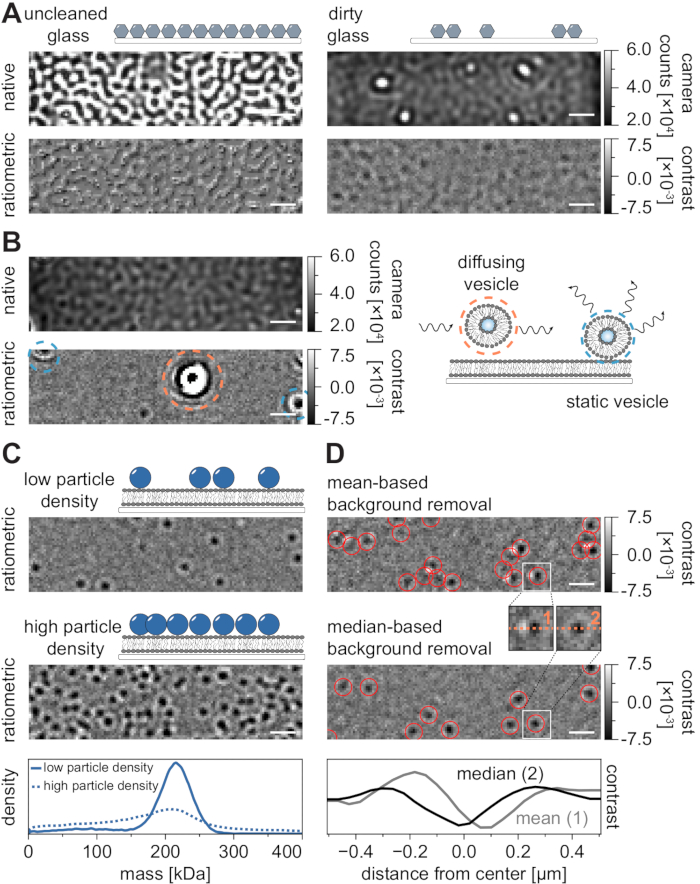
図7:MSPT測定中またはデータ分析中の潜在的な合併症。 (A)未洗浄のカバーガラススライドのネイティブおよび処理済み(中央値ベースのバックグラウンド除去)レシオメトリック図の両方に表示される表面粗さの代表的な画像。どちらの場合も、輝点は残留表面不純物を構成し、アーチファクトのない測定を妨げます。(b)不十分な膜洗浄後の視野内の残留小胞の例示的な画像。静的(青色で強調表示)と拡散(オレンジ色で強調表示)の両方の小胞は、それぞれ脈動および揺れ、またはそれらの方向移動のために測定品質を損ないます。(C)単一粒子技術として、MSPTは、各粒子の適切な連結および質量決定を可能にするために、低い粒子密度(代表画像、上パネル)を必要とする。膜 - 粒子密度が高い場合(中央パネル)、粒子フィッティングが損なわれ、質量決定に影響します(下パネルを参照)。(D)平均ベース(上パネル)または中央値ベースのバックグラウンド除去のいずれかの後に膜界面上に拡散する粒子の代表的なレシオメトリック画像。拡散パーティクルの場合、平均ベースのバックグラウンド除去ストラテジーは、上部パネルと中央パネルの間の小さなインセットに見られるように、パーティクルの PSF の歪んだ画像を生成します。対照的に、歪みのない粒子PSFは、中央値ベースのアプローチによって得ることができる。下パネル: 平均ベースまたは中央値ベースのバックグラウンド除去後に得られた PSF の中心を通るラインプロファイルの比較。この図に示されているすべてのネイティブ画像とレシオメトリック画像について、スケールバーは1μmを表します。データ分析 (付属の Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1,001 フレーム、検出しきい値 (thresh) = 0.00055、検索範囲 (dmax) = 4 ピクセル、メモリ (max_frames_to_vanish) = 0 フレーム、最小軌道長 (minimum_trajectory_length) = 5 のパラメーターを使用しました。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:タンパク質非含有膜と占有膜の比較。 精製ストレプトアビジン(STP)の添加前(A)および(B)後のインタクトに支持された脂質二重層の代表的な画像。モデルPSFに正常に適合した候補スポットは、赤で囲まれています。(C)空の膜(膜背景、灰色)および拡散ストレプトアビジン粒子を有する二重層(青色)上で検出された粒子のコントラスト確率分布。どちらの確率分布も、同一の映画取得パラメータと解析パラメータを持つ3つの独立した実験のプールデータを表します。データ分析 (付属の Jupyter ノートブック、手順 9 を参照) では、ウィンドウ サイズの中央値 (window_length) = 1,001 フレーム、検出しきい値 (thresh) = 0.00055、検索範囲 (dmax) = 4 ピクセル、メモリ (max_frames_to_vanish) = 0 フレーム、最小軌道長 (minimum_trajectory_length) = 7 フレームのパラメーターを使用しました。 このファイルをダウンロードするには、ここをクリックしてください。
補足ムービー1:質量光度計で記録された均質な膜への小胞の破裂および融合を示す例示的なムービー。画像処理ウィンドウの中央値 (window_length) = 1,001 フレーム。スケールバー:1μm。カメラカウント範囲: 黒 = 16,892;白 = 65,408。 この映画をダウンロードするには、ここをクリックしてください。
補足ムービー2:MSPT測定から得られた二重層上のアネキシンV(上)およびビオチン化アルドラーゼ(下)複合体の拡散を示す例示的なムービー。画像処理ウィンドウの中央値 (window_length) = 1,001 フレーム。スケールバー:1μm。干渉散乱コントラスト範囲: 黒 = -0.0075;白 = 0.0075。 この映画をダウンロードするには、ここをクリックしてください。
ディスカッション
提示されたプロトコルは、ガラスに吸着する単一の生体分子の質量を分析する技術である質量測光法21を、標識されていない膜相互作用生体分子の質量および拡散を同時に測定することができるさらに汎用性の高いツールに拡張する。この分析拡張は、分子24、25の横方向運動に適合した修正バックグラウンド除去戦略の実施によって達成される。一般に、ガラス表面粗さの強い散乱が主な解析障害を表し、各ピクセルの局所背景の正確な決定が粒子の質量と位置の定量化に不可欠であるため、バックグラウンド除去はiSCATベースのアプローチにとって最も重要です。粒子の動きに適応した画像解析に加えて、その後の粒子検出、軌道連結、およびデータ解析は、MPの質量感受性粒子追跡(MSPT)への新規な拡張を完了する。
一般に、徹底的に洗浄されたガラスカバースライドとクリーンな作業環境は、MSPT実験を成功させるための重要な要件です。巨大分子標識がないため、獲得されたシグナルは本質的に非選択的である。したがって、クリーンなサンプルと適切なサンプル処理は、観測値が誤って解釈されないようにするために不可欠です。特に、低分子量の分子が検査される場合、バックグラウンド寄与を評価するために、タンパク質非含有膜の対照測定が承認される(補足図1)。したがって、制御測定を含めることに加えて、各フローチャンバについて 図2 に示す準備手順に従うことをお勧めします。これらの安全対策を組み合わせると、検出された信号が目的の生体分子から発信され、汚染された流れチャンバ、緩衝液、または膜などから発信されないことが保証されます。
実験計画に関する注意事項のほかに、MSPT画像処理の際にも注意が必要です。ビデオ処理中は、正しい結果が得られるように、3 つのパラメータの値を慎重に選択する必要があります: i) 背景除去の中央値ウィンドウの長さ、ii) 粒子検出のしきい値、iii) リンク割り当て時の最大検索半径。より大きな中央値窓(i)は、一般に、重畳された準定数バックグラウンドからの拡散粒子の分離を容易にする。ただし、ウィンドウ サイズが大きすぎると、サンプル ドリフトが最終的に顕著になり、バックグラウンド推定の精度が低下します。最適な設定は、サンプルの特性と測定条件に大きく依存します。それにもかかわらず、値 1,001 を堅牢な開始点として使用できます。閾値パラメータ(ii)は、サンプルで予想される最低分子量に応じて調整する必要があります。0.0005未満の値は、この研究で使用した質量光度計で測定するには推奨されません。分析時間を短縮するために、高分子量のサンプルが予想される場合は、より高い値を選択できます。軌道リンクにおける検索半径(iii)は、粒子のシフト位置が連続するフレーム内で検索される最大半径距離をピクセル単位で指定する。サンプル内の最速のパーティクルに適合させる必要があり、好まれる場合は、代わりに適応検索範囲( trackpyのドキュメントを参照)を使用して計算時間を短縮することができます。特にプロジェクトの初期段階では、得られた結果を検証するために、さまざまなパラメータで映画を再分析することをお勧めします。
MSPTの単一分子の性質に照らして、正確なコントラストおよび質量決定を妨げる可能性があるため、高い膜粒子密度で測定することは避けるべきである。1平方マイクロメートル当たり1粒子未満の密度がMSPT測定に有利であることが示されている24。もう 1 つの考慮事項は、サンプル内の予想される拡散係数です。広範囲の拡散係数に適用可能であるが、MSPTはアクセス可能な拡散係数の下限を有する。中央値ウィンドウ期間のかなりの部分の間に、少数のピクセルの領域への局所的な閉じ込めは、パーティクルを静的背景とマージします。このプロトコルで使用されるイメージング条件では、0.01 μm2/s 未満の拡散係数の測定は推奨されません。この拡散速度では、例えば、中央値窓半値の間の粒子の平均二乗変位は約4ピクセルであり、したがってPSFの範囲と同様のサイズである。その結果、静的バックグラウンド推定値には粒子自体からの信号寄与が含まれる可能性が高く、その結果、最終的にノイズレベルに近づくまで粒子のコントラストが明らかに低下します。しかし、0.05~10μm2/sの範囲の高分子拡散係数は明確に解くことができます。
MSPTアプリケーションの範囲をさらに広げるために、パーティクルで一時的に占有されているピクセルを排除するか、より大きな中央値ウィンドウサイズを可能にするサンプルドリフト補正によって、中央値ベースのバックグラウンドアルゴリズムの進歩を想像することができます。どちらのアプローチも、高い粒子密度と遅い拡散での測定に関する問題を緩和するだろう。低質量感度の面での改善は、50kDa未満の生体分子へのアクセスを提供する可能性のある新世代の質量光度計で地平線上にあります。したがって、将来のMSPT実験では、クッション性二重層や高分子系などのさらに広い範囲の膜模倣物について、単一分子ダイナミクスと膜関連相互作用を研究することができます。
開示事項
著者には利益相反はありません。
謝辞
フィリップ・ククラ、ギャビン・ヤング、Refeynソフトウェアチームからの支援に心から感謝し、画像解析コードの一部を共有することで彼らの支援に感謝します。我々は、商用のRefeyn質量光度計へのアクセスを提供してくれたCryo-EM MPIBコアファシリティに感謝する。F.S.は、ユルゲン・プリツコとヴォルフガング・バウマイスターが与えた支援と資金提供に感謝の意を表します。T.H.とPSは、ドイツ研究財団(DFG)-Project-ID 201269156 - SFB 1032(A09)を通じて資金提供を受けました。N.H.はDFGのリターングラントHU 2462/3-1によって支援されました。PSは、ドイツ連邦教育研究省(BMBF)とマックスプランク協会の共同資金提供イニシアチブ を通じて 、研究ネットワークMaxSynBioを通じた支援を認めています。
資料
| Name | Company | Catalog Number | Comments |
| annexin V | Sigma Aldrich | #SRP8026 | examplary membrane-interacting protein |
| Bio-Rad Protein Assay | Bio-Rad Laboratories Inc. | #5000006 | bradford assay kit to determine protein stock concentrations |
| biotin labeled bovine albumin | Sigma Aldrich | #A8549 | examplary protein that can be used as standard protein for MSPT |
| cholera toxin subunit B | Sigma Aldrich | #SAE0069 | examplary membrane-interacting protein |
| cover glasses, #1.5, 24 x 24 mm | Paul Marienfeld GmbH & Co. KG | #0102062 | |
| cover glasses, #1.5, 24 x 60 mm | Paul Marienfeld GmbH & Co. KG | #0102242 | |
| dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | #850375 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoethanolamine-N-cap biotinyl (18:1 Biotinyl Cap PE | Avanti Polar Lipids | #870273 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoglycerol (DOPG) | Avanti Polar Lipids | #840475 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) | Avanti Polar Lipids | #840035 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| double-sided tape | tesa | #57912-00000-02 | needed for the assembly of glass sample chambers |
| Extruder | Avanti Polar Lipids | #610023 | Lipid extruder to enable monodisperse vesicle distributions |
| EZ-Link Maleimide-PEG2-Biotin | Thermo Fisher Scientific | #A39261 | maileimide-fused biotin that can be used to biotinylate standard proteins for MSPT |
| Fibronectin (Biotinylated) | Cytoskeleton Inc. | #FNR03-A | examplary protein that can be used as standard protein for MSPT |
| Gel Filtration HMW Calibration Kit | Cytiva | #28403842 | standard proteins, e.g. aldolase that can be biotinylated and used as molecular weight standards for MSPT |
| GM1 Ganglioside (Brain, Ovine-Sodium Salt) | Avanti Polar Lipids | #860065 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Biotin | Thermo Fisher Scientific, Waltham, USA) | #31820 | examplary protein to highlight the existence of different protein states |
| Isopropanol, 99.5%, for spectroscopy | Thermo Fisher Scientific | #10003643 | |
| Low Autofluorescence Immersion Oil | Olympus K.K. | #IMMOIL-F30CC | |
| pET21a-Streptavidin-Alive | Addgene | #20860 | required to express and purify divalent streptavidin in combination with each other |
| pET21a-Streptavidin-Dead | Addgene | #20859 | required to express and purify divalent streptavidin in combination with each other |
| Pierce Alkaline Phosphatase, biotinylated | Thermo Fisher Scientific | #29339 | examplary protein that can be used as standard protein for MSPT |
| Pierce Protein A, Biotinylated | Thermo Fisher Scientific | #29989 | examplary protein that can be used as standard protein for MSPT |
| Refeyn Acquire | Refeyn Ltd. | control software for Refeyn OneMP | |
| Refeyn One | Refeyn Ltd. | - | mass photometer |
| sterile syringe filters 0.45 µm cellulose acetate membrane | VWR International | #514-0063 | needed to filter particles from the buffer of interest |
| tetravalent streptavidin | Thermo Fisher Scientific | #SNN1001 | tetravalent streptavidin to enable the presence of several biotin binding sites |
| Whatman Nuclepore Hydrophilic Membrane, 0.05 µm Pore Size, 25 mm Circle | Cytiva | #110603 | a pore size of 50 nm is recommended for supported lipid bilayer formation in the context of MSPT |
| Zepto model 2 plasma cleaner | Diener electronic GmbH | - |
参考文献
- Robertson, J. L. The lipid bilayer membrane and its protein constituents. Journal of General Physiology. 150 (11), 1472-1483 (2018).
- Grecco, H. E., Schmick, M., Bastiaens, P. I. H. Signaling from the Living Plasma Membrane. Cell. 144 (6), 897-909 (2011).
- Cho, W., Stahelin, R. V. Membrane-protein interactions in cell signaling and membrane trafficking. Annual Review of Biophysics and Biomolecular Structure. 34, 119-151 (2005).
- Whited, A. M., Johs, A. The interactions of peripheral membrane proteins with biological membranes. Chemistry and Physics of Lipids. 192, 51-59 (2015).
- Gonzalez, L., Scheller, R. H. Regulation of membrane trafficking: Structural insights from a Rab/effector complex. Cell. 96 (6), 755-758 (1999).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- Bagheri, Y., Ali, A. A., You, M. Current methods for detecting cell membrane transient interactions. Frontiers in Chemistry. 8, 603259 (2020).
- Miller, H., Zhou, Z., Shepherd, J., Wollman, A. J. M., Leake, M. C. Single-molecule techniques in biophysics: A review of the progress in methods and applications. Reports on Progress in Physics. 81 (2), 024601 (2018).
- Manzo, C., Garcia-Parajo, M. F. A review of progress in single particle tracking: From methods to biophysical insights. Reports on Progress in Physics. 78 (12), 124601 (2015).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331 (6155), 450-453 (1988).
- Funatsu, T., Harada, Y., Tokunaga, M., Saito, K., Yanagida, T. Imaging of single fluorescent molecules and individual ATP turnovers by single myosin molecules in aqueous solution. Nature. 374 (6522), 555-559 (1995).
- Schmidt, T., Schütz, G. J., Baumgartner, W., Gruber, H. J., Schindler, H. Imaging of single molecule diffusion. Proceedings of the National Academy of Sciences of the United States of America. 93 (7), 2926-2929 (1996).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Kukura, P., et al. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405 (2006).
- Ueno, H., et al. Simple dark-field microscopy with nanometer spatial precision and microsecond temporal resolution. Biophysical Journal. 98 (9), 2014-2023 (2010).
- Loose, M., Fischer-Friedrich, E., Herold, C., Kruse, K., Schwille, P. Min protein patterns emerge from rapid rebinding and membrane interaction of MinE. Nature Structural and Molecular Biology. 18 (5), 577-583 (2011).
- Bezeljak, U., Loya, H., Kaczmarek, B., Saunders, T. E., Loose, M. Stochastic activation and bistability in a Rab GTPase regulatory network. Proceedings of the National Academy of Sciences of the United States of America. 117 (12), 6504-6549 (2020).
- Ha, T., Tinnefeld, P. Photophysics of fluorescent probes for single-molecule biophysics and super-resolution imaging. Annual Review of Physical Chemistry. 63 (1), 595-617 (2012).
- Garcia-Parajo, M. F., Segers-Nolten, G. M. J., Veerman, J. A., Greve, J., Van Hulst, N. F. Real-time light-driven dynamics of the fluorescence emission in single green fluorescent protein molecules. Proceedings of the National Academy of Sciences of the United States of America. 97 (13), 7237-7242 (2000).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495 (2014).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Heermann, T., Steiert, F., Ramm, B., Hundt, N., Schwille, P. Mass-sensitive particle tracking to elucidate the membrane-associated MinDE reaction cycle. Nature Methods. 18 (10), 1239-1246 (2021).
- Foley, E. D. B., Kushwah, M. S., Young, G., Kukura, P. Mass photometry enables label-free tracking and mass measurement of single proteins on lipid bilayers. Nature Methods. 18 (10), 1247-1252 (2021).
- Voss, O. H., Lee, H. N., Tian, L., Krzewski, K., Coligan, J. E. Liposome preparation for the analysis of lipid-receptor interaction and efferocytosis. Current Protocols in Immunology. 120, 1-21 (2018).
- Pincet, F., et al. FRAP to characterize molecular diffusion and interaction in various membrane environments. PLoS ONE. 11 (7), 0158457 (2016).
- Howarth, M., et al. A monovalent streptavidin with a single femtomolar biotin binding site. Nature Methods. 3 (4), 267-273 (2006).
- Allan, D., et al. soft-matter/trackpy: Trackpy v.0.5.0. Zenodo. , (2021).
- Weimann, L., et al. A quantitative comparison of single-dye tracking analysis tools using Monte Carlo simulations. PLoS ONE. 8 (5), 64287 (2013).
- Michalet, X. Mean square displacement analysis of single-particle trajectories with localization error: Brownian motion in an isotropic medium. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 82 (4), 041914 (2010).
- Sygusch, J., Beaudry, D., Allaire, M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution. Proceedings of the National Academy of Sciences of the United States of America. 84 (22), 7846-7850 (1987).
- Heath, G. R., Scheuring, S. High-speed AFM height spectroscopy reveals µs-dynamics of unlabeled biomolecules. Nature Communications. 9 (1), 4983 (2018).
- Day, C. A., Kenworthy, A. K. Mechanisms underlying the confined diffusion of cholera toxin B-subunit in intact cell membranes. PLOS ONE. 7 (4), 34923 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved