Method Article
막과 관련된 거대분자 역학을 특성화하기 위한 질량 민감성 입자 추적
요약
이 프로토콜은 분자 질량의 동시 조사 및 지질 막과 상호 작용하는 거대 분자의 확산 거동을 가능하게하는 iSCAT 기반 이미지 처리 및 단일 입자 추적 접근법을 설명합니다. 샘플 준비, 질량 대비 변환, 영화 수집 및 사후 처리에 대한 단계별 지침이 잠재적 인 함정을 방지하기위한 지침과 함께 제공됩니다.
초록
다수의 필수 생물학적 반응이 일어나는 계면인 지질 막에서 거대분자의 단기 또는 일시적 상호작용은 본질적으로 표준 생물물리학적 방법으로 평가하기가 어렵다. 질량 민감성 입자 추적(MSPT)의 도입은 이러한 공정의 철저한 정량적 특성화를 향한 중요한 단계를 구성합니다. 기술적으로, 이것은 간섭 산란 현미경 (iSCAT) 기반 질량 광도계 (MP)의 출현을 통해 가능하게되었습니다. 배경 제거 전략이 막 관련 입자의 이차원 운동을 나타내도록 최적화되면,이 기술은 생물학적 막에서 표지되지 않은 거대 분자의 확산 및 분자 질량 모두를 실시간으로 분석 할 수있게합니다. 여기에서, 막 관련 시스템의 질량 민감성 입자 추적을 수행하고 분석하기 위한 상세한 프로토콜이 설명된다. 상업용 질량 광도계에서 수행되는 측정은 밀리초 단위로 시간 분해능을 달성하며, MP 시스템에 따라 질량 검출 한계가 50kDa까지 내려갑니다. 일반적으로 막-촉매화된 거대분자 역학의 심층 분석을 위한 MSPT의 잠재력을 입증하기 위해, 천연 막 상호작용자 아넥신 V와 같은 예시적인 단백질 시스템에 대해 수득된 결과가 제시된다.
서문
한때 광범위한 주변 물리적 조건에 대한 장벽으로 인식되던 생물학적 막은 오늘날 기능적 실체 및 촉매 플랫폼(1,2)으로 간주된다. 막-관련 거대분자 반응에 반응하여 신호를 국소화, 증폭 및 지시하는 능력에 기초하여, 지질 계면은 막 밀매 및 신호전달 캐스케이드 3,4,5와 같은 매우 다양한 세포 과정에 중요한 요소를 구성한다. 안정한 복합체의 조립을 위한 핵형성 부위로서 작용하는, 막 부착은 종종 거대분자의 막-연관 형태와 세포질 형태 사이의 동적 평형에 의존하며, 따라서 일시적인 성질의 6,7이다.
생물학에서 그들의 큰 중요성에도 불구하고, 지금까지 실시간7,8에서 막-관련 거대분자 반응의 구성적, 공간적, 시간적 이질성에 대한 접근을 제공할 수 있는 방법을 개발하는 것은 도전적이었다. 기본 분자 과정을 해결하기 위해 두 가지 실험 측면이 결정적입니다 : 충분한 시간 분해능과 단일 입자 감도. 따라서, 광표백 후 형광 회복(FRAP)과 같은 앙상블 평균 기술뿐만 아니라 훨씬 더 민감한 형광 상관 분광법(FCS)도 시간 정보로부터 공간 정보를 크게 분리하기 때문에 한계가 있다(9). 따라서 개별 분자 역학의 특성화를 향한 중요한 단계는 매우 민감한 현미경과 결합 된 단일 입자 추적 (SPT)의 출현이었습니다. 특히, 두 가지 SPT 접근법이 이와 관련하여 효과적인 것으로 입증되었습니다. 첫째, 형광단을 표지로 활용하고 그에 상응하는 형광 검출 시스템은 나노미터 정밀도와 밀리초 시간 분해능10,11,12를 위한 길을 열었다. 둘째, 금 나노입자를 이용한 산란 기반 검출은 서브나노미터 및 마이크로초 범위(각각13,14,15,16)로 국소화 정밀도와 시간 분해능을 모두 향상시켰다. 막-관련 시스템들(17,18)의 기계론적 이해에 관한 접근법들 및 그것들의 중요한 기여들 둘 다의 많은 이점들에도 불구하고, 두 기술들은 지금까지 제한되어 왔다: 그들은 관심 분자들의 라벨링을 필요로 하며, 이는 잠재적으로 그들의 본래의 거동을 교란시키고 막-관련 입자들(19,20)의 분자 구성에 둔감하다.
이러한 두 한계는 최근 질량 광도측정법(MP)21,22,23으로 불리는 새로운 간섭 산란(iSCAT) 기반 접근법의 도입에 의해 극복되었다. 이 기술은 유리 계면에 착륙 할 때 iSCAT 대비에 따라 생체 분자의 용액 내 질량 분포를 결정할 수있게합니다. 그러나, 지질막에 확산되는 이동 분자의 검출 및 특성화를 위해, 보다 정교한 이미지 분석 접근법이 개발되어야 했다. 한편 이것은 성공적으로 구현되었으며, 지질 계면(24,25) 상에서 확산되는 단일 표지되지 않은 생체분자의 분자 질량을 검출, 추적 및 결정할 수 있게 한다. 동적 질량 광도계 또는 질량 민감성 입자 추적(MSPT)으로 지칭되는 이 기술은 이제 추적된 개체의 분자 질량의 변화를 직접 기록함으로써 복잡한 거대분자 상호작용의 평가를 가능하게 하며, 따라서 막 관련 분자 역학의 기계론적 분석을 위한 새로운 가능성을 열어준다.
여기서, MSPT에 필요한 샘플 준비, 이미징 및 데이터 분석 파이프라인을 위한 상세한 프로토콜이 제시된다. 특히, 샘플 요구 사항 및 측정 및 분석 중에 발생할 수있는 잠재적 인 문제가 논의됩니다. 또한, 막-상호작용 거대분자 시스템을 분석하기 위한 비할 데 없는 잠재력은 다양한 대표적인 결과를 통해 입증된다.
프로토콜
1. 시료 준비
- 다중항종 소포(MLV)의 생성
- 원하는 지질 혼합물 및 필요한 현탁액 부피에 따라 클로로포름-용해된 지질(들)의 양을 계산한다.
참고 : 4 mg / mL 지질의 최종 소포 농도는 재현탁 (반응) 완충액에 권장됩니다. - 지질의 계산된 부피를 유리 팁이 장착된 포지티브 변위 피펫을 사용하여 1.5 mL 유리 바이알에 피펫한다.
- 희미한 질소 흐름 하에서 지질 용매를 증발시키고 유리 벽에 지질의 동등한 분포를 보장하기 위해 바이알을 지속적으로 회전시킵니다.
- 바이알을 15분 동안 질소의 일정한 스트림 하에 위치시켜 완전한 용매 증발을 보장한다.
- 추가 시간 동안 진공 데시케이터에서 진공 건조하여 클로로포름의 잔류 흔적을 제거하십시오.
- 지질 혼합물을 원하는 재현탁(반응) 완충액에 재수화시키고, 지질 막이 바이알의 벽으로부터 용해될 때까지 현탁액을 완전히 와류시킨다.
참고: 반응 완충액은 단백질 활성과 안정성을 보장해야 합니다. 본 연구에 사용된 반응 완충액은 50 mM 트리스-HCl (pH = 7.5), 150 mM KCl, 및 5 mMMgCl2를 함유한다. 지질 또는 단백질을 희석하는 데 사용되는 모든 완충액은 간섭하는 미립자 불순물을 제거하기 위해 여과되어야합니다 (단계 5 참조).
- 원하는 지질 혼합물 및 필요한 현탁액 부피에 따라 클로로포름-용해된 지질(들)의 양을 계산한다.
- 작은 unilamellar 소포 (SUV)의 생성
- 지질 재현탁의 연속적인 동결-해동 사이클을 위해(단계 1.1.6), 물 500 mL를 핫플레이트 상의 비이커에서 끓여(70°C 내지 99°C 사이) 액체 질소로 용기를 제조하였다.
- 충격-액체 질소에서 지질 재현탁물을 동결시킨다. 용액이 완전히 해동 될 때까지 바이알을 뜨거운 물로 비이커에 옮깁니다. 이 동결 - 해동 사이클을 8-10 번 반복하거나 이전에 탁한 혼합물이 맑게 나타날 때까지 반복하십시오.
주의: 고글, 장갑 및 핀셋과 같은 적절한 안전 의류 및 장비를 사용하여 액체 질소, 냉동 지질 바이알 또는 끓는 물과 직접 접촉하지 않도록 하십시오. - 단분산 소포 분포의 생성을 위해, 지질-압출기를 조립하고 반응 완충액으로 그 완전성을 시험하여 누출되지 않는지 확인한다.
참고: 누출이 관찰되면 버퍼 유출이 분명하지 않을 때까지 지질 압출기를 조심스럽게 다시 조립하십시오. - 37 동안 지질 현탁액을 압출하여 50 nm의 기공 크기를 갖는 핵포어 막을 통과시켜26. 통과 횟수는 최종 SUV 혼합물이 핵포어 막을 통과하여 지질 응집체 또는 다중 라멜라 소포가 없는지 확인하기 위해 고르지 않아야합니다. 압출된 소포는 나중에 지지된 지질 이중층을 형성하는데 사용될 것이다(단계 6 및 7 참조).
참고 : SUV는 마찬가지로 재수화 된 지질 혼합물의 초음파 처리에 의해 형성 될 수 있습니다. 그러나, 압출을 통한 준비는 SUV의보다 단분산 분포를 제공하며, 이는 지질 이중층 형성 동안 소포 파열을 용이하게합니다. 압출 소포는 최대 3 일 동안 냉장고에 보관할 수 있습니다.
2. 현미경 슬라이드의 청소
- 동일한 수의 현미경 슬라이드(No. #1.5; 0.17mm 두께)를 24mm x 60mm 및 24mm x 24mm 크기의 폴리테트라플루오르에틸렌(PTFE) 현미경 홀더에 배포합니다.
- PTFE 홀더를 초순수가 들어있는 비커에 옮기고 실온에서 15 분 동안 초음파 처리하십시오.
참고: 비이커에 따라 PTFE 홀더를 완전히 덮을 수 있도록 물의 양을 조정해야 합니다. - 핀셋을 사용하여 비이커에서 홀더를 제거하고 물을 초순수 이소프로판올로 교체하십시오. 홀더를 이소프로판올이 들어있는 비커에 넣고 15 분 동안 다시 초음파 처리하십시오.
참고 : 비커에 따라 이소프로판올의 부피를 조정하여 PTFE 홀더를 완전히 덮을 필요가 있습니다. - 이소프로판올을 초순수로 교체하고 홀더가 들어있는 비커를 15분 동안 초음파 처리하십시오.
- 비커에서 PTFE 홀더를 제거하고 질소 가스 또는 압축 공기의 일정한 흐름 하에서 홀더의 현미경 슬라이드를 블로우 드라이합니다.
참고: 각 비커를 덮기 위해 장갑, 깨끗한 비커 및 파라핀 필름을 사용하여 커버 슬라이드를 올바르게 청소하십시오. 그렇지 않으면 잔류 먼지가 MSPT 측정 중에 상당한 배경 변동을 일으킬 수 있습니다.
3. 현미경 슬라이드의 친수화
참고: 균질하고 유체적으로 지지된 지질 이중층을 얻기 위해서는 슬라이드의 친수화가 필수적이며 유동 챔버 조립 직전에 수행되어야 합니다.
- 24mm x 60mm 현미경 슬라이드만 포함된 PTFE 홀더를 공정 가스로 산소가 있는 플라즈마 클리너에 놓고 플라즈마로 현미경 슬라이드를 청소합니다(이 작업에 사용된 파라미터: 30% 전력, 30초 동안 0.3mbar 산소 압력, 사용된 플라즈마 클리너에 대한 자세한 내용은 자료표 참조).
참고: 유체 멤브레인을 얻으려면 전력, 산소 압력 및 세척 시간과 같은 플라즈마 세척 매개 변수를 각 장비에 맞게 조정해야 합니다. 이러한 목적을 위해, 막 유동성을 보장하기 위해 형광 표지된 지질의 사용은 광표백(FRAP) 실험27 후 형광 회수로 정량화될 수 있다. 파라미터가 각각의 셋업에 대해 최적화되지 않으면, 멤브레인 확산은 감소된 멤브레인 유동성으로 인해 손상될 수 있다.
4. 유동 챔버의 조립
- 플로우 챔버 조립 전에 세척된 현미경 슬라이드(24mm x 24mm), 친수화 현미경 슬라이드(24mm x 60mm), 알루미늄 호일, 플랫 판지, 메스 및 양면 테이프와 같은 구성 요소를 준비하십시오.
- 평평한 판지를 알루미늄 호일로 감싸십시오.
- 청소 된 24 mm x 24 mm 현미경 슬라이드를 알루미늄 호일 위에 서로 충분한 거리로 펼치십시오.
- 양면 테이프 스트립을 슬라이드의 위쪽 및 아래쪽 가장자리에 연결합니다.
- 각 현미경 슬라이드를 메스로 절제하여 알루미늄 호일에서 제거 할 수 있도록하십시오. 따라서 각 슬라이드에는 슬라이드의 위쪽 및 아래쪽 가장자리에 양면 테이프 줄무늬가 부착되어 있어야 합니다( 그림 1 참조).
- 두 개의 양면 테이프 스트립이 있는 24mm x 24mm 슬라이드를 친수화된 24mm x 60mm 슬라이드에 부착하여 더 작고 큰 현미경 슬라이드 사이의 유로를 형성합니다.
참고: 깨끗한 유량실을 보장하려면 장갑을 지속적으로 착용하고 작업대에 먼지가 없는지 확인하십시오.
5. 반응 완충액의 여과
- MSPT 측정 동안 최소한의 배경 신호를 보장하기 위해 0.45 μm 셀룰로오스 아세테이트 멤브레인을 통해 모든 반응 완충액을 멸균 여과합니다.
참고: ATP와 같은 뉴클레오티드의 존재가 성공적인 실험에 필수적이라면, 배경 신호의 잠재적 증가를 인지해야 한다. 단백질 활성을 보장하는 최소한의 양만 사용하는 것이 좋습니다.
6. 지지된 지질 이중층(SLB) 형성
참고 : 질량 광도계에 지지되는 지질 이중층의 형성을 수행하여 시각적으로 성공적인 소포 확산과 융합되지 않은 소포의 완전한 제거를 보장하는 것이 좋습니다.
- 갓 압출 된 SUV (자세한 내용은 1 단계 참조)를 필요한 반응 완충액에서 0.4 mg / mL의 최종 농도로 희석하십시오. 임의로, 소포 파열을 촉진하기 위해, 소포 현탁액에2 mM CaCl2 를 첨가한다.
참고: 2가 양이온은PiP2와 같은 일부 지질의 응집을 일으킬 수 있다. 이러한 지질을 함유하는 혼합물의 경우, 재현탁 완충제 중의 소포 파열 또는 다른 2가 양이온의 촉진을 위해CaCl2 를 사용하는 것을 삼가한다. 실험에 필요한 경우, 2가 양이온은 담지된 지질 이중층의 성공적인 형성 후에 첨가될 수 있다. - 50 μL의 베시클 현탁액을 유동 챔버 내로 플러시하고(단계 4) 챔버를 2분 동안 인큐베이션한다.
참고: 완충액, 소포 또는 단백질 용액은 작은 흠뻑 젖은 조직으로 유동 챔버를 통해 플러시될 수 있습니다. 그러나, 기계식 펌프 시스템을 사용하는 것도 가능하다. - 매번 200 μL의 반응 완충액으로 유동 챔버의 반복된 (적어도 세 번) 세척을 통해 융합되지 않은 소포를 제거한다.
참고: MSPT 측정 중에 안정적인 배경 신호를 보장하기 위해 소포를 유동 챔버 밖으로 완전히 세척해야 합니다.
7. 보정 곡선의 생성
참고: 검출된 입자의 대비를 분자 질량으로 변환하려면 알려진 크기의 단백질을 사용하여 신호를 보정해야 합니다. 관심 시스템에 예상되는 분자 질량의 범위를 커버하기 위해 표준 단백질 크기 체계를 조정하는 것이 좋습니다.
- 시스테인 잔기를 갖는 표준 단백질의 비오티닐화
- 제조업체의 지침에 따라 표준 단백질에 대한 말레이미드-비오틴의 적절한 양을 계산하십시오.
- 결정된 부피의 말레이미드-비오틴과 함께 표준 단백질을 실온에서 1시간 동안 인큐베이션한다.
- 접합된 비오틴-단백질 복합체로부터 비접합된 말레이미드-비오틴을 제거하기 위해, 관심있는 단백질에 적합한 컬럼 상에서 크기-배제 크로마토그래피를 수행한다.
- 브래드포드 어세이를 사용하여 단백질 농도를 결정한다.
참고: 추가 측정을 위해 표준 단백질을 저장하려면 단백질을 액체 질소의 일회용 분취량으로 동결하고 -80°C에 보관합니다.
- 검량선에 대한 표준 단백질의 측정
- 유동 챔버에서, 0.01 몰% (v/v) 비오티닐 캡 PE (1,2-디올레오일-sn-글리세로-3-포스포에탄올아민-N-캡 비오티닐)를 함유하는 0.4 mg/mL 압출 SUV (자세한 내용은 단계 1 및 6 참조)로 지지된 지질 이중층을 준비한다.
- 50 μL의 2.5 nM 2가 스트렙타비딘을 유동 챔버 내의 이중층에 첨가하고, 10분 동안 인큐베이션한다.
참고: 2가 스트렙타비딘은 Howarth et al.28에 요약된 바와 같이 발현되고 정제되었다. 사가의 스트렙타비딘도 마찬가지로 사용될 수 있다. 그러나, 2가 스트렙타비딘의 사용은 종의 할당을 용이하게 하기 위해 비오틴화 지질과 비오틴 모이어티에 접합되는 표준 단백질 사이의 가능한 반응 화학량론을 감소시킬 수 있다. - 100 μL의 반응 완충액으로 결합되지 않은 2가 스트렙타비딘을 제거하였다.
- 50 μL의 100 nM 비오틴-컨쥬게이션된 표준 단백질을 유동 챔버 내의 이중층에 첨가하고, 2분 동안 인큐베이션한다.
참고: 비오티닐화 효율 및 디가 또는 사가 스트렙타비딘의 사용 여부에 따라, 비오틴-접합된 표준 단백질 및 스트렙타비딘의 최적 농도는 달라질 수 있다. - 단계 8에 요약된 세부사항에 따라 MSPT 측정을 수행한다.
주의: 이미징 조건은 샘플 및 교정 표준 모두에 대해 동일해야 합니다.
8. 이미징
- SLB 형성 및 샘플 준비
- 단계 6에서 보다 상세히 설명된 바와 같이, 원하는 지질 혼합물(25 μL)의 SUVs를 샘플 유동 챔버에 도입하고 담지된 지질 이중층을 형성한다. 챔버를 100 μL의 반응 완충액으로 (세 번) 철저하게 세척하여 융합되지 않은 모든 소포를 제거하였다.
- 관심있는 단백질 50 μL를 샘플 챔버에 첨가한다.
참고: MSPT는 단일 입자 방법이므로 단백질 농도는 방해받지 않는 입자 검출 및 추적을 허용하기 위해 pM 내지 nM 범위로 유지되어야 합니다.
- 비디오 수집
- 획득 소프트웨어에서 시야각(FOV)의 크기, 프레임 속도, 노출 시간 및 획득 시간과 같은 원하는 이미징 조건을 설정합니다.
참고: 다음 설정은 상용 질량 광도계에서 MSPT에 대해 작동하는 것으로 입증되었습니다 ( 자료 표 참조): 128 픽셀 x 35 픽셀의 FOV, 1kHz의 프레임 속도로 후속 5 배 프레임 평균 후 초당 약 200 프레임, 0.95ms의 노출 시간이 발생합니다. - 초점을 자동 또는 수동으로 조정합니다. 필요한 경우, FOV를 측면 제어를 사용하여 균질한 멤브레인을 갖는 위치로 이동시킨다.
- 프로젝트 폴더를 만들고 동영상 녹화를 시작합니다. 기록이 완료되면 획득 소프트웨어가 요청하는 대화 상자에서 파일 이름을 지정합니다. 그런 다음 동영상은 후속 분석을 위해 MP 파일로 프로젝트 폴더에 자동으로 저장됩니다.
참고: 개별 멤브레인의 무결성과 결과의 재현성을 보장하기 위해 서로 다른 유동 챔버에 적어도 세 번의 반복실험을 기록하십시오. 동영상 지속 시간은 미리 설정할 수 있으며 실험 유형에 따라 다릅니다. 대부분의 경우 5 분에서 7 분 사이의 수집 시간을 권장합니다.
주의: 기본적으로 상용 질량 광도계 수집 소프트웨어의 동영상 녹화는 저장 공간을 줄이기 위해 저장되기 전에 압축됩니다. 그러나 이 프로토콜에 설명된 대로 사용자 지정 데이터 분석을 사용하려면 파일 압축을 해제해야 합니다. 파일 압축을 끄는 방법에 대한 자세한 내용은 제조업체의 사용 설명서에서 찾을 수 있습니다.
- 획득 소프트웨어에서 시야각(FOV)의 크기, 프레임 속도, 노출 시간 및 획득 시간과 같은 원하는 이미징 조건을 설정합니다.
9. 데이터 분석
참고: 데이터 분석 파이프라인에는 두 개의 대화형 Jupyter 노트북(MSPT analysis.ipynb, Movie visualization.ipynb)이 함께 제공됩니다. 아래에 설명된 MSPT 분석을 수행하는 데 필요한 Jupyter 노트북 및 관련 사용자 지정 작성된 Python 모듈은 공용 저장소인 https://github.com/MSPT-toolkit/MSPT-toolkit 에서 사용할 수 있습니다. 아래 분석에 대한 자세한 지침은 위의 링크를 사용하여 액세스한 MSPT analysis.ipynb 를 참조하십시오.
- 비디오 처리
- image_processing.mp_reader 함수를 사용하여 픽셀 단위 배경 추정 알고리즘으로 빛의 지배적 인 정적 산란을 제거하십시오.
- 배경 제거를 적용하려면 매개변수 모드에 continuous_median 옵션을 선택하고 노트북 섹션 B.1에서 슬라이딩 중앙값 창(window_length)에 적절한 길이를 설정합니다. 선택적으로 배경 제거 후 파티클 감지 및 궤적 연결에 사용할 동영상을 저장합니다(매개변수 save_processed_movies을 True로 설정하여).
참고: 멤브레인의 입자 밀도, 예상 확산 계수, 획득 프레임 속도 및 필요한 처리 속도에 따라 창 크기(window_length)를 101과 2001 사이의 값으로 조정하십시오.
주의: 배경 제거 전략은 멤브레인이 너무 조밀하게 포장되지 않고 입자의 확산이 충분히 빠른 경우(즉, 각 픽셀이 대부분의 경우 파티클을 차지하지 않는 경우) 잘 작동합니다. 그렇지 않으면, 입자들의 콘트라스트는 배경 신호와 적절하게 구별될 수 없기 때문에 체계적으로 과소평가될 것이다. 이는 계산 속도를 희생하여 중앙값 창 크기를 늘려 보상할 수 있습니다. 그러나 창 크기를 너무 크게 설정하면 샘플 드리프트로 인해 출력에 부정적인 영향을 줄 수 있습니다. 처리 된 비디오의 육안 검사는 중요합니다.
- 배경 제거를 적용하려면 매개변수 모드에 continuous_median 옵션을 선택하고 노트북 섹션 B.1에서 슬라이딩 중앙값 창(window_length)에 적절한 길이를 설정합니다. 선택적으로 배경 제거 후 파티클 감지 및 궤적 연결에 사용할 동영상을 저장합니다(매개변수 save_processed_movies을 True로 설정하여).
- particle_fitting.particle_fitter 함수를 사용하여 동영상 전체에서 파티클과 파티클의 각각의 위치를 감지합니다(노트북 섹션 B.2 참조).
- 입자 검출의 감도를 임계값 파라미터(thresh; 노트북 섹션 B.1 참조)로 조정하십시오. 이 파라미터는 이미지 이진화로 후보 스폿을 강조 표시하는 데 사용됩니다. 다양한 임계값 파라미터가 스팟 감지 감도에 미치는 영향은 별도의 노트북(Movie visualization.ipynb)에서 검사할 수 있습니다. 파티클 감지 결과는 동영상 파일의 하위 디렉토리에 있는 CSV 파일에 자동으로 저장됩니다.
참고: 임계값 매개변수를 임의로 낮게 설정(예: 사용된 질량 광도계로 촬영한 동영상의 경우 임계값 매개변수 0.0005 미만)은 후보 스폿이 스퓨리어스 노이즈에 의해 지배되므로 처리 시간이 길어지므로 권장되지 않습니다.
- 입자 검출의 감도를 임계값 파라미터(thresh; 노트북 섹션 B.1 참조)로 조정하십시오. 이 파라미터는 이미지 이진화로 후보 스폿을 강조 표시하는 데 사용됩니다. 다양한 임계값 파라미터가 스팟 감지 감도에 미치는 영향은 별도의 노트북(Movie visualization.ipynb)에서 검사할 수 있습니다. 파티클 감지 결과는 동영상 파일의 하위 디렉토리에 있는 CSV 파일에 자동으로 저장됩니다.
- image_processing.mp_reader 함수를 사용하여 픽셀 단위 배경 추정 알고리즘으로 빛의 지배적 인 정적 산란을 제거하십시오.
- 파이썬 패키지 trackpy (v.0.5.0)29를 사용하여 연속적인 프레임의 파티클을 궤적에 연결합니다.
참고: 궤적 연결은 스폿 감지 후 즉석에서 수행됩니다. 따라서 궤적 정보를 포함하는 추가 CSV 파일이 입자 감지 CSV 파일의 하위 디렉토리에 저장됩니다.- 매개변수 minimum_trajectory_length (노트북 섹션 B.1 참조)을 사용하여 너무 적은 점으로 궤적을 제거하여 확산 계수를 강력하게 결정할 수 있습니다. trackpy 함수의 다른 매개 변수에 대한 자세한 설명은 trackpy의 설명서를 참조하십시오.
- 궤적 분석
- 노트북 섹션 C.1에서 동영상 획득에 사용된 프레임 속도(frame_rate) 및 픽셀 크기(pixel_size)를 nm로 지정합니다. trajectory_analysis.get_csv_files 함수(노트북 섹션 C.2)를 사용하여 trackpy에서 반환된 궤적 정보를 포함하는 CSV 파일 목록을 만듭니다(9.2단계 참조).
- 또한 디스크에 피팅 결과를 저장하는 데 사용되는 HDF5 컨테이너의 출력 파일 이름을 지정합니다(노트북 섹션 C.3). CSV 파일 목록을 반복하는 노트북 섹션 C.4의 trajectory_analysis.fit_trajectories 함수를 사용하여 모든 궤적을 분석합니다. 이 함수는 점프 거리 분포(JDD)30 및 평균 제곱 변위(MSD)31 분석을 사용하여 각 궤적의 확산 계수를 추정합니다.
- MSPT 교정으로부터 얻어진 대조-질량 관계를 사용하여 각 궤적의 중앙값 대비를 그의 상응하는 질량으로 변환한다(섹션 7 참조). iSCAT 대비를 분자 질량과 관련시키는 교정 라인의 기울기(기울기) 및 y 절편(오프셋)을 지정합니다(함수 trajectory_analysis.apply_calibration; 노트북 섹션 C.5 참조). 이 함수는 궤적의 중간 질량이 있는 열을 각 데이터 프레임에 추가합니다.
- trajectory_analysis.membrane_density 함수를 사용하여 멤브레인의 겉보기 입자 밀도를 평가합니다.이 함수는 데이터 프레임의 추가 열로 각 프레임 동안 감지된 입자 및 존재하는 궤적의 관점에서 중앙값 밀도 값을 반환합니다(노트북 섹션 C.6 참조).
참고: 검출 및 궤적 연결 과정 중에 입자의 일부가 손실되므로 실제 입자 밀도가 더 높을 수 있습니다. 질량 히스토그램뿐만 아니라 입자 밀도와 관련된 신뢰할 수 있는 결과를 얻으려면 대표적인 동영상 스냅샷을 육안으로 검사하여 측정 조건이 단일 입자 추적에 적합한지 확인합니다(단계 9.1.1 참조).
10. 데이터 시각화
- 질량과 확산 계수와 파이썬 패키지 fastkde (v.1.0.19; https://pypi.org/project/fastkde/)를 기반으로하는 2 차원 커널 밀도 추정 (KDE)과의 상관 관계를 보여줍니다.
- 플롯을 생성하려면 MSPT 결과가 포함된 HDF5 파일을 지정하고(단계 9.3.2 및 노트북 섹션 D.1 참조) 단일(노트북 섹션 D.2) 또는 연결된 데이터 프레임(노트북 섹션 D.3)을 plotting.generate_2D_KDE 함수(노트북 섹션 D.4)의 입력 데이터로 선택합니다.
참고: 플로팅된 각 데이터 세트에는 신뢰할 수 있는 2D-KDE에 대해 이상적으로 1,000개 이상의 궤적이 포함되어야 합니다.
결과
유동 챔버에서 지지된 지질 이중층(SLBs)의 제조를 위한 본 명세서의 상세한 프로토콜에 따라(도 1), 모든 디스플레이된 조건의 네이티브 뷰에서 얼룩 형상 패턴을 명확하게 인식할 수 있다(도 2). 이 효과는 일반적으로 산란 신호를 지배하고 시각적으로 구별 할 수없는 조건 (유리, SLB가있는 유리 또는 SLB 및 부착 단백질이있는 유리)으로 이어지는 유리의 표면 거칠기에 의해 발생합니다. 그러나 소포의 존재는 소포의 큰 산란 단면으로 인해 분명히 구별되며 소포 파열 및 균질 막으로의 융합을 관찰 할 수 있습니다 (그림 2B 및 보충 영화 1). 시야24,25 내의 동적 요소를 강조하는 비율계량 접근법으로 유리 표면의 정적 산란 신호를 제거 할 때, 빈 SLB (그림 2C) 또는 유리 자체 (그림 2A)가 시끄러운 이미지로 나타나는 동안 멤브레인 (그림 2D)에서 확산되는 표지되지 않은 단백질을 발견 할 수 있습니다.
MSPT 측정의 고유 배경은 동일한 이미지 위치에서 동영상의 이전 및 후속 픽셀의 n개의 중앙값을 통해 각 픽셀 값을 나눔으로써 로컬로 추정할 수 있습니다(그림 3). 결과적으로, 거대분자는 등방성 점확산 기능(PSF)으로 나타나며, 그 기능은 막에서의 움직임을 관찰, 추적 및 정량화할 수 있다. 사실, 콘트라스트 및 동적 거동 모두의 가용성은 입자의 분자 크기와 각각의 확산 거동을 직접 연관시킬 수 있으며, 이는 모두 입자를 라벨링 할 필요없이 가능합니다. 그럼에도 불구하고, MSPT 실험 동안 결정된 iSCAT 콘트라스트를 해석하기 위해서는, 신호 진폭을 분자 질량으로 변환하는 캘리브레이션을 수행하는 것이 필수적이다. 이는 공지된 질량의 생체분자를 비오틴-스트렙타비딘-비오틴 복합체를 통해 SLB에 부착함으로써 달성될 수 있다(도 4A). 예시적인 전략으로서, 소 혈청 알부민 (BSA), 단백질 A (prA), 알칼리성 포스파타제 (AP), 및 피브로넥틴 (FN)의 비오티닐화 변이체를 사용할 수 있으며, 이는 그 자체가 막 내의 비오틴 함유 지질 (비오티닐 캡 PE)에 결합되는 스트렙타비딘 (STP)에 결합한다. 도 4A에 표시된 바와 같이, 이들 예시적인 거대분자의 점점 더 뚜렷한 대조는 각각의 비오티닐화 표준물질의 증가된 분자량을 반영한다. 대조 히스토그램의 각 피크 (도 4B)를 표준 단백질의 올리고머 상태의 상응하는 질량에 할당함으로써, 콘트라스트와 질량 사이의 선형 관계가밝혀지고 21,22 이후에 알려지지 않은 거대 분자 시스템의 분석에 사용될 수 있습니다 (그림 4C).
분자량을 분석하고 따라서 올리고머 상태 및 올리고머화 사건을 연구하는 MSPT의 적용 가능성 및 능력을 입증하는 좋은 예는 비오티닐화 알돌라제 및 비오티닐화 IgG의 고려이다(도 5). 알돌라아제는 일반적으로 호모테트라머32인 것으로 보고된다. 그러나 MSPT에 의해 해결된 질량 분포는 네 개의 뚜렷한 피크를 특징으로 하며, 이는 다중 모집단의 존재를 강조합니다(그림 5A). 첫 번째 마이너 피크는 점유되지 않은 스트렙타비딘에 해당하고 이러한 종류의 실험에서의 구성으로 인해 예상될 수 있지만, 단지 2개의 서브유닛(2SU) 또는 6개의 서브유닛(6SU)만을 갖는 알돌라제 복합체도 마찬가지로 검출될 수 있다(도 5B). 흥미롭게도, 테트라- 및 헥사머 알돌라제-스트렙타비딘 복합체는 이량체 알돌라제 및 스트렙타비딘 단독과 비교할 때 감소된 확산 계수를 나타내며, 이는 증가된 점성 항력, 예를 들어, 스트렙타비딘에 대한 초비오티닐화 지질의 부착을 통해 나타낸다. 유사하게, 비오티닐화 IgG는 질량 분포에서 세 개의 피크를 나타내며, 첫 번째 피크는 다시 단일 스트렙타비딘의 질량과 일치한다. 가장 풍부한 피크의 질량은 1개의 경쇄 및 1개의 중쇄 (1SU), 즉 IgG 항체의 절반의 질량에 상응한다. 두 개의 동일한 반쪽 (2SU)을 가진 전체 항체가 약 11 %의 경우에서 검출됩니다. 복잡한 크기 증가에 따른 확산 계수의 감소는 스트렙타비딘과 하나 이상의 비오티닐화 지질 또는 부착된 IgG, 또는 둘 다에 의해 야기된 추가적인 드래그의 상호작용을 나타낸다.
막-의존성 올리고머 상태의 유일한 분석 외에, MSPT는 또한 관심있는 거대분자의 확산 거동을 그의 올리고머 상태와 상관시키는 특별한 이점을 부여한다. 이러한 유형의 분석에 대한 대표적인 결과는 막에 혼입된 디올레오일포스파티딜세린(DOPS) 또는 글리코스핑고지질(GM1)에 각각 결합하는 아넥신 V(AnV) 및 콜레라 독소 서브유닛 B(CTxB)에 대해 도시되어 있다(도 6A). 두 커널 밀도 추정 (KDE)은 질량과 확산의 단봉 분포를 특징으로하며, 유사한 확산 거동을 가진 단일 풍부한 종을 나타냅니다. 분자 질량 및 확산 계수의 피크 위치는 AnV에 대해 각각 49.8 ± 2.2 kDa 및 1.4 ± 0.1μm2/s인 것으로 나타났으며, 뿐만 아니라 CTxB에 대해 각각 62.7 ± 3.1 kDa 및 0.4 ± 0.1μm2/s인 것으로 나타났다. 측정된 확산 계수는 고속 AFM 및 FRAP33,34에서 얻은 이전에 보고된 값과 비슷합니다. 예상된 거대분자의 질량(AnV 삼량체의 경우 52 kDa, CTxB 펜타머의 경우 65 kDa)과 비교하여 약간 감소된 질량은 앙상블 내에 더 적은 서브유닛을 갖는 더 작은 복합체의 존재를 나타낼 수 있다. 단백질 간의 질량 차이는 작고 현미경의 지정된 검출 한계 (≈50kDa)에 가깝지만 확산 계수는 상당히 다릅니다. 등몰 혼합물에서, 예를 들어, 혼합물의 확산을 AnV 및 CTxB 단독의 분포와 비교함으로써, AnV가 CTxB보다 멤브레인 상에 더 풍부하다는 결론을 내릴 수 있다(도 6B). 그러나, CTxB의 농도가 AnV의 농도와 비교하여 두 배가 되면, 평형은 막 상의 우세한 단백질로서 CTxB쪽으로 이동된다. AnV 및 CTxB의 혼합물에 대해 예시된 바와 같이, MSPT는 그들의 분자량에 따라 막-관련 거대분자를 구별할 수 있을 뿐만 아니라 그들의 확산 거동에 따라 상이한 거대분자 집단의 차별을 가능하게 한다.
모든 현미경 검사 기술과 마찬가지로 원하는 데이터 품질을 얻기 위해 일부 실험 요구 사항이 중요합니다. 이 맥락에서 중요한 예는 철저히 청소 된 커버 슬립입니다. 일반적으로, 이것은 현미경 관련 단일 분자 실험의 전제 조건으로 간주되지만, MSPT는 샘플 불순물에 특히 민감하다. 청소되지 않은 커버슬립의 유리 표면에서 발생하는 증가된 산란은 정량적 iSCAT 측정을 방지합니다. 특히, 충분히 세척되지 않은 유리에 잔류 먼지 또는 먼지 입자조차도 눈에 띄는 이미지 왜곡을 일으킬 수 있으며 네이티브 이미징 모드에서 밝은 점으로 인식 할 수 있습니다 (그림 7A). 이러한 결함은 정적 특성으로 인해 배경 추정에 의해 제거되지만 입자의 대비를 정확하게 결정하는 데 장애가 있을 수 있으므로 정량 분석에 부정적인 영향을 미칩니다. MSPT 실험에서 발생하는 또 다른 일반적인 문제는 시야를 통해 부유 (주황색으로 둘러싸인) 나머지 소포 또는 멤브레인의 특정 위치에 붙어 (파란색으로 둘러싸여있는) 융합되지 않은 소포가 큰 맥동 산란기로 나타나는 것입니다 (그림 7B). 영화 획득에 대한 발생과 간섭을 최소화하려면 단백질을 추가하기 전에 SLB를 철저히 씻고 작은 일라멜라 소포 (SUV)와 2가 양이온의 새로 준비된 혼합물을 사용하는 것이 좋습니다.
질량 민감성 입자 추적 실험의 설계를 위해 고려되어야 하는 한 가지 요소는 막 계면과 관련된 거대분자의 밀도이다. 멤브레인의 높은 입자 밀도는 실제로 두 가지 이유로 문제를 일으킬 수 있습니다 : i) 연속 프레임에서 궤적으로 입자 검출을 연결하는 것은 모호 해지고 따라서 오류 및 잘못 판단 된 확산 계수의 가능성을 증가시킵니다. ii) 해당 PSF 적합도의 진폭으로부터 추출되는 입자의 질량은 체계적으로 과소 평가되고 동적 입자 신호로부터 정적 배경 신호의 분리가 점점 어려워지기 때문에 질량 피크가 확대됩니다 (그림 7C). 현재, MSPT 비디오를 획득하는 과정에서 데이터 품질의 시각적 평가는 사용 가능한 상용 현미경에서 어려운 데, 그 이유는 획득 소프트웨어에서 구현된 비율계량 뷰가 여기에 설명된 중앙값 기반 알고리즘 대신 질량 광도계(21)에 대해 확립된 배경 제거를 사용하고 참조(24,25)에서 이용가능하다(도 7D ). 질량 광도계에서 착륙 분자를 시각화하는 데 사용되는 평균 기반 연속 배경 제거는 확산 입자가 밝은 꼬리가있는 어두운 전선으로 나타나게하여 반점이 매우 이방성으로 보이게하고 탐지 절차 중에 PSF 피팅을 방해합니다. 따라서, 획득 소프트웨어에서 구현된 평균 기반 이미지 프로세싱의 사용은 멤브레인 상의 확산성 생체분자의 분석에 부적합하다.
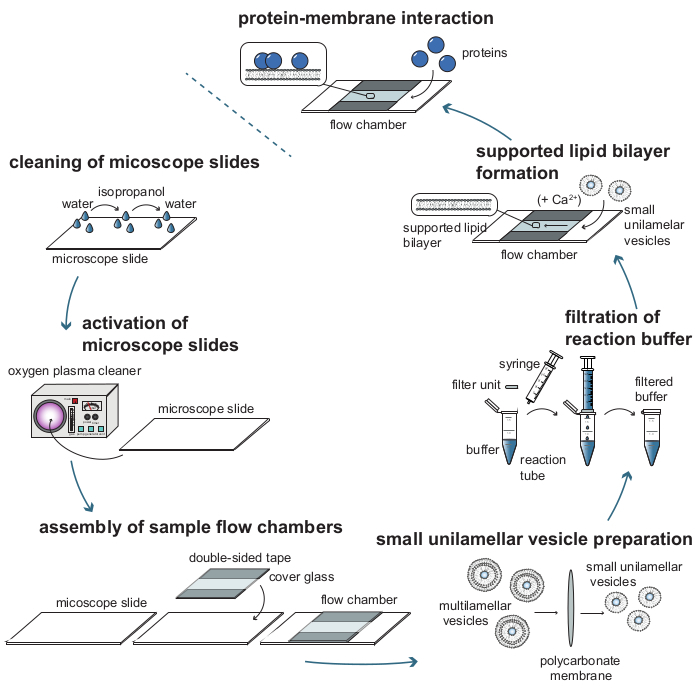
그림 1: 질량 민감성 입자 추적(MSPT)을 통한 단백질-막 상호작용을 분석하는 데 필요한 개별 단계의 공정 흐름도. MSPT 측정을 위해 샘플을 준비하려면 유리 커버 슬라이드를 철저히 청소하고 산소 플라즈마로 활성화해야합니다. 샘플 유동 챔버로 조립 한 후, 작은 일라멜라 소포 (SUV)는 지지된 지질 이중층 (SLB) 형성을 위해 준비되고 모든 반응 완충액은 배경 산란을 줄이기 위해 여과됩니다. SUV는 유동 챔버 내에 지질 이중층을 형성하기 위해 첨가된다. 임의로,Ca2+ 이온과 같은 2가 양이온은 소포 파열을 촉진하기 위해 SUV에 첨가될 수 있다. 마지막으로, 관심있는 단백질의 낮은 농도는 반응 챔버 내로 플러싱된다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
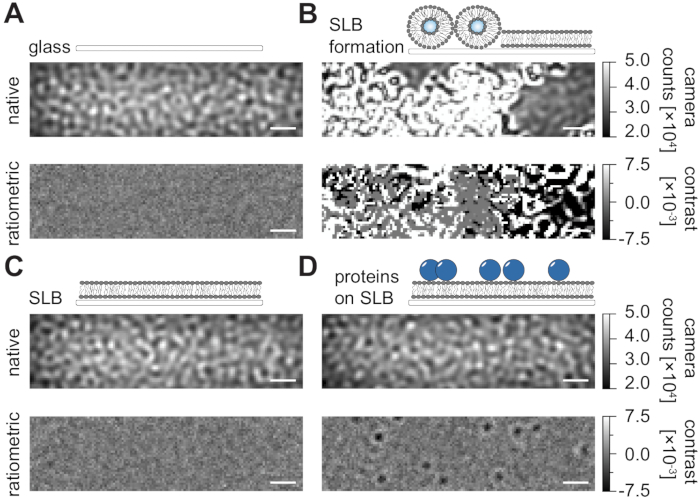
그림 2: MSPT 측정과 관련된 예시적인 표면의 기본 및 비율계량도. 유리 커버 슬라이드(A)의 표면 거칠기의 대표적인 이미지는, 담지된 지질 이중층(B)의 형성 동안, 무손상 지지된 지질 이중층(C) 및 SLB(D) 상에 재구성된 예시적인 단백질들이다. 네 가지 예제 모두 기본 모드로 표시되며, 측정 자체에서 액세스할 수 있으며 중앙값 기반 배경 제거 후 처리된 비율계량 이미지로 표시됩니다. 스케일 바는 1 μm를 나타낸다. 데이터 분석(동반 Jupyter 노트북 참조, 9단계 참조)에는 중간 창 크기(window_length) = 1001의 매개 변수가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
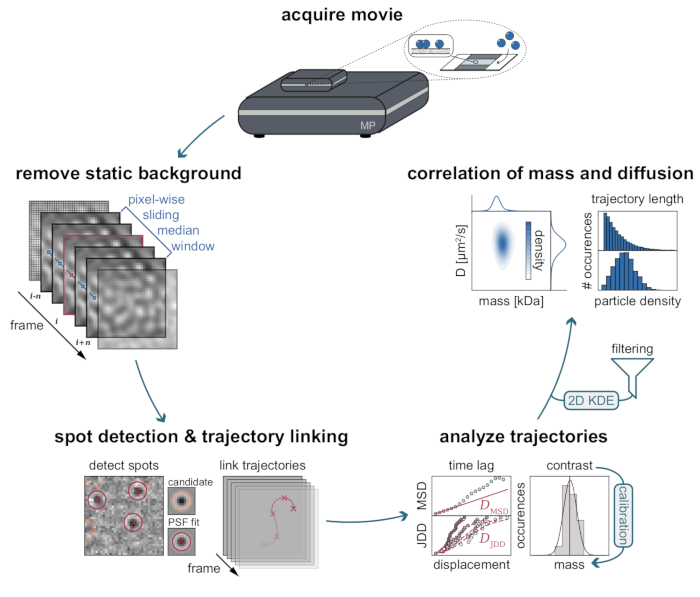
그림 3: MSPT 데이터 수집 및 분석에 필요한 단계의 단계별 다이어그램. 질량 광도계에서 관심있는 샘플에 대한 데이터 수집 후, 영화는 픽셀 단위 슬라이딩 중앙값 접근법을 통해 정적 배경을 제거하도록 처리됩니다. 그 후, 후보 입자는 입자 궤적으로의 연결 전에 점 확산 함수 (PSF)에 의해 확인되고 장착된다. 각 입자에 대한 확산 계수의 결정을 가능하게 하기 위해, 평균 제곱 변위(MSD) 또는 점프 거리 분포(JDD) 분석이 사용된다. 이 단계에서, 명암비는 교정 전략을 통해 결정된 대조-질량-관계에 따라 분자 질량으로 변형될 수 있다. 마지막 단계로서, 궤적은 길이 또는 막 입자 밀도에 기초하여 필터링되고 2차원 커널 밀도 추정(2D-KDE)에 의해 시각화될 수 있다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
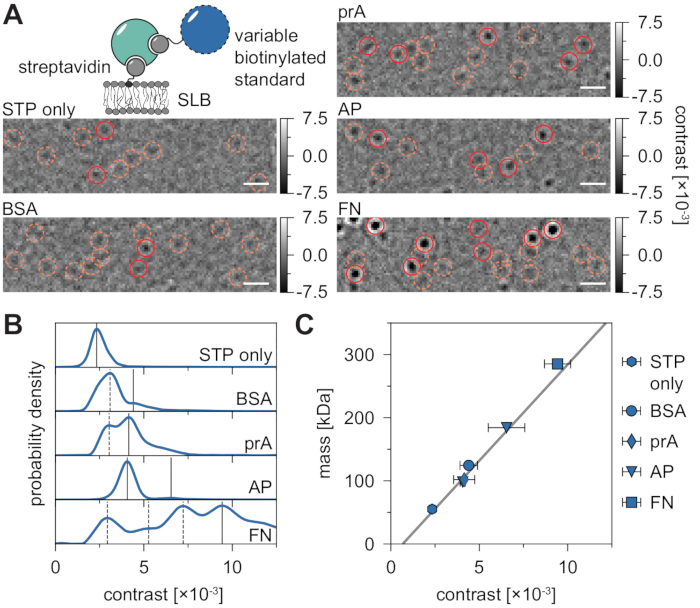
도 4: MSPT 측정을 위한 질량-대조 관계의 교정. (A) 작은 비율의 비오티닐화 지질을 함유하는 지지된 지질 이중층 상에서 확산되는 예시적인 스트렙타비딘-표준 단백질 복합체에 대해 수득된 대표적인 비율계량 프레임(DOPC:DOPG:Biotinyl Cap PE 비율 70:29.99:0.01 mol%). 모델 분자량 표준으로서, 일가 스트렙타비딘 28 (STP 전용) 또는 2가 스트렙타비딘28 중 어느 하나와 비오티닐화 소 혈청 알부민 (BSA), 비오티닐화 단백질 A (prA), 비오티닐화 알칼리성 포스파타제 (AP), 또는 비오티닐화 피브로넥틴 (FN)과의 복합체가 도시되어 있다. 후보 스폿은 주황색(파선 원)으로 강조 표시되고 성공적인 입자 감지는 빨간색(단색 원)으로 강조 표시됩니다. 스케일 바는 1 μm를 나타낸다. (B) 다섯 모델 표준 단백질에 대해 얻어진 대조값의 확률 밀도 분포. 표시된 모든 데이터는 조건당 세 개의 독립적인 실험의 풀링된 분포를 나타냅니다: STP는 단지 n = 82,719; BSA n = 9,034; prA n = 22,204; AP n = 69,065, FN n = 71,759 궤적. 단백질이 있는 막에 대해 결정된 입자 수와 비교하여, 빈 이중층에서 검출된 입자의 수는 적당한 막 밀도에서 무시할 수 있다(보충 그림 1). 질량 교정을 위해 고려되는 콘트라스트 피크는 연속적인 선을 통해 표시되고, 파선은 고려되지 않은 올리고머 상태를 나타냅니다. (c) 패널 D에서의 피크 콘트라스트와 복합체의 각각의 서열 질량으로부터 도출된 콘트라스트-대-질량 보정 곡선. 오류 막대는 부트스트래핑으로 추정된 피크 위치의 표준 오차를 표시합니다(각각 1,000개의 궤적이 있는 100개의 재샘플). 데이터 분석(Jupyter 노트북, 9단계 참조)에는 중간 창 크기(window_length) = 1,001프레임, 감지 임계값(thresh) = 0.00055, 검색 범위(dmax) = 4픽셀, 메모리(max_frames_to_vanish) = 0프레임, 최소 궤적 길이(minimum_trajectory_length) = 7프레임(STP만), 9프레임(BSA/FN), 15프레임(prA), 10프레임(AP) 등의 매개 변수가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
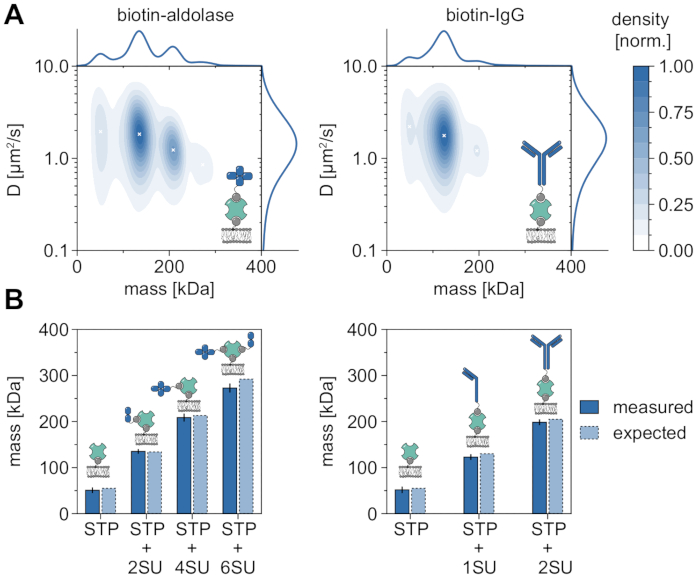
도 5: 막 관련 단백질의 올리고머 상태를 해독. (A) 비오티닐화 알돌라제(왼쪽 패널) 또는 비오틴-변형된 염소 항토끼 IgG 항체(오른쪽 패널)와 복합체에서 4가 스트렙타비딘의 질량 및 확산 계수 둘 다의 2D 커널 밀도 추정. 두 복합체의 재구성은 DOPC, DOPG, 및 비오티닐 캡 PE를 각각 70:29.99:0.01 몰%의 비율로 함유하는 담지 지질 이중층 상에서 수행되었다. 총 116,787개의 3개의 독립적인 반복실험의 궤적이 스트렙타비딘-알돌라제 복합체(0.1 μm-2의 입자 밀도)에 대해, 스트렙타비딘-IgG 복합체(0.1 μm-2의 입자 밀도)에 대해서는 348,405개가 포함되었다. 트랙 길이가 적어도 다섯 프레임인 입자만이 포함되었다. 분자 질량 (상단)과 확산 계수 (오른쪽) 모두의 한계 확률 분포가 제시됩니다. 두 패널의 검은색 x는 KDE의 각 로컬 최대값을 표시합니다. (b) 서열 질량에 따라, 예상 분자량에 따라, 비오틴-개질된 알돌라제(왼쪽 패널) 또는 비오티닐화 IgG(오른쪽 패널)와 사가 스트렙타비딘의 복합체에 대한 결정된 올리고머 질량의 비교. 약어 SU는 관심 대상 하위 단위의 단백질을 대신하여 도입됩니다. 오류 막대는 부트스트래핑으로 추정된 피크 위치의 표준 오차를 표시합니다(각각 1,000개의 궤적이 있는 100개의 재샘플). 데이터 분석(동반 Jupyter 노트북 참조; 9단계 참조)에는 중간 창 크기(window_length) = 1,001프레임, 감지 임계값(thresh) = 0.00055, 검색 범위(dmax) = 4픽셀, 메모리(max_frames_to_vanish) = 0프레임, 최소 궤적 길이(minimum_trajectory_length) = 5 매개 변수가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
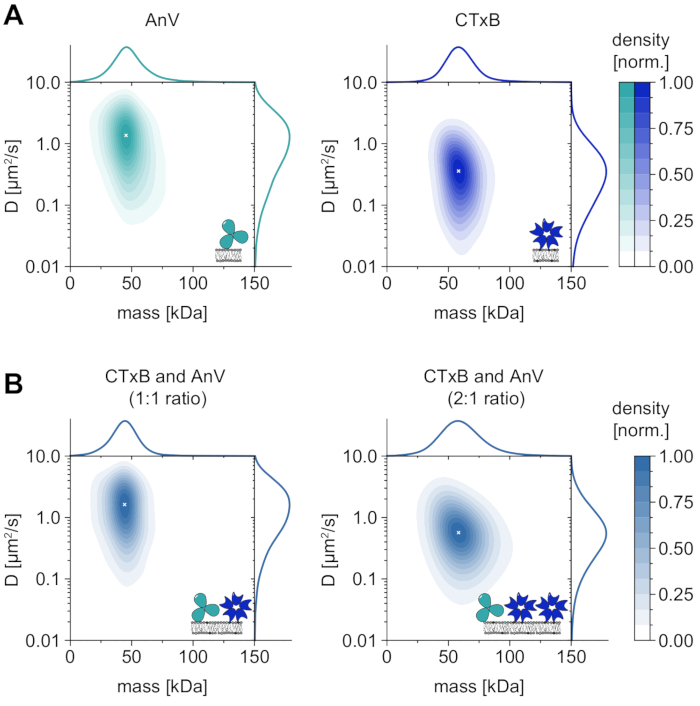
도 6: 천연 막 상호작용 단백질의 용해 아넥신 V (AnV) 및 콜레라 독소 서브유닛 B (CTxB). (A) 아넥신 V (왼쪽 패널) 및 콜레라 독소 서브유닛 B (오른쪽 패널)의 질량 및 확산 계수 둘 다의 2D 커널 밀도 추정. AnV 및 CTxB 막 재구성을 위해, GM1에 대한 80:20 몰% DOPC 및 99.99:0.01 몰% DOPC의 지질 조성물이 각각 사용되었다. 총 206,819개의 궤적에서 AnV(0.1 μm-2의 입자 밀도) 및 CTxB(0.2 μm-2의 입자 밀도)에 대한 142,895개의 궤적에 대해 세 개의 독립적인 반복실험이 포함되었다. (B) CTxB 및 AnV 혼합물의 2D 커널 밀도 추정을 각각 1:1 (왼쪽 패널) 또는 2:1 (오른쪽 패널)의 비율로 추정한다. 단백질 혼합물의 재구성은 DOPC, DOPS, 및 GM1 지질을 80:19.99:0.01 몰%의 비율로 함유하는 담지된 지질 이중층 상에서 수행되었다. 총 42,696개의 궤적에서 3개의 독립적인 반복실험이 1:1 혼합물(0.1 μm-2의 입자 밀도) 및 2:1 비율(0.3 μm-2의 입자 밀도)에 대한 264,561 궤적에 대해 포함되었다. (A) 및 (B) 둘 다에 대해, 트랙 길이가 적어도 다섯 프레임인 입자만이 포함되었다. 분자 질량 (상단)과 확산 계수 (오른쪽) 모두의 한계 확률 분포가 제시됩니다. 각 패널의 흰색 x는 KDE의 각 전역 최대값을 표시합니다. 데이터 분석(동반 Jupyter 노트북 참조; 단계 9) 매개 변수가 사용되었습니다: 중간 창 크기(window_length) = 1,001프레임, 감지 임계값(thresh) = 0.00055, 검색 범위(dmax) = 4픽셀, 메모리(max_frames_to_vanish) = 0프레임, 최소 궤적 길이(minimum_trajectory_length) = 5. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
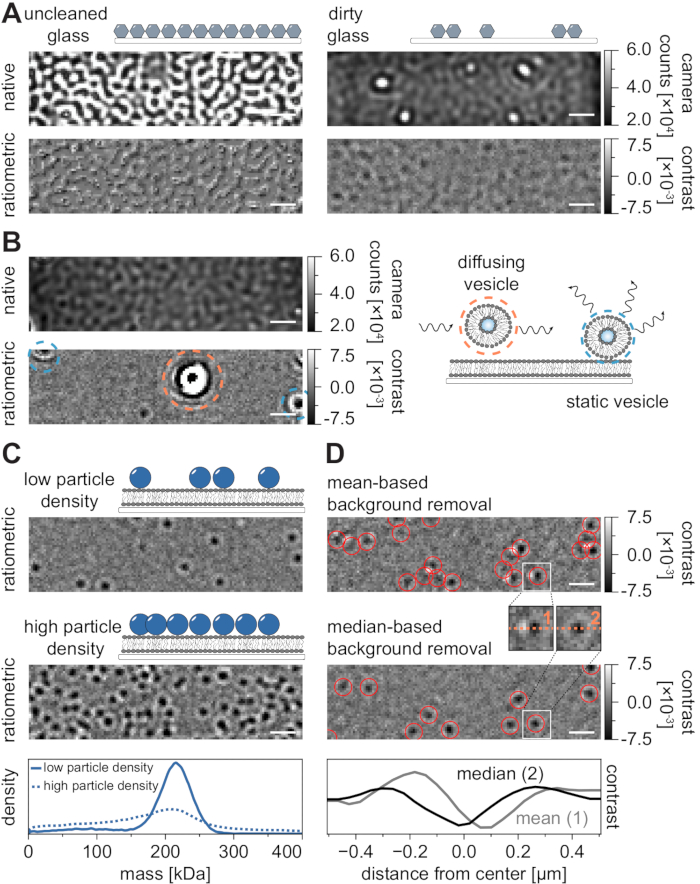
도 7: MSPT 측정 과정 또는 데이터 분석 중 잠재적인 합병증. (A) 청소되지 않은 커버 글라스 슬라이드의 기본 및 처리된(중앙값 기반 배경 제거) 비율계량 도에서 표시되는 표면 거칠기의 대표적인 이미지. 두 경우 모두 밝은 반점은 유물이없는 측정을 방해하는 잔류 표면 불순물을 구성합니다. (b) 불충분한 막 세척 후 시야에서 잔류 소포의 예시적인 이미지. 정적 (파란색으로 강조 표시됨)과 확산 (주황색으로 강조 표시됨) 소포는 각각 맥동 및 흔들림 또는 방향 이동으로 인해 측정 품질을 손상시킵니다. (C) 단일 입자 기술로서, MSPT는 각 입자의 적절한 연결 및 질량 결정을 가능하게 하기 위해 낮은 입자 밀도(대표 이미지, 상부 패널)를 필요로 한다. 높은 멤브레인 입자 밀도 (중간 패널)의 경우, 입자 피팅이 손상되어 질량 결정에 영향을 미칩니다 (하단 패널 참조). (D) 평균 기반 (상부 패널) 또는 중앙값 기반 배경 제거 후 멤브레인 계면 상에서 확산되는 입자의 대표적인 비율계량 이미지. 확산 입자의 경우, 평균 기반 배경 제거 전략은 상부 패널과 중간 패널 사이의 작은 인셋에서 볼 수 있듯이 입자의 PSF의 왜곡 된 이미지를 생성합니다. 대조적으로, 왜곡되지 않은 입자 PSF는 중앙값 기반 접근법을 통해 얻어질 수 있다. 하단 패널: 평균 또는 중앙값 기반 배경 제거 후 얻은 PSF의 중심을 통한 선 프로파일 비교. 이 그림에 표시된 모든 기본 및 비율계량 이미지의 경우 배율 막대는 1μm를 나타냅니다. 데이터 분석(동반 Jupyter 노트북 참조; 9단계 참조)에는 중간 창 크기(window_length) = 1,001프레임, 감지 임계값(thresh) = 0.00055, 검색 범위(dmax) = 4픽셀, 메모리(max_frames_to_vanish) = 0프레임, 최소 궤적 길이(minimum_trajectory_length) = 5 매개 변수가 사용되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1 : 단백질이없는 막과 점유 된 막의 비교. 정제된 스트렙타비딘(STP)의 첨가 전(A) 및 후(B)의 무손상 담지된 지질 이중층의 대표적인 이미지. 모델 PSF에 성공적으로 적합했던 후보 스폿은 빨간색으로 둘러싸여 있습니다. (C) 빈 막 (막 배경, 회색)과 확산 된 스트렙타비딘 입자 (파란색)가있는 이중층에서 검출 된 입자의 대조 확률 분포. 두 확률 분포 모두 동일한 영화 수집 및 분석 매개 변수를 가진 세 개의 독립적인 실험의 풀링된 데이터를 나타냅니다. 데이터 분석(동반 Jupyter 노트북 참조, 9단계 참조)에는 중간 창 크기(window_length) = 1,001프레임, 감지 임계값(thresh) = 0.00055, 검색 범위(dmax) = 4픽셀, 메모리(max_frames_to_vanish) = 0프레임, 최소 궤적 길이(minimum_trajectory_length) = 7프레임의 매개 변수가 사용되었습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 영화 1: 질량 광도계로 기록된 균질한 막으로의 소포의 파열 및 융합을 보여주는 예시적인 영화. 이미지 처리 중앙값 창 크기(window_length) = 1,001프레임. 스케일 바: 1 μm. 카메라 카운트 범위: 검정 = 16,892; 흰색 = 65,408. 이 영화를 다운로드하려면 여기를 클릭하십시오.
보충 영화 2: MSPT 측정으로부터 수득된 바와 같은 이중층 상의 아넥신 V(상부) 및 비오티닐화 알돌라제(하단) 복합체의 확산을 보여주는 예시적인 영화. 이미지 처리 중앙값 창 크기(window_length) = 1,001프레임. 스케일 바: 1 μm. 간섭 산란 대비 범위: 검정 = -0.0075; 흰색 = 0.0075. 이 영화를 다운로드하려면 여기를 클릭하십시오.
토론
제시된 프로토콜은 유리에 흡착되는 단일 생체 분자의 질량을 분석하는 기술인 질량 광도계(21)를 표지되지 않은 막 상호작용 생체분자의 질량과 확산을 동시에 측정할 수 있는 훨씬 더 다재다능한 도구로 확장한다. 이러한 분석 확장은 분자(24,25)의 측방향 운동에 적응된 변형된 배경 제거 전략의 구현을 통해 달성된다. 일반적으로 유리 표면 거칠기의 강한 산란이 주요 분석 장애를 나타내기 때문에 iSCAT 기반 접근법에서는 배경 제거가 가장 중요하며 입자 질량 및 위치의 정량화를 위해서는 각 픽셀의 로컬 배경에 대한 정확한 결정이 필수적입니다. 입자 운동에 적합한 이미지 분석 외에도 후속 입자 감지, 궤적 연결 및 데이터 분석은 MP를 질량 민감성 입자 추적(MSPT)으로 새롭게 확장합니다.
일반적으로 철저히 청소 된 유리 커버 슬라이드와 깨끗한 작업 환경은 MSPT 실험의 성공적인 성능을 위해 중요한 요구 사항입니다. 거대분자 표지의 부재로 인해, 획득된 신호는 본질적으로 비선택적이다. 따라서 깨끗한 샘플과 적절한 샘플 처리는 관측치가 잘못 해석되지 않도록 하는 데 매우 중요합니다. 특히, 저분자량의 분자를 검사할 때, 단백질이 없는 막의 대조군 측정은 배경 기여도를 평가하기 위해 승인된다(보충 그림 1). 따라서 제어 측정을 포함하는 것 외에도 각 유량 챔버에 대해 그림 2 에 표시된 준비 단계를 따르는 것이 좋습니다. 조합될 때, 이들 안전 조치들은 검출된 신호가 관심있는 생체분자로부터 기원하고, 예를 들어, 오염된 유동 챔버, 버퍼 또는 멤브레인으로부터 유래하지 않도록 보장할 것이다.
실험 설계에 관한 예방 조치 외에도 MSPT 이미지 처리 중에주의해야합니다. 비디오 프로세싱 동안, 정확한 결과를 보장하기 위해 세 개의 파라미터에 대한 값을 신중하게 선택해야 한다: i) 배경 제거를 위한 중앙값 윈도우의 길이, ii) 파티클 검출을 위한 임계값, iii) 링크 할당 동안 최대 검색 반경. 더 큰 중앙값 창 (i)은 일반적으로 중첩된 준불수 배경으로부터 확산 입자의 분리를 용이하게 한다. 그러나 너무 큰 창 크기의 경우 샘플 드리프트가 결국 눈에 띄게되고 배경 추정의 정확도가 떨어집니다. 최적의 설정은 샘플 특성과 측정 조건에 따라 크게 달라집니다. 그럼에도 불구하고 1,001의 값을 강력한 시작점으로 사용할 수 있습니다. 역치 파라미터 (ii)는 샘플에서 예상되는 가장 낮은 분자 질량에 따라 조정되어야 한다. 0.0005 미만의 값은 이 연구에 사용된 질량 광도계로 측정한 경우에는 권장되지 않습니다. 분석 시간을 단축하기 위해 분자량이 높은 샘플이 예상되는 경우 더 높은 값을 선택할 수 있습니다. 궤적 링크(iii)의 검색 반경은 파티클의 이동된 위치가 연속적인 프레임에서 검색될 픽셀 단위의 최대 방사 거리를 지정합니다. 샘플에서 가장 빠른 파티클에 맞게 조정해야 하며, 선호하는 경우 계산 시간을 줄이기 위해 적응형 검색 범위( trackpy 문서 참조)를 대신 사용할 수 있습니다. 특히 프로젝트의 초기 단계에서 다양한 매개 변수로 영화를 다시 분석하여 얻은 결과를 검증하는 것이 좋습니다.
MSPT의 단일 분자 특성에 비추어 볼 때, 정확한 콘트라스트 및 질량 결정을 방해 할 수 있으므로 높은 막 입자 밀도에서 측정하는 것을 피해야합니다. 제곱 마이크로미터당 하나의 입자 미만의 밀도가 MSPT 측정(24)에 유리하다는 것이 밝혀졌다. 추가적인 고려사항은 샘플에서 예상되는 확산 계수입니다. 광범위한 확산 계수에 적용 가능하지만, MSPT는 접근 가능한 확산 계수의 하한을 갖는다. 중앙값 창 기간의 상당 부분 동안 몇 픽셀의 영역에 대한 로컬 제한은 파티클을 정적 배경과 병합합니다. 이 프로토콜에 사용되는 이미징 조건의 경우 0.01μm2/s 미만의 확산 계수를 측정하지 않는 것이 좋습니다. 이러한 확산 속도에서, 예를 들어, 중앙값 윈도우 하프 사이즈 동안 입자의 평균 제곱 변위는 약 4픽셀이고, 따라서 PSF의 범위와 유사한 크기이다. 결과적으로, 정적 배경 추정치는 입자 자체의 신호 기여를 포함할 가능성이 높으며, 이로 인해 결국 노이즈 레벨에 도달할 때까지 입자의 대비가 명백하게 감소합니다. 그러나 0.05 ~ 10μm2/s 범위의 거대분자 확산 계수는 명확하게 해결할 수 있습니다.
MSPT 응용 프로그램의 범위를 더욱 확장하기 위해 파티클이 일시적으로 점유되는 픽셀을 제거하거나 더 큰 중앙값 창 크기를 가능하게 하는 샘플 드리프트 보정을 통해 중앙값 기반 백그라운드 알고리즘의 발전을 구상할 수 있습니다. 두 접근법 모두 높은 입자 밀도와 느린 확산에서의 측정과 관련된 문제를 완화 할 것입니다. 낮은 질량 감도 측면에서 개선은 50kDa보다 작은 생체 분자에 대한 액세스를 제공 할 수있는 새로운 세대의 질량 광도계로 지평선에 있습니다. 따라서, 미래의 MSPT 실험은 쿠션된 이중층 및 거대분자 시스템과 같은 훨씬 더 넓은 범위의 막 모방체에 대한 단일 분자 역학 및 막 관련 상호작용을 연구할 수 있을 것이다.
공개
저자는 이해 상충이 없습니다.
감사의 말
Philipp Kukura, Gavin Young, Refeyn 소프트웨어 팀의 지원에 진심으로 감사드리며 이미지 분석 코드의 일부를 공유함으로써 도움을 인정합니다. 상업용 Refeyn 질량 광도계에 대한 액세스를 제공 한 Cryo-EM MPIB 핵심 시설에 감사드립니다. F.S.는 Jürgen Plitzko와 Wolfgang Baumeister가 부여한 지원과 기금을 감사하게 인정합니다. T.H.와 P.S.는 Deutsche Forschungsgemeinschaft (DFG, German Research Foundation) - Project-ID 201269156 - SFB 1032 (A09)를 통해 자금을 지원받았습니다. N.H.는 DFG 반환 보조금 HU 2462/3-1에 의해 지원되었다. P.S.는 독일 연방 교육 연구부 (BMBF)와 막스 플랑크 학회 (Max Planck Society)의 공동 자금 조달 이니셔티브를 통해 연구 네트워크 MaxSynBio를 통한 지원을 인정합니다.
자료
| Name | Company | Catalog Number | Comments |
| annexin V | Sigma Aldrich | #SRP8026 | examplary membrane-interacting protein |
| Bio-Rad Protein Assay | Bio-Rad Laboratories Inc. | #5000006 | bradford assay kit to determine protein stock concentrations |
| biotin labeled bovine albumin | Sigma Aldrich | #A8549 | examplary protein that can be used as standard protein for MSPT |
| cholera toxin subunit B | Sigma Aldrich | #SAE0069 | examplary membrane-interacting protein |
| cover glasses, #1.5, 24 x 24 mm | Paul Marienfeld GmbH & Co. KG | #0102062 | |
| cover glasses, #1.5, 24 x 60 mm | Paul Marienfeld GmbH & Co. KG | #0102242 | |
| dioleoyl-sn-glycero-3-phosphocholine (DOPC) | Avanti Polar Lipids | #850375 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoethanolamine-N-cap biotinyl (18:1 Biotinyl Cap PE | Avanti Polar Lipids | #870273 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phosphoglycerol (DOPG) | Avanti Polar Lipids | #840475 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| dioleoyl-sn-glycero-3-phospho-L-serine (DOPS) | Avanti Polar Lipids | #840035 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| double-sided tape | tesa | #57912-00000-02 | needed for the assembly of glass sample chambers |
| Extruder | Avanti Polar Lipids | #610023 | Lipid extruder to enable monodisperse vesicle distributions |
| EZ-Link Maleimide-PEG2-Biotin | Thermo Fisher Scientific | #A39261 | maileimide-fused biotin that can be used to biotinylate standard proteins for MSPT |
| Fibronectin (Biotinylated) | Cytoskeleton Inc. | #FNR03-A | examplary protein that can be used as standard protein for MSPT |
| Gel Filtration HMW Calibration Kit | Cytiva | #28403842 | standard proteins, e.g. aldolase that can be biotinylated and used as molecular weight standards for MSPT |
| GM1 Ganglioside (Brain, Ovine-Sodium Salt) | Avanti Polar Lipids | #860065 | lipid - in the form of extruded small unilamellar vesicles required for supported lipid bilayer formation |
| Goat anti-Rabbit IgG (H+L) Secondary Antibody, Biotin | Thermo Fisher Scientific, Waltham, USA) | #31820 | examplary protein to highlight the existence of different protein states |
| Isopropanol, 99.5%, for spectroscopy | Thermo Fisher Scientific | #10003643 | |
| Low Autofluorescence Immersion Oil | Olympus K.K. | #IMMOIL-F30CC | |
| pET21a-Streptavidin-Alive | Addgene | #20860 | required to express and purify divalent streptavidin in combination with each other |
| pET21a-Streptavidin-Dead | Addgene | #20859 | required to express and purify divalent streptavidin in combination with each other |
| Pierce Alkaline Phosphatase, biotinylated | Thermo Fisher Scientific | #29339 | examplary protein that can be used as standard protein for MSPT |
| Pierce Protein A, Biotinylated | Thermo Fisher Scientific | #29989 | examplary protein that can be used as standard protein for MSPT |
| Refeyn Acquire | Refeyn Ltd. | control software for Refeyn OneMP | |
| Refeyn One | Refeyn Ltd. | - | mass photometer |
| sterile syringe filters 0.45 µm cellulose acetate membrane | VWR International | #514-0063 | needed to filter particles from the buffer of interest |
| tetravalent streptavidin | Thermo Fisher Scientific | #SNN1001 | tetravalent streptavidin to enable the presence of several biotin binding sites |
| Whatman Nuclepore Hydrophilic Membrane, 0.05 µm Pore Size, 25 mm Circle | Cytiva | #110603 | a pore size of 50 nm is recommended for supported lipid bilayer formation in the context of MSPT |
| Zepto model 2 plasma cleaner | Diener electronic GmbH | - |
참고문헌
- Robertson, J. L. The lipid bilayer membrane and its protein constituents. Journal of General Physiology. 150 (11), 1472-1483 (2018).
- Grecco, H. E., Schmick, M., Bastiaens, P. I. H. Signaling from the Living Plasma Membrane. Cell. 144 (6), 897-909 (2011).
- Cho, W., Stahelin, R. V. Membrane-protein interactions in cell signaling and membrane trafficking. Annual Review of Biophysics and Biomolecular Structure. 34, 119-151 (2005).
- Whited, A. M., Johs, A. The interactions of peripheral membrane proteins with biological membranes. Chemistry and Physics of Lipids. 192, 51-59 (2015).
- Gonzalez, L., Scheller, R. H. Regulation of membrane trafficking: Structural insights from a Rab/effector complex. Cell. 96 (6), 755-758 (1999).
- Sezgin, E., Levental, I., Mayor, S., Eggeling, C. The mystery of membrane organization: composition, regulation and roles of lipid rafts. Nature Reviews Molecular Cell Biology. 18 (6), 361-374 (2017).
- Bagheri, Y., Ali, A. A., You, M. Current methods for detecting cell membrane transient interactions. Frontiers in Chemistry. 8, 603259(2020).
- Miller, H., Zhou, Z., Shepherd, J., Wollman, A. J. M., Leake, M. C. Single-molecule techniques in biophysics: A review of the progress in methods and applications. Reports on Progress in Physics. 81 (2), 024601(2018).
- Manzo, C., Garcia-Parajo, M. F. A review of progress in single particle tracking: From methods to biophysical insights. Reports on Progress in Physics. 78 (12), 124601(2015).
- Gelles, J., Schnapp, B. J., Sheetz, M. P. Tracking kinesin-driven movements with nanometre-scale precision. Nature. 331 (6155), 450-453 (1988).
- Funatsu, T., Harada, Y., Tokunaga, M., Saito, K., Yanagida, T. Imaging of single fluorescent molecules and individual ATP turnovers by single myosin molecules in aqueous solution. Nature. 374 (6522), 555-559 (1995).
- Schmidt, T., Schütz, G. J., Baumgartner, W., Gruber, H. J., Schindler, H. Imaging of single molecule diffusion. Proceedings of the National Academy of Sciences of the United States of America. 93 (7), 2926-2929 (1996).
- Taylor, R. W., et al. Interferometric scattering microscopy reveals microsecond nanoscopic protein motion on a live cell membrane. Nature Photonics. 13 (7), 480-487 (2019).
- Kukura, P., et al. High-speed nanoscopic tracking of the position and orientation of a single virus. Nature Methods. 6 (12), 923-927 (2009).
- Jacobsen, V., Stoller, P., Brunner, C., Vogel, V., Sandoghdar, V. Interferometric optical detection and tracking of very small gold nanoparticles at a water-glass interface. Optics Express. 14 (1), 405(2006).
- Ueno, H., et al. Simple dark-field microscopy with nanometer spatial precision and microsecond temporal resolution. Biophysical Journal. 98 (9), 2014-2023 (2010).
- Loose, M., Fischer-Friedrich, E., Herold, C., Kruse, K., Schwille, P. Min protein patterns emerge from rapid rebinding and membrane interaction of MinE. Nature Structural and Molecular Biology. 18 (5), 577-583 (2011).
- Bezeljak, U., Loya, H., Kaczmarek, B., Saunders, T. E., Loose, M. Stochastic activation and bistability in a Rab GTPase regulatory network. Proceedings of the National Academy of Sciences of the United States of America. 117 (12), 6504-6549 (2020).
- Ha, T., Tinnefeld, P. Photophysics of fluorescent probes for single-molecule biophysics and super-resolution imaging. Annual Review of Physical Chemistry. 63 (1), 595-617 (2012).
- Garcia-Parajo, M. F., Segers-Nolten, G. M. J., Veerman, J. A., Greve, J., Van Hulst, N. F. Real-time light-driven dynamics of the fluorescence emission in single green fluorescent protein molecules. Proceedings of the National Academy of Sciences of the United States of America. 97 (13), 7237-7242 (2000).
- Young, G., et al. Quantitative mass imaging of single biological macromolecules. Science. 360 (6387), 423-427 (2018).
- Piliarik, M., Sandoghdar, V. Direct optical sensing of single unlabelled proteins and super-resolution imaging of their binding sites. Nature Communications. 5, 4495(2014).
- Cole, D., Young, G., Weigel, A., Sebesta, A., Kukura, P. Label-free single-molecule imaging with numerical-aperture-shaped interferometric scattering microscopy. ACS Photonics. 4 (2), 211-216 (2017).
- Heermann, T., Steiert, F., Ramm, B., Hundt, N., Schwille, P. Mass-sensitive particle tracking to elucidate the membrane-associated MinDE reaction cycle. Nature Methods. 18 (10), 1239-1246 (2021).
- Foley, E. D. B., Kushwah, M. S., Young, G., Kukura, P. Mass photometry enables label-free tracking and mass measurement of single proteins on lipid bilayers. Nature Methods. 18 (10), 1247-1252 (2021).
- Voss, O. H., Lee, H. N., Tian, L., Krzewski, K., Coligan, J. E. Liposome preparation for the analysis of lipid-receptor interaction and efferocytosis. Current Protocols in Immunology. 120, 1-21 (2018).
- Pincet, F., et al. FRAP to characterize molecular diffusion and interaction in various membrane environments. PLoS ONE. 11 (7), 0158457(2016).
- Howarth, M., et al. A monovalent streptavidin with a single femtomolar biotin binding site. Nature Methods. 3 (4), 267-273 (2006).
- Allan, D., et al. soft-matter/trackpy: Trackpy v.0.5.0. Zenodo. , (2021).
- Weimann, L., et al. A quantitative comparison of single-dye tracking analysis tools using Monte Carlo simulations. PLoS ONE. 8 (5), 64287(2013).
- Michalet, X. Mean square displacement analysis of single-particle trajectories with localization error: Brownian motion in an isotropic medium. Physical Review E - Statistical, Nonlinear, and Soft Matter Physics. 82 (4), 041914(2010).
- Sygusch, J., Beaudry, D., Allaire, M. Molecular architecture of rabbit skeletal muscle aldolase at 2.7-A resolution. Proceedings of the National Academy of Sciences of the United States of America. 84 (22), 7846-7850 (1987).
- Heath, G. R., Scheuring, S. High-speed AFM height spectroscopy reveals µs-dynamics of unlabeled biomolecules. Nature Communications. 9 (1), 4983(2018).
- Day, C. A., Kenworthy, A. K. Mechanisms underlying the confined diffusion of cholera toxin B-subunit in intact cell membranes. PLOS ONE. 7 (4), 34923(2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유