Method Article
使用类器官共培养物对食管成纤维细胞进行功能表征和可视化
摘要
类器官-成纤维细胞共培养为研究 体内 干细胞生态位提供了一个模型。这里描述了食管类器官-成纤维细胞共培养的方案。此外,全卡口成像用于可视化成纤维细胞-类器官相互作用。
摘要
上皮干细胞和祖细胞有助于整个生命中上皮屏障的形成和维持。大多数干细胞和祖细胞群隐藏在解剖学上不同的位置,能够与保持干性的生态位信号进行排他性的相互作用。虽然上皮类器官培养物的发展为理解干细胞和祖细胞在体内平衡和疾病中的作用提供了强有力的工具,但生态位环境中的相互作用在很大程度上不存在,从而阻碍了影响干细胞行为的因素的鉴定。成纤维细胞在指导上皮干和祖细胞命运方面起着关键作用。在这里,提出了一个全面的类器官-成纤维细胞共培养方案,能够在食管祖细胞更新和分化中描绘成纤维细胞亚群。在该协议中,描述了一种从食道平行分离上皮细胞和成纤维细胞的方法。概述了不同的荧光激活细胞分选策略,用于从转基因报告基因或野生型小鼠中分离食管祖细胞和成纤维细胞亚群。该协议提供了一种通用方法,可以适应特定成纤维细胞亚群的分离。该协议包括建立和传代食管上皮类器官单一培养物,以便与共培养系统直接比较。此外,还描述了一种3D清除方法,可以对上皮-成纤维细胞相互作用进行详细的图像分析。总的来说,该协议描述了一种比较且相对高通量的方法,用于在 体外鉴定和了解食管干细胞生态位成分。
引言
类器官用作 3D 体外测定,以表征干细胞和祖细胞,以及了解源自干细胞生态位1,2,3,4 的细胞成分的信号线索。小鼠食管类器官于2014年首次被描述,几篇论文已经确定了维持和传代食管类器官所需的生长因子,如R-Spondin(RSPO),NOGGIN和表皮生长因子(EGF)5,6,7,认为体内需要类似的信号线索。 祖细胞更新。然而,生长因子通常以非生理浓度添加,导致类器官生长条件不一定反映体内信号传导环境。
成纤维细胞是异质基质细胞群,支持许多干细胞生态位中的祖细胞特性8。在同一类器官培养物中结合上皮祖细胞和成纤维细胞,可以在降低浓度的外源性补充生长因子中形成类器官。描述了来自肠和肝上皮的类器官共培养系统,但建立食管类器官-成纤维细胞共培养的方案仍然未完成9,10,11。
在该协议中,概述了使用转基因PdgfrαH 2 BeGFP 小鼠12 或具有经典抗体染色的野生型小鼠的食道成纤维细胞的两种荧光激活细胞分选(FACS)策略。可以使用所选的细胞表面标记物分离成纤维细胞的不同亚群,从而为方案提供灵活性。此外,保留类器官形态的3D荧光成像技术用于表征成纤维细胞-类器官相互作用。类器官清除提供了一种快速方法来增加类器官中的光穿透深度,改善类器官-成纤维细胞连接的可视化,并能够完整地再现类器官结构。该协议将食管类器官共培养与全支架成像策略相结合,能够对成纤维细胞-类器官相互作用进行功能表征。
研究方案
本研究的动物实验已获得斯德哥尔摩Norra djurförsöksetiska nämnd(伦理许可证号14051-2019)的批准。根据欧洲实验动物科学协会联合会的建议,将动物饲养在无病原体的条件下。
1. 准备
- 在冰上解冻用于解离的酶储备溶液(见 材料表)。在4°C下解冻生长因子还原(GFR)基底膜基质(基质)的等分试样。
- 准备培养基。使用 表1 中描述的培养基进行类器官培养和共培养,并在开始方案之前进行制备。
2.食管上皮和基质的解剖和分离
注意:确保用于解剖和组织处理的所有仪器都是无菌的。每三个食管在汉克斯平衡盐溶液 (HBSS) 中制备 2 mL 解离溶液(参见 材料表)。
- 使用选择的小鼠品系,例如C57BL / 6J小鼠。小鼠的食管发育在出生后一天(p)70后完成,因此建议使用年龄超过p7013的小鼠。使用四或五只小鼠,因为它们提供了足够的材料来建立8-10个类器官共培养物。
注意:类器官形成效率随着小鼠年龄的增长而降低。如果感兴趣的是特定的成纤维细胞亚群,则低成纤维细胞产量可能会限制可以建立的类器官共培养物的数量。 - 使用转基因(例如,PdgfrαH2BeGFP)或野生型(WT)小鼠分离成纤维细胞群。使用WT小鼠时,进行抗体染色以通过FACS 从 基质中分离出特定的成纤维细胞亚群。
- 通过CO2 窒息对小鼠实施安乐死。用镊子和解剖剪刀解剖食道。要切除整个食道,请切开胃正上方的食道远端和气管起点的近端。将食道浸入PBS中并将其放在冰上。
- 使用解剖显微镜(总放大倍率范围为8x-40x)和镊子机械地取出外肌层。使用一对镊子握住解剖食管的远端,并使用其他镊子抓住肌肉并将其从解剖食道的远端拉到近端。去除并丢弃肌肉层。
- 纵向打开食道。使用带有球尖的显微切割弹簧剪刀效果最好,以防止组织损伤。握住食道的一端,以便将弹簧剪刀的球插入食道的腔中,并在保持末端的同时切开食道。
- 将食管放入 1.5 mL 微量离心管或 24 孔板中。将打开的食道在37°C的HBSS中的0.5mg / mL热溶酶中在摇臂摇床上孵育15分钟。将食道完全浸入热溶酶溶液中。
注意:使用的热溶素溶液的体积取决于孔或管的大小。可以将几个食管放置并浸没在同一孔或管中。 - 从热溶酶溶液中取出食道。使用解剖显微镜小心地将食管上皮与基质分开。使用细镊子,抓住组织的上皮侧和基质侧,并慢慢将它们拉开以分离两层。
注意:基质通过其白色和不透明的外观来识别,与透明的上皮形成对比。基质包含固有层和粘膜下层。 - 将上皮层和基质层转移到两个独立的 1.5 mL 微量离心管中,在 HBSS 中加入 200 μL 解离溶液。放在冰上。
3.食管祖细胞的分离
注意:食管祖细胞(步骤2)和成纤维细胞(步骤3)的分离可以同时进行。在 HBSS 中制备 50 mL 1% FBS 管(1% FBS)。
- 将分离的食管上皮从1.5mL微量离心管(步骤2.8)转移到干净的培养皿中,并使用锋利的手术刀切碎。用 200 μL 解离溶液从培养皿中收集切碎的组织,并将其转移回 1.5 mL 微量离心管中。
注意:当可以使用 200 μL 移液器吸头将碎片放回 1.5 mL 微量离心管中时,上皮正确切碎。 - 将 800 μL 新鲜解离溶液加入 1.5 mL 微量离心管中,总体积为 1 mL。
注意:添加足够体积的解离溶液很重要。每 1 至 3 个食管,建议使用 1 mL 溶液。当一次处理更多食管时,扩大规模。 - 将带有切碎的上皮层的管放在37°C的摇臂振动器上60分钟。每 15 分钟使用 200 μL 移液器吸头上下移取溶液约 20 次,以增强消化。
- 60 分钟后,使用 200 μL 移液器吸头再上下移液 20 次。将溶液通过 40 μm 细胞过滤器进入新的 1.5 mL 微量离心管中。在4°C下以300× g 离心10分钟。
注意:在过滤细胞之前,用1%FBS润湿细胞过滤器,以尽量减少细胞对过滤器的粘附。上皮不会被完全消化,组织碎片仍然可见。然而,更长的孵育时间会降低细胞存活率,并且不会导致更高的活细胞产量。 - 用 1 mL 移液管除去多余的液体,弃去上清液,并将沉淀重悬于 1 mL 的 1% FBS 中。在4°C下以300× g 离心10分钟。
- 在离心过程中,制备用于食管祖细胞FACS的偶联抗体混合物。
- 将 1 μL CD324-PE-Cy7(依粘蛋白)和 CD104-A647 (整合素-β4) 混合在每百万个细胞 200 μL 1% FBS 中。
注意:1 μL 抗体(200 μL 最终体积)足以用于一个或两个食管。当一次处理更多的食管时,增加抗体染色液的体积。
- 将沉淀重悬于 200 μL 抗体混合物中,并转移到流式细胞术管中。添加荧光抗体后,将细胞悬液保持在黑暗中以避免信号漂白。将细胞在4°C孵育30分钟。 加入 3 mL 的 1% FBS,并在 4 °C 下以 300 x g 离心 10 分钟,然后将细胞重悬于至少 200 μL 的 1% FBS 中。
注意:500 μL 1% FBS 用于多达四个或五个食管。当一次处理更多食管时,增加体积,因此可以实现 100-300 个事件/秒的 FACS 流速。更多的事件/秒会降低分选效率,流速的增加会降低细胞存活率。 - 在FACS分选前5分钟将死细胞染色标记物添加到终浓度为1:10,000,以分离活细胞。使用FACS机器对祖细胞进行分类(有关门控策略,请参见 图1 )。将细胞收集在装有 200 μL 碱性类器官培养基的 1.5 mL 微量离心管中(表 1)。
4. 从基质层中分离成纤维细胞
- 使用解剖剪刀在含有 200 μL 解离溶液(步骤 2.8)的 1.5 mL 管中将气孔层切成细块。一旦可以使用 200 μL 移液器吸头上下移液溶液,组织就被适当切碎。
- 将 800 μL 新鲜解离溶液加入 1.5 mL 微量离心管中,总体积为 1 mL。
注意:添加足够体积的解离溶液很重要。每 1 至 3 个食管,建议使用 1 mL 溶液。当一次处理更多食管时,扩大规模。 - 将试管放在37°C的摇臂摇床上30分钟。15 分钟后,使用 200 μL 移液器吸头上下移液约 20 次,以增强消化。
- 酶消化 30 分钟后,使用 200 μL 移液器吸头再上下移液 20 次。将溶液通过 70 μm 细胞过滤器过滤到新的 1.5 mL 微量离心管中。在4°C下以300× g 离心10分钟。
注意:在过滤细胞之前,用1%FBS润湿细胞过滤器,以尽量减少细胞对过滤器的粘附。 - 用 1 mL 移液管除去多余的液体,弃去上清液,并将沉淀重悬于 1 mL 的 1% FBS 中。在4°C下以300× g 离心10分钟。
注意:当使用含有荧光标记的成纤维细胞的转基因小鼠品系时,抗体染色是可选的。如果不需要抗体染色,请继续执行步骤3.7并将样品转移到流式细胞术管中。- 在离心过程中,制备偶联抗体混合物用于成纤维细胞的FACS分离。将 1 μL CD26-APC (DPP4) 与每百万个细胞 200 μL 1% FBS 混合。
注意:1 μL 抗体足以满足一个或两个食道。当一次处理更多的食管时,增加抗体染色液的体积。
- 在离心过程中,制备偶联抗体混合物用于成纤维细胞的FACS分离。将 1 μL CD26-APC (DPP4) 与每百万个细胞 200 μL 1% FBS 混合。
- 将沉淀重悬于 1% FBS 中的 200 μL 偶联抗体混合物中,并转移到流式细胞术管中。将细胞在4°C孵育30分钟。
- 加入3mL的1%FBS,并在4°C下以300× g 离心10分钟。 将细胞重悬于至少 200 μL 的 1% FBS 中。
注意:500 μL 1% FBS 用于多达四个或五个食管。当一次处理更多的食管时,增加体积,因此可以实现100-300个事件/秒的流速。更多的事件/秒会降低分选效率,增加流速会降低细胞存活率。添加荧光抗体后,细胞悬液应保持黑暗,以避免信号漂白。 - 在FACS分选前5分钟将死细胞染色标记物添加到终浓度为1:10,000,以分离活细胞。使用FACS机器对细胞进行分类(有关门控策略,请参见 图1 )。将细胞收集在装有 200 μL 碱性类器官培养基的 1.5 mL 微量离心管中(表 1)。
5. 食管类器官的建立与培养
注意:预热ER低 (类器官共培养),ENR(类器官)培养基(有关描述,请参见 表1 )和37°C下的48孔板。 将解冻的基质(在步骤1中制备)等分试样放在冰上。建议使用此处提供的基质(见 材料表)进行小鼠食管类器官培养,因为其他品牌的基质会对类器官形成效率产生负面影响。
- 对于类器官共培养,在管中以 1:2 的比例混合分选的上皮细胞和成纤维细胞。对于每个基质圆顶,使用5,000个上皮细胞和10,000个成纤维细胞。在准备更多的圆顶时,在一根管中加入 5,000 个上皮细胞和 10,000 个成纤维细胞的倍数。对于不含成纤维细胞的类器官培养物,每个基质圆顶使用 5,000 个上皮细胞。
- 将混合细胞群以300× g 离心5分钟。用 200 μL 移液器小心地将其除去,丢弃上清液。
- 通过将沉淀重悬于冷碱性类器官培养基中并以300× g 离心5分钟来洗涤细胞一次。将细胞放在冰上。
- 制备由80%基质和20%冷碱性类器官培养基组成的混合物。将所有东西放在冰上,因为基质在室温(RT)下凝固。
- 离心后用200μL移液管小心地除去上清液,丢弃上清液。将细胞重悬于 10 μL 基质混合物/圆顶中,然后放回冰上。
- 从37°C培养箱中取出预热的48孔板,并使用20μL移液器每孔制作一个基质圆顶。每个圆顶包含 10 μL 80% 基质、5,000 个上皮细胞和 10,000 个成纤维细胞。将板倒置转移到培养箱中,让圆顶在37°C下再凝固20-30分钟。
注意:基质圆顶体积的减小和/或细胞数量的增加将影响类器官形成效率。 - 将 200 μL 预热的 ER低培养基(表 1)加入到含有类器官共培养物的基质圆顶和 ENR 培养基(表 1)中,加入到仅包含上皮类器官的相应基质圆顶中,并将板放入培养箱中。
- 在37°C和5%CO2下生长类器官。在前2天,用10μM岩石抑制剂(Y-27623)补充培养基。岩石抑制剂可防止应激诱导的细胞死亡,并增加成功建立类器官培养物的机会。
- 每 2-3 天刷新一次培养基。确保培养基是温的,以防止温度敏感基质解离。
- 在电镀后6至8天对实验进行分析。类器官可以在培养物中保存长达14天。在第14天左右,观察到圆顶完整性的丧失。
6. 类器官的传代
注意:在共培养中生长的类器官的传代会导致成纤维细胞的损失。因此,建议在传代时对所有类器官使用ENR培养基。在37°C下预热ENR,PBS和48孔板。
- 除去培养基并用预热的PBS清洗含有基质圆顶的孔。加入 200 μL 冷的 0.25% 胰蛋白酶溶液,上下移液以打破基质圆顶。
注意:建议使用冷的0.25%胰蛋白酶,因为基质对温度敏感,这有助于分解基质圆顶。 - 将类器官与胰蛋白酶在37°C孵育~20分钟。10分钟后上下移液以增加类器官的解离。每5-10分钟用显微镜监测解离过程。由于胰蛋白酶会降低细胞活力,这有助于确定理想的解离时间。
- 20 分钟后,用 200 μL 移液器上下移液类器官以解离类器官。将细胞收集在 1.5 mL 微量离心管中,加入 1 mL 碱性类器官培养基,并在室温下以 300 x g 离心 5 分钟。
- 可选:为确保最佳的类器官生长条件和新的类器官来源于单细胞,请通过预润湿的 40 μm 细胞过滤器过滤细胞。过滤细胞悬液可去除难以解离的类器官核心和细胞团块。
- 制备由80%基质和20%冷碱性类器官培养基组成的基质混合物。将所有东西放在冰上,因为基质在室温下凝固。
- 用 200 μL 移液器小心地除去上清液,弃去上清液,将细胞重悬于 10 μL 基质混合物/圆顶中,然后将混合物放回冰上。
注意:类器官可以以 1:5 到 1:10 的比例拆分,具体取决于圆顶密度。上皮细胞也可以计数并以5,000个细胞/圆顶重新铺板。 - 从37°C培养箱中取出预热的48孔板,每孔制作一个圆顶。将板倒置转移到培养箱中,让圆顶在37°C下再凝固20-30分钟。
- 向相应的类器官圆顶中加入 200 μL 预热的 ENR 培养基。前2天用10μM岩石抑制剂(Y-27623)补充培养基。
- 每 2-3 天刷新一次培养基。确保培养基是温的,以防止温度敏感基质解离。
7. 用于整体封口染色的类器官处理
注意:使用前在PBS中涂上10%FBS的尖端和管子,以避免类器官粘附在塑料上。对于移液器吸头,在使用吸头之前,在10%FBS / PBS溶液中上下移液一次或两次就足够了。对于试管,用10%FBS / PBS填充试管,然后取出溶液。
- 取出类器官培养基,向基质圆顶中加入 200 μL 冰冷的 PBS。将板放在冰上5-10分钟。
- 上下移液并将溶液转移到 0.6 mL 微量离心机的非粘附管中。以 100 x g 离心 30-60 秒,让类器官沉淀在底部。
注意:过量的移液和长时间的离心会破坏类器官并破坏成纤维细胞-类器官相互作用。 - 去除多余的液体并加入冰冷的PBS。以 100 x g 离心 30-60 秒,让类器官沉淀在底部。
- 除去多余的液体,并在 PBS 溶液中用 200 μL 冷的 4% 甲醛固定类器官在冰上 30 分钟。
注意:甲醛是有毒的,必须始终在化学通风橱中使用。必须始终佩戴丁腈手套、安全眼镜和实验室外套。 - 类器官的固定使它们下沉,不再需要离心。通过将管直立放置并等待 2-3 分钟,让类器官下沉,去除甲醛,并加入 500 μL 冷 PBS 以洗去甲醛。
- 让类器官下沉,去除多余的 PBS,然后加入 500 μL 新鲜冷 PBS。让类器官下沉,去除多余的 PBS,并加入 500 μL 封闭缓冲液(PBS 中 5% 正常驴血清、1% BSA 和 0.5% Triton X-100)。将管子放在摇臂振动器上,在室温下60分钟。
注意:封闭也可以在4°C下过夜(O / N)。 - 让类器官下沉,除去封闭缓冲液,并将类器官重悬于含有一抗的200 μL封闭缓冲液中(参见 材料表)。将类器官保持在4°C的摇臂摇床O / N上。
注意:为了改善核蛋白,低表达蛋白或显示非特异性染色的抗体的染色,可以在4°C下增加孵育时间1或2天。 将类器官放在摇臂振动筛上至关重要,因为它可以防止类器官聚集在一起并提高染色效率。 - 让类器官下沉,除去一抗混合物,并使用 500 μL 0.02% Triton X-100 在 PBS (0.02% Tx) 中在室温下洗涤类器官 60 分钟。 重复三次。
注意:当需要更长的一抗孵育时间时,在4°C的PBS O / N中加入0.02%Tx洗涤步骤。 - 让类器官下沉,除去洗涤缓冲液,并在4°C的封闭缓冲液O / N中加入200μL荧光偶联的二抗。 添加荧光二抗后,将类器官保持在黑暗中以避免信号漂白。
- 让类器官下沉,除去二抗混合物,并在室温下用 500 μL 0.02% Tx 洗涤类器官 60 分钟。 重复三次。
- 如果需要,用 200 μL DAPI (0.25 μg/mL) 溶液对类器官进行复染,以进行核染色。将样品在摇臂摇床上在室温下孵育60分钟。
- 让类器官下沉,除去DAPI溶液,并在室温下在500μLPBS中洗涤类器官15分钟。 重复三次。
- 让类器官下沉并去除所有多余的液体。向类器官中加入 10 μL 透明溶液,并在室温下孵育 15 分钟。
注意:透明溶液是粘稠的,因此在移液清除溶液之前,请切断20μL移液器吸头的外部。如果使用更大的垫片进行成像,则可以添加更多的清除溶液。当不清除类器官时,可以使用安装溶液代替清除溶液。清除解决方案可减少成像时的背景并增加成像深度。 - 将0.05 mm双面粘性4孔垫片放在显微镜载玻片上。将 10 μL 的澄清溶液与类器官一起加入一个孔中,并将盖玻片放在垫片顶部。
注意:类器官也可以在不使用垫片的情况下安装。垫片保持类器官形状完整,并防止类器官变平。 - 将载玻片保持在RT O / N以清除类器官。对于长期储存,将载玻片保持在4°C。 使用共聚焦显微镜系统采集图像。
结果
食道分为不同的层:上皮,固有层,粘膜下层和外肌层(图1A)。成纤维细胞位于粘膜下层和固有层内,称为基质。在该协议中,外肌层被机械去除(图1B),这不会导致基质中存在的成纤维细胞(PdgfrαH2BeGFP +)的损失(图1C)。在解离之前,上皮与基质分离,导致两个组织段(图1B)。与脆弱的基质层相比,分离两层提供了增加更坚固的上皮层解离时间的机会。通过这种方式,建立了有效的分离方案,产生活的上皮祖细胞和基质成纤维细胞(图1B)。食管祖细胞根据其高整合素-β4和E-钙粘蛋白表达进行分选(图1C,D)。
成纤维细胞的亚群可以通过使用不同的标记物来分离。在该协议中,提供了基于常用的成纤维细胞标志物PDGFRα和DPP4(CD26)的成纤维细胞分离策略。通过PdgfrαH2BeGFP 报告表达或DPP4抗体分离显示,大约50%的分离细胞是成纤维细胞(图1E,F)。此外,70%的PDGFRα+成纤维细胞是DPP4+,表明获得了很大程度上重叠但不完全相同的成纤维细胞群。分离上皮细胞群和基质细胞群后,食管祖细胞单独培养或与成纤维细胞一起在基质圆顶中培养。为了研究成纤维细胞对类器官形成的贡献,将共培养物维持在生长因子还原培养基中(图1G)。
食管祖细胞在EGF,NOGGIN和RSPO(ENR)存在下形成类器官。去除NOGGIN并减少RSPO的量(25纳克/μL;ER低)足以防止类器官形成(图2A)。有趣的是,在ER低培养基中将DPP4+或PDGFRα +成纤维细胞添加到食管祖细胞中可恢复类器官形成能力,显示出对两个成纤维细胞群的支持功能(图2A-D)。PdgfrαH2BeGFP转基因的可视化显示,在类器官形成过程中,成纤维细胞与上皮祖细胞密切接触(图2A)。在第6天,PdgfrαH2BeGFP+成纤维细胞仍然大量存在于共培养物中。成纤维细胞存在于整个圆顶,靠近并接触类器官(全箭头),或附着在类器官上(箭头;图 2D)。
整个封片染色显示了成纤维细胞与类器官相互作用的3D表示(图3)。虽然可以在不使用清除溶液的情况下执行整个安装方案,但它会降低类器官的透明度和激光穿透力(图3B,z视图)。安装类器官时,垫片有助于保持类器官形态。相反,将盖玻片直接镀在类器官上(没有垫片)会使类器官变平并导致类器官结构的损失(图3A,B)。
发现DPP4+和PDGFRα+成纤维细胞都包裹在类器官周围(图3C,视频1和视频2)。食管类器官的分化可以使用不同的标志物进行评估。图4显示,提供的染色方案适用于更容易染色的角蛋白(KRT14/13)以及更难染色的转录因子(TRP63/KLF4)。共培养方案产生具有相似分化模式的类器官,如体内13,14所示,以及在ENR培养基中生长的类器官中所看到的;KRT14+或TRP63+祖细胞形成外层,KRT13+或KLF4+分化细胞向内定向。
该协议提供了一种工具,用于在 体外 研究食管干细胞生态位,并可视化类器官和成纤维细胞之间的相互作用。通过实施使用抗体分离成纤维细胞的方案,该方法具有适应性,可用于研究成纤维细胞亚群,而无需转基因小鼠。
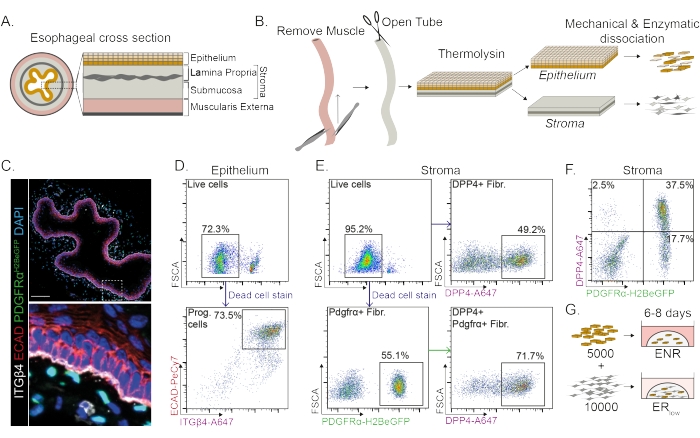
图1:从食道中分离祖细胞和成纤维细胞亚群 。 (A)食道不同层的示意图。基质包含固有层和粘膜下层。(B) 隔离协议的示意图概述。肌肉(外肌层)使用镊子机械去除;将剩余的食道切开并在热溶酶中孵育,以将上皮层与基质分离。将上皮和基质分离,机械切碎,并酶消化成单细胞悬浮液。然后将解离的细胞染色并制备用于FACS。(C)从外肌层剥离的食道横截面显示基质中的PdgfrαH2BeGFP +成纤维细胞。整合素-β4(ITGβ4)和E-钙粘蛋白(ECAD)双阳性细胞是食道的上皮祖细胞。比例尺 = 100 μm。 (D)上皮细胞分离的代表性流式细胞术图,显示所有单细胞中活细胞的百分比(上图)。下图显示了来自所有活细胞的分离ITGβ4+ ECAD+祖细胞(Prog.)的百分比。(E)显示活细胞百分比的基质细胞分离的代表性流式细胞术图(左上图)。代表性流式细胞术图显示了分离的DPP4+成纤维细胞(纤维;右上图)和Pdgfrα+成纤维细胞(左下图)在所有活细胞中的百分比。70%的Pdgfrα+成纤维细胞也是DPP4+(右下图)。(F)基质的代表性流式细胞术图,显示仅DPP4+细胞(2.5%),DPP4 + PDGFRα +细胞(37.5%)和仅PDGFRα+细胞(17.7%)。百分比是所有活细胞的百分比。(G)仅上皮细胞在存在50 ng / μL EGF,100 ng / μL NOGGIN和250 ng / μL RSPO(ENR)的情况下接种在基质圆顶中,或在EGF和低浓度RSPO(25ng / μL)存在下与成纤维细胞一起接种。 请点击此处查看此图的大图。
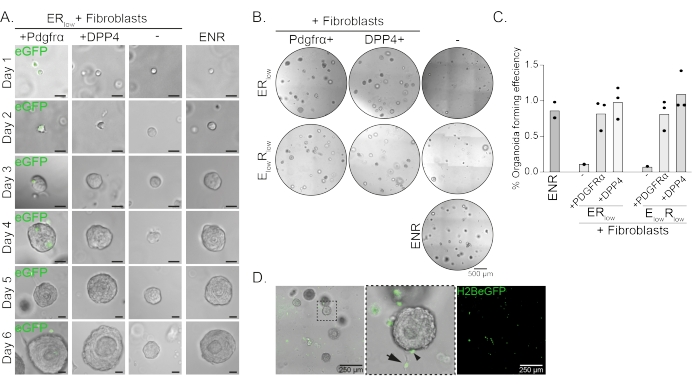
图2:类器官共培养的代表性结果。 (A)明场图像显示类器官从第1天到第6天的生长。与PdgfrαH2BeGFP +成纤维细胞共培养的类器官的明场图像也显示了核eGFP信号。比例尺 = 25 μm。 (B) 第 6 天整个矩阵圆顶的明场图像。左列显示了在 ER低培养基或 E 低 R低培养基中存在 Pdgfrα+ 成纤维细胞的情况下生长的类器官共培养物。中间列显示了在 ER低培养基或 E低R低培养基中存在 DPP4+ 成纤维细胞的情况下生长的类器官共培养物。右列显示了在ENR培养基中生长的类器官单培养物。ENR 培养基 = EGF (50 ng/μL)、NOGGIN (100 ng/μL) 和 RSPO (250 ng/μL)。ER低 = EGF 和 25 ng/μL RSPO。E低 R低 = 5 纳克/微升 EGF 和 25 纳克/微升 RSPO。比例尺 = 500 μm。 (C)显示类器官形成效率(%)的图表(即,在不同培养条件下形成类器官的细胞的百分比)。每个点代表一个矩阵圆顶,条形表示每个条件的所有点的平均值。(D)与PdgfrαH2BeGFP +成纤维细胞共培养的第6天类器官的明场和荧光图像。PdgfrαH2BeGFP+成纤维细胞存在于整个圆顶上,附着在类器官上(箭头),未附着但与类器官接触(全箭头)。比例尺 = 250 μm。 请点击此处查看此图的大图。
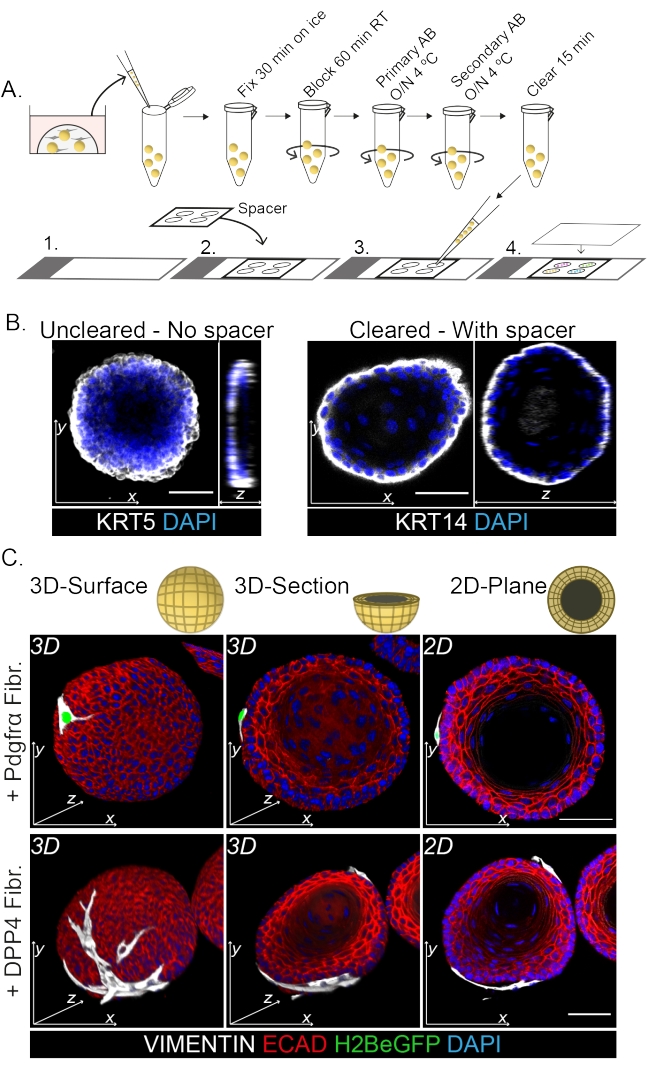
图 3:用于研究成纤维细胞-类器官相互作用的全封片染色 方案。 (A)全卡口免疫荧光方案的示意图概述。AB = 抗体。(B)未清除的整个安装染色的免疫荧光图像显示,与清除的类器官相比,激光的透明度和穿透性降低。没有间隔物会导致类器官变平和类器官形态丧失。(C)共培养类器官的整个安装图像显示了类器官的3D表面,VIMENTIN+成纤维细胞(Fibr.)包裹在类器官周围并与类器官紧密接触。3D横截面和2D平面图像显示了类器官的管腔。比例尺 = 50 μm。 请点击此处查看此图的大图。
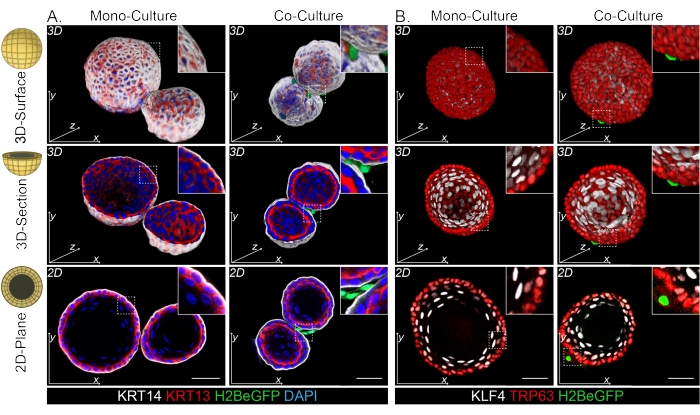
图 4:整个安装图像显示不同的 基底和基底上细胞群。 (A) 用 PdgfrαH2BeGFP+ 成纤维细胞对单培养和共培养类器官进行全安装染色,显示外层有 KRT14+ 基底细胞和 KRT13+ 分化的基底上细胞。比例尺 = 50 μm。(B)用PdgfrαH2BeGFP +成纤维细胞对单培养和共培养的类器官进行全安装染色,显示外层的TRP63 +基底细胞和KLF4 +分化的基底上细胞。比例尺 = 50 μm。 请点击此处查看此图的大图。
表1:描述类器官培养基组分的表格。请按此下载此表格。
视频1:PdgfrαH2BeGFP+成纤维细胞包裹并与类器官紧密接触。 视频附在 图3C的上面板上。 图3C 中的比例尺为50μm,类器官直径为~120μm。VIMENTIN以白色显示,E-CADHERIN以红色显示,PdgfrαH2BeGFP以绿色显示,DAPI以蓝色显示。 请点击此处下载此视频。
视频2:DPP4+成纤维细胞包裹并与类器官紧密接触。 视频附在 图3C的下面板上。 图3C 中的比例尺为50μm,类器官直径为~120μm。VIMENTIN以白色显示,E-CADHERIN以红色显示,DAPI以蓝色显示。 请点击此处下载此视频。
讨论
这里提出的协议建立了一个体 外 模型,用于研究功能性食管上皮 - 成纤维细胞相互作用。
上皮层与基质分离,允许上皮和基质区室的优化解离方案。尽管优化了上皮解离方案,但组织团块仍然很明显。每15分钟剧烈上下移液可大大减少团块的数量和大小。其他方案使用胰蛋白酶进一步解离上皮层5,6。这里不建议使用胰蛋白酶或进一步增加解离时间,因为这往往会导致上皮细胞活力和类器官形成效率降低。与上皮相反,基质很容易解离,解离溶液中30分钟产生具有~90%成纤维细胞活力的单细胞悬液(图1E)。在方案中排除上皮 - 造口分离步骤大大增加了解离时间,导致成纤维细胞活力降低和上皮细胞产量降低。此外,将上皮与基质分离提供了确定每个群体的细胞数量并在建立共培养物时混合来自不同小鼠系的上皮细胞和成纤维细胞的机会。
研究类器官生长中的成纤维细胞功能是干细胞生物学中常用的方法9,10,11,15,16。已建立的共培养基要么补充有10%胎牛血清(FCS)9,15的DMEM,要么是生长因子还原培养基10,16。在该协议中,生长因子还原培养基用于模拟体内干细胞生态位中的条件,其中成纤维细胞在很大程度上是静止的。FCS是一种富含生长因子的血清,可导致共培养物中成纤维细胞的活化和增殖,可能对应于与体内状态不同的成纤维细胞状态。通过排除FCS和减少生长因子,使培养基单独(ER低)不支持类器官生长并且不刺激成纤维细胞增殖,可以分离成纤维细胞对类器官生长的影响。在这种培养基中,NOGGIN被去除,RSPO降低到最小值(10%RPSO)。NOGGIN和RSPO已被证明对食管类器官生长至关重要6。EGF保留在共培养基中,因为它本身不支持类器官生长。然而,成纤维细胞也能够在EGF还原培养基(E 低R低;图 2B,D)。
类器官共培养不能通过传代来维持,因为在胰蛋白酶消化过程中成纤维细胞会丢失。然而,类器官传代包含在方案中,因为食管类器官可以维持、扩增并作为单一培养物用于进一步实验。来自单一培养物的传代类器官可用于与新鲜分离的成纤维细胞建立共培养物。使用原代细胞的一个缺点是建立多个类器官共培养所需的小鼠数量。当专注于成纤维细胞的小亚群时,获得的共培养物数量有限。在其他方案中,成纤维细胞首先在培养物中扩增,然后再使用它们来建立类器官共培养物10。然而,成纤维细胞在传代过程中改变形态和身份,通过使用原代皮肤和心脏成纤维细胞17,18显示。食管成纤维细胞的常规 2D 传代会导致形态和表型变化,表明成纤维细胞的 体外 富集不适合旨在表型复制内源性干细胞生态位的共培养。
全封片染色提供了一种维持和可视化成纤维细胞-类器官相互作用的工具。应该注意的是,虽然并非所有类器官都有成纤维细胞直接附着在其上,但大多数类器官与成纤维细胞接触(见 图2C)。为了维持上皮-成纤维细胞的相互作用,重要的是要小心处理类器官,避免剧烈移液、涡旋和高速旋转。最佳固定对于维持 3D 组织结构以及保持内源性荧光非常重要。30 分钟的固定足以保留 H2BeGFP 信号,并且对于本协议中使用的抗体是最佳的,但是这可能因使用的荧光团和抗体而异。类器官的清除减少了光散射,并大大改善了整个3D结构的可视化。由于类器官很小,清除简单快捷;然而,使用激光扫描共聚焦显微镜对整个类器官进行成像可能非常耗时,因为需要制作多个Z堆栈。共聚焦显微镜,如旋转盘,可用于减少成像时间。
总体而言,在成纤维细胞存在下生长的食管类器官为了解食管干细胞生态位的各个方面提供了有价值的工具。此外,全支架清除提供了一种可视化成纤维细胞和类器官之间相互作用的可访问方法。
披露声明
作者声明不存在利益冲突。
致谢
这项研究得到了ERC StG TroyCAN的支持(851241)。E.E.是Cancerfonden博士后助理。M.G.是Ragnar Söderberg研究员和Cancerfonden初级研究员。我们感谢卡罗林斯卡学院核心设施的技术援助,包括生物医学流式细胞术核心设施、生物医学成像核心(BIC)和比较医学生物医学(KMB)动物设施。我们感谢Genander实验室的成员仔细阅读和评论该协议。
材料
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
参考文献
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836 (2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889 (2019).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。