Method Article
Özofagus Fibroblastlarının Organoid Ko-Kültürler Kullanılarak Fonksiyonel Karakterizasyonu ve Görüntülenmesi
Bu Makalede
Özet
Organoid-fibroblast ko-kültürleri, in vivo kök hücre nişini incelemek için bir model sağlar. Burada, özofagus organoid-fibroblast ko-kültürleri için bir protokol tanımlanmıştır. Ek olarak, fibroblast-organoid etkileşimini görselleştirmek için tüm montaj görüntülemesi kullanılır.
Özet
Epitel kök ve progenitör hücreleri, yaşam boyunca epitel bariyerinin oluşumuna ve korunmasına katkıda bulunur. Çoğu kök ve progenitör hücre popülasyonu, anatomik olarak farklı yerlerde sıkışıp kalır ve bu da köklülüğü koruyan niş sinyallerle özel etkileşimler sağlar. Epitelyal organoid kültürlerin gelişimi, kök ve progenitör hücrelerin homeostaz ve hastalıktaki rolünü anlamak için güçlü bir araç sağlarken, niş ortam içindeki etkileşim büyük ölçüde yoktur, böylece kök hücre davranışını etkileyen faktörlerin tanımlanmasını engeller. Fibroblastlar epitel sapı ve progenitör kaderini yönlendirmede anahtar rol oynamaktadır. Burada, özofagus progenitör hücre yenilenmesi ve farklılaşmasında fibroblast alt popülasyonlarının tanımlanmasını sağlayan kapsamlı bir organoid-fibroblast ko-kültür protokolü sunulmuştur. Bu protokolde, hem epitel hücrelerini hem de fibroblastları yemek borusundan paralel olarak izole etmek için bir yöntem tanımlanmıştır. Hem özofagus progenitör hücrelerini hem de fibroblast alt popülasyonlarını transgenik muhabir veya vahşi tip farelerden izole etmek için farklı floresan aktive hücre sıralama stratejileri özetlenmiştir. Bu protokol, spesifik fibroblast alt popülasyonlarının izolasyonuna uyum sağlamak için uyarlanabilecek çok yönlü bir yaklaşım sağlar. Özofagus epitelyal organoid mono-kültürlerinin kurulması ve geçiştirilmesi bu protokole dahil edilmiştir ve ko-kültür sistemi ile doğrudan karşılaştırma yapılmasına olanak sağlanmaktadır. Ek olarak, epitelyal-fibroblast etkileşimlerinin ayrıntılı görüntü analizine izin veren bir 3D temizleme yaklaşımı açıklanmaktadır. Toplu olarak, bu protokol, özofagus kök hücre niş bileşenlerini in vitro olarak tanımlamak ve anlamak için karşılaştırmalı ve nispeten yüksek verimli bir yöntemi tanımlamaktadır.
Giriş
Organoidler, kök ve progenitör hücreleri karakterize etmek ve kök hücre nişinin hücresel bileşenlerinden türetilen sinyal ipuçlarını anlamak için 3D in vitro tahliller olarak kullanılır 1,2,3,4. Fare özofagus organoidleri ilk olarak 2014 yılında tanımlanmıştır ve birkaç makale, özofagus organoidlerini korumak ve geçmek için gerekli olan R-Spondin (RSPO), NOGGIN ve epidermal büyüme faktörü (EGF) gibi büyüme faktörlerini tanımlamıştır 5,6,7, in vivo için benzer sinyal ipuçlarının gerekli olduğunu savunmuştur progenitör hücre yenilenmesi. Bununla birlikte, büyüme faktörleri genellikle fizyolojik olmayan konsantrasyonlarda eklenir ve bu da in vivo sinyal ortamını mutlaka yansıtmayan organoid büyüme koşullarına neden olur.
Fibroblastlar, birçok kök hücre nişinde progenitör hücre özelliklerini destekleyen heterojen stromal hücre popülasyonlarıdır8. Epitelyal progenitör hücrelerin ve fibroblastların aynı organoid kültürde birleştirilmesi, ekzojen olarak takviye edilmiş büyüme faktörlerinin azaltılmış konsantrasyonlarında organoid oluşumunu sağlar. İntestinal ve hepatik epitelden organoid ko-kültür sistemleri tanımlanmıştır, ancak özofagus organoid-fibroblast ko-kültürlerini oluşturmak için bir protokol hala göze çarpmaktadır 9,10,11.
Bu protokolde, transgenik PdgfrαH2BeGFP fare12 veya klasik antikor boyaması olan vahşi tip fareler kullanılarak yemek borusundan fibroblastlar için iki floresan aktive hücre sıralama (FACS) stratejisi özetlenmiştir. Fibroblastların farklı alt popülasyonları, tercih edilen hücre yüzey belirteçleri kullanılarak izole edilebilir, böylece protokole esneklik sağlanır. Ek olarak, fibroblast-organoid etkileşimlerini karakterize etmek için organoid morfolojiyi koruyan bir 3D floresan görüntüleme tekniği kullanılır. Organoid temizleme, organoidlerdeki ışık penetrasyon derinliğini arttırmak, organoid-fibroblast bağlantılarının görselleştirilmesini iyileştirmek ve organoid yapının bütünüyle özetlenmesini sağlamak için hızlı bir yöntem sağlar. Bu protokol, özofagus organoid ko-kültürünü bütün bir montaj görüntüleme stratejisi ile birleştirerek fibroblast-organoid etkileşiminin fonksiyonel karakterizasyonunu sağlar.
Protokol
Bu çalışma için hayvan deneyleri Stockholms Norra djurförsöksetiska nämnd (etik izin no 14051-2019) tarafından onaylanmıştır. Hayvanlar, Avrupa Laboratuvar Hayvanları Bilimi Derneği Federasyonu'nun tavsiyelerine göre patojensiz koşullarda barındırıldı.
1. Hazırlık
- Ayrışma için kullanılan enzimatik stok çözeltilerini (bakınız Malzeme Tablosu) buz üzerinde çözün. Büyüme faktörü azaltılmış (GFR) bazal membran matrisinin (matris) bir alikotunu 4 °C'de çözün.
- Kültür ortamını hazırlayın. Organoid kültürler ve ortak kültürler için Tablo 1'de açıklanan ortamı kullanın ve protokole başlamadan önce hazırlayın.
2. Özofagus epitelinin ve stromanın diseksiyonu ve ayrılması
NOT: Diseksiyon ve doku işleme için kullanılan tüm aletlerin steril olduğundan emin olun. Hanks'in dengeli tuz çözeltisinde (HBSS) üç özofaj başına 2 mL ayrışma çözeltisi ( Malzeme Tablosuna bakınız) hazırlayın.
- C57BL/6J fareler gibi tercih ettiğiniz bir fare türünü kullanın. Farelerde özofagus gelişimi doğum sonrası gün (p) 70'ten sonra sona erer, bu nedenle p7013'ten daha eski farelerin kullanılması önerilir. 8-10 organoid ko-kültür oluşturmak için yeterli materyal sağladıkları için dört veya beş fare kullanın.
NOT: Organoid oluşturma verimliliği, farelerin yaşı ile birlikte azalır. Spesifik fibroblast alt popülasyonları ilgi çekiyorsa, düşük fibroblast veriminin kurulabilecek organoid ko-kültürlerin sayısını sınırlaması mümkündür. - Fibroblast popülasyonlarının izolasyonu için genetiği değiştirilmiş (örneğin, PdgfrαH2BeGFP) veya vahşi tip (WT) fareler kullanın. WT fareleri kullanırken, spesifik fibroblast alt popülasyonlarını FACS yoluyla stromadan izole etmek için antikor boyaması yapın.
- CO2 boğulması ile fareleri ötenazi yapın. Forseps ve diseksiyon makası kullanarak yemek borusunu diseke edin. Tüm yemek borusunu çıkarmak için, yemek borusunun distal ucunu doğrudan midenin üstünde ve proksimal ucu trakeanın başlangıcında kesin. Yemek borusunu PBS'ye batırın ve buzun üzerine koyun.
- Bir diseksiyon mikroskobu (toplam büyütme aralığı 8x-40x) ve forseps kullanarak muscularis eksternasını mekanik olarak çıkarın. Disseke özofagusun distal ucunu bir çift forseps kullanarak tutun ve diğer forsepsleri kullanarak kası distalden disseke özofagusun proksimal ucuna kadar tutup çekin. Kas tabakasını çıkarın ve atın.
- Yemek borusunu uzunlamasına açın. Bu, doku hasarını önlemek için bir top ucuna sahip mikrodiseksiyon yay makası kullanarak en iyi şekilde çalışır. Yay makası topunu yemek borusunun lümenine sokmak için yemek borusunun bir ucunu tutun ve sonuna kadar tutarken yemek borusunu kesin.
- Yemek borusunu 1,5 mL'lik bir mikro santrifüj tüpüne veya 24 delikli bir plakaya yerleştirin. Açılan yemek borusunu HBSS'de 0.5 mg/mL termolizin içinde 37 °C'de bir rocker-shaker üzerinde 15 dakika boyunca inkübe edin. Yemek borusunu tamamen termolizin çözeltisine batırın.
NOT: Kullanılan termolizin çözeltisinin hacmi, kuyuya veya tüp boyutuna bağlıdır. Birkaç özofagus aynı kuyuya veya tüpe yerleştirilebilir ve batırılabilir. - Yemek borusunu termolizin çözeltisinden çıkarın. Özofagus epitelini stromadan dikkatlice ayırmak için bir diseksiyon mikroskobu kullanın. İnce forseps kullanarak, dokunun hem epitel tarafını hem de stroma tarafını tutun ve iki katmanı ayırmak için yavaşça ayırın.
NOT: Stroma, şeffaf epitelin aksine, beyaz ve opak görünümü ile tanımlanır. Stroma lamina propria ve submukozal tabakayı içerir. - Epitel ve stromal tabakayı, HBSS'de 200 μL ayrışma çözeltisi içeren iki ayrı 1.5 mL mikro santrifüj tüpüne aktarın. Buz üzerine koyun.
3. Özofagus progenitör hücrelerinin izolasyonu
NOT: Özofagus progenitör hücrelerinin izolasyonu (adım 2) ve fibroblastların (adım 3) aynı anda yapılabilir. HBSS'de 50 mL'lik bir tüp hazırlayın % 1 FBS (% 1 FBS).
- Ayrılmış özofagus epitelini 1.5 mL mikro-santrifüj tüpünden (adım 2.8) temiz bir Petri kabına aktarın ve kıymak için keskin bir neşter kullanın. Kıyılmış dokuyu Petri kabından 200 μL ayrışma çözeltisi ile toplayın ve 1,5 mL mikro santrifüj tüpüne geri aktarın.
NOT: Parçalar 200 μL pipet ucu kullanılarak 1,5 mL mikro santrifüj tüpüne geri yerleştirilebildiğinde epitel düzgün bir şekilde kıyılır. - 1,5 mL mikro santrifüj tüpüne toplam 1 mL hacme 800 μL taze ayrışma çözeltisi ekleyin.
NOT: Yeterli miktarda ayrışma çözümü eklemek önemlidir. Bir ila üç özofaj başına 1 mL çözelti önerilir. Aynı anda daha fazla özofagus işlendiğinde ölçeği artırın. - Tüpü kıyılmış epitel tabakası ile 60 dakika boyunca 37 ° C'de bir rocker-shaker üzerine yerleştirin. Sindirimi artırmak için her 15 dakikada bir 200 μL pipet ucu kullanarak çözeltiyi yaklaşık 20 kez yukarı ve aşağı pipetleyin.
- 60 dakika sonra, 200 μL pipet ucu kullanarak 20 kez daha yukarı ve aşağı pipet yapın. Çözeltiyi 40 μm'lik bir hücre süzgecinden yeni bir 1,5 mL mikro santrifüj tüpüne geçirin. 4 °C'de 10 dakika boyunca 300 x g'de santrifüj.
NOT: Hücrelerin filtreye yapışmasını en aza indirmek için hücreleri zorlamadan önce hücre süzgecini %1 FBS ile ıslatın. Epitel tamamen sindirilmeyecek ve doku parçaları hala görülebilecektir. Bununla birlikte, daha uzun inkübasyon, hücre sağkalımını azaltacak ve daha yüksek bir canlı hücre verimi ile sonuçlanmayacaktır. - Fazla sıvıyı 1 mL'lik bir pipetle çıkararak süpernatantı atın ve peleti 1 mL'lik %1 FBS'de yeniden askıya alın. 4 °C'de 10 dakika boyunca 300 x g'de santrifüj.
- Santrifüjleme sırasında, özofagus progenitör hücrelerinin FACS'si için konjuge antikor karışımını hazırlayın.
- 1 μL CD324-PE-Cy7 (ECADHERIN) ve CD104-A647 (INTEGRIN-β4) bir milyon hücre başına 200 μL'de %1 FBS ile karıştırın.
NOT: Bir veya iki özofaj için 1 μL antikor (200 μL son hacim) yeterlidir. Bir kerede daha fazla özofagus işlenirken, antikor boyama çözeltisinin hacmini arttırın.
- Peleti 200 μL antikor karışımında tekrar askıya alın ve bir akış sitometri tüpüne aktarın. Floresan antikorları ekledikten sonra, sinyalin ağartılmasını önlemek için hücre süspansiyonlarını karanlıkta tutun. Hücreleri 4 ° C'de 30 dakika boyunca inkübe edin. 3 mL% 1 FBS ekleyin ve 4 ° C'de 10 dakika boyunca 300 x g'de santrifüj yapın ve ardından hücreleri FBS'nin% 1'inin en az 200 μL'sinde yeniden askıya alın.
NOT: 500 μL% 1 FBS, dört veya beş özofaja kadar kullanılır. Aynı anda daha fazla özofagus işlendiğinde hacmi artırın, böylece 100-300 olay / sn FACS akış hızı elde edilebilir. Daha fazla olay / s sıralama verimliliğini azaltacak ve akış hızındaki bir artış hücre hayatta kalmasını azaltacaktır. - Canlı hücreleri izole etmek için FACS sıralamasından 5 dakika önce, 1:10.000'lik son konsantrasyona ölü hücre leke işaretleyicisi ekleyin. Bir FACS makinesi kullanarak progenitör hücreleri sıralayın (geçit stratejisi için Şekil 1'e bakın). Hücreleri 200 μL bazik organoid ortam ile doldurulmuş 1.5 mL mikro santrifüj tüplerinde toplayın (Tablo 1).
4. Fibroblastların stromal tabakadan izolasyonu
- Stomal tabakayı, diseksiyon makası kullanarak 200 μL ayrışma çözeltisi (adım 2.8) içeren 1.5 mL'lik bir tüpte ince parçalar halinde kesin. Çözelti 200 μL pipet ucu kullanılarak yukarı ve aşağı pipetlenebildikten sonra doku düzgün bir şekilde kıyılır.
- 1,5 mL mikro santrifüj tüpüne toplam 1 mL hacme 800 μL taze ayrışma çözeltisi ekleyin.
NOT: Yeterli miktarda ayrışma çözümü eklemek önemlidir. Bir ila üç özofaj başına 1 mL çözelti önerilir. Aynı anda daha fazla özofagus işlendiğinde ölçeği artırın. - Tüpü 30 dakika boyunca 37 ° C'de bir rocker-shaker üzerine yerleştirin. 15 dakika sonra, sindirimi artırmak için 200 μL pipet ucu kullanarak çözeltiyi yaklaşık 20 kez yukarı ve aşağı pipetleyin.
- 30 dakikalık enzimatik parçalamadan sonra, 200 μL pipet ucu kullanarak pipeti 20 kez daha yukarı ve aşağı çekin. Çözeltiyi 70 μm'lik bir hücre süzgecinden geçirerek yeni bir 1,5 mL mikro santrifüj tüpüne süzün. 4 °C'de 10 dakika boyunca 300 x g'de santrifüj.
NOT: Hücrelerin filtreye yapışmasını en aza indirmek için hücreleri zorlamadan önce hücre süzgecini %1 FBS ile ıslatın. - Fazla sıvıyı 1 mL'lik bir pipetle çıkararak süpernatantı atın ve peleti 1 mL'lik %1 FBS'de yeniden askıya alın. 4 °C'de 10 dakika boyunca 300 x g'de santrifüj.
NOT: Floresan etiketli fibroblastlar içeren genetiği değiştirilmiş bir fare suşu kullanıldığında, antikor boyamaları isteğe bağlıdır. Antikor boyamaları gerekli değilse, adım 3.7 ile devam edin ve numuneyi bir akış sitometri tüpüne aktarın.- Santrifüjleme sırasında, fibroblastların FACS izolasyonu için konjuge antikor karışımını hazırlayın. 1 μL CD26-APC (DPP4) ile bir milyon hücre başına %1 FBS'nin 200 μL'sinde karıştırın.
NOT: Bir veya iki özofagus için 1 μL antikor yeterlidir. Bir kerede daha fazla özofagus işlenirken, antikor boyama çözeltisinin hacmini arttırın.
- Santrifüjleme sırasında, fibroblastların FACS izolasyonu için konjuge antikor karışımını hazırlayın. 1 μL CD26-APC (DPP4) ile bir milyon hücre başına %1 FBS'nin 200 μL'sinde karıştırın.
- Peleti %1 FBS'de 200 μL konjuge antikor karışımında tekrar askıya alın ve bir akış sitometri tüpüne aktarın. Hücreleri 4 ° C'de 30 dakika boyunca inkübe edin.
- 3 mL% 1 FBS ekleyin ve 4 ° C'de 10 dakika boyunca 300 x g'de santrifüj yapın. Hücreleri FBS'nin% 1'inin en az 200 μL'sinde yeniden askıya alın.
NOT: 500 μL% 1 FBS, dört veya beş özofaja kadar kullanılır. Aynı anda daha fazla yemek borusu işlendiğinde hacmi artırın, böylece 100-300 olay / sn akış hızı elde edilebilir. Daha fazla olay / s sıralama verimliliğini azaltacak ve akış hızının arttırılması hücre hayatta kalmasını azaltacaktır. Floresan antikorlar eklendikten sonra, sinyalin ağartılmasını önlemek için hücre süspansiyonları karanlık tutulmalıdır. - Canlı hücreleri izole etmek için FACS sıralamasından 5 dakika önce, 1:10.000'lik son konsantrasyona ölü hücre leke işaretleyicisi ekleyin. Bir FACS makinesi kullanarak hücreleri sıralayın (geçiş stratejisi için Şekil 1'e bakın). Hücreleri 200 μL bazik organoid ortam ile doldurulmuş 1.5 mL mikro santrifüj tüplerinde toplayın (Tablo 1).
5. Özofagus organoidlerinin kurulması ve kültürü
NOT: ER'yiönceden ısıtın düşük (organoid kokültür), ENR (organoid) ortamı (açıklama için Tablo 1'e bakın) ve 37 ° C'de 48 delikli bir plaka. Çözülmüş matrisi (1. adımda hazırlanan) aliquot'u buzun üzerine yerleştirin. Fare özofagus organoid kültürü için burada verilen matrisin kullanılması önerilir ( Malzeme Tablosuna bakınız), çünkü diğer matris markaları organoid oluşturma verimliliğini olumsuz yönde etkiler.
- Organoid ko-kültür için, sıralanmış epitel hücrelerini ve fibroblastları bir tüpte 1: 2 oranında karıştırın. Her matris kubbesi için 5.000 epitel hücresi ve 10.000 fibroblast kullanın. Daha fazla kubbe için hazırlanırken, bir tüpe 5.000 epitel hücresi ve 10.000 fibroblastın katlarını ekleyin. Fibroblastsız organoid kültürler için, matris kubbesi başına 5.000 epitel hücresi kullanın.
- Karışık hücre popülasyonunu 5 dakika boyunca 300 x g'de santrifüj edin. Süpernatantı 200 μL pipetle dikkatlice çıkararak atın.
- Peletleri soğuk bazik organoid ortamda tekrar askıya alarak hücreleri bir kez yıkayın ve 5 dakika boyunca 300 x g'de santrifüj yapın. Hücreleri buzun üzerine yerleştirin.
- % 80 matris ve% 20 soğuk bazik organoid ortamdan oluşan bir karışım hazırlayın. Matris oda sıcaklığında (RT) katılaştıkça her şeyi buzun üzerine yerleştirin.
- Santrifüjlemeden sonra süpernatantı 200 μL pipetle dikkatlice çıkararak atın. Hücreleri 10 μL matris karışımı / kubbesi içinde tekrar askıya alın ve tekrar buza koyun.
- Önceden ısıtılmış 48 delikli plakayı 37 °C inkübatörden alın ve 20 μL pipet kullanarak kuyucuk başına bir matris kubbesi yapın. Her kubbe 10 μL% 80 matris, 5.000 epitel hücresi ve 10.000 fibroblast içerir. Plakayı baş aşağı bir inkübatöre aktarın ve kubbelerin 37 ° C'de 20-30 dakika daha katılaşmasına izin verin.
NOT: Matris kubbe hacmindeki azalma ve/veya hücre sayısındaki artış organoid oluşum verimliliğini etkileyecektir. - Sadece epitel organoidleri içeren ilgili matris kubbelerine organoid ko-kültürler ve ENR ortamı (Tablo 1) içeren matris kubbelerine 200 μL önceden ısıtılmış ERdüşük ortamı (Tablo 1) ekleyin ve plakayı inkübatöre yerleştirin.
- Organoidleri 37 ° C'de ve% 5 CO2'de büyütün. İlk 2 gün boyunca, ortamı 10 μM Kaya inhibitörü (Y-27623) ile destekleyin. Kaya inhibitörü strese bağlı hücre ölümünü önler ve organoid kültürlerin başarılı bir şekilde kurulma şansını arttırır.
- Ortamı her 2-3 günde bir yenileyin. Sıcaklığa duyarlı matrisin ayrışmasını önlemek için ortamın sıcak olduğundan emin olun.
- Kaplamadan 6 ila 8 gün sonra deneyin analizlerini yapın. Organoidler kültürde 14 güne kadar tutulabilir. 14. gün civarında kubbe bütünlüğünde kayıp gözlenir.
6. Organoidlerin geçişi
NOT: Ko-kültürde yetiştirilen organoidlerin geçişi fibroblast kaybına neden olur. Bu nedenle, geçişi sırasında tüm organoidler için ENR ortamının kullanılması önerilir. ENR, PBS ve 48 delikli plakayı 37 °C'de önceden ısıtın.
- Ortamı çıkarın ve matris kubbesini içeren kuyucuğu önceden ısıtılmış PBS ile yıkayın. 200 μL soğuk% 0.25 tripsin çözeltisi ekleyin ve matris kubbesini kırmak için yukarı ve aşağı pipet yapın.
NOT: Matris sıcaklığa duyarlı olduğundan ve matris kubbelerinin parçalanmasına yardımcı olduğundan% 0.25 tripsin kullanılması tavsiye edilir. - Organoidleri ~ 20 dakika boyunca 37 ° C'de tripsin ile inkübe edin. Organoidlerin ayrışmasını arttırmak için 10 dakika sonra pipet yukarı ve aşağı. Ayrışma sürecini her 5-10 dakikada bir mikroskopla izleyin. Tripsin hücre canlılığını azalttığından, bu ideal ayrışma süresini belirlemeye yardımcı olabilir.
- 20 dakika sonra, organoidleri ayırmak için organoidleri 200 μL'lik bir pipetle yukarı ve aşağı pipetin. Hücreleri 1,5 mL'lik bir mikro santrifüj tüpünde toplayın, 1 mL bazik organoid ortam ekleyin ve RT'de 5 dakika boyunca 300 x g'de santrifüj yapın.
- İsteğe bağlı: En iyi organoid büyüme koşullarını ve yeni organoidlerin tek hücrelerden türetilmesini sağlamak için, hücreleri önceden ıslatılmış 40 μm hücre süzgecinden geçirin. Hücre süspansiyonunun filtrelenmesi, ayrılması zor olan organoid çekirdeklerin ve hücre kümelerinin çıkarılmasına neden olur.
- %80 matris ve %20 soğuk bazik organoid ortamdan oluşan bir matris karışımı hazırlayın. Matris RT'de katılaştıkça her şeyi buzun üzerine yerleştirin.
- Süpernatantı 200 μL'lik bir pipetle dikkatlice çıkararak atın, hücreleri 10 μL matris karışımı / kubbesinde yeniden askıya alın ve karışımı tekrar buza koyun.
NOT: Organoidler, kubbe yoğunluğuna bağlı olarak 1:5 ila 1:10 oranında bölünebilir. Epitel hücreleri de sayılabilir ve 5.000 hücre / kubbede yeniden kaplanabilir. - Önceden ısıtılmış 48 delikli plakayı 37 ° C inkübatörden alın ve kuyu başına bir kubbe yapın. Plakayı baş aşağı bir inkübatöre aktarın ve kubbelerin 37 ° C'de 20-30 dakika daha katılaşmasına izin verin.
- İlgili organoid kubbelere 200 μL önceden ısıtılmış ENR ortamı ekleyin. Ortamı ilk 2 gün boyunca 10 μM Kaya inhibitörü (Y-27623) ile destekleyin.
- Ortamı her 2-3 günde bir yenileyin. Sıcaklığa duyarlı matrisin ayrışmasını önlemek için ortamın sıcak olduğundan emin olun.
7. Tüm montaj boyama için organoid işleme
NOT: Organoidlerin plastiklere yapışmasını önlemek için kullanmadan önce uçları ve tüpleri PBS'de %10 FBS ile kaplayın. Pipet uçları için, ucu kullanmadan önce %10 FBS/PBS çözeltisinde bir veya iki kez yukarı ve aşağı pipet yapmak yeterlidir. Tüpler için, tüpü% 10 FBS / PBS ile doldurun ve ardından çözeltiyi çıkarın.
- Organoid ortamı çıkarın ve matris kubbelerine 200 μL buz gibi soğuk PBS ekleyin. Plakayı 5-10 dakika boyunca buzun üzerine yerleştirin.
- Pipeti yukarı ve aşağı çekin ve çözeltiyi 0,6 mL mikro santrifüj yapışkan olmayan borulara aktarın. Organoidlerin tabana yerleşmesini sağlamak için 100 x g'de 30-60 s kısa sürede santrifüj yapın.
NOT: Aşırı pipetleme ve uzun santrifüjleme organoidleri kırar ve fibroblast-organoid etkileşimini bozar. - Fazla sıvıyı çıkarın ve buz gibi soğuk PBS ekleyin. Organoidlerin tabana yerleşmesini sağlamak için 100 x g'de 30-60 s kısa sürede santrifüj yapın.
- Fazla sıvıyı çıkarın ve organoidi PBS çözeltisinde buz üzerinde 30 dakika boyunca 200 μL soğuk% 4 formaldehit ile sabitleyin.
DİKKAT: Formaldehit toksiktir ve her zaman kimyasal duman davlumbazında kullanılmalıdır. Nitril eldivenler, koruyucu gözlükler ve laboratuvar önlükleri her zaman giyilmelidir. - Organoidin sabitlenmesi batmalarına neden olur ve santrifüjlemeye artık gerek yoktur. Tüpü dik yerleştirerek organoidlerin batmasına izin verin ve 2-3 dakika bekleyin, formaldehiti çıkarın ve formaldehiti yıkamak için 500 μL soğuk PBS ekleyin.
- Organoidlerin batmasına izin verin, fazla PBS'yi çıkarın ve 500 μL taze soğuk PBS ekleyin. Organoidlerin batmasına izin verin, fazla PBS'yi çıkarın ve 500 μL bloke edici tampon ekleyin (PBS'de% 5 normal eşek serumu,% 1 BSA ve% 0.5 Triton X-100). Tüpü RT'de 60 dakika boyunca bir rocker-shaker'a koyun.
NOT: Engelleme, 4 ° C'de gece boyunca (O / N) de yapılabilir. - Organoidlerin batmasına izin verin, bloke edici tamponu çıkarın ve organoidleri birincil antikorlarla 200 μL bloke tamponunda yeniden askıya alın (bkz. Organoidleri 4 ° C'de bir rocker-shaker O / N üzerinde tutun.
NOT: Nükleer proteinlerin, düşük eksprese proteinlerin veya spesifik olmayan boyama gösteren antikorların boyanmasını iyileştirmek için, inkübasyon süresi 4 ° C'de 1 veya 2 gün boyunca arttırılabilir. Organoidleri bir rocker-shaker üzerine yerleştirmek, organoidlerin bir araya toplanmasını önlediği ve lekelenme verimliliğini arttırdığı için çok önemlidir. - Organoidlerin batmasına izin verin, birincil antikor karışımını çıkarın ve organoidleri RT'de 60 dakika boyunca PBS'de (% 0.02 Tx) 500 μL% 0.02 Triton X-100 kullanarak yıkayın.
NOT: Daha uzun primer antikor inkübasyonu gerektiğinde, 4 °C'de PBS O / N'de% 0.02 Tx ile bir yıkama adımı ekleyin. - Organoidlerin batmasına izin verin, yıkama tamponunu çıkarın ve 4 ° C'de tampon O / N'yi bloke etmek için 200 μL floresan konjuge ikincil antikor ekleyin. Floresan sekonder antikorlar ekledikten sonra, sinyalin ağartılmasını önlemek için organoidleri karanlıkta tutun.
- Organoidlerin batmasına izin verin, ikincil antikor karışımını çıkarın ve organoidleri RT'de 60 dakika boyunca 500 μL% 0.02 Tx kullanarak yıkayın.
- Gerekirse nükleer boyama için organoidleri 200 μL DAPI (0.25 μg / mL) çözeltisi ile karşı boyayın. Numuneleri RT'de 60 dakika boyunca bir rocker-shaker üzerinde inkübe edin.
- Organoidlerin batmasına izin verin, DAPI çözeltisini çıkarın ve organoidleri RT'de 15 dakika boyunca 500 μL PBS'de yıkayın.
- Organoidlerin batmasına izin verin ve tüm fazla sıvıyı çıkarın. Organoidlere 10 μL temizleme çözeltisi ekleyin ve RT'de 15 dakika boyunca inkübe edin.
NOT: Temizleme çözeltisi viskozdur, bu nedenle temizleme çözeltisini pipetlemeden önce 20 μL pipet ucunun dış kısmını kesin. Görüntüleme için daha büyük bir ara parça kullanılırsa daha fazla temizleme çözeltisi eklenebilir. Organoidlerin temizlenmediği zamanlarda temizleme çözeltisi yerine montaj çözeltisi kullanılabilir. Temizleme çözümü, görüntüleme sırasında arka planı azaltır ve görüntüleme derinliğini artırır. - Bir mikroskop slaytına 0,05 mm çift taraflı yapışkan 4 kuyucuklu bir ara parça yerleştirin. 10 μL temizleme çözeltisini organoidlerle birlikte bir kuyucuğa ekleyin ve ara parçanın üstüne bir kapak kayması yerleştirin.
NOT: Organoidler ara parça kullanılmadan da monte edilebilir. Ara parça organoid şeklini sağlam tutar ve organoidlerin düzleşmesini önler. - Organoidleri temizlemek için slaytı RT O / N'de tutun. Uzun süreli depolama için, slaytları 4 °C'de tutun. Konfokal mikroskopi sistemi kullanarak görüntüler elde edin.
Sonuçlar
Yemek borusu farklı katmanlara ayrılır: epitel, lamina propria, submukoza ve muscularis eksterna (Şekil 1A). Fibroblastlar, stroma olarak adlandırılan submukoza ve lamina propriada bulunur. Bu protokolde, muscularis eksterna mekanik olarak çıkarılır (Şekil 1B), bu da stromada bulunan fibroblastların (PdgfrαH2BeGFP +) kaybına yol açmaz (Şekil 1C). Dissosiyasyondan önce, epitel stromadan ayrılır ve iki doku segmenti oluşur (Şekil 1B). İki tabakanın ayrılması, kırılgan stromal tabakaya kıyasla daha sağlam epitel tabakası için ayrışma süresini arttırma fırsatı sağlar. Bu şekilde, hem canlı epitelyal progenitör hücreleri hem de stromal fibroblastları veren etkili bir izolasyon protokolü oluşturulmuştur (Şekil 1B). Özofagus progenitör hücreleri yüksek INTEGRIN-β4 ve E-CADHERIN ekspresyonlarına göre sıralanır (Şekil 1C, D).
Fibroblastların alt popülasyonları farklı belirteçler kullanılarak izole edilebilir. Bu protokolde, yaygın olarak kullanılan fibroblast belirteçleri PDGFRα ve DPP4'e (CD26) dayanan fibroblast izolasyonu için bir strateji sağlanmıştır. PdgfrαH2BeGFP muhabir ekspresyonu veya DPP4 antikoru ile izolasyon, izole edilen hücrelerin yaklaşık% 50'sinin fibroblast olduğunu göstermektedir (Şekil 1E, F). Ek olarak, PDGFRa + fibroblastlarının% 70'i DPP4 + 'dır, bu da büyük ölçüde örtüşen, ancak aynı olmayan bir fibroblast popülasyonunun elde edildiğini gösterir. Hem epitel hem de stromal hücre popülasyonlarını izole ettikten sonra, özofagus progenitör hücreleri ya tek başına ya da bir matriks kubbesinde fibroblastlarla birlikte kültürlenir. Fibroblastların organoid oluşumuna katkısını incelemek için, ko-kültür büyüme faktörü azaltılmış bir ortamda tutulur (Şekil 1G).
Özofagus progenitör hücreleri EGF, NOGGIN ve RSPO (ENR) varlığında organoidler oluşturur. NOGGIN'in giderilmesi ve RSPO miktarının azaltılması (25 ng/μL; ERdüşük) organoid oluşumunu önlemek için yeterlidir (Şekil 2A). İlginç bir şekilde, ERdüşük ortamdaki özofagus progenitör hücrelerine DPP4 + veya PDGFRa + fibroblastların eklenmesi, her iki fibroblast popülasyonu için destekleyici bir işlev göstererek organoid oluşturma yeteneğini geri yükler (Şekil 2A-D). PdgfrαH2BeGFP transgeninin görselleştirilmesi, fibroblastların organoid oluşumu sırasında epitel progenitör hücrelerle yakın temas halinde olduğunu göstermektedir (Şekil 2A). 6. günde, PdgfrαH2BeGFP + fibroblastlar hala ortak kültürde bol miktarda bulunur. Fibroblastlar kubbe boyunca, organoidlerin yakınında ve onlara dokunarak (tam ok) veya organoidlere (ok ucu; Şekil 2D).
Tüm montaj boyaması, fibroblastların organoidlerle etkileşiminin 3D gösterimini gösterir (Şekil 3). Tüm montaj protokolünü bir temizleme çözeltisi kullanmadan gerçekleştirmek mümkün olsa da, şeffaflığı ve organoidin lazer penetrasyonunu azaltır (Şekil 3B, z-view). Organoidleri monte ederken, ara parça organoid morfolojisinin korunmasına yardımcı olur. Buna karşılık, kapak kaymasının doğrudan organoidler üzerine (ara parça olmadan) kaplanması organoidleri düzleştirir ve organoid yapı kaybına neden olur (Şekil 3A, B).
Hem DPP4+ hem de PDGFRα+ fibroblastlarının organoidlerin etrafına sarılmış olduğu bulunmuştur (Şekil 3C, Video1 ve Video 2). Özofagus organoidlerinin farklılaşması farklı belirteçler kullanılarak değerlendirilebilir. Şekil 4, sağlanan boyama protokolünün boyanması daha kolay keratinler (KRT14/13) ve boyanması daha zor transkripsiyon faktörleri (TRP63/KLF4) için uygun olduğunu göstermektedir. Ko-kültür protokolü, in vivo13,14 ve ENR ortamında yetiştirilen organoidlerde görüldüğü gibi, benzer bir farklılaşma paternine sahip organoidler üretir; KRT14+ veya TRP63+ progenitör hücreler dış tabakayı oluşturur ve KRT13+ veya KLF4+ farklılaşmış hücreler içe doğru yönelir.
Bu protokol, özofagus kök hücre nişini in vitro olarak incelemek için bir araç sağlar ve organoidler ile fibroblastlar arasındaki etkileşimi görselleştirir. Antikorlar kullanarak fibroblastların izolasyonu için bir protokol uygulayarak, yöntem uyarlanabilir ve transgenik farelere ihtiyaç duymadan fibroblast alt popülasyonlarını incelemek için kullanılabilir.
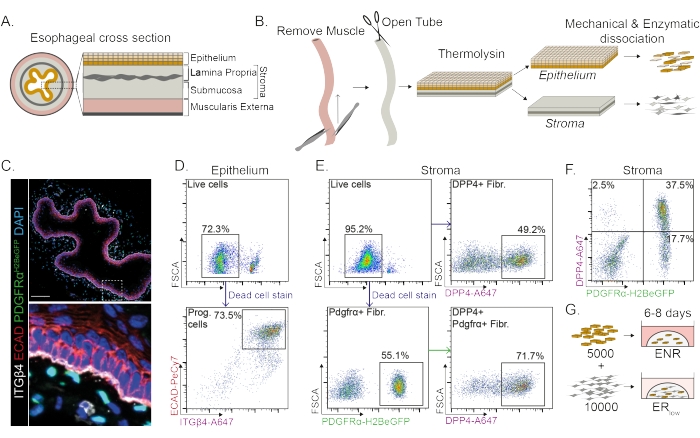
Şekil 1: Progenitör hücrelerin ve fibroblast alt popülasyonlarının yemek borusundan izolasyonu . (A) Yemek borusundaki farklı katmanlara şematik bakış. Stroma lamina propria ve submukoza içerir. (B) İzolasyon protokolüne şematik genel bakış. Kas (muscularis externa) forseps kullanılarak mekanik olarak çıkarılır; Kalan yemek borusu kesilir ve epitel tabakasını stromadan ayırmak için termolizin içinde inkübe edilir. Epitel ve stroma ayrılır, mekanik olarak kıyılır ve enzimatik olarak tek hücreli süspansiyonlara sindirilir. Ayrışmış hücreler daha sonra boyanır ve FACS için hazırlanır. (C) Stromada PdgfrαH2BeGFP+ fibroblastları gösteren muscularis eksternasından sıyrılan yemek borusunun kesiti. INTEGRIN-β4 (ITGβ4) ve E-CADHERIN (ECAD) çift pozitif hücreleri yemek borusunun epitelyal progenitör hücreleridir. Ölçek çubuğu = 100 μm. (D) Tüm tek hücrelerden canlı hücrelerin (üst panel) yüzdesini gösteren epitel hücre izolasyonunun temsili akış sitometrisi grafiği. Alt panel, tüm canlı hücrelerden izole edilmiş ITGβ4 + ECAD + progenitör (Prog.) hücrelerinin yüzdesini gösterir. (E) Canlı hücrelerin yüzdesini gösteren stromal hücre izolasyonunun temsili akış sitometri grafiği (sol üst panel). Tüm canlı hücrelerin izole DPP4+ fibroblastlarının (Fibr.; sağ üst panel) ve Pdgfrα+ fibroblastlarının (sol alt panel) yüzdesini gösteren temsili akım sitometri grafikleri. Pdgfrα+ fibroblastların %70'i de DPP4+'tır (sağ alt panel). (F) Sadece DPP4+ hücrelerini (%2.5), DPP4+ PDGFRa+ hücrelerini (%37.5) ve PDGFRa+ sadece hücreleri (%17.7) gösteren stromanın temsili akım sitometri grafiği. Yüzdeler tüm canlı hücrelere aittir. (G) Sadece epitelyal hücreler, 50 ng/μL EGF, 100 ng/μL NOGGIN ve 250 ng/μL RSPO (ENR) varlığında veya EGF ve düşük RSPO konsantrasyonu (25 ng/μL) varlığında fibroblastlarla birlikte bir matris kubbesi içinde kaplanır. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
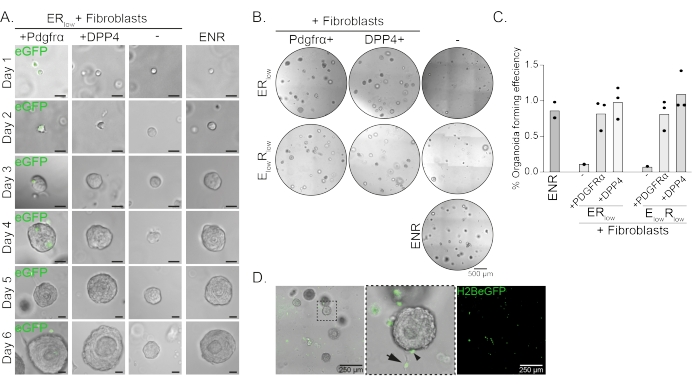
Şekil 2: Organoid ko-kültürlerin temsili sonuçları. (A) Organoidlerin 1. günden 6. güne kadar büyümesini gösteren parlak alan görüntüleri. PdgfrαH2BeGFP+ fibroblastlarla birlikte kültürlenen organoidlerle parlak alan görüntüleri de nükleer eGFP sinyalini göstermektedir. Ölçek çubuğu = 25 μm. (B) 6. günde tüm matris kubbesinin parlak alan görüntüleri. Sol sütun, ER düşük veya E düşük R düşük ortada Pdgfrα + fibroblastların varlığında yetiştirilen organoid ko-kültürlerigöstermektedir. Orta sütun, ER düşük veya E düşük R düşük ortada DPP4 + fibroblastların varlığında yetiştirilen organoid ko-kültürlerigöstermektedir. Sağ sütun, ENR ortamında yetiştirilen organoid mono-kültürleri göstermektedir. ENR ortamı = EGF (50 ng/μL), NOGGIN (100 ng/μL) ve RSPO (250 ng/μL). ERdüşük = EGF ve 25 ng/μL RSPO. E düşükRdüşük = 5 ng/μL EGF ve 25 ng/μL RSPO. Ölçek çubuğu = 500 μm. (C) Organoid oluşturma verimliliğini (%) gösteren grafik (yani, farklı kültür koşullarında organoidleri oluşturan hücrelerin yüzdesi). Her nokta bir matris kubbesini temsil eder ve çubuk koşul başına tüm noktaların ortalamasını temsil eder. (D) PdgfrαH2BeGFP+ fibroblastlarla birlikte kültürlenmiş 6. gün organoidlerinin parlak alan ve floresan görüntüsü. PdgfrαH2BeGFP+ fibroblastlar kubbe boyunca bulunur, organoidlere (ok ucu) bağlanır ve bağlanmamış ancak organoidlerle temas halindedir (tam ok). Ölçek çubuğu = 250 μm. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
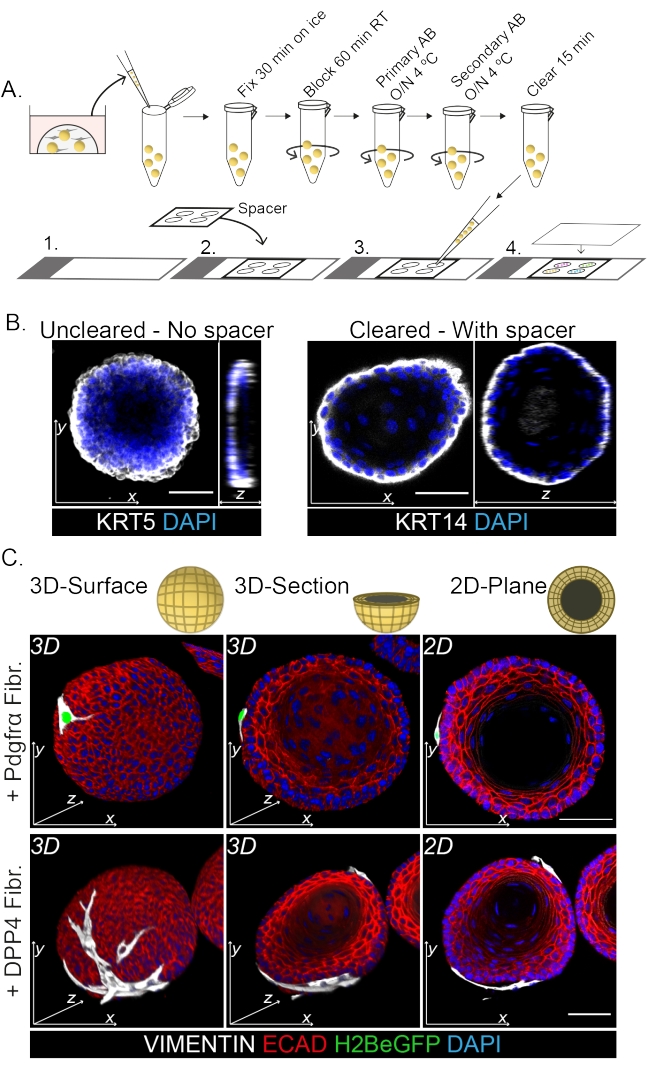
Şekil 3: Fibroblast-organoid etkileşimlerinin incelenmesi için tüm montaj boyama protokolü . (A) Tüm mount immünofloresan protokolüne şematik genel bakış. AB = antikor. (B) Temizlenmemiş tüm montaj boyamasının immünofloresan resmi, temizlenmiş organoidlere kıyasla lazer ışığının saydamlığının ve penetrasyonunun azaldığını gösterir. Bir ara parçanın yokluğu organoidin düzleşmesine ve organoid morfolojisinde kayba neden olur. (C) Birlikte kültürlenmiş organoidlerin tüm montaj görüntüleri, organoidlerin etrafına sarılmış ve organoid ile yakın temas halinde VIMENTIN + fibroblastları (Fibr.) ile 3D yüzeylerini göstermektedir. 3D kesitler ve 2D düzlem görüntüleri organoidin lümenini gösterir. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
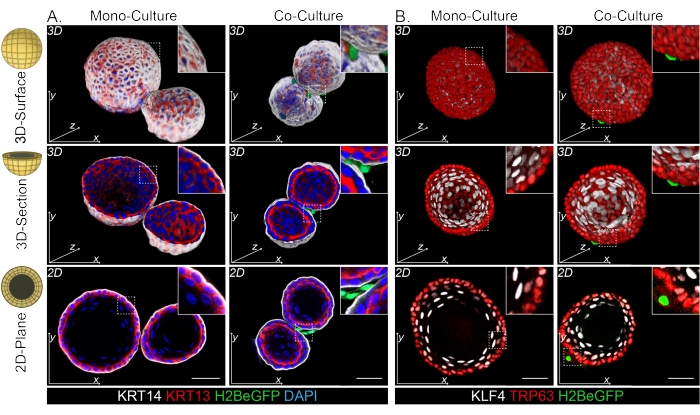
Şekil 4: Tüm montaj görüntüleri farklı bazal ve suprabazal hücre popülasyonlarını ortaya koymaktadır. (A) Dış tabakada KRT14+ bazal hücreleri ve KRT13+ farklılaşmış suprabazal hücreleri gösteren PdgfrαH2BeGFP+ fibroblastları ile mono ve ko-kültürlü organoidlerin bütün montaj boyaması. Ölçek çubuğu = 50 μm. (B) Dış tabakada TRP63+ bazal hücreleri ve KLF4+ farklılaşmış suprabazal hücreleri gösteren PdgfrαH2BeGFP+ fibroblastları ile mono- ve ko-kültürlenmiş organoidlerin bütün montaj boyaması. Ölçek çubuğu = 50 μm. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Tablo 1: Organoid kültür ortam bileşenlerini açıklayan tablo. Bu Tabloyu indirmek için lütfen tıklayınız.
Video 1: PdgfrαH2BeGFP+ fibroblast, organoidin etrafına sarılmış ve organoid ile yakın temas halindedir. Video, Şekil 3C'nin üst paneline eşlik eder. Şekil 3C'deki ölçek çubuğu 50 μm'dir ve organoid çapı ~ 120 μm'dir. VIMENTIN beyaz, E-CADHERIN kırmızı, PdgfrαH2BeGFP yeşil ve DAPI mavi renkte gösterilmiştir. Bu Videoyu indirmek için lütfen buraya tıklayın.
Video 2: DPP4 + fibroblast, organoid ile sarılmış ve yakın temas halindedir. Video, Şekil 3C'nin alt paneline eşlik eder. Şekil 3C'deki ölçek çubuğu 50 μm'dir ve organoid çapı ~ 120 μm'dir. VIMENTIN beyaz, E-CADHERIN kırmızı ve DAPI mavi renkte gösterilir. Bu Videoyu indirmek için lütfen buraya tıklayın.
Tartışmalar
Burada sunulan protokol, fonksiyonel özofagus epitel-fibroblast etkileşimlerini araştırmak için in vitro bir model oluşturmaktadır.
Epitel tabakası stromadan ayrılır ve hem epitel hem de stromal bölme için optimize edilmiş bir ayrışma protokolüne izin verir. Epitelyal dissosiyasyon protokolünün optimizasyonuna rağmen, doku kümeleri belirgin kalmaktadır. Her 15 dakikada bir kuvvetli bir şekilde yukarı ve aşağı pipetleme, kümelerin sayısını ve boyutunu önemli ölçüde azaltır. Diğer protokoller, epitel tabakası 5,6'yı daha da ayrıştırmak için tripsin kullanır. Burada, tripsin kullanımı veya ayrışma süresinin daha da arttırılması, epitel hücre canlılığının azalmasına ve organoid oluşturma verimliliğine neden olma eğiliminde olduğu için önerilmez. Epitelin aksine, stroma kolayca ayrışır ve ayrışma çözeltisinde 30 dakika, ~% 90 fibroblast canlılığına sahip tek hücreli bir süspansiyonla sonuçlanır (Şekil 1E). Protokolde epitelyal-stomal ayırma basamağının hariç tutulması, ayrışma süresini önemli ölçüde artırarak fibroblast canlılığının azalmasına ve epitel hücrelerinin veriminin düşmesine neden olur. Ek olarak, epiteli stromadan ayırmak, her popülasyonun hücre sayılarını belirlemek ve ortak kültürleri kurarken epitel hücrelerini ve fibroblastları farklı fare çizgilerinden karıştırmak için bir fırsat sağlar.
Organoid büyüme üzerine fibroblast fonksiyonunun incelenmesi, kök hücre biyolojisinde yaygın olarak kullanılan bir yöntemdir 9,10,11,15,16. Yerleşik ko-kültür ortamları ya %10 fetal buzağı serumu (FCS)9,15 ile desteklenen DMEM ya da büyüme faktörü azaltılmış orta10,16'dır. Bu protokolde, büyüme faktörü azaltılmış ortam, fibroblastların büyük ölçüde sessiz olduğu in vivo kök hücre nişindeki koşulları taklit etmek için kullanılır. FCS, ko-kültürlerde fibroblastların aktivasyonu ve proliferasyonu ile sonuçlanan, muhtemelen in vivo durumdan farklı bir fibroblast hücre durumuna karşılık gelen büyüme faktörü bakımından zengin bir serumdur. FCS'yi dışlayarak ve büyüme faktörlerini azaltarak, böylece tek başına ortam (ERdüşük) organoid büyümeyi desteklemez ve fibroblast proliferasyonunu uyarmaz, fibroblastların organoid büyüme üzerindeki etkisini izole etmek mümkündür. Bu ortamda, NOGGIN kaldırılır ve RSPO minimuma indirilir (% 10 RPSO). Hem NOGGIN hem de RSPO'nun özofagus organoid büyümesi için gerekli olduğu gösterilmiştir6. EGF, organoid büyümeyi kendi başına desteklemediği için ko-kültür ortamında tutuldu. Bununla birlikte, fibroblastlar ayrıca EGF ile indirgenmiş bir ortamda organoid büyümesini destekleyebilir (E düşük, R,düşük; Şekil 2B,D).
Organoid ko-kültürler, tripsinizasyon sırasında fibroblastlar kaybolduğu için geçiş yoluyla sürdürülemez. Bununla birlikte, özofagus organoidleri korunabildiğinden, genişletilebildiğinden ve mono-kültürler olarak daha fazla deney için kullanılabildiğinden, organoid pasajlama protokole dahil edilmiştir. Mono-kültürlerden pasajlı organoidler, yeni izole edilmiş fibroblastlarla ortak kültürler oluşturmak için kullanılabilir. Birincil hücrelerin kullanılmasının bir dezavantajı, çoklu organoid ko-kültürleri kurmak için gereken fare sayısıdır. Fibroblastların küçük alt popülasyonlarına odaklanıldığında, elde edilen ko-kültürlerin sayısı sınırlıdır. Diğer protokollerde, fibroblastlar organoid ko-kültürleri kurmak için kullanılmadan önce kültürde ilk önce genişletilir10. Bununla birlikte, fibroblastlar geçiş sırasında morfolojiyi ve kimliği değiştirir, primer deri ve kardiyak fibroblastlar kullanılarak gösterilmiştir17,18. Özofagus fibroblastlarının konvansiyonel 2D geçişi hem morfoloji hem de fenotip değişikliklerine neden olur ve fibroblastların in vitro zenginleştirilmesinin endojen kök hücre nişini fenoskopi yapmayı amaçlayan ko-kültürler için uygun olmadığını gösterir.
Tüm montaj boyama, fibroblast-organoid etkileşimini korumak ve görselleştirmek için bir araç sağlar. Tüm organoidlerin doğrudan kendilerine bağlı fibroblastları olmasa da, çoğu organoidin fibroblastlarla temas halinde olduğu belirtilmelidir (bkz. Şekil 2C). Epitelyal-fibroblast etkileşimlerini sürdürmek için, organoidleri dikkatli bir şekilde ele almak ve kuvvetli pipetleme, vorteks ve yüksek hızlı eğirmeden kaçınmak önemlidir. Optimal fiksasyon, 3D doku mimarisini korumak ve endojen floresanı korumak için önemlidir. 30 dakikalık bir fiksasyon, H2BeGFP sinyalini korumak için yeterlidir ve bu protokolde kullanılan antikorlar için en uygunudur, ancak bu, kullanılan floroforlar ve antikorlar arasında değişebilir. Organoidlerin temizlenmesi ışık saçılımını azaltır ve tüm 3D yapının görselleştirilmesini önemli ölçüde geliştirir. Organoidler küçük olduğundan, temizleme kolay ve hızlıdır; Bununla birlikte, lazer taramalı konfokal mikroskopi kullanarak tüm organoidlerin görüntülenmesi zaman alıcı olabilir, çünkü birden fazla Z-yığınının yapılması gerekir. Dönen disk gibi konfokal mikroskoplar, görüntüleme süresini azaltmak için kullanılabilir.
Genel olarak, fibroblastların varlığında yetiştirilen özofagus organoidleri, özofagus kök hücre nişinin yönlerini anlamak için değerli bir araç sağlar. Ek olarak, tüm montaj temizleme, fibroblastlar ve organoidler arasındaki etkileşimi görselleştirmek için erişilebilir bir yöntem sağlar.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan ederler.
Teşekkürler
Bu çalışma ERC StG TroyCAN (851241) tarafından desteklenmiştir. E.E. bir Cancerfonden Doktora Sonrası Yardımcısıdır. M.G. bir Ragnar Söderberg Üyesi ve Cancerfonden Junior Araştırmacısıdır. Biyomedikal Akış Sitometri Çekirdek Tesisi, Biyomedikal Görüntüleme Çekirdeği (BIC) ve Karşılaştırmalı Tıp Biyomedikal (KMB) hayvan tesisi de dahil olmak üzere Karolinska Enstitüsü çekirdek tesislerinden gelen teknik yardım için minnettarız. Genander laboratuvarı üyelerine protokolü dikkatlice okudukları ve yorumladıkları için teşekkür ederiz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
Referanslar
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300(2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440(2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836(2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889(2019).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır