Method Article
אפיון פונקציונלי והדמיה של פיברובלסטים בוושט באמצעות תרביות אורגנואידים
In This Article
Summary
תרביות משותפות אורגנואידים-פיברובלסטים מספקות מודל לחקר נישת תאי הגזע in vivo . כאן מתואר פרוטוקול לתרביות משותפות אורגנואידים-פיברובלסטים בוושט. בנוסף, הדמיה של הר שלם משמשת כדי להמחיש את האינטראקציה פיברובלסט-אורגנואידים.
Abstract
גזע אפיתל ותאי אב תורמים להיווצרות ותחזוקה של מחסום האפיתל לאורך כל החיים. רוב אוכלוסיות תאי הגזע ותאי האב חבויות במקומות נפרדים אנטומית, מה שמאפשר אינטראקציות בלעדיות עם אותות נישה השומרים על גזעיות. בעוד הפיתוח של תרביות אורגנואידים אפיתל מספק כלי רב עוצמה להבנת התפקיד של תאי גזע ותאי אב בהומאוסטזיס ובמחלות, האינטראקציה בתוך סביבת הנישה נעדרת במידה רבה, ובכך מעכבת את זיהוי הגורמים המשפיעים על התנהגות תאי גזע. פיברובלסטים ממלאים תפקיד מפתח בהכוונת גזע האפיתל וגורל האב. כאן, מוצג פרוטוקול מקיף של תרבית משותפת אורגנואידים-פיברובלסטים המאפשר תיחום של תת-אוכלוסיות פיברובלסטים בהתחדשות והתמיינות תאי אב של הוושט. בפרוטוקול זה מתוארת שיטה לבידוד תאי אפיתל ופיברובלסטים במקביל מהוושט. מתוארות אסטרטגיות מיון תאים פלואורסצנטיות שונות לבידוד תאי האב של הוושט וכן תת-אוכלוסיות פיברובלסטים מעכברים טרנסגניים או עכברי בר. פרוטוקול זה מספק גישה רב-תכליתית שניתן להתאים לבידוד של תת-אוכלוסיות פיברובלסטים ספציפיות. הקמה והעברה של מונו-תרביות אורגנואידים אפיתליאליים של הוושט נכללת בפרוטוקול זה, ומאפשרת השוואה ישירה עם מערכת התרבות המשותפת. בנוסף, מתוארת גישת ניקוי תלת ממדית המאפשרת ניתוח תמונה מפורט של אינטראקציות אפיתל-פיברובלסט. באופן קולקטיבי, פרוטוקול זה מתאר שיטה השוואתית ובעלת תפוקה גבוהה יחסית לזיהוי והבנה של רכיבי נישה של תאי גזע בוושט במבחנה.
Introduction
אורגנואידים משמשים כמבחני מבחנה תלת-ממדיים לאפיון תאי גזע ותאי אב, כמו גם להבנת רמזי האיתות הנגזרים מהרכיבים התאיים של נישת תאי הגזע 1,2,3,4. אורגנואידים של הוושט בעכברים תוארו לראשונה בשנת 2014 ומספר מאמרים זיהו גורמי גדילה, כמו R-Spondin (RSPO), NOGGIN וגורם גדילה אפידרמלי (EGF), הדרושים כדי לשמור ולעבור אורגנואידים של הוושט 5,6,7, בטענה כי רמזי איתות דומים נדרשים עבור in vivo חידוש תאי אב. עם זאת, גורמי גדילה מתווספים בדרך כלל בריכוזים לא פיזיולוגיים, וכתוצאה מכך תנאי גדילה אורגנואידים שאינם משקפים בהכרח את סביבת האיתות in vivo.
פיברובלסטים הם אוכלוסיות תאי סטרומה הטרוגניות התומכות בתכונות תאי אב בנישות רבות של תאי גזע8. שילוב תאי אב אפיתל ופיברובלסטים באותה תרבית אורגנואידים מאפשר יצירת אורגנואידים בריכוזים מופחתים של גורמי גדילה בעלי תוספת אקסוגנית. מתוארות מערכות תרבית אורגנואידים מאפיתל המעי והכבד, אך פרוטוקול לקביעת תרביות משותפות אורגנואידים-פיברובלסטים בוושט עדיין יוצא מן הכלל 9,10,11.
בפרוטוקול זה, מתוארות שתי אסטרטגיות מיון תאים המופעלות על ידי פלואורסצנטיות (FACS) עבור פיברובלסטים מהוושט, באמצעות עכברי PdgfrαH2BeGFP טרנסגניים12 או עכברי בר עם צביעת נוגדנים קלאסית. ניתן לבודד תת-אוכלוסיות שונות של פיברובלסטים באמצעות סמני פני התא לפי בחירתם, ובכך לספק גמישות לפרוטוקול. בנוסף, נעשה שימוש בטכניקת הדמיה פלואורסצנטית תלת-ממדית המשמרת מורפולוגיה של אורגנואידים כדי לאפיין אינטראקציות פיברובלסט-אורגנואידים. ניקוי אורגנואידים מספק שיטה מהירה להגדלת עומק חדירת האור באורגנואידים, משפר את ההדמיה של קשרי אורגנואידים-פיברובלסטים ומאפשר שחזור של מבנה האורגנואיד בשלמותו. פרוטוקול זה משלב תרבית משותפת של אורגנואידים בוושט עם אסטרטגיית הדמיה שלמה, המאפשרת אפיון פונקציונלי של האינטראקציה פיברובלסט-אורגנואידים.
Protocol
ניסויים בבעלי חיים למחקר זה אושרו על ידי Stockholms Norra djurförsöksetiska nämnd (היתר אתי מספר 14051-2019). בעלי החיים שוכנו בתנאים נטולי פתוגנים על פי המלצות הפדרציה האירופית למדעי חיות המעבדה.
1. הכנה
- הפשירו את תמיסות המניות האנזימטיות המשמשות לדיסוציאציה (ראו טבלת חומרים) על קרח. הפשרת אליקוט של מטריצת קרום מרתף מופחתת גורם גדילה (GFR) (מטריצה) ב 4 ° C.
- הכינו את מדיום התרבות. השתמש במדיום המתואר בטבלה 1 עבור תרביות אורגנואידים ותרביות משותפות והכן אותו לפני תחילת הפרוטוקול.
2. דיסקציה והפרדה של אפיתל הוושט וסטרומה
הערה: ודא שכל המכשירים המשמשים לדיסקציה ולעיבוד רקמות הם סטריליים. הכינו 2 מ"ל של תמיסת דיסוציאציה (ראו טבלת חומרים) בתמיסת מלח מאוזנת של הנקס (HBSS) לכל שלושה ושט.
- השתמש בזן עכבר לבחירה, כגון עכברי C57BL/6J. התפתחות הוושט בעכברים מסתיימת לאחר יום הלידה (עמ' 70), ולכן מומלץ להשתמש בעכברים שגילם עולה על p7013. השתמש בארבעה או חמישה עכברים מכיוון שהם מספקים מספיק חומר כדי ליצור 8-10 תרביות אורגנואידים.
הערה: יעילות יצירת אורגנואידים יורדת עם גיל העכברים. אם תת-אוכלוסיות פיברובלסטים ספציפיות מעניינות, ייתכן שהתנובה הפיברובלסטית הנמוכה מגבילה את מספר התרביות האורגנואידיות שניתן להקים. - השתמש בעכברים מהונדסים גנטית (למשל, PdgfrαH2BeGFP) או מסוג בר (WT) לבידוד אוכלוסיות פיברובלסטים. בעת שימוש בעכברי WT, בצע צביעת נוגדנים כדי לבודד תת-אוכלוסיות פיברובלסטים ספציפיות מהסטרומה באמצעות FACS.
- הרדימו את העכברים על ידי חנקCO2 . לנתח את הוושט באמצעות מלקחיים ומספריים דיסקציה. כדי להסיר את כל הוושט, לחתוך את הקצה הדיסטלי של הוושט ישירות מעל הבטן ואת הקצה הפרוקסימלי בתחילת קנה הנשימה. לטבול את הוושט PBS ולשים אותו על קרח.
- הסר באופן מכני את השרירים החיצוניים באמצעות מיקרוסקופ דיסקציה (טווח הגדלה כולל של 8x-40x) ומלקחיים. החזיקו את הקצה הדיסטלי של הוושט המנותח באמצעות זוג מלקחיים אחד והשתמשו במלקחיים האחרים כדי לתפוס ולמשוך את השריר מהקצה הדיסטלי לקצה הפרוקסימלי של הוושט המנותח. הסר והשלך את שכבת השריר.
- פתח את הוושט לאורך. זה עובד הכי טוב באמצעות מספריים קפיציים microdissection עם קצה כדור כדי למנוע נזק לרקמות. החזיקו בקצה אחד של הוושט על מנת להכניס את כדור מספריים הקפיץ לתוך לומן הוושט וחתכו את הוושט תוך אחיזה עד הסוף.
- מניחים את הוושט בצינור מיקרו-צנטריפוגה בנפח 1.5 מ"ל או בצלחת בת 24 בארות. יש לדגור על הוושט הפתוח בתרמוליזין של 0.5 מ"ג/מ"ל ב-HBSS בטמפרטורה של 37°C על שייקר נדנדה למשך 15 דקות. לטבול את הוושט לחלוטין בתמיסת תרמוליזין.
הערה: נפח תמיסת התרמוליזין בשימוש תלוי בגודל הבאר או הצינור. מספר ושט ניתן להציב ולשקוע באותה באר או צינור. - מוציאים את הוושט מתמיסת התרמוליזין. השתמש במיקרוסקופ דיסקציה כדי להפריד בזהירות את אפיתל הוושט מן הסטרומה. בעזרת מלקחיים עדינים, תופסים גם את צד האפיתל וגם את צד הסטרומה של הרקמה ומפרידים אותם לאט לאט כדי להפריד בין שתי השכבות.
הערה: הסטרומה מזוהה על ידי המראה הלבן והאטום שלה, בניגוד לאפיתל השקוף. הסטרומה מכילה את הלמינה פרופריה ואת השכבה התת-רירית. - מעבירים את שכבת האפיתל והסטרומה לשני צינורות מיקרו-צנטריפוגות נפרדים של 1.5 מ"ל עם 200 מיקרוליטר של תמיסת דיסוציאציה ב- HBSS. שים על קרח.
3. בידוד תאי אב של הוושט
הערה: בידוד תאי אב של הוושט (שלב 2) ופיברובלסטים (שלב 3) יכול להתבצע בו זמנית. הכינו צינור 50 מ"ל של 1% FBS ב- HBSS (1% FBS).
- מעבירים את אפיתל הוושט המופרד מצינור מיקרו-צנטריפוגה בנפח 1.5 מ"ל (שלב 2.8) לצלחת פטרי נקייה ומשתמשים באזמל חד לטחינה. אספו את הרקמה הטחונה מצלחת הפטרי עם 200 מיקרוליטר של תמיסת דיסוציאציה והעבירו אותה חזרה לצינור מיקרו-צנטריפוגה של 1.5 מ"ל.
הערה: האפיתל נטחן כראוי כאשר ניתן להחזיר את החתיכות לצינור מיקרו-צנטריפוגה של 1.5 מ"ל באמצעות קצה פיפטה של 200 מיקרוליטר. - הוסף 800 μL של תמיסת דיסוציאציה טרייה לצינור מיקרו-צנטריפוגה 1.5 מ"ל לנפח כולל של 1 מ"ל.
הערה: חשוב להוסיף נפח מספיק של פתרון דיסוציאציה. לכל אחד עד שלושה esophagi, 1 מ"ל של פתרון מומלץ. להגדיל כאשר יותר ושט מעובדים בבת אחת. - הניחו את הצינור עם שכבת האפיתל הטחון על נדנדה-שייקר בטמפרטורה של 37°C למשך 60 דקות. פיפטה את התמיסה למעלה ולמטה בערך 20 פעמים באמצעות קצה פיפטה 200 μL כל 15 דקות כדי לשפר את העיכול.
- לאחר 60 דקות, פיפטה מעלה ומטה עוד 20 פעמים באמצעות קצה פיפטה 200 μL. העבירו את התמיסה דרך מסננת תאים של 40 מיקרומטר לתוך צינור מיקרו-צנטריפוגה חדש בנפח 1.5 מ"ל. צנטריפוגה ב 300 x גרם במשך 10 דקות ב 4 ° C.
הערה: יש להרטיב את מסננת התאים עם FBS של 1% לפני מאמץ התאים כדי למזער את היצמדות התאים למסנן. האפיתל לא יעוכל לחלוטין, וחתיכות רקמה עדיין יהיו גלויות. עם זאת, דגירה ארוכה יותר תפחית את הישרדות התאים ולא תביא לתנובה גבוהה יותר של תאים בני קיימא. - יש להשליך את הסופרנאטנט על ידי הסרת נוזל עודף עם פיפטה של 1 מ"ל ולהשהות מחדש את הגלולה ב-1 מ"ל של 1% FBS. צנטריפוגה ב 300 x גרם במשך 10 דקות ב 4 ° C.
- במהלך הצנטריפוגה, להכין את תערובת נוגדנים מצומדים עבור FACS של תאי אב הוושט.
- ערבב 1 μL של CD324-PE-Cy7 (ECADHERIN) ו- CD104-A647 (INTEGRIN-β4) ב- 200 μL של 1% FBS לכל מיליון תאים.
הערה: 1 μL של נוגדן (200 μL נפח סופי) מספיק עבור אחד או שניים esophagi. בעת עיבוד יותר ושט בבת אחת, להגדיל את נפח הפתרון מכתים נוגדנים.
- להשהות את הגלולה ב 200 μL של תערובת נוגדנים ולהעביר ציטומטריה זרימה ציטומטריה. לאחר הוספת נוגדנים פלואורסצנטיים, שמור על מתלי התאים בחושך כדי למנוע הלבנה של האות. לדגור על התאים במשך 30 דקות ב 4 ° C. הוסף 3 מ"ל של 1% FBS וצנטריפוגה ב 300 x גרם במשך 10 דקות ב 4 ° C, ולאחר מכן להשעות מחדש את התאים במינימום של 200 μL של 1% של FBS.
הערה: 500 μL של 1% FBS משמש עד ארבע או חמש ושט. הגדל את הנפח כאשר יותר ושט מעובדים בבת אחת, כך קצב זרימת FACS של 100-300 אירועים / s ניתן להשיג. יותר אירועים/ים יפחיתו את יעילות המיון, ועלייה בקצב הזרימה תקטין את הישרדות התא. - הוסף סמן כתמים של תאים מתים לריכוז סופי של 1:10,000, 5 דקות לפני מיון FACS לבידוד תאים חיים. מיין את תאי האב באמצעות מכשיר FACS (ראה איור 1 עבור אסטרטגיית gating). אספו את התאים בצינורות מיקרו-צנטריפוגות בנפח 1.5 מ"ל המלאים ב-200 מיקרוליטר של תווך אורגנואיד בסיסי (טבלה 1).
4. בידוד פיברובלסטים משכבת הסטרומה
- חותכים את שכבת הסטומל לחתיכות עדינות בצינור של 1.5 מ"ל המכיל 200 מיקרוליטר של תמיסת דיסוציאציה (שלב 2.8) באמצעות מספריים לדיסקציה. הרקמה נטחנת כראוי ברגע שניתן להעלות ולהוריד את התמיסה באמצעות קצה פיפטה של 200 מיקרוליטר.
- הוסף 800 μL של תמיסת דיסוציאציה טרייה לצינור מיקרו-צנטריפוגה 1.5 מ"ל לנפח כולל של 1 מ"ל.
הערה: חשוב להוסיף נפח מספיק של פתרון דיסוציאציה. לכל אחד עד שלושה esophagi, 1 מ"ל של פתרון מומלץ. להגדיל כאשר יותר ושט מעובדים בבת אחת. - הניחו את הצינור על שייקר נדנדה בטמפרטורה של 37°C למשך 30 דקות. לאחר 15 דקות, פיפטה את התמיסה למעלה ולמטה בערך 20 פעמים באמצעות קצה פיפטה 200 μL כדי לשפר את העיכול.
- לאחר 30 דקות של עיכול אנזימטי, פיפטה מעלה ומטה עוד 20 פעמים באמצעות קצה פיפטה 200 μL. מסננים את התמיסה דרך מסננת תאים של 70 מיקרומטר לתוך צינור מיקרו-צנטריפוגה חדש בנפח 1.5 מ"ל. צנטריפוגה ב 300 x גרם במשך 10 דקות ב 4 ° C.
הערה: יש להרטיב את מסננת התאים עם FBS של 1% לפני מאמץ התאים כדי למזער את היצמדות התאים למסנן. - יש להשליך את הסופרנאטנט על ידי הסרת נוזל עודף עם פיפטה של 1 מ"ל ולהשהות מחדש את הגלולה ב-1 מ"ל של 1% FBS. צנטריפוגה ב 300 x גרם במשך 10 דקות ב 4 ° C.
הערה: בעת שימוש בזן עכבר מהונדס גנטית המכיל פיברובלסטים המסומנים בתווית פלורסנט, כתמי נוגדנים הם אופציונליים. אם אין צורך בכתמי נוגדנים, המשך לשלב 3.7 והעבר את הדגימה לציטומטריית זרימה.- במהלך הצנטריפוגה, הכינו את תערובת הנוגדנים המצומדים לבידוד FACS של פיברובלסטים. ערבב 1 μL של CD26-APC (DPP4) ב 200 μL של 1% FBS לכל מיליון תאים.
הערה: 1 μL של נוגדן מספיק עבור אחד או שניים esophagi. בעת עיבוד יותר ושט בבת אחת, להגדיל את נפח הפתרון מכתים נוגדנים.
- במהלך הצנטריפוגה, הכינו את תערובת הנוגדנים המצומדים לבידוד FACS של פיברובלסטים. ערבב 1 μL של CD26-APC (DPP4) ב 200 μL של 1% FBS לכל מיליון תאים.
- להשעות מחדש את הגלולה ב 200 μL של תערובת נוגדנים מצומדים ב 1% FBS ולהעביר ציטומטריה זרימה. לדגור על התאים במשך 30 דקות ב 4 ° C.
- הוסף 3 מ"ל של FBS 1% וצנטריפוגה ב 300 x גרם למשך 10 דקות ב 4 ° C. להשעות מחדש את התאים במינימום של 200 μL של 1% של FBS.
הערה: 500 μL של 1% FBS משמש עד ארבע או חמש ושט. הגדל את הנפח כאשר יותר ושט מעובדים בבת אחת, כך קצב זרימה של 100-300 אירועים / s ניתן להשיג. יותר אירועים/ים יפחיתו את יעילות המיון, והגדלת קצב הזרימה תקטין את הישרדות התא. לאחר הוספת נוגדנים פלואורסצנטיים, יש לשמור על תרחיפים כהים כדי למנוע הלבנת אות. - הוסף סמן כתמים של תאים מתים לריכוז סופי של 1:10,000, 5 דקות לפני מיון FACS לבידוד תאים חיים. מיין את התאים באמצעות מכשיר FACS (ראה איור 1 עבור אסטרטגיית gating). אספו את התאים בצינורות מיקרו-צנטריפוגות בנפח 1.5 מ"ל המלאים ב-200 מיקרוליטר של תווך אורגנואיד בסיסי (טבלה 1).
5. הקמה ותרבות של אורגנואידים בוושט
הערה: Prewarm ERנמוך (תרבית משותפת אורגנואידים), ENR (אורגנואיד) בינוני (ראה טבלה 1 לתיאור), וצלחת 48 בארות ב 37 ° C. מניחים את המטריצה המופשרת (מוכנה בשלב 1) aliquot על קרח. מומלץ להשתמש במטריצה המסופקת כאן (ראה טבלת חומרים) עבור תרבית אורגנואידים של הוושט בעכבר, שכן מותגים אחרים של מטריצה משפיעים לרעה על יעילות יצירת אורגנואידים.
- עבור תרבית אורגנואידים, ערבבו את תאי האפיתל הממוינים והפיברובלסטים ביחס של 1:2 בצינור. עבור כל כיפת מטריצה, השתמש 5,000 תאי אפיתל ו 10,000 פיברובלסטים. כאשר מתכוננים לכיפות נוספות, יש להוסיף מכפלה של 5,000 תאי אפיתל ו-10,000 פיברובלסטים לצינור אחד. עבור תרביות אורגנואידים ללא פיברובלסטים, השתמש ב-5,000 תאי אפיתל לכל כיפת מטריצה.
- צנטריפוגה אוכלוסיית התאים המעורבים ב 300 x גרם במשך 5 דקות. השליכו את הסופרנאטנט על ידי הסרתו בזהירות עם פיפטה של 200 מיקרוליטר.
- שטפו את התאים פעם אחת על ידי השעיית הגלולה בתווך אורגנואיד בסיסי קר וצנטריפוגה ב 300 x גרם למשך 5 דקות. מניחים את התאים על קרח.
- הכינו תערובת המורכבת מ-80% מטריצה ו-20% מדיום אורגנואיד בסיסי קר. הניחו הכל על קרח כשהמטריצה מתמצקת בטמפרטורת החדר (RT).
- השליכו את הסופרנאטנט לאחר הצנטריפוגה על ידי הסרתו בזהירות עם פיפטה של 200 מיקרוליטר. מרחפים מחדש את התאים ב-10 מיקרוליטר של תערובת מטריצה / כיפה ומחזירים לקרח.
- קח את הצלחת המחוממת מראש של 48 בארות מאינקובטור של 37 מעלות צלזיוס וצור כיפת מטריצה אחת לכל באר באמצעות פיפטה של 20 מיקרוליטר. כל כיפה מכילה 10 μL של 80% מטריצה, 5,000 תאי אפיתל ו-10,000 פיברובלסטים. מעבירים את הצלחת הפוכה לאינקובטור ונותנים לכיפות להתמצק עוד 20-30 דקות ב 37 מעלות צלזיוס.
הערה: ירידה בנפח כיפת המטריצה ו/או עלייה במספר התאים ישפיעו על יעילות יצירת האורגנואידים. - הוסף 200 μL של ERמחומם מראש בינוני נמוך (טבלה 1) לכיפות המטריצה המכילות תרביות אורגנואידים ותווך ENR (טבלה 1) לכיפות המטריצה המתאימות המכילות אורגנואידים אפיתליאליים בלבד ומקם את הצלחת באינקובטור.
- לגדל את האורגנואידים ב 37 ° C ו 5% CO2. במשך היומיים הראשונים, להשלים את המדיום עם 10 מיקרומטר מעכב סלע (Y-27623). מעכב סלעים מונע מוות תאי כתוצאה מלחץ ומגדיל את הסיכוי להקמה מוצלחת של תרביות אורגנואידים.
- רענן את המדיום כל 2-3 ימים. ודא שהתווך חם כדי למנוע דיסוציאציה של המטריצה הרגישה לטמפרטורה.
- בצע ניתוחים של הניסוי 6 עד 8 ימים לאחר הציפוי. ניתן לשמור את האורגנואידים בתרבית עד 14 יום. בסביבות היום ה-14 נצפה אובדן שלמות הכיפה.
6. מעבר של אורגנואידים
הערה: העברה של אורגנואידים שגדלו בתרבית משותפת גורמת לאובדן פיברובלסטים. לכן, מומלץ להשתמש בתווך ENR עבור כל האורגנואידים בעת מעבר. חימום מראש של ENR, PBS וצלחת של 48 בארות ב-37°C.
- מוציאים את המדיום ושוטפים היטב את כיפת המטריקס עם PBS שחומם מראש. הוסף 200 μL של תמיסת טריפסין קרה 0.25% ופיפטה למעלה ולמטה כדי לשבור את כיפת המטריצה.
הערה: מומלץ להשתמש בטריפסין 0.25% קר, מכיוון שהמטריצה רגישה לטמפרטורה וזה מסייע בפירוק כיפות המטריצה. - לדגור על אורגנואידים עם טריפסין ב 37 ° C במשך ~ 20 דקות. פיפטה למעלה ולמטה לאחר 10 דקות כדי להגביר את הדיסוציאציה של האורגנואידים. עקוב אחר תהליך הדיסוציאציה במיקרוסקופ כל 5-10 דקות. מאחר שטריפסין מקטין את יכולת הקיום של התא, זה יכול לעזור לזהות את זמן הדיסוציאציה האידיאלי.
- לאחר 20 דקות, פיפטה את האורגנואידים למעלה ולמטה עם פיפטה 200 μL כדי לנתק את האורגנואידים. אסוף את התאים בצינור מיקרו-צנטריפוגה של 1.5 מ"ל, הוסף 1 מ"ל של תווך אורגנואיד בסיסי, וצנטריפוגה ב -300 x גרם למשך 5 דקות ב- RT.
- אופציונלי: כדי להבטיח את תנאי הגידול הטובים ביותר של אורגנואידים ושאורגנואידים חדשים מופקים מתאים בודדים, סננו את התאים באמצעות מסננת תאים של 40 מיקרומטר שהורטבה מראש. סינון תרחיף התא גורם להסרת ליבות אורגנואידים וגושי תאים שקשה לנתק.
- הכינו תערובת מטריצה המורכבת מ-80% מטריצה ו-20% מדיום אורגנואיד בסיסי קר. הניחו הכל על קרח, כאשר המטריצה מתמצקת ב- RT.
- השליכו את הסופרנאטנט על ידי הסרתו בזהירות עם פיפטה של 200 מיקרוליטר, השהו מחדש את התאים ב-10 מיקרוליטר של תערובת מטריצה / כיפה, והחזירו את התערובת לקרח.
הערה: ניתן לפצל אורגנואידים ביחס של 1:5 עד 1:10, בהתאם לצפיפות הכיפה. ניתן גם לספור תאי אפיתל ולצפות אותם מחדש ב-5,000 תאים/כיפה. - קח את צלחת 48 בארות שחוממה מראש מאינקובטור 37 מעלות צלזיוס ולעשות כיפה אחת לכל באר. מעבירים את הצלחת הפוכה לאינקובטור ונותנים לכיפות להתמצק עוד 20-30 דקות ב 37 מעלות צלזיוס.
- הוסף 200 μL של מדיום ENR שחומם מראש לכיפות האורגנואידים המתאימות. השלם את המדיום עם מעכב סלע 10 מיקרומטר (Y-27623) במשך היומיים הראשונים.
- רענן את המדיום כל 2-3 ימים. ודא שהתווך חם כדי למנוע דיסוציאציה של המטריצה הרגישה לטמפרטורה.
7. עיבוד אורגנואיד לצביעת הר שלם
הערה: יש לצפות את הקצוות והצינורות ב-10% FBS ב-PBS לפני השימוש כדי למנוע הידבקות של אורגנואידים לפלסטיק. עבור קצוות פיפטה, מספיק פיפטה פעם או פעמיים למעלה ולמטה בתמיסת 10% FBS/PBS לפני השימוש בקצה. עבור צינורות, מלא את הצינור עם 10% FBS / PBS ולאחר מכן להסיר את התמיסה.
- הסר את התווך האורגנואידי והוסף 200 μL של PBS קר כקרח לכיפות המטריצה. מניחים את הצלחת על קרח למשך 5-10 דקות.
- פיפטה למעלה ולמטה ולהעביר את הפתרון 0.6 מ"ל מיקרו צנטריפוגות צינורות לא דבקים. צנטריפוגה זמן קצר במשך 30-60 שניות ב 100 x גרם כדי לתת אורגנואידים לשקוע בתחתית.
הערה: עודף פיפטינג וצנטריפוגה ארוכה שוברים את האורגנואידים ומשבשים את האינטראקציה פיברובלסט-אורגנואידים. - יש להסיר את עודפי הנוזלים ולהוסיף PBS קר כקרח. צנטריפוגה זמן קצר במשך 30-60 שניות ב 100 x גרם כדי לתת אורגנואידים לשקוע בתחתית.
- הסר את עודפי הנוזל וקבע את האורגנואיד עם 200 μL של פורמלדהיד קר 4% בתמיסת PBS למשך 30 דקות על קרח.
אזהרה: פורמלדהיד הוא רעיל ויש להשתמש בו תמיד במנדף כימי. יש ללבוש תמיד כפפות ניטריל, משקפי בטיחות ומעילי מעבדה. - קיבוע האורגנואיד גורם להם לשקוע, ואין עוד צורך בצנטריפוגה. תנו לאורגנואידים לשקוע על ידי הנחת הצינור זקוף והמתינו 2-3 דקות, הסירו את הפורמלדהיד והוסיפו 500 μL של PBS קר כדי לשטוף את הפורמלדהיד.
- תנו לאורגנואידים לשקוע, הסירו את עודפי PBS והוסיפו 500 מיקרוליטר של PBS קר טרי. תנו לאורגנואידים לשקוע, הסירו את עודפי PBS והוסיפו 500 μL של חיץ חוסם (5% סרום חמור רגיל, 1% BSA ו-0.5% Triton X-100 ב-PBS). הניחו את הצינור על נדנדה-שייקר למשך 60 דקות ב-RT.
הערה: חסימה יכולה להיעשות גם בלילה (O/N) ב 4 ° C. - תנו לאורגנואידים לשקוע, הסירו את המאגר החוסם, והשעו מחדש את האורגנואידים ב-200 מיקרוליטר של חיץ חוסם עם נוגדנים ראשוניים (ראו טבלת חומרים). שמור את האורגנואידים על מטלטל נדנדה O/N ב 4 ° C.
הערה: כדי לשפר את הצביעה של חלבונים גרעיניים, חלבונים בעלי ביטוי נמוך או נוגדנים המראים צביעה לא ספציפית, ניתן להגדיל את זמן הדגירה למשך יום או יומיים ב -4 מעלות צלזיוס. הנחת האורגנואידים על נדנדה-שייקר היא חיונית מכיוון שהיא מונעת מאורגנואידים להתקבץ יחד ומגבירה את יעילות הצביעה. - תן לאורגנואידים לשקוע, הסר את תערובת הנוגדנים הראשונית ושטוף את האורגנואידים באמצעות 500 μL של 0.02% Triton X-100 ב- PBS (0.02% Tx) למשך 60 דקות ב- RT. חזור על הפעולה שלוש פעמים.
הערה: כאשר יש צורך בדגירה ארוכה יותר של נוגדנים ראשוניים, הוסף שלב שטיפה עם 0.02% Tx ב- PBS O/N ב- 4 ° C. - הניחו לאורגנואידים לשקוע, הסירו את מאגר הכביסה והוסיפו 200 μL של נוגדן משני מצומד פלואורסצנטי בחסימת O/N ב-4°C. לאחר הוספת נוגדנים משניים פלואורסצנטיים, שמור את האורגנואידים בחושך כדי למנוע הלבנה של האות.
- תן לאורגנואידים לשקוע, הסר את תערובת הנוגדנים המשנית ושטוף את האורגנואידים באמצעות 500 μL של 0.02% Tx במשך 60 דקות ב- RT. חזור על הפעולה שלוש פעמים.
- הכתימו את האורגנואידים בתמיסת DAPI (0.25 מיקרוגרם/מ"ל) של 200 מיקרוליטר לצביעה גרעינית במידת הצורך. דגרו על הדגימות במשך 60 דקות ב-RT על נדנדה-שייקר.
- תן לאורגנואידים לשקוע, הסר תמיסת DAPI ושטוף את האורגנואידים ב 500 μL של PBS במשך 15 דקות ב- RT. חזור על הפעולה שלוש פעמים.
- תנו לאורגנואידים לשקוע והוציאו את כל עודפי הנוזלים. הוסף 10 μL של תמיסת ניקוי לאורגנואידים ודגר במשך 15 דקות ב- RT.
הערה: תמיסת הסליקה צמיגית, לכן יש לחתוך את החלק החיצוני של קצה פיפטה של 20 μL לפני ביצוע תמיסת הסילוק. ניתן להוסיף פתרון ניקוי נוסף אם נעשה שימוש בספייסר גדול יותר להדמיה. ניתן להשתמש בתמיסת הרכבה במקום בתמיסת הסליקה כאשר לא מנקים את האורגנואידים. פתרון הניקוי מפחית את הרקע בעת ההדמיה ומגדיל את עומק ההדמיה. - הניחו ספייסר דו-צדדי דביק בקוטר 4 בארות בקוטר 0.05 מ"מ על שקופית מיקרוסקופ. הוסף את 10 μL של תמיסת ניקוי עם האורגנואידים בבאר אחת ומניחים מחליק כיסוי על גבי הספייסר.
הערה: ניתן גם להרכיב אורגנואידים ללא שימוש בספייסר. הספייסר שומר על צורת האורגנואיד שלמה ומונע שיטוח של האורגנואידים. - השאר את השקופית ב- RT O/N כדי לנקות את האורגנואידים. לאחסון לטווח ארוך, שמור את המגלשות בטמפרטורה של 4°C. רכוש תמונות באמצעות מערכת מיקרוסקופיה קונפוקלית.
תוצאות
הוושט מחולק לשכבות שונות: אפיתל, lamina propria, submucosa, ו muscularis externa (איור 1A). פיברובלסטים שוכנים בתוך התת-רירית והלמינה פרופריה, המכונה סטרומה. בפרוטוקול הזה, השרירים החיצוניים מוסרים באופן מכני (איור 1B), מה שלא מוביל לאובדן של פיברובלסטים (PdgfrαH2BeGFP+) השוכנים בסטרומה (איור 1C). לפני הדיסוציאציה, האפיתל מופרד מהסטרומה וכתוצאה מכך נוצרים שני מקטעי רקמה (איור 1B). הפרדת שתי השכבות מספקת הזדמנות להאריך את זמן הדיסוציאציה של שכבת האפיתל החזקה יותר בהשוואה לשכבת הסטרומה השברירית. בדרך זו נוצר פרוטוקול בידוד יעיל שמניב גם תאי אב אפיתליאליים בני קיימא וגם פיברובלסטים של סטרומה (איור 1B). תאי אב של הוושט ממוינים בהתבסס על ביטוי INTEGRIN-β4 ו-E-CADHERIN הגבוה שלהם (איור 1C,D).
ניתן לבודד תת-אוכלוסיות של פיברובלסטים באמצעות סמנים מובחנים. בפרוטוקול זה, ניתנת אסטרטגיה לבידוד פיברובלסטים המבוססת על סמני פיברובלסטים נפוצים PDGFRα ו- DPP4 (CD26). בידוד על-ידי ביטוי הכתב PdgfrαH2BeGFP או נוגדן DPP4 מראה שכ-50% מהתאים המבודדים הם פיברובלסטים (איור 1E,F). בנוסף, 70% מהפיברובלסטים PDGFRα+ הם DPP4+, מה שמצביע על כך שמתקבלת אוכלוסיית פיברובלסטים חופפת במידה רבה, אך לא זהה. לאחר בידוד אוכלוסיות תאי אפיתל וסטרומה, תאי אב לוושט מתורבתים לבד או יחד עם פיברובלסטים בכיפת מטריצה. כדי לחקור את התרומה של פיברובלסטים להיווצרות אורגנואידים, התרבות המשותפת נשמרת בתווך מופחת גורם גדילה (איור 1G).
תאי אב לוושט יוצרים אורגנואידים בנוכחות EGF, NOGGIN ו- RSPO (ENR). הסרת NOGGIN והפחתת כמות RSPO (25 ng / μL; ERנמוך) מספיק כדי למנוע היווצרות אורגנואידים (איור 2A). באופן מעניין, הוספת פיברובלסטים DPP4+ או PDGFRα+ לתאי האב של הוושט בתווךהנמוך של חדר המיון משחזרת את יכולת יצירת האורגנואידים, ומדגימה תפקוד תומך עבור שתי אוכלוסיות הפיברובלסטים (איור 2A-D). הדמיה של טרנסגן PdgfrαH2BeGFP מראה שפיברובלסטים נמצאים בקשר הדוק עם תאי האב של האפיתל במהלך היווצרות אורגנואידים (איור 2A). ביום 6, פיברובלסטים מסוג PdgfrαH2BeGFP+ עדיין נמצאים בשפע בתרבות המשותפת. פיברובלסטים נמצאים בכל רחבי הכיפה, ליד האורגנואידים ונוגעים בהם (חץ מלא), או מחוברים לאורגנואידים (ראש חץ; איור 2D).
צביעת הר שלם מראה ייצוג תלת-ממדי של האינטראקציה של הפיברובלסטים עם האורגנואידים (איור 3). בעוד שניתן לבצע את כל פרוטוקול ההרכבה ללא שימוש בתמיסת ניקוי, זה מפחית את השקיפות ואת חדירת הלייזר של האורגנואיד (איור 3B, z-view). בעת הרכבת אורגנואידים, הספייסר מסייע לשמור על מורפולוגיה אורגנואידית. לעומת זאת, ציפוי הכיסוי ישירות על האורגנואידים (ללא ספייסר) משטח את האורגנואידים וגורם לאובדן מבנה האורגנואידים (איור 3A,B).
גם הפיברובלסטים DPP4+ וגם PDGFRα+ כרוכים סביב האורגנואידים (איור 3C, וידאו1 ווידיאו 2). הבחנה של אורגנואידים הוושט ניתן להעריך באמצעות סמנים שונים. איור 4 מראה שפרוטוקול הצביעה שסופק מתאים לקרטין קל יותר להכתמה (KRT14/13) כמו גם לגורמי שעתוק קשים יותר להכתמה (TRP63/KLF4). פרוטוקול התרבית המשותפת מייצר אורגנואידים בעלי דפוס התמיינות דומה, כפי שהודגם in vivo13,14 וכפי שניתן לראות באורגנואידים הגדלים בתווך ENR; תאי אב KRT14+ או TRP63+ יוצרים את השכבה החיצונית ותאים ממוינים KRT13+ או KLF4+ מכוונים פנימה.
פרוטוקול זה מספק כלי לחקר נישת תאי הגזע של הוושט במבחנה וממחיש את האינטראקציה בין אורגנואידים לפיברובלסטים. על ידי יישום פרוטוקול לבידוד פיברובלסטים באמצעות נוגדנים, השיטה ניתנת להתאמה וניתן להשתמש בה לחקר תת-אוכלוסיות פיברובלסטים ללא צורך בעכברים טרנסגניים.
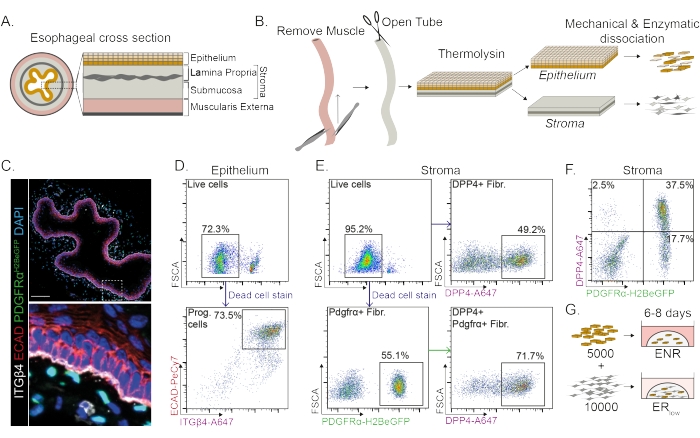
איור 1: בידוד של תאי אב ותת-אוכלוסיות פיברובלסטים מהוושט . (A) סקירה סכמטית של השכבות השונות בוושט. הסטרומה מכילה את lamina propria ו submucosa. (ב) סקירה סכמטית של פרוטוקול הבידוד. השריר (muscularis externa) מוסר באופן מכני באמצעות מלקחיים; הוושט הנותר נחתך ומודגר בתרמוליזין כדי להפריד את שכבת האפיתל מהסטרומה. האפיתל והסטרומה מופרדים, נטחנים מכנית ומתעכלים אנזימטית לתרחיפים של תא בודד. לאחר מכן תאים מנותקים מוכתמים ומוכנים ל-FACS. (C) חתך רוחב של הוושט שהופשט מהשרירים החיצוניים מראה פיברובלסטים PdgfrαH2BeGFP+ בסטרומה. INTEGRIN-β4 (ITGβ4) ו- E-CADHERIN (ECAD) תאים חיוביים כפולים הם תאי אב אפיתל של הוושט. סרגל קנה מידה = 100 מיקרומטר. (D) ציטומטריית זרימה מייצגת תרשים של בידוד תאי אפיתל המראה את אחוז התאים החיים (פאנל עליון) מכל התאים הבודדים. הלוח התחתון מציג את אחוז תאי האב המבודדים מסוג ITGβ4+ ECAD+ (Prog.) מכל התאים החיים. (E) תרשים ציטומטריית זרימה מייצג של בידוד תאי סטרומה המראה את אחוז התאים החיים (פאנל שמאלי עליון). תרשימי ציטומטריה של זרימה מייצגת המציגים את אחוז הפיברובלסטים המבודדים DPP4+ (Fibr.; פאנל ימני עליון) ופיברובלסטים Pdgfrα+ (פאנל שמאלי תחתון) של כל התאים החיים. 70% מהפיברובלסטים Pdgfrα+ הם גם DPP4+ (פאנל ימני תחתון). (F) תרשים ציטומטריית זרימה מייצג של הסטרומה המציג תאים בלבד DPP4+ (2.5%), תאי DPP4+ PDGFRα+ (37.5%) ותאי PDGFRα+ בלבד (17.7%). האחוזים הם של כל התאים החיים. (G) תאי אפיתל בלבד מצופים בכיפת מטריצה בנוכחות 50 ng/μL EGF, 100 ng/μL NOGGIN ו-250 ng/μL RSPO (ENR), או יחד עם פיברובלסטים בנוכחות EGF וריכוז נמוך של RSPO (25 ng/μL). אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
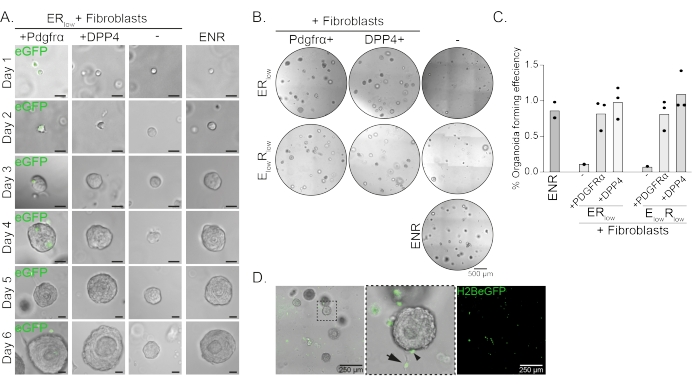
איור 2: תוצאות מייצגות של תרביות אורגנואידים. (A) תמונות ברייטפילד המראות גדילה של האורגנואידים מהיום הראשון עד היום השישי. תמונות השדה הבהיר עם האורגנואידים בתרבית משותפת עם פיברובלסטים PdgfrαH2BeGFP+ מראות גם את אות ה-eGFP הגרעיני. סרגל קנה מידה = 25 מיקרומטר. (B) תמונות שדה בהיר של כל כיפת המטריצה ביום 6. העמודה השמאלית מראה תרביות אורגנואידים שגדלו בנוכחות פיברובלסטים Pdgfrα+ ב- ER נמוך או EנמוךRנמוך בינוני. העמודה האמצעית מציגה תרביות אורגנואידים שגדלו בנוכחות פיברובלסטים DPP4+ ב-ER נמוך אוEנמוך Rנמוך בינוני. העמודה הימנית מציגה מונו-תרביות אורגנואידיות הגדלות בתווך ENR. ENR medium = EGF (50 ng/μL), NOGGIN (100 ng/μL) ו-RSPO (250 ng/μL). ERנמוך = EGF ו- RSPO של 25 ננוגרם/מיקרוליטר. E נמוךRנמוך = 5 ng/μL EGF ו- 25 ng/μL RSPO. סרגל קנה מידה = 500 מיקרומטר. (C) גרף המציג את יעילות יצירת האורגנואידים (%) (כלומר, אחוז התאים המרכיבים אורגנואידים בתנאי תרבית שונים). כל נקודה מייצגת כיפת מטריצה והסרגל מייצג את הממוצע של כל הנקודות לכל תנאי. (D) תמונה בהירה ופלואורסצנטית של אורגנואידים מיום 6 בתרבית משותפת עם פיברובלסטים PdgfrαH2BeGFP+. פיברובלסטים PdgfrαH2BeGFP+ נמצאים בכל רחבי הכיפה, מחוברים לאורגנואידים (ראש החץ), ואינם מחוברים אך באים במגע עם האורגנואידים (חץ מלא). סרגל קנה מידה = 250 מיקרומטר. לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
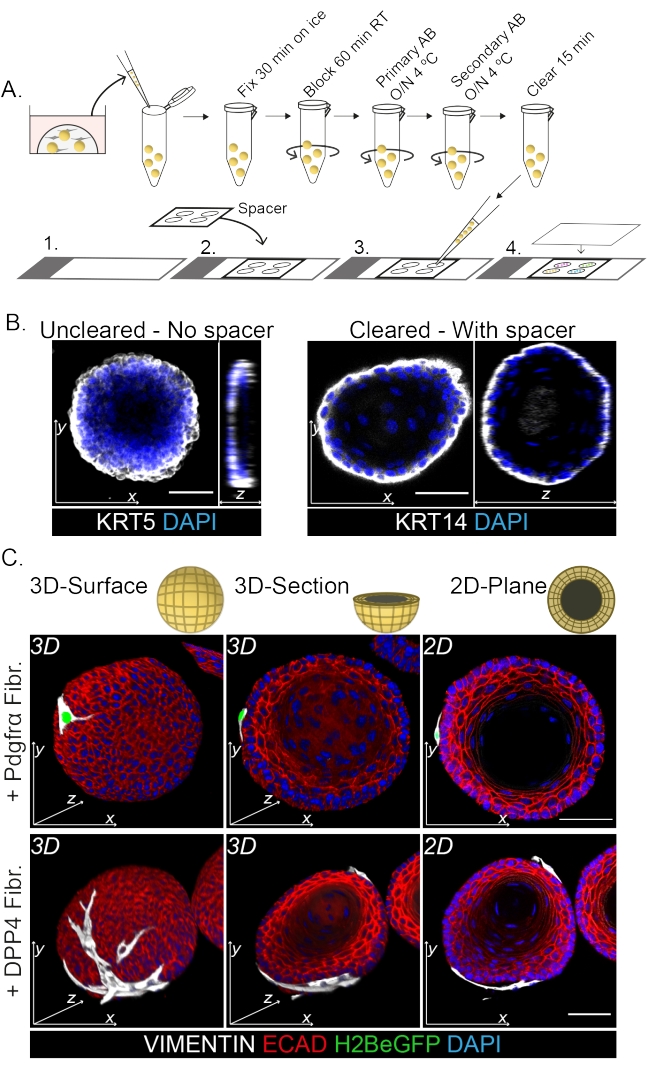
איור 3: פרוטוקול צביעת הר שלם לחקר אינטראקציות פיברובלסט-אורגנואידים . (A) סקירה סכמטית של כל פרוטוקול האימונופלואורסנציה של ההר. AB = נוגדן. (B) תמונה אימונופלואורסצנטית של צביעת הר שלם שלא נוקתה המראה ירידה בשקיפות ובחדירה של אור הלייזר בהשוואה לאורגנואידים שפונו. היעדר ספייסר גורם להשטחת האורגנואיד ולאובדן המורפולוגיה של האורגנואידים. (C) תמונות שלמות של האורגנואידים בתרבית משותפת מראות משטחים תלת-ממדיים של האורגנואידים עם פיברובלסטים מסוג VIMENTIN+ (Fibr.) כרוכים סביב האורגנואיד ובמגע הדוק איתו. חתכים תלת-ממדיים ותמונות מישור דו-ממדיות מראים את לומן האורגנואיד. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
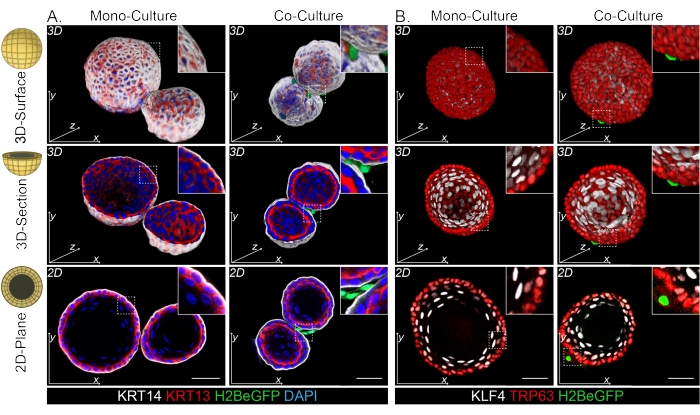
איור 4: תמונות שלמות חושפות אוכלוסיות נפרדות של תאים בזאליים ועל-בזאליים . (A) צביעה מלאה של אורגנואידים חד-גוניים ומשולבים בתרבית עם פיברובלסטים PdgfrαH2BeGFP+ המראים תאי בסיס KRT14+ בשכבה החיצונית ותאים על-בזאליים ממוינים KRT13+. סרגל קנה מידה = 50 מיקרומטר. (B) צביעה בהרכבה שלמה של אורגנואידים חד-ממדיביים ומשותפים עם פיברובלסטים PdgfrαH2BeGFP+ המראים תאי בסיס TRP63+ בשכבה החיצונית ותאים על-בזאליים ממוינים KLF4+. סרגל קנה מידה = 50 מיקרומטר. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
טבלה 1: טבלה המתארת את מרכיבי המדיה של תרבית אורגנואידים. אנא לחץ כאן כדי להוריד טבלה זו.
וידאו 1: פיברובלסט PdgfrαH2BeGFP+ כרוך סביב ובא במגע הדוק עם האורגנואיד. הווידיאו מלווה את הפאנל העליון של איור 3C. סרגל קנה המידה באיור 3C הוא 50 מיקרומטר, והאורגנואיד הוא ~120 מיקרומטר בקוטר. VIMENTIN מוצג בלבן, E-CADHERIN באדום, PdgfrαH2BeGFP בירוק ו-DAPI בכחול. אנא לחץ כאן כדי להוריד סרטון זה.
וידאו 2: פיברובלסט DPP4+ כרוך סביב ובא במגע הדוק עם האורגנואיד. הסרטון מלווה את הפאנל התחתון של איור 3C. סרגל קנה המידה באיור 3C הוא 50 מיקרומטר, והאורגנואיד הוא ~120 מיקרומטר בקוטר. VIMENTIN מוצג בלבן, E-CADHERIN באדום, ו- DAPI בכחול. אנא לחץ כאן כדי להוריד סרטון זה.
Discussion
הפרוטוקול המוצג כאן קובע מודל במבחנה לחקר אינטראקציות אפיתל-פיברובלסטים פונקציונליים בוושט.
שכבת האפיתל מופרדת מהסטרומה, מה שמאפשר פרוטוקול דיסוציאציה אופטימלי הן לתא האפיתל והן לתא הסטרומה. למרות אופטימיזציה של פרוטוקול דיסוציאציה אפיתל, גושי רקמות עדיין ניכרים. עלייה וירידה נמרצת כל 15 דקות מקטינה את מספר וגודל הגושים באופן משמעותי. פרוטוקולים אחרים משתמשים בטריפסין כדי לנתק עוד יותר את שכבת האפיתל 5,6. כאן, השימוש בטריפסין, או הגדלת זמן הדיסוציאציה עוד יותר, אינו מומלץ, שכן זה נוטה לגרום לירידה בכדאיות תאי האפיתל וביעילות יצירת אורגנואידים. בניגוד לאפיתל, הסטרומה מנותקת בקלות, ו-30 דקות בתמיסת דיסוציאציה גורמות לתרחיף חד-תאי עם ~90% כדאיות פיברובלסטים (איור 1E). אי הכללת שלב ההפרדה האפיתל-סטומלי בפרוטוקול מאריכה את זמן הדיסוציאציה באופן משמעותי, וכתוצאה מכך הכדאיות הפיברובלסטים יורדת והתשואה הנמוכה יותר של תאי אפיתל. בנוסף, הפרדת האפיתל מהסטרומה מספקת הזדמנות לקבוע את מספרי התאים של כל אוכלוסייה ולערבב תאי אפיתל ופיברובלסטים מקווי עכברים שונים בעת הגדרת התרביות המשותפות.
חקר תפקוד הפיברובלסטים על גדילת אורגנואידים היא שיטה נפוצה בביולוגיה של תאי גזע 9,10,11,15,16. מדיה מבוססת של תרבות משותפת היא DMEM בתוספת 10% סרום עגל עוברי (FCS) 9,15 או גורם גדילה מופחתבינוני 10,16. בפרוטוקול זה, המדיום המופחת של גורם הגדילה משמש לחיקוי התנאים בנישת תאי הגזע in vivo, שבה הפיברובלסטים שקטים במידה רבה. FCS הוא סרום עשיר בגורם גדילה המביא להפעלה והתפשטות של פיברובלסטים בתרביות המשותפות, ככל הנראה מתאים למצב תאי פיברובלסט שונה ממצב in vivo. על ידי הרחקת FCS והפחתת גורמי גדילה, כך שהמדיום לבדו (ERנמוך) אינו תומך בצמיחת אורגנואידים ואינו מעודד התפשטות פיברובלסטים, ניתן לבודד את השפעת הפיברובלסטים על צמיחת האורגנואידים. במדיום זה, NOGGIN מוסר ו- RSPO מופחת למינימום (10% RPSO). גם NOGGIN וגם RSPO הוכחו כחיוניים לצמיחת אורגנואידים בוושט6. EGF נשמר במדיום התרבות המשותפת, מכיוון שהוא אינו תומך בגידול אורגנואידים בפני עצמו. עם זאת, פיברובלסטים מסוגלים גם לתמוך בצמיחת אורגנואידים בתווך מופחת EGF (E low Rlow; איור 2B,D).
תרביות אורגנואידים אינן יכולות להתקיים באמצעות מעבר מכיוון שפיברובלסטים אובדים במהלך טריפסיניזציה. עם זאת, העברת אורגנואידים נכללה בפרוטוקול מכיוון שניתן לתחזק, להרחיב ולהשתמש באורגנואידים של הוושט לניסויים נוספים כמונו-תרבויות. ניתן להשתמש באורגנואידים שעברו ממונו-תרבויות כדי להקים תרביות משותפות עם פיברובלסטים שזה עתה בודדו. החיסרון בשימוש בתאים ראשוניים הוא מספר העכברים הדרושים להקמת תרביות אורגנואידים מרובות. כאשר מתמקדים בתת-אוכלוסיות קטנות של פיברובלסטים, מספר התרביות המתקבלות מוגבל. בפרוטוקולים אחרים, פיברובלסטים מורחבים תחילה בתרבית לפני השימוש בהם להקמת תרביות אורגנואידים10. עם זאת, פיברובלסטים משנים מורפולוגיה וזהות במהלך המעבר, כפי שניתן לראות באמצעות פיברובלסטים ראשוניים של העור והלב17,18. מעבר דו-ממדי קונבנציונלי של פיברובלסטים בוושט גורם הן לשינויים במורפולוגיה והן בפנוטיפ, מה שמוכיח כי העשרת פיברובלסטים במבחנה אינה מתאימה לתרביות משותפות שמטרתן פנוסקופיה של נישת תאי הגזע האנדוגניים.
צביעת הרכבה שלמה מספקת כלי לתחזוקה ולהדמיה של אינטראקציה פיברובלסט-אורגנואידים. יש לציין שבעוד שלא לכל האורגנואידים יהיו פיברובלסטים המחוברים אליהם ישירות, רוב האורגנואידים באים במגע עם פיברובלסטים (ראו איור 2C). כדי לשמור על אינטראקציות אפיתל-פיברובלסט, חשוב לטפל באורגנואידים בזהירות ולהימנע מפיפטינג נמרץ, מערבולות וספינינג במהירות גבוהה. קיבוע אופטימלי חשוב כדי לשמור על ארכיטקטורת רקמות 3D, כמו גם לשמור על פלואורסצנטיות אנדוגנית. קיבוע של 30 דקות מספיק כדי לשמור על אות H2BeGFP והוא אופטימלי עבור הנוגדנים המשמשים בפרוטוקול זה, אולם זה עשוי להשתנות בין פלואורופורים ונוגדנים בשימוש. ניקוי האורגנואידים מפחית את פיזור האור ומשפר את ההדמיה של כל המבנה התלת-ממדי באופן משמעותי. מכיוון שהאורגנואידים קטנים, הניקוי קל ומהיר; עם זאת, הדמיה של אורגנואידים שלמים באמצעות מיקרוסקופ קונפוקלי סורק לייזר יכולה לגזול זמן, מכיוון שיש צורך ליצור ערימות Z מרובות. ניתן להשתמש במיקרוסקופ קונפוקלי, כמו הדיסק המסתובב, כדי לקצר את זמן ההדמיה.
באופן כללי, אורגנואידים של הוושט הגדלים בנוכחות פיברובלסטים מספקים כלי רב ערך להבנת היבטים של נישת תאי הגזע של הוושט. בנוסף, ניקוי הר שלם מספק שיטה נגישה כדי לדמיין את האינטראקציה בין פיברובלסטים ואורגנואידים.
Disclosures
המחברים מצהירים כי אין ניגוד עניינים.
Acknowledgements
מחקר זה נתמך על ידי ERC StG TroyCAN (851241). א"א הוא עמית פוסט-דוקטורט ב-Cancerfonden. מ.ג. הוא עמית Ragnar Söderberg וחוקר זוטר בתחום הסרטן. אנו אסירי תודה על הסיוע הטכני ממתקני הליבה של מכון קרולינסקה, כולל מתקן הליבה של Biomedicum Flow Cytometry, ליבת ההדמיה הביומדית (BIC) ומתקן בעלי החיים Comparative Medicine Biomedicum (KMB). אנו מודים לחברי מעבדת גננדר על שקראו בעיון את הפרוטוקול והעירו עליו.
Materials
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
References
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836 (2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved