Method Article
Caracterización funcional y visualización de fibroblastos esofágicos mediante cocultivos organoides
En este artículo
Resumen
Los cocultivos organoide-fibroblastos proporcionan un modelo para estudiar el nicho de células madre in vivo . Aquí, se describe un protocolo para los cocultivos organoide-fibroblastos esofágicos. Además, se utilizan imágenes de montaje completo para visualizar la interacción fibroblasto-organoide.
Resumen
Las células madre epiteliales y progenitoras contribuyen a la formación y mantenimiento de la barrera epitelial durante toda la vida. La mayoría de las poblaciones de células madre y progenitoras están escondidas en lugares anatómicamente distintos, lo que permite interacciones exclusivas con señales de nicho que mantienen la derivación. Si bien el desarrollo de cultivos de organoides epiteliales proporciona una herramienta poderosa para comprender el papel de las células madre y progenitoras en la homeostasis y la enfermedad, la interacción dentro del entorno de nicho está ausente en gran medida, lo que dificulta la identificación de los factores que influyen en el comportamiento de las células madre. Los fibroblastos juegan un papel clave en la dirección del tallo epitelial y el destino del progenitor. Aquí, se presenta un protocolo integral de cocultivo organoide-fibroblasto que permite la delineación de subpoblaciones de fibroblastos en la renovación y diferenciación de células progenitoras esofágicas. En este protocolo, se describe un método para aislar tanto las células epiteliales como los fibroblastos en paralelo del esófago. Se describen distintas estrategias de clasificación celular activada por fluorescencia para aislar tanto las células progenitoras esofágicas como las subpoblaciones de fibroblastos de ratones reporteros transgénicos o de ratones de tipo salvaje. Este protocolo proporciona un enfoque versátil que se puede adaptar para adaptarse al aislamiento de subpoblaciones específicas de fibroblastos. El establecimiento y paso de monocultivos de organoides epiteliales esofágicos se incluye en este protocolo, lo que permite una comparación directa con el sistema de cocultivo. Además, se describe un enfoque de limpieza 3D que permite un análisis detallado de imágenes de las interacciones epitelial-fibroblasto. En conjunto, este protocolo describe un método comparativo y de rendimiento relativamente alto para identificar y comprender los componentes del nicho de células madre esofágicas in vitro.
Introducción
Los organoides se utilizan como ensayos 3D in vitro para caracterizar células madre y progenitoras, así como para comprender las señales de señalización derivadas de los componentes celulares del nicho de células madre 1,2,3,4. Los organoides esofágicos de ratón se describieron por primera vez en 2014 y varios artículos han identificado factores de crecimiento, como R-Spondin (RSPO), NOGGIN y factor de crecimiento epidérmico (EGF), necesarios para mantener y pasar organoides esofágicos 5,6,7, argumentando que se requieren señales de señalización similares para in vivo Renovación de células progenitoras. Sin embargo, los factores de crecimiento se añaden comúnmente en concentraciones no fisiológicas, lo que da lugar a condiciones de crecimiento de organoides que no reflejan necesariamente el entorno de señalización in vivo.
Los fibroblastos son poblaciones heterogéneas de células estromales que apoyan las propiedades de las células progenitoras en muchos nichos de células madre8. La combinación de células progenitoras epiteliales y fibroblastos en el mismo cultivo de organoides permite la formación de organoides en concentraciones reducidas de factores de crecimiento suplementados exógenamente. Se describen sistemas de cocultivo de organoides a partir de epitelios intestinales y hepáticos, pero sigue pendiente un protocolo para establecer cocultivos organoides-fibroblastos esofágicos 9,10,11.
En este protocolo, se describen dos estrategias de clasificación celular activada por fluorescencia (FACS) para fibroblastos del esófago, utilizando ratones transgénicos PdgfrαH2BeGFP 12 o ratones de tipo salvaje con tinción clásica de anticuerpos. Se pueden aislar diferentes subpoblaciones de fibroblastos utilizando marcadores de superficie celular de elección, lo que proporciona flexibilidad al protocolo. Además, se utiliza una técnica de imagen de fluorescencia 3D que preserva la morfología organoide para caracterizar las interacciones fibroblasto-organoide. El aclaramiento de organoides proporciona un método rápido para aumentar la profundidad de penetración de la luz en los organoides, mejorando la visualización de las conexiones organoide-fibroblasto y permitiendo la recapitulación de la estructura organoide en su totalidad. Este protocolo combina el cocultivo de organoides esofágicos con una estrategia de imagen de montaje completo, lo que permite la caracterización funcional de la interacción fibroblasto-organoide.
Protocolo
Los experimentos con animales para este estudio fueron aprobados por Stockholms Norra djurförsöksetiska nämnd (permiso ético n.º 14051-2019). Los animales fueron alojados en condiciones libres de patógenos de acuerdo con las recomendaciones de la Federación Europea de la Asociación Europea de Ciencia de Animales de Laboratorio.
1. Preparación
- Descongelar las soluciones madre enzimáticas utilizadas para la disociación (ver Tabla de materiales) en hielo. Descongelar una alícuota de matriz de membrana basal reducida del factor de crecimiento (TFG) (matriz) a 4 °C.
- Preparar el medio de cultivo. Utilice el medio descrito en la Tabla 1 para cultivos organoides y cocultivos y prepárelo antes de comenzar el protocolo.
2. Disección y separación del epitelio esofágico y el estroma
NOTA: Asegúrese de que todos los instrumentos utilizados para la disección y el procesamiento de tejidos sean estériles. Prepare 2 ml de solución de disociación (consulte la Tabla de materiales) en la solución salina balanceada de Hanks (HBSS) por tres esófagos.
- Use una cepa de ratón de su elección, como los ratones C57BL/6J. El desarrollo esofágico en ratones termina después del día postnatal (p) 70, por lo que se recomienda utilizar ratones mayores de p7013. Use cuatro o cinco ratones, ya que proporcionan suficiente material para establecer 8-10 cocultivos de organoides.
NOTA: La eficiencia de formación de organoides disminuye con la edad de los ratones. Si las subpoblaciones específicas de fibroblastos son de interés, es posible que el bajo rendimiento de fibroblastos esté limitando el número de cocultivos de organoides que se pueden establecer. - Utilice ratones modificados genéticamente (por ejemplo, PdgfrαH2BeGFP) o de tipo salvaje (WT) para el aislamiento de poblaciones de fibroblastos. Cuando se utilizan ratones WT, realizar tinción de anticuerpos para aislar subpoblaciones específicas de fibroblastos del estroma a través de FACS.
- Eutanasia a los ratones por asfixia deCO2 . Diseccionar el esófago con fórceps y tijeras de disección. Para extirpar todo el esófago, corte el extremo distal del esófago directamente por encima del estómago y el extremo proximal al comienzo de la tráquea. Sumerge el esófago en PBS y ponlo en hielo.
- Extirpar mecánicamente la muscular externa utilizando un microscopio de disección (rango de aumento total de 8x-40x) y fórceps. Sostenga el extremo distal del esófago disecado con un par de fórceps y use los otros fórceps para agarrar y tirar del músculo desde el extremo distal hasta el extremo proximal del esófago disecado. Retire y deseche la capa muscular.
- Abra el esófago longitudinalmente. Esto funciona mejor usando tijeras de resorte de microdisección con una punta de bola para evitar daños en los tejidos. Sostenga un extremo del esófago para insertar la bola de las tijeras de resorte en la luz del esófago y abra el esófago mientras se sostiene en el extremo.
- Coloque el esófago en un tubo de microcentrífuga de 1,5 ml o en una placa de 24 pocillos. Incubar el esófago abierto en 0,5 mg/ml de termolisina en HBSS a 37 °C en un balancín-agitador durante 15 min. Sumergir el esófago completamente en solución de termolisina.
NOTA: El volumen de la solución de termolisina utilizada depende del tamaño del pozo o tubo. Se pueden colocar varios esófagos y sumergirlos en el mismo pozo o tubo. - Saque el esófago de la solución de termolisina. Use un microscopio de disección para separar cuidadosamente el epitelio esofágico del estroma. Con pinzas finas, agarre tanto el lado epitelial como el lado del estroma del tejido y sepárelos lentamente para separar las dos capas.
NOTA: El estroma se identifica por su aspecto blanco y opaco, en contraste con el epitelio transparente. El estroma contiene la lámina propia y la capa submucosa. - Transfiera la capa epitelial y estromal a dos tubos de microcentrífuga separados de 1,5 ml con 200 μL de solución de disociación en HBSS. Poner en hielo.
3. Aislamiento de células progenitoras esofágicas
NOTA: El aislamiento de células progenitoras esofágicas (paso 2) y fibroblastos (paso 3) se puede realizar simultáneamente. Prepare un tubo de 50 ml de FBS al 1% en HBSS (FBS al 1%).
- Transfiera el epitelio esofágico separado del tubo de microcentrífuga de 1,5 ml (paso 2.8) a una placa de Petri limpia y use un bisturí afilado para picar. Recoger el tejido picado de la placa de Petri con 200 μL de solución de disociación y transferirlo de nuevo al tubo de microcentrífuga de 1,5 ml.
NOTA: El epitelio se pica correctamente cuando las piezas se pueden volver a colocar en el tubo de microcentrífuga de 1,5 ml utilizando una punta de pipeta de 200 μL. - Añadir 800 μL de solución de disociación fresca al tubo de microcentrífuga de 1,5 ml hasta un volumen total de 1 ml.
NOTA: Es importante agregar un volumen suficiente de solución de disociación. Por uno a tres esófagos, se recomienda 1 ml de solución. Amplíe cuando se procesen más esófagos a la vez. - Colocar el tubo con la capa epitelial picada en un balancín a 37 °C durante 60 min. Pipetear la solución hacia arriba y hacia abajo aproximadamente 20 veces usando una punta de pipeta de 200 μL cada 15 minutos para mejorar la digestión.
- Después de 60 minutos, pipetear hacia arriba y hacia abajo otras 20 veces con una punta de pipeta de 200 μL. Pasar la solución a través de un filtro celular de 40 μm a un nuevo tubo de microcentrífuga de 1,5 ml. Centrifugar a 300 x g durante 10 min a 4 °C.
NOTA: Moje el filtro celular con FBS al 1% antes de colar las células para minimizar la adherencia de las células al filtro. El epitelio no se digerirá completamente y los pedazos de tejido aún serán visibles. Sin embargo, una incubación más prolongada disminuirá la supervivencia celular y no dará como resultado un mayor rendimiento de células viables. - Deseche el sobrenadante eliminando el exceso de líquido con una pipeta de 1 ml y vuelva a suspender el pellet en 1 ml de FBS al 1%. Centrifugar a 300 x g durante 10 min a 4 °C.
- Durante la centrifugación, preparar la mezcla de anticuerpos conjugados para el FACS de las células progenitoras esofágicas.
- Mezclar 1 μL de CD324-PE-Cy7 (ECADHERIN) y CD104-A647 (INTEGRIN-β4) en 200 μL de FBS al 1% por millón de células.
NOTA: 1 μL de anticuerpo (200 μL de volumen final) es suficiente para uno o dos esófagos. Cuando procese más esófagos a la vez, aumente el volumen de la solución de tinción de anticuerpos.
- Resuspender el pellet en 200 μL de mezcla de anticuerpos y transferirlo a un tubo de citometría de flujo. Después de agregar anticuerpos fluorescentes, mantenga las suspensiones celulares en la oscuridad para evitar el blanqueamiento de la señal. Incubar las celdas durante 30 min a 4 °C. Añadir 3 ml de FBS al 1% y centrifugar a 300 x g durante 10 min a 4 °C, y luego resuspender las células en un mínimo de 200 μL de 1% de FBS.
NOTA: 500 μL de FBS al 1% se utilizan para hasta cuatro o cinco esófagos. Aumente el volumen cuando se procesan más esófagos a la vez, de modo que se pueda lograr una tasa de flujo FACS de 100-300 eventos / s. Más eventos disminuirán la eficiencia de clasificación, y un aumento en la tasa de flujo disminuirá la supervivencia celular. - Agregue el marcador de tinción de células muertas a una concentración final de 1:10.000, 5 minutos antes de la clasificación del FACS para aislar las células vivas. Clasifique las células progenitoras utilizando una máquina FACS (consulte la Figura 1 para la estrategia de compuerta). Recoger las células en tubos de microcentrífuga de 1,5 ml llenos de 200 μL de medio organoide básico (Tabla 1).
4. Aislamiento de fibroblastos de la capa estromal
- Cortar la capa estomal en trozos finos en un tubo de 1,5 ml que contenga 200 μL de solución de disociación (paso 2.8) utilizando tijeras de disección. El tejido se pica correctamente una vez que la solución se puede pipetear hacia arriba y hacia abajo utilizando una punta de pipeta de 200 μL.
- Añadir 800 μL de solución de disociación fresca al tubo de microcentrífuga de 1,5 ml hasta un volumen total de 1 ml.
NOTA: Es importante agregar un volumen suficiente de solución de disociación. Por uno a tres esófagos, se recomienda 1 ml de solución. Amplíe cuando se procesen más esófagos a la vez. - Colocar el tubo en un balancín a 37 °C durante 30 min. Después de 15 minutos, pipetear la solución hacia arriba y hacia abajo aproximadamente 20 veces con una punta de pipeta de 200 μL para mejorar la digestión.
- Después de 30 minutos de digestión enzimática, pipetear hacia arriba y hacia abajo otras 20 veces con una punta de pipeta de 200 μL. Colar la solución a través de un filtro celular de 70 μm en un nuevo tubo de microcentrífuga de 1,5 ml. Centrifugar a 300 x g durante 10 min a 4 °C.
NOTA: Moje el filtro celular con FBS al 1% antes de colar las células para minimizar la adherencia de las células al filtro. - Deseche el sobrenadante eliminando el exceso de líquido con una pipeta de 1 ml y vuelva a suspender el pellet en 1 ml de FBS al 1%. Centrifugar a 300 x g durante 10 min a 4 °C.
NOTA: Cuando se utiliza una cepa de ratón modificada genéticamente que contiene fibroblastos marcados con fluorescencia, las tinciones de anticuerpos son opcionales. Si no se requieren tinciones de anticuerpos, continúe con el paso 3.7 y transfiera la muestra a un tubo de citometría de flujo.- Durante la centrifugación, preparar la mezcla de anticuerpos conjugados para el aislamiento de fibroblastos por FACS. Mezclar 1 μL de CD26-APC (DPP4) en 200 μL de FBS al 1% por millón de células.
NOTA: 1 μL de anticuerpo es suficiente para uno o dos esófagos. Cuando procese más esófagos a la vez, aumente el volumen de la solución de tinción de anticuerpos.
- Durante la centrifugación, preparar la mezcla de anticuerpos conjugados para el aislamiento de fibroblastos por FACS. Mezclar 1 μL de CD26-APC (DPP4) en 200 μL de FBS al 1% por millón de células.
- Resuspender el pellet en 200 μL de mezcla de anticuerpos conjugados en FBS al 1% y transferir a un tubo de citometría de flujo. Incubar las celdas durante 30 min a 4 °C.
- Añadir 3 ml de FBS al 1% y centrifugar a 300 x g durante 10 min a 4 °C. Resuspender las células en un mínimo de 200 μL de 1% de FBS.
NOTA: 500 μL de FBS al 1% se utilizan para hasta cuatro o cinco esófagos. Aumente el volumen cuando se procesan más esófagos a la vez, de modo que se pueda lograr una tasa de flujo de 100-300 eventos / s. Más eventos/s disminuirán la eficiencia de clasificación, y el aumento de la tasa de flujo disminuirá la supervivencia celular. Después de agregar anticuerpos fluorescentes, las suspensiones celulares deben mantenerse oscuras para evitar el blanqueamiento de la señal. - Agregue el marcador de tinción de células muertas a una concentración final de 1:10.000, 5 minutos antes de la clasificación del FACS para aislar las células vivas. Ordene las celdas utilizando una máquina FACS (consulte la Figura 1 para conocer la estrategia de compuerta). Recoger las células en tubos de microcentrífuga de 1,5 ml llenos de 200 μL de medio organoide básico (Tabla 1).
5. Establecimiento y cultivo de organoides esofágicos
NOTA: Precaliente ERbajo (cocultivo de organoides), medio ENR (organoide) (ver Tabla 1 para la descripción) y una placa de 48 pocillos a 37 °C. Coloque la matriz descongelada (preparada en el paso 1) alícuota sobre hielo. Se recomienda utilizar la matriz proporcionada aquí (consulte la Tabla de materiales) para el cultivo de organoides esofágicos de ratón, ya que otras marcas de matriz afectan negativamente la eficiencia de formación de organoides.
- Para el cocultivo de organoides, mezclar las células epiteliales y fibroblastos clasificados en una proporción de 1:2 en un tubo. Para cada cúpula de matriz, utilice 5.000 células epiteliales y 10.000 fibroblastos. Cuando se prepare para más domos, agregue un múltiplo de 5,000 células epiteliales y 10,000 fibroblastos a un tubo. Para cultivos organoides sin fibroblastos, utilizar 5.000 células epiteliales por cúpula de matriz.
- Centrifugar la población celular mixta a 300 x g durante 5 min. Deseche el sobrenadante retirándolo cuidadosamente con una pipeta de 200 μL.
- Lavar las células una vez resuspendiendo el pellet en medio organoide básico frío y centrifugar a 300 x g durante 5 min. Coloque las celdas en hielo.
- Preparar una mezcla compuesta por un 80% de matriz y un 20% de medio organoide básico frío. Coloque todo en hielo a medida que la matriz se solidifica a temperatura ambiente (RT).
- Deseche el sobrenadante después de la centrifugación retirándolo cuidadosamente con una pipeta de 200 μL. Resuspender las células en 10 μL de mezcla de matriz/cúpula y volver a ponerlas en hielo.
- Tome la placa precalentada de 48 pocillos de la incubadora a 37 °C y haga una cúpula de matriz por pocillo con una pipeta de 20 μL. Cada domo contiene 10 μL de matriz al 80%, 5.000 células epiteliales y 10.000 fibroblastos. Transfiera la placa boca abajo a una incubadora y deje que los domos se solidifiquen durante otros 20-30 minutos a 37 ° C.
NOTA: Una disminución en el volumen de la cúpula de la matriz y / o un aumento en el número de células afectará la eficiencia de formación de organoides. - Agregue 200 μL de ERbajo medio precalentado (Tabla 1) a las cúpulas matriciales que contienen cocultivos organoides y medio ENR (Tabla 1) a las respectivas cúpulas de matriz que contengan solo organoides epiteliales y coloque la placa en la incubadora.
- Cultivar los organoides a 37 °C y 5% deCO2. Durante los primeros 2 días, complemente el medio con un inhibidor de roca de 10 μM (Y-27623). El inhibidor de roca previene la muerte celular inducida por estrés y aumenta la posibilidad de un establecimiento exitoso de cultivos de organoides.
- Actualice el medio cada 2-3 días. Asegúrese de que el medio esté caliente para evitar la disociación de la matriz sensible a la temperatura.
- Realizar análisis del experimento de 6 a 8 días después del enchapado. Los organoides se pueden mantener en cultivo hasta por 14 días. Alrededor del día 14, se observa pérdida de la integridad del domo.
6. Transmisión de organoides
NOTA: El paso de organoides cultivados en cocultivo resulta en la pérdida de fibroblastos. Por lo tanto, se recomienda utilizar medio ENR para todos los organoides cuando se pasan. Precaliente ENR, PBS y una placa de 48 pocillos a 37 °C.
- Retire el medio y lave el pozo que contiene la cúpula de la matriz con PBS precalentado. Añadir 200 μL de solución fría de tripsina al 0,25% y pipetear hacia arriba y hacia abajo para romper la cúpula de la matriz.
NOTA: Se recomienda el uso de tripsina fría al 0,25%, ya que la matriz es sensible a la temperatura y esto ayuda a descomponer las cúpulas de la matriz. - Incubar los organoides con tripsina a 37 °C durante ~20 min. Pipetear hacia arriba y hacia abajo después de 10 minutos para aumentar la disociación de los organoides. Monitoree el proceso de disociación con un microscopio cada 5-10 min. Dado que la tripsina disminuye la viabilidad celular, esto puede ayudar a identificar el tiempo de disociación ideal.
- Después de 20 minutos, pipetear los organoides hacia arriba y hacia abajo con una pipeta de 200 μL para disociar los organoides. Recoja las células en un tubo de microcentrífuga de 1,5 ml, agregue 1 ml de medio organoide básico y centrifugar a 300 x g durante 5 minutos a RT.
- Opcional: Para garantizar las mejores condiciones de crecimiento de organoides y que los nuevos organoides se deriven de células individuales, cuele las células a través de un filtro celular prehumedecido de 40 μm. El filtrado de la suspensión celular da como resultado la eliminación de núcleos de organoides y grupos celulares que son difíciles de disociar.
- Preparar una mezcla matricial compuesta por 80% de matriz y 20% de medio organoide básico frío. Coloque todo en hielo, ya que la matriz se solidifica en RT.
- Deseche el sobrenadante retirándolo cuidadosamente con una pipeta de 200 μL, resuspenda las células en 10 μL de mezcla/cúpula de matriz y vuelva a poner la mezcla en hielo.
NOTA: Los organoides se pueden dividir en una proporción de 1:5 a 1:10, dependiendo de la densidad del domo. Las células epiteliales también se pueden contar y volver a colocar en 5.000 células / domo. - Tome la placa precalentada de 48 pocillos de la incubadora a 37 °C y haga una cúpula por pocillo. Transfiera la placa boca abajo a una incubadora y deje que los domos se solidifiquen durante otros 20-30 minutos a 37 ° C.
- Añadir 200 μL de medio ENR precalentado a las cúpulas organoides respectivas. Complementar el medio con 10 μM Rock-inhibitor (Y-27623) durante los primeros 2 días.
- Actualice el medio cada 2-3 días. Asegúrese de que el medio esté caliente para evitar la disociación de la matriz sensible a la temperatura.
7. Procesamiento de organoides para tinción de montaje completo
NOTA: Cubra las puntas y los tubos con un 10% de FBS en PBS antes de usarlos para evitar que los organoides se adhieran a los plásticos. Para las puntas de pipeta, es suficiente pipetear una o dos veces hacia arriba y hacia abajo en una solución FBS/PBS al 10% antes de usar la punta. Para los tubos, llene el tubo con 10% de FBS / PBS y luego retire la solución.
- Retire el medio organoide y agregue 200 μL de PBS helado a las cúpulas de la matriz. Coloque el plato en hielo durante 5-10 min.
- Pipetear hacia arriba y hacia abajo y transferir la solución a tubos no adherentes de microcentrífuga de 0,6 ml. Centrifugar brevemente durante 30-60 s a 100 x g para que los organoides se asienten en el fondo.
NOTA: El exceso de pipeteo y la centrifugación larga rompen los organoides e interrumpen la interacción fibroblasto-organoide. - Retire el exceso de líquido y agregue PBS helado. Centrifugar brevemente durante 30-60 s a 100 x g para que los organoides se asienten en el fondo.
- Retire el exceso de líquido y fije el organoide con 200 μL de formaldehído frío al 4% en solución PBS durante 30 minutos en hielo.
PRECAUCIÓN: El formaldehído es tóxico y siempre debe usarse en una campana extractora de humos químicos. Siempre se deben usar guantes de nitrilo, gafas de seguridad y batas de laboratorio. - La fijación del organoide hace que se hundan, y la centrifugación ya no es necesaria. Deje que los organoides se hundan colocando el tubo en posición vertical y espere 2-3 minutos, retire el formaldehído y agregue 500 μL de PBS frío para eliminar el formaldehído.
- Deje que los organoides se hundan, retire el exceso de PBS y agregue 500 μL de PBS fresco y frío. Deje que los organoides se hundan, elimine el exceso de PBS y agregue 500 μL de tampón de bloqueo (5% de suero de burro normal, 1% de BSA y 0.5% de Triton X-100 en PBS). Coloque el tubo en un balancín durante 60 minutos en RT.
NOTA: El bloqueo también se puede realizar durante la noche (O/N) a 4 °C. - Deje que los organoides se hundan, retire el tampón de bloqueo y resuspenda los organoides en 200 μL de tampón de bloqueo con anticuerpos primarios (consulte la Tabla de materiales). Mantener los organoides en un agitador balancín O/N a 4 °C.
NOTA: Para mejorar la tinción de proteínas nucleares, proteínas de baja expresión o anticuerpos que muestran tinción inespecífica, el tiempo de incubación puede aumentarse durante 1 o 2 días a 4 °C. Colocar los organoides en un balancín-agitador es esencial, ya que evita que los organoides se agrupen y aumenta la eficiencia de la tinción. - Deje que los organoides se hundan, retire la mezcla de anticuerpos primarios y lave los organoides usando 500 μL de Triton X-100 al 0,02% en PBS (0,02% Tx) durante 60 minutos a RT. Repita tres veces.
NOTA: Cuando se necesite una incubación de anticuerpos primarios más prolongada, agregue un paso de lavado con 0.02% de Tx en PBS O/N a 4 °C. - Deje que los organoides se hundan, retire el tampón de lavado y agregue 200 μL de anticuerpo secundario conjugado con fluorescencia en el tampón de bloqueo O/N a 4 °C. Después de agregar anticuerpos secundarios fluorescentes, mantenga los organoides en la oscuridad para evitar el blanqueamiento de la señal.
- Deje que los organoides se hundan, retire la mezcla de anticuerpos secundarios y lave los organoides con 500 μL de Tx al 0,02% durante 60 minutos a RT. Repita tres veces.
- Contrarrestar la tinción de los organoides con 200 μL de solución DAPI (0,25 μg/ml) para la tinción nuclear si es necesario. Incubar las muestras durante 60 minutos en RT en un balancín-agitador.
- Deje que los organoides se hundan, retire la solución DAPI y lave los organoides en 500 μL de PBS durante 15 minutos en RT. Repita tres veces.
- Deje que los organoides se hundan y elimine todo el exceso de líquido. Añadir 10 μL de solución de aclaramiento a los organoides e incubar durante 15 min a RT.
NOTA: La solución de aclaramiento es viscosa, así que corte la parte exterior de una punta de pipeta de 20 μL antes de pipetear la solución de aclaración. Se puede agregar más solución de limpieza si se usa un espaciador más grande para obtener imágenes. Se puede utilizar una solución de montaje en lugar de la solución de limpieza cuando no se limpian los organoides. La solución de limpieza reduce el fondo al crear imágenes y aumenta la profundidad de la imagen. - Coloque un espaciador adhesivo de 4 pocillos de doble cara de 0,05 mm en un portaobjetos de microscopio. Agregue los 10 μL de solución de limpieza con los organoides en un pocillo y coloque un cubreobjetos en la parte superior del espaciador.
NOTA: Los organoides también se pueden montar sin el uso de un espaciador. El espaciador mantiene intacta la forma del organoide y evita que los organoides se aplanen. - Mantenga la diapositiva en RT O/N para limpiar los organoides. Para un almacenamiento prolongado, mantenga los portaobjetos a 4 °C. Adquirir imágenes mediante un sistema de microscopía confocal.
Resultados
El esófago se divide en diferentes capas: epitelio, lámina propia, submucosa y muscular externa (Figura 1A). Los fibroblastos residen dentro de la submucosa y la lámina propia, conocida como estroma. En este protocolo, la muscularis externa se elimina mecánicamente (Figura 1B), lo que no conduce a una pérdida de fibroblastos (PdgfrαH2BeGFP+) que residen en el estroma (Figura 1C). Antes de la disociación, el epitelio se separa del estroma dando como resultado dos segmentos de tejido (Figura 1B). La separación de las dos capas brinda la oportunidad de aumentar el tiempo de disociación para la capa epitelial más robusta en comparación con la frágil capa estromal. De esta manera, se establece un protocolo de aislamiento eficiente que produce tanto células progenitoras epiteliales viables como fibroblastos estromales (Figura 1B). Las células progenitoras esofágicas se clasifican en función de su alta expresión de INTEGRINA-β4 y E-CADHERINA (Figura 1C, D).
Las subpoblaciones de fibroblastos se pueden aislar mediante el uso de marcadores distintos. En este protocolo, se proporciona una estrategia para el aislamiento de fibroblastos basada en los marcadores de fibroblastos PDGFRα y DPP4 (CD26) de uso común. El aislamiento por la expresión del reportero PdgfrαH2BeGFP o el anticuerpo DPP4 muestra que alrededor del 50% de las células aisladas son fibroblastos (Figura 1E, F). Además, el 70% de los fibroblastos PDGFRα+ son DPP4+, lo que indica que se obtiene una población de fibroblastos en gran parte superpuesta, pero no idéntica. Después de aislar las poblaciones de células epiteliales y estromales, las células progenitoras esofágicas se cultivan solas o junto con fibroblastos en una cúpula de matriz. Para estudiar la contribución de los fibroblastos a la formación de organoides, el cocultivo se mantiene en un factor de crecimiento medio reducido (Figura 1G).
Las células progenitoras esofágicas forman organoides en presencia de EGF, NOGGIN y RSPO (ENR). Eliminar NOGGIN y reducir la cantidad de RSPO (25 ng/μL; ERbajo) es suficiente para prevenir la formación de organoides (Figura 2A). Curiosamente, la adición de fibroblastos DPP4 + o PDGFRα + a las células progenitoras esofágicas en el mediobajo del RE restaura la capacidad de formación de organoides, demostrando una función de apoyo para ambas poblaciones de fibroblastos (Figura 2A-D). La visualización del transgén PdgfrαH2BeGFP muestra que los fibroblastos están en estrecho contacto con las células progenitoras epiteliales durante la formación de organoides (Figura 2A). En el día 6, los fibroblastosPdgfrα H2BeGFP+ todavía están abundantemente presentes en el cocultivo. Los fibroblastos están presentes en toda la cúpula, cerca y tocando los organoides (flecha completa), o unidos a los organoides (punta de flecha; Figura 2D).
La tinción de montaje completo muestra una representación 3D de la interacción de los fibroblastos con los organoides (Figura 3). Si bien es posible realizar todo el protocolo de montaje sin el uso de una solución de limpieza, disminuye la transparencia y la penetración láser del organoide (Figura 3B, vista z). Al montar organoides, el espaciador ayuda a mantener la morfología de los organoides. Por el contrario, el recubrimiento directamente sobre los organoides (sin un espaciador) aplana los organoides y resulta en la pérdida de la estructura del organoide (Figura 3A, B).
Tanto los fibroblastos DPP4+ como los PDGFRα+ se encuentran envueltos alrededor de los organoides (Figura 3C, Video1 y Video 2). La diferenciación de los organoides esofágicos se puede evaluar utilizando diferentes marcadores. La figura 4 muestra que el protocolo de tinción proporcionado es adecuado para queratinas más fáciles de teñir (KRT14/13), así como para factores de transcripción más difíciles de teñir (TRP63/KLF4). El protocolo de cocultivo genera organoides con un patrón de diferenciación similar, como se demostró in vivo13,14 y como se ve en organoides cultivados en medio ENR; Las células progenitoras KRT14+ o TRP63+ forman la capa externa y las células diferenciadas KRT13+ o KLF4+ se orientan hacia el interior.
Este protocolo proporciona una herramienta para estudiar el nicho de células madre esofágicas in vitro y visualiza la interacción entre organoides y fibroblastos. Al implementar un protocolo para el aislamiento de fibroblastos utilizando anticuerpos, el método es adaptable y se puede utilizar para estudiar subpoblaciones de fibroblastos sin necesidad de ratones transgénicos.
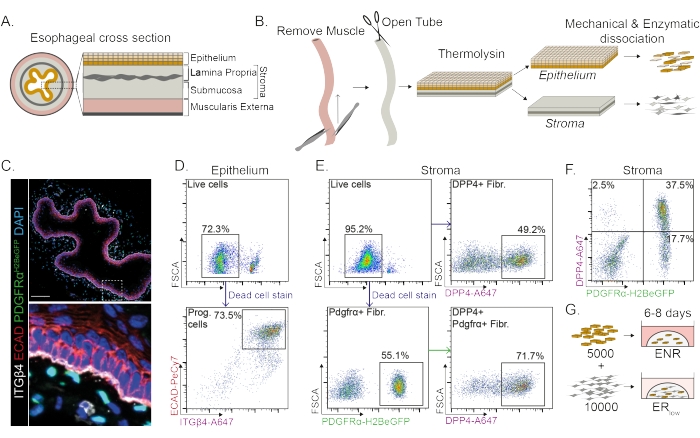
Figura 1: Aislamiento de células progenitoras y subpoblaciones de fibroblastos del esófago . (A) Resumen esquemático de las diferentes capas del esófago. El estroma contiene la lámina propia y la submucosa. (B) Resumen esquemático del protocolo de aislamiento. El músculo (muscularis externa) se extirpa mecánicamente con fórceps; El esófago restante se abre y se incuba en termolisina para separar la capa epitelial del estroma. El epitelio y el estroma se separan, se pican mecánicamente y se digieren enzimáticamente en suspensiones unicelulares. Las células disociadas se tiñen y se preparan para el FACS. (C) Sección transversal del esófago despojado de la muscular externa que muestra fibroblastos PdgfrαH2BeGFP+ en el estroma. Las células INTEGRIN-β4 (ITGβ4) y E-CADHERINA (ECADIN) doble positivas son las células progenitoras epiteliales del esófago. Barra de escala = 100 μm. (D) Gráfico de citometría de flujo representativo del aislamiento de células epiteliales que muestra el porcentaje de células vivas (panel superior) de todas las células individuales. El panel inferior muestra el porcentaje de células progenitoras ITGβ4+ ECAD+ (Prog.) aisladas de todas las células vivas. (E) Gráfico de citometría de flujo representativo del aislamiento de células estromales que muestra el porcentaje de células vivas (panel superior izquierdo). Gráficos de citometría de flujo representativos que muestran el porcentaje de fibroblastos DPP4+ aislados (Fibr.; panel superior derecho) y fibroblastos Pdgfrα+ (panel inferior izquierdo) de todas las células vivas. El 70% de los fibroblastos Pdgfrα+ también son DPP4+ (panel inferior derecho). (F) Gráfico de citometría de flujo representativo del estroma que muestra células DPP4+ solo (2,5%), células PDGFRα+ DPP4+ (37,5%) y células solo PDGFRα+ (17,7%). Los porcentajes son de todas las células vivas. (G) Las células epiteliales solamente se colocan en una cúpula de matriz en presencia de 50 ng/μL EGF, 100 ng/μL NOGGIN y 250 ng/μL RSPO (ENR), o junto con fibroblastos en presencia de EGF y una baja concentración de RSPO (25 ng/μL). Haga clic aquí para ver una versión más grande de esta figura.
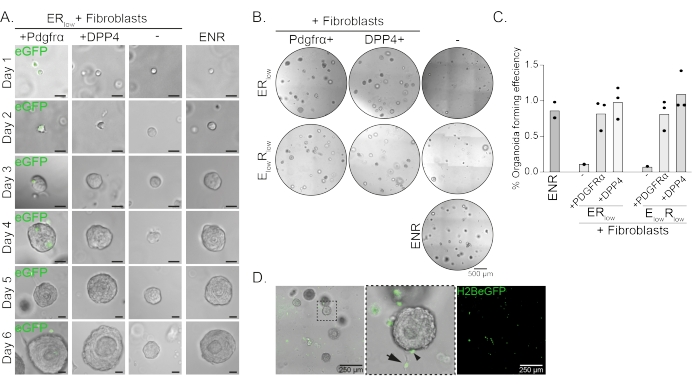
Figura 2: Resultados representativos de cocultivos de organoides. (A) Imágenes de campo claro que muestran el crecimiento de los organoides desde el día 1 hasta el día 6. Las imágenes de campo claro con los organoides cocultivados con fibroblastos PdgfrαH2BeGFP+ también muestran la señal nuclear de eGFP. Barra de escala = 25 μm. (B) Imágenes de campo claro de toda la cúpula de la matriz en el día 6. La columna izquierda muestra cocultivos organoides cultivados en presencia de fibroblastos Pdgfrα+ en ER bajo o E bajo Rbajo medio. La columna central muestra cocultivos organoides cultivados en presencia de fibroblastos DPP4+ en ER bajo o E bajo Rbajo medio. La columna de la derecha muestra monocultivos organoides cultivados en medio ENR. Medio ENR = EGF (50 ng/μL), NOGGIN (100 ng/μL) y RSPO (250 ng/μL). ER bajo = EGF y 25 ng/μLRSPO. E bajoRbajo = 5 ng/μL EGF y 25 ng/μL RSPO. Barra de escala = 500 μm. (C) Gráfico que muestra la eficiencia de formación de organoides (%) (es decir, el porcentaje de células que forman organoides en diferentes condiciones de cultivo). Cada punto representa una cúpula matricial y la barra representa la media de todos los puntos por condición. (D) Imagen fluorescente y de campo claro de organoides del día 6 cocultivados con fibroblastos PdgfrαH2BeGFP+. Los fibroblastos PdgfrαH2BeGFP+ están presentes en toda la cúpula, unidos a los organoides (punta de flecha) y no unidos pero en contacto con los organoides (flecha completa). Barra de escala = 250 μm. Haga clic aquí para ver una versión más grande de esta figura.
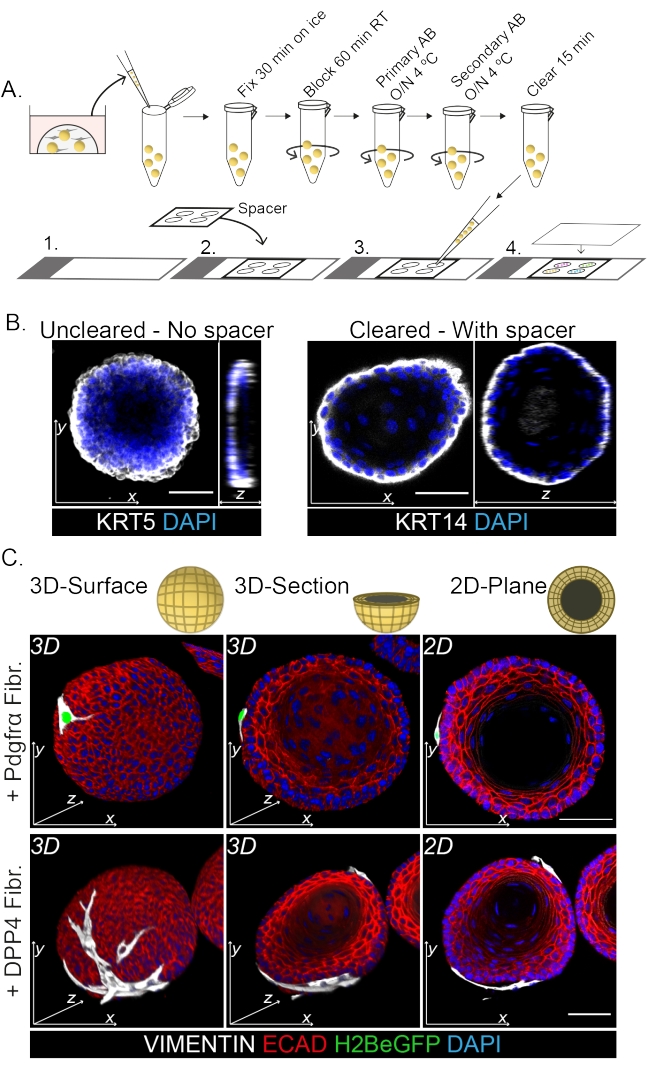
Figura 3: Protocolo de tinción de montaje completo para el estudio de las interacciones fibroblasto-organoide . (A) Resumen esquemático del protocolo de inmunofluorescencia de montaje completo. AB = anticuerpo. (B) Imagen de inmunofluorescencia de tinción de montaje completo no aclarada que muestra una disminución de la transparencia y la penetración de la luz láser en comparación con los organoides eliminados. La ausencia de un espaciador resulta en el aplanamiento del organoide y la pérdida en la morfología del organoide. (C) Las imágenes de montaje completo de los organoides cocultivados muestran superficies 3D de los organoides con fibroblastos VIMENTIN+ (Fibr.) envueltos alrededor y en estrecho contacto con el organoide. Las secciones transversales 3D y las imágenes planas 2D muestran la luz del organoide. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
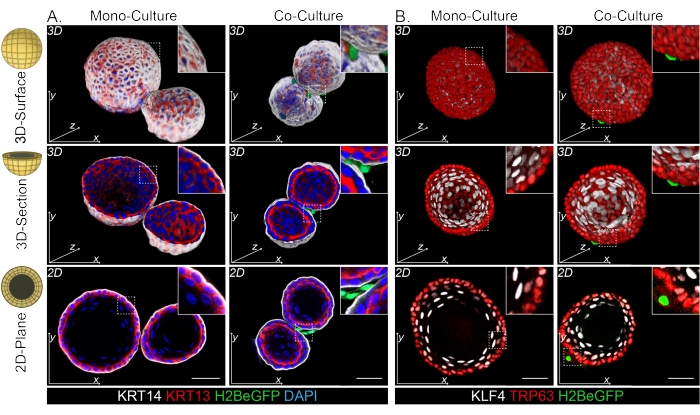
Figura 4: Las imágenes de montaje completo revelan distintas poblaciones de células basales y suprabasales. (A) Tinción de montaje completo de organoides mono y cocultivados con fibroblastos PdgfrαH2BeGFP+ que muestran células basales KRT14+ en la capa externa y células suprabasales diferenciadas KRT13+. Barra de escala = 50 μm. (B) Tinción de montaje completo de organoides mono y cocultivados con fibroblastos PdgfrαH2BeGFP+ que muestran células basales TRP63+ en la capa externa y células suprabasales diferenciadas KLF4+. Barra de escala = 50 μm. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: Tabla que describe los componentes de los medios de cultivo de organoides. Haga clic aquí para descargar esta tabla.
Video 1: Fibroblasto PdgfrαH2BeGFP+ envuelto alrededor y en estrecho contacto con el organoide. El video acompaña al panel superior de la Figura 3C. La barra de escala en la Figura 3C es de 50 μm, y el organoide tiene ~120 μm de diámetro. VIMENTIN se muestra en blanco, E-CADHERIN en rojo, PdgfrαH2BeGFP en verde y DAPI en azul. Haga clic aquí para descargar este video.
Video 2: Fibroblasto DPP4+ envuelto alrededor y en estrecho contacto con el organoide. El video acompaña al panel inferior de la Figura 3C. La barra de escala en la Figura 3C es de 50 μm, y el organoide tiene ~120 μm de diámetro. VIMENTIN se muestra en blanco, E-CADHERIN en rojo y DAPI en azul. Haga clic aquí para descargar este video.
Discusión
El protocolo presentado aquí establece un modelo in vitro para investigar las interacciones epitelial-fibroblastos esofágicas funcionales.
La capa epitelial está separada del estroma, lo que permite un protocolo de disociación optimizado tanto para el compartimento epitelial como para el estromal. A pesar de la optimización del protocolo de disociación epitelial, los grupos de tejido siguen siendo evidentes. Subir y bajar vigorosamente cada 15 minutos disminuye sustancialmente el número y el tamaño de los grupos. Otros protocolos utilizan tripsina para disociar aún más la capa epitelial 5,6. Aquí, el uso de tripsina, o aumentar aún más el tiempo de disociación, no se recomienda, ya que esto tiende a resultar en una disminución de la viabilidad de las células epiteliales y la eficiencia de formación de organoides. En contraste con el epitelio, el estroma se disocia fácilmente, y 30 minutos en solución de disociación da como resultado una suspensión unicelular con ~ 90% de viabilidad de fibroblastos (Figura 1E). La exclusión del paso de separación epitelial-estomal en el protocolo aumenta sustancialmente el tiempo de disociación, lo que resulta en una disminución de la viabilidad de los fibroblastos y un menor rendimiento de las células epiteliales. Además, separar el epitelio del estroma brinda la oportunidad de determinar el número de células de cada población y mezclar células epiteliales y fibroblastos de diferentes líneas de ratón al establecer los cocultivos.
El estudio de la función de los fibroblastos en el crecimiento de organoides es un método comúnmente utilizado en la biología de células madre 9,10,11,15,16. Los medios de cocultivo establecidos son DMEM suplementado con suplementado con suero fetal de ternera (FCS) al 10%9,15 o factor de crecimiento medio reducido10,16. En este protocolo, el medio reducido del factor de crecimiento se utiliza para imitar las condiciones en el nicho de células madre in vivo, donde los fibroblastos son en gran medida inactivos. FCS es un suero rico en factores de crecimiento que resulta en la activación y proliferación de fibroblastos en los cocultivos, probablemente correspondiente a un estado de células de fibroblastos distinto del estado in vivo. Al excluir FCS y reducir los factores de crecimiento, de modo que el medio solo (ERbajo) no apoya el crecimiento de organoides y no estimula la proliferación de fibroblastos, es posible aislar el efecto de los fibroblastos en el crecimiento de organoides. En este medio, NOGGIN se elimina y RSPO se reduce a un mínimo (10% RPSO). Tanto NOGGIN como RSPO han demostrado ser esenciales para el crecimiento de organoides esofágicos6. EGF se mantuvo en el medio de cocultivo, ya que no admite el crecimiento de organoides por sí mismo. Sin embargo, los fibroblastos también son capaces de soportar el crecimiento de organoides en un medio reducido en EGF (E bajo Rbajo; Figura 2B, D).
Los cocultivos de organoides no pueden sostenerse a través del paso, ya que los fibroblastos se pierden durante la tripsinización. Sin embargo, el paso de organoides se incluyó en el protocolo ya que los organoides esofágicos se pueden mantener, expandir y usar para experimentos adicionales como monocultivos. Los organoides pasados de monocultivos se pueden usar para establecer cocultivos con fibroblastos recién aislados. Una desventaja del uso de células primarias es el número de ratones necesarios para establecer múltiples cocultivos de organoides. Cuando se centra en pequeñas subpoblaciones de fibroblastos, el número de cocultivos obtenidos es limitado. En otros protocolos, los fibroblastos se expanden primero en cultivo antes de usarlos para establecer cocultivos de organoides10. Sin embargo, los fibroblastos cambian morfología e identidad durante el paso, demostrado por el uso de fibroblastos primarios cutáneos y cardíacos17,18. El paso 2D convencional de fibroblastos esofágicos da como resultado cambios tanto en la morfología como en el fenotipo, lo que demuestra que el enriquecimiento in vitro de fibroblastos no es adecuado para cocultivos que tienen como objetivo fenocopiar el nicho de células madre endógenas.
La tinción de montaje completo proporciona una herramienta para mantener y visualizar la interacción fibroblasto-organoide. Cabe señalar que, si bien no todos los organoides tendrán fibroblastos directamente unidos a ellos, la mayoría de los organoides están en contacto con fibroblastos (ver Figura 2C). Para mantener las interacciones epitelial-fibroblasto, es importante manejar los organoides con cuidado y evitar el pipeteo vigoroso, el vórtice y el giro a alta velocidad. La fijación óptima es importante para mantener la arquitectura del tejido 3D, así como para mantener la fluorescencia endógena. Una fijación de 30 minutos es suficiente para retener la señal H2BeGFP y es óptima para los anticuerpos utilizados en este protocolo, sin embargo, esto puede variar entre los fluoróforos y los anticuerpos utilizados. La limpieza de los organoides reduce la dispersión de la luz y mejora sustancialmente la visualización de toda la estructura 3D. Como los organoides son pequeños, la limpieza es fácil y rápida; sin embargo, la obtención de imágenes de organoides completos utilizando microscopía confocal de escaneo láser puede llevar mucho tiempo, ya que se deben hacer múltiples pilas Z. Los microscopios confocales, como el disco giratorio, se pueden usar para reducir el tiempo de obtención de imágenes.
En general, los organoides esofágicos cultivados en presencia de fibroblastos proporcionan una herramienta valiosa para comprender aspectos del nicho de células madre esofágicas. Además, la limpieza de montaje completo proporciona un método accesible para visualizar la interacción entre fibroblastos y organoides.
Divulgaciones
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Este estudio fue apoyado por ERC StG TroyCAN (851241). E.E. es un asociado postdoctoral de Cancerfonden. M.G. es Ragnar Söderberg Fellow e Investigador Junior de Cancerfonden. Estamos agradecidos por la asistencia técnica de las instalaciones centrales del Instituto Karolinska, incluidas las instalaciones centrales de citometría de flujo Biomedicum, el núcleo de imágenes Biomedicum (BIC) y las instalaciones para animales de Medicina Comparada Biomedicum (KMB). Agradecemos a los miembros del laboratorio de Genander por leer y comentar cuidadosamente el protocolo.
Materiales
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
Referencias
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836 (2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados