Method Article
Функциональная характеристика и визуализация фибробластов пищевода с использованием органоидных кокультур
В этой статье
Резюме
Кокультуры органоидов и фибробластов представляют собой модель для изучения ниши стволовых клеток in vivo . Здесь описан протокол для сокультур органоидов пищевода, фибробластов. Кроме того, для визуализации взаимодействия фибробластов и органоидов используется визуализация всего крепления.
Аннотация
Эпителиальные стволовые клетки и клетки-предшественники способствуют формированию и поддержанию эпителиального барьера на протяжении всей жизни. Большинство популяций стволовых клеток и клеток-предшественников спрятаны в анатомически различных местах, что позволяет эксклюзивно взаимодействовать с нишевыми сигналами, которые поддерживают стволовость. В то время как развитие эпителиальных органоидных культур обеспечивает мощный инструмент для понимания роли стволовых клеток и клеток-предшественников в гомеостазе и заболевании, взаимодействие в нишевой среде в значительной степени отсутствует, тем самым препятствуя выявлению факторов, влияющих на поведение стволовых клеток. Фибробласты играют ключевую роль в управлении судьбой эпителиального ствола и предшественника. Здесь представлен комплексный протокол совместного культивирования органоидов и фибробластов, позволяющий очертить субпопуляции фибробластов при обновлении и дифференцировке клеток-предшественников пищевода. В этом протоколе описан способ выделения как эпителиальных клеток, так и фибробластов параллельно из пищевода. Изложены различные стратегии сортировки клеток, активируемые флуоресценцией, для выделения как клеток-предшественников пищевода, так и субпопуляций фибробластов от трансгенных репортеров или мышей дикого типа. Этот протокол обеспечивает универсальный подход, который может быть адаптирован для выделения конкретных субпопуляций фибробластов. В этот протокол включено установление и прохождение монокультур органоидных органоидов эпителия пищевода, что позволяет проводить прямое сравнение с системой совместного культивирования. Кроме того, описан подход 3D-очистки, позволяющий детально анализировать изображения взаимодействия эпителия и фибробластов. В совокупности этот протокол описывает сравнительный и относительно высокопроизводительный метод идентификации и понимания компонентов ниши стволовых клеток пищевода in vitro.
Введение
Органоиды используются в качестве 3D-анализов in vitro для характеристики стволовых клеток и клеток-предшественников, а также для понимания сигнальных сигналов, полученных от клеточных компонентов ниши стволовых клеток 1,2,3,4. Органоиды пищевода мыши были впервые описаны в 2014 году, и в нескольких работах были идентифицированы факторы роста, такие как R-спондин (RSPO), NOGGIN и эпидермальный фактор роста (EGF), необходимые для поддержания и прохождения органоидов пищевода 5,6,7, утверждая, что аналогичные сигнальные сигналы необходимы для in vivo обновление клеток-предшественников. Однако факторы роста обычно добавляются в нефизиологических концентрациях, что приводит к органоидным условиям роста, которые не обязательно отражают сигнальную среду in vivo.
Фибробласты представляют собой гетерогенные популяции стромальных клеток, которые поддерживают свойства клеток-предшественников во многих нишах стволовых клеток8. Объединение эпителиальных клеток-предшественников и фибробластов в одной и той же органоидной культуре позволяет формировать органоиды в пониженных концентрациях экзогенно дополненных факторов роста. Описаны системы сокультур органоидов из эпителия кишечника и печени, но протокол установления кокультур органоидов и фибробластов пищевода все еще не найден 9,10,11.
В этом протоколе изложены две стратегии флуоресцентно-активированной клеточной сортировки (FACS) для фибробластов из пищевода с использованием либо трансгенных мышей PdgfrαH2BeGFP 12, либо мышей дикого типа с классическим окрашиванием антителами. Различные субпопуляции фибробластов могут быть выделены с использованием маркеров клеточной поверхности по выбору, тем самым обеспечивая гибкость протокола. Кроме того, метод 3D-флуоресцентной визуализации, сохраняющий морфологию органоидов, используется для характеристики взаимодействий фибробластов и органоидов. Очистка органоидов обеспечивает быстрый метод увеличения глубины проникновения света в органоиды, улучшая визуализацию соединений органоид-фибробласты и позволяя полностью рекапитулировать структуру органоида. Этот протокол сочетает в себе совместное культивирование органоидов пищевода со всей стратегией визуализации монтировки, что позволяет функционально охарактеризовать взаимодействие фибробластов и органоидов.
протокол
Эксперименты на животных для этого исследования были одобрены Stockholms Norra djurförsöksetiska nämnd (этическое разрешение No 14051-2019). Животные были размещены в условиях, свободных от патогенов, в соответствии с рекомендациями Федерации Европейской ассоциации лабораторных животных.
1. Подготовка
- Разморозьте ферментативные исходные растворы, используемые для диссоциации (см. Таблицу материалов), на льду. Размораживание аликвоты матрицы базальной мембраны (матрицы) с пониженным фактором роста (СКФ) при 4 °C.
- Подготовьте питательную среду. Используйте среду, описанную в таблице 1 для органоидных культур и кокультур, и подготовьте ее перед началом протокола.
2. Рассечение и разделение эпителия пищевода и стромы
ПРИМЕЧАНИЕ: Убедитесь, что все инструменты, используемые для вскрытия и обработки тканей, стерильны. Приготовьте 2 мл диссоциативного раствора (см. Таблицу материалов) в сбалансированном солевом растворе Хэнкса (HBSS) на три пищевода.
- Используйте выбранный штамм мыши, например мыши C57BL/6J. Развитие пищевода у мышей заканчивается после послеродового дня (p) 70, поэтому рекомендуется использовать мышей старше p7013. Используйте четырех или пять мышей, так как они обеспечивают достаточное количество материала для создания 8-10 органоидных кокультур.
ПРИМЕЧАНИЕ: Эффективность органоидообразования снижается с возрастом мышей. Если представляют интерес конкретные субпопуляции фибробластов, возможно, что низкий выход фибробластов ограничивает количество органоидных кокультур, которые могут быть установлены. - Используйте генетически модифицированных (например, PdgfrαH2BeGFP) или мышей дикого типа (WT) для выделения популяций фибробластов. При использовании мышей WT выполняйте окрашивание антител, чтобы выделить специфические субпопуляции фибробластов из стромы с помощью FACS.
- Усыпляют мышей путем удушья CO2 . Рассекают пищевод с помощью щипцов и диссекционных ножниц. Чтобы удалить весь пищевод, отрежьте дистальный конец пищевода непосредственно над желудком и проксимальный конец в начале трахеи. Погрузите пищевод в PBS и положите его на лед.
- Механически удаляют наружную мышцу с помощью диссекционного микроскопа (общий диапазон увеличения 8x-40x) и щипцов. Удерживайте дистальный конец рассеченного пищевода с помощью одной пары щипцов, а другими щипцами захватывайте и тяните мышцу от дистального к проксимальному концу рассеченного пищевода. Удалите и выбросьте мышечный слой.
- Откройте пищевод в продольном направлении. Лучше всего это работает с использованием пружинных ножниц для микродиссекции с шариковым наконечником, чтобы предотвратить повреждение тканей. Возьмитесь за один конец пищевода, чтобы вставить шарик пружинных ножниц в просвет пищевода и разрежьте пищевод, держась за конец.
- Поместите пищевод в микроцентрифужную пробирку объемом 1,5 мл или 24-луночную пластину. Инкубировать открытый пищевод в 0,5 мг/мл термолизина в HBSS при 37 °C на коромысле-шейкере в течение 15 мин. Полностью погрузите пищевод в раствор термолизина.
ПРИМЕЧАНИЕ: Объем используемого раствора термолизина зависит от размера лунки или трубки. Несколько пищеводов могут быть помещены и погружены в одну и ту же лунку или трубку. - Извлеките пищевод из раствора термолизина. Используйте диссекционный микроскоп, чтобы аккуратно отделить эпителий пищевода от стромы. Используя тонкие щипцы, возьмите как эпителиальную, так и стромальную сторону ткани и медленно раздвиньте их, чтобы разделить два слоя.
ПРИМЕЧАНИЕ: Строма идентифицируется по ее белому и непрозрачному виду, в отличие от прозрачного эпителия. Строма содержит собственную пластинку и подслизистый слой. - Перенесите эпителиальный и стромальный слой в две отдельные микроцентрифужные пробирки объемом 1,5 мл с 200 мкл диссоциативного раствора в HBSS. Положите на лед.
3. Выделение клеток-предшественников пищевода
ПРИМЕЧАНИЕ: Выделение клеток-предшественников пищевода (шаг 2) и фибробластов (шаг 3) может быть выполнено одновременно. Подготовьте пробирку объемом 50 мл с 1% FBS в HBSS (1% FBS).
- Перенесите отделенный эпителий пищевода из микроцентрифужной пробирки объемом 1,5 мл (этап 2.8) в чистую чашку Петри и используйте острый скальпель для измельчения. Соберите измельченную ткань из чашки Петри с 200 мкл диссоциативного раствора и перенесите ее обратно в микроцентрифужную пробирку объемом 1,5 мл.
ПРИМЕЧАНИЕ: Эпителий измельчается должным образом, когда кусочки могут быть помещены обратно в микроцентрифужную пробирку объемом 1,5 мл с помощью наконечника пипетки объемом 200 мкл. - Добавьте 800 мкл свежего диссоциирующего раствора в микроцентрифужную пробирку объемом 1,5 мл до общего объема 1 мл.
ПРИМЕЧАНИЕ: Важно добавить достаточный объем диссоциационного раствора. На один-три пищевода рекомендуется 1 мл раствора. Увеличьте масштаб, когда одновременно обрабатывается больше эзофагов. - Поместите пробирку с измельченным эпителиальным слоем на коромысло при температуре 37 °C на 60 мин. Пипеткой вводите раствор вверх и вниз примерно 20 раз, используя наконечник пипетки объемом 200 мкл каждые 15 минут, чтобы улучшить пищеварение.
- Через 60 минут пипетка вверх и вниз еще 20 раз с помощью наконечника пипетки объемом 200 мкл. Пропустите раствор через сетчатый фильтр 40 мкм в новую микроцентрифужную пробирку объемом 1,5 мл. Центрифуга при 300 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Смочите сетчатый фильтр 1% FBS перед процеживанием клеток, чтобы свести к минимуму прилипание клеток к фильтру. Эпителий полностью не переварится, и кусочки ткани все равно будут видны. Однако более длительная инкубация снизит выживаемость клеток и не приведет к более высокому выходу жизнеспособных клеток. - Откажитесь от надосадочной жидкости, удалив лишнюю жидкость пипеткой объемом 1 мл, и ресуспендируйте гранулу в 1 мл 1% FBS. Центрифуга при 300 x g в течение 10 мин при 4 °C.
- Во время центрифугирования готовят смесь конъюгированных антител для FACS клеток-предшественников пищевода.
- Смешайте 1 мкл CD324-PE-Cy7 (ECADHERIN) и CD104-A647 (INTEGRIN-β4) в 200 мкл 1% FBS на миллион клеток.
ПРИМЕЧАНИЕ: 1 мкл антитела (конечный объем 200 мкл) достаточно для одного или двух пищеводов. При обработке сразу большего количества эзофагов увеличьте объем раствора для окрашивания антител.
- Ресуспендировать гранулу в 200 мкл смеси антител и перенести в проточную цитометрическую пробирку. После добавления флуоресцентных антител храните клеточные суспензии в темноте, чтобы избежать обесцвечивания сигнала. Инкубировать клетки в течение 30 мин при 4 °C. Добавьте 3 мл 1% FBS и центрифугу при 300 x g в течение 10 мин при 4 ° C, а затем ресуспендируйте клетки минимум в 200 мкл 1% FBS.
ПРИМЕЧАНИЕ: 500 мкл 1% FBS используется для четырех или пяти пищеводов. Увеличьте объем, когда одновременно обрабатывается больше пищевода, чтобы можно было достичь скорости потока FACS 100-300 событий / с. Большее количество событий/с снизит эффективность сортировки, а увеличение скорости потока снизит выживаемость клеток. - Добавьте маркер окрашивания мертвых клеток до конечной концентрации 1:10 000 за 5 минут до сортировки FACS, чтобы выделить живые клетки. Отсортируйте клетки-предшественники с помощью машины FACS (см. рис. 1 для стратегии стробирования). Соберите клетки в микроцентрифужные пробирки объемом 1,5 мл, заполненные 200 мкл основной органоидной среды (табл. 1).
4. Выделение фибробластов из стромального слоя
- Разрежьте слой стомы на мелкие кусочки в пробирке объемом 1,5 мл, содержащей 200 мкл диссоциирующего раствора (этап 2.8), с помощью ножниц для рассечения. Ткань должным образом измельчается после того, как раствор можно пипетировать вверх и вниз с помощью наконечника пипетки объемом 200 мкл.
- Добавьте 800 мкл свежего диссоциирующего раствора в микроцентрифужную пробирку объемом 1,5 мл до общего объема 1 мл.
ПРИМЕЧАНИЕ: Важно добавить достаточный объем диссоциационного раствора. На один-три пищевода рекомендуется 1 мл раствора. Увеличьте масштаб, когда одновременно обрабатывается больше эзофагов. - Поместите трубку на шейкер при температуре 37 °C на 30 минут. Через 15 минут нанесите раствор пипеткой вверх и вниз примерно 20 раз, используя наконечник пипетки объемом 200 мкл для улучшения пищеварения.
- После 30 минут ферментативного сбраживания пипетка вверх и вниз еще 20 раз с помощью наконечника пипетки объемом 200 мкл. Процедите раствор через сетчатое фильтр для клеток 70 мкм в новую микроцентрифужную пробирку объемом 1,5 мл. Центрифуга при 300 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: Перед процеживанием клеток смочите сетчатый фильтр 1% FBS, чтобы свести к минимуму прилипание клеток к фильтру. - Откажитесь от надосадочной жидкости, удалив лишнюю жидкость пипеткой объемом 1 мл, и ресуспендируйте гранулу в 1 мл 1% FBS. Центрифуга при 300 x g в течение 10 мин при 4 °C.
ПРИМЕЧАНИЕ: При использовании генетически модифицированного штамма мыши, содержащего флуоресцентно меченные фибробласты, окрашивание антителами не является обязательным. Если окрашивание антителами не требуется, перейдите к шагу 3.7 и перенесите образец в проточную цитометрическую пробирку.- Во время центрифугирования готовят смесь конъюгированных антител для выделения фибробластов FACS. Смешайте 1 мкл CD26-APC (DPP4) с 200 мкл 1% FBS на один миллион клеток.
ПРИМЕЧАНИЕ: 1 мкл антитела достаточно для одного или двух пищеводов. При обработке сразу большего количества эзофагов увеличьте объем раствора для окрашивания антител.
- Во время центрифугирования готовят смесь конъюгированных антител для выделения фибробластов FACS. Смешайте 1 мкл CD26-APC (DPP4) с 200 мкл 1% FBS на один миллион клеток.
- Ресуспендировать гранулу в 200 мкл смеси конъюгированных антител в 1% FBS и перенести в проточную цитометрическую пробирку. Инкубировать клетки в течение 30 мин при 4 °C.
- Добавьте 3 мл 1% FBS и центрифугу при 300 x g в течение 10 мин при 4 ° C. Ресуспендировать клетки в концентрации не менее 200 мкл 1% ФБС.
ПРИМЕЧАНИЕ: 500 мкл 1% FBS используется для четырех или пяти пищеводов. Увеличьте объем, когда одновременно обрабатывается больше эзофагов, чтобы можно было достичь скорости потока 100-300 событий / с. Большее количество событий/с снизит эффективность сортировки, а увеличение скорости потока снизит выживаемость клеток. После добавления флуоресцентных антител клеточные суспензии следует держать в темноте, чтобы избежать обесцвечивания сигнала. - Добавьте маркер окрашивания мертвых клеток до конечной концентрации 1:10 000 за 5 минут до сортировки FACS, чтобы выделить живые клетки. Отсортируйте ячейки с помощью машины FACS (см. рис. 1 для стратегии стробирования). Соберите клетки в микроцентрифужные пробирки объемом 1,5 мл, заполненные 200 мкл основной органоидной среды (табл. 1).
5. Создание и культивирование органоидов пищевода
ПРИМЕЧАНИЕ: Предварительно прогретыйER low (органоидная совместная культура), ENR (органоидная) среда (см. Таблицу 1 для описания) и 48-луночная пластина при 37 ° C. Размороженную матрицу (подготовленную на шаге 1) аликвоту выложить на лед. Для культуры органоидов пищевода мышей рекомендуется использовать приведенную здесь матрицу (см. Таблицу материалов), так как другие марки матрицы отрицательно влияют на эффективность формирования органоидов.
- Для совместной культуры органоидов смешайте отсортированные эпителиальные клетки и фибробласты в пробирке в соотношении 1:2. Для каждого матричного купола используют 5000 эпителиальных клеток и 10000 фибробластов. При подготовке к большему количеству куполов добавьте в одну пробирку 5000 эпителиальных клеток и 10000 фибробластов. Для органоидных культур без фибробластов используйте 5000 эпителиальных клеток на матричный купол.
- Центрифугируйте смешанную клеточную популяцию при 300 x g в течение 5 мин. Выбросьте надосадочную жидкость, осторожно удалив ее пипеткой объемом 200 мкл.
- Промойте клетки один раз, ресуспендировав гранулу в холодной основной органоидной среде и центрифуге при 300 x g в течение 5 мин. Поместите клетки на лед.
- Готовят смесь, состоящую на 80% из матрицы и на 20% из холодной основной органоидной среды. Положите все на лед, пока матрица затвердевает при комнатной температуре (RT).
- Выбросьте надосадочную жидкость после центрифугирования, осторожно удалив ее пипеткой объемом 200 мкл. Ресуспендируют клетки в 10 мкл матричной смеси/купола и снова кладут на лед.
- Возьмите предварительно разогретую 48-луночную пластину из инкубатора с температурой 37 °C и сделайте по одному матричному куполу на лунку с помощью пипетки объемом 20 мкл. Каждый купол содержит 10 мкл 80% матрикса, 5000 эпителиальных клеток и 10 000 фибробластов. Переложите тарелку вверх дном в инкубатор и дайте куполам застыть еще 20-30 минут при 37 °C.
ПРИМЕЧАНИЕ: Уменьшение объема матричного купола и/или увеличение количества ячеек повлияет на эффективность формирования органоидов. - Добавьте 200 мкл предварительно разогретойнизкой среды ER (таблица 1) к матричным куполам, содержащим органоидные кокультуры, и среду ENR (таблица 1) к соответствующим матричным куполам, содержащим только эпителиальные органоиды, и поместите планшет в инкубатор.
- Выращивайте органоиды при 37 ° C и 5% CO2. В течение первых 2 дней дополняйте среду 10 мкМ Rock-ингибитором (Y-27623). Ингибитор горных пород предотвращает вызванную стрессом гибель клеток и увеличивает вероятность успешного укоренения органоидных культур.
- Обновляйте средство каждые 2-3 дня. Убедитесь, что среда теплая, чтобы предотвратить диссоциацию термочувствительной матрицы.
- Проведите анализ эксперимента через 6-8 дней после нанесения покрытия. Органоиды могут храниться в культуре до 14 дней. Примерно на 14 день наблюдается потеря целостности купола.
6. Пассаж органоидов
ПРИМЕЧАНИЕ: Пассаж органоидов, выращенных в совместной культуре, приводит к потере фибробластов. Поэтому рекомендуется использовать среду ENR для всех органоидов при прохождении. Предварительно разогрейте ENR, PBS и 48-луночную пластину при 37 °C.
- Удалите среду и промойте колодец, содержащий матричный купол, предварительно разогретым PBS. Добавьте 200 мкл холодного 0,25% раствора трипсина и пипетку вверх и вниз, чтобы разрушить матричный купол.
ПРИМЕЧАНИЕ: Рекомендуется использовать холодный 0,25% трипсина, так как матрица чувствительна к температуре, и это помогает разрушать купола матрицы. - Инкубируйте органоиды с трипсином при 37 °C в течение ~20 мин. Пипеткой вверх и вниз через 10 мин, чтобы увеличить диссоциацию органоидов. Контролируйте процесс диссоциации с помощью микроскопа каждые 5-10 мин. Поскольку трипсин снижает жизнеспособность клеток, это может помочь определить идеальное время диссоциации.
- Через 20 минут органоиды пипеткой вверх и вниз пипеткой объемом 200 мкл для диссоциации органоидов. Соберите клетки в микроцентрифужную пробирку объемом 1,5 мл, добавьте 1 мл основной органоидной среды и центрифугу при 300 x g в течение 5 мин при ЛТ.
- Необязательно: Чтобы обеспечить наилучшие условия роста органоидов и получение новых органоидов из отдельных клеток, процедите клетки через предварительно смачиваемый клеточный фильтр размером 40 мкм. Фильтрация клеточной суспензии приводит к удалению органоидных ядер и клеточных скоплений, которые трудно диссоциировать.
- Приготовьте матричную смесь, состоящую из 80% матрицы и 20% холодной основной органоидной среды. Положите все на лед, пока матрица застывает при RT.
- Выбросьте надосадочную жидкость, осторожно удалив ее пипеткой объемом 200 мкл, ресуспендируйте клетки в 10 мкл матричной смеси/купола и положите смесь обратно на лед.
ПРИМЕЧАНИЕ: Органоиды могут быть разделены в соотношении от 1:5 до 1:10, в зависимости от плотности купола. Эпителиальные клетки также могут быть подсчитаны и повторно покрыты в количестве 5000 клеток / купол. - Возьмите предварительно разогретую 48-луночную тарелку из инкубатора с температурой 37 °C и сделайте по одному куполу на лунку. Переложите тарелку вверх дном в инкубатор и дайте куполам застыть еще 20-30 минут при 37 °C.
- Добавьте 200 мкл предварительно разогретой среды ENR в соответствующие органоидные купола. Дополните среду 10 мкМ ингибитором горных пород (Y-27623) в течение первых 2 дней.
- Обновляйте средство каждые 2-3 дня. Убедитесь, что среда теплая, чтобы предотвратить диссоциацию термочувствительной матрицы.
7. Обработка органоидов для окрашивания всего крепления
ПРИМЕЧАНИЕ: Перед использованием покройте наконечники и трубки 10% FBS в PBS, чтобы избежать прилипания органоидов к пластику. Для наконечников для пипеток достаточно один или два раза пипеткой вверх и вниз в 10% растворе FBS / PBS перед использованием наконечника. Для пробирок заполните пробирку 10% FBS/PBS, а затем удалите раствор.
- Удалите органоидную среду и добавьте 200 мкл ледяного PBS в матричные купола. Поставьте тарелку на лед на 5-10 минут.
- Пипеткой вверх и вниз и перенесите раствор в микроцентрифужные неадгезионные пробирки объемом 0,6 мл. Центрифугу в течение 30-60 с при 100 x g , чтобы органоиды осели на дне.
ПРИМЕЧАНИЕ: Избыточное пипетирование и длительное центрифугирование разрушают органоиды и нарушают взаимодействие фибробластов и органоидов. - Удалите лишнюю жидкость и добавьте ледяной PBS. Центрифугу в течение 30-60 с при 100 x g , чтобы органоиды осели на дне.
- Удалите лишнюю жидкость и зафиксируйте органоид 200 мкл холодного 4% формальдегида в растворе PBS на 30 мин на льду.
ВНИМАНИЕ: Формальдегид токсичен и всегда должен использоваться в химическом вытяжном шкафу. Всегда необходимо носить нитриловые перчатки, защитные очки и лабораторные халаты. - Фиксация органоида приводит к тому, что они опускаются, и центрифугирование больше не требуется. Дайте органоидам утонуть, поместив трубку вертикально, и подождите 2-3 минуты, удалите формальдегид и добавьте 500 мкл холодного PBS, чтобы смыть формальдегид.
- Дайте органоидам утонуть, удалите излишки PBS и добавьте 500 мкл свежего холодного PBS. Дайте органоидам утонуть, удалите излишки PBS и добавьте 500 мкл блокирующего буфера (5% нормальной ослиной сыворотки, 1% BSA и 0,5% Triton X-100 в PBS). Поместите трубку на коромысла-шейкер на 60 мин при RT.
ПРИМЕЧАНИЕ: Блокировка также может быть выполнена в течение ночи (O / N) при 4 ° C. - Дайте органоидам опуститься, удалите блокирующий буфер и ресуспендируйте органоиды в 200 мкл блокирующего буфера с первичными антителами (см. Таблицу материалов). Храните органоиды на коромысле-шейкере O/N при температуре 4 °C.
ПРИМЕЧАНИЕ: Для улучшения окрашивания ядерных белков, низкоэкспрессированных белков или антител, которые проявляют неспецифическое окрашивание, время инкубации может быть увеличено на 1 или 2 дня при 4 ° C. Размещение органоидов на коромысле имеет важное значение, поскольку это предотвращает слипание органоидов и повышает эффективность окрашивания. - Дайте органоидам утонуть, удалите смесь первичных антител и промойте органоиды, используя 500 мкл 0,02% Triton X-100 в PBS (0,02% Tx) в течение 60 минут при RT. Повторите три раза.
ПРИМЕЧАНИЕ: Если требуется более длительная инкубация первичных антител, добавьте стадию промывки с 0,02% Tx в PBS O/N при 4 °C. - Дайте органоидам утонуть, удалите промывочный буфер и добавьте 200 мкл флуоресцентно-конъюгированного вторичного антитела в блокирующий буфер O/N при 4 ° C. После добавления флуоресцентных вторичных антител держите органоиды в темноте, чтобы избежать обесцвечивания сигнала.
- Дайте органоидам утонуть, удалите смесь вторичных антител и промойте органоиды, используя 500 мкл 0,02% Tx в течение 60 мин при RT. Повторите три раза.
- При необходимости покрасьте органоиды 200 мкл раствора DAPI (0,25 мкг/мл) для ядерного окрашивания. Инкубируйте образцы в течение 60 мин при RT на коромысле-шейкере.
- Дайте органоидам втонуть, удалите раствор DAPI и промойте органоиды в 500 мкл PBS в течение 15 мин при RT. Повторите три раза.
- Дайте органоидам утонуть и удалите всю лишнюю жидкость. Добавьте 10 мкл очищающего раствора к органоидам и инкубируйте в течение 15 мин при RT.
ПРИМЕЧАНИЕ: Очищающий раствор вязкий, поэтому перед пипеткой очистного раствора отрежьте внешнюю часть наконечника пипетки объемом 20 мкл. Больше решения для очистки может быть добавлено, если для визуализации используется большая прокладка. Монтажный раствор можно использовать вместо очищающего раствора, когда органоиды не очищаются. Очищающее решение уменьшает фон при визуализации и увеличивает глубину изображения. - Поместите двустороннюю липкую 4-луночную спейсер диаметром 0,05 мм на предметное стекло микроскопа. Добавьте 10 мкл очищающего раствора с органоидами в одну лунку и поместите покровное стекло поверх прокладки.
ПРИМЕЧАНИЕ: Органоиды также могут быть установлены без использования прокладки. Прокладка сохраняет форму органоида нетронутой и предотвращает сплющивание органоидов. - Держите предметное стекло в точке RT O/N, чтобы очистить органоиды. Для длительного хранения храните предметные стекла при температуре 4 °C. Получение изображений с помощью системы конфокальной микроскопии.
Результаты
Пищевод делится на разные слои: эпителий, собственную пластинку, подслизистую оболочку и наружную мышечную ткань (рис. 1А). Фибробласты находятся в подслизистой оболочке и собственной пластинке, называемой стромой. В этом протоколе внешняя мышечная мышца удаляется механически (рис. 1B), что не приводит к потере фибробластов (PdgfrαH2BeGFP+), находящихся в строме (рис. 1C). Перед диссоциацией эпителий отделяется от стромы, в результате чего образуются два тканевых сегмента (рис. 1B). Разделение двух слоев дает возможность увеличить время диссоциации для более прочного эпителиального слоя по сравнению с хрупким стромальным слоем. Таким образом, устанавливается эффективный протокол выделения, дающий как жизнеспособные эпителиальные клетки-предшественники, так и стромальные фибробласты (рис. 1B). Клетки-предшественники пищевода сортируются на основе их высокой экспрессии INTEGRIN-β4 и E-CADHERIN (рис. 1C, D).
Субпопуляции фибробластов могут быть выделены с помощью различных маркеров. В этом протоколе представлена стратегия выделения фибробластов, основанная на широко используемых маркерах фибробластов PDGFRα и DPP4 (CD26). Выделение либо репортерной экспрессией PdgfrαH2BeGFP , либо антителом DPP4 показывает, что около 50% изолированных клеток являются фибробластами (рис. 1E, F). Кроме того, 70% фибробластов PDGFRα+ являются DPP4+, что указывает на то, что получена в значительной степени перекрывающаяся, но не идентичная популяция фибробластов. После выделения популяций эпителиальных и стромальных клеток клетки-предшественники пищевода культивируются либо отдельно, либо вместе с фибробластами в матричном куполе. Для изучения вклада фибробластов в образование органоидов кокультуру поддерживают в среде с пониженным фактором роста (рис. 1G).
Клетки-предшественники пищевода образуют органоиды в присутствии EGF, NOGGIN и RSPO (ENR). Удаление NOGGIN и уменьшение количества RSPO (25 нг/мкл; ERнизкий) достаточен для предотвращения образования органоидов (рис. 2А). Интересно, что добавление фибробластов DPP4+ или PDGFRα+ к клеткам-предшественникам пищевода внизкой среде ER восстанавливает органоидообразующую способность, демонстрируя поддерживающую функцию для обеих популяций фибробластов (рис. 2A-D). Визуализация трансгена PdgfrαH2BeGFP показывает, что фибробласты находятся в тесном контакте с эпителиальными клетками-предшественниками при образовании органоидов (рис. 2А). На 6-й день фибробласты PdgfrαH2BeGFP+ все еще в изобилии присутствуют в кокультуре. Фибробласты присутствуют по всему куполу, рядом с органоидами и соприкасаются с ними (полная стрелка) или прикрепляются к органоидам (наконечник стрелки; Рисунок 2D).
Окрашивание всего крепления показывает 3D-представление взаимодействия фибробластов с органоидами (рис. 3). Несмотря на то, что можно выполнить весь протокол монтажа без использования очищающего раствора, это снижает прозрачность и лазерное проникновение органоида (рис. 3B, z-view). При монтаже органоидов спейсер помогает поддерживать морфологию органоидов. Напротив, нанесение покровного стекла непосредственно на органоиды (без прокладки) сплющивает органоиды и приводит к потере структуры органоидов (рис. 3A, B).
Обнаружено, что фибробласты DPP4+ и PDGFRα+ обернуты вокруг органоидов (рис. 3C, видео1 и видео 2). Дифференциацию органоидов пищевода можно оценить с помощью различных маркеров. На рисунке 4 показано, что предоставленный протокол окрашивания подходит для легче окрашиваемых кератинов (KRT14/13), а также для более трудноокрашиваемых факторов транскрипции (TRP63/KLF4). Протокол совместного культивирования генерирует органоиды с аналогичной схемой дифференцировки, как показано in vivo13,14 и как видно на органоидах, выращенных в среде ENR; Клетки-предшественники KRT14+ или TRP63+ образуют внешний слой, а дифференцированные клетки KRT13+ или KLF4+ ориентируются внутрь.
Этот протокол предоставляет инструмент для изучения ниши стволовых клеток пищевода in vitro и визуализирует взаимодействие между органоидами и фибробластами. Реализуя протокол выделения фибробластов с использованием антител, метод адаптируется и может быть использован для изучения субпопуляций фибробластов без необходимости использования трансгенных мышей.
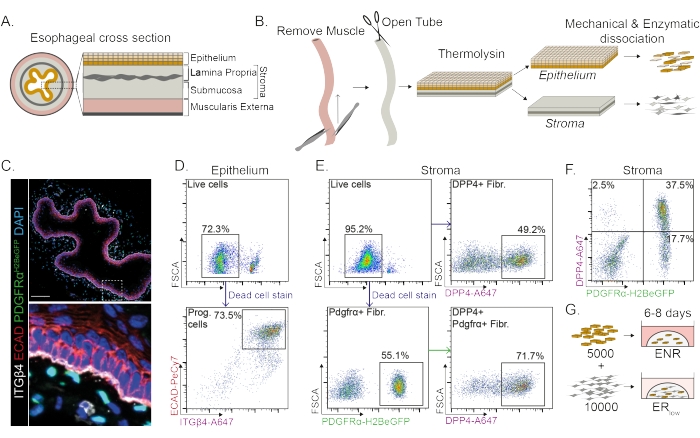
Рисунок 1: Выделение клеток-предшественников и субпопуляций фибробластов из пищевода . (A) Схематический обзор различных слоев пищевода. Строма содержит собственную пластинку и подслизистую оболочку. (B) Схематический обзор протокола изоляции. Мышца (muscularis externa) удаляется механически с помощью щипцов; Оставшийся пищевод разрезают и инкубируют в термолизине, чтобы отделить эпителиальный слой от стромы. Эпителий и строма разделяются, механически измельчаются и ферментативно перевариваются до одноклеточных суспензий. Затем диссоциированные клетки окрашивают и подготавливают к FACS. (C) Поперечный срез пищевода, отделенный от muscularis extterna, показывающий фибробласты PdgfrαH2BeGFP+ в строме. Двойные положительные клетки INTEGRIN-β4 (ITGβ4) и E-CADHERIN (ECAD) являются эпителиальными клетками-предшественниками пищевода. Масштабная линейка = 100 мкм. (D) Репрезентативный график проточной цитометрии выделения эпителиальных клеток, показывающий процент живых клеток (верхняя панель) от всех отдельных клеток. На нижней панели показан процент изолированных клеток-предшественников (Prog.) ITGβ4+ ECAD+ из всех живых клеток. (E) Репрезентативный график проточной цитометрии выделения стромальных клеток, показывающий процент живых клеток (верхняя левая панель). Репрезентативные графики проточной цитометрии, показывающие процент изолированных фибробластов DPP4+ (фибр.; верхняя правая панель) и фибробластов Pdgfrα+ (нижняя левая панель) всех живых клеток. 70% фибробластов Pdgfrα+ также являются DPP4+ (нижняя правая панель). (F) Репрезентативный график проточной цитометрии стромы, показывающий только клетки DPP4+ (2,5%), DPP4+ клетки PDGFRα+ (37,5%) и только клетки PDGFRα+ (17,7%). Проценты указаны для всех живых клеток. (G) Эпителиальные клетки помещаются в матричный купол в присутствии 50 нг/мкл EGF, 100 нг/мкл NOGGIN и 250 нг/мкл RSPO (ENR) или вместе с фибробластами в присутствии EGF и низкой концентрации RSPO (25 нг/мкл). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
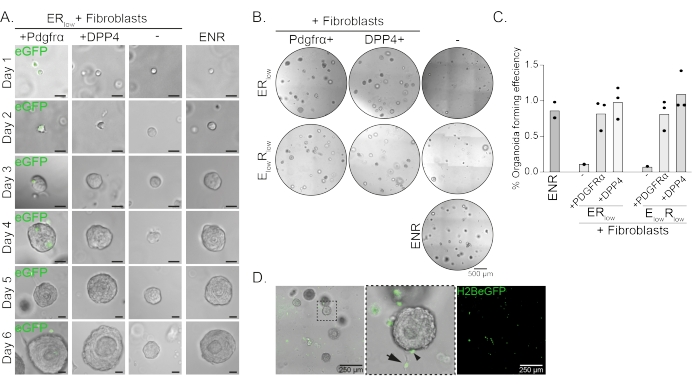
Рисунок 2: Репрезентативные результаты сокультур органоидов. (A) Изображения светлого поля, показывающие рост органоидов с 1-го по 6-й день. Изображения светлого поля с органоидами, культивируемыми совместно с фибробластами PdgfrαH2BeGFP+, также показывают ядерный сигнал eGFP. Масштабная линейка = 25 мкм. (B) Изображения всего купола матрицы в светлом поле на 6-й день. В левом столбце показаны органоидные кокультуры, выращенные в присутствии фибробластов Pdgfrα+ внизких средах ER или ElowR. В среднем столбце показаны органоидные кокультуры, выращенные в присутствии фибробластов DPP4+ в низком ER или E низком R, низком среднем. В правой колонке показаны монокультуры органоидов, выращенные в среде ENR. Среда ENR = EGF (50 нг/мкл), NOGGIN (100 нг/мкл) и RSPO (250 нг/мкл). Низкий ER = EGF и 25 нг/мкл RSPO. EнизкийR низкий = 5 нг/мкл ЭФР и 25 нг/мкл RSPO. Масштабная линейка = 500 мкм. (C) График, показывающий эффективность формирования органоидов (%) (т.е. процент клеток, образующих органоиды в различных условиях культивирования). Каждая точка представляет собой матричный купол, а столбец представляет среднее значение всех точек на условие. (D) Светлопольное и флуоресцентное изображение органоидов 6-го дня, культивируемых совместно с фибробластами PdgfrαH2BeGFP+. Фибробласты PdgfrαH2BeGFP+ присутствуют по всему куполу, прикреплены к органоидам (наконечник стрелки) и не прикреплены, но находятся в контакте с органоидами (полная стрелка). Масштабная линейка = 250 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
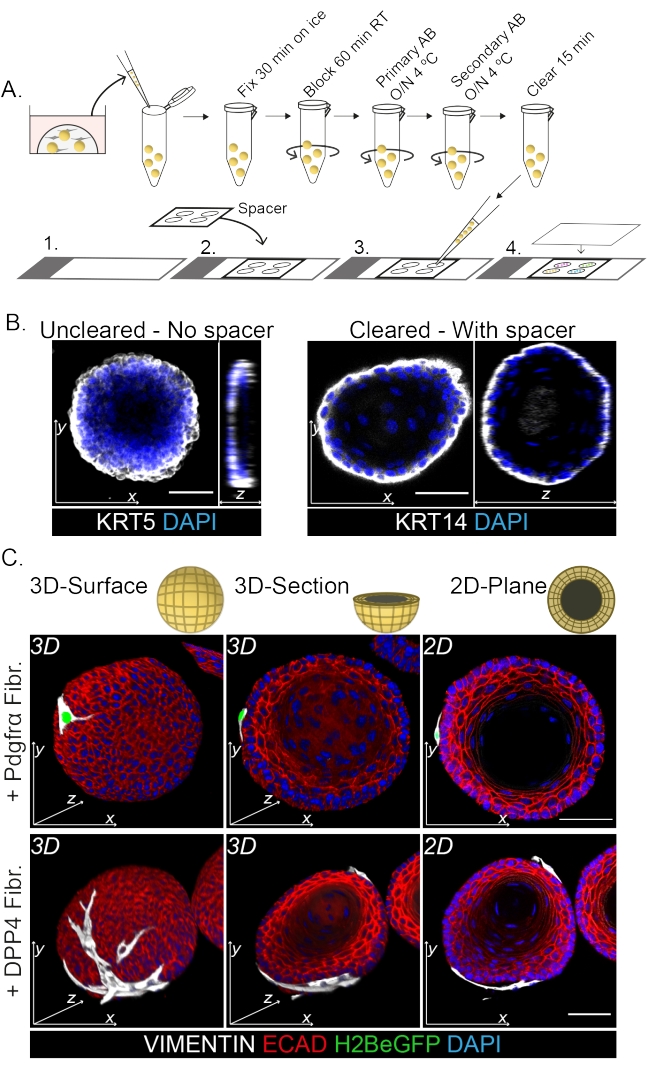
Рисунок 3: Протокол окрашивания всего крепления для изучения взаимодействий фибробластов и органоидов . (A) Схематический обзор всего протокола иммунофлуоресценции маунта. AB = антитело. (B) Иммунофлуоресцентная картина неочищенного окрашивания всей горы, показывающая снижение прозрачности и проникновения лазерного света по сравнению с очищенными органоидами. Отсутствие спейсера приводит к уплощению органоида и потере морфологии органоидов. (C) Целые изображения совместно культивируемых органоидов показывают 3D-поверхности органоидов с фибробластами VIMENTIN+ (Fibr.), обернутыми вокруг органоида и находящимися в тесном контакте с ним. 3D поперечные сечения и 2D плоские изображения показывают просвет органоида. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
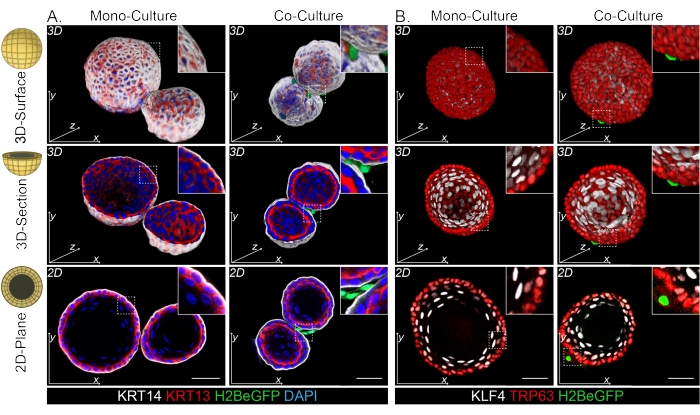
Рисунок 4: Изображения всего монтировки показывают различные популяции базальных и супрабазальных клеток. (A) Окрашивание моно- и кокультивируемых органоидов с фибробластами PdgfrαH2BeGFP+ с признаками базальных клеток KRT14+ во внешнем слое и дифференцированных супрабазальных клеток KRT13+. Масштабная линейка = 50 мкм. (B) Окрашивание моно- и кокультивируемых органоидов фибробластами PdgfrαH2BeGFP+ с признаками базальных клеток TRP63+ во внешнем слое и дифференцированных супрабазальных клеток KLF4+. Масштабная линейка = 50 мкм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Таблица 1: Таблица с описанием компонентов органоидных питательных сред. Пожалуйста, нажмите здесь, чтобы загрузить эту таблицу.
Видео 1: Фибробласт PdgfrαH2BeGFP+, обернутый вокруг органоида и находящийся в тесном контакте с ним. Видео сопровождает верхнюю панель рисунка 3C. Масштабная линейка на рисунке 3C составляет 50 мкм, а органоид - ~ 120 мкм в диаметре. VIMENTIN показан белым цветом, E-CADHERIN - красным, PdgfrαH2BeGFP - зеленым, а DAPI - синим. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Видео 2: Фибробласты DPP4+, обернутые вокруг органоида и находящиеся в тесном контакте с ним. Видео сопровождает нижнюю панель рисунка 3C. Масштабная линейка на рисунке 3C составляет 50 мкм, а органоид - ~ 120 мкм в диаметре. VIMENTIN показан белым цветом, E-CADHERIN - красным, а DAPI - синим. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Обсуждение
Представленный здесь протокол устанавливает модель in vitro для исследования функциональных взаимодействий эпителия пищевода с фибробластами.
Эпителиальный слой отделен от стромы, что позволяет оптимизировать протокол диссоциации как для эпителиального, так и для стромального компартмента. Несмотря на оптимизацию протокола диссоциации эпителия, скопления тканей остаются очевидными. Энергичное пипетирование вверх и вниз каждые 15 минут существенно уменьшает количество и размер комков. Другие протоколы используют трипсин для дальнейшей диссоциации эпителиального слоя 5,6. Здесь использование трипсина или дальнейшее увеличение времени диссоциации не рекомендуется, так как это приводит к снижению жизнеспособности эпителиальных клеток и эффективности формирования органоидов. В отличие от эпителия, строма легко диссоциирует, и через 30 минут в диссоциативном растворе получается одноклеточная суспензия с жизнеспособностью фибробластов ~ 90% (рис. 1E). Исключение этапа эпителиально-стомального разделения в протоколе существенно увеличивает время диссоциации, что приводит к снижению жизнеспособности фибробластов и снижению выхода эпителиальных клеток. Кроме того, отделение эпителия от стромы дает возможность определить количество клеток каждой популяции и смешать эпителиальные клетки и фибробласты из разных линий мышей при создании кокультур.
Изучение функции фибробластов на рост органоидов является широко используемым методом в биологии стволовых клеток 9,10,11,15,16. Установленные среды для совместного культивирования представляют собой либо ДМЭМ, дополненный 10% фетальной телячьей сывороткой (FCS)9,15, либо средой с пониженным фактором роста10,16. В этом протоколе среда с пониженным фактором роста используется для имитации условий в нише стволовых клеток in vivo, где фибробласты в значительной степени находятся в состоянии покоя. FCS представляет собой сыворотку, богатую факторами роста, которая приводит к активации и пролиферации фибробластов в кокультурах, что, вероятно, соответствует состоянию клеток фибробластов, отличному от состояния in vivo. Исключив FCS и уменьшив факторы роста, чтобы среда сама по себе (ER low) не поддерживала рост органоидов и не стимулировала пролиферацию фибробластов, можно изолировать влияние фибробластов на рост органоидов. В этой среде NOGGIN удаляется, а RSPO снижается до минимума (10% RPSO). Было продемонстрировано, что и NOGGIN, и RSPO необходимы для роста органоидов пищевода6. EGF был сохранен в среде совместного культивирования, так как сам по себе он не поддерживает рост органоидов. Однако фибробласты также способны поддерживать рост органоидов в среде с пониженным EGF (E низкий R,низкийR; Рисунок 2B,D).
Сокультуры органоидов не могут поддерживаться путем пассажа, поскольку фибробласты теряются во время трипсинизации. Тем не менее, пассаж органоидов был включен в протокол, поскольку органоиды пищевода могут быть сохранены, расширены и использованы для дальнейших экспериментов в качестве монокультур. Пассажные органоиды из монокультур могут быть использованы для создания кокультур со свежевыделенными фибробластами. Недостатком использования первичных клеток является количество мышей, необходимое для создания нескольких органоидных кокультур. При сосредоточении внимания на небольших субпопуляциях фибробластов количество получаемых кокультур ограничено. В других протоколах фибробласты сначала расширяют в культуре, а затем используют их для создания органоидных кокультур10. Однако фибробласты изменяют морфологию и идентичность во время пассажа, что показано при использовании первичных фибробластов кожи и сердца17,18. Традиционное 2D-пассирование фибробластов пищевода приводит как к морфологическим, так и к фенотипическим изменениям, демонстрируя, что обогащение фибробластов in vitro не подходит для совместных культур, направленных на фенокопирование ниши эндогенных стволовых клеток.
Окрашивание всего крепления предоставляет инструмент для поддержания и визуализации взаимодействия фибробластов и органоидов. Следует отметить, что, хотя не все органоиды будут иметь фибробласты, непосредственно прикрепленные к ним, большинство органоидов находятся в контакте с фибробластами (см. рис. 2C). Чтобы поддерживать взаимодействие эпителия и фибробластов, важно осторожно обращаться с органоидами и избегать энергичного пипетирования, вихря и высокоскоростного вращения. Оптимальная фиксация важна для поддержания 3D-архитектуры тканей, а также для сохранения эндогенной флуоресценции. 30-минутная фиксация достаточна для сохранения сигнала H2BeGFP и является оптимальной для антител, используемых в этом протоколе, однако это может варьироваться между используемыми флуорофорами и антителами. Очистка органоидов уменьшает рассеяние света и существенно улучшает визуализацию всей 3D-структуры. Поскольку органоиды маленькие, очистка выполняется легко и быстро; однако визуализация целых органоидов с помощью конфокальной микроскопии с лазерным сканированием может занять много времени, так как необходимо сделать несколько Z-стеков. Конфокальные микроскопы, такие как вращающийся диск, можно использовать для сокращения времени визуализации.
В целом, органоиды пищевода, выращенные в присутствии фибробластов, представляют собой ценный инструмент для понимания аспектов ниши стволовых клеток пищевода. Кроме того, очистка всего крепления обеспечивает доступный метод визуализации взаимодействия между фибробластами и органоидами.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование было поддержано ERC StG TroyCAN (851241). Э.Е. является научным сотрудником Cancerfonden. М.Г. является научным сотрудником Рагнара Сёдерберга и младшим исследователем Cancerfonden. Мы благодарны за техническую помощь основным учреждениям Каролинского института, в том числе центру проточной цитометрии Biomedicum, центру визуализации Biomedicum (BIC) и животноводческому центру сравнительной медицины Biomedicum (KMB). Мы благодарим сотрудников лаборатории Genander за внимательное прочтение и комментирование протокола.
Материалы
| Name | Company | Catalog Number | Comments |
| B-27 Supplement (50X), serum free | Thermo Fisher (Gibco) | 17504001 | |
| Corning Matrigel Growth Factor Reduced (GFR) Basement Membrane Matrix | fisher scientific | 356231 | |
| Dimethyl sulfoxide | Sigma-Aldrich | 276855-100ML | |
| DMEM/F-12 | Thermo Fisher (Gibco) | 11320074 | |
| DPBS | Thermo Fisher (Gibco) | 14190250 | |
| Fetal Bovine Serum | Sigma-Aldrich | F7524 | |
| GlutaMAX Supplement | Thermo Fisher (Gibco) | 35050061 | |
| HBSS, no calcium, no magnesium, no phenol red | Thermo Fisher (Gibco) | 14175-129 | |
| Normal Donkey Serum | Jackson Immuno | 017-000-121 | |
| Penicillin-Streptomycin (10,000 U/mL) | Thermo Fisher (Gibco) | 15140122 | |
| Triton X-100 solution | Merck | 93443-100ML | |
| Trypsin-EDTA (0.25%), phenol red | Thermo Fisher (Gibco) | 25200-056 | |
| Chemicals, Peptides, and recombinant proteins | |||
| DAPI Solution | Thermo Fisher | 62248 | |
| Dissociation solution: 0.25 mg/ml Liberase TM, 0.25 mg/ml Dnase in HBSS | |||
| Dnase I | Sigma-Aldrich | 11284932001 | |
| Formaldehyde, 37%, with 10-15% methanol | Sigma-Aldrich | 252549-1L | |
| Liberase | Sigma-Aldrich | 5401127001 | |
| N-Acetyl-cysteine | Sigma-Aldrich | A9165-25G | |
| Noggin murine | Peprotech | 250-38 | |
| RapiClear 1.47 | SunJin Lab | #RC147001 | |
| Recombinant Mouse EGF Protein, CF | R&D systems | 2028-EG-200 | |
| R-spondin-1 murine | Peprotech | 315-32 | |
| SYTOX Blue Dead Cell Stain | Thermo Fisher | S34857 | |
| Thermolysin | Sigma-Aldrich | T7902-25MG | |
| Y-27632 dihydrochloride | Sigma-Aldrich | Y0503-5MG | |
| Plastic & Glassware | |||
| Corning Sterile Cell Strainers 40um | VWR | 15360801 | |
| Corning Sterile Cell Strainers 70um | VWR | 431751 | |
| Menzel Deckgläser/ cover slips | Thermo Fisher | Q10143263NR15 | |
| SafeSeal reaction tube, 1.5 mL, PP | Sarstedt | 72.706 | |
| Snap Cap Low Retention Microcentrifuge Tubes 0.6 mL | Thermo Fisher | 3446 | |
| SuperFrost Slides | VWR | 631-9483 | |
| Tools | |||
| 0.05 mm 4 circular well iSpacer | SunJin Lab | #IS204 | |
| Dumont #5 forceps, biology tip | F.S.T | 11252-20 | |
| ImmEdge Pen | VectorLaboratories | H-4000 | |
| Spring Scissors Angled to Side Ball Tip 8mm Cutting Edge | F.S.T | 15033-09 | |
| Instruments | |||
| Confocal microscope Stellaris 5 | Leica | ||
| Dissection microscope ZEISS Stemi 305 | Zeiss | ||
| FACS ARIA III | BD Biosciences | ||
| Conjugated Antibodies for FACS | |||
| Alexa Fluor 647 anti-mouse CD104 Antibody Clone: 346-11A | 123608 | 123608 | |
| APC anti-mouse CD26 (DPP-4) Antibody | H194-112 | H194-112 | |
| PE/Cy7 anti-mouse/human CD324 (E-Cadherin) Antibody | 147310 | 147310 | |
| Antibodies for Immunofluorescence | |||
| CD104 (ß-integrin 4) Clone: 346-11A | BioLegend | 553745 | |
| Cytokeratin 14 | Acris Antibodies (AbD Serotec) | BP5009 | |
| Cytokeratin13 Clone: EPR3671 | abcam | ab92551 | |
| E-cadherin (CD324) Clone: 2.40E+11 | Cell Signaling Technology | 3195 | |
| Keratin 5 Polyclonal Chicken Antibody, Purified Clone: Poly9059 | BioLegend | 905901 | |
| p63 Clone: 4a4 | abcam | ab735 | |
| Recombinant Anti-KLF4 antibod Clone: EPR20753-25 | abcam | ab214666 | |
| Vimentin | Sigma-Aldrich | AB5733 | |
| Secondary antibodies | |||
| Donkey anti-species* antibodies with fluorophore of choice | Jackson Immuno |
Ссылки
- Sachs, N., et al. Long-term expanding human airway organoids for disease modeling. The EMBO Journal. 38 (4), 100300 (2019).
- Lohmussaar, K., et al. Patient-derived organoids model cervical tissue dynamics and viral oncogenesis in cervical cancer. Cell Stem Cell. 28 (8), 1380-1396 (2021).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Smukler, S. R., et al. The adult mouse and human pancreas contain rare multipotent stem cells that express insulin. Cell Stem Cell. 8 (3), 281-293 (2011).
- Zheng, B., et al. A new murine esophageal organoid culture method and organoid-based model of esophageal squamous cell neoplasia. iScience. 24 (12), 103440 (2021).
- DeWard, A. D., Cramer, J., Lagasse, E. Cellular heterogeneity in the mouse esophagus implicates the presence of a nonquiescent epithelial stem cell population. Cell Reports. 9 (2), 701-711 (2014).
- Kasagi, Y., et al. The esophageal organoid system reveals functional interplay between notch and cytokines in reactive epithelial changes. Cellular and Molecular Gastroenterology and Hepatology. 5 (3), 333-352 (2018).
- Plikus, M. V., et al. Fibroblasts: Origins, definitions, and functions in health and disease. Cell. 184 (15), 3852-3872 (2021).
- McCarthy, N., et al. Distinct mesenchymal cell populations generate the essential intestinal BMP signaling gradient. Cell Stem Cell. 26 (3), 391-402 (2020).
- Cordero-Espinoza, L., et al. Dynamic cell contacts between periportal mesenchyme and ductal epithelium act as a rheostat for liver cell proliferation. Cell Stem Cell. 28 (11), 1907-1921 (2021).
- Pastula, A., et al. Three-dimensional gastrointestinal organoid culture in combination with nerves or fibroblasts: a method to characterize the gastrointestinal stem cell niche. Stem Cells International. 2016, 3710836 (2016).
- Hamilton, T. G., Klinghoffer, R. A., Corrin, P. D., Soriano, P. Evolutionary divergence of platelet-derived growth factor alpha receptor signaling mechanisms. Molecular and Cellular Biology. 23 (11), 4013-4025 (2003).
- McGinn, J., et al. A biomechanical switch regulates the transition towards homeostasis in oesophageal epithelium. Nature Cell Biology. 23 (5), 511-525 (2021).
- Zhang, Y., Bailey, D., Yang, P., Kim, E., Que, J. The development and stem cells of the esophagus. Development. 148 (6), (2021).
- Ohlund, D., et al. Distinct populations of inflammatory fibroblasts and myofibroblasts in pancreatic cancer. The Journal of Experimental Medicine. 214 (3), 579-596 (2017).
- Pentinmikko, N., et al. Notum produced by Paneth cells attenuates regeneration of aged intestinal epithelium. Nature. 571 (7765), 398-402 (2019).
- Janson, D., Rietveld, M., Willemze, R., El Ghalbzouri, A. Effects of serially passaged fibroblasts on dermal and epidermal morphogenesis in human skin equivalents. Biogerontology. 14 (2), 131-140 (2013).
- Landry, N. M., Rattan, S. G., Dixon, I. M. C. An improved method of maintaining primary murine cardiac fibroblasts in two-dimensional cell culture. Scientific Reports. 9 (1), 12889 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены