需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
TACI:用于 3D 钙成像分析的 ImageJ 插件
摘要
TrackMate 钙成像分析 (TACI) 是一个用于 3D 钙成像分析的开源 ImageJ 插件,用于检查 z 轴上的运动并确定每个 z 堆栈的最大值,以表示细胞在相应时间点的强度。它可以分离在横向(x / y)方向上重叠但在不同的z平面上的神经元。
摘要
神经科学研究已经发展到使用复杂的成像和计算工具从数据集中提取全面的信息。钙成像是一种广泛使用的技术,需要复杂的软件才能获得可靠的结果,但许多实验室在更新协议以满足现代标准时难以采用计算方法。由于缺乏编程知识和软件付费墙,出现了困难。此外,感兴趣的细胞在钙成像过程中显示所有方向的运动。已经开发出许多方法来校正横向(x/y)方向的运动。
本文描述了使用新的 ImageJ 插件 TrackMate 钙成像分析 (TACI) 来检查 3D 钙成像中 z 轴运动的工作流程。该软件从神经元出现的所有z位置识别最大荧光值,并使用它来表示神经元在相应t位置的强度。因此,此工具可以分离在横向 (x/y) 方向上重叠但出现在不同 z 平面上的神经元。作为 ImageJ 插件,TACI 是一种用户友好的开源计算工具,用于 3D 钙成像分析。我们使用苍蝇幼虫热敏神经元验证了这一工作流程,该神经元在温度波动期间显示所有方向的运动,并从苍蝇大脑获得的 3D 钙成像数据集。
引言
细胞内钙的水平是神经元兴奋性的精确标志物。钙成像测量细胞内钙的变化以了解神经元活动1。由于测量细胞内钙浓度的技术的发展,神经科学研究越来越多地使用这种方法,包括遗传编码钙指示剂(GECIs),例如GCaMP2,3,它可以通过遗传方法在特定神经元集中无创表达。激光器和显微镜组件成本的降低也增加了钙成像的使用4。重要的是,钙成像允许在自由移动的动物中同时记录和研究单个神经元以及大型神经元群5。
然而,钙成像数据的分析具有挑战性,因为(1)它涉及跟踪单个细胞的荧光随时间的变化,(2)荧光信号间歇性地消失或随着神经元反应而重新出现,以及(3)神经元可以向各个方向移动,特别是进出焦平面或出现在多个平面上4,6.手动分析非常耗时,并且随着记录长度和神经元数量的增加而变得不切实际。已经开发了各种软件程序来加速分析钙成像的过程。以前,软件是在有限的实验环境中设计的,这使得其他实验室难以采用它。最近为满足软件共享的现代标准所做的努力导致了几种工具的开发,这些工具可以一致地分析不同组的钙成像数据7,8,9,10,11,12,13,14,15,16,17,18,19.但是,这些工具中的大多数都需要编程知识和/或依赖于商业软件。缺乏编程知识和软件付费墙阻碍了研究人员采用这些方法。此外,其中许多工具专注于校正 x/y 运动,尽管 z 轴上的运动也需要明确诊断和校正6。需要一种计算工具来分析3D钙成像,该成像侧重于表现出z漂移并出现在多个z平面上的神经元。理想情况下,该工具应使用开源软件,并且不需要编程知识即可让其他实验室轻松采用它。
在这里,我们开发了一个新的ImageJ插件TACI,用于分析3D钙成像数据。首先,如果需要,软件会重命名,并按z位置组织3D钙成像数据。在每个z位置跟踪感兴趣的细胞,并通过TrackMate或其他计算工具提取其荧光强度。然后应用 TACI 来检查 z 轴上的运动。它标识 z 堆栈的最大值,并使用它来表示相应时间点的单元格强度。该工作流程适用于分析在所有方向上运动和/或神经元在横向(x/y)方向重叠但出现在不同z位置的3D钙成像。为了验证该工作流程,使用了来自大脑中苍蝇幼虫热敏神经元和蘑菇神经元的 3D 钙成像数据集。值得注意的是,TACI是一个开源的ImageJ插件,不需要任何编程知识。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 钙成像
- 苍蝇幼虫准备
注意:苍蝇和幼虫在12小时:12小时光照:黑暗循环下保持在25°C。- 用CO2麻醉苍蝇。将20-45名雄性和20-45名雌性分到每个苍蝇瓶中,并给予它们至少24小时至48小时以从CO2 暴露中恢复。
注意:苍蝇接触CO2 应持续尽可能短的时间。 - 为了同步幼虫年龄,将苍蝇敲入含有酵母颗粒的新小瓶中,并让它们产卵4-8小时。通过将苍蝇翻转到新小瓶中来去除苍蝇。
- 在72小时使用10mL的20%w / v蔗糖溶液收集幼虫。
- 用CO2麻醉苍蝇。将20-45名雄性和20-45名雌性分到每个苍蝇瓶中,并给予它们至少24小时至48小时以从CO2 暴露中恢复。
- 显微镜和温度控制设置
- 使用以下设置在共聚焦显微镜(参见 材料表)和带有载物台插入物台的z轴压电载物台上进行成像: 激光,氩气; 扫描模式,帧; 帧尺寸,512 x 512; 速度,最大值; 通道/位深度,1/8 位; 变焦,1.5; z堆栈,切片 =15, 保持 = 切片; 聚焦设备和策略, 明确的焦点; 焦点, 明确关注。
- 通过传热化合物将帕尔贴冷却模块连接到散热器上,以构建热电冷却器。帕尔贴由 2 A 电源供电。
- 将热电偶微型探头连接到数据采集设备以记录温度。
- 钙成像
- 在1x磷酸盐缓冲盐水(PBS)中冲洗幼虫3次。
- 将 75 μL 的 1x PBS 移液到载玻片的中心。
- 将一个或两个幼虫放入1x PBS中,并将热电偶微探针放置在幼虫附近。
注意:幼虫和微探针之间的距离应为~5毫米。如果微探针离幼虫太近,幼虫可能会移动。距离过长可能会导致温度读数不准确。 - 用玻璃盖玻片覆盖幼虫和热电偶微探针。用指甲油密封盖玻片。
- 将载玻片放在显微镜载物台上,使用25倍物镜找到焦点,然后将热电冷却器放在载玻片上。
注意:帕尔贴直接放置在幼虫提供温度刺激的载玻片上。 - 在共聚焦软件中,专注于感兴趣的荧光细胞。调整激光功率以避免过饱和。在 z 堆栈设置中设置第一个和最后一个切片位置。
注意:记录前使用尽可能低的激光功率,以防止光漂白。 - 同时启动z-stack扫描和温度记录。
- 控制为帕尔贴供电的电源以改变帕尔贴表面温度。打开电源以降低温度,将其关闭以升高温度。
- 停止z-stack扫描和温度记录。
2. 三维钙成像数据分析
- 将钙成像数据导出到TIFF文件,并将它们保存在与TIFF文件的基本名称相同的文件夹中。
注意:文件名 不得包含任何逗号。- 使用以下参数从ZEN(黑色版)导出钙成像数据: 文件类型,TIFF; 压缩,LZW; 通道,2;Z 位置,全部;时间,所有;相位,1;区域,已满。
- 安装
- 从Github下载TACI-Calcium_Imaging.jar(https://github.com/niflylab/TACI_CalciumImagingPlugin/releases)。
- 在斐济安装插件,方法是单击菜单栏中的插件,然后单击下拉菜单中的安装(插件 |安装)。然后,重新启动斐济。
注意: 请勿 使用 插件 |安装插件。 - 通过单击插件,然后选择 TACI-钙成像(插件 |TACI-钙成像)。
- 使用 重命名 函数将 TIFF 文件名转换为所需的结构。
注意:该工具使用 filename_h#t#z#c#.tif 作为默认结构(h# 和 c# 是可选的;#:正整数)。如果图像文件名不在默认结构中,则必须执行 RENAME 函数。- 通过单击 浏览文件夹来选择需要重命名 TIFF 图像的文件夹。
- 填写参数信息。列出了五个参数,包括文件名、相位、最大 T 位置、最大 Z 位置和通道。 每个参数有三个值:"前置文本"、"参数值"和"顺序"。
注意:该信息 区分大小写。如果图像文件名 在参数前包含短语,请将该短语填写为相应参数的前 文本 。如果图像文件名 在所有参数后都包含一个短语,请将该短语填写为 发布文本。- 请务必输入文件名、最大 T 位置和最大 Z 位置,并且最大 T 位置和最大 Z 位置的参数值包括所有数字。
- 等待文件名使用文件夹名称自动填充。
- 如果 TIFF 文件名不包含相位和通道,请将相应的参数值留空,然后依次选择 Na。
- 单击重命名以创建具有相同名称和_r的文件夹。请注意,在文件夹中,TIFF文件名已重新构建为与ORGANIZATION函数兼容。
注意:_r已添加到 TIFF 图像的文件名中。
- 使用 ORGANIZE 函数将同一 z 位置的 TIFF 图像保存在一个文件夹中。
注意:文件夹名称必须与内部 TIFF 文件的基本名称相同,并且不得包含任何逗号。- 通过单击浏览 文件夹来选择需要组织 TIFF 图像的文件夹。
- 如果参数 CSV 文件 (param.csv) 存在,请等待参数值自动填充。
注意:参数.csv文件具有所需的格式。参数(包括文件名、相位、position_t、position_z、通道和is_gray)必须从 A 列开始从左到右填写在第 1 行中。必须在第 2 行中填写每个参数的相应值。 - 如果参数 CSV 文件 (param.csv) 不存在,请手动填写参数值。确保相位和通道的参数值包含字母,而 T 位置和 Z 位置的参数值应为 t 和 z 位置的最大数。如果图像文件名不包含相位或通道,请输入 Na。
- 在需要时创建灰度 TIFF 图像。保留"图像 是灰色的吗?" 框,取消选中以对图像进行灰度化。
- 单击 "组织 "以创建具有相同名称和_gray_stacks的文件夹,并在该文件夹中生成具有相同名称和 _# (#: z 位置) 的文件夹。观察 TIFF 文件按 z 位置分类到相应的文件夹中,并生成名为 param.csv 的文件,其中可以找到参数及其值。
- 使用斐济的TrackMate从每个z位置提取感兴趣细胞的荧光强度。
注:此步骤也可以通过其他成像软件完成。- 在斐济的z位置文件夹中打开TIFF图像。
- 通过点击插件运行 TrackMate |追踪 |跟踪伴侣,并根据需要调整以下参数。
- 使用 DoG 或 LoG 探测器。
- 更改 blob 直径、阈值和 中值筛选器。将 斑点直径 调整为与细胞直径相似。如果单元格为椭圆形,请将 斑点直径 调整为与短轴相似。
注意:提高 阈值 有助于避免背景噪声被拾取为信号,而不会影响信号强度(补充图1)。但是, 阈值 的增加可能会错过真实信号(补充图1)。如果信号较强,请使用 中值滤波器 来降低盐和胡椒噪声。 - 设置过滤器以删除一些(如果不是全部)不相关的信号。 过滤器 X 和 Y 是空间过滤器。使用 滤波器 X 和 Y 删除与真实信号相距甚远的不相关信号。
注意:在一个图像上设置滤波器时,检查所有其他图像以确保不会删除真实信号至关重要。 - 设置链接最大距离、间隙闭合最大距离和间隙闭合最大帧间距。将链接最大距离和间隙闭合最大距离设置为斑点直径的 3x-5 倍,尤其是当样本随时间显著移动时,以帮助减少轨迹数量。将间隙闭合最大帧间隙设置为堆栈中的图像数。
- 将感兴趣区域 (ROI) 的荧光强度导出到 CSV 文件。如果使用旧的 TrackMate 版本,请在"选择操作"窗口中选择"导出所有斑点统计信息"。如果 TrackMate 版本为 7.6.1 或更高版本,请在"显示选项"窗口中选择"斑点"。将交互式文件导出或另存为 CSV 文件。
注意:这两个文件都与图像窗互;突出显示 ROI 会在图像窗口中显示相应的 ROI。这些文件包括感兴趣的单元格在相应时间点(POSITION_T)的平均强度(MEAN_INTENSITY或MEAN_INTENSITY_CH1)。相同的TRACK_IDs应代表不同时间点的相同投资回报率。但是,这并不总是正确的,可能需要在必要时手动更正。如果 TrackMate 无法识别某些时间点的投资回报率,则不会显示这些时间点。
- 提取背景荧光强度,并创建Background_list.csv文件。
注意:在本研究中,每个z位置的背景强度是通过使用三到五个相邻的相同大小的斑点的平均值来估计的,这些斑点不包含荧光信号并且来自不同的时间点。- Background_list.csv文件具有所需的格式:每列包含一个神经元的信息,从神经元 0 开始。在第 1 行中填写神经元编号,例如神经元 0。然后,为分析的每个 z 位置提供背景强度 - 如果针对神经元 0 分析了五个 z 位置,请填写神经元 0 以下的五个背景强度值。
注意:TACI 提取 功能需要Background_list.csv文件。如果背景可以忽略不计,则必须提供每个神经元背景强度为零的Background_list.csv。
- Background_list.csv文件具有所需的格式:每列包含一个神经元的信息,从神经元 0 开始。在第 1 行中填写神经元编号,例如神经元 0。然后,为分析的每个 z 位置提供背景强度 - 如果针对神经元 0 分析了五个 z 位置,请填写神经元 0 以下的五个背景强度值。
- 使用 EXTRACT 函数确定每个 t 位置的最大荧光强度,并计算 ΔF/F0,如公式 (1) 所示。
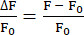 (1)
(1)- 创建一个文件夹并使用神经元编号命名它,从神经元 0 开始。将包含相应神经元荧光信息的CSV文件保存在文件夹中。每个 CSV 文件包含一个 z 位置的信息,因此 CSV 文件的数量等于分析的 z 位置数量。将 CSV 文件命名为 Mean_Intensity#.csv(# 表示 z 位置),每个 CSV 文件至少包含两列:POSITION_T 和 MEAN_INTENSITY 或 MEAN_INTENSITY_CH1。
注意:为每个感兴趣的单元格创建一个文件夹。 - 将步骤 2.7.1 中创建的Background_list.csv文件和文件夹保存在一个文件夹中。通过单击" 浏览文件"选择此文件夹。
注意:Background_list.csv文件中的背景值数量必须与每个神经元的 Mean_Intensity#.csv 文件的数量相匹配。 - 后台文件会自动填充。为 T 仓数填写最大数量的 t 仓位。
- 单击 "提取 "以创建结果文件夹,包括每个神经元的 CSV 文件和绘图。CSV 文件包括有关每个 t 位置的最大荧光强度和 ΔF/F0 的信息。这些图是 Δf/F0 在 t 位置上的折线图。
注意:在本研究中,ΔF/F0 是使用公式 (1) 计算的。每个 z 位置的第一个值用作 F0。如果此 F0 不适合20,则插件提供包含 python_files 文件夹中每个神经元的原始数据的文件。
- 创建一个文件夹并使用神经元编号命名它,从神经元 0 开始。将包含相应神经元荧光信息的CSV文件保存在文件夹中。每个 CSV 文件包含一个 z 位置的信息,因此 CSV 文件的数量等于分析的 z 位置数量。将 CSV 文件命名为 Mean_Intensity#.csv(# 表示 z 位置),每个 CSV 文件至少包含两列:POSITION_T 和 MEAN_INTENSITY 或 MEAN_INTENSITY_CH1。
- 使用 MERGE 函数平均每个神经元的 ΔF/F 0,计算 SEM,并在 t 位置上绘制平均 ΔF/F0。
- 通过单击浏览文件选择由 EXTRACT 函数创建的结果文件夹。
- 填写 T 仓数最多的 T 仓位数 。
- 单击 "合并 "以创建merged_data文件夹,包括merged_data.csv文件和Average_dF_F0.png打印。CSV 文件包括每个 t 位置的平均值和 SEM ΔF/F0 的信息。该图是 t 位置上平均 ΔF/F0 的折线图。
Access restricted. Please log in or start a trial to view this content.
结果
三维钙成像分析工作流程
在这项研究中,我们开发了一个新的 ImageJ 插件 TACI,并描述了一种跟踪 z 漂移和分析 3D 钙成像的工作流程,该工作流程可精确定位出现在多个 z 位置的单个细胞的反应(图 1)。此工具有四个功能:重命名、组织、提取和合并。首先,如果图像名称与 ORGANIZE 函数不兼容,...
Access restricted. Please log in or start a trial to view this content.
讨论
这项研究开发了一个新的ImageJ插件TACI,并描述了分析3D钙成像的工作流程。许多当前可用的工具专注于校正 x/y 运动,尽管 z 轴上的运动也需要明确诊断或校正6。在活体生物体的图像采集过程中,即使生物体被固定,z轴上的运动也是不可避免的,并且某些刺激(例如温度变化)通常会导致显着的z漂移。增加z堆栈的高度将允许在整个成像过程中记录感兴趣的细胞;但是,分析 z 轴...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有利益冲突需要披露。
致谢
弗拉林成像中心的蔡司LSM 880用于收集钙成像数据。我们感谢Michelle L Olsen博士和Yuhang Pan在IMARIS软件方面的帮助。我们感谢 Lenwood S. Heath 博士对手稿的建设性评论,感谢 Steven Giavasis 对 GitHub README 文件的评论。这项工作得到了NIH R21MH122987(https://www.nimh.nih.gov/index.shtml)和NIH R01GM140130(https://www.nigms.nih.gov/)对L.N.的支持。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Blunt Fill Needel | BD | 303129 | |
| Calcium chloride dihydrate | Fisher Scientific | 10035-04-8 | Fly food ingredient |
| Carbon dioxide | Airgas | UN1013 | Size 200 High Pressure Steel Cylinder |
| CO2 bubbler kit | Genesee | 59-180 | |
| Confocal microscope LSM880 | Zeiss | 4109002107876000 | An inverted Axio Observer Z1, equipped with 5 lasers, 2 standard PMT detectors, 32-channel GaAsP dectectors, an Airyscan detector, and Definite Focus.2. |
| DAQami software | Measurement Computing | ||
| Dextrose | Genesee | 62-113 | Fly food ingredient |
| Drosophila Agar | Genesee | 66-111 | Fly food ingredient |
| Ethanol | Decon Labs, Inc. | 64-17-5 | Fly food ingredient |
| Fly line: Ir21a-Gal4 | Dr. Paul Garrity lab | A kind gift | |
| Fly line: Ir21a-Gal80 | Dr. Lina Ni lab | ||
| Fly line: Ir68a-Gal4 | Dr. Aravinthan DT Samuel lab | A kind gift | |
| Fly line: Ir93a-Gal4 | Dr. Paul Garrity lab | A kind gift | |
| Fly line: UAS-GCaMP6 | Bloomington Drosophila Stock Center | 42750 | |
| Flypad | Genesee | 59-114 | |
| General purpose forged brass regulator | Gentec | G152 | |
| Gibco PBS pH 7.4 (1x) | Thermo Fisher Scientific | 10010-031 | |
| Green Drosophila tubing | Genesee | 59-124 | |
| Heat transfer compound | MG Chemicals | 860-60G | |
| Heatsink | Digi-Key Electronics | ATS2193-ND | Resize to 12.9 x 5.5 cm |
| Illuminator | AmScope | LED-6W | |
| Inactive Dry Yeast | Genesee | 62-108 | Fly food ingredient |
| Incubator | Pervical | DR-41VL | Light: dark cycle: 12h:12h; temperature: 25 °C; humidity: 40-50% RH. |
| Methyl-4-hydroxybenzoate | Thermo Scientific | 126965000 | Fly food ingrediete |
| Micro cover glass | VWR | 48382-126 | 22 x 40 mm |
| Microscope slides | Fisher Scientific | 12-544-2 | 25 x 75 x 1.0 mm |
| Nail polish | Kleancolor | ||
| Narrow Drosophila vials | Genesee | 32-113RL | |
| Objective | Zeiss | 420852-9871-000 | LD LCI Plan-Apochromat 25x/0.8 Imm Corr DIC M27 |
| Peltier cooling module | TE Technology | TE-127-1.0-0.8 | 30 x 30 mm |
| Plugs | Genesee | 49-102 | |
| Power Supply | Circuit Specialists | CSI1802X | 10 volt DC 2.0 amp linear bench power supply |
| Princeton Artist Brush Nepture | Princeton Artist Brush Co. | Series 4750, size 2 | |
| Sodium potassium L-tartrate tetrahydrate | Thermo Scientific | 033241-36 | Fly food ingredient |
| Stage insert | Wienecke and Sinske | 432339-9030-000 | |
| Stereo Microscope | Olympus | SZ61 | Any stereo microscope works |
| T-Fitting | Genesee | 59-123 | |
| Thermocouple data acquisition device | Measurement Computing | USB-2001-TC | Single channel |
| Thermocouple microprobe | Physitemp | IT-24P | |
| Yellow Cornmeal | Genesee | 62-101 | Fly food ingredient |
| Z-axis piezo stage | Wienecke and Sinske | 432339-9000-000 |
参考文献
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Zhang, Y., et al. jGCaMP8 fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Robbins, M., Christensen, C. N., Kaminski, C. F., Zlatic, M. Calcium imaging analysis - How far have we come. F1000Research. 10, 258(2021).
- Oh, J., Lee, C., Kaang, B. K. Imaging and analysis of genetically encoded calcium indicators linking neural circuits and behaviors. The Korean Journal of Physiology & Pharmacology. 23 (4), 237-249 (2019).
- Stringer, C., Pachitariu, M. Computational processing of neural recordings from calcium imaging data. Current Opinion in Neurobiology. 55, 22-31 (2019).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. Journal of Neuroscience Methods. 291, 83-94 (2017).
- Nguyen, J. P., Linder, A. N., Plummer, G. S., Shaevitz, J. W., Leifer, A. M. Automatically tracking neurons in a moving and deforming brain. PLoS Computational Biology. 13 (5), 1005517(2017).
- Lagache, T., Hanson, A., Pérez-Ortega, J. E., Fairhall, A., Yuste, R. EMC2: A versatile algorithm for robust tracking of calcium dynamics from individual neurons in behaving animals. bioRxiv. , (2021).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173(2019).
- Delestro, F., et al. In vivo large-scale analysis of Drosophila neuronal calcium traces by automated tracking of single somata. Scientific Reports. 10, 7153(2020).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25(2020).
- Eglen, S. J., et al. Toward standard practices for sharing computer code and programs in neuroscience. Nature Neuroscience. 20 (6), 770-773 (2017).
- Pachitariu, M., et al. Suite2p: Beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , (2017).
- Corder, G., et al. An amygdalar neural ensemble that encodes the unpleasantness of pain. Science. 363 (6424), 276-281 (2019).
- Lagache, T., Hanson, A., Pérez-Ortega, J. E., Fairhall, A., Yuste, R. Tracking calcium dynamics from individual neurons in behaving animals. PLoS Computational Biology. 17 (10), 1009432(2021).
- Kolar, K., Dondorp, D., Zwiggelaar, J. C., Høyer, J., Chatzigeorgiou, M. Mesmerize is a dynamically adaptable user-friendly analysis platform for 2D and 3D calcium imaging data. Nature Communications. 12, 6569(2021).
- Moein, M., et al. CaSiAn: A Calcium Signaling Analyzer tool. Bioinformatics. 34 (17), 3052-3054 (2018).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728(2018).
- Neugornet, A., O'Donovan, B., Ortinski, P. I. Comparative effects of event detection methods on the analysis and interpretation of Ca(2+) imaging data. Frontiers in Neuroscience. 15, 620869(2021).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Fazeli, E., et al. Automated cell tracking using StarDist and TrackMate. F1000Research. 9, 1279(2020).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ni, L., et al. The ionotropic receptors IR21a and IR25a mediate cool sensing in Drosophila. Elife. 5, 13254(2016).
- Omelchenko, A. A., et al. Cool and warm ionotropic receptors control multiple thermotaxes in Drosophila larvae. Frontiers in Molecular Neuroscience. , (2022).
- Sanchez-Alcaniz, J. A., et al. An expression atlas of variant ionotropic glutamate receptors identifies a molecular basis of carbonation sensing. Nature Communications. 9 (1), 4252(2018).
- Hernandez-Nunez, L., et al. Synchronous and opponent thermosensors use flexible cross-inhibition to orchestrate thermal homeostasis. Science Advances. 7 (35), (2021).
- Klein, M., et al. Sensory determinants of behavioral dynamics in Drosophila thermotaxis. Proceedings of the National Academy of Sciences of the United States of America. 112 (2), 220-229 (2015).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。