Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
TACI: Un plugin de ImageJ para el análisis de imágenes de calcio 3D
En este artículo
Resumen
TrackMate Analysis of Calcium Imaging (TACI) es un complemento de código abierto de ImageJ para el análisis de imágenes de calcio en 3D que examina el movimiento en el eje z e identifica el valor máximo de cada pila z para representar la intensidad de una celda en el punto de tiempo correspondiente. Puede separar neuronas que se superponen en la dirección lateral (x / y) pero en diferentes planos z.
Resumen
La investigación en neurociencia ha evolucionado para utilizar imágenes complejas y herramientas computacionales para extraer información completa de conjuntos de datos. La imagen de calcio es una técnica ampliamente utilizada que requiere un software sofisticado para obtener resultados confiables, pero muchos laboratorios luchan por adoptar métodos computacionales al actualizar los protocolos para cumplir con los estándares modernos. Las dificultades surgen debido a la falta de conocimientos de programación y paywalls para el software. Además, las células de interés muestran movimientos en todas las direcciones durante las imágenes de calcio. Se han desarrollado muchos enfoques para corregir el movimiento en la dirección lateral (x / y).
Este documento describe un flujo de trabajo utilizando un nuevo complemento de ImageJ, TrackMate Analysis of Calcium Imaging (TACI), para examinar el movimiento en el eje z en imágenes de calcio 3D. Este software identifica el valor máximo de fluorescencia de todas las posiciones z en las que aparece una neurona y lo utiliza para representar la intensidad de la neurona en la posición t correspondiente. Por lo tanto, esta herramienta puede separar neuronas que se superponen en la dirección lateral (x / y) pero que aparecen en distintos planos z. Como complemento de ImageJ, TACI es una herramienta computacional de código abierto fácil de usar para el análisis de imágenes de calcio en 3D. Validamos este flujo de trabajo utilizando neuronas termosensibles larvales de mosca que mostraban movimientos en todas las direcciones durante la fluctuación de la temperatura y un conjunto de datos de imágenes de calcio en 3D adquiridos del cerebro de la mosca.
Introducción
El nivel de calcio intracelular es un marcador preciso de excitabilidad neuronal. La imagen de calcio mide los cambios en el calcio intracelular para comprender la actividad neuronal1. Los estudios en neurociencia han utilizado cada vez más este método debido al desarrollo de técnicas para medir la concentración intracelular de calcio, incluidos los indicadores de calcio codificados genéticamente (GECI), como GCaMP2,3, que pueden expresarse de forma no invasiva en conjuntos específicos de neuronas a través de enfoques genéticos. Los menores costos de los láseres y los componentes del microscopio también han aumentado el uso de imágenes de calcio4. Es importante destacar que las imágenes de calcio permiten registrar y estudiar neuronas individuales, así como grandes poblaciones de neuronas simultáneamente en animales que se mueven libremente5.
Sin embargo, el análisis de los datos de imágenes de calcio es desafiante porque (1) implica rastrear los cambios en la fluorescencia de las células individuales a lo largo del tiempo, (2) la señal de fluorescencia desaparece intermitentemente o reaparece con respuestas neuronales, y (3) las neuronas pueden moverse en todas las direcciones, específicamente dentro y fuera de un plano focal o apareciendo en múltiples planos4, 6. El análisis manual requiere mucho tiempo y se vuelve poco práctico a medida que aumenta la duración de las grabaciones y el número de neuronas. Se han desarrollado varios programas de software para acelerar el proceso de análisis de imágenes de calcio. Anteriormente, el software se diseñaba en un contexto experimental limitado, lo que dificultaba que otros laboratorios lo adoptaran. Los esfuerzos recientes para cumplir con los estándares modernos para el intercambio de software han llevado al desarrollo de varias herramientas que pueden analizar consistentemente los datos de imágenes de calcio en diferentes grupos 7,8,9,10,11,12,13,14,15,16,17,18,19 . Sin embargo, la mayoría de estas herramientas requieren conocimientos de programación y/o dependen de software comercial. La falta de conocimientos de programación y los muros de pago de software disuaden a los investigadores de adoptar estos métodos. Además, muchas de estas herramientas se centran en corregir el movimiento x/y, aunque el movimiento en el eje z también necesita ser diagnosticado y corregido explícitamente6. Existe la necesidad de una herramienta computacional para analizar imágenes de calcio 3D que se centren en las neuronas que exhiben z-drift y aparecen en múltiples z-planos. Idealmente, esta herramienta debería usar software de código abierto y no requerir conocimientos de programación para permitir que otros laboratorios la adopten fácilmente.
Aquí, desarrollamos un nuevo complemento de ImageJ, TACI, para analizar datos de imágenes de calcio en 3D. Primero, el software cambia el nombre, si es necesario, y organiza los datos de imágenes de calcio 3D por posiciones z. Las células de interés se rastrean en cada posición z, y sus intensidades de fluorescencia son extraídas por TrackMate u otras herramientas computacionales. Luego se aplica TACI para examinar el movimiento en el eje z. Identifica el valor máximo de una pila z y lo utiliza para representar la intensidad de una celda en el punto de tiempo correspondiente. Este flujo de trabajo es adecuado para analizar imágenes 3D de calcio con movimiento en todas las direcciones y / o con neuronas superpuestas en la dirección lateral (x / y) pero que aparecen en diferentes posiciones z. Para validar este flujo de trabajo, se utilizaron conjuntos de datos de imágenes de calcio 3D de neuronas termosensibles larvales de moscas y neuronas de hongos en el cerebro. Cabe destacar que TACI es un complemento de código abierto de ImageJ y no requiere ningún conocimiento de programación.
Protocolo
1. Imágenes de calcio
- Preparación de larvas de mosca
NOTA: Las moscas y larvas se mantienen a 25 °C bajo un ciclo de luz:oscuridad de 12 h:12 h.- Anestesiar las moscas conCO2. Clasificar 20-45 machos y 20-45 hembras en cada vial de mosca, y darles al menos 24 h a 48 h para recuperarse de la exposición alCO2 .
NOTA: La exposición de las moscas alCO2 debe durar el menor tiempo posible. - Para sincronizar la edad de las larvas, golpee sobre las moscas en nuevos viales que contengan gránulos de levadura y déjelas 4-8 h para poner huevos. Retire las moscas volteándolas en viales nuevos.
- Recolectar las larvas a las 72 h usando 10 mL de solución de sacarosa al 20% p/v.
- Anestesiar las moscas conCO2. Clasificar 20-45 machos y 20-45 hembras en cada vial de mosca, y darles al menos 24 h a 48 h para recuperarse de la exposición alCO2 .
- Configuración del microscopio y del control de temperatura
- Realice la obtención de imágenes en un microscopio confocal (consulte la Tabla de materiales) y una etapa piezoeléctrica del eje z con un inserto de escenario utilizando los siguientes ajustes: láser, argón; modo de escaneo, marco; tamaño del marco, 512 x 512; velocidad, máximo; canales/profundidad de bits, 1/8 bit; zoom, 1.5; pila z, corte = 15, Keep = corte; dispositivos de enfoque y estrategia, enfoque definido; enfoque, Enfoque definido en.
- Conecte un módulo de enfriamiento Peltier a un disipador de calor mediante el compuesto de transferencia de calor para construir un enfriador termoeléctrico. El Peltier funciona con una fuente de alimentación de 2 A.
- Conecte una microsonda de termopar a un dispositivo de adquisición de datos para registrar la temperatura.
- Imágenes de calcio
- Enjuague las larvas 3 veces en 1x solución salina tamponada con fosfato (PBS).
- Pipetear 75 μL de 1x PBS en el centro de un portaobjetos de vidrio.
- Coloque una o dos larvas en 1x PBS y coloque la microsonda del termopar cerca de las larvas.
NOTA: La distancia entre las larvas y la microsonda debe ser ~5 mm. Las larvas pueden moverse si la microsonda se coloca demasiado cerca de ellas. Una gran distancia podría resultar en lecturas de temperatura inexactas. - Cubra las larvas y la microsonda del termopar con un cubreobjetos de vidrio. Selle el cubreobjetos con esmalte de uñas.
- Coloque el portaobjetos en la platina del microscopio, encuentre el enfoque con un objetivo de 25x y coloque el enfriador termoeléctrico en el portaobjetos.
NOTA: El Peltier se coloca directamente en el portaobjetos donde las larvas deben entregar los estímulos de temperatura. - En el software confocal, concéntrese en las células fluorescentes de interés. Ajuste la potencia del láser para evitar sobresaturación. Establezca las posiciones de primer y último sector en la configuración z-stack.
NOTA: Utilice la potencia láser más baja posible antes de grabar para evitar el fotoblanqueo. - Inicie el escaneo z-stack y el registro de temperatura al mismo tiempo.
- Controle la fuente de alimentación que alimenta el Peltier para cambiar la temperatura de la superficie del Peltier. Encienda la fuente de alimentación para disminuir la temperatura y apáguela para aumentar la temperatura.
- Detenga el escaneo z-stack y el registro de temperatura.
2. Análisis de los datos de imágenes de calcio 3D
- Exporte los datos de imágenes de calcio a archivos TIFF y guárdelos en una carpeta con el mismo nombre que el nombre base de los archivos TIFF dentro.
Nota : el nombre de archivo no debe contener comas.- Utilice los siguientes parámetros para exportar los datos de imágenes de calcio de ZEN (edición negra): tipo de archivo, TIFF; compresión, LZW; canales, 2; posición Z, todos; tiempo, todo; fase, 1; región, lleno.
- Instalación
- Descargue TACI-Calcium_Imaging.jar desde Github (https://github.com/niflylab/TACI_CalciumImagingPlugin/releases).
- Instale el complemento en FIJI haciendo clic en Plugins en la barra de menú y luego haciendo clic en Instalar en el menú desplegable (Plugins | Instalar). A continuación, reinicie FIJI.
NOTA: NO utilice plugins | Instalar plugin. - Ejecute el complemento haciendo clic en Plugins y luego eligiendo TACI-Calcium Imaging (Plugins | TACI-Imágenes de calcio).
- Utilice la función RENAME para convertir los nombres de archivo TIFF a la estructura necesaria.
NOTA: La herramienta utiliza filename_h#t#z#c#.tif como estructura predeterminada (h# y c# son opcionales; #: un entero positivo). Si los nombres de archivo de imagen no están en la estructura predeterminada, se debe ejecutar la función RENAME .- Elija la carpeta en la que es necesario cambiar el nombre de las imágenes TIFF haciendo clic en Examinar carpetas.
- Rellene la información del parámetro. Se enumeran cinco parámetros, incluidos Nombre de archivo, Fase, Posición T máxima, Posición Z máxima y Canal. Cada parámetro tiene tres valores: Texto anterior, Valor del parámetro y Orden.
NOTA: La información distingue entre mayúsculas y minúsculas. Si los nombres de archivo de imagen contienen una frase antes de un parámetro, rellene la frase como Texto anterior del parámetro correspondiente. Si los nombres de archivo de imagen contienen una frase después de todos los parámetros, rellene la frase como Texto de publicación.- Asegúrese de escribir Nombre de archivo, Posición T máxima y Posición Z máxima y que los valores de los parámetros para Posición T máxima y Posición Z máxima incluyan todos los dígitos.
- Espere a que el nombre de archivo se rellene automáticamente con el nombre de carpeta.
- Si los nombres de archivo TIFF no incluyen la fase y el canal, deje en blanco el valor del parámetro correspondiente y elija Na en orden.
- Haga clic en Cambiar nombre para crear una carpeta con el mismo nombre y _r. Observe que en la carpeta, los nombres de archivo TIFF se han reestructurado para que sean compatibles con la función ORGANIZAR .
NOTA: _r se ha agregado a los nombres de archivo de las imágenes TIFF.
- Utilice la función ORGANIZE para guardar las imágenes TIFF desde la misma posición z en una carpeta.
NOTA: El nombre de la carpeta debe tener el mismo nombre que el nombre base de los archivos TIFF dentro y NO debe tener comas.- Elija la carpeta en la que las imágenes TIFF deben organizarse haciendo clic en Examinar carpetas.
- Si el archivo CSV de parámetros (param.csv) existe, espere a que los valores de los parámetros se rellenen automáticamente.
Nota: El archivo param.csv tiene un formato requerido. Los parámetros, incluidos el nombre de archivo, la fase, el position_t, el position_z, el canal y is_gray, deben rellenarse en la fila 1 de izquierda a derecha a partir de la columna A. Los valores correspondientes para cada parámetro deben rellenarse en la fila 2. - Si el archivo CSV de parámetros (param.csv) no existe, rellene manualmente los valores de los parámetros. Asegúrese de que los valores de los parámetros de Fase y Canal incluyan letras, mientras que los valores de parámetro de Posición T y Posición Z deben ser los números más grandes de las posiciones t y z. Si los nombres de archivo de imagen no incluyen la fase o el canal, escriba Na.
- Cree imágenes TIFF en escala de grises cuando sea necesario. Deje la casilla de ¿Son las imágenes grises? sin marcar para escalar grises las imágenes.
- Haga clic en Organizar para crear una carpeta con el mismo nombre y _gray_stacks y para generar carpetas con el mismo nombre y _# (#: z-positions) en la carpeta. Observe que los archivos TIFF están ordenados en las carpetas correspondientes por posiciones z y que se genera un archivo llamado param.csv, en el que se pueden encontrar los parámetros y sus valores.
- Utilice TrackMate en FIJI para extraer las intensidades de fluorescencia de las células de interés de cada posición z.
NOTA: Este paso también se puede realizar con otro software de imágenes.- Abra las imágenes TIFF en una carpeta z-position de FIJI.
- Ejecute TrackMate haciendo clic en Plugins | Seguimiento | TrackMate y ajuste los siguientes parámetros si es necesario.
- Utilice detectores DoG o LoG.
- Cambie el diámetro del blob, el umbral y el filtro mediano. Ajuste el diámetro de la mancha para que sea similar al diámetro de las celdas. Si las celdas son ovaladas, ajuste el diámetro de la mancha para que sea similar al eje menor.
NOTA: El aumento del umbral ayuda a evitar que el ruido de fondo se capte como señales sin afectar a las intensidades de la señal (Figura complementaria 1). Sin embargo, un aumento en el umbral puede pasar por alto señales verdaderas (Figura complementaria 1). Si las señales son fuertes, use el filtro mediano para disminuir el ruido de sal y pimienta. - Configure los filtros para eliminar algunas, si no todas, las señales irrelevantes. Los filtros X e Y son filtros espaciales. Utilice los filtros X e Y para eliminar las señales irrelevantes que están distantes de las señales reales.
NOTA: Cuando se establecen filtros en una imagen, es crucial verificar todas las demás imágenes para asegurarse de que no se eliminen las señales reales. - Establezca la distancia máxima de vinculación, la distancia máxima de cierre de huecos y el espacio máximo de fotogramas de cierre de huecos. Establezca la distancia máxima de enlace y la distancia máxima de cierre de espacios para que sean 3x-5x el diámetro de la mancha, especialmente cuando las muestras se mueven significativamente con el tiempo, para ayudar a disminuir el número de pistas. Establezca el espacio máximo de fotogramas que cierra el espacio en el número de imágenes de la pila.
- Exporte las intensidades de fluorescencia de las regiones de interés (ROI) a un archivo CSV. Si se utiliza una versión antigua de TrackMate, elija Exportar todas las estadísticas de anuncios en la ventana Seleccionar una acción . Si la versión de TrackMate es 7.6.1 o superior, elija Spots en la ventana Opciones de pantalla . Exporte o guarde como archivos interactivos en archivos CSV.
NOTA: Ambos archivos son interactivos con la ventana de imagen; resaltar un ROI muestra el ROI correspondiente en la ventana de la imagen. Estos archivos incluyen las intensidades medias (MEAN_INTENSITY o MEAN_INTENSITY_CH1) de las celdas de interés en los puntos de tiempo correspondientes (POSITION_T). El mismo TRACK_IDs debe representar el mismo ROI en diferentes puntos de tiempo. Sin embargo, esto no siempre es cierto y puede necesitar ser corregido manualmente, cuando sea necesario. Si TrackMate no reconoce los ROI en algunos puntos de tiempo, esos puntos de tiempo no se muestran.
- Extraiga la intensidad de fluorescencia de fondo y cree el archivo Background_list.csv.
NOTA: En este estudio, la intensidad de fondo para cada posición z se estimó utilizando el valor promedio de tres a cinco manchas vecinas del mismo tamaño que no contenían señales de fluorescencia y provenían de diferentes puntos de tiempo.- El archivo Background_list.csv tiene un formato requerido: cada columna contiene la información de una neurona, a partir de la neurona 0. Rellene los números de neurona, como Neurona 0, en la fila 1. Luego, proporcione la intensidad de fondo para cada posición z analizada; si se analizan cinco posiciones z para la neurona 0, complete cinco valores de intensidad de fondo debajo de la neurona 0.
NOTA: El archivo Background_list.csv es necesario para la función TACI EXTRACT . Si el fondo es insignificante, se debe proporcionar el Background_list.csv con la intensidad de fondo cero de cada neurona.
- El archivo Background_list.csv tiene un formato requerido: cada columna contiene la información de una neurona, a partir de la neurona 0. Rellene los números de neurona, como Neurona 0, en la fila 1. Luego, proporcione la intensidad de fondo para cada posición z analizada; si se analizan cinco posiciones z para la neurona 0, complete cinco valores de intensidad de fondo debajo de la neurona 0.
- Utilice la función EXTRACT para identificar las intensidades máximas de fluorescencia en cada posición t y calcular ΔF/F0 como se muestra en la ecuación (1).
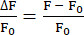 (1)
(1)- Cree una carpeta y asígnele un nombre con el número de neurona, comenzando por Neurona 0. Guarde los archivos CSV que contienen la información de fluorescencia de la neurona correspondiente en la carpeta. Cada archivo CSV contiene la información de una posición z, por lo que el número de archivos CSV es igual al número de posiciones z analizadas. Asigne a los archivos CSV el nombre Mean_Intensity#.csv (# representa la posición z) y cada archivo CSV incluye al menos dos columnas: POSITION_T y MEAN_INTENSITY o MEAN_INTENSITY_CH1.
NOTA: Cree una carpeta para cada celda de interés. - Guarde el archivo Background_list.csv y las carpetas creadas en el paso 2.7.1 en una carpeta. Elija esta carpeta haciendo clic en Examinar archivos.
Nota : el número de valores de fondo en el archivo de Background_list.csv debe coincidir con el número de los archivos Mean_Intensity#.csv para cada neurona. - El archivo de fondo se rellena automáticamente. Complete el mayor número de posiciones t para el número de posiciones T.
- Haga clic en Extraer para crear una carpeta de resultados, incluidos los archivos CSV y los gráficos de cada neurona. Los archivos CSV incluyen información sobre la intensidad máxima de fluorescencia y ΔF/F0 en cada posición t. Los gráficos son gráficos de líneas de ΔF/F0 sobre posiciones t.
NOTA: En este estudio, ΔF/F0 se calculó utilizando la ecuación (1). El primer valor de cada posición z se utilizó como F0. Si este F0 no es apropiado20, el complemento proporciona archivos que incluyen datos sin procesar para cada neurona en la carpeta python_files.
- Cree una carpeta y asígnele un nombre con el número de neurona, comenzando por Neurona 0. Guarde los archivos CSV que contienen la información de fluorescencia de la neurona correspondiente en la carpeta. Cada archivo CSV contiene la información de una posición z, por lo que el número de archivos CSV es igual al número de posiciones z analizadas. Asigne a los archivos CSV el nombre Mean_Intensity#.csv (# representa la posición z) y cada archivo CSV incluye al menos dos columnas: POSITION_T y MEAN_INTENSITY o MEAN_INTENSITY_CH1.
- Utilice la función MERGE para promediar el ΔF/F 0 de cada neurona, calcular el SEM y trazar el promedio de ΔF/F0 sobre las posiciones t.
- Elija la carpeta de resultados creada por la función EXTRACT haciendo clic en Examinar archivos.
- Rellene el número de posiciones T con el mayor número de posiciones t.
- Haga clic en Combinar para crear una carpeta merged_data, incluido un archivo merged_data.csv y un trazado de Average_dF_F0.png. El archivo CSV incluye la información sobre el promedio y SEM ΔF / F0 en cada posición t. El gráfico es un gráfico de líneas del promedio ΔF/F0 sobre las posiciones t.
Resultados
Flujo de trabajo del análisis de imágenes de calcio 3D
En este estudio, desarrollamos un nuevo complemento de ImageJ, TACI, y describimos un flujo de trabajo para rastrear la deriva z y analizar imágenes de calcio 3D que señalan las respuestas de las células individuales que aparecen en múltiples posiciones z (Figura 1). Esta herramienta tiene cuatro funciones: RENAME, ORGANIZE, EXTRACT y MERGE. En ...
Discusión
Este estudio desarrolló un nuevo complemento de ImageJ, TACI, y describió un flujo de trabajo que analiza las imágenes de calcio en 3D. Muchas herramientas actualmente disponibles se centran en corregir el movimiento x/y, aunque el movimiento en el eje z también necesita ser diagnosticado o corregido explícitamente6. Durante la adquisición de imágenes en un organismo vivo, el movimiento en el eje z es inevitable incluso cuando el organismo está inmovilizado, y algunos estímulos, como el c...
Divulgaciones
Los autores no tienen conflictos de intereses que revelar.
Agradecimientos
Se utilizó un Zeiss LSM 880 en el Fralin Imaging Center para recopilar los datos de imágenes de calcio. Agradecemos a la Dra. Michelle L Olsen y Yuhang Pan por su ayuda con el software IMARIS. Agradecemos al Dr. Lenwood S. Heath por sus comentarios constructivos sobre el manuscrito y a Steven Giavasis por sus comentarios sobre el archivo README de GitHub. Este trabajo fue apoyado por NIH R21MH122987 (https://www.nimh.nih.gov/index.shtml) y NIH R01GM140130 (https://www.nigms.nih.gov/) a L.N. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Blunt Fill Needel | BD | 303129 | |
| Calcium chloride dihydrate | Fisher Scientific | 10035-04-8 | Fly food ingredient |
| Carbon dioxide | Airgas | UN1013 | Size 200 High Pressure Steel Cylinder |
| CO2 bubbler kit | Genesee | 59-180 | |
| Confocal microscope LSM880 | Zeiss | 4109002107876000 | An inverted Axio Observer Z1, equipped with 5 lasers, 2 standard PMT detectors, 32-channel GaAsP dectectors, an Airyscan detector, and Definite Focus.2. |
| DAQami software | Measurement Computing | ||
| Dextrose | Genesee | 62-113 | Fly food ingredient |
| Drosophila Agar | Genesee | 66-111 | Fly food ingredient |
| Ethanol | Decon Labs, Inc. | 64-17-5 | Fly food ingredient |
| Fly line: Ir21a-Gal4 | Dr. Paul Garrity lab | A kind gift | |
| Fly line: Ir21a-Gal80 | Dr. Lina Ni lab | ||
| Fly line: Ir68a-Gal4 | Dr. Aravinthan DT Samuel lab | A kind gift | |
| Fly line: Ir93a-Gal4 | Dr. Paul Garrity lab | A kind gift | |
| Fly line: UAS-GCaMP6 | Bloomington Drosophila Stock Center | 42750 | |
| Flypad | Genesee | 59-114 | |
| General purpose forged brass regulator | Gentec | G152 | |
| Gibco PBS pH 7.4 (1x) | Thermo Fisher Scientific | 10010-031 | |
| Green Drosophila tubing | Genesee | 59-124 | |
| Heat transfer compound | MG Chemicals | 860-60G | |
| Heatsink | Digi-Key Electronics | ATS2193-ND | Resize to 12.9 x 5.5 cm |
| Illuminator | AmScope | LED-6W | |
| Inactive Dry Yeast | Genesee | 62-108 | Fly food ingredient |
| Incubator | Pervical | DR-41VL | Light: dark cycle: 12h:12h; temperature: 25 °C; humidity: 40-50% RH. |
| Methyl-4-hydroxybenzoate | Thermo Scientific | 126965000 | Fly food ingrediete |
| Micro cover glass | VWR | 48382-126 | 22 x 40 mm |
| Microscope slides | Fisher Scientific | 12-544-2 | 25 x 75 x 1.0 mm |
| Nail polish | Kleancolor | ||
| Narrow Drosophila vials | Genesee | 32-113RL | |
| Objective | Zeiss | 420852-9871-000 | LD LCI Plan-Apochromat 25x/0.8 Imm Corr DIC M27 |
| Peltier cooling module | TE Technology | TE-127-1.0-0.8 | 30 x 30 mm |
| Plugs | Genesee | 49-102 | |
| Power Supply | Circuit Specialists | CSI1802X | 10 volt DC 2.0 amp linear bench power supply |
| Princeton Artist Brush Nepture | Princeton Artist Brush Co. | Series 4750, size 2 | |
| Sodium potassium L-tartrate tetrahydrate | Thermo Scientific | 033241-36 | Fly food ingredient |
| Stage insert | Wienecke and Sinske | 432339-9030-000 | |
| Stereo Microscope | Olympus | SZ61 | Any stereo microscope works |
| T-Fitting | Genesee | 59-123 | |
| Thermocouple data acquisition device | Measurement Computing | USB-2001-TC | Single channel |
| Thermocouple microprobe | Physitemp | IT-24P | |
| Yellow Cornmeal | Genesee | 62-101 | Fly food ingredient |
| Z-axis piezo stage | Wienecke and Sinske | 432339-9000-000 |
Referencias
- Grienberger, C., Konnerth, A. Imaging calcium in neurons. Neuron. 73 (5), 862-885 (2012).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nature Biotechnology. 19 (2), 137-141 (2001).
- Zhang, Y., et al. jGCaMP8 fast genetically encoded calcium indicators. Janelia Research Campus. , (2020).
- Robbins, M., Christensen, C. N., Kaminski, C. F., Zlatic, M. Calcium imaging analysis - How far have we come. F1000Research. 10, 258 (2021).
- Oh, J., Lee, C., Kaang, B. K. Imaging and analysis of genetically encoded calcium indicators linking neural circuits and behaviors. The Korean Journal of Physiology & Pharmacology. 23 (4), 237-249 (2019).
- Stringer, C., Pachitariu, M. Computational processing of neural recordings from calcium imaging data. Current Opinion in Neurobiology. 55, 22-31 (2019).
- Pnevmatikakis, E. A., Giovannucci, A. NoRMCorre: An online algorithm for piecewise rigid motion correction of calcium imaging data. Journal of Neuroscience Methods. 291, 83-94 (2017).
- Nguyen, J. P., Linder, A. N., Plummer, G. S., Shaevitz, J. W., Leifer, A. M. Automatically tracking neurons in a moving and deforming brain. PLoS Computational Biology. 13 (5), 1005517 (2017).
- Lagache, T., Hanson, A., Pérez-Ortega, J. E., Fairhall, A., Yuste, R. EMC2: A versatile algorithm for robust tracking of calcium dynamics from individual neurons in behaving animals. bioRxiv. , (2021).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. Elife. 8, 38173 (2019).
- Delestro, F., et al. In vivo large-scale analysis of Drosophila neuronal calcium traces by automated tracking of single somata. Scientific Reports. 10, 7153 (2020).
- Cantu, D. A., et al. EZcalcium: Open-source toolbox for analysis of calcium imaging data. Frontiers in Neural Circuits. 14, 25 (2020).
- Eglen, S. J., et al. Toward standard practices for sharing computer code and programs in neuroscience. Nature Neuroscience. 20 (6), 770-773 (2017).
- Pachitariu, M., et al. Suite2p: Beyond 10,000 neurons with standard two-photon microscopy. bioRxiv. , (2017).
- Corder, G., et al. An amygdalar neural ensemble that encodes the unpleasantness of pain. Science. 363 (6424), 276-281 (2019).
- Lagache, T., Hanson, A., Pérez-Ortega, J. E., Fairhall, A., Yuste, R. Tracking calcium dynamics from individual neurons in behaving animals. PLoS Computational Biology. 17 (10), 1009432 (2021).
- Kolar, K., Dondorp, D., Zwiggelaar, J. C., Høyer, J., Chatzigeorgiou, M. Mesmerize is a dynamically adaptable user-friendly analysis platform for 2D and 3D calcium imaging data. Nature Communications. 12, 6569 (2021).
- Moein, M., et al. CaSiAn: A Calcium Signaling Analyzer tool. Bioinformatics. 34 (17), 3052-3054 (2018).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. Elife. 7, 28728 (2018).
- Neugornet, A., O'Donovan, B., Ortinski, P. I. Comparative effects of event detection methods on the analysis and interpretation of Ca(2+) imaging data. Frontiers in Neuroscience. 15, 620869 (2021).
- Tinevez, J. Y., et al. TrackMate: An open and extensible platform for single-particle tracking. Methods. 115, 80-90 (2017).
- Schindelin, J., et al. Fiji: An open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Fazeli, E., et al. Automated cell tracking using StarDist and TrackMate. F1000Research. 9, 1279 (2020).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Ni, L., et al. The ionotropic receptors IR21a and IR25a mediate cool sensing in Drosophila. Elife. 5, 13254 (2016).
- Omelchenko, A. A., et al. Cool and warm ionotropic receptors control multiple thermotaxes in Drosophila larvae. Frontiers in Molecular Neuroscience. , (2022).
- Sanchez-Alcaniz, J. A., et al. An expression atlas of variant ionotropic glutamate receptors identifies a molecular basis of carbonation sensing. Nature Communications. 9 (1), 4252 (2018).
- Hernandez-Nunez, L., et al. Synchronous and opponent thermosensors use flexible cross-inhibition to orchestrate thermal homeostasis. Science Advances. 7 (35), (2021).
- Klein, M., et al. Sensory determinants of behavioral dynamics in Drosophila thermotaxis. Proceedings of the National Academy of Sciences of the United States of America. 112 (2), 220-229 (2015).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados