Method Article
使用核内流式细胞术定量分离小鼠脑小胶质细胞中的整体组蛋白翻译后修饰
摘要
这项工作描述了一种在分离的脑小胶质细胞中使用核内流式细胞术定量全局组蛋白修饰的方案。这项工作还包含用于数据收集的小胶质细胞分离方案。
摘要
基因表达控制部分通过染色质结构的修饰发生,包括添加和去除组蛋白尾部的翻译后修饰。组蛋白翻译后修饰 (HPTM) 可以促进基因表达或抑制。例如,组蛋白尾部赖氨酸残基的乙酰化可中和正电荷并减少尾部与带负电荷的DNA之间的相互作用。组蛋白尾部-DNA 相互作用的减少导致基础 DNA 的可及性增加,从而增加转录因子的可及性。乙酰化标记还可以作为含溴结构域的转录激活因子的识别位点,共同导致基因表达增强。组蛋白标记可以在细胞分化过程中动态调节,并响应不同的细胞环境和刺激。虽然下一代测序方法已经开始表征单个组蛋白修饰的基因组位置,但只能同时检查一种修饰。鉴于有数百种不同的 HPTM,我们开发了一种高通量、定量的全球 HPTM 测量方法,可用于在进行更广泛的基因组测序方法之前筛选组蛋白修饰。该协议描述了一种基于流式细胞术的方法来检测全局HPTM,可以使用培养中的细胞或从 体内 组织中分离的细胞进行。我们提供了来自分离的小鼠脑小胶质细胞的示例数据,以证明该测定法的灵敏度,以检测 HPTM 响应细菌衍生的免疫刺激(脂多糖)的全局变化。该协议允许对HPTM进行快速和定量评估,并可应用于抗体可检测的任何转录或表观遗传调节因子。
引言
表观遗传学是研究在不改变潜在DNA序列的情况下调节基因表达的机制。基因表达的表观遗传调控在细胞内是动态的,可以对各种环境刺激做出快速和协调的反应。动态调节的发生部分是由于核小体水平染色质结构的变化,核小体由组蛋白(H2A、H2B、H3、H4)组成,这些蛋白组装成由DNA1紧密缠绕的八聚体核心。组蛋白和 DNA 之间的相互作用可以控制 DNA 对转录机制的可及性,从而最终控制基因表达和染色质生物学的其他方面2。组蛋白具有非结构化的尾部,其特征是带正电荷的残基与带负电荷的 DNA 骨架形成静电相互作用。这些相互作用导致DNA紧密堆积并降低DNA可及性。组蛋白尾部的共价修饰,称为组蛋白翻译后修饰 (HPTM),可以调节这些相互作用 3,4。一些最充分表征的 HPTM 包括组蛋白尾部乙酰化和甲基化,它们可以改变组蛋白尾部和 DNA 之间静电相互作用的亲和力,导致对潜在 DNA 的可及性和在特定位点识别这些 HPTM 的转录因子的募集。HPTM 由三类重要的酶调节,称为读取器(识别)、写入器(沉积)和橡皮擦(去除 HPTM)。因此,读取酶、写酶或橡皮擦酶的募集或溶解最终可以改变 HPTM 的格局并控制染色质的结构和功能,使其调节和读出对于理解细胞生物学和功能至关重要 3,4。
中枢神经系统 (CNS) 中的细胞在表观遗传上是灵活的,因为它们会改变其转录组以适应环境刺激。越来越多的证据表明,表观基因组的变化,如 DNA 甲基化、非编码 RNA 和 HPTM,在记忆形成和突触功能中起着至关重要的作用5。通过操纵相关的阅读器、写入器或橡皮擦来破坏 HPTM 动态可以阻止或增强联想学习和长期增强 6,7,8。小胶质细胞是中枢神经系统的常驻免疫细胞,通过表观基因组的动态变化快速调节其转录组以响应免疫刺激 9,10,11。这种对局部大脑环境的高度适应使它们难以在孤立的背景下进行检查,因为研究表明,小胶质细胞的表观基因组和转录组在从大脑环境中取出后仅在培养基中几个小时后就会发生变化11。此外,由于小胶质细胞仅占大脑细胞的 10%,因此检查整个组织水平变化的措施缺乏敏感性和特异性12,13。因此,需要快速分离小胶质细胞以检查表观遗传变化,例如离体HPTM水平。
常用于检查 HPTM 的方法包括染色质免疫沉淀测序 (ChIP-seq) 和靶标下切割和标记测序 (CUT&Tag-seq)4。虽然这些技术对单个 HPTM 具有高度特异性,并且可以告知特定基因组环境中 HPTM 的存在,但它们只能在单个实验中检查许多可能的 HPTM 中的一种 11,14 因此,在进行此类需要大量时间和金钱投资的实验之前,通过首先检查全球的变化来缩小潜在感兴趣的 HPTM 列表以进行进一步研究是非常有价值的HPTM 的水平。检查整体 HPTM 水平的两种主要方法是免疫组化和蛋白质印迹分析,但这两种方法都只是半定量、低通量,并且需要大量组织切片或分离细胞15,16。因此,我们旨在开发一种高度灵敏的定量方法,可用于在单细胞水平上快速检查全球HPTM水平。
所提出的方案能够使用核内流式细胞术快速检测全球HPTM水平。先前对癌细胞的研究已经证明了从临床角度检查全球水平的重要性17,18。在评估感兴趣的特定 HPTM 的基因组位置之前,研究通常使用全局水平作为筛选方法19,20。对于小胶质细胞,由于细胞产量低,在分离后评估整体水平具有挑战性;Pan 等人提出了来自分离小胶质细胞的整体 HPTM 水平,其中来自三只动物的小胶质细胞被合并,以便通过蛋白质印迹19 检测蛋白质水平。使用我们的方案,我们能够以更低的细胞输入量检测全局变化,从而能够筛选每只动物的多个标记,并且无需混合样本。
在这里,我们描述了一种通过定量核内流式细胞术在分离的小胶质细胞中快速检测HPTM水平的方案。虽然为了简洁起见,我们特别关注HPTM定量,但该协议可以以相同的方式用于量化读取器,写入器和橡皮擦酶的全局水平。该方案分为两部分:第一部分是小胶质细胞的分离方法,第二部分是用于确定HPTM水平的基于流式细胞术的方法。分离方法产生的细胞可用于 RNA 分离和 HPTM 水平评估,从而可以评估来自同一样品的基因表达和 HPTM 水平。此外,HPTM评估方法可用于方案中指示的其他细胞类型。
研究方案
所有动物护理协议均由不列颠哥伦比亚大学动物护理委员会根据加拿大动物护理委员会指南批准。
1. 用于小胶质细胞分离的脑消化
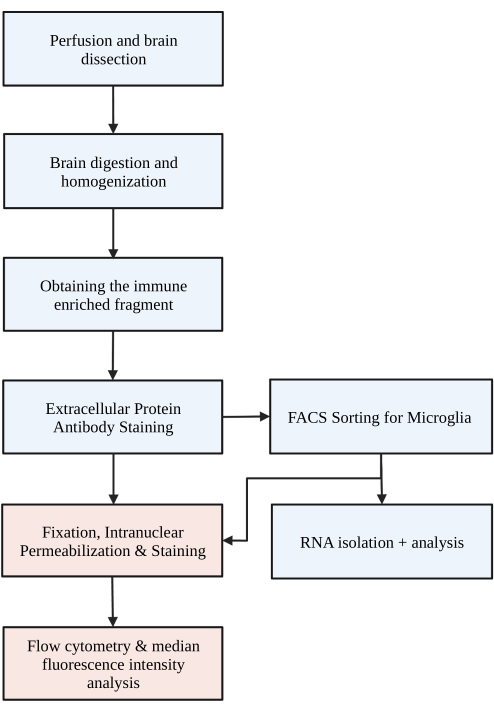
图 1:协议的简单流程图。 首先用HBSS经心灌注小鼠,然后解剖大脑。然后,大脑通过化学消化和机械破坏解离,形成单细胞匀浆。通过不连续的密度梯度收集免疫富集部分,然后对细胞进行 P2RY12 染色。染色的细胞 1) 通过荧光活化细胞分选 (FACS) 进行分选以进行 RNA 分析或下游蛋白质分析和/或 2) 固定、透化和染色以进行核内蛋白。通过流式细胞术确定的目标通道中的中值荧光强度来量化蛋白质水平。蓝色的方框是协议步骤 1) 小胶质细胞分离的脑消化的一部分。红色框是协议步骤 2) 用于蛋白质表达分析的核内流动染色的一部分。用 BioRender.com 创建。 请点击这里查看此图的较大版本.
- 试剂的制备
注意:如果计划提取以收集 RNA 和细胞进行 HPTM 分析,请参阅第 1.7.1 节,了解包括转录和翻译抑制剂的修饰。然而,如果只是评估蛋白质信号,则不需要这样做,因为细胞在冰上保持静止时基本上是静止的。- 荧光活化细胞分选 (FACS) 缓冲液(每个样品 20 mL):将牛血清白蛋白 (BSA) 溶解在 1x Hanks 平衡盐溶液 (HBSS) 中以制备 2% BSA 溶液。将EDTA溶解至2%BSA溶液中的终浓度为1mM。使用0.2μm过滤器过滤灭菌,并在使用前在4°C下储存长达1周。
- 消解缓冲液(每个样品 1 mL):在 HBSS 中复溶一小瓶木瓜蛋白酶,在含有 0.5 mM EDTA 的 1 mM L-半胱氨酸中达到终浓度为 20 U/mL。在37°C下活化至少10分钟或直到准备好消化组织。使用前,将 DNase I 添加到活化的木瓜蛋白酶溶液中,最终浓度为 200 U/mL。在实验当天准备,不要储存。
- 等渗密度梯度溶液(每个样品 5.5 mL):将 10x HBSS 添加到冷密度梯度介质中,最终浓度为 1x HBSS,最终密度为 1.117 g/mL。使用前涡旋混合至少 30 秒。放在冰上直至使用。
- 37% 密度梯度溶液(每个样品 4 mL):向 1x HBSS 中加入等渗密度梯度,使终浓度为 37%,终密度为 1.043 g/mL。每 mL 密度梯度为 37% 时加入 20 μL 酚红,制成粉红色溶液,用于分层过程中的可视化。使用前涡旋至少 30 秒。放在冰上直至使用。
- 70% 密度梯度溶液(每个样品 2 mL):将等渗密度梯度加入 1x HBSS 中,使终浓度为 70%,终密度为 1.082 g/mL。每 mL 密度为 70% 的培养基加入 5 μL 台盼蓝,制成蓝色溶液,用于分层过程中的可视化。使用前涡旋至少 30 秒。放在冰上直至使用。
- 灌注和脑部夹层
注意:灌注方案类似于 Posel 等人,其特点是小鼠开胸术、经心灌注和脑切除术的视频描述21.在这里,我们使用成年C57BL / 6J雄性和雌性小鼠(10-15周龄,20-30g),但该协议可用于对任何小鼠进行开胸术。在进行实验之前,所有动物程序都必须得到机构伦理委员会的批准。- 小鼠麻醉:用4%异氟醚在100%氧气中麻醉小鼠,直到超过手术麻醉平面,这可以通过捏脚趾或用力捏住小鼠脚时缺乏反射来确认。将鼠标放在背上,将其四只爪子牢牢地固定在倾斜放置在塑料托盘中的手术解剖板中,确保鼻子固定在异氟烷鼻锥中。转移后,确保动物仍然超过麻醉的手术平面,然后再进行。
- 小鼠胸腔:用镊子抓住并提起腹部皮肤,在皮肤和腹壁上做一个浅切口,露出木质,而不会损坏降主动脉或任何下层器官。
- 用镊子夹住木膈肌,在胸腔下方做横向切口,露出横膈膜和肝脏。用细剪刀沿着肋骨的长度小心地浅切开横膈膜,用组织剪刀穿过胸腔,并将胸骨钉在小鼠头部附近的手术台上,以暴露心脏和肺部进行心肌灌注。
- 经心灌注:准备蠕动灌注泵,将一根 26.5G 针头连接到管子的一端。通过将管子的一端插入冷的 1x HBSS 小瓶中并打开泵以用 1x HBSS 完全填充管子来为该过程灌注管路。
- 用钝镊子握住心脏的同时,将带有灌注管的 26.5G 针尖插入心脏的左心室,并在右心房做一个小切口。打开灌注泵,以至少15-20mL冷1x HBSS以~2-4mL / min的速率小心地灌注小鼠。
注意:当肝脏开始清除血液并变得与心脏颜色相同时,通常表明完全灌注。 - 脑切除术:使用组织解剖剪刀将小鼠斩首,并在从颈部到鼻子的头皮上做一个中线切口。将皮瓣向两侧剥离,露出颅骨,并用解剖剪刀去除颅骨尾端多余的组织和骨骼。
- 小心地将剪刀的一把刀片滑入颅骨下方的枕骨大孔中,锋利的一面朝向骨头,然后小心地将中线切向鼻子。使用解剖剪刀在颅底和鼻子附近进行横向切割。使用细镊子,从中线到外部对头骨进行生理,以裂开头骨碎片并暴露大脑。用刮刀轻轻抬起大脑,放在解剖印迹纸上。
- 脑解剖:将大脑放在一张用 1x HBSS 润湿的解剖印迹纸上,放在装满冰的封闭培养皿上。取出小脑,用干净的剃须刀片将脑半球一分为二。
- 从每个半球切除脑干、纹状体和白质,同时保持海马体和覆盖皮层完整。将含有分离皮层和海马组织的半球转移到装有 5 mL 冷 1x HBSS 的 15 mL 管中并保持在冰上。
注意:重要的是尽快进行解剖,以便组织保持低温,在斩首和最终将解剖组织放入冰上的 1x HBSS 中不超过 2 分钟。如果从多只动物中分离出小胶质细胞,则可以将大脑储存在1x HBSS中的冰上~1小时,然后再处理整个动物队列进行消化等。
- 大脑消化和均质化
- 机械和化学解离:将每只小鼠的脑组织和 1 mL 消化缓冲液放入冰上的单个培养皿中。使用干净的手术刀刀片,将大脑彻底切成小块(<1毫米)。
- 从塑料移液管上切下尖端,小心地将每个切碎的大脑转移到冰上的24孔板内的单独孔中。用透明柔性薄膜覆盖板,并在冰上孵育30分钟。
注意:如果切碎得当,脑组织类似于切碎的大蒜。 - Dounce 均质化:将消化的脑溶液从每个孔转移到冰上的单个 7 mL 玻璃 Dounce 均质器中,每个均充满 5 mL 冷 FACS 缓冲液。用松散的杵(A)轻轻蘸每个大脑,大约30-40次,直到获得单细胞悬浮液。用 A 杵掺搓后,用紧杵 (B) 轻轻掰搓 3-4 次,以确保单细胞悬浮液。
注意: 不要将研杵向下推超过 3/4,以免压碎均质器底部的组织。最终的解决方案应该是不透明的和乳白色的。
注意:如果在一次实验中消化多个大脑,则定时将大脑消化转移到FACS缓冲液中,以便每个样品仅在消化缓冲液中停留30分钟。过度消化会导致表面蛋白的裂解,从而减少下游抗体的结合和信号。
- 获得免疫富集片段
- 建立密度梯度:将来自每个脑的匀浆转移到单独的 15 mL 聚丙烯管中,并加入 2.125 mL 等渗密度梯度,并加入 8.5 mL,每个管都加入 FACS 缓冲液,以获得 25% 密度梯度的最终浓度。轻轻地将15ml管倒置20倍以充分混合。
- 使用窄刻度移液管,将 4 mL 37% 密度梯度轻轻覆盖到每个试管上,非常小心地建立干净的层。切换移液器并轻轻覆盖2mL的70%密度梯度(图2A)。转移到冷却至4°C的离心机中,并以500× g 旋转20分钟,制动斜坡设置为零。
- 收集免疫富集片段:使用干净的移液管,使用干净的移液管从15 mL管中的体积顶部轻轻吸出髓鞘,然后弃去。使用移液管小心地将密度梯度的顶部片段收集到干净的 15 mL 聚丙烯管中。
- 小心地将免疫富集片段(在70%和37%密度梯度层相遇的地方上方1.5mL和下方1.5mL)收集到新的15mL聚丙烯管中(图2B)。向免疫富集样品中加入 10 mL FACS 缓冲液以稀释密度梯度培养基,然后轻轻倒置试管 20 倍以充分混合。
注意:由于细胞往往会粘在试管的侧面,因此在收集液体时,通过沿着试管侧面缓慢绕移液器,确保在收集步骤中收集样品中的所有细胞。 - 通过在4°C离心机中以500× g 离心15mL管10分钟,并将下坡斜坡制动器设置为零,沉淀免疫富集样品中的细胞。旋转结束后,立即小心地取出上清液,在15mL管中留下约300μL液体,注意不要干扰沉淀(可能不可见)。
- 将上清液收集在另一个 15 mL 管中,以确保细胞在离心中沉淀(一旦用重悬沉淀的细胞计数进行验证,就丢弃该部分)。使用 P1000 移液管将细胞沉淀重悬于 300 μL 体积后,用血细胞计数器对细胞进行计数以估计总细胞产量。
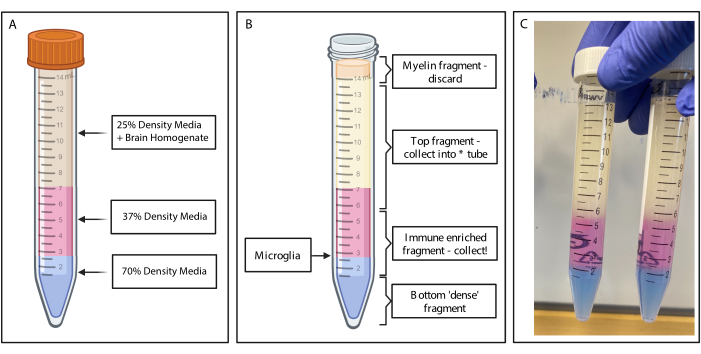
图2:通过不连续密度梯度获得免疫富集片段。 (A) 将脑匀浆制成 25% 密度的培养基,通过酚红覆盖 4 mL 密度 37% 的中等颜色粉红色和 2 mL 通过台盼蓝的 70% 密度中等颜色蓝色。(B) 离心后,馏分已分离。小胶质细胞位于密度为 37% 和 70% 的介质碎片的界面上。髓鞘片段位于 15 mL 试管的顶部,将被丢弃。收集顶部片段作为备份,以防旋转失败,并且没有细胞被回收。如果发生这种情况,可以使用此分数重复梯度。免疫富集部分被收集到下游。含有任何红细胞的底部部分保留在试管中并被丢弃。(C) 描绘完整图层的示例图。用 BioRender.com 创建。 请点击这里查看此图的较大版本.
- 细胞外抗体染色
- 封闭:将细胞转移到冰上的圆底 96 孔板上,并以 500 x g 离心,制动器使细胞沉淀。通过轻弹板以处理上清液,快速除去水槽中的上清液,使细胞沉淀完好无损地留在孔底。
- 使用 P200 移液管(终浓度 10 μg/mL,稀释因子 1:50)将细胞重悬于含有抗小鼠 CD16/32 FC 受体封闭试剂的 50 μL FACS 缓冲液中,以防止抗体与单核细胞或其他 FcR 携带细胞的非特异性结合。在冰上孵育10分钟。
- 抗体染色:制备适当体积的含有 P2RY12- 别藻蓝蛋白(APC;稀释因子 1:50,浓度 4 μg/mL,终孔浓度为 1:100,浓度 2 μg/mL)和紫色 525 活死染料(稀释因子 1:50,终孔浓度为 1:100)。将 50 μL 染色预混液加入细胞悬液(在第 1.5.1 节中封闭后获得)中,并将板在冰上黑暗孵育 30 分钟。
注意:对于该方案,我们提出用P2RY12对细胞进行染色。首先,P2RY12是小胶质细胞的稳态标志物,在某些疾病情况下可以下调。例如,5XFAD阿尔茨海默氏症模型小鼠的P2RY12水平下调,这可能使它们难以识别22。可用于分离的替代染料包括 Tmem119、Cd11b 和 CD4523。其次,可以调整偶联荧光染料APC以适应所需的抗体组。然而,选择明亮的荧光染料,如APC或PE,将有助于确保阳性和阴性群体易于区分24。 - 染色后,将 200 μL FACS 缓冲液直接加入每个孔中以洗涤细胞。在4°C下以500× g 旋转以通过轻弹除去上清液。用P200移液管将细胞重悬于200μLFACS缓冲液中,在4°C下以500× g 旋转,然后轻弹板以从孔中除去缓冲液。
- 制备流量对照品:在染色之前,在步骤1.5.1中封闭后,从每个样品中分离出必要体积的细胞,以获得所需的流量对照品。
注意:每次实验都需要流量控制来建立浇口。流量控制可以取自其他动物或每个实验孔的一小部分。分裂细胞时,确保为每个对照分配足够的细胞,因为每个对照需要 10,000-30,000 个细胞才能以高置信度建立门。- 有三种相关的流量对照:无染色、活死和 P2RY12 同型对照。对于无染色对照,请勿添加任何抗体。在 P2RY12 同种型对照中,用活性染料 (1:100) 和与 APC 偶联的同型对照抗体 (1:100) 处理细胞。
- 为了制备活死对照,将细胞分装到单独的孔中,并将一半的细胞体积移入 500 μL 管中。将 500 μL 试管放入 -80 °C 冰箱中 5 分钟,然后放入 37 °C 培养箱中 5 分钟以杀死细胞。将死细胞的等分试样放回活死对照孔中,并用紫罗兰色525(稀释因子1:100)上的胺结合活性染料染色以标记死细胞。
注意:该方案是为平板染色而编写的,采用轻弹法去除上清液。然而,这需要在离心完成后立即去除上清液,并且需要以足够的力进行轻弹,以便在不干扰沉淀的情况下快速去除上清液。或者,可以使用1.5mL RNAse / DNase游离管进行染色,并进行以下修改:将细胞转移到1.5mL微量离心管中,并在4°C下以800× g 沉淀5分钟。 用移液器吸出上清液。提示:为了提高速度,带有 P200 吸头的 5 mL 移液器可以快速准确地吸出上清液。吸气时,检查颗粒。如果沉淀不可见,请留下 50 μL 上清液并相应地调整计算。洗脱抗体时,添加额外的 FACS 以增加抗体的稀释度(1000 μL 而不是 200 μL),以解决上清液去除不完全的原因。根据流式细胞仪的不同,使用 1.5 mL 试管进行分选,从而减少所需的耗材量。
- 小胶质细胞的FACS分选
- 制备:用 P200 移液管将每个孔重悬于 200 μL FACS 缓冲液中,然后转移到标记的流式分选管中,并将 FACS 缓冲液加入总计 500 μL,浓度约为 5 x 10 5 个事件/mL。在黑暗中储存在冰上,直到分析。通过加入 100 μL FACS 缓冲液作为 1.5 mL 无 RNAse 试管中细胞的缓冲垫来制备分选后管。
- 流式细胞仪设置:在设置有 100 μm 喷嘴的流式细胞仪上对细胞进行分选。使用 18-20 psi 对细胞进行分类。
- 门控:在流式细胞仪上,使用侧向散射 (SSC) 面积与前向散射 (FSC) 高度对细胞大小进行门,使用无染色控制来帮助区分碎片,将 SSC-A 放在对数轴上以可视化细胞群并密切门以选择细胞(门 S1; 图3)。要去除任何双峰,请绘制 FSC-H 与 FSC-W 的图谱,并在细胞群周围紧密栅门,去除任何碎片和双峰(门 S2)。使用 P2RY12 同种型对照,检查 APC 通道中的细胞并设置自发荧光门以确定 P2RY12+ 细胞。使用无染色和活死对照,将紫光 525 nm 上不发荧光的细胞作为活细胞进行门。
- 排序:绘制紫色 525 nm 与 APC 的关系,并确定 P2RY12+ 并通过 FMO (MG) 生存的种群。将这些细胞分选到标记的后分选管中(图3)。最终排序百分比约为总事件的 50%,其中大部分事件总损失是在门 S1 中清除的碎片(~70% 的事件是细胞; 表1)。
- RNA分离和分析
- 转录和翻译抑制剂:如果计划提取 RNA,为了消除分离相关转录组特征的风险,请在缓冲步骤中加入翻译和转录抑制剂。制备Marsh等人描述的抑制剂混合物,包括放线菌素D,茴香霉素和雷公藤内酯25。
- 抑制剂制备:复溶抑制剂储备并按如下方式储存:将放线菌素D在二甲基亚砜(DMSO)中的复溶至5mg/mL,并在-20°C下储存。 将雷公藤甲内酯在DMSO中复溶至10mM,并储存在-20°C,避光保存。将茴香霉素在DMSO中的复溶至10mg / mL,并储存在4°C,避光保存。复溶后储存所有抑制剂储备液不超过 1 个月。
- 缓冲液修饰:在方案中的四种不同缓冲液中添加抑制剂,如下所示:进行经心灌注时,用放线菌素D(5μg/ mL,1:1000从库存中)和雷公藤内酯(10μM,1:1000从库存中)制备HBSS。灌注后,将含有放线菌素D(5μg/mL,1:1000,1:1000)雷公藤内酯(10μM,1:1000)和茴香霉素(27.1μg/mL,1:368.5)的HBSS中的大脑运送到实验室。用放线菌素D(5μg/mL,1:1000,1:1000,雷公藤素)和茴香霉素(27.1μg/mL,1:368.5)制备FACS缓冲液。用放线菌素D(5μg/mL,1:1000,原料1:1000)、雷公藤内酯(10μM,1:1000)和茴香霉素(27.1μg/mL,1:368.5原料)制备消化缓冲液。制备分选后洗涤缓冲液,HBSS含有放线菌素D(5μg/mL,1:1000,1:1000,1:1000)和茴香霉素(27.1μg/mL,1:368.5)。
注意:添加抑制剂时,请确保在使用前立即添加它们,并在使用时保护任何准备好的缓冲液免受光线照射。避免储备溶液冻融。
- 分选后洗涤:由于细胞已在 FACS 缓冲液中分选到 1.5 mL 无 RNase 试管中,这会干扰 RNA 分离,因此有必要洗涤细胞。在4°C下以1000× g 旋转细胞5分钟并除去上清液,留下约50μL液体。
- 加入 200 μL 含有放线菌素 D(5 μg/mL,1:1000 原料)、雷公藤内酯(10 μM,1:1000 原料)和茴香霉素(27.1 μg/mL,1:368.5 原料)的 1x HBSS,并充分混合。重复旋转并除去上清液,留下 50 μL 液体(洗涤 1)。加入 200 μL 分选后洗涤缓冲液,充分混合并重复旋转并除去上清液,留下 25 μL 液体(洗涤 2)。
- RNA 提取:对于从小胶质细胞中分离 RNA,请使用低起始量 RNA 分离试剂盒,以获得高且一致的 RNA 产量和 RIN 评分高于 9(产品推荐见下文和 材料表 )。向细胞沉淀中加入推荐试剂盒中的350μL裂解缓冲液+β-巯基乙醇(1:100)并充分混合。
注意:如有必要,此时可以暂停协议。样品可以储存在-80°C的裂解缓冲液中,直到RNA提取。如果在储存后提取 RNA,请在冰上解冻裂解物,然后按照试剂盒特定的说明进行分离。 - 将裂解物转移到基于柱的细胞粉碎机中(有关产品建议 ,请参阅材料表 ),并在4°C下以最大速度离心2分钟。在至少 14 μL 无 RNase 的水中洗脱,并酌情测定浓度。在此之后,RNA可用于任何下游应用。
- 转录和翻译抑制剂:如果计划提取 RNA,为了消除分离相关转录组特征的风险,请在缓冲步骤中加入翻译和转录抑制剂。制备Marsh等人描述的抑制剂混合物,包括放线菌素D,茴香霉素和雷公藤内酯25。
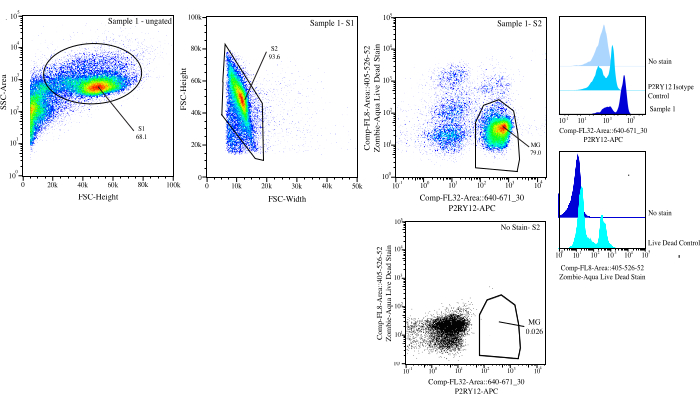
图 3:流排序的门控策略。 事件针对 SSC-A 与 FSC-H (S1) 上的单元大小进行门控。然后,将细胞门控为 FSC-H 与 FSC-W (S2) 上的单线态。使用 P2RY12 同种型对照,将单线态细胞分选为活细胞(如果在 Comp-FL8-A::405-526-52)(紫色 525 活死染色剂)上呈阴性,如果在 Comp-FL32-A::640-671_30 (P2RY12-APC) 上呈阳性,则分选为 P2RY12+。细胞被标记为 MG,如果同时活细胞和 P2RY12+,则进行分类。 请点击这里查看此图的较大版本.
| 封闭人口 | 父项的频率 | 总频率 | 计数 |
| S1系列 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| 直播 (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| 名爵 (P2RY12+ Live) >S2>S1 | 78.96% | 50.30% | 119794 |
表1: 示例世系表,其中包含门控百分比和预期事件编号。
2. 用于蛋白质表达分析的核内流动染色
注意:此时可以开始其他细胞类型,该协议使用培养细胞进行测试,包括 HEK293 细胞、BV2 小胶质细胞样细胞和人 IPSC 衍生的小胶质细胞。
- 细胞的固定和染色
注意:对于以下方案,请使用针对核染色进行优化的细胞内染色试剂盒。看 材料表 用于产品推荐。- 将第 1.5.2 节的细胞外染色细胞等分到 96 孔板(5 x 104- 1 x 106 个细胞)中。在4°C下以500× g 离心细胞5分钟,轻弹以除去FACS缓冲液。
注意:为了获得中位数水平高置信度的数据,每孔至少应使用10,000个细胞。虽然没有推荐的最大值,但最好在整个实验过程中保持细胞数一致,以确保不同变异系数 (CV) 没有显着影响。 - 固定和透化:加入 200 μL 1x 定影浓缩液,并与 P200 移液管轻轻混合以重悬细胞。在黑暗中孵育 45-60 分钟。 在室温(RT)下以500× g 离心板5分钟,轻弹弃上清液。
注意:如有必要,此时可以暂停协议。弃去上清液后,将细胞重新悬浮在免疫细胞的长期储存缓冲液中(产品推荐见 材料表 )。样品可在4°C下储存12-18小时,避光并覆盖透明薄膜以保护缓冲液蒸发。 - 向每个孔中加入 200 μL 1x 透化缓冲液,并用 P200 移液混合。在室温下以500×g离心板5分钟,轻弹弃去清液。重复透化缓冲液洗涤共3次。
- 制备流量对照品:从每个样品中分离出细胞体积,用于所需的流量控制品(每个对照孔 10,000-30,000 个细胞就足够了)。
- 要制备无染色对照,请将分选或等分未染色细胞中的无染色细胞固定到不会接收任何抗体的单独孔中。
- 为了制备荧光减一 (FMO) 对照,将检测组合上除该通道中的抗体外的每种抗体的细胞分装细胞。
- 对于相关通道,在 FMO 中包括同型对照抗体进行门控。例如,在包含 P2RY12-APC 和 H3K27Ac-AlexaFluor568 的 panel 中,应该有两个 FMOS:(1) 仅包含 H3K27Ac-AlexaFluor568 和 P2RY12 同种型对照抗体的 APC-FMO,以及 (2) 仅包含 P2RY12-APC 和同种型对照一发性和 568 次级的 568-FMO。
注意:该协议用于测试单个HPTM,但是可以建立包含许多与不同荧光团偶联的HPTM的panel。
- 一抗染色:向每个孔中加入 50 μL 含有适当浓度一抗的 1x 透化缓冲液。在室温下在黑暗中孵育 30 分钟。用 200 μL 1x 透化缓冲液洗涤 2 次。
注意:用于每种 HPTM 的抗体浓度包含在 材料表中。浓度是通过在用兴奋剂处理的培养细胞上测试不同浓度的抗体来确定的,这些兴奋剂会导致显着增加,例如,用于乙酰化标记的HDAC抑制剂,并确保未经处理和处理的细胞都在检测范围内(高于同型对照,低于细胞仪的最大检测范围)。HPTM 的最佳抗体浓度应在荧光基团通道中的平均中位荧光强度介于 5 x 104 和 1 x 105 之间。 - 二抗染色:用 200 μL 含有 2% 正常驴血清 (NDS) 的 1x 透化缓冲液在室温下封闭 10 分钟,在室温下以 500 x g 旋转 5 分钟,轻弹以除去上清液。
- 加入 50 μL 含 2% NDS 和适当浓度的 1x 透化缓冲液和适当浓度的二抗,并在室温下在黑暗中孵育 30 分钟。向孔中加入200μL 1x透化缓冲液稀释,在室温下以500× g 离心板5分钟,轻弹弃上清液。用 200 μL 1x 透化缓冲液洗涤细胞 2 次。
注意:如有必要,此时暂停协议。用P200移液器将细胞重悬于200μL免疫细胞长期储存缓冲液中(参见材料 表 的建议),并在4°C下避光储存12-24小时。 - 准备流式细胞术:在室温下以500× g 离心板5分钟,轻弹弃去清液。使用 P200 移液器将细胞重悬于 200 μL FACS 缓冲液中进行流式细胞术。用透明薄膜密封,以便运输到细胞仪。
- 将第 1.5.2 节的细胞外染色细胞等分到 96 孔板(5 x 104- 1 x 106 个细胞)中。在4°C下以500× g 离心细胞5分钟,轻弹以除去FACS缓冲液。
- 流式细胞术
- 要分析建议的抗体组合,请确保细胞仪配备至少四种激光器,包括紫色 (405 nm)、蓝色 (488 nm)、黄色 (561 nm) 和红色 (633 nm)。流式细胞仪需要滤光片来检测 FITC(蓝色 525 nm)、KRO(紫色 525 nm)、PE(黄色 585 nm)和 APC(红色 660 nm)。根据所选的流式细胞仪添加其他抗体。
- 校准和标准化:在每个实验开始时,运行彩虹荧光珠并调整光电倍增管 (PMT) 电压,直到珠子峰值与先前实验的目标值相当。这种标准化方法允许适应设备随时间推移的漂移。
- 补偿:在为实验设置了PMT电压和增益后,使用抗体捕获的补偿珠建立抗体组合的补偿矩阵。该计算将确保荧光团不会导致其他通道中的信号变化。在多重检测多种抗体时,这一点越来越必要。
- 尺寸门控:在点图中,在对数上绘制 SSC-A 与线性在 FSC-H 上绘制。栅极栅出碎片并使用 S1 栅极选择单元大小。在 FSC-W 与 FSC-H 的点图中选择单线态细胞,并将栅极设置为 S2。(图 4)。
- 建立荧光基团门:使用每个荧光团通道的相关FMO,建立门,使用单参数直方图确定每个通道中的正信号(图4)。
- 测量样品:使用既定的门控策略仔细记录样品。使用 P2RY12+ 信号识别小胶质细胞,仅确定小胶质细胞相应通道中蛋白质的表达。
- 流式细胞术数据分析
- 建立分析门:在分析软件用户界面上对流式细胞仪使用上述步骤,使用用于记录分析的相同门。
- 使用流式细胞术分析软件获得 MFI 值(参见材料 表 以获取建议):概括用于流式分析的流式细胞仪门控策略。使用添加统计函数,为补偿通道高度上的感兴趣总体(例如,568+)选择中位数。使用表格编辑器,将相应通道的中值荧光强度 (MFI) 值导出到电子表格中以进行统计分析(表 2)。
注意: 补充文件 S1 包括来自脂多糖 (LPS) 和磷酸盐缓冲盐水 (PBS) 注射小鼠的示例数据以及具有门控策略和 MFI 值的示例分析文件。 - 分析 MFI 值与蛋白质倍数变化:获得 MFI 值后,计算 MFI 相对于对照组或未处理群体的倍数变化(公式 1)。MFI的倍数变化反映了蛋白质水平的倍数变化。使用倍数变化值,评估表达的变化,并使用 t 检验或方差分析计算统计显着性。
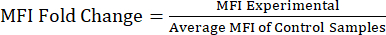 等式 1
等式 1
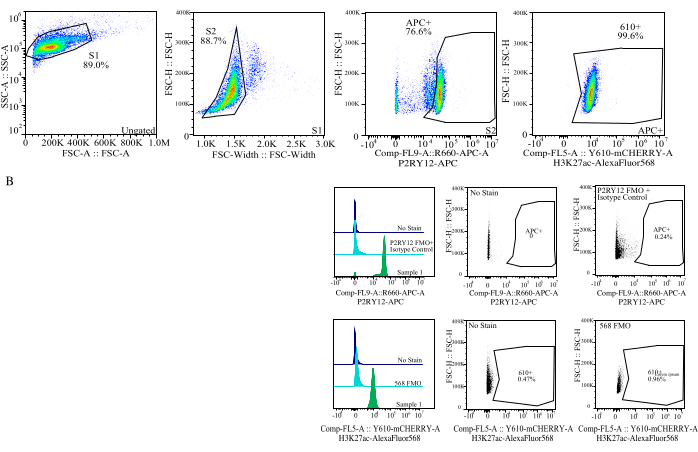
图 4:蛋白质 MFI 评估的门控策略。 首先针对 SSC-A 与 FSC-H (S1) 上的单元大小对事件进行门控。然后对细胞进行门控,以获得 FSC-H 与 FSC-W (S2) 上的单线态。然后通过 P2RY12-APC 信号 (APC+) 将单线态细胞鉴定为小胶质细胞,并在含有同型对照抗体的 APC-FMO 对照中基于荧光建立门。然后对细胞进行 Comp-FL5-A::Y610-mCherry 上的 H3K27Ac-AlexaFluor568 信号门控。610+细胞的荧光强度被确定为蛋白质表达的代表。 请点击这里查看此图的较大版本.
结果
成年小鼠经心灌注并处死小胶质细胞分离。在冰上分离小胶质细胞,并用 P2RY12-APC 和紫色 525 活死抗体染色。将 P2RY12 阳性、紫 525 活死染色阴性的细胞分选为活小胶质细胞。解剖小鼠大脑中小胶质细胞的平均产量为 1.28 x 105 ± 0.05(平均值±均值标准误差 (SEM),N=100)。雌性(1.25 x 105 ± 0.09 [平均 ± SEM,N=46])和雄性 (1.32 x 105 ± 0.07 [平均 ± SEM, N=54]) 小鼠 (t(98)=0.6365, p=0.526) 的小胶质细胞产量没有差异。当从特定的大脑区域分离时,小鼠皮质中小胶质细胞的平均产量为 8.3 x 104 ± 0.08(平均 ± SEM,N=15),小鼠海马体的平均产量为 4.1 x 104 ± 0.02(平均 ± SEM,N=16)。正如预期的那样,每个大脑区域的小胶质细胞产量存在显着差异(F(2,128)=25.25,P<0.0001)。小胶质细胞分离后,使用低起始量 RNA 分离试剂盒从分离的细胞中提取 RNA。RNA完整性评分(RIN)始终高于9.0(9.62±0.05),每个细胞的RNA平均产量为0.25±0.01pg(SEM±平均值,N=32; 补充文件S2)。
成年小鼠在处死前24小时腹膜内注射1mg / kg脂多糖(LPS)。小鼠经心灌注HBSS,并根据所述方案从整个大脑中分离小胶质细胞(图5A)。对于每种染色剂,将 20,000-30,000 个细胞分配给每组抗体。通过流式细胞术评估分离小胶质细胞中组蛋白 3 赖氨酸 27 乙酰化 (H3K27Ac) 的整体水平。对于雄性和雌性小鼠,当MFI在性别内归一化时,LPS处理诱导H3K27Ac增加(t(6)=9.676,p<0.0001;图5B)。当检查染色细胞的直方图时,群体保持正态分布,具有相似的变化;然而,细胞已经转向增加的荧光,导致MFI的增加(图5C)。当在同一处理中检查H3K9Ac时,H3K9Ac也有类似的增加(t(6)=7.299,p=0.0003;图5D,E)然而,H3K9Ac信号的LPS相对于PBS的倍数变化小于H3K27Ac信号。
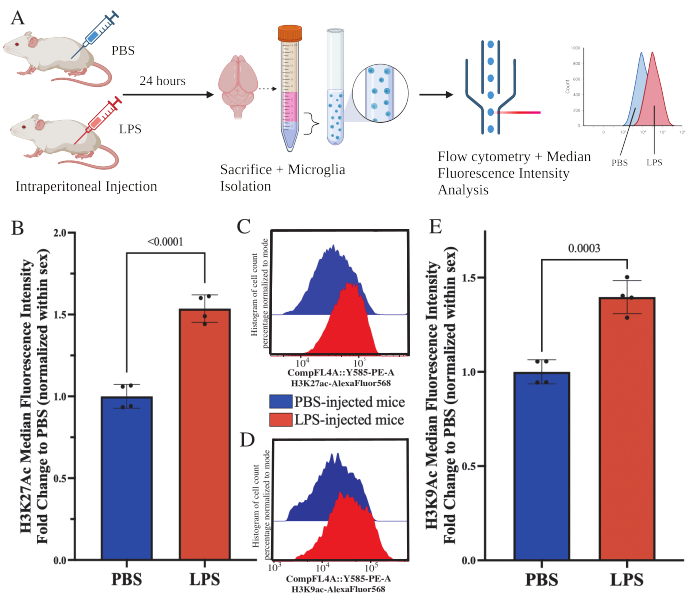
图5:分离小胶质细胞中组蛋白乙酰化的全局变化。 (A)在处死前24小时腹膜内注射磷酸盐缓冲盐水(PBS)或1mg / kg脂多糖(LPS)。从免疫富集部分收集小胶质细胞并固定用于流式细胞术和整体组蛋白翻译修饰后评估。中位荧光强度被评估为蛋白质表达的代表。用 BioRender.com 创建。(B) 全球H3K27Ac水平随着LPS处理的增加而增加。在实验和性别中归一化的 PBS 的倍数变化。未配对双尾 t 检验,t(6)=9.676,p<0.0001。条形图描绘了 SEM 的平均值±N=8 只动物;在 2 个独立实验中每个条件 2 个。(C) 描述H3K27Ac荧光强度偏移的示例直方图。模态描绘了PBS注射与LPS注射小鼠的直方图。(D) 描述H3K9Ac荧光强度偏移的示例直方图。模态描绘了PBS注射与LPS注射小鼠的直方图。(E) 全球H3K9Ac水平因LPS处理而增加。在实验和性别中归一化的 PBS 的倍数变化。未配对双尾 t 检验,t(6)=7.299,p=0.0003。条形图描绘了 SEM 的平均值±N=8 只动物;在 2 个独立实验中每个条件 2 个。 请点击这里查看此图的较大版本.
为了确认所描述的方法与以前用于全局组蛋白修饰定量的其他方法具有可比性,我们旨在使用免疫印迹作为比较工具。然而,分离的小胶质细胞的产量太低,无法进行合理的评估。因此,我们使用培养的 BV2 细胞将细胞内流式细胞术方法与蛋白质印迹 (WB) 进行比较。BV2细胞在37°C,5%CO2的完全培养基(DMEMF12,10%FBS,1x青霉素/链霉素和1xL-谷氨酰胺)中生长。用 0.25% 胰蛋白酶-EDTA 传代细胞,并以 250,000 个细胞/孔的密度接种,并在还原血清培养基(DMEM F12、2% FBS、1x 青霉素/链霉素和 1x L-谷氨酰胺)中处理,并在 37 °C、5% CO2 下恢复 12 小时。在如上所述固定或用 WB 裂解缓冲液裂解之前,用 25 ng/mL LPS 处理细胞 24 小时。H3K27Ac 的信号通过两种方法执行,其中 GAPDH 用作 WB 的加载对照。确定每组与PBS对照相比的归一化荧光强度分析(图6A)。当通过 WB 检查归一化 H3K27Ac 信号的变化时,相对于 H2O 对照,LPS 处理条件增加了 1.527 倍,这被非配对 t 检验确定为显着 (t=3.024, df=5; p=0.0293)。当使用流式细胞术检查变化时,LPS处理条件增加了1.482倍,这被确定为显着(t = 7.843,df = 10;p<0.0001)。使用双因素方差分析比较方法,确定处理有显著效果 (F(1,15)=45.21,p<0.0001),但方法没有显著效果 (F(1,15)=0.05545,p=0.8697) 或交互作用 (F(1,15)=0.02785,p=0.8697)。此外,我们在这里验证蛋白质印迹和流式细胞术对组蛋白 H3 水平没有变化,因为 2 元方差分析显示 LPS 处理 (F(1,7)=0.02170,p=0.8870)、方法 (F(1,7)=0.01191,p=0.9162) 或相互作用 (F(1,7=0.01191, p=0.9162;图6B)。还显示了该数据的印迹和直方图偏移示例(图6C,D)。
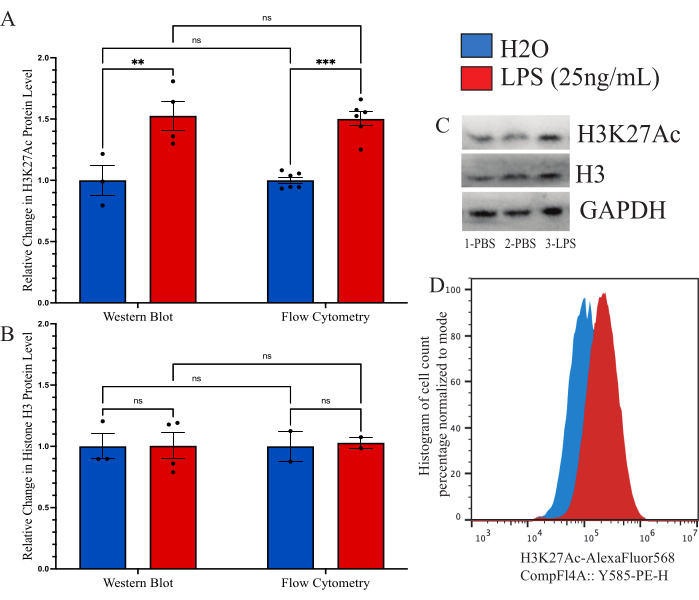
图 6:流式细胞术和蛋白质印迹法之间全局组蛋白修饰变化的定量方法比较。 (A) 在分析前用 25 ng/mL 脂多糖 (LPS) 或 H2O 处理 BV2 细胞 24 小时。H3K27Ac 的荧光强度被描述为流式细胞术和蛋白质印迹的载体对照磷酸盐缓冲盐水 (PBS) 的倍数变化。2因素方差分析显示LPS处理(F(1,15)=45.21,p<0.0001)有显著效果,但未显示该方法(F(1,15)=0.05545,p=0.8697)或交互作用(F(1,15)=0.02785,p=0.8697)。Tukey 对多重假设检验的校正应用于残差。* 表示 0.0332,** 表示 0.0021。(B) 组蛋白 H3 的荧光强度被描述为流式细胞术和蛋白质印迹的 PBS 倍数变化。2因素方差分析显示LPS处理(F(1,7)=0.02170,p=0.8870)或方法(F(1,7)=0.01191,p=0.9162)或交互作用(F(1,7=0.01191,p=0.9162)无显著影响。描绘了 (C) 示例印迹和 (D) 流式细胞术位移。直方图大小根据模式荧光强度下存在的细胞数归一化为百分比。条形图描绘了平均 SEM。 n=2 个独立实验,每个实验每个条件 2 个。 请点击这里查看此图的较大版本.
总而言之,这些结果表明,该技术可用于定量评估分离小胶质细胞中的整体HPTM水平。此外,该方法被证明与以前的技术相当,但需要更低的细胞输入。此外,虽然未显示,但通过适当的补偿,本技术可以与同一panel上的多种抗体一起使用,以评估不同的HPTM。
补充文件 S1:示例分析文件。 该文件包含一个 wsp 分析文件和 7 个 fcs 文件,包括无染色、P2RY12FMO、568FMO、2 只 PBS 处理的动物和 2 只用 H3K27Ac 染色的 LPS 处理的动物。此文件的目的是演示对实验的分析和门控,该实验可以描述成功的实验是什么样子的。 请点击此处下载此文件。
补充文件 S2:隔离数据。 包含的文件包含小胶质细胞排序后的相关数据,其中包含来自所述方案的小胶质细胞和 RNA 产量。 请点击此处下载此文件。
| 封闭人口 | 父项的频率 | 总频率 | 计数 |
| S1系列 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
表2: 示例样本谱系图描述了准确蛋白质检测所需的百分比和事件数。
讨论
所提出的方案可以通过流式细胞术定量评估全球HPTM水平。虽然该协议提出了一种新方法,但以前的研究已经使用类似的方法对蛋白质进行了定量评估26。以前用于评估全球 HPTM 水平的方法包括免疫组化和蛋白质印迹16、17、19、20。所提出的基于流式细胞术的方法是一种易于量化的方法,而蛋白质印迹和免疫组化是半定量的,通量较低。蛋白质印迹依赖于细胞裂解,因此需要蛋白质归一化和假设在实验条件27下保持不变的上样对照蛋白。免疫组化是半定量的,通量非常低,因为如果不检查单个细胞水平,就很难定量评估蛋白质的量16。同样,对于分离的小胶质细胞,使用流式细胞术方法也有好处,因为蛋白质印迹需要更大的蛋白质输入19,因此产量有限。低细胞数量要求允许从同一动物身上运行多个染色板。
然而,与任何其他方法一样,该技术存在抗体成本和可用性等局限性,因为并非所有抗体在流式细胞术环境中都能正常工作。此外,与免疫印迹相比,所需的抗体浓度要高得多。虽然多重检测允许在同一组细胞上使用多种抗体,但分析后不能剥离细胞中的抗体,从而将细胞的使用限制为每种抗体种类一种。这与免疫印迹不同,免疫印迹可以重复使用相同的印迹。然而,根据抗体的可用性和细胞仪上的检测通道数量,可以同时检查多达十几个标记。
目前的方法仅捕获蛋白质表达的全局水平,而不是特定的基因组位置,并且全局水平的变化可能无法反映单个基因组位点的变化。同样,全球水平缺乏变化可能并不意味着没有基因组位点发生变化,只是全球变化的总和意味着治疗之间没有差异。因此,该技术旨在用作筛选,以识别基因组分析所需的HPTM。此外,该方法不允许在不同的蛋白质标记之间进行比较,除非被评估为对照的倍数变化。因此,与用于蛋白质测定的标准基于曲线的方法(如 ELISA)相比,这是有限的。
所提出的方案提供了一种分离活脑小胶质细胞的策略。该协议依赖于 P2RY12 蛋白表达进行小胶质细胞分离。然而,P2RY12 是小胶质细胞中的稳态标志物,可以在疾病模型中下调,例如 5XFAD22。因此,当使用疾病模型动物时,一定要选择其他标记蛋白,如TMEM119、CD11b或CD45,以帮助分离小胶质细胞23。同样,我们将该协议表示为与海马体和/或皮层的隔离。该协议将用于将小胶质细胞与其他大脑区域(包括白质区域)隔离开来,但是,根据感兴趣区域的大小,可能需要多只动物才能获得足够的小胶质细胞。
所提出的方案可以稳健地分离活的脑小胶质细胞,但是在分离阶段有几个步骤,如下所述,如果执行不当,可能会降低细胞产量。
该方案的灌注导致免疫富集片段中小胶质细胞的百分比更高,这将减少分选仪的时间。但是,不需要灌注,如果需要,可以使用其他安乐死方法。
在小胶质细胞分离期间,髓磷脂应完全去除。流式细胞仪依赖于细胞能够快速穿过狭窄的管路。由于髓鞘的粘度和结块倾向,髓鞘会导致细胞仪出现问题,经常导致堵塞,从而损坏设备并破坏样品,从而大大降低产量。在收集富含免疫的片段时,要小心去除所有髓鞘,以避免在下游出现问题。
平板染色与试管染色:在该方案中,我们描述了在 1.5 mL 试管或 96 孔板中对细胞进行染色的两种选择。每个用例都取决于实验;然而,一般来说,试管染色影响产量的风险低于平板染色,因为如果操作不当,试管可能会丢失细胞。平板染色要快得多,因为吸出每个试管的上清液非常耗时。在固定(用于分选等)之前,使用试管染色以最大限度地提高产量并降低损失风险。然而,对于 HPTM 分析,一旦细胞固定用于核内染色,沉淀就更稳定,并且轻弹丢失的风险降低。
建立不连续的密度梯度:在建立分层时,正确设置分层对于获得免疫富集部分至关重要。如果各层受到干扰或混合并出现浑浊,则细胞将无法分选到所需的位置,并且将难以获得免疫富集的细胞部分。如果发生这种情况,用密度培养基旋转以除去髓磷脂,然后收集整个剩余部分,用 3 mL FACS 缓冲液稀释至 1 mL 密度培养基并充分混合(这将需要多个试管)。以 500 x g 旋转 10 分钟,制动器为 0。弃去上清液,仅留下~300μL溶液。收集整个样品并染色。这将降低分选百分比,并在流式细胞仪上花费更多的时间,但产量仍然可以具有可比性。
当使用分离方法时,能够从同一小鼠大脑中收集用于RNA和HPTM评估的细胞是有益的。在这种情况下,在对活小胶质细胞进行分选后,可以将细胞分开以分配一部分用于 RNA 评估(获得体面的 RNA 产量的最小细胞输入数为 75,000 个细胞)和一部分用于进一步的流式细胞术分析(每孔至少 10,000 个细胞,以便很好地测定 MFI)。在这种情况下,需要流式细胞仪分选。但是,当仅计划将细胞用于HPTM分析时,不需要分选,并且可以用P2RY12抗体和HPTM抗体对免疫部分进行染色。然后可以为P2RY12+小胶质细胞设置细胞仪上的门控,就像流式分选一样,以仅分析小胶质细胞内的HPTM信号。消除排序可以使协议更快、更具成本效益。此外,如果评估来自培养细胞的HPTM,从染色方案开始就足够了,不需要细胞标志物抗体,如 图6所示。HPTM 评估方案可用于多种细胞类型,包括培养细胞、原代细胞和 IPSC 衍生细胞。
最后,虽然我们只介绍了小胶质细胞在分离下游的两种潜在用途,但还有许多其他用途,包括 ChIP、CUT&Tag 和 CUT&RUN 等表观遗传技术。在基因组表观遗传技术的情况下,表征特定位点的变化是感兴趣的,选择特定的抑制剂作为染色质标记11 的写入者和橡皮擦,以确保所描述的任何小胶质细胞表观遗传修饰不是来自分离过程(如酶消化)任何步骤的技术伪影。在评估表观遗传标记全局水平的变化时,例如使用定量流式细胞术,预计任何程序诱导的变化都不会大到在全局水平上检测到。
总体而言,所讨论的方法提供了一种新颖的单细胞方法,用于通过流式细胞术量化组蛋白修饰和其他表观遗传变化的全局水平。我们证明,该方法足够灵敏,可以检测小胶质细胞中增强子标记物 H3K27ac 对 体内 LPS 的反应的全局变化。这与先前在 LPS 刺激后对 H3K27ac 进行的 ChIP 测序一致,该测序显示对 LPS28 有反应的增强子发生了显着重塑。这种方法的应用将允许检查不同脑细胞类型在发育和疾病中的整体表观遗传变化。
披露声明
作者没有什么可透露的。
致谢
感谢 Yanyang Bai 帮助完成 图 5 中的免疫印迹。这项工作得到了加拿大卫生研究院[CRC-RS 950-232402至AC]的支持;加拿大自然科学与工程研究委员会 [RGPIN-2019-04450, DGECR-2019-00069 to AC];苏格兰分册慈善基金会 [21103 至 AC] 和加拿大大脑基金会 [AWD-023132 至 AC];不列颠哥伦比亚大学原住民研究生奖学金(6481至MT);不列颠哥伦比亚省研究生奖学金(6768 至 MT);加拿大开放神经科学平台学生学者奖(10901 给 JK);不列颠哥伦比亚大学四年制博士奖学金(6569 至 JK)。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
参考文献
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。