Method Article
분리된 마우스 뇌 미세아교세포에서 핵내 유세포 분석을 사용한 글로벌 히스톤 번역 후 변형의 정량화
요약
이 연구는 고립된 뇌 미세아교세포에서 핵내 유세포 분석을 사용하여 전역 히스톤 변형의 정량화를 위한 프로토콜을 설명합니다. 이 작업에는 데이터 수집에 사용된 미세아교세포 격리 프로토콜도 포함되어 있습니다.
초록
유전자 발현 조절은 히스톤 꼬리에 대한 번역 후 변형의 추가 및 제거를 포함하여 염색질 구조의 변형에 의해 부분적으로 발생합니다. 히스톤 번역 후 변형(HPTM)은 유전자 발현 또는 억제를 촉진할 수 있습니다. 예를 들어, 히스톤 꼬리 라이신 잔기의 아세틸화는 양전하를 중화하고 꼬리와 음전하를 띤 DNA 사이의 상호 작용을 감소시킵니다. 히스톤 꼬리-DNA 상호 작용의 감소는 기본 DNA의 접근성을 증가시켜 전사 인자 접근성을 증가시킵니다. 아세틸화 마크는 또한 브로모도메인 함유 전사 활성제의 인식 부위 역할을 하여 유전자 발현을 향상시킵니다. 히스톤 마크는 세포 분화 과정과 다양한 세포 환경 및 자극에 반응하여 동적으로 조절될 수 있습니다. 차세대 염기서열 분석 접근법은 개별 히스톤 변형에 대한 게놈 위치를 특성화하기 시작했지만 하나의 변형만 동시에 검사할 수 있습니다. 수백 가지의 서로 다른 HPTM이 있다는 점을 감안할 때, 우리는 보다 광범위한 게놈 시퀀싱 접근 방식을 수행하기 전에 히스톤 변형을 선별하는 데 사용할 수 있는 글로벌 HPTM의 높은 처리량, 정량적 측정을 개발했습니다. 이 프로토콜은 글로벌 HPTM을 검출하기 위한 유세포 분석 기반 방법을 설명하며 배양 중인 세포 또는 생체 내 조직에서 분리된 세포를 사용하여 수행할 수 있습니다. 박테리아 유래 면역 자극(지질다당류)에 대한 반응으로 HPTM의 전역 이동을 감지하기 위한 분석의 민감도를 입증하기 위해 분리된 마우스 뇌 미세아교세포의 예제 데이터를 제시합니다. 이 프로토콜은 HPTM의 신속하고 정량적인 평가를 가능하게 하며 항체로 검출할 수 있는 모든 전사 또는 후성유전학적 조절자에 적용할 수 있습니다.
서문
후성유전학(Epigenetics)은 근본적인 DNA 염기서열을 변경하지 않고 유전자 발현을 조절하는 메커니즘에 대한 연구입니다. 유전자 발현의 후성유전학적 조절은 세포 내에서 역동적이며 다양한 환경 자극에 대해 신속하고 조정된 반응을 가능하게 할 수 있습니다. 동적 조절은 DNA1에 의해 단단히 감긴 옥타머 코어에 조립된 히스톤 단백질(H2A, H2B, H3, H4)로 구성된 뉴클레오솜 수준의 염색질 구조 변화로 인해 부분적으로 발생합니다. 히스톤 단백질과 DNA 사이의 상호 작용은 전사 기계에 대한 DNA의 접근성을 제어 할 수 있으며, 이는 궁극적으로 유전자 발현 및 염색질 생물학의 다른 측면을 제어 할 수 있습니다2. 히스톤 단백질은 음전하를 띤 DNA 골격과 정전기 상호작용을 형성하는 양전하를 띤 잔류물을 특징으로 하는 구조화되지 않은 꼬리를 가지고 있습니다. 이러한 상호 작용으로 인해 DNA가 단단히 포장되고 DNA 접근성이 감소합니다. 히스톤 후 번역 변형 (HPTM)이라고하는 히스톤 꼬리에 대한 공유 변형은 이러한 상호 작용을 조절 할 수 있습니다 3,4. 몇몇은의 잘 성격을 나타낸 HPTMS의 몇몇은, 히스톤 꼬리와 DNA 사이 정전기 상호 작용의 친화력을 변화시킬 수 있는 히스톤 꼬리 아세틸화와 메틸화를 포함해, 근본적인 DNA에 차별적인 접근가능성 및 특정한 위치에 이 HPTMs를 인식하는 전사 요인의 모집의 유래하. HPTMs는 효소의 3개의 중요한 종류에 의해 통제된다 인식하는 독자, 예금하는 작가 및 HPTMs를 제거하는 지우개- 불렸다. 따라서 판독기, 작가 또는 지우개 효소의 모집 또는 용해는 궁극적으로 HPTM의 지형을 변화시키고 염색질의 구조와 기능을 지배할 수 있으므로 세포 생물학 및 기능을 이해하는 데 필수적인 조절 및 판독이 될 수 있습니다 3,4.
중추신경계(CNS)의 세포는 환경 자극에 적응하기 위해 전사체를 변화시키기 때문에 후성유전학적으로 유연합니다. 축적된 증거에 따르면 DNA 메틸화, 비암호화 RNA, HPTM과 같은 후성유전체의 변화가 기억 형성과 시냅스 기능에 필수적인 역할을 한다5. 관련 독자, 작가 또는 지우개의 조작을 통해 HPTM 역학을 방해하면 연상 학습 및 장기 강화를 차단하거나 향상시킬 수 있습니다 6,7,8. 중추신경계의 상주 면역 세포인 미세아교세포는 후성유전체(epigenome) 9,10,11의 동적 변화를 통해 면역 자극에 반응하여 전사체를 빠르게 조절합니다. 미세아교세포의 후성유전체(epigenome)와 전사체(transcriptome)는 뇌 환경에서 제거된 후 배양 배지에서 단 몇 시간 만에 변화한다는 연구 결과가 있기 때문에 국소적 뇌 환경에 대한 이러한 높은 수준의 적응은 고립된 맥락에서 검사하기 어렵게 만든다11. 또한 미세아교세포는 뇌 세포의 10%만을 구성하기 때문에 전체 조직 수준에서 변화를 검사하는 측정은 민감도와 특이성이 부족합니다12,13. 결과적으로, 미세아교세포는 생체 외에서 HPTM 수준과 같은 후성유전학적 변화를 검사하기 위해 신속하게 분리되어야 합니다.
HPTM을 검사하는 데 일반적으로 사용되는 방법에는 염색질 면역침전 염기서열분석(ChIP-seq)과 표적 절단 및 태깅 염기서열분석(CUT&Tag-seq)이 있습니다4. 이러한 기술은 개별 HPTM에 매우 특이적이며 특정 게놈 컨텍스트 내에서 HPTM의 존재를 알릴 수 있지만, 단일 실험 내에서 가능한 많은 HPTM 중 하나만 검사할 수 있습니다11,14 따라서 상당한 시간과 비용 투자가 필요한 이러한 실험을 진행하기 전에 먼저 글로벌 변화를 조사하여 추가 조사를 위해 잠재적으로 흥미로운 HPTM 목록을 좁히는 것이 매우 중요합니다. HPTM 수준. 전체 HPTM 수준을 검사하기 위한 두 가지 주요 접근법은 면역조직화학과 웨스턴 블롯 분석이지만, 두 접근법 모두 반정량적이고 처리량이 적으며 많은 수의 조직 절편 또는 분리된 세포가 필요합니다15,16. 따라서 우리는 단일 세포 수준에서 글로벌 HPTM 수준을 신속하게 검사하는 데 사용할 수 있는 매우 민감하고 정량적인 방법을 개발하는 것을 목표로 했습니다.
제시된 프로토콜은 핵내 유세포 분석을 사용하여 글로벌 HPTM 수준을 신속하게 검출할 수 있습니다. 암세포에 대한 이전 연구는 임상적 관점에서 전 지구적 수준을 조사하는 것의 중요성을 정당화했다17,18. 또한 연구에서 관심 있는 특정 HPTM의 게놈 위치를 평가하기 전에 스크리닝 방법으로 글로벌 수준을 사용하는 것이 일반적입니다19,20. 미세아교세포의 경우, 낮은 세포 수율로 인해 분리 후 전체 수준을 평가하는 것은 어렵습니다. Pan 등은 분리된 미세아교세포의 전반적인 HPTM 수준을 제시하며, 여기서 3마리의 미세아교세포를 모아 웨스턴 블롯19에 의한 단백질 수준 검출을 가능하게 했습니다. 당사의 프로토콜을 사용하면 훨씬 적은 세포 입력으로 전반적인 변화를 감지할 수 있으므로 동물당 여러 마크를 스크리닝할 수 있고 샘플을 통합할 필요가 없습니다.
여기에서는 분리된 미세아교세포에서 정량적 핵내 유세포 분석을 통해 HPTM 수준을 신속하게 검출하는 프로토콜을 설명합니다. 간결함을 위해 HPTM 정량화에 특히 중점을 두지만, 이 프로토콜은 리더, 라이터 및 지우개 효소의 글로벌 수준을 정량화하는 데 동일한 방식으로 사용할 수 있습니다. 프로토콜은 두 부분으로 나뉘는데, 첫째는 미세아교세포에 대한 분리 방법이고, 둘째는 HPTM 수준을 측정하기 위한 유세포 분석 기반 방법입니다. 분리 방법은 RNA 분리 및 HPTM 수준 평가 모두에 사용할 수 있는 세포를 생성하며, 이를 통해 동일한 샘플에서 유전자 발현 및 HPTM 수준을 평가할 수 있습니다. 또한, HPTM 평가 방법은 프로토콜에 표시된 다른 세포 유형에서 사용할 수 있습니다.
프로토콜
모든 동물 관리 프로토콜은 캐나다 동물 관리 위원회 지침에 따라 브리티시 컬럼비아 대학교의 동물 관리 위원회의 승인을 받았습니다.
1. 미세아교세포 분리를 위한 뇌 소화
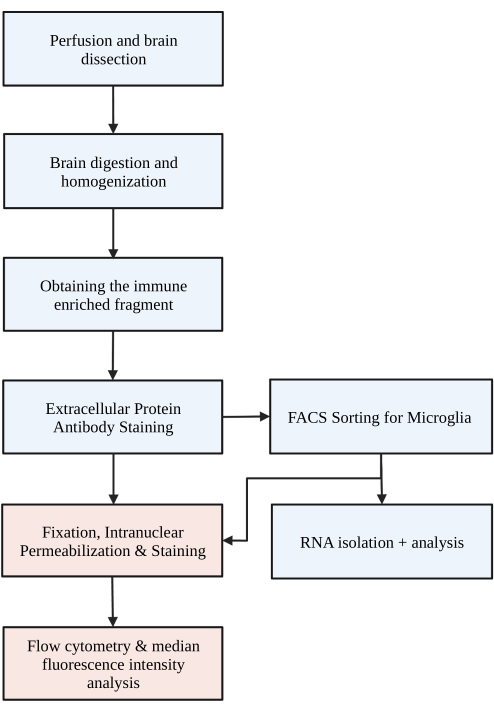
그림 1: 프로토콜의 간단한 순서도. 생쥐는 먼저 HBSS로 심장 경관류를 받고 뇌를 절개합니다. 그런 다음 뇌는 화학적 소화와 기계적 파괴를 통해 해리되어 단일 세포 균질화를 초래합니다. 면역 강화 분획은 불연속 밀도 구배를 통해 수집되며, 그 후 세포는 P2RY12에 대해 염색됩니다. 염색된 세포는 1) 형광 활성 세포 분류(FACS)를 통해 분류되어 RNA 분석 또는 다운스트림 단백질 분석으로 이어지거나 2) 핵 내 단백질에 대해 고정, 투과화 및 염색됩니다. 단백질 수준은 유세포 분석에 의해 결정된 관심 채널의 중간 형광 강도로 정량화됩니다. 파란색으로 표시된 상자는 프로토콜 단계 1) 미세아교세포 분리를 위한 뇌 소화의 일부입니다. 빨간색으로 표시된 상자는 프로토콜 단계 2) 단백질 발현 분석을 위한 핵내 유동 염색의 일부입니다. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 시약의 준비
참고: HPTM 분석을 위해 RNA와 세포를 모두 수집하기 위한 추출을 계획하는 경우 전사 및 번역 억제제를 포함하도록 수정하려면 섹션 1.7.1을 참조하십시오. 그러나 단백질 신호를 평가하는 경우에는 세포가 얼음 위에 보관될 때 대부분 정지하기 때문에 이것은 필요하지 않습니다.- 형광 활성 세포 분류(FACS) 완충액(샘플당 20mL): 소 혈청 알부민(BSA)을 1x Hanks 균형 소금 용액(HBSS)에 용해시켜 2% BSA 용액을 만듭니다. EDTA를 2% BSA 용액에 최종 농도 1mM으로 용해시킵니다. 0.2μm 필터를 사용하여 필터를 멸균하고 4°C에서 최대 1주일 동안 보관한 후 사용하십시오.
- 분해 완충액(샘플당 1mL): HBSS의 파파인 바이알을 0.5mM EDTA를 사용하여 1mM L-시스테인에서 최종 농도 20U/mL로 재구성합니다. 37°C에서 최소 10분 동안 또는 조직을 소화할 준비가 될 때까지 활성화합니다. 사용 직전에 DNase I을 활성 파파인 용액에 첨가하여 최종 농도 200U/mL까지 합니다. 실험 당일에 준비하고 보관하지 마십시오.
- 등장 밀도 그래디언트 용액(샘플당 5.5mL): 10x HBSS를 저온 밀도 그래디언트 배지에 1x HBSS의 최종 농도로 추가하여 최종 밀도 1.117g/mL를 만듭니다. 사용하기 전에 최소 30초 동안 Vortex를 혼합하십시오. 사용할 때까지 얼음 위에 올려 놓으십시오.
- 37% 밀도 그래디언트 용액(샘플당 4mL): 1x HBSS에 등장 밀도 그래디언트를 추가하여 최종 밀도 1.043g/mL로 최종 농도 37%를 만듭니다. 37% 밀도 구배의 각 mL에 대해 20μL의 페놀 레드를 추가하여 적층 중 시각화를 위한 분홍색 용액을 만듭니다. 사용하기 전에 최소 30초 동안 소용돌이를 일으키십시오. 사용할 때까지 얼음 위에 올려 놓으십시오.
- 70% 밀도 그래디언트 용액(샘플당 2mL): 1x HBSS에 등장 밀도 그래디언트를 추가하여 최종 밀도 1.082g/mL로 최종 농도 70%를 만듭니다. 70% 밀도 배지의 각 mL에 대해 5μL의 트리판 블루를 추가하여 적층 중 시각화를 위한 블루 용액을 만듭니다. 사용하기 전에 최소 30초 동안 소용돌이를 일으키십시오. 사용할 때까지 얼음 위에 올려 놓으십시오.
- 관류 및 뇌 해부
참고: 관류 프로토콜은 마우스 개흉술, 심 경 관류 및 뇌 제거에 대한 비디오 묘사를 특징으로 하는 Posel et al.과 유사합니다21. 여기서는 성체 C57BL/6J 수컷 및 암컷 마우스(생후 10-15주, 20-30g)를 사용하지만 이 프로토콜은 모든 마우스에 대해 개흉술을 수행하는 데 사용할 수 있습니다. 모든 동물 시술은 실험을 수행하기 전에 기관 윤리 위원회의 승인을 받아야 합니다.- 마우스 마취: 발가락 꼬집기 또는 쥐의 발을 세게 꼬집었을 때 반사 부족으로 확인할 수 있는 수술 마취 평면을 지날 때까지 100% 산소에 4% 이소플루란으로 마우스를 마취합니다. 마우스를 등에 대고 네 발을 플라스틱 트레이에 기울어져 놓인 수술 해부 보드에 단단히 고정하여 코가 이소불소 코콘에 고정되도록 합니다. 이송 후 진행하기 전에 동물이 여전히 수술 마취면을 지났는지 확인하십시오.
- 쥐 흉곽술: 집게를 사용하여 복부 피부를 잡고 들어 올리고 피부와 복벽을 얕게 절개하여 하행 대동맥이나 기저 장기를 손상시키지 않고 시푸스를 노출시킵니다.
- 집게로 시푸스를 잡고 흉곽 아래를 옆으로 절개하여 횡격막과 간을 노출시킵니다. 가는 가위를 사용하여 흉곽 길이를 따라 횡격막을 조심스럽게 얕게 자르고 조직 가위를 사용하여 흉곽을 통해 흉골을 쥐 머리 근처의 수술 스테이션에 고정하여 심장과 폐를 심 관류를 위해 노출시킵니다.
- 심 관류: 연동 관류 펌프를 준비하고 26.5G 바늘을 튜브의 한쪽 끝에 부착합니다. 튜빙의 한쪽 끝을 차가운 1x HBSS 바이알에 삽입하고 펌프를 켜서 튜빙을 1x HBSS로 완전히 채워 절차를 위해 튜빙을 프라이밍합니다.
- 뭉툭한 집게로 심장을 잡고 관류관이 부착된 26.5G 바늘 끝을 심장의 좌심실에 삽입하고 우심방을 작게 절개합니다. 관류 펌프를 켜서 최소 2-4mL의 차가운 1x HBSS로 ~4-1mL/분의 속도로 마우스를 조심스럽게 관류합니다.
알림: 간이 혈액을 맑게 하기 시작하고 심장과 같은 색이 될 때 완전한 관류가 종종 표시됩니다. - 뇌 제거: 조직 해부 가위를 사용하여 쥐의 목을 베고 목에서 코까지 두피의 정중선을 절개합니다. 피부 플랩을 옆으로 벗겨 두개골을 노출시키고 해부 가위로 두개골 꼬리 끝의 과도한 조직과 뼈를 제거합니다.
- 두개골 아래의 가위 한쪽 날을 날카로운 면이 뼈를 향하도록 하여 구멍 매그넘에 조심스럽게 밀어 넣고 코 쪽으로 정중선을 조심스럽게 자릅니다. 해부 가위를 사용하여 두개골 기저부와 코 근처를 측면으로 자릅니다. 미세한 집게를 사용하여 정중선에서 바깥쪽까지 두개골에 생명을 불어넣어 두개골 조각을 부수고 뇌를 노출시킵니다. 주걱으로 뇌를 부드럽게 들어 올려 해부 블롯 페이퍼에 놓습니다.
- 뇌 해부: 얼음으로 채워진 닫힌 페트리 접시 위에 1x HBSS로 적신 해부 블롯 종이 위에 뇌를 놓습니다. 소뇌를 제거하고 깨끗한 면도날을 사용하여 뇌 반구를 이등분합니다.
- 각 반구에서 뇌간, 선조체, 백질을 제거하고 해마와 피질을 덮고 있는 것은 그대로 유지합니다. 분리된 피질과 해마 조직이 포함된 반구를 5mL의 차가운 1x HBSS가 있는 15mL 튜브에 옮기고 얼음 위에 보관합니다.
알림: 참수와 얼음 위의 1x HBSS에 절개된 조직을 최종적으로 배치하는 사이에 2분을 넘지 않고 조직이 차갑게 유지되도록 가능한 한 빨리 해부를 수행하는 것이 중요합니다. 여러 동물에서 미세아교세포를 분리하는 경우 뇌를 1x HBSS의 얼음에 ~1시간 동안 보관한 후 소화 등을 위해 전체 동물 코호트를 처리할 수 있습니다.
- 뇌 소화 및 균질화
- 기계적 및 화학적 해리: 각 쥐의 뇌 조직과 1mL의 소화 완충액을 얼음 위의 개별 페트리 접시에 넣습니다. 깨끗한 메스 칼날을 사용하여 뇌를 작은 조각(<1mm)으로 완전히 자릅니다.
- 플라스틱 이송 피펫의 팁을 자르고 다진 각 뇌를 얼음 위의 24웰 플레이트 내에 있는 별도의 웰로 조심스럽게 옮깁니다. 투명하고 유연한 필름으로 접시를 덮고 얼음 위에서 30분 동안 배양합니다.
참고: 올바르게 다진 뇌 조직은 잘 다진 마늘과 비슷합니다. - Dounce 균질화: 각 웰에서 분해된 뇌 용액을 각각 5mL의 차가운 FACS 완충액으로 채워진 얼음 위의 개별 7mL 유리 dounce 균질화기로 옮깁니다. 단일 세포 현탁액이 얻어질 때까지 느슨한 유봉(A)으로 각 뇌를 약 30-40회 부드럽게 두드립니다. A 유봉으로 반죽한 후 단단한 유봉(B)으로 3-4회 부드럽게 두드려 단일 셀 현탁액을 보장합니다.
알림: 균질기 바닥의 조직이 찌그러지지 않도록 유봉을 3/4 이상 아래로 밀지 마십시오. 최종 솔루션은 불투명하고 유백색이어야 합니다.
참고: 단일 실험에서 여러 뇌를 분해하는 경우 각 샘플이 30분 동안 분해 완충액에만 있도록 뇌 분해물을 FACS 완충액으로 전송하는 시간을 정합니다. 과분해는 표면 단백질의 절단을 초래하여 다운스트림 항체 결합 및 신호를 감소시킬 수 있습니다.
- 면역 강화 단편 얻기
- 밀도 구배 설정: 각 뇌의 균질액을 별도의 15mL 폴리프로필렌 튜브로 옮기고 2.125mL의 등장성 밀도 구배를 추가하고 각각에 대해 FACS 완충액을 사용하여 8.5mL를 추가하여 25% 밀도 구배의 최종 농도를 얻습니다. 15ml 튜브를 20x 부드럽게 뒤집어 잘 섞습니다.
- 좁은 눈금이 매겨진 이송 피펫을 사용하여 4mL의 37% 밀도 구배를 각 튜브에 부드럽게 밑받침하고 깨끗한 층을 형성하도록 매우 주의합니다. 이송 피펫을 전환하고 2mL의 70% 밀도 구배를 부드럽게 밑받침합니다(그림 2A). 4°C로 냉각된 원심분리기로 옮기고 제동 램프를 0으로 설정한 상태에서 20분 동안 500 x g 으로 회전합니다.
- 면역 강화 단편 수집: 깨끗한 이송 피펫을 사용하여 깨끗한 이송 피펫을 사용하여 15mL 튜브의 부피 상단에서 미엘린을 부드럽게 흡입하고 폐기합니다. 이송 피펫을 사용하여 밀도 구배의 상단 단편을 깨끗한 15mL 폴리프로필렌 튜브에 조심스럽게 수집합니다.
- 면역 강화 단편(70% 및 37% 밀도 그래디언트 층이 만나는 위 1.5mL 및 아래 1.5mL)을 새로운 15mL 폴리프로필렌 튜브에 조심스럽게 수집합니다(그림 2B). 면역이 풍부한 샘플에 FACS 완충액 10mL를 추가하여 밀도 구배 배지를 희석하고 튜브를 부드럽게 20배 뒤집어 완전히 혼합합니다.
알림: 세포가 튜브의 측면에 달라붙는 경향이 있으므로 액체를 수집하는 동안 튜브의 측면을 따라 피펫을 천천히 돌면서 수집 단계 동안 모든 세포를 s에 모으십시오. - 내리막 램프 브레이크를 0으로 설정하고 500 x g 의 4°C 원심분리기에서 10분 동안 15mL 튜브를 원심분리하여 면역이 풍부한 샘플의 세포를 펠트합니다. 탈수가 끝나면 즉시 상층액을 조심스럽게 제거하고 15mL 튜브에 약 300μL의 액체를 남겨두고 펠릿(보이지 않을 수 있음)을 방해하지 않도록 주의합니다.
- 다른 15mL 튜브에서 상층액을 수집하여 세포가 스핀에서 펠릿화되었는지 확인합니다(재현탁된 펠릿의 세포 수를 확인한 후 이 분획을 폐기). P1000 피펫을 사용하여 300μL 부피의 세포 펠릿을 재현탁시킨 후 혈구분석기로 세포를 계수하여 총 세포 수율을 추정합니다.
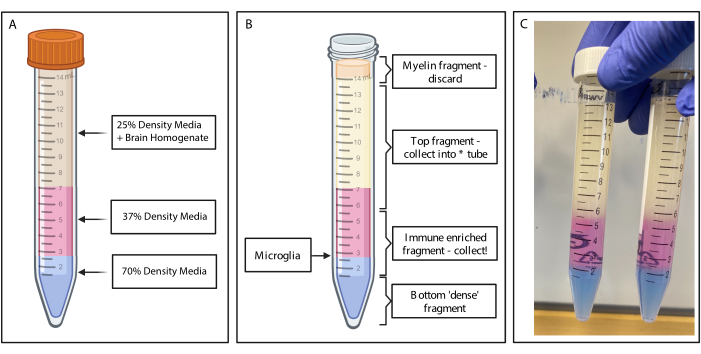
그림 2: 불연속적인 밀도 구배를 통한 면역 강화 단편 획득. (A) 뇌 균질액은 25% 밀도 배지로 만들어지고, 페놀 레드를 통해 37% 밀도의 중간 색상의 분홍색 4mL와 트리판 블루를 통해 70% 밀도의 중간 색상의 파란색 2mL를 밑받침으로 만듭니다. (B) 원심분리 후 분획이 분리되었습니다. 미세아교세포는 37% 및 70% 밀도의 배지 조각의 계면에 있습니다. 미엘린 조각은 15mL 튜브의 상단에 있으며 폐기됩니다. 스핀이 실패할 경우 상단 조각이 백업으로 수집되고 셀이 복구되지 않습니다. 이 경우 이 분수를 사용하여 그라데이션을 반복할 수 있습니다. 면역이 강화된 분획은 다운스트림에서 수집됩니다. 적혈구가 들어 있는 아래쪽 분획은 튜브에 남아 버려집니다. (C) 전체 레이어를 묘사한 예제 그림. BioRender.com 로 만들었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 세포외 항체 염색
- 차단: 얼음 위의 둥근 바닥 96웰 플레이트로 세포를 옮기고 브레이크를 사용하여 500 x g 에서 원심분리하여 세포를 펠릿화합니다. 접시를 튕겨 상층액을 처리하여 싱크대에서 상층액을 빠르게 제거하고 세포 펠릿을 웰 바닥에 그대로 둡니다.
- P200 피펫(최종 농도 10μg/mL, 희석 인자 1:50)을 사용하여 항-마우스 CD16/32 FC-수용체 차단 시약으로 50μL의 FACS 완충액에 세포를 재현탁시켜 단핵구 또는 기타 FcR 베어링 세포에 대한 항체의 비특이적 결합을 방지합니다. 얼음 위에서 10분간 배양합니다.
- 항체 염색: P2RY12- 알로피코시아닌(APC; 희석 계수 1:50, 최종 웰 농도 1:100, 농도 2μg/mL에 대한 농도 4μg/mL) 및 보라색 525 살아있는 죽은 염색(최종 웰 농도 1:100에 대한 희석 계수 1:50)을 포함하는 2x 마스터 믹스의 적절한 부피를 준비합니다. 염색 마스터 믹스 50μL를 세포 현탁액(섹션 1.5.1에서 차단 후 얻음)에 추가하고 얼음 위의 어두운 곳에서 30분 동안 플레이트를 배양합니다.
참고: 이 프로토콜의 경우 P2RY12로 세포를 염색합니다. 첫째, P2RY12는 특정 질병 상황에서 하향 조절될 수 있는 미세아교세포에 대한 항상성 마커입니다. 예를 들어, 5XFAD 알츠하이머 모델 마우스는 P2RY12 수치를 하향 조절하여22를 식별하기 어렵게 만들 수 있습니다. 분리에 사용할 수 있는 대체 염색에는 Tmem119, Cd11b 및 CD4523이 있습니다. 둘째, 접합체 형광 색소 APC는 원하는 항체 패널에 맞게 조정할 수 있습니다. 그러나 APC 또는 PE와 같은 밝은 형광 색소를 선택하면 양성 및 음성 모집단을 쉽게 구별할 수 있도록 하는 데 도움이 됩니다24. - 염색 후 200μL의 FACS 완충액을 각 웰에 직접 추가하여 세포를 세척합니다. 4°C에서 500 x g 으로 회전하여 상층액을 제거합니다. P200 피펫을 사용하여 200μL의 FACS 버퍼에 세포를 재현탁하고, 4°C에서 500 x g 으로 회전하고, 플레이트를 플릭하여 웰에서 버퍼를 제거합니다.
- 흐름 제어 준비: 염색하기 전에 필요한 흐름 제어를 위해 1.5.1단계에서 차단한 후 각 샘플에서 필요한 양의 세포를 분리합니다.
참고: 게이트를 설정하기 위해 각 실험에 흐름 제어가 필요합니다. 흐름 제어는 추가 동물 또는 각 실험 우물의 일부에서 가져올 수 있습니다. 세포를 분할할 때 높은 신뢰도로 게이트를 설정하기 위해 대조군당 10,000-30,000개의 세포가 필요하므로 대조군당 충분한 세포를 할당해야 합니다.- 세 가지 관련 흐름 제어가 있습니다: 얼룩 없음, 살아있는 시체 및 P2RY12 동형 제어. 얼룩 방지를 위해 항체를 추가하지 마십시오. P2RY12 동형 대조군에서 세포를 생존도 염료(1:100)와 APC에 접합된 동형 대조군 항체(1:100)로 처리합니다.
- 살아있는 죽은 대조군을 준비하려면 세포를 별도의 웰에 분취하고 세포 부피의 절반을 500μL 튜브로 옮깁니다. 500μL 튜브를 -80°C 냉동고에 5분 동안 넣은 다음 37°C 인큐베이터에 5분 동안 넣어 세포를 죽입니다. 죽은 세포의 분취액을 살아있는 죽은 대조군에 되돌려 놓고 보라색 525(희석 계수 1:100)에 아민 결합 생존도 염료로 염색하여 죽은 세포를 표시합니다.
참고: 이 프로토콜은 상층액 제거를 위한 플릭 방법을 사용한 플레이트 염색을 위해 작성되었습니다. 그러나 이를 위해서는 탈수 완료 직후 상층액을 제거해야 하며 펠릿을 방해하지 않고 상층액을 빠르게 제거할 수 있도록 충분한 힘으로 플릭을 수행해야 합니다. 또는 1.5mL RNAse/DNase가 없는 튜브를 다음과 같이 수정하여 염색에 사용할 수 있습니다. 세포를 1.5mL 미세 원심분리 튜브에 옮기고 4°C에서 5분 동안 800 x g 의 펠릿으로 전달합니다. 피펫으로 상층액을 흡입합니다. 팁: 속도를 위해 P200 팁이 있는 5mL 이송 피펫을 사용하면 상층액을 빠르고 정확하게 흡입할 수 있습니다. 흡입할 때 펠릿을 확인하십시오. 펠릿이 보이지 않으면 50μL의 상층액을 남겨두고 그에 따라 계산을 조정합니다. 항체를 세척할 때 FACS를 추가하여 항체의 희석을 증가(200μL 대신 1000μL)하여 상층액의 불완전한 제거를 설명합니다. 유세포 분석기에 따라 분류에 1.5mL 튜브를 사용하여 필요한 공급량을 줄일 수 있습니다.
- 미세아교세포에 대한 FACS 분류
- 준비: P200 피펫을 사용하여 200μL의 FACS 완충액에 각 웰을 재현탁하고 라벨이 부착된 유동 분류 튜브로 옮기고 FACS 완충액을 총 500μL에 추가하여 mL당 약 5 x 105 이벤트의 농도를 만듭니다. 분석할 때까지 어두운 곳에서 얼음 위에 보관하십시오. 1.5mL RNAse free 튜브에 세포용 쿠션으로 100μL의 FACS 완충액을 추가하여 분류 후 튜브를 준비합니다.
- 유세포 분석기 설정: 100μm 노즐로 설정된 유세포 분석 세포 분류기에서 세포를 분류합니다. 18-20psi를 사용하여 세포를 분류합니다.
- 게이팅: 유세포에서 파편을 구별하는 데 도움이 되도록 염색 없는 대조군을 사용하여 측면 산란(SSC) 영역 대 전방 산란(FSC) 높이를 사용하여 세포 크기에 대한 게이트를 측정하고, SSC-A를 로그 축에 배치하여 세포 집단을 시각화하고 세포를 선택하기 위해 밀접하게 게이트합니다(게이트 S1; 그림 3). 이중항을 제거하려면 FSC-H 대 FSC-W를 플로팅하고 세포 집단 주위를 밀접하게 게이트하여 파편과 이중항을 제거합니다(게이트 S2). P2RY12 isotype control을 사용하여 APC 채널의 세포를 검사하고 자가형광 게이트를 설정하여 P2RY12+ 세포를 결정합니다. 얼룩이 없고 죽은 대조군을 사용하여 보라색 525nm에서 형광이 아닌 세포를 살아있는 세포로 게이트합니다.
- 정렬: 보라색 525nm 대 APC를 플로팅하고 P2RY12+이고 FMO(MG)에 의해 살아있는 모집단을 결정합니다. 이러한 셀을 라벨이 붙은 포스트 정렬 튜브에 정렬합니다(그림 3). 최종 정렬 비율은 전체 이벤트의 약 50%이며, 이벤트 총 손실의 대부분은 게이트 S1에서 제거된 파편입니다(이벤트의 ~70%는 셀; 표 1).
- RNA 분리 및 분석
- 전사 및 번역 억제제: RNA 추출을 계획하는 경우 분리 관련 전사체 서명의 위험을 제거하기 위해 완충액 단계에 번역 및 전사 억제제를 포함하십시오. Marsh et al.에 기술된 바와 같이 악티노마이신 D, 아니소마이신 및 트립톨라이드25를 포함하는 억제제 칵테일을 준비한다.
- 억제제 준비: 억제제 재고를 재구성하고 다음과 같이 보관합니다: 디메틸설폭사이드(DMSO)에서 악티노마이신 D를 5mg/mL로 재구성하고 -20°C에서 보관합니다. DMSO에서 트리톨라이드를 10mM으로 재구성하고 -20°C에서 빛으로부터 보호하여 보관합니다. DMSO의 애니소마이신을 10mg/mL로 재구성하고 4°C에서 보관하고 빛으로부터 보호합니다. 모든 억제제 재고는 재구성 후 1개월 이상 보관하지 마십시오.
- 완충액 변형: 다음과 같이 프로토콜의 4가지 다른 완충액에 억제제를 추가합니다. 심경 관류를 수행할 때 악티노마이신 D(5μg/mL, 재고에서 1:1000) 및 트립톨라이드(10μM, 재고에서 1:1000)로 HBSS를 준비합니다. 관류 후 뇌를 방선단지 D(5μg/mL, 재고 1:1000), 트립톨라이드(10μM, 재고 1:1000) 및 아니소마이신(27.1μg/mL, 재고 1:368.5)이 포함된 HBSS의 실험실로 운반합니다. FACS 완충액을 방광막 D(5μg/mL, 재고 1:1000), 트립톨라이드(10μM, 재고 1:1000) 및 아니소마이신(27.1μg/mL, 재고 1:368.5)으로 준비합니다. 방광균 D(5μg/mL, 재고 1:1000), 트립톨라이드(10μM, 재고 1:1000) 및 아니소마이신(27.1μg/mL, 재고 1:368.5)으로 분해 완충액을 준비합니다. 방선광균 D(5μg/mL, 재고 1:1000), 트리톨라이드(10μM, 재고 1:1000) 및 아니소마이신(27.1μg/mL, 재고 1:368.5)을 함유한 HBSS로 분류 후 세척 완충액을 준비합니다.
알림: 억제제를 추가할 때는 사용 직전에 추가하고 사용 중 준비된 완충액을 빛으로부터 보호하십시오. 원액의 동결 해동을 피하십시오.
- 분류 후 세척: 세포가 FACS 완충액에서 1.5mL RNase free 튜브로 분류되어 RNA 분리를 방해하기 때문에 세포를 세척해야 합니다. 4°C에서 1000 x g 으로 5분 동안 셀을 회전시키고 상층액을 제거하고 약 50μL의 액체를 남깁니다.
- 방광막 D(5μg/mL, 육수 1:1000), 트리톨라이드(10μM, 육시 1:1000) 및 아니소마이신(27.1μg/mL, 육수 1:368.5)을 함유한 1x HBSS 200μL를 넣고 잘 섞습니다. 탈수를 반복하고 50μL의 액체를 남기고 상층액을 제거합니다(세척 1). 200μL의 포스트 분류 세척 버퍼를 추가하고 완전히 혼합한 다음 탈수를 반복하고 25μL의 액체를 남기고 상층액을 제거합니다(세척 2).
- RNA 추출: 미세아교세포에서 RNA를 분리하려면 저투입 RNA 분리 키트를 사용하여 높고 일관된 RNA 수율과 9 이상의 RIN 점수를 얻을 수 있습니다(제품 권장 사항은 아래 및 재료 표 참조). 세포 펠릿에 권장 키트의 용해 완충액 350μL + β-메르캅토에탄올(1:100)을 넣고 잘 섞습니다.
참고: 필요한 경우 이 시점에서 프로토콜을 일시 중단할 수 있습니다. 샘플은 RNA 추출까지 -80°C의 용해 버퍼에 보관할 수 있습니다. 보관 후 RNA를 추출하는 경우 용해물을 얼음 위에서 해동하고 분리를 위한 키트별 지침을 진행합니다. - 용해물을 컬럼 기반 세포 파쇄기로 옮기고(제품 권장 사항은 재료 표 참조) 4°C에서 최대 속도로 2분 동안 원심분리합니다. 최소 14μL의 RNase가 없는 물에 용리하고 적절한 농도를 측정합니다. RNA는 이 시점 이후의 모든 다운스트림 응용 분야에 사용할 수 있습니다.
- 전사 및 번역 억제제: RNA 추출을 계획하는 경우 분리 관련 전사체 서명의 위험을 제거하기 위해 완충액 단계에 번역 및 전사 억제제를 포함하십시오. Marsh et al.에 기술된 바와 같이 악티노마이신 D, 아니소마이신 및 트립톨라이드25를 포함하는 억제제 칵테일을 준비한다.
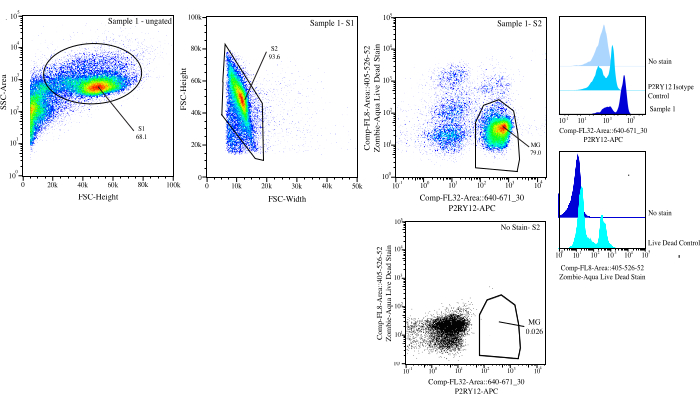
그림 3: 흐름 정렬을 위한 게이팅 전략. 이벤트는 SSC-A 대 FSC-H(S1)의 셀 크기에 대해 게이트됩니다. 그런 다음 세포는 FSC-H 대 FSC-W(S2)에서 단일항이 되도록 게이트됩니다. 단일항 세포는 P2RY12-isotype 대조군을 사용하여 Comp-FL8-A::405-526-52(보라색 525 살아있는 죽은 염색)에서 음성인 경우 살아있는 세포로 정렬되고 Comp-FL32-A::640-671_30(P2RY12-APC)에서 양성인 경우 P2RY12+로 분류됩니다. 세포는 MG로 라벨링되고 살아 있는 세포와 P2RY12+인 경우 분류됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 게이티드 모집단(GATED POPULATION) | 부모의 빈도 | 합계의 빈도 | 세다 |
| 시즌 1 | 68.10% | 68.10% | 162186 |
| 시즌 2> 시즌 1 | 93.59% | 63.70% | 151707 |
| P2Ry12+(670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| 라이브(525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ 라이브) >S2>S1 | 78.96% | 50.30% | 119794 |
표 1: 예제 예제 샘플 계보 테이블(게이팅 백분율 및 예상 이벤트 번호).
2. 단백질 발현 분석을 위한 핵내 유동 염색
참고: 이 시점에서 다른 세포 유형을 시작할 수 있으며, 이 프로토콜은 HEK293 세포, BV2 미세아교세포 유사 세포 및 인간 IPSC 유래 미세아교세포를 포함한 배양 세포로 테스트됩니다.
- 세포의 고정 및 염색
참고: 다음 프로토콜의 경우 핵 염색에 최적화된 세포 내 염색 키트를 사용하십시오. 보다 재료 표 제품 추천을 위해.- 섹션 1.5.2에서 96웰 플레이트(5 x 104- 1 x 106 세포)로 세포 외 염색된 세포를 분취합니다. 4°C에서 500 x g 에서 5분 동안 셀을 회전시키고 튕겨 FACS 버퍼를 제거합니다.
참고: 중앙값 수준의 높은 신뢰도로 데이터를 얻으려면 웰당 최소 10,000개의 세포를 사용해야 합니다. 권장되는 최대값은 없지만 다른 변동 계수(CV)의 유의미한 영향이 없도록 실험 전반에 걸쳐 셀 수를 일관되게 유지하는 것이 가장 좋습니다. - 고정 및 투과성: 200μL의 1x 고정 농축액을 추가하고 P200 피펫과 부드럽게 혼합하여 세포를 재현탁시킵니다. 어둠 속에서 45-60분 동안 배양합니다. 실온(RT)에서 500 x g 에서 5분 동안 원심분리기 플레이트를 돌리고 튕겨 상층액을 버립니다.
참고: 필요한 경우 이 시점에서 프로토콜을 일시 중단할 수 있습니다. 상층액을 폐기한 후 면역 세포를 위한 장기 보관 완충액에 세포를 다시 부유시킵니다(제품 권장 사항은 재료 표 참조). 시료는 4°C에서 12-18시간 동안 보관할 수 있으며, 빛으로부터 보호되고 완충액 증발을 보호하기 위해 투명 필름으로 덮여 있습니다. - 200μL의 1x 투과화 완충액을 각 웰에 추가하고 P200이 있는 피펫을 혼합합니다. 원심분리기 플레이트를 RT에서 500 x g에서 5분 동안 돌리고 튕겨 상층액을 버립니다. 투과화 완충액을 총 3회 세척을 반복합니다.
- 유량 제어 준비: 필요한 유량 제어를 위해 각 샘플에서 세포의 부피를 분할합니다(대조군당 10,000-30,000개의 세포로 충분함).
- 무염색 대조군을 준비하려면 염색되지 않은 세포의 무염색 세포를 항체를 받지 않는 별도의 웰에 고정하거나 분취합니다.
- 형광 마이너스 원(FMO) 대조군을 준비하기 위해, 해당 채널에 있는 항체를 제외한 패널 상의 각 항체에 대한 분취액 세포.
- 관련 채널의 경우 게이팅을 위해 FMO에 isotype control 항체를 포함합니다. 예를 들어, P2RY12-APC 및 H3K27Ac-AlexaFluor568을 포함하는 패널에는 (1) H3K27Ac-AlexaFluor568 및 P2RY12 동형 대조 항체만 포함하는 APC-FMO와 (2) P2RY12-APC와 동형 대조군 1차 및 568 2차만 포함하는 568-FMO의 두 가지 FMOS가 있어야 합니다.
참고: 이 프로토콜은 단일 HPTM을 테스트하기 위해 제공되지만 다른 형광단에 접합된 많은 HPTM을 포함하는 패널을 설정할 수 있습니다.
- 1차 항체 염색: 적절한 농도의 1차 항체가 포함된 50μL의 1배 투과화 완충액을 각 웰에 추가합니다. 어둠 속에서 RT에서 30분 동안 배양합니다. 200μL의 1x 투과화 완충액으로 2x 세척합니다.
참고: 각 HPTM에 사용되는 항체의 농도는 재료 표에 포함되어 있습니다. 농도는 급격한 증가를 유발할 수 있는 자극제(예: 아세틸화 표시에 대한 HDAC 억제제)로 처리된 배양 세포에서 항체의 다양한 농도를 테스트하고 처리되지 않은 세포와 처리된 세포가 모두 검출 범위 내에 있는지 확인하여 결정됩니다(동형 대조군 초과 및 세포분석기의 최대 검출 범위 미만). HPTM에 대한 최적의 항체 농도는 형광단 채널에서 5 x 104 와 1 x 105 사이의 평균 형광 강도 중앙값을 가져야 합니다. - 2차 항체 염색: 2% 정상 당나귀 혈청(NDS)이 포함된 200μL의 1x 투과화 완충액으로 RT에서 10분 동안 차단합니다. RT에서 500 x g 에서 5분 동안 회전하고 튕겨 상층액을 제거합니다.
- 2% NDS와 적절한 농도의 2차 항체가 있는 1x 투과화 완충액 50μL를 추가하고 어두운 곳에서 RT에서 30분 동안 배양합니다. 200μL의 1x 투과화 완충액을 웰에 추가하여 희석하고, 상온에서 500 x g 에서 5분 동안 플레이트를 원심분리한 다음, 튕겨 상층액을 버립니다. 200μL의 1x 투과화 완충액으로 세포를 2배 세척합니다.
참고: 필요한 경우 이 시점에서 프로토콜을 일시 중단합니다. P200 피펫을 사용하여 면역 세포를 위한 200μL의 장기 보관 완충액에 세포를 재현탁하고(권장 사항은 재료 표 참조) 빛으로부터 보호되어 4°C에서 12-24시간 동안 보관합니다. - 유세포 분석 준비: 원심분리기 플레이트를 RT에서 500 x g 에서 5분 동안 튕겨 상층액을 버립니다. 유세포 분석용 P200 피펫을 사용하여 200μL의 FACS 완충액에 세포를 재현탁시킵니다. 세포분석기로 이송하기 위해 투명 필름으로 밀봉합니다.
- 섹션 1.5.2에서 96웰 플레이트(5 x 104- 1 x 106 세포)로 세포 외 염색된 세포를 분취합니다. 4°C에서 500 x g 에서 5분 동안 셀을 회전시키고 튕겨 FACS 버퍼를 제거합니다.
- 유세포 분석
- 제안된 항체 패널을 분석하려면 유세포 분석기에 보라색(405nm), 파란색(488nm), 노란색(561nm) 및 빨간색(633nm)을 포함한 최소 4개의 레이저가 장착되어 있는지 확인하십시오. 유세포분석기는 FITC(청색-525nm), KRO(보라색-525nm), PE(황색-585nm) 및 APC(적색-660nm)를 검출하기 위한 필터가 필요합니다. 선택한 세포분석기에 따라 항체를 추가합니다.
- 보정 및 표준화: 각 실험을 시작할 때 무지개 형광 비드를 실행하고 비드 피크가 이전 실험에서 실행된 목표값과 비교할 수 있을 때까지 광전자 증배관(PMT) 전압을 조정합니다. 이 표준화 방법을 사용하면 시간 경과에 따른 장비 드리프트를 수용할 수 있습니다.
- 보상: 실험을 위해 PMT 전압 및 이득을 설정한 후 항체 포획 보상 비드를 사용하여 항체 패널에 대한 보상 매트릭스를 설정합니다. 이 계산은 형광단이 다른 채널의 신호 변화에 기여하지 않도록 합니다. 이는 여러 항체를 다중화할 때 점점 더 필요합니다.
- 크기 게이팅: 점도표에서 로그의 SSC-A와 선형의 FSC-H를 플로팅합니다. 파편을 제거하고 S1 게이트를 사용하여 셀 크기를 선택합니다. FSC-W 대 FSC-H의 도트 플롯에서 단일항 셀을 선택하고 게이트를 S2로 지정합니다. (그림 4).
- 형광단 게이트 설정: 각 형광단 채널에 대한 관련 FMO를 사용하여 단일 파라미터 히스토그램을 사용하여 각 채널에서 포지티브 신호가 무엇인지 결정하기 위해 게이트를 설정합니다(그림 4).
- 샘플 측정: 확립된 게이팅 전략을 사용하여 샘플을 주의 깊게 기록합니다. P2RY12+ 신호를 사용하여 미세아교세포를 식별하고, 미세아교세포에 대해서만 각 채널에서 단백질의 발현을 결정합니다.
- 유세포 분석 데이터 분석
- 분석 게이트 설정: 분석 소프트웨어 사용자 인터페이스에서 유세포 분석기에 대해 위의 단계를 사용하여 분석을 위한 기록에 사용된 것과 동일한 게이트를 사용합니다.
- 유세포 분석 소프트웨어를 사용하여 MFI 값 얻기(권장 사항은 자료표 참조): 유세포 분석을 위한 유세포분석기 게이팅 전략을 요약합니다. 통계 추가 기능을 사용하여 보상된 채널 높이에서 관심 모집단의 중앙값(예: 568+)을 선택합니다. 표 편집기를 사용하여 각 채널의 중간 형광 강도(MFI) 값을 스프레드시트로 내보내 통계 분석을 진행합니다(표 2).
참고: 보충 파일 S1 에는 LPS(lipopolysaccharide) 및 PBS(phosphate buffered saline) 주입 마우스의 예제 데이터와 gating 전략 및 MFI 값이 포함된 예제 분석 파일이 포함되어 있습니다. - 단백질 접힘 변화에 대한 MFI 값 분석: MFI 값을 얻은 후 대조군 또는 처리되지 않은 모집단에 대한 MFI의 접힘 변화를 계산합니다(수식 1). MFI 폴드 변화는 단백질 수준의 폴드 변화를 반영합니다. 접기 변화 값을 사용하여 표현식의 변화를 평가하고 t-검정 또는 분산 분석을 사용하여 통계적 유의성을 계산합니다.
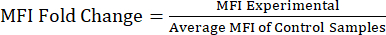 방정식 1
방정식 1
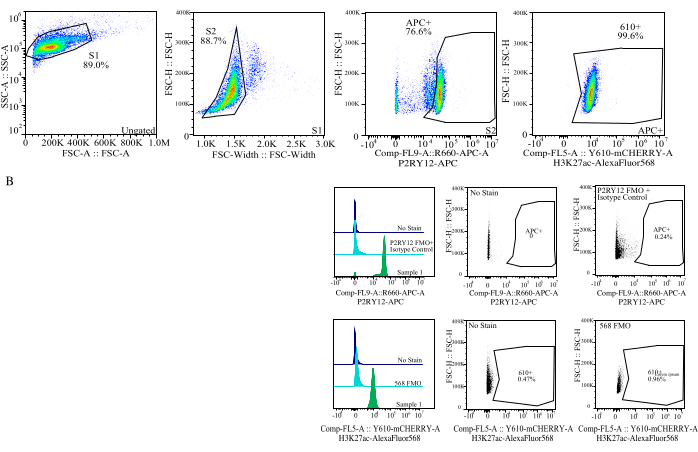
그림 4: 단백질 MFI 평가를 위한 게이팅 전략. 이벤트는 SSC-A 대 FSC-H(S1)의 셀 크기에 대해 먼저 게이트됩니다. 그런 다음 세포는 FSC-H 대 FSC-W(S2)의 단일항에 대해 게이트됩니다. 그런 다음 단일항 세포는 P2RY12-APC 신호(APC+)에 의해 미세아교세포로 식별되며, 동형 대조 항체를 포함하는 APC-FMO 대조군의 형광을 기반으로 게이트가 설정됩니다. 그런 다음 Comp-FL5-A::Y610-mCherry에서 H3K27Ac-AlexaFluor568 신호에 대해 셀을 게이트합니다. 610+ 세포의 형광 강도는 단백질 발현의 대용물로 결정됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
다 자란 마우스는 미세아교세포(microglia) 분리를 위해 경심(transcardially perfusion)되고 희생되었다. 미세아교세포를 얼음 상에서 분리하고, P2RY12-APC 및 보라색 525 살아있는 죽은 항체로 염색하였다. P2RY12에 대해 양성이고 보라색 525 살아있는 죽은 염색에 대해 음성으로 결정된 세포는 살아있는 미세아교세포로 분류되었습니다. 절개된 쥐의 뇌에서 나온 미세아교세포의 평균 수율은 1.28 x 105 ± 0.05(평균 ± 평균 표준 오차(SEM), N=100)이었다. 암컷(1.25 x 105 ± 0.09 [평균 ± SEM, N=46])과 수컷(1.32 x 105 ± 0.07 [평균 ± SEM, N=54]) 마우스(t(98)=0.6365, p=0.526)의 미세아교세포의 수율에는 차이가 없습니다. 특정 뇌 영역에서 분리했을 때, 쥐 피질에서 미세아교세포의 평균 수율은 8.3 x 104 ± 0.08(평균 ± SEM, N=15)이고 쥐 해마에서 4.1 x 104 ± 0.02(평균 ± SEM, N=16)입니다. 예상대로, 각 뇌 영역에서 미세아교세포의 수율에 유의한 차이가 있습니다(F(2, 128)=25.25, P<0.0001). 미세아교세포 분리 후, 저투입 RNA 분리 키트를 사용하여 분리된 세포에서 RNA를 추출했습니다. 일관되게 RNA 무결성 점수(RIN)는 9.0(9.62 ± 0.05) 이상이었고 세포당 RNA의 평균 수율은 0.25 ± 0.01pg(평균 ± SEM, N=32; 보충 파일 S2).
성체 마우스는 희생 24시간 전에 1mg/kg 지질다당류(LPS)를 복강내로 주사했습니다. 마우스는 HBSS로 심장 경관류되었고, 설명된 프로토콜에 따라 전체 뇌에서 미세아교세포를 분리했습니다(그림 5A). 각 염색에 대해, 20,000-30,000개의 세포가 각 항체 패널에 할당되었습니다. 히스톤 3 라이신 27 아세틸화(H3K27Ac)의 전반적인 수준은 유세포 분석을 통해 분리된 미세아교세포에서 평가되었습니다. 수컷 및 암컷 마우스의 경우, LPS 처리는 MFI가 성별 내에서 정규화될 때 H3K27Ac의 증가를 유도했습니다(t(6)=9.676, p<0.0001; 그림 5B). 염색된 세포에 대한 히스토그램을 검사할 때 모집단은 유사한 변동으로 정규 분포를 유지합니다. 그러나 세포는 형광 증가로 이동하여 MFI가 증가했습니다(그림 5C). 동일한 처리에서 H3K9Ac를 검사할 때 H3K9Ac도 유사한 증가가 있습니다(t(6)=7.299, p=0.0003; 그림 5D,E) 그러나 H3K9Ac 신호의 PBS에 대한 LPS의 접힘 변화는 H3K27Ac 신호보다 작습니다.
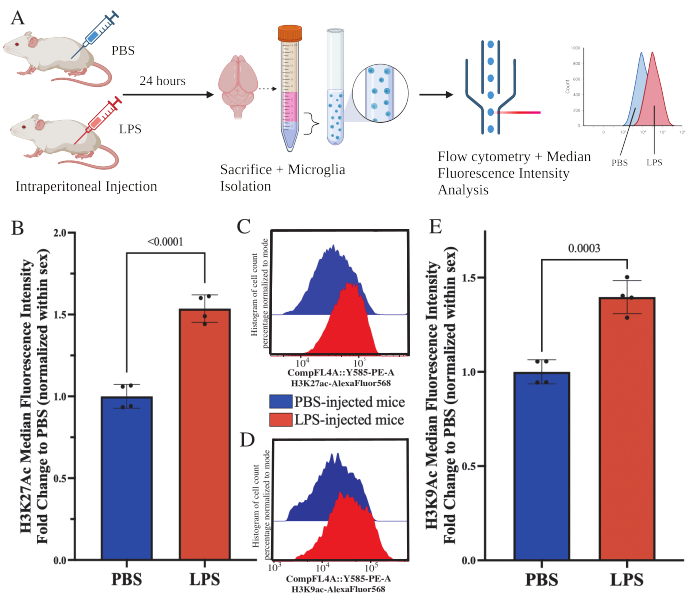
그림 5: 분리된 미세아교세포에서 히스톤 아세틸화의 전반적인 변화. (A) 마우스는 희생 24시간 전에 인산염 완충 식염수(PBS) 또는 1mg/kg 지질다당류(LPS)를 복강내로 주입합니다. 미세아교세포는 면역 농축 분획에서 수집되고 유세포 분석 및 전체 히스톤 번역 후 변형 평가를 위해 고정됩니다. 중간 형광 강도는 단백질 발현의 대용으로 평가됩니다. BioRender.com 로 만들었습니다. (B) LPS 치료에 대한 반응으로 H3K27Ac의 전반적인 수준이 증가했습니다. 실험과 성별 내에서 정규화된 PBS로의 폴드 변경. 쌍을 이루지 않은 양측 t-검정, t(6)=9.676, p<0.0001. 막대 그래프는 평균± SEM을 나타냅니다. N=8마리; 2개의 독립적인 실험에서 조건당 2개. (C) H3K27Ac 형광 강도의 이동을 묘사한 히스토그램의 예. 모달은 PBS 주입 마우스와 LPS 주입 마우스의 히스토그램을 나타냅니다. (D) H3K9Ac 형광 강도의 이동을 묘사한 히스토그램의 예. 모달은 PBS 주입 마우스와 LPS 주입 마우스의 히스토그램을 나타냅니다. (E) LPS 치료에 대한 반응으로 H3K9Ac의 전반적인 수준이 증가했습니다. 실험과 성별 내에서 정규화된 PBS로의 폴드 변경. 쌍을 이루지 않은 양측 t-검정, t(6)=7.299, p=0.0003. 막대 그래프는 평균± SEM을 나타냅니다. N=8마리; 2개의 독립적인 실험에서 조건당 2개. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
설명 된 방법이 이전에 사용 된 다른 히스톤 변형 정량화 방법과 비교할 수 있는지 확인하기 위해 면역 블롯을 비교 도구로 사용하는 것을 목표로했습니다. 그러나 분리된 미세아교세포의 수율은 합리적인 평가가 가능하기에는 너무 낮습니다. 따라서 배양된 BV2 세포를 사용하여 세포 내 유세포 분석법과 웨스턴 블롯(WB)을 비교했습니다. BV2 세포는 37°C, 5%CO2의 완전한 배지(DMEMF12, 10% FBS, 1x 페니실린/스트렙타마이신 및 1x L-글루타민)에서 성장시켰다. 세포를 0.25% 트립신-EDTA로 통과시키고 250,000 cells/well의 밀도로 도말하고 환원 혈청 배지(DMEM F12, 2% FBS, 1x 페니실린/스트렙타마이신 및 1x L-글루타민)에서 처리하고 37°C, 5%CO2에서 12시간 동안 회수하도록 했습니다. 세포는 상술한 바와 같이 고정하거나 WB 용해 완충액으로 용해하기 전에 24시간 동안 25ng/mL LPS로 처리하였다. H3K27Ac의 신호는 WB의 부하 제어로 GAPDH를 사용하여 두 가지 방법으로 수행되었습니다. PBS 대조군과 비교하여 정규화된 형광 강도를 분석한 결과, 각 그룹에 대해 결정하였다(그림 6A). WB에 의한 정규화된 H3K27Ac 신호의 변화를 조사할 때, 짝을 이루지 않은 t-검정(t=3.024, df=5; p=0.0293)에 의해 유의한 것으로 결정된H2O대조군에 비해 LPS 처리 조건이 1.527배 증가했습니다. 유세포 분석을 사용하여 변화를 조사했을 때 LPS 처리 조건이 1.482배 증가했으며 이는 유의한 것으로 확인되었습니다(t=7.843, df=10; p<0.0001). 2차 분산 분석을 사용하여 방법을 비교한 결과, 처리(F(1,15)=45.21,p<0.0001)에는 유의한 효과가 있는 것으로 확인되었지만 방법(F(1,15)=0.05545, p=0.8697) 또는 교호작용(F(1,15)=0.02785, p=0.8697)에는 유의한 효과가 없는 것으로 확인되었습니다. 또한, 2-way ANOVA는 LPS 처리(F(1,7)=0.02170,p=0.8870), 방법(F(1,7)=0.01191, p=0.9162) 또는 상호작용(F(1,7=0.01191, p=0.9162; 그림 6B). 이 데이터에 대한 블롯 및 히스토그램 이동의 예도 나와 있습니다(그림 6C,D).
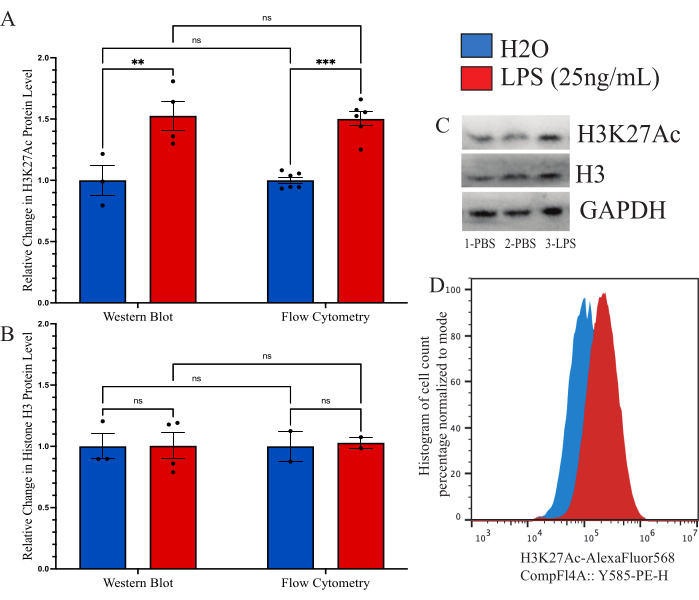
그림 6: 유세포 분석법과 웨스턴 블롯 간의 글로벌 히스톤 변형 변화를 정량화하기 위한 방법 비교. (A) BV2 세포는 분석 전에 25ng/mL 지질다당류(LPS) 또는H2O로 24시간 동안 처리됩니다. H3K27Ac의 형광 강도는 유세포 분석 및 웨스턴 블롯 모두에 대해 차량 제어, 인산염 완충 식염수(PBS)의 접힘 변화로 표시됩니다. 2원 분산 분석에서는 LPS 처리(F(1,15)=45.21, p<0.0001)의 유의한 효과가 나타났지만, 방법(F(1,15)=0.05545, p=0.8697) 또는 교호작용(F(1,15)=0.02785, p=0.8697)은 유의하지 않았습니다. 다중 가설 검정에 대한 Tukey의 수정이 잔차에 적용되었습니다. *는 0.0332를 나타내고, **는 0.0021을 나타냅니다. (B) 히스톤 H3의 형광 강도는 유세포 분석 및 웨스턴 블롯 모두에 대해 PBS로의 접힘 변화로 표시됩니다. 2원 분산 분석에서는 LPS 처리(F(1,7)=0.02170, p=0.8870) 또는 방법(F(1,7)=0.01191, p=0.9162) 또는 교호작용(F(1,7=0.01191, p=0.9162)에서 유의한 효과가 나타나지 않았습니다. (C) 블롯 및 (D) 유세포 분석 이동이 묘사되어 있습니다. 히스토그램 크기는 형광 강도 모드에 존재하는 셀 수를 기준으로 백분율로 정규화됩니다. 막대 그래프는 평균 SEM을 나타냅니다. n=2개의 독립 실험, 실험당 조건당 2개. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이러한 결과는 이 기법이 분리된 미세아교세포의 전체 HPTM 수준을 정량적으로 평가하는 데 사용될 수 있음을 보여줍니다. 또한, 이 방법은 이전 기술과 비슷하지만 훨씬 더 낮은 셀 입력을 필요로 하는 것으로 나타났습니다. 또한, 도시되지는 않았지만, 적절한 보상과 함께, 본 기술은 상이한 HPTM을 평가하는 동일한 패널 상의 다수의 항체와 함께 사용될 수 있다.
보충 파일 S1: 예제 분석 파일. 이 파일에는 wsp 분석 파일과 얼룩이 없는 P2RY12FMO, 568FMO, PBS 처리 동물 2마리 및 H3K27Ac로 염색된 LPS 처리 동물 2마리를 포함한 7개의 fcs 파일이 포함되어 있습니다. 이 파일의 목적은 성공적인 실험이 어떻게 생겼는지 묘사할 수 있는 실험에 대한 분석 및 게이팅을 보여 주는 것입니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 S2: 격리 데이터. 포함된 파일에는 설명된 프로토콜의 미세아교세포 및 RNA 수율을 포함하는 관련 데이터 포스트 미세아교세포가 포함되어 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
| 게이티드 모집단(GATED POPULATION) | 부모의 빈도 | 합계의 빈도 | 세다 |
| 시즌 1 | 89.00% | 89.00% | 25672 |
| 시즌 2> 시즌 1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
표 2: 샘플 계통 차트의 예는 정확한 단백질 검출에 필요한 백분율 및 사건 수를 보여줍니다.
토론
제시된 프로토콜은 유세포 분석을 통해 전체 HPTM 수준의 정량적 평가를 가능하게 합니다. 이 프로토콜은 새로운 방법을 제시하지만, 이전 연구에서는 유사한 접근법을 사용하여 단백질의 정량적 평가를 수행했다26. HPTM의 전반적인 수준을 평가하기 위해 사용된 이전 방법에는 면역조직화학과 웨스턴 블롯 16,17,19,20이 포함됩니다. 제시된 유세포 분석 기반 분석법은 쉽게 정량화할 수 있는 방법인 반면, 웨스턴 블롯 및 면역조직화학은 반정량적이며 처리량이 적습니다. 웨스턴 블롯은 세포 용해에 의존하며, 따라서 단백질 정규화와 실험 조건27에 의해 변하지 않는 것으로 가정되는 로딩 제어 단백질을 모두 필요로 한다. 면역조직화학(Immunohistochemistry)은 반정량적이며 단일 세포 수준에서 검사하지 않고는 단백질의 양을 정량적으로 평가하기 어렵기 때문에 처리량이 매우 낮다(16). 유사하게, 분리된 미세아교세포의 경우, 웨스턴 블롯이 훨씬 더 큰 단백질 투입을 필요로 하기 때문에 제한된 수율로 인해 유세포 분석법을 사용하는 것이 이점이 있다19. 세포 수 요건이 적기 때문에 동일한 동물에서 여러 염색 패널을 실행할 수 있습니다.
그러나 다른 방법과 마찬가지로 이 기술에는 모든 항체가 유세포 분석 환경에서 잘 작동하는 것은 아니기 때문에 항체 비용 및 가용성을 포함한 제한 사항이 있습니다. 또한 면역블롯에 비해 필요한 항체의 농도가 훨씬 높습니다. 멀티플렉싱을 통해 동일한 세포 패널에서 여러 항체를 사용할 수 있지만 분석 후 세포에서 항체를 제거할 수 없으므로 세포 사용이 항체 종당 하나로 제한됩니다. 이것은 같은 블롯을 반복적으로 사용할 수 있는 면역블롯과는 다릅니다. 그러나 항체의 가용성과 세포분석기의 검출 채널 수에 따라 최대 12개의 마크를 동시에 검사할 수 있습니다.
현재 방법은 특정 게놈 위치가 아닌 단백질 발현의 글로벌 수준만 캡처하며, 글로벌 수준의 변화는 개별 게놈 위치의 변화를 반영하지 않을 수 있습니다. 마찬가지로, 전 지구적 수준의 변화가 없다는 것은 게놈 유전자좌가 변화하지 않는다는 것을 의미하지 않을 수 있으며, 단순히 전 지구적 변화가 치료법 간의 차이를 합치지 않는다는 것을 의미할 수 있습니다. 따라서 이 기술은 게놈 분석을 위한 관심 HPTM을 식별하기 위한 스크리닝으로 사용됩니다. 또한, 이 방법은 대조군에 대한 접힘 변화로 평가되는 경우를 제외하고는 다른 단백질 마크에 대한 비교를 허용하지 않습니다. 따라서 이는 단백질 측정을 위한 ELISA와 같은 표준 곡선 기반 방법에 비해 제한적입니다.
제시된 프로토콜은 살아있는 뇌 미세아교세포를 분리하기 위한 전략을 제공합니다. 이 프로토콜은 미세아교세포 분리를 위해 P2RY12 단백질 발현에 의존합니다. 그러나 P2RY12는 미세아교세포의 항상성 마커이며 5XFAD22와 같은 질병 모델에서 하향 조절될 수 있습니다. 따라서 질병 모델 동물을 사용할 때는 미세아교세포(23)의 분리를 돕기 위해 TMEM119, CD11b 또는 CD45와 같은 다른 마커 단백질을 선택해야 합니다. 마찬가지로, 우리는 이 프로토콜을 해마 및/또는 피질로부터의 격리로 제시합니다. 이 프로토콜은 백질 영역을 포함한 다른 뇌 영역에서 미세아교세포를 분리하는 데 효과가 있지만, 관심 영역의 크기에 따라 충분한 미세아교세포를 얻기 위해 여러 동물이 필요할 수 있습니다.
제시된 프로토콜은 살아있는 뇌 미세아교세포를 강력하게 분리할 수 있지만, 잘못 수행할 경우 세포 수율을 감소시킬 수 있는 분리 단계에서 아래에 설명된 몇 가지 단계가 있습니다.
이 프로토콜에 대한 관류는 면역이 풍부한 단편에서 더 높은 비율의 미세아교세포를 발생시켜 분류기에서 시간을 단축합니다. 그러나 관류는 필요하지 않으며 필요한 경우 다른 안락사 방법을 사용할 수 있습니다.
미세아교세포를 분리하는 동안 미엘린은 완전히 제거되어야 합니다. 유세포 분석기는 세포가 좁은 튜브를 빠른 속도로 통과할 수 있어야 합니다. 점도와 응집되는 경향으로 인해 미엘린은 세포 분석기에 문제를 일으키며, 종종 막힘을 일으켜 장비를 손상시키고 샘플을 파괴하여 수율을 크게 감소시킬 수 있습니다. 다운스트림에서 문제가 발생하지 않도록 면역이 풍부한 단편을 수집하는 동안 모든 미엘린을 제거하는 데 주의하십시오.
플레이트 염색 대 튜브 염색: 이 프로토콜에서는 1.5mL 튜브 또는 96웰 플레이트에서 세포를 염색하는 두 가지 옵션을 설명했습니다. 각각의 사용 사례는 실험에 따라 다릅니다. 그러나 일반적으로 튜브 염색은 잘못 수행할 경우 세포가 손실될 위험이 있기 때문에 플레이트 염색보다 수율에 영향을 미칠 위험이 낮습니다. 플레이트 염색은 각 튜브의 상층액을 흡입하는 데 시간이 많이 걸리기 때문에 훨씬 빠릅니다. 고정(분류 등)하기 전에 튜브 염색을 사용하여 수율을 최대화하고 손실 위험을 줄이십시오. 그러나 HPTM 분석의 경우 핵 내 염색을 위해 세포를 고정하면 펠릿이 더 안정적이며 플릭으로 인한 손실 위험이 줄어듭니다.
불연속적인 밀도 구배 설정: 층을 설정할 때 면역 농축 분획을 얻으려면 층을 적절하게 설정하는 것이 필수적입니다. 층이 교란되거나 혼합되어 뿌옇게 보이면 세포가 원하는 위치로 분류되지 않고 면역이 풍부한 세포 분획을 얻는 데 어려움이 있습니다. 이 경우 밀도 배지로 회전시켜 미엘린을 제거한 다음 나머지 분획 전체를 수집하고 FACS 완충액 3mL로 밀도 배지 1mL로 희석한 다음 잘 혼합합니다(여러 개의 튜브가 필요함). 브레이크를 500으로 설정한 상태에서 10분 동안 0 x g 으로 회전합니다. 상층액을 버리고 ~300μL 용액만 남깁니다. 전체 샘플과 얼룩을 수집합니다. 이렇게 하면 분류 비율이 감소하고 세포분석기에서 더 많은 시간을 소비할 수 있지만 수율은 여전히 비슷할 수 있습니다.
분리 방법을 사용할 때 동일한 마우스 뇌에서 RNA 및 HPTM 평가를 위한 세포를 수집할 수 있는 것이 좋습니다. 이 상황에서, 살아있는 미세아교세포를 분류한 후, 세포를 나누어 RNA 평가에 일부를 할당하고(적절한 RNA 수율을 얻기 위한 최소 세포 투입 수는 75,000개임) 추가 유세포 분석 분석을 위한 부분(MFI의 양호한 측정을 위해 웰당 최소 10,000개 세포)을 할당할 수 있습니다. 이 경우 유세포 분석기 분류가 필요합니다. 그러나 HPTM 분석에만 세포를 사용할 계획인 경우 분류가 필요하지 않으며 면역 분획을 P2RY12 항체 및 HPTM 항체로 염색할 수 있습니다. 그런 다음 유동 분류와 마찬가지로 P2RY12+ 미세아교세포에 대해 유세포분석기의 게이팅을 설정하여 미세아교세포 내의 HPTM 신호만 분석할 수 있습니다. 정렬을 제거하면 프로토콜이 더 빠르고 비용 효율적일 수 있습니다. 또한 배양된 세포에서 HPTM을 평가하는 경우 염색 프로토콜에서 시작하는 것으로 충분하며 그림 6에 표시된 것처럼 세포 마커 항체가 필요하지 않습니다. HPTM 평가 프로토콜은 배양, 일차 세포 및 IPSC 유래 세포를 포함한 많은 세포 유형에 사용할 수 있습니다.
마지막으로, 미세아교세포의 두 가지 잠재적 용도를 제시했지만, ChIP, CUT&Tag 및 CUT&RUN과 같은 후성유전학적 기법을 포함한 다른 많은 용도가 있습니다. 특정 유전자좌의 변화를 특성화하는 것이 중요한 게놈 후성유전학 기법의 경우, 프로파일링된 미세아교세포 후성유전학적 변형이 효소 분해와 같은 분리 절차의 모든 단계에서 발생하는 기술적 인공물이 아닌지 확인하기 위해 실험에 맞춤화된 염색질 표시11 의 작성자 및 지우개에 대한 특정 억제제를 선택하십시오. 정량적 유세포 분석을 사용하는 것과 같이 후성유전학적 표지의 글로벌 수준의 변화를 평가할 때, 절차로 인한 변화는 글로벌 수준에서 검출될 정도로 크지 않을 것으로 예상됩니다.
전반적으로, 논의된 방법은 유세포 분석에 의한 히스톤 변형 및 기타 후성유전학적 변화의 글로벌 수준을 정량화하기 위한 새로운 단일 세포 방법을 제공합니다. 우리는 이 방법이 생체 내 LPS에 반응하여 미세아교세포에서 인핸서 마커 H3K27ac의 전반적인 변화를 검출할 수 있을 만큼 충분히 민감하다는 것을 입증했습니다. 이는 LPS28에 반응하는 인핸서의 극적인 리모델링을 보여주는 LPS 자극 후 H3K27ac의 이전 ChIP 시퀀싱과 일치합니다. 이 방법을 적용하면 발달 및 질병의 다양한 뇌 세포 유형에 걸쳐 전반적인 후성유전학적 변화를 조사할 수 있습니다.
공개
저자는 공개할 것이 없습니다.
감사의 말
그림 5의 면역블롯을 도와준 Yanyang Bai에게 감사의 말을 전합니다. 이 연구는 캐나다 보건 연구소(Canadian Institutes for Health Research)[CRC-RS 950-232402 to AC]의 지원을 받았습니다. 캐나다 자연 과학 및 공학 연구 위원회(Natural Sciences and Engineering Research Council of Canada) [RGPIN-2019-04450, DGECR-2019-00069 to AC]; Scottish Rite Charitable Foundation [21103 to AC] 및 Brain Canada Foundation [AWD-023132 to AC]; 브리티시 컬럼비아 대학교 원주민 대학원 펠로우십 (6481에서 MT); 브리티시 컬럼비아 대학원 장학금(6768에서 MT); 캐나다 오픈 신경 과학 플랫폼 학생 학자 상 (10901 to JK); 브리티시 컬럼비아 대학교 4년제 박사 펠로우십(6569에서 JK). 연구비 지원자들은 연구 설계, 자료 수집 및 분석, 출판 결정, 원고 준비에 아무런 역할도 하지 않았다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
참고문헌
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유