Method Article
Quantificação de modificações pós-traducionais globais de histona utilizando citometria de fluxo intranuclear em microglia cerebral isolada de camundongos
Neste Artigo
Resumo
Este trabalho descreve um protocolo para quantificação de modificações globais de histonas utilizando citometria de fluxo intranuclear em microglia cerebral isolada. O trabalho também contém o protocolo de isolamento da micróglia que foi utilizado para a coleta de dados.
Resumo
O controle da expressão gênica ocorre parcialmente por modificações na estrutura da cromatina, incluindo a adição e remoção de modificações pós-traducionais nas caudas das histonas. As modificações pós-traducionais de histona (HPTMs) podem facilitar a expressão gênica ou a repressão. Por exemplo, a acetilação de resíduos de lisina da cauda de histona neutraliza a carga positiva e reduz as interações entre a cauda e o DNA carregado negativamente. A diminuição das interações histona-cauda-DNA resulta em maior acessibilidade do DNA subjacente, permitindo maior acesso ao fator de transcrição. A marca de acetilação também serve como um local de reconhecimento para ativadores transcricionais contendo bromodomínio, resultando juntos em maior expressão gênica. As marcas de histona podem ser reguladas dinamicamente durante a diferenciação celular e em resposta a diferentes ambientes e estímulos celulares. Embora as abordagens de sequenciamento de próxima geração tenham começado a caracterizar locais genômicos para modificações individuais de histonas, apenas uma modificação pode ser examinada simultaneamente. Dado que existem centenas de HPTMs diferentes, desenvolvemos uma medida quantitativa de alto rendimento de HPTMs globais que pode ser usada para rastrear modificações de histonas antes de conduzir abordagens mais extensas de sequenciamento genômico. Este protocolo descreve um método baseado em citometria de fluxo para detectar HPTMs globais e pode ser conduzido usando células em cultura ou células isoladas de tecidos in vivo . Apresentamos dados de exemplo de microglia cerebral isolada de camundongos para demonstrar a sensibilidade do ensaio para detectar mudanças globais em HPTMs em resposta a um estímulo imune derivado de bactérias (lipopolissacarídeo). Este protocolo permite a avaliação rápida e quantitativa de HPTMs e pode ser aplicado a qualquer regulador transcricional ou epigenético que possa ser detectado por um anticorpo.
Introdução
Epigenética é o estudo dos mecanismos que regulam a expressão gênica sem alterar a sequência de DNA subjacente. A regulação epigenética da expressão gênica é dinâmica dentro das células e pode permitir respostas rápidas e coordenadas a vários estímulos ambientais. A regulação dinâmica ocorre em parte devido a mudanças na estrutura da cromatina ao nível do nucleossomo, que é composto por proteínas de histonas (H2A, H2B, H3, H4) reunidas em um núcleo octamérico firmemente enrolado pelo DNA1. As interações entre as proteínas das histonas e o DNA podem controlar a acessibilidade do DNA à maquinaria de transcrição, que pode, em última análise, controlar a expressão gênica e outros aspectos da biologia da cromatina2. As proteínas Histone têm caudas não estruturadas que apresentam resíduos carregados positivamente que formam interações eletrostáticas com a espinha dorsal de DNA carregada negativamente. Essas interações resultam em empacotamento apertado do DNA e acessibilidade reduzida ao DNA. Modificações covalentes nas caudas das histonas, denominadas modificações pós-traducionais de histonas (HPTMs), podem regular essas interações 3,4. Algumas das HPTMs mais bem caracterizadas incluem acetilação e metilação da cauda de histonas, que podem alterar a afinidade das interações eletrostáticas entre as caudas de histonas e o DNA, resultando em acessibilidade diferencial ao DNA subjacente e recrutamento de fatores de transcrição que reconhecem essas HPTMs em locais específicos. As HPTMs são reguladas por três importantes classes de enzimas denominadas leitores - que reconhecem, gravadores - que depositam, e borrachas - que removem HPTMs. Assim, o recrutamento ou dissolução de enzimas leitoras, escritoras ou borrachadoras pode, em última instância, alterar a paisagem das HPTMs e governar a estrutura e a função da cromatina, tornando sua regulação e leitura essenciais para o entendimento da biologia e função celular 3,4.
As células do sistema nervoso central (SNC) são epigeneticamente flexíveis à medida que mudam seu transcriptoma para se adaptar aos estímulos ambientais. Evidências acumuladas sugerem que alterações no epigenoma, como metilação do DNA, RNAs não codificantes e HPTMs, desempenham um papel essencial na formação da memória e na função sináptica5. Interromper a dinâmica HPTM por meio da manipulação dos leitores, escritores ou apagadores relevantes pode bloquear ou melhorar o aprendizado associativo e a potencialização a longo prazo 6,7,8. Microglia, a célula imune residente do SNC, regula rapidamente seu transcriptoma em resposta à estimulação imune através de mudanças dinâmicas em seu epigenoma 9,10,11. Esse alto nível de adaptação ao ambiente cerebral local os torna difíceis de serem examinados em um contexto isolado, pois estudos têm mostrado que o epigenoma e o transcriptoma da micróglia tornam-se alterados após apenas algumas horas em meios de cultura após a remoção do ambiente cerebral11. Além disso, como a microglia representa apenas 10% das células cerebrais, as medidas que examinam as alterações em todo o nível tecidual carecem de sensibilidade e especificidade12,13. Como resultado, a microglia precisa ser rapidamente isolada para examinar as alterações epigenéticas, como os níveis de HPTM, ex vivo.
Os métodos comumente usados para examinar HPTMs incluem o sequenciamento por imunoprecipitação com cromatina (ChIP-seq) e a clivagem sob alvos e o sequenciamento por tagmentação (CUT&Tag-seq)4. Embora essas técnicas sejam altamente específicas para uma HPTM individual e possam informar a presença de HPTMs dentro de um contexto genômico específico, elas só podem examinar uma das muitas HPTMs possíveis dentro de um único experimento 11,14 Portanto, antes de prosseguir com tais experimentos, que requerem um investimento significativo de tempo e dinheiro, é altamente valioso restringir a lista de HPTMs potencialmente interessantes para uma investigação mais aprofundada, examinando primeiro as mudanças no mercado global níveis de HPTMs. As duas principais abordagens para examinar os níveis globais de HPTM são a imunohistoquímica e a análise de western blot, mas ambas as abordagens são apenas semiquantitativas, de baixo rendimento e requerem grande número de cortes teciduais ou células isoladas15,16. Assim, nosso objetivo foi desenvolver um método quantitativo altamente sensível que pudesse ser usado para examinar os níveis globais de HPTM rapidamente e em nível de célula única.
O protocolo apresentado permite a detecção rápida dos níveis globais de HPTM por meio da citometria de fluxo intranuclear. Estudos prévios em células cancerosas justificaram a importância de examinar os níveis globais do ponto de vista clínico17,18. Também é comum que estudos utilizem níveis globais como método de triagem antes de avaliar a localização genômica de HPTMs específicas de interesse19,20. Para a micróglia, avaliar os níveis globais após o isolamento é um desafio devido ao baixo rendimento celular; Pan et al apresentam níveis globais de HPTM a partir de micróglia isolada, na qual a micróglia de três animais foi agrupada para permitir a detecção do nível de proteína por western blot19. Usando nosso protocolo, somos capazes de detectar mudanças globais com entradas de células muito menores, permitindo a triagem de várias marcas por animal e eliminando a necessidade de agrupar amostras.
Aqui, descrevemos um protocolo para detectar rapidamente os níveis de HPTM através de citometria de fluxo intranuclear quantitativa em microglia isolada. Embora nos concentremos especificamente na quantificação de HPTM por uma questão de brevidade, este protocolo pode ser usado da mesma maneira para quantificar os níveis globais de enzimas leitoras, escritoras e borrachadoras. O protocolo é entregue em duas partes: primeiro, o método de isolamento para micróglia e, segundo, o método baseado em citometria de fluxo para determinar os níveis de HPTM. O método de isolamento produz células que podem ser usadas tanto para o isolamento de RNA quanto para a avaliação do nível de HPTM, o que permite a avaliação da expressão gênica e dos níveis de HPTM a partir de uma mesma amostra. Além disso, o método de avaliação de HPTM pode ser usado em outros tipos de células, conforme indicado no protocolo.
Protocolo
Todos os protocolos de cuidados com animais foram aprovados pelo Comitê de Cuidados com Animais da Universidade da Colúmbia Britânica, de acordo com as diretrizes do Conselho Canadense de Cuidados com Animais.
1. Digestão cerebral para isolamento da micróglia
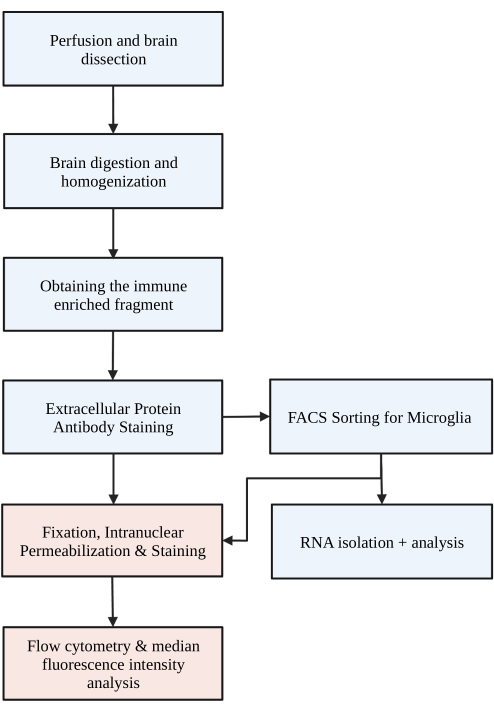
Figura 1: Fluxograma simples do protocolo. Os camundongos são primeiramente perfundidos transcardialmente com HBSS, e o cérebro é dissecado. O cérebro é então dissociado através da digestão química e interrupção mecânica para resultar em um homogeneizado de célula única. A fração imunoenriquecida é coletada através de gradiente de densidade descontínuo, após o qual as células são coradas para P2RY12. As células coradas são 1) classificadas via fluorescent activated cell sorting (FACS) para levar à análise de RNA ou análise de proteínas a jusante e/ou 2) fixas, permeabilizadas e coradas para proteínas intranucleares. O nível de proteína é quantificado pela intensidade mediana da fluorescência no canal de interesse determinada por citometria de fluxo. Caixas coloridas em azul fazem parte do protocolo passo 1) Digestão cerebral para isolamento da micróglia. As caixas coloridas em vermelho fazem parte do protocolo passo 2) Coloração de fluxo intranuclear para análise da expressão proteica. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
- Preparação de reagentes
NOTA: Se planear uma extracção para recolher ARN e células para análise de HPTM, consulte a secção 1.7.1 para modificações que incluam inibidores de transcrição e tradução. No entanto, isso não é necessário se apenas avaliar o sinal da proteína, pois as células são em grande parte quiescentes quando mantidas no gelo.- Tampão de classificação celular ativada por fluorescência (FACS) (20 mL por amostra): Dissolver albumina de soro bovino (BSA) em 1x solução salina balanceada de Hanks (HBSS) para criar uma solução de BSA a 2%. Dissolver o EDTA até uma concentração final de 1 mM na solução de BSA a 2%. Esterilizar o filtro com um filtro de 0,2 μm e conservar a 4 °C até 1 semana antes da utilização.
- Tampão de digestão (1 mL por amostra): Reconstituir um frasco para injetáveis de papaína em HBSS até uma concentração final de 20 U/mL em 1 mM L-cisteína com EDTA 0,5 mM. Activar a 37 °C durante um mínimo de 10 minutos ou até estar pronto a digerir o tecido. Imediatamente antes da utilização, adicionar DNase I à solução de papaína ativada até uma concentração final de 200 U/ml. Prepare no dia do experimento e não guarde.
- Solução de gradiente de densidade isotônica (5,5 mL por amostra): Adicionar 10x HBSS ao meio com gradiente de densidade fria até uma concentração final de 1x HBSS, resultando em uma densidade final de 1,117 g/mL. Vórtice para misturar por pelo menos 30 s antes de usar. Coloque no gelo até usar.
- Solução com gradiente de densidade de 37% (4 mL por amostra): Adicionar gradiente de densidade isotônico a 1x HBSS para obter uma concentração final de 37% com uma densidade final de 1,043 g/mL. Adicionar 20 μL de vermelho de fenol para cada mL de gradiente de densidade de 37% para fazer uma solução rosa para visualização durante a camada. Vórtice por pelo menos 30 s antes do uso. Coloque no gelo até usar.
- Solução com gradiente de densidade a 70% (2 mL por amostra): Adicionar gradiente de densidade isotônico a 1x HBSS para obter uma concentração final de 70% com uma densidade final de 1,082 g/mL. Adicionar 5 μL de azul de tripano para cada mL de meio de densidade de 70% para fazer uma solução azul para visualização durante a camada. Vórtice por pelo menos 30 s antes do uso. Coloque no gelo até usar.
- Perfusão e dissecção cerebral
NOTA: O protocolo de perfusão é semelhante ao de Posel et al., que apresenta representação em vídeo de toracotomia de camundongos, perfusão transcárdica e remoção de cérebro21. Aqui, usamos camundongos adultos C57BL/6J machos e fêmeas (10-15 semanas de idade, 20-30 g), mas este protocolo pode ser usado para realizar uma toracotomia para qualquer camundongo. Todos os procedimentos com animais devem ser aprovados pelo comitê de ética institucional antes da realização de experimentos.- Anestesia em camundongos: Anestesiar camundongos com isoflurano a 4% em oxigênio a 100% até ultrapassar o plano de anestesia cirúrgica, o que pode ser confirmado com uma pinça do dedo do pé ou falta de reflexo ao apertar firmemente o pé do camundongo. Coloque o rato nas costas e fixe firmemente as quatro patas na placa de dissecção cirúrgica colocada inclinada numa bandeja de plástico, garantindo que o nariz está preso no cone nasal de isofluorano. Após a transferência, certifique-se de que o animal ainda tenha passado do plano cirúrgico da anestesia antes de prosseguir.
- Toracotamia de camundongo: Agarre e levante a pele abdominal usando pinças e faça uma incisão rasa através da pele e da parede abdominal para expor a xifoide sem danificar a aorta descendente ou quaisquer órgãos subjacentes.
- Segure o xifoide com pinça e faça incisões laterais abaixo da caixa torácica para expor o diafragma e o fígado. Faça cortes rasos cuidadosos através do diafragma ao longo do comprimento da caixa torácica usando tesoura fina e através da caixa torácica usando tesoura de tecido e fixe o esterno na estação cirúrgica perto da cabeça do camundongo para expor o coração e os pulmões para perfusão transcárdica.
- Perfusão transcárdica: Prepare uma bomba de perfusão peristáltica e conecte uma agulha 26.5G em uma extremidade da tubulação. Prepare a tubulação para o procedimento inserindo uma extremidade da tubulação em um frasco de 1x HBSS frio e ligando a bomba para encher completamente a tubulação com 1x HBSS.
- Enquanto segura o coração com pinça romba, insira a ponta de uma agulha 26.5G com o tubo de perfusão acoplado no ventrículo esquerdo do coração e faça uma pequena incisão no átrio direito. Ligue a bomba de perfusão para perfundir cuidadosamente o mouse a uma taxa de ~2-4 mL/min com pelo menos 15-20 mL de HBSS 1x frio.
NOTA: Uma perfusão completa é frequentemente indicada quando o fígado começa a limpar o sangue e se torna da mesma cor que o coração. - Remoção cerebral: Decapitar o camundongo usando tesoura dissecante de tecido e fazer uma incisão na linha média no couro cabeludo do pescoço ao nariz. Descascar os retalhos de pele para os lados para expor o crânio e remover o excesso de tecido e ossos na extremidade caudal do crânio com tesoura dissecante.
- Deslize cuidadosamente uma lâmina da tesoura sob o crânio para o forame magno com o lado afiado voltado para o osso e corte cuidadosamente a linha média em direção ao nariz. Faça cortes laterais na base do crânio e perto do nariz usando tesouras dissecantes. Usando pinças finas, vida o crânio da linha média para o exterior para quebrar os pedaços do crânio e expor o cérebro. Levante suavemente o cérebro com uma espátula e coloque em papel manchado de dissecação.
- Dissecção cerebral: Coloque o cérebro em um pedaço de papel manchado de dissecação molhado com 1x HBSS em cima de uma placa de Petri fechada cheia de gelo. Remova o cerebelo e corte os hemisférios cerebrais usando uma lâmina de barbear limpa.
- Remova o tronco cerebral, o estriado e a substância branca de cada hemisfério, mantendo intacto o hipocampo e o córtex sobreposto. Transfira os hemisférios contendo córtex isolado e tecido hipocampal para um tubo de 15 mL com 5 mL de HBSS 1x frio e mantenha no gelo.
OBS: É importante realizar as dissecções o mais rápido possível para que o tecido permaneça frio com no máximo 2 min entre a decapitação e a colocação final do tecido dissecado em 1x HBSS sobre gelo. Se isolar a microglia de vários animais, os cérebros podem ser armazenados no gelo em 1x HBSS por ~1 h antes de prosseguir com o processamento de toda a coorte de animais para digestão, etc.
- Digestão e homogeneização cerebral
- Dissociação mecânica e química: Coloque o tecido cerebral de cada camundongo e 1 mL de tampão de digestão em placas de Petri individuais sobre gelo. Usando uma lâmina de bisturi limpa, pique completamente o cérebro em pequenos pedaços (<1 mm).
- Corte a ponta de uma pipeta de transferência de plástico e transfira cuidadosamente cada um dos cérebros picados em poços separados dentro de uma placa de 24 poços no gelo. Cubra a placa com filme flexível transparente e incube no gelo por 30 min.
NOTA: Quando picado corretamente, o tecido cerebral se assemelha ao alho bem picado. - Homogeneização de dounce: Transfira a solução cerebral digerida de cada poço para homogeneizadores individuais de 7 mL de dounce de vidro em gelo, cada um preenchido com 5 mL de tampão FACS frio. Saltar cada cérebro suavemente com o pilão solto (A), aproximadamente 30-40 vezes, até obter uma única suspensão celular. Depois de douncing com o pilão A, rebata suavemente com o pilão apertado (B) 3-4 vezes para garantir uma suspensão de célula única.
NOTA: Não empurre o pilão mais de 3/4 do caminho para baixo para evitar esmagar o tecido no fundo do homogeneizador. A solução final deve ser opaca e leitosa.
NOTA: Se digerir vários cérebros em um único experimento, cronometre a transferência do cérebro digerido para o buffer FACS de modo que cada amostra fique apenas no buffer digest por 30 min. A digestão excessiva pode resultar na clivagem das proteínas de superfície, reduzindo a ligação e o sinal de anticorpos a jusante.
- Obtenção de fragmento enriquecido imunologicamente
- Estabelecimento do gradiente de densidade: Transferir o homogeneizado de cada cérebro para tubos separados de polipropileno de 15 mL e adicionar 2,125 mL de gradiente de densidade isotônico e completar para 8,5 mL com tampão FACS para cada um para obter uma concentração final de 25% de gradiente de densidade. Inverta suavemente os tubos de 15 ml 20x para misturar completamente.
- Usando uma pipeta de transferência graduada estreita, subponha suavemente 4 mL de gradiente de densidade de 37% em cada tubo, tomando muito cuidado para estabelecer camadas limpas. Pipetas de transferência de interruptor e subposição suave de 2 mL de gradiente de densidade de 70% (Figura 2A). Transfira para uma centrífuga resfriada a 4 °C e gire a 500 x g por 20 min com a rampa de frenagem zerada.
- Coleta de fragmento enriquecido imuno: Usando pipetas de transferência limpas, aspirar suavemente a mielina do topo do volume no tubo de 15 mL usando uma pipeta de transferência limpa e descartar. Recolher cuidadosamente o fragmento superior do gradiente de densidade num tubo de polipropileno limpo de 15 ml utilizando uma pipeta de transferência.
- Coletar cuidadosamente o fragmento enriquecido imunemente (1,5 mL acima e 1,5 mL abaixo, onde as camadas de gradiente de densidade de 70% e 37% se encontram) em um novo tubo de polipropileno de 15 mL (Figura 2B). Adicionar 10 mL de tampão FACS à amostra enriquecida imunologicamente para diluir o meio de gradiente de densidade e inverter o tubo suavemente 20x para misturar completamente.
NOTA: Como as células tendem a grudar nas laterais do tubo, certifique-se de reunir todas as células da amostra durante as etapas de coleta, circulando lentamente a pipeta ao longo das laterais do tubo enquanto coleta o líquido. - Pastilhar as células da amostra enriquecida imunologicamente centrifugando os tubos de 15 mL em uma centrífuga de 4 °C a 500 x g por 10 min com o freio de rampa de descida regulado para zero. Imediatamente após o término do spin, remova o sobrenadante cuidadosamente, deixando aproximadamente 300 μL de líquido no tubo de 15 mL, tomando cuidado para não perturbar o pellet (que pode não ser visível).
- Coletar o sobrenadante em outro tubo de 15 mL para garantir que as células foram peletizadas no spin (descartar essa fração uma vez feita a verificação com a contagem de células do pellet ressuspenso). Após ressuspender o pellet celular no volume de 300 μL usando uma pipeta P1000, conte as células com um hemacitômetro para estimar o rendimento celular total.
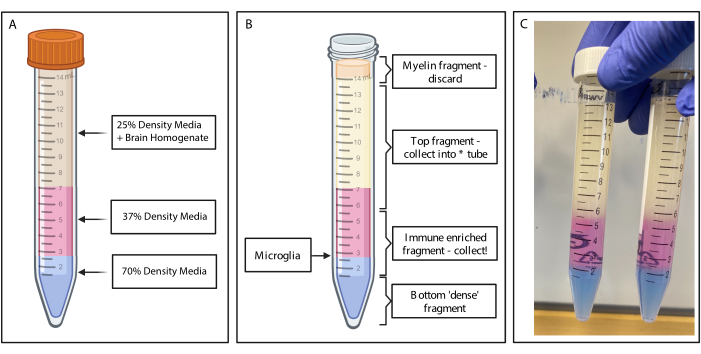
Figura 2: Obtenção do fragmento enriquecido imune por gradiente de densidade descontínuo. (A) O homogeneizado cerebral é feito para meio de densidade de 25%, subjaz 4 mL de 37% de densidade média cor-de-rosa via vermelho fenol e 2 mL de densidade média de 70% de cor azul via azul tripano. (B) Após a centrifugação, as frações se separaram. A microglia repousa na interface de 37% e 70% de fragmentos de meios de densidade. O fragmento de mielina encontra-se no topo do tubo de 15 mL e será descartado. O fragmento superior é coletado como backup caso o spin falhe e nenhuma célula seja recuperada. Se isso ocorrer, o gradiente pode ser repetido usando essa fração. A fração imunoenriquecida é coletada a jusante. A fração inferior contendo quaisquer hemácias permanece no tubo e é descartada. (C) Figura de exemplo representando camadas completas. Criado com BioRender.com. Clique aqui para ver uma versão maior desta figura.
- Coloração de anticorpos extracelulares
- Bloqueio: Transfira as células para uma placa de fundo redondo de 96 poços sobre gelo e centrifuja a 500 x g com freio para peletizar as células. Remova rapidamente o sobrenadante na pia agitando a placa para descartar o sobrenadante, deixando o pellet de célula intacto no fundo do poço.
- Ressuspender as células em 50 μL de tampão FACS com reagente bloqueador anti-receptor CD16/32 FC de camundongo usando uma pipeta P200 (concentração final 10 μg/mL, fator de diluição 1:50) para evitar a ligação inespecífica de anticorpos a monócitos ou outras células portadoras de FcR. Incubar por 10 min no gelo.
- Coloração de anticorpos: Preparar o volume apropriado de uma mistura mestre de 2x contendo P2RY12- Aloficocianina (APC; fator de diluição 1:50, concentração 4 μg/mL para uma concentração final de poço de 1:100, concentração 2 μg/mL) e violeta 525 mancha morta viva (fator de diluição 1:50 para uma concentração final de poço de 1:100). Adicionar 50 μL da mistura mestra de coloração à suspensão celular (obtida após bloqueio no ponto 1.5.1) e incubar a placa durante 30 minutos no escuro sobre gelo.
OBS: Para este protocolo, apresentamos a coloração das células com P2RY12. Em primeiro lugar, P2RY12 é um marcador homeostático para microglia que pode ser regulado negativamente em certos contextos de doença. Por exemplo, os ratos modelo de Alzheimer 5XFAD têm níveis de P2RY12 downregulated que podem torná-los difíceis de identificar22. Colorações alternativas que podem ser usadas para o isolamento incluem Tmem119, Cd11b e CD4523. Em segundo lugar, o conjugado fluorocromo APC pode ser ajustado para se adequar ao painel desejado de anticorpos. No entanto, a escolha de um fluorocromo brilhante, como APC ou PE, ajudará a garantir que as populações positivas e negativas sejam facilmente distinguíveis24. - Após a coloração, adicionar 200 μL de tampão FACS diretamente em cada poço para lavar as células. Gire a 500 x g a 4 °C para remover o sobrenadante agitando-se. Ressuspender as células em 200 μL de tampão FACS com uma pipeta P200, girar a 500 x g a 4 °C e agitar a placa para remover o tampão dos poços.
- Preparação dos controlos de fluxo: Antes da coloração, separe os volumes necessários de células de cada amostra após o bloqueio na etapa 1.5.1 para os controlos de fluxo necessários.
NOTA: Controles de fluxo são necessários para cada experimento para estabelecer as comportas. Os controles de fluxo podem ser obtidos de um animal adicional ou de uma fração de cada um dos poços experimentais. Ao dividir células, certifique-se de atribuir células suficientes por controle, pois 10.000-30.000 células por controle são necessárias para estabelecer portas com alta confiança.- Existem três controles de fluxo relevantes: sem mancha, vivo morto e controle do isotipo P2RY12. Para o controle sem manchas, não adicione nenhum anticorpo. No controle do isotipo P2RY12, tratar células com corante de viabilidade (1:100) e um anticorpo controle de isótipo conjugado ao APC (1:100).
- Para preparar o controle morto vivo, alíquota as células em um poço separado e mova metade do volume celular para um tubo de 500 μL. Colocar o tubo de 500 μL no congelador de -80 °C por 5 min, seguido de colocar em incubadora de 37 °C por 5 min para matar as células. Devolver a alíquota de células mortas para o poço de controlo de mortos vivos e corar com um corante de viabilidade de ligação à amina no violeta 525 (factor de diluição 1:100) para marcar as células mortas.
NOTA: O protocolo é escrito para coloração de placa com um método flick para remoção do sobrenadante. No entanto, isso requer que o sobrenadante seja removido imediatamente após a conclusão do giro e o movimento precisa ser feito com força suficiente para remover rapidamente o sobrenadante sem perturbar a pelota. Alternativamente, tubos livres de RNAse/DNase de 1,5 mL podem ser usados para a coloração, com as seguintes modificações: Transferir células para tubo de microcentrífuga de 1,5 mL e pellet a 800 x g por 5 min a 4 °C. Sobrenadante aspirado com pipetas. Dica: Para velocidade, uma pipeta de transferência de 5 mL com uma ponta P200 pode aspirar o sobrenadante de forma rápida e precisa. Ao aspirar, verifique se há a pastilha. Se o pellet não estiver visível, deixe 50 μL de sobrenadante e ajuste os cálculos de acordo. Ao lavar os anticorpos, adicione FACS adicional para aumentar a diluição de anticorpos (1000 μL em vez de 200 μL) para explicar a remoção incompleta do sobrenadante. Dependendo do citômetro, utilizar os tubos de 1,5 mL para triagem, reduzindo a quantidade de insumos necessários.
- Classificação FACS para microglia
- Preparação: Ressuspender cada poço em 200 μL de tampão FACS com uma pipeta P200 e transferir para tubos de classificação de fluxo marcados e adicionar tampão FACS a um total de 500 μL para uma concentração de aproximadamente 5 x 105 eventos por mL. Armazenar no gelo no escuro até a análise. Preparar tubos pós-classificação adicionando 100 μL de tampão FACS como uma almofada para células em tubos livres de RNAse de 1,5 mL.
- Configurações do citômetro: Classifique as células em um classificador de células de citometria de fluxo configurado com o bico de 100 μm. Classifique as células usando 18-20 psi.
- Gating: No citômetro, porta para o tamanho da célula usando a área de dispersão lateral (SSC) versus altura da dispersão direta (FSC) usando o controle sem mancha para ajudar a distinguir detritos, coloque SSC-A em um eixo logarítmico para visualizar uma população celular e porta de perto para selecionar células (porta S1; Gráfico 3). Para remover quaisquer duplos, plote FSC-H vs FSC-W e portão ao redor da população celular removendo quaisquer detritos e duplos (portão S2). Usando o controle do isotipo P2RY12, examine as células no canal APC e ajuste a porta para autofluorescência para determinar as células P2RY12+. Usando os controles sem mancha e mortos vivos, porta para as células que não são fluorescentes no violeta 525 nm como células vivas.
- Classificação: Plotar violeta 525 nm vs APC e determinar a população que é P2RY12+ e viver por FMOs (MG). Classifique essas células no tubo de pós-classificação marcado (Figura 3). A porcentagem de classificação final é de aproximadamente 50% do total de eventos, com a maior parte da perda total de eventos sendo detritos removidos no portão S1 (~70% dos eventos são células; Tabela 1).
- Isolamento e análise de RNA
- Transcrição e inibidores de tradução: Se planejar a extração de RNA, para eliminar o risco de isolamento associado assinaturas transcriptômicas, incluir inibidores de tradução e transcrição nas etapas de tampão. Preparar o coquetel inibidor conforme descrito por Marsh e col. incluindo actinomicina D, anisomicina e triptolídeo25.
- Preparação do inibidor: Reconstituir as existências inibidoras e armazenar da seguinte forma: Reconstituir a actinomicina D em dimetilsulfóxido (DMSO) a 5 mg/ml e armazenar a -20 °C. Reconstituir triptolida em DMSO a 10 mM e conservar a -20 °C, protegido da luz. Reconstituir a anisomicina em DMSO a 10 mg/mL e armazenada a 4 °C, protegida da luz. Conservar todas as existências inibidoras durante um período máximo de 1 mês após a sua reconstituição.
- Modificações no tampão: Adicionar inibidores em quatro tampões diferentes no protocolo da seguinte forma: Ao realizar a perfusão transcárdica, preparar HBSS com actinomicina D (5 μg/mL, 1:1000 do estoque) e triptolide (10 μM, 1:1000 do estoque). Após a perfusão, transportar cérebros para o laboratório em HBSS contendo actinomicina D (5 μg/mL, 1:1000 do estoque), triptolida (10 μM, 1:1000 do estoque) e anisomicina (27,1 μg/mL, 1:368,5 do estoque). Preparar tampão FACS com actinomicina D (5 μg/mL, 1:1000 do estoque), triptolide (10 μM, 1:1000 do estoque) e anisomicina (27,1 μg/mL, 1:368,5 do estoque). Preparar tampão de digestão com actinomicina D (5 μg/mL, 1:1000 do estoque), triptolide (10 μM, 1:1000 do estoque) e anisomicina (27,1 μg/mL, 1:368,5 do estoque). Preparar tampão de lavagem pós-classificação, com HBSS contendo actinomicina D (5 μg/mL, 1:1000 do estoque), triptolide (10 μM, 1:1000 do estoque) e anisomicina (27,1 μg/mL, 1:368,5 do estoque).
NOTA: Ao adicionar os inibidores, certifique-se de adicioná-los imediatamente antes de usar e proteja todos os buffers preparados da luz durante o uso. Evite congelamento-descongelamento de soluções de estoque.
- Lavagens pós-classificação: Como as células foram classificadas em tubos livres de RNase de 1,5 mL em tampão FACS, o que interferirá no isolamento do RNA, é necessário lavar as células. Girar as células a 1000 x g a 4 °C durante 5 min e remover o sobrenadante, deixando aproximadamente 50 μL de líquido.
- Adicionar 200 μL de 1x HBSS contendo actinomicina D (5 μg/mL, 1:1000 do estoque), triptolide (10 μM, 1:1000 do estoque) e anisomicina (27,1 μg/mL, 1:368,5 do estoque) e homogeneizar. Repita o giro e retire o sobrenadante deixando 50 μL de líquido (lavar 1). Adicionar 200 μL de tampão pós-lavagem, misturar bem e repetir o spin e remover o sobrenadante deixando 25 μL de líquido (lavar 2).
- Extração de RNA: Para isolamento de RNA de células microgliais, use um kit de isolamento de RNA de baixa entrada para rendimentos de RNA altos e consistentes e pontuações de RIN acima de 9 (veja abaixo e Tabela de Materiais para recomendações do produto). Ao pellet celular, adicione 350 μL do tampão de lise do kit recomendado + β-mercaptoetanol (1:100) e misture bem.
NOTA: Se necessário, o protocolo pode ser suspenso neste momento. As amostras podem ser armazenadas no tampão de lise a -80 °C até a extração do RNA. Se extrair o RNA após o armazenamento, descongele o lisado no gelo e prossiga com as instruções específicas do kit para o isolamento. - Transfira o lisado para o triturador de células à base de colunas (consulte a Tabela de materiais para recomendações do produto) e centrifuja à velocidade máxima a 4 °C durante 2 minutos. Eluir num mínimo de 14 μL de água isenta de RNase e determinar a concentração conforme adequado. O RNA pode ser usado para qualquer aplicação a jusante após este ponto.
- Transcrição e inibidores de tradução: Se planejar a extração de RNA, para eliminar o risco de isolamento associado assinaturas transcriptômicas, incluir inibidores de tradução e transcrição nas etapas de tampão. Preparar o coquetel inibidor conforme descrito por Marsh e col. incluindo actinomicina D, anisomicina e triptolídeo25.
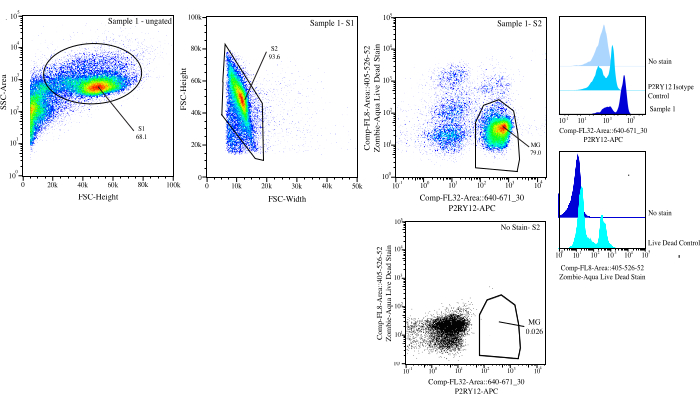
Figura 3: Estratégia de gating para classificação de fluxo. Os eventos são fechados para o tamanho da célula em SSC-A vs FSC-H (S1). Em seguida, as células são fechadas para serem singlets em FSC-H vs FSC-W (S2). As células singletes são classificadas como vivas se negativas em Comp-FL8-A::405-526-52 (violeta 525 cor morta viva) e como P2RY12+ se positivas em Comp-FL32-A::640-671_30 (P2RY12-APC) usando o controle de isotipo P2RY12. As células são rotuladas como MG e classificadas se estiverem vivas e P2RY12+. Clique aqui para ver uma versão maior desta figura.
| CONDOMÍNIO FECHADO | Frequência dos pais | Frequência do Total | Contar |
| E1 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| Ao vivo (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ Live) >S2>S1 | 78.96% | 50.30% | 119794 |
Tabela 1: Exemplo de tabela de linhagem de exemplo com porcentagens de limite e números de eventos esperados.
2. Coloração de fluxo intranuclear para análise da expressão proteica
NOTA: Outros tipos de células podem ser iniciados neste ponto, este protocolo é testado com células cultivadas, incluindo células HEK293, células BV2 microglia-like, e microglia humana derivada de IPSC.
- Fixação e coloração de células
Observação : para o protocolo a seguir, use um kit de coloração intracelular otimizado para coloração nuclear. Ver Tabela de Materiais para recomendações de produtos.- Alíquotas extracelulares coradas células da secção 1.5.2 em placa de 96 poços (5 x 104- 1 x 106 células). Gire as células durante 5 minutos a 500 x g a 4 °C e mexa rapidamente para remover o tampão FACS.
NOTA: Para obter dados com alta confiança dos níveis medianos, um mínimo de 10.000 células por poço deve ser usado. Embora não haja um máximo recomendado, é melhor manter o número de células consistente durante todo o experimento para garantir que não haja efeito significativo de diferentes coeficientes de variações (CV). - Fixação e permeabilização: Adicionar 200 μL de 1x concentrado fixo e misturar suavemente com pipeta P200 para ressuspender as células. Incubar no escuro por 45-60 min. Centrifugar a placa por 5 min a 500 x g à temperatura ambiente (TR) e deslizar para descartar o sobrenadante.
NOTA: Se necessário, o protocolo pode ser suspenso neste momento. Depois de descartar o sobrenadante, ressuspenda as células em tampão de armazenamento de longo prazo para células imunes (consulte a Tabela de Materiais para recomendações de produtos). As amostras podem ser armazenadas a 4 °C por 12-18 h, protegidas da luz e cobertas por filme transparente para proteger a evaporação do tampão. - Adicionar 200 μL de tampão de permeabilização 1x a cada poço e pipetar com um P200 para misturar. Placa de centrifugação por 5 min a 500 x g em RT e deslize para descartar sobrenadante. Repita a lavagem do tampão de permeabilização um total de 3x.
- Preparação de controles de fluxo: Dividir o volume de células de cada amostra para os controles de fluxo necessários (10.000-30.000 células por poço de controle é suficiente).
- Para preparar o controle sem manchas, fixe as células sem manchas do tipo ou alíquota de células não coradas em um poço separado que não receberá nenhum anticorpo.
- Para preparar o controle de fluorescência menos um (FMO), alíquota de células para cada um dos anticorpos no painel, exceto o desse canal.
- Para os canais relevantes, inclua o anticorpo de controle de isótipo no FMO para gating. Por exemplo, em um painel contendo P2RY12-APC e H3K27Ac-AlexaFluor568 - deve haver dois FMOS: (1) o APC-FMO que contém apenas H3K27Ac-AlexaFluor568 e o anticorpo de controle do isotipo P2RY12 e (2) o 568-FMO que contém apenas P2RY12-APC e o controle de isótipo primário e 568 secundário.
NOTA: Este protocolo é apresentado para testar uma única HPTM, no entanto podem ser estabelecidos painéis que contêm muitas HPTMs conjugadas a diferentes fluoróforos.
- Coloração primária de anticorpos: Adicionar 50 μL de tampão de permeabilização 1x com a concentração apropriada de anticorpo primário para cada poço. Incubar por 30 min no TR no escuro. Lavar 2x com 200 μL de tampão de permeabilização 1x.
NOTA: A concentração de anticorpos utilizados para cada HPTM está incluída na Tabela de Materiais. A concentração é determinada testando diferentes concentrações dos anticorpos em células cultivadas tratadas com um estimulante que causaria um aumento dramático, por exemplo, um inibidor de HDAC para marcas de acetilação e garantindo que as células não tratadas e tratadas estivessem bem dentro da faixa de detecção (acima do controle de isotipo e abaixo da faixa máxima de detecção do citômetro). A concentração ótima de anticorpos para HPTMs deve ter uma intensidade fluorescente mediana média média no canal do fluoróforo entre 5 x 104 e 1 x 105. - Coloração secundária de anticorpos: Bloquear com 200 μL de tampão de permeabilização 1x com soro de burro normal (NDS) a 2% por 10 min na RT. Girar por 5 min a 500 x g na RT e deslizar para remover o sobrenadante.
- Adicionar 50 μL de tampão de permeabilização 1x com NDS a 2% e a concentração adequada de anticorpo secundário e incubar por 30 min em TR no escuro. Adicionar 200 μL de tampão de permeabilização 1x aos poços para diluir, centrifugar a placa por 5 min a 500 x g em RT e deslizar para descartar o sobrenadante. Lavar as células 2x com 200 μL de tampão de permeabilização 1x.
Observação : se necessário, suspenda o protocolo neste ponto. Ressuspender as células em 200 μL de tampão de armazenamento a longo prazo para células imunitárias com pipeta P200 (ver Tabela de Materiais para recomendações) e conservar a 4 °C durante 12-24 h protegidas da luz. - Preparação para citometria de fluxo: Placa centrífuga por 5 min a 500 x g no RT e movimento para descartar sobrenadante. Ressuspender as células em 200 μL de tampão FACS usando uma pipeta P200 para citometria de fluxo. Selo com filme transparente para transporte até o citômetro.
- Alíquotas extracelulares coradas células da secção 1.5.2 em placa de 96 poços (5 x 104- 1 x 106 células). Gire as células durante 5 minutos a 500 x g a 4 °C e mexa rapidamente para remover o tampão FACS.
- Citometria de fluxo
- Para analisar o painel de anticorpos proposto, certifique-se de que o citômetro esteja equipado com pelo menos quatro lasers, incluindo violeta (405 nm), azul (488 nm), amarela (561 nm) e vermelha (633 nm). O citômetro precisa de filtros para detectar FITC (azul-525 nm), KRO (violeta-525 nm), PE (amarelo-585 nm) e APC (vermelho-660 nm). Adicione anticorpos adicionais dependendo do citômetro escolhido.
- Calibração e padronização: No início de cada experimento, execute contas fluorescentes arco-íris e ajuste a tensão do tubo fotomultiplicador (PMT) até que os picos do cordão sejam comparáveis aos valores-alvo executados para experimentos anteriores. Este método de padronização permite a acomodação da deriva do equipamento ao longo do tempo.
- Compensação: Após a voltagem e o ganho de PMT terem sido definidos para o experimento, utilizar esferas de compensação capturadas por anticorpos para estabelecer a matriz de compensação para o painel de anticorpos. Este cálculo garantirá que os fluoróforos não estejam contribuindo para as mudanças de sinal em outros canais. Isso é cada vez mais necessário ao multiplexar múltiplos anticorpos.
- Limite de tamanho: Em um gráfico de pontos, plote SSC-A em log vs FSC-H em linear. Remova os detritos e selecione o tamanho da célula usando o portão S1. Selecione para células singlet em um gráfico de pontos de FSC-W vs FSC-H e porta como S2. (Figura 4).
- Estabelecimento de portões de fluoróforo: Usando o FMO relevante para cada canal de fluoróforo, estabeleça as comportas para determinar o que é um sinal positivo em cada canal usando histogramas de parâmetro único (Figura 4).
- Medição das amostras: Registre cuidadosamente as amostras usando a estratégia de fechamento estabelecida. Identificar a microglia usando o sinal P2RY12+, determinar a expressão da proteína nos respectivos canais apenas para a micróglia.
- Análise dos dados de citometria de fluxo
- Estabelecendo portas de análise: Usando as etapas acima para o citômetro na interface do usuário do software de análise, use as mesmas portas usadas para gravação para análise.
- Obter valores de IFM usando o software de análise de citometria de fluxo (consulte Tabela de Materiais para recomendações): Recapitule a estratégia de fechamento do citômetro para análise de fluxo. Usando a função adicionar estatísticas, selecione mediana para a população de interesse (por exemplo, 568+) na altura do canal compensado. Usando o editor de tabelas, exporte os valores medianos de intensidade fluorescente (MFI) dos respectivos canais para uma planilha para prosseguir com a análise estatística (Tabela 2).
Observação : arquivo suplementar S1 inclui dados de exemplo de lipopolissacarídeo (LPS) e solução salina tamponada com fosfato (PBS) injetado e um arquivo de análise de exemplo com a estratégia de gating e valores de MFI. - Analisando os valores de IFM para alteração da dobra proteica: Após a obtenção dos valores de IFM, calcule a variação da dobra da MFI em relação à população controle ou não tratada (Equação 1). A mudança da dobra da MFI é reflexo da mudança da dobra nos níveis de proteína. Usando os valores de mudança de dobra, avaliar a mudança na expressão e calcular a significância estatística usando um teste t ou ANOVA.
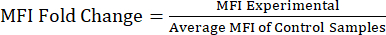 Equação 1
Equação 1
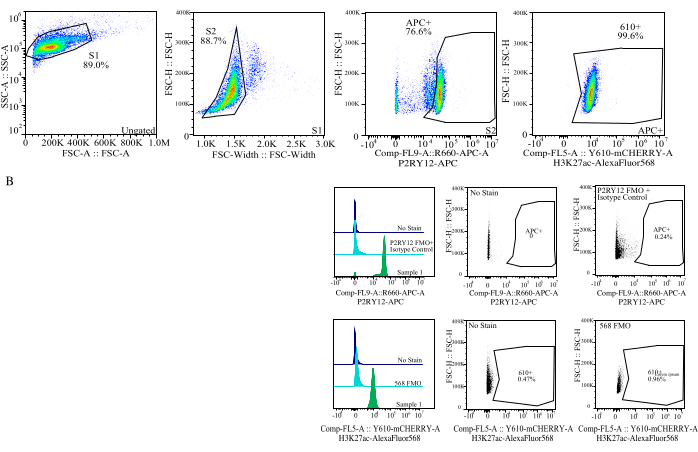
Figura 4: Estratégia de gating para avaliação de IFM de proteínas. Os eventos são fechados primeiro para o tamanho da célula em SSC-A vs FSC-H (S1). As células são então fechadas para singlets em FSC-H vs FSC-W (S2). As células singletes são então identificadas como microglia pelo sinal P2RY12-APC (APC+) com a porta estabelecida com base na fluorescência em um controle APC-FMO que contém um anticorpo de controle isotípico. As células são então fechadas para o sinal H3K27Ac-AlexaFluor568 no Comp-FL5-A::Y610-mCherry. A intensidade fluorescente das células 610+ é determinada como proxy para a expressão de proteínas. Clique aqui para ver uma versão maior desta figura.
Resultados
Camundongos adultos foram perfundidos transcardialmente e sacrificados para isolamento da micróglia. Microglias foram isoladas no gelo e coradas com P2RY12-APC e violeta 525 anticorpos mortos vivos. As células que foram determinadas como positivas para P2RY12 e negativas para violeta 525 vivas mortas foram classificadas como micróglia viva. O rendimento médio de microglia de um cérebro dissecado de camundongo foi de 1,28 x 105 ± 0,05 (média ± erro padrão da média (EPM), N=100). Não há diferença no rendimento da micróglia em camundongos fêmeas (1,25 x 105 ± 0,09 [média ± EPM, N=46]) e machos (1,32 x10 5 ± 0,07 [média ± EPM, N=54]) (t(98)=0,6365, p=0,526). Ao isolar de regiões específicas do cérebro, o rendimento médio da micróglia de córtices de camundongos é de 8,3 x 104 ± 0,08 (média ± EPM, N=15) e do hipocampo de camundongos é de 4,1 x 104 ± 0,02 (média ± EPM, N=16). Como esperado, há uma diferença significativa no rendimento da microglia de cada região cerebral (F(2, 128)=25,25, P<0,0001). Após o isolamento da micróglia, o RNA foi extraído das células isoladas usando um kit de isolamento de RNA de baixa entrada. Consistentemente, o escore de integridade do RNA (NIR) foi acima de 9,0 (9,62 ± 0,05) e o rendimento médio de RNA por célula foi de 0,25 ± 0,01 pg (média ± EPM, N=32; Arquivo Suplementar S2).
Camundongos adultos foram injetados intraperitonealmente com 1 mg/kg de lipopolissacarídeo (LPS) 24 h antes do sacrifício. Os camundongos foram perfundidos transcardialmente com HBSS e a microglia isolada de todo o encéfalo de acordo com o protocolo descrito (Figura 5A). Para cada coloração, 20.000-30.000 células foram alocadas para cada painel de anticorpos. Os níveis globais de acetilação da lisina 27 da histona 3 (H3K27Ac) foram avaliados em micróglias isoladas por citometria de fluxo. Para camundongos machos e fêmeas, o tratamento com LPS induziu aumento de H3K27Ac quando o MFI é normalizado dentro do sexo (t(6)=9,676, p<0,0001; Figura 5B). Ao examinar os histogramas para as células coradas, as populações permanecem normalmente distribuídas com variação semelhante; no entanto, as células deslocaram-se para fluorescência aumentada, resultando no aumento do IFM (Figura 5C). Ao examinar H3K9Ac no mesmo tratamento, há um aumento semelhante em H3K9Ac (t(6)=7,299, p=0,0003; Figura 5D,E) no entanto, a mudança de dobra do LPS em relação ao PBS do sinal H3K9Ac é menor que o sinal H3K27Ac.
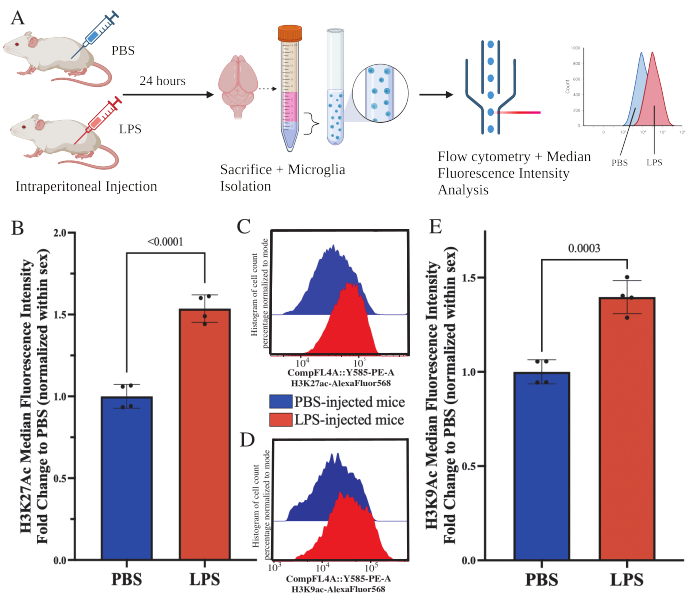
Figura 5: Alterações globais na acetilação de histonas em micróglias isoladas. (A) Os camundongos são injetados intraperitonealmente com solução salina tamponada com fosfato (PBS) ou lipopolissacarídeo (LPS) 1 mg/kg 24 h antes do sacrifício. As microglias são coletadas da fração enriquecida imune e fixadas para citometria de fluxo e avaliação pós-modificação pós-traducional de histonas. A intensidade fluorescente mediana é avaliada como proxy da expressão proteica. Criado com BioRender.com. (B) Os níveis globais de H3K27Ac aumentaram em resposta ao tratamento com LPS. Mudança de dobra para PBS normalizada dentro do experimento e sexo. Teste t bicaudal não pareado, t(6)=9,676, p<0,0001. O gráfico de barras mostra a média ± EPM. N=8 animais; 2 por condição em 2 experimentos independentes. (C) Exemplo de histogramas que mostram o desvio da intensidade fluorescente de H3K27Ac. Modal descreve histogramas de camundongos injetados com PBS versus LPS. (D) Exemplo de histogramas que mostram o desvio da intensidade fluorescente de H3K9Ac. Modal descreve histogramas de camundongos injetados com PBS versus LPS. (E) Os níveis globais de H3K9Ac aumentaram em resposta ao tratamento com LPS. Mudança de dobra para PBS normalizada dentro do experimento e sexo. Teste t bicaudal não pareado, t(6)=7,299, p=0,0003. O gráfico de barras mostra a média ± EPM. N=8 animais; 2 por condição em 2 experimentos independentes. Clique aqui para ver uma versão maior desta figura.
Para confirmar que o método descrito era comparável a outros métodos previamente utilizados para quantificação global de modificação de histonas, nosso objetivo foi usar o immunoblot como ferramenta comparativa. No entanto, o rendimento da micróglia isolada é simplesmente demasiado baixo para permitir uma avaliação razoável. Portanto, usamos células BV2 cultivadas para comparar o método de citometria de fluxo intracelular com um Western blot (WB). As células BV2 foram cultivadas em meio completo (DMEMF12, 10% FBS, 1x penicilina/estreptamicina e 1x L-glutamina) a 37 °C, 5% CO2. As células foram passadas com tripsina-EDTA a 0,25% e plaqueadas a uma densidade de 250.000 células/poço e tratadas em meios séricos reduzidos (DMEM F12, 2% FBS, 1x penicilina/estreptamicina e 1x L-glutamina) e deixadas recuperar por 12 h a 37 °C, 5% CO2. As células foram tratadas com 25 ng/mL de LPS por 24 h antes da fixação, como descrito acima, ou lise com um tampão de lise WB. O sinal de H3K27Ac foi realizado por ambos os métodos, sendo o GAPDH utilizado como controle de carga para WB. A análise da intensidade fluorescente normalizada em relação ao controle PBS foi determinada para cada grupo (Figura 6A). Ao examinar a mudança no sinal H3K27Ac normalizado pelo WB, houve um aumento de 1,527 vezes na condição tratada com LPS em relação ao controle H2O, que foi determinado como significativo pelo teste t não pareado (t=3,024, df=5; p=0,0293). Ao examinar a alteração por citometria de fluxo, houve um aumento de 1,482 vezes na condição tratada com LPS, que foi determinado como significativo (t=7,843, df=10; p<0,0001). Usando uma ANOVA de 2 vias para comparar os métodos, determinou-se que houve um efeito significativo do tratamento (F(1,15)=45,21,p<0,0001), mas não do método (F(1,15)=0,05545, p=0,8697) ou interação (F(1,15)=0,02785, p=0,8697). Além disso, verificamos aqui que não há alteração nos níveis de histona H3 tanto pelo Western blot quanto pela citometria de fluxo, pois a ANOVA de 2 vias não revelou efeito significativo do tratamento com LPS (F(1,7)=0,02170,p=0,8870), do método (F(1,7)=0,01191, p=0,9162) ou da interação (F(1,7=0,01191, p=0,9162; Figura 6B). Exemplos de manchas e deslocamentos de histograma para esses dados também são mostrados (Figura 6C,D).
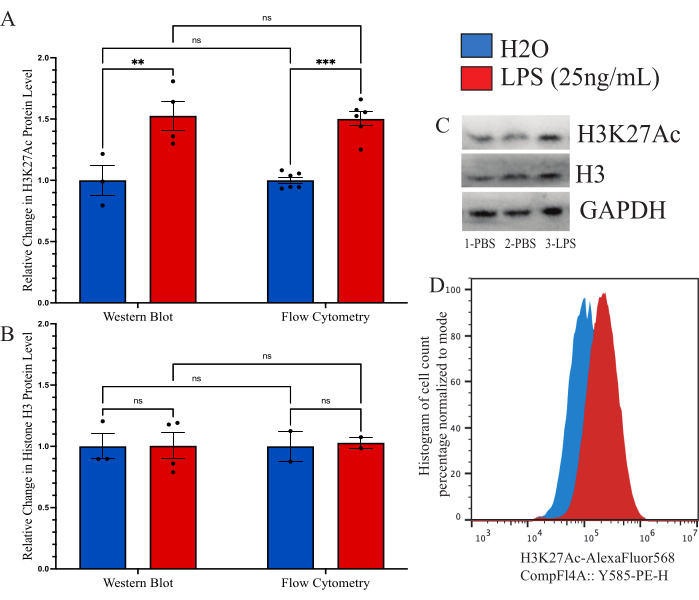
Figura 6: Comparação de métodos para quantificação da mudança global de modificação de histonas entre citometria de fluxo e western blot. (A) As células BV2 são tratadas com 25 ng/mL de lipopolissacarídeo (LPS) ou H2O por 24 h antes da análise. A intensidade fluorescente de H3K27Ac é descrita como mudança de dobra para o veículo controle, solução salina tamponada com fosfato (PBS), tanto para citometria de fluxo quanto para western blot. A ANOVA de 2 vias revelou efeito significativo do tratamento com LPS (F(1,15)=45,21, p<0,0001), mas não do método (F(1,15)=0,05545, p=0,8697) ou interação (F(1,15)=0,02785, p=0,8697). A correção de Tukey para testes de hipóteses múltiplas foi aplicada para os resíduos. * apresenta 0,0332, ** apresenta 0,0021. (B) A intensidade fluorescente para a histona H3 é descrita como mudança de dobra para PBS tanto para citometria de fluxo quanto para western blot. A ANOVA de 2 vias não revelou efeito significativo do tratamento com LPS (F(1,7)=0,02170, p=0,8870) ou do método (F(1,7)=0,01191, p=0,9162) ou da interação (F(1,7=0,01191, p=0,9162). (C) Exemplos de coágulos e (D) deslocamentos de citometria de fluxo são retratados. O tamanho do histograma é normalizado para porcentagem com base no número de células presentes na intensidade fluorescente do modo. O gráfico de barras mostra a média de EPM.n=2 experimentos independentes, 2 por condição por experimento. Clique aqui para ver uma versão maior desta figura.
Em conjunto, esses resultados mostram que esta técnica pode ser usada para avaliar quantitativamente os níveis globais de HPTM em micróglias isoladas. Além disso, o método mostrou-se comparável às técnicas anteriores, mas exigindo entradas celulares muito menores. Além disso, enquanto não demonstrada, com a devida compensação, a presente técnica pode ser utilizada com múltiplos anticorpos no mesmo painel avaliando diferentes HPTMs.
Arquivo suplementar S1: arquivos de análise de exemplo. Este arquivo contém um arquivo de análise wsp e 7 arquivos fcs, incluindo o sem mancha, P2RY12FMO, 568FMO, dois animais tratados com PBS e dois animais tratados com LPS corados com H3K27Ac. O objetivo deste arquivo é demonstrar a análise e o fechamento de um experimento que poderia retratar como foi um experimento bem-sucedido. Clique aqui para baixar este arquivo.
Arquivo suplementar S2: Dados de isolamento. O arquivo incluído contém os dados relevantes pós-classificação da micróglia que contém o rendimento da micróglia e do RNA do protocolo descrito. Clique aqui para baixar este arquivo.
| CONDOMÍNIO FECHADO | Frequência dos pais | Frequência do Total | Contar |
| E1 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
Tabela 2: Exemplo de gráfico de linhagem de amostra mostra números de porcentagem e eventos necessários para a detecção precisa de proteínas.
Discussão
O protocolo apresentado permite a avaliação quantitativa dos níveis globais de HPTM por citometria de fluxo. Embora este protocolo apresente um novo método, estudos anteriores fizeram avaliação quantitativa de proteínas usando uma abordagem semelhante26. Métodos prévios utilizados para avaliar os níveis globais de HPTMs incluem imunohistoquímica e western blot 16,17,19,20. O método baseado em citometria de fluxo apresentado é um método facilmente quantificável, enquanto o western blot e a imunohistoquímica são semiquantitativos e apresentam menor rendimento. O Western blot depende da lise celular e, portanto, requer tanto a normalização da proteína quanto uma proteína de controle de carga que é assumida como inalterada pela condição experimental27. A imuno-histoquímica é semiquantitativa e de baixíssimo rendimento, pois é difícil avaliar quantitativamente a quantidade de proteína sem examinar em nível de célula única16. Da mesma forma, para a micróglia isolada, há um benefício no uso do método de citometria de fluxo devido ao rendimento limitado, uma vez que o western blot requer uma entrada proteica muito maior19. Os requisitos de baixo número de células permitem que vários painéis de coloração sejam executados a partir do mesmo animal.
No entanto, como em qualquer outro método, há limitações para essa técnica, incluindo custo e disponibilidade de anticorpos, já que nem todos os anticorpos funcionam bem em um cenário de citometria de fluxo. Além disso, em comparação com o immunoblot, a concentração de anticorpos necessária é muito maior. Enquanto a multiplexação permite que vários anticorpos sejam usados no mesmo painel de células, as células não podem ser destituídas do anticorpo após a análise, limitando assim o uso celular a um por espécie de anticorpo. Isso é diferente do immunoblot, em que o mesmo blot pode ser usado repetidamente. No entanto, dependendo da disponibilidade de anticorpos e do número de canais de detecção em um citômetro, seria possível examinar até uma dúzia de marcas simultaneamente.
O método atual captura apenas os níveis globais de expressão proteica e não a localização genômica específica, e mudanças nos níveis globais podem não refletir mudanças nos loci genômicos individuais. Da mesma forma, a falta de mudança nos níveis globais pode não significar que nenhum loci genômico está passando por mudanças, simplesmente que as mudanças globais não somam diferenças entre os tratamentos. Como tal, esta técnica destina-se a ser usada como uma tela para identificar HPTMs de interesse para análise genômica. Além disso, este método não permite a comparação entre diferentes marcas de proteínas, exceto quando avaliado como uma mudança de dobra para controle. Portanto, isso é limitado em comparação com um método padrão baseado em curvas, como o ELISA, para determinação de proteínas.
O protocolo apresentado oferece uma estratégia para isolar a micróglia cerebral viva. Este protocolo baseia-se na expressão da proteína P2RY12 para o isolamento da micróglia. No entanto, o P2RY12 é um marcador homeostático na micróglia e pode ser regulado negativamente em modelos de doenças, como o 5XFAD22. Portanto, ao utilizar um animal modelo de doença, certifique-se de escolher outras proteínas marcadoras, como TMEM119, CD11b ou CD45, para auxiliar no isolamento da micróglia23. Da mesma forma, apresentamos este protocolo como isolamento do hipocampo e/ou córtex. Este protocolo funcionaria para isolar a micróglia de outras regiões do cérebro, incluindo regiões da substância branca, no entanto, vários animais podem ser necessários para obter microglia suficiente, dependendo do tamanho das regiões de interesse.
O protocolo apresentado pode isolar de forma robusta a microglia cerebral viva, mas existem várias etapas, descritas a seguir, na fase de isolamento que podem diminuir o rendimento celular se realizadas de forma incorreta.
As perfusões para este protocolo resultam em uma maior porcentagem de micróglia no fragmento enriquecido imune, o que reduzirá a quantidade de tempo no classificador. No entanto, a perfusão não é necessária, e outros métodos de eutanásia podem ser usados, se necessário.
Durante o isolamento da micróglia, a mielina deve ser completamente removida. Os citômetros de fluxo dependem que as células sejam capazes de viajar através de tubos estreitos em um ritmo rápido. Devido à sua viscosidade e tendência à aglomeração, a mielina causa problemas com citômetros, muitas vezes causando entupimentos que podem danificar o equipamento e destruir a amostra, reduzindo drasticamente o rendimento. Tenha cuidado para remover toda a mielina durante a coleta de fragmentos enriquecidos imunologicamente para evitar ter problemas a jusante.
Coloração de placa versus coloração de tubo: Neste protocolo, descrevemos duas opções para coloração de células em tubos de 1,5 mL ou em uma placa de 96 poços. O caso de uso para cada um depende do experimento; no entanto, geralmente a coloração do tubo é menor risco de afetar o rendimento do que a coloração da placa, pois o flick corre o risco de perda de células se feito incorretamente. A coloração da placa é muito mais rápida, pois a aspiração do sobrenadante para cada tubo é demorada. Antes da fixação (para triagem, etc.), use coloração de tubo para maximizar o rendimento e reduzir o risco de perda. No entanto, para a análise por HPTM, uma vez que as células são fixadas para coloração intranuclear, o pellet é mais estável, e há risco reduzido de perda com a cintilação.
Estabelecer o gradiente de densidade descontínuo: Ao estabelecer as camadas, a configuração adequada das camadas é essencial para obter a fração imunoenriquecida. Se as camadas forem perturbadas ou misturadas e parecerem turvas, as células não se classificarão para o local desejado e haverá dificuldade em obter a fração celular imunoenriquecida. Se isso ocorrer, gire com o meio de densidade para remover a mielina e, em seguida, colete todas as frações restantes, dilua com 3 mL de tampão FACS para 1 mL de meio de densidade e misture bem (isso exigirá vários tubos). Gire a 500 x g por 10 min com o freio ligado em 0. Descarte o sobrenadante, deixando apenas ~300 μL de solução. Coletar toda a amostra e manchar. Isso resultará em porcentagens de classificação reduzidas e uma quantidade maior de tempo gasto no citômetro, mas o rendimento ainda pode ser comparável.
Ao usar o método de isolamento, é benéfico ser capaz de coletar células para RNA e para avaliação de HPTM do mesmo cérebro de camundongo. Nessa situação, após a classificação da micróglia viva, as células podem ser divididas para alocar uma porção para avaliação de RNA (número mínimo de entrada de células para obter um rendimento de RNA decente é de 75.000 células) e uma porção para análise de citometria de fluxo adicional (mínimo de 10.000 células por poço para boa determinação de MFI). Nesse caso, a triagem por citômetro de fluxo é necessária. No entanto, ao planejar apenas o uso das células para análise de HPTM, a classificação não é necessária, e a fração imune pode ser corada com o anticorpo P2RY12 e o anticorpo HPTM. O acoplamento no citômetro pode então ser ajustado para a microglia P2RY12+, como seria feito para a classificação de fluxo, para analisar apenas o sinal de HPTM dentro da micróglia. A eliminação da classificação permite que o protocolo seja mais rápido e econômico. Além disso, se avaliarmos HPTMs a partir de células cultivadas, iniciar o protocolo de coloração é suficiente e nenhum tipo de anticorpos marcadores celulares é necessário, como demonstrado na Figura 6. O protocolo de avaliação HPTM pode ser usado para muitos tipos celulares, incluindo células cultivadas, primárias e derivadas de IPSC.
Finalmente, embora tenhamos apresentado apenas dois usos potenciais da microglia a jusante do isolamento, existem muitos outros, incluindo técnicas epigenéticas como ChIP, CUT&Tag e CUT&RUN. No caso de técnicas epigenéticas genômicas, em que caracterizar alterações em loci específicos é de interesse, escolha inibidores específicos para escritores e borrachas de marcas de cromatina11 adaptados aos experimentos para garantir que quaisquer modificações epigenéticas microgliais perfiladas não sejam artefatos técnicos de quaisquer etapas do procedimento de isolamento, como a digestão enzimática. Ao avaliar mudanças nos níveis globais de marcas epigenéticas, como por citometria de fluxo quantitativa, não se espera que quaisquer alterações induzidas pelo procedimento sejam tão grandes a ponto de serem detectadas em nível global.
Em geral, os métodos discutidos fornecem um novo método de célula única para quantificar os níveis globais de modificações de histonas e outras alterações epigenéticas por citometria de fluxo. Nós demonstramos que este método é suficientemente sensível para detectar mudanças globais no marcador intensificador H3K27ac em micróglia em resposta ao LPS in vivo. Isso é consistente com o sequenciamento prévio de ChIP de H3K27ac após estimulação com LPS mostrando remodelamento dramático de intensificadores responsivos ao LPS28. As aplicações deste método permitirão examinar as alterações epigenéticas globais em diferentes tipos de células cerebrais em desenvolvimento e doença.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Obrigado a Yanyang Bai por ajudar com o immunoblot na Figura 5. Este trabalho foi apoiado pelo Canadian Institutes for Health Research [CRC-RS 950-232402 to AC]; Conselho de Pesquisa em Ciências Naturais e Engenharia do Canadá [RGPIN-2019-04450, DGECR-2019-00069 para AC]; Scottish Rite Charitable Foundation [21103 para AC] e a Brain Canada Foundation [AWD-023132 para AC]; University of British Columbia Aboriginal Graduate Fellowship (6481 para MT); British Columbia Graduate Scholarship (6768 para MT); Prêmio Acadêmico Estudantil da Plataforma Aberta de Neurociência Canadense (10901 para JK); Bolsa de Doutorado de quatro anos da Universidade da Colúmbia Britânica (6569 para JK). Os financiadores não tiveram nenhum papel no desenho do estudo, coleta e análise de dados, decisão de publicação ou preparação do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Referências
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados