Method Article
Cuantificación de las modificaciones postraduccionales globales de histonas mediante citometría de flujo intranuclear en microglía cerebral de ratón aislada
En este artículo
Resumen
En este trabajo se describe un protocolo para la cuantificación de modificaciones globales de histonas mediante citometría de flujo intranuclear en microglía cerebral aislada. El trabajo también contiene el protocolo de aislamiento de microglía que se utilizó para la recolección de datos.
Resumen
El control de la expresión génica se produce parcialmente por modificaciones en la estructura de la cromatina, incluida la adición y eliminación de modificaciones postraduccionales en las colas de histonas. Las modificaciones postraduccionales de histonas (HPTM) pueden facilitar la expresión génica o la represión. Por ejemplo, la acetilación de los residuos de lisina de la cola de histonas neutraliza la carga positiva y reduce las interacciones entre la cola y el ADN cargado negativamente. La disminución de las interacciones entre la cola de las histonas y el ADN da como resultado una mayor accesibilidad del ADN subyacente, lo que permite un mayor acceso al factor de transcripción. La marca de acetilación también sirve como un sitio de reconocimiento para los activadores transcripcionales que contienen bromodominios, lo que en conjunto da como resultado una mayor expresión génica. Las marcas de histonas pueden regularse dinámicamente durante la diferenciación celular y en respuesta a diferentes entornos y estímulos celulares. Si bien los enfoques de secuenciación de próxima generación han comenzado a caracterizar las ubicaciones genómicas para las modificaciones de histonas individuales, solo se puede examinar una modificación al mismo tiempo. Dado que hay cientos de HPTM diferentes, hemos desarrollado una medida cuantitativa de alto rendimiento de HPTM globales que se puede utilizar para detectar modificaciones de histonas antes de realizar enfoques de secuenciación genómica más extensos. Este protocolo describe un método basado en citometría de flujo para detectar HPTM globales y se puede realizar utilizando células en cultivo o células aisladas de tejidos in vivo . Presentamos datos de ejemplo de microglía cerebral de ratón aislada para demostrar la sensibilidad del ensayo para detectar cambios globales en HPTM en respuesta a un estímulo inmunológico derivado de bacterias (lipopolisacárido). Este protocolo permite la evaluación rápida y cuantitativa de HPTMs y se puede aplicar a cualquier regulador transcripcional o epigenético que pueda ser detectado por un anticuerpo.
Introducción
La epigenética es el estudio de los mecanismos que regulan la expresión génica sin alterar la secuencia de ADN subyacente. La regulación epigenética de la expresión génica es dinámica dentro de las células y puede permitir respuestas rápidas y coordinadas a diversos estímulos ambientales. La regulación dinámica ocurre en parte debido a cambios en la estructura de la cromatina a nivel del nucleosoma, que está compuesto por proteínas histonas (H2A, H2B, H3, H4) ensambladas en un núcleo octámero fuertemente enrollado por el ADN1. Las interacciones entre las proteínas histonas y el ADN pueden controlar la accesibilidad del ADN a la maquinaria de transcripción, que en última instancia puede controlar la expresión génica y otros aspectos de la biología de la cromatina. Las proteínas histonas tienen colas desestructuradas que presentan residuos cargados positivamente que forman interacciones electrostáticas con la columna vertebral del ADN cargada negativamente. Estas interacciones dan como resultado un empaquetamiento apretado del ADN y una menor accesibilidad al ADN. Las modificaciones covalentes de las colas de histonas, denominadas modificaciones postraduccionales de histonas (HPTM), pueden regular estas interacciones 3,4. Algunos de los HPTM mejor caracterizados incluyen la acetilación y la metilación de la cola de histonas, que pueden cambiar la afinidad de las interacciones electrostáticas entre las colas de histonas y el ADN, lo que resulta en una accesibilidad diferencial al ADN subyacente y al reclutamiento de factores de transcripción que reconocen estos HPTM en sitios específicos. Los HPTM están regulados por tres clases importantes de enzimas denominadas lectores, que reconocen, escritores, que depositan, y borradores, que eliminan los HPTM. Por lo tanto, el reclutamiento o la disolución de las enzimas lectoras, escritoras o borradoras pueden, en última instancia, cambiar el panorama de las HPTM y gobernar la estructura y función de la cromatina, lo que hace que su regulación y lectura sean esenciales para comprender la biología celular y su función 3,4.
Las células del sistema nervioso central (SNC) son epigenéticamente flexibles, ya que cambian su transcriptoma para adaptarse a los estímulos ambientales. La evidencia acumulada sugiere que los cambios en el epigenoma, como la metilación del ADN, los ARN no codificantes y los HPTM, juegan un papel esencial en la formación de la memoria y la función sináptica5. La interrupción de la dinámica de HPTM a través de la manipulación de los lectores, escritores o borradores relevantes puede bloquear o mejorar el aprendizaje asociativo y la potenciación a largo plazo 6,7,8. La microglía, la célula inmunitaria residente del SNC, regula rápidamente su transcriptoma en respuesta a la estimulación inmunitaria a través de cambios dinámicos en su epigenoma 9,10,11. Este alto nivel de adaptación a su entorno cerebral local hace que sean difíciles de examinar en un contexto aislado, ya que los estudios han demostrado que el epigenoma y el transcriptoma de la microglía se alteran después de unas pocas horas en los medios de cultivo después de la eliminación del entorno cerebral11. Además, dado que la microglía solo constituye el 10% de las células cerebrales, las medidas que examinan los cambios a nivel de todo el tejido carecen de sensibilidad y especificidad12,13. Como resultado, la microglía debe aislarse rápidamente para examinar los cambios epigenéticos, como los niveles de HPTM, ex vivo.
Los métodos comúnmente utilizados para examinar las HPTM incluyen la secuenciación de inmunoprecipitación de cromatina (ChIP-seq) y la escisión bajo objetivos y la secuenciación de marcaje (CUT&Tag-seq)4. Si bien estas técnicas son altamente específicas para un HPTM individual y pueden informar la presencia de HPTM dentro de un contexto genómico específico, solo pueden examinar uno de los muchos HPTM posibles dentro de un solo experimento 11,14 Por lo tanto, antes de proceder con tales experimentos, que requieren una inversión significativa de tiempo y dinero, es muy valioso reducir la lista de HPTM potencialmente interesantes para una mayor investigación, examinando primero los cambios en el mercado global. niveles de HPTM. Los dos enfoques principales para examinar los niveles globales de HPTM son la inmunohistoquímica y el análisis de Western blot, pero ambos enfoques son solo semicuantitativos, de bajo rendimiento y requieren un gran número de secciones de tejido o células aisladas15,16. Por lo tanto, nuestro objetivo era desarrollar un método cuantitativo altamente sensible que pudiera utilizarse para examinar los niveles globales de HPTM rápidamente y a nivel de célula única.
El protocolo presentado permite la detección rápida de los niveles globales de HPTM mediante citometría de flujo intranuclear. Estudios previos en células cancerosas han justificado la importancia de examinar los niveles globales desde una perspectiva clínica17,18. También es común que los estudios utilicen niveles globales como método de cribado previo a la evaluación de la localización genómica de HPTM específicas de interés19,20. En el caso de la microglía, la evaluación de los niveles globales después del aislamiento es un reto debido al bajo rendimiento celular; Pan et al presentan niveles globales de HPTM a partir de microglía aislada, en la que se agrupó la microglía de tres animales para permitir la detección del nivel de proteínas mediante Western blot19. Utilizando nuestro protocolo, somos capaces de detectar cambios globales con entradas celulares mucho más bajas, lo que permite el cribado de múltiples marcas por animal y elimina la necesidad de agrupar muestras.
Aquí, describimos un protocolo para detectar rápidamente los niveles de HPTM a través de citometría de flujo intranuclear cuantitativa en microglía aislada. Si bien nos enfocamos específicamente en la cuantificación de HPTM en aras de la brevedad, este protocolo se puede usar de la misma manera para cuantificar los niveles globales de enzimas lectoras, escritoras y borradoras. El protocolo se entrega en dos partes: en primer lugar, el método de aislamiento de la microglía y, en segundo lugar, el método basado en citometría de flujo para determinar los niveles de HPTM. El método de aislamiento produce células que se pueden utilizar tanto para el aislamiento de ARN como para la evaluación del nivel de HPTM, lo que permite evaluar la expresión génica y los niveles de HPTM de la misma muestra. Además, el método para la evaluación de HPTM se puede utilizar en otros tipos de células, tal y como se indica en el protocolo.
Protocolo
Todos los protocolos de cuidado animal fueron aprobados por el Comité de Cuidado Animal de la Universidad de Columbia Británica de acuerdo con las pautas del Consejo Canadiense de Cuidado Animal.
1. Digestión cerebral para el aislamiento de la microglía
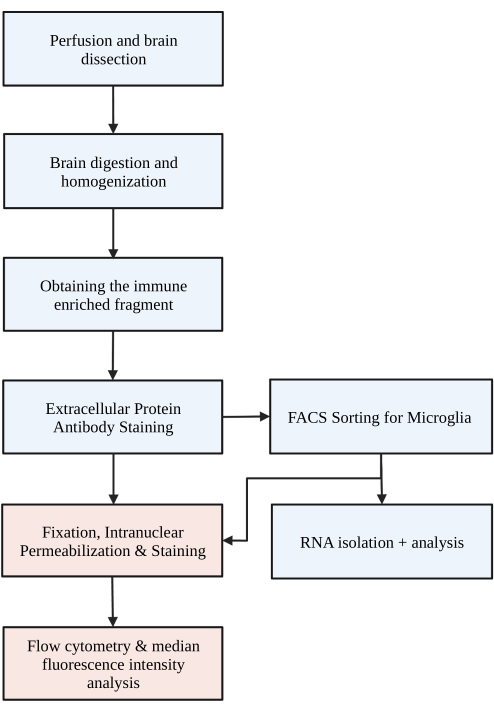
Figura 1: Diagrama de flujo simple del protocolo. En primer lugar, los ratones se perfunden transcardíacamente con HBSS y se disecciona el cerebro. Luego, el cerebro se disocia a través de la digestión química y la disrupción mecánica para dar como resultado un homogeneizado de una sola célula. La fracción inmunoenriquecida se recolecta a través de un gradiente de densidad discontinuo, después de lo cual las células se tiñen para P2RY12. Las células teñidas se clasifican 1) mediante clasificación de células activadas fluorescentes (FACS) para realizar análisis de ARN o análisis de proteínas posteriores y/o 2) se fijan, permeabilizan y tiñen para proteínas intranucleares. El nivel de proteína se cuantifica mediante la mediana de la intensidad de fluorescencia en el canal de interés determinada por citometría de flujo. Las cajas de color azul son parte del paso 1 del protocolo: Digestión cerebral para el aislamiento de la microglía. Los cuadros de color rojo forman parte del paso 2 del protocolo: Tinción de flujo intranuclear para el análisis de expresión de proteínas. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
- Preparación de reactivos
NOTA: Si planea una extracción para recolectar ARN y células para el análisis de HPTM, consulte la sección 1.7.1 para ver las modificaciones para incluir inhibidores de la transcripción y la traducción. Sin embargo, esto no es necesario si solo se evalúa la señal de la proteína, ya que las células están en gran medida inactivas cuando se mantienen en hielo.- Tampón de clasificación celular activada por fluorescencia (FACS) (20 ml por muestra): Disuelva la albúmina sérica bovina (BSA) en 1 solución salina equilibrada Hanks (HBSS) para crear una solución BSA al 2%. Disuelva el EDTA hasta una concentración final de 1 mM en la solución de BSA al 2%. Esterilizar con un filtro de 0,2 μm y almacenar a 4 °C hasta 1 semana antes de su uso.
- Tampón de digestión (1 mL por muestra): Reconstituir un vial de papaína en HBSS a una concentración final de 20 U/mL en L-cisteína 1 mM con EDTA 0,5 mM. Actívelo a 37 °C durante un mínimo de 10 minutos o hasta que esté listo para digerir el tejido. Justo antes de su uso, añadir DNasa I a la solución de papaína activada hasta una concentración final de 200 U/mL. Prepáralo el día del experimento y no lo guardes.
- Solución de gradiente de densidad isotónica (5,5 ml por muestra): Añadir 10x HBSS al medio de gradiente de densidad fría hasta una concentración final de 1x HBSS, lo que da como resultado una densidad final de 1,117 g/ml. Vórtice para mezclar durante al menos 30 s antes de su uso. Coloque sobre hielo hasta su uso.
- Solución de gradiente de densidad al 37% (4 mL por muestra): Añadir gradiente de densidad isotónica a 1x HBSS para obtener una concentración final del 37% con una densidad final de 1,043 g/mL. Agregue 20 μL de rojo de fenol por cada ml de gradiente de densidad del 37% para hacer una solución rosa para la visualización durante la estratificación. Vórtice durante al menos 30 s antes de su uso. Coloque sobre hielo hasta su uso.
- Solución de gradiente de densidad al 70% (2 ml por muestra): Añadir gradiente de densidad isotónica a 1x HBSS para obtener una concentración final del 70% con una densidad final de 1,082 g/ml. Agregue 5 μL de azul de tripán por cada ml de medio de densidad al 70% para hacer una solución azul para la visualización durante la estratificación. Vórtice durante al menos 30 s antes de su uso. Coloque sobre hielo hasta su uso.
- Perfusión y disección cerebral
NOTA: El protocolo de perfusión es similar al de Posel et al., que presenta una representación en video de la toracotomía de ratón, la perfusión transcardíaca y la extirpación del cerebro21. En este caso, utilizamos ratones machos y hembras adultos C57BL/6J (10-15 semanas de edad, 20-30 g), pero este protocolo se puede utilizar para realizar una toracotomía a cualquier ratón. Todos los procedimientos con animales deben ser aprobados por el comité de ética institucional antes de realizar experimentos.- Anestesia de ratón: Anestesiar ratones con isoflurano al 4% en oxígeno al 100% hasta que pase el plano de anestesia quirúrgica, lo que se puede confirmar con un pellizco en el dedo del pie, o una falta de reflejo al pellizcar firmemente el pie del ratón. Coloque el ratón boca arriba y sujete firmemente sus cuatro patas hacia abajo en la tabla de disección quirúrgica colocada inclinada en una bandeja de plástico, asegurándose de que la nariz esté asegurada en el cono nasal de isofluorano. Después de la transferencia, asegúrese de que el animal aún haya pasado el plano quirúrgico de la anestesia antes de continuar.
- Toracotamía de ratón: Agarre y levante la piel abdominal con fórceps y haga una incisión poco profunda a través de la piel y la pared abdominal para exponer la xifoidea sin dañar la aorta descendente ni ningún órgano subyacente.
- Sujete la xifoidea con pinzas y haga incisiones laterales debajo de la caja torácica para exponer el diafragma y el hígado. Haga cortes cuidadosos y poco profundos a través del diafragma a lo largo de la caja torácica con tijeras finas y a través de la caja torácica con tijeras de tejido y sujete el esternón a la estación quirúrgica cerca de la cabeza del ratón para exponer el corazón y los pulmones para la perfusión transcárdica.
- Perfusión transcárdica: Prepare una bomba de perfusión peristáltica y coloque una aguja de 26,5 G en un extremo del tubo. Prepare el tubo para el procedimiento insertando un extremo del tubo en un vial de 1x HBSS frío y encendiendo la bomba para llenar completamente el tubo con 1x HBSS.
- Mientras sostiene el corazón con pinzas romas, inserte la punta de una aguja 26.5G con el tubo de perfusión adjunto en el ventrículo izquierdo del corazón y haga una pequeña incisión en la aurícula derecha. Encienda la bomba de perfusión para perfundir cuidadosamente el ratón a una velocidad de ~2-4 ml/min con al menos 15-20 ml de 1x HBSS frío.
NOTA: A menudo se indica una perfusión completa cuando el hígado comienza a eliminar la sangre y adquiere el mismo color que el corazón. - Extracción de cerebro: Decapitar al ratón con unas tijeras de disección de tejidos y hacer una incisión en la línea media del cuero cabelludo desde el cuello hasta la nariz. Pele los colgajos de piel hacia los lados para exponer el cráneo y eliminar el exceso de tejido y huesos en el extremo caudal del cráneo con unas tijeras de disección.
- Desliza con cuidado una hoja de las tijeras debajo del cráneo en el foramen magnum con el lado afilado hacia el hueso y corta con cuidado la línea media hacia la nariz. Haz cortes laterales tanto en la base del cráneo como cerca de la nariz con unas tijeras de disección. Con pinzas finas, dale vida al cráneo desde la línea media hacia el exterior para romper las piezas del cráneo y exponer el cerebro. Levante suavemente el cerebro con una espátula y colóquelo sobre papel de disección.
- Disección del cerebro: Coloque el cerebro en un pedazo de papel seca de disección humedecido con 1x HBSS encima de una placa de Petri cerrada llena de hielo. Retire el cerebelo y divida en dos los hemisferios cerebrales con una cuchilla de afeitar limpia.
- Extirpa el tronco encefálico, el cuerpo estriado y la materia blanca de cada hemisferio, manteniendo intactos el hipocampo y la corteza suprapuesta. Transfiera los hemisferios que contienen tejido aislado de la corteza y el hipocampo a un tubo de 15 ml con 5 ml de HBSS frío 1x y manténgalo en hielo.
NOTA: Es importante realizar las disecciones lo más rápido posible para que el tejido permanezca frío con no más de 2 minutos entre la decapitación y la colocación final del tejido diseccionado en 1x HBSS en hielo. Si se aísla la microglía de varios animales, los cerebros se pueden almacenar en hielo en 1x HBSS durante ~ 1 h antes de proceder con el procesamiento de toda la cohorte de animales para la digestión, etc.
- Digestión y homogeneización del cerebro
- Disociación mecánica y química: Coloque el tejido cerebral de cada ratón y 1 ml de tampón de digestión en placas de Petri individuales sobre hielo. Con una hoja de bisturí limpia, corte bien el cerebro en trozos pequeños (<1 mm).
- Corte la punta de una pipeta de transferencia de plástico y transfiera con cuidado cada uno de los sesos picados a pocillos separados dentro de una placa de 24 pocillos en hielo. Cubra la placa con film flexible transparente e incube en hielo durante 30 min.
NOTA: Cuando se pica correctamente, el tejido cerebral se asemeja al ajo bien picado. - Homogeneización de onzas: Transfiera la solución cerebral digerida de cada pocillo a homogeneizadores individuales de onzas de vidrio de 7 ml en hielo, cada uno lleno con 5 ml de tampón FACS frío. Resalte cada cerebro suavemente con el mortero suelto (A), aproximadamente 30-40 veces, hasta obtener una suspensión de una sola célula. Después de rociar con el mortero A, remogue suavemente con el mortero apretado (B) 3-4 veces para asegurar una suspensión de una sola celda.
NOTA: No empuje el mortero más de 3/4 del camino hacia abajo para evitar aplastar el tejido en la parte inferior del homogeneizador. La solución final debe ser opaca y lechosa.
NOTA: Si se digieren varios cerebros en un solo experimento, programe la transferencia del digesto cerebral al tampón FACS de modo que cada muestra esté solo en el tampón de digestión durante 30 minutos. La digestión excesiva puede provocar la escisión de las proteínas de la superficie, lo que reduce la unión y la señal de los anticuerpos posteriores.
- Obtención de un fragmento enriquecido con inmunidad
- Establecimiento del gradiente de densidad: Transfiera el homogeneizado de cada cerebro a tubos de polipropileno separados de 15 mL y agregue 2.125 mL de gradiente de densidad isotónica y supere a 8.5 mL con tampón FACS para cada uno para obtener una concentración final de gradiente de densidad del 25%. Invierta suavemente los tubos de 15 ml 20x para mezclar bien.
- Utilizando una pipeta de transferencia graduada estrecha, aplique suavemente 4 ml de gradiente de densidad del 37 % en cada tubo, teniendo mucho cuidado de establecer capas limpias. Cambie las pipetas de transferencia y coloque suavemente 2 ml de gradiente de densidad del 70 % (Figura 2A). Pasar a una centrífuga enfriada a 4 °C y centrifugar a 500 x g durante 20 minutos con la rampa de frenado puesta a cero.
- Recogida de fragmentos enriquecidos con sistema inmunitario: Con pipetas de transferencia limpias, aspire suavemente la mielina desde la parte superior del volumen en el tubo de 15 ml con una pipeta de transferencia limpia y deséchela. Recoja cuidadosamente el fragmento superior del gradiente de densidad en un tubo de polipropileno limpio de 15 ml con una pipeta de transferencia.
- Recoja cuidadosamente el fragmento enriquecido con sistema inmunitario (1,5 ml por encima y 1,5 ml por debajo de donde se encuentran las capas de gradiente de densidad del 70 % y el 37 %) en un nuevo tubo de polipropileno de 15 ml (Figura 2B). Agregue 10 ml de tampón FACS a la muestra inmunoenriquecida para diluir el medio de gradiente de densidad e invierta el tubo suavemente 20 veces para mezclar bien.
NOTA: Como las células tienden a adherirse a los lados del tubo, asegúrese de recoger todas las células de la muestra durante los pasos de recolección haciendo círculos lentamente con la pipeta a lo largo de los lados del tubo mientras recoge el líquido. - Granular las células de la muestra inmunoenriquecida centrifugando los tubos de 15 ml en una centrífuga a 4 °C a 500 x g durante 10 min con el freno de rampa descendente puesto a cero. Inmediatamente después del final del centrifugado, retire el sobrenadante con cuidado, dejando aproximadamente 300 μL de líquido en el tubo de 15 ml, teniendo cuidado de no alterar el gránulo (que puede no ser visible).
- Recoja el sobrenadante en otro tubo de 15 mL para asegurarse de que las células se peletizaron en el centrifugado (deseche esta fracción una vez que se haya realizado la verificación con los recuentos celulares del gránulo resuspendido). Después de resuspender el gránulo celular en el volumen de 300 μL con una pipeta P1000, cuente las células con un hemacitómetro para estimar el rendimiento total de la célula.
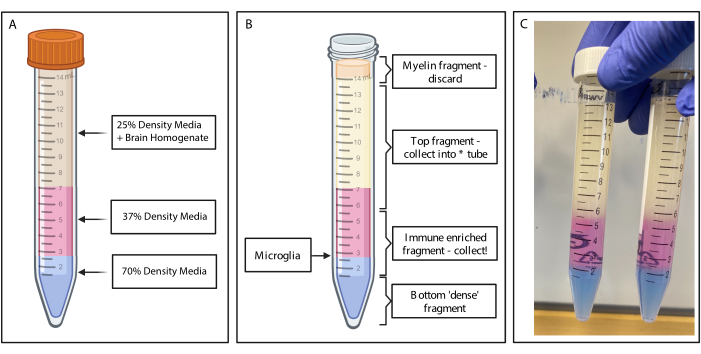
Figura 2: Obtención del fragmento inmunoenriquecido por gradiente de densidad discontinuo. (A) El homogeneizado cerebral se realiza a un medio de densidad del 25%, una capa inferior de 4 mL de color rosa medio de densidad 37% a través de rojo fenol y 2 mL de azul de color medio de densidad 70% a través de azul tripano. (B) Después de la centrifugación, las fracciones se han separado. La microglía descansa en la interfaz de fragmentos de medios de densidad del 37% y 70%. El fragmento de mielina se encuentra en la parte superior del tubo de 15 ml y se desechará. El fragmento superior se recoge como respaldo en caso de que falle el giro y no se recupere ninguna célula. Si eso ocurre, el gradiente se puede repetir usando esta fracción. La fracción inmunoenriquecida se recoge aguas abajo. La fracción inferior que contiene los glóbulos rojos permanece en el tubo y se desecha. (C) Figura de ejemplo que representa capas completas. Creado con BioRender.com. Haga clic aquí para ver una versión más grande de esta figura.
- Tinción de anticuerpos extracelulares
- Bloqueo: Transfiera las celdas a una placa de 96 pocillos de fondo redondo sobre hielo y centrifugue a 500 x g con freno para pellet las celdas. Retire rápidamente el sobrenadante en el fregadero moviendo la placa para desechar el sobrenadante, dejando el gránulo de celda intacto en el fondo del pozo.
- Resuspender las células en 50 μL de tampón FACS con un reactivo de bloqueo del receptor FC CD16/32 anti-ratón utilizando una pipeta P200 (concentración final 10 μg/mL, factor de dilución 1:50) para evitar la unión inespecífica de anticuerpos a monocitos u otras células portadoras de FcR. Incubar durante 10 minutos en hielo.
- Tinción de anticuerpos: Prepare el volumen adecuado de una mezcla maestra 2x que contenga P2RY12-aloficocianina (APC; factor de dilución 1:50, concentración 4 μg/ml para una concentración final de pocillo de 1:100, concentración 2 μg/ml) y tinción violeta 525 viva muerta (factor de dilución 1:50 para una concentración final de pocillo de 1:100). Añadir 50 μL de la mezcla maestra de tinción a la suspensión celular (obtenida tras el bloqueo en la sección 1.5.1) e incubar la placa durante 30 min en la oscuridad sobre hielo.
NOTA: Para este protocolo, presentamos la tinción de las células con P2RY12. En primer lugar, P2RY12 es un marcador homeostático de la microglía que puede ser regulado a la baja en ciertos contextos de enfermedad. Por ejemplo, los ratones modelo de Alzheimer 5XFAD tienen niveles de P2RY12 regulados a la baja, lo que podría dificultar su identificación22. Las tinciones alternativas que se pueden utilizar para el aislamiento incluyen Tmem119, Cd11b y CD4523. En segundo lugar, el conjugado fluorocromo APC se puede ajustar para adaptarse al panel de anticuerpos deseado. Sin embargo, la elección de un fluorocromo brillante, como APC o PE, ayudará a garantizar que las poblaciones positivas y negativas sean fácilmente distinguibles24. - Después de la tinción, agregue 200 μL de tampón FACS directamente a cada pocillo para lavar las células. Girar a 500 x g a 4 °C para eliminar el sobrenadante con un golpecito. Vuelva a suspender las células en 200 μL de tampón FACS con una pipeta P200, centrifugar a 500 x g a 4 °C y agitar la placa para eliminar el tampón de los pocillos.
- Preparación de los controles de flujo: Antes de la tinción, separe los volúmenes necesarios de células de cada muestra después del bloqueo en el paso 1.5.1 para los controles de flujo requeridos.
NOTA: Se requieren controles de flujo para cada experimento a fin de establecer las puertas. Los controles de flujo se pueden tomar de un animal adicional o de una fracción de cada uno de los pozos experimentales. Al dividir las celdas, asegúrese de asignar suficientes celdas por control, ya que se requieren entre 10.000 y 30.000 celdas por control para establecer puertas con alta confianza.- Hay tres controles de flujo relevantes: sin mancha, muertos vivos y control de isotipo P2RY12. Para el control sin manchas, no agregue ningún anticuerpo. En el control del isotipo P2RY12, tratar las células con colorante de viabilidad (1:100) y un anticuerpo de control del isotipo conjugado con APC (1:100).
- Para preparar el control de muertos vivos, coloque las células alícuotas en un pocillo separado y mueva la mitad del volumen celular a un tubo de 500 μL. Coloque el tubo de 500 μL en el congelador a -80 °C durante 5 minutos, luego colóquelo en la incubadora a 37 °C durante 5 minutos para matar las células. Devolver la alícuota de células muertas al pocillo de control de muertos vivos y teñir con un colorante de viabilidad de unión a aminas sobre violeta 525 (factor de dilución 1:100) para marcar las células muertas.
NOTA: El protocolo está escrito para la tinción de placas con un método de movimiento rápido para la eliminación del sobrenadante. Sin embargo, esto requiere que el sobrenadante se elimine inmediatamente después de completar el giro y el movimiento debe realizarse con suficiente fuerza para eliminar rápidamente el sobrenadante sin perturbar el gránulo. Alternativamente, se pueden utilizar tubos libres de ARNasa/DNasa de 1,5 ml para la tinción, con las siguientes modificaciones: Transfiera las células al tubo de microcentrífuga de 1,5 ml y gránulos a 800 x g durante 5 min a 4 °C. Aspirar sobrenadante con pipetas. Consejo: Para mayor velocidad, una pipeta de transferencia de 5 ml con una punta P200 puede aspirar el sobrenadante de forma rápida y precisa. Al aspirar, compruebe si hay gránulos. Si el gránulo no es visible, deje 50 μL de sobrenadante y ajuste los cálculos en consecuencia. Al eliminar los anticuerpos, agregue FACS adicionales para aumentar la dilución de anticuerpos (1000 μL en lugar de 200 μL) para tener en cuenta la eliminación incompleta del sobrenadante. Dependiendo del citómetro, utilice los tubos de 1,5 ml para clasificar, lo que reduce la cantidad de suministros necesarios.
- Clasificación FACS para microglía
- Preparación: Vuelva a suspender cada pocillo en 200 μL de tampón FACS con una pipeta P200 y transfiéralo a tubos de clasificación de flujo marcados y agregue tampón FACS hasta un total de 500 μL para una concentración de aproximadamente 5 x 105 eventos por ml. Almacenar en hielo en la oscuridad hasta el análisis. Prepare los tubos de clasificación posterior añadiendo 100 μL de tampón FACS como colchón para las células en tubos libres de ARNasa de 1,5 mL.
- Configuración del citómetro: Ordene las células en un clasificador de células de citometría de flujo configurado con la boquilla de 100 μm. Ordene las celdas usando 18-20 psi.
- Compuerta: En el citómetro, compuerta para el tamaño de la célula utilizando el área de dispersión lateral (SSC) frente a la altura de dispersión frontal (FSC) utilizando el control sin tinción para ayudar a distinguir los residuos, coloque SSC-A en un eje logarítmico para visualizar una población de células y la puerta de cerca para seleccionar las células (puerta S1; Figura 3). Para eliminar cualquier doblete, trace FSC-H vs FSC-W y compuerta cerca de la población celular eliminando cualquier residuo y doblete (puerta S2). Con el control de isotipo P2RY12, examine las células del canal APC y configure la puerta de autofluorescencia para determinar las células P2RY12+. Usando los controles sin tinción y muertos vivos, compuerta para las células que no son fluorescentes en violeta 525 nm como células vivas.
- Clasificación: Grafique violeta 525 nm vs APC y determine la población que es P2RY12+ y vive por FMO (MG). Clasifique esas celdas en el tubo de clasificación de publicaciones etiquetado (Figura 3). El porcentaje de ordenación final es de aproximadamente el 50 % del total de eventos, y la mayoría de las pérdidas totales de eventos son escombros eliminados en la puerta S1 (~ 70 % de los eventos son celdas; Tabla 1).
- Aislamiento y análisis de ARN
- Inhibidores de la transcripción y de la traducción: Si se planea la extracción de ARN, para eliminar el riesgo de firmas transcriptómicas asociadas al aislamiento, incluya los inhibidores de la traducción y la transcripción en los pasos del tampón. Prepare el cóctel inhibidor como lo describe Marsh et al. que incluye actinomicina D, anisomicicina y triptólido25.
- Preparación del inhibidor: Reconstituya las existencias de inhibidores y almacene de la siguiente manera: Reconstituya la actinomicina D en dimetilsulfóxido (DMSO) a 5 mg/ml y almacene a -20 °C. Reconstituir el triptólido en DMSO a 10 mM y conservar a -20 °C, protegido de la luz. Reconstituir la anisociina en DMSO a 10 mg/mL y almacenarla a 4 °C, protegida de la luz. Almacene todas las existencias de inhibidores durante no más de 1 mes después de ser reconstituidas.
- Modificaciones del tampón: Añadir inhibidores en cuatro tampones diferentes en el protocolo de la siguiente manera: Al realizar la perfusión transcárdica, preparar HBSS con actinomicina D (5 μg/ml, 1:1000 de stock) y triptólido (10 μM, 1:1000 de stock). Después de la perfusión, transportar cerebros al laboratorio en HBSS que contienen actinomicina D (5 μg/mL, 1:1000 de stock), triptolido (10 μM, 1:1000 de stock) y anisomicicina (27,1 μg/mL, 1:368,5 de stock). Preparar tampón FACS con actinomicina D (5 μg/mL, 1:1000 de stock), triptólido (10 μM, 1:1000 de stock) y anisomicicina (27,1 μg/mL, 1:368,5 de stock). Preparar tampón de digestión con actinomicina D (5 μg/mL, 1:1000 de la culata), triptólido (10 μM, 1:1000 de la culata) y anisomicicina (27,1 μg/mL, 1:368,5 de la culata). Prepare el tampón de lavado posterior a la clasificación, con HBSS que contenga actinomicina D (5 μg/ml, 1:1000 de stock), triptólido (10 μM, 1:1000 de stock) y anisocicina (27,1 μg/mL, 1:368,5 de stock).
NOTA: Al agregar los inhibidores, asegúrese de agregarlos inmediatamente antes de usarlos y proteja los tampones preparados de la luz mientras está en uso. Evite la congelación y descongelación de las soluciones madre.
- Lavados posteriores a la clasificación: Debido a que las células se han clasificado en tubos libres de ARNasa de 1,5 ml en tampón FACS, lo que interferirá con el aislamiento del ARN, es necesario lavar las células. Centrifugar las células a 1000 x g a 4 °C durante 5 min y eliminar el sobrenadante, dejando aproximadamente 50 μL de líquido.
- Añadir 200 μL de 1x HBSS que contenga actinomicina D (5 μg/mL, 1:1000 en stock), triptólido (10 μM, 1:1000 en stock) y anisomicicina (27,1 μg/mL, 1:368,5 en stock) y mezclar bien. Repetir el centrifugado y eliminar el sobrenadante dejando 50 μL de líquido (lavar 1). Añadir 200 μL de tampón de lavado post sort, mezclar bien y repetir el centrifugado y eliminar el sobrenadante dejando 25 μL de líquido (lavar 2).
- Extracción de ARN: Para el aislamiento de ARN de células microgliales, utilice un kit de aislamiento de ARN de baja entrada para obtener rendimientos de ARN altos y consistentes y puntuaciones de RIN superiores a 9 (consulte a continuación y la Tabla de materiales para obtener recomendaciones de productos). Al gránulo celular, añadir 350 μL del tampón de lisis del kit recomendado + β-mercaptoetanol (1:100) y mezclar bien.
NOTA: Si es necesario, el protocolo se puede suspender en este punto. Las muestras pueden almacenarse en el tampón de lisis a -80 °C hasta la extracción del ARN. Si extrae ARN después del almacenamiento, descongele el lisado en hielo y proceda con las instrucciones específicas del kit para el aislamiento. - Transfiera el lisado a una trituradora de células en columna (consulte la Tabla de materiales para ver las recomendaciones del producto) y centrifugue a velocidad máxima a 4 °C durante 2 min. Eluir en un mínimo de 14 μL de agua libre de RNasa y determinar la concentración según corresponda. El ARN se puede utilizar para cualquier aplicación posterior después de este punto.
- Inhibidores de la transcripción y de la traducción: Si se planea la extracción de ARN, para eliminar el riesgo de firmas transcriptómicas asociadas al aislamiento, incluya los inhibidores de la traducción y la transcripción en los pasos del tampón. Prepare el cóctel inhibidor como lo describe Marsh et al. que incluye actinomicina D, anisomicicina y triptólido25.
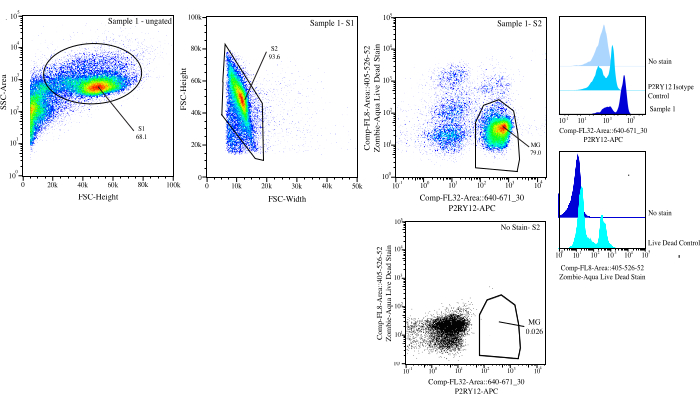
Figura 3: Estrategia de compuerta para la ordenación de flujo. Los eventos se limitan al tamaño de celda en SSC-A frente a FSC-H (S1). A continuación, las células se activan para ser singletes en FSC-H frente a FSC-W (S2). Las células singlete se clasifican como vivas si son negativas en Comp-FL8-A::405-526-52 (tinción violeta 525 muerta viva) y como P2RY12+ si son positivas en Comp-FL32-A::640-671_30 (P2RY12-APC) utilizando el control de isotipo P2RY12. Las células se etiquetan como MG y se clasifican tanto si están vivas como si son P2RY12+. Haga clic aquí para ver una versión más grande de esta figura.
| POBLACIÓN CERRADA | Frecuencia de los padres | Frecuencia de Total | Contar |
| S1 | 68.10% | 68.10% | 162186 |
| S2>S1 | 93.59% | 63.70% | 151707 |
| P2Ry12+ (670+) > S2 > S1 | 83.05% | 52.90% | 125986 |
| En vivo (525-) > S2 > S1 | 92.78% | 59.10% | 140752 |
| MG (P2RY12+ en vivo) >S2>S1 | 78.96% | 50.30% | 119794 |
Tabla 1: Ejemplo de tabla de linaje de muestra con porcentajes de compuerta y números de eventos esperados.
2. Tinción de flujo intranuclear para el análisis de la expresión de proteínas
NOTA: En este punto se pueden iniciar otros tipos de células, este protocolo se prueba con células cultivadas, incluidas las células HEK293, las células similares a la microglía BV2 y la microglía humana derivada de IPSC.
- Fijación y tinción de células
NOTA: Para el siguiente protocolo, utilice un kit de tinción intracelular que esté optimizado para la tinción nuclear. Ver Tabla de materiales para recomendaciones de productos.- Células teñidas extracelularmente alícuotas de la sección 1.5.2 en una placa de 96 pocillos (5 x 104- 1 x 106 células). Centrifugar las celdas durante 5 min a 500 x g a 4 °C y deslizar para eliminar el tampón FACS.
NOTA: Para obtener datos con alta confianza de los niveles medianos, se debe utilizar un mínimo de 10.000 células por pocillo. Si bien no hay un máximo recomendado, es mejor mantener el número de células constante durante todo el experimento para asegurarse de que no haya un efecto significativo de diferentes coeficientes de variación (CV). - Fijación y permeabilización: Añadir 200 μL de concentrado 1x fix y mezclar suavemente con la pipeta P200 para resuspender las células. Incubar en la oscuridad durante 45-60 min. Centrifugar la placa durante 5 min a 500 x g a temperatura ambiente (RT) y agitar para desechar el sobrenadante.
NOTA: Si es necesario, el protocolo se puede suspender en este punto. Después de desechar el sobrenadante, vuelva a suspender las células en un tampón de almacenamiento a largo plazo para las células inmunitarias (consulte la Tabla de materiales para conocer las recomendaciones del producto). Las muestras pueden almacenarse a 4 °C durante 12-18 h, protegerse de la luz y cubrirse con una película transparente para proteger la evaporación del tampón. - Añadir 200 μL de tampón de permeabilización 1x a cada pocillo y pipetear con un P200 para mezclar. Centrifugar la placa durante 5 min a 500 x g a RT y agitar para desechar el sobrenadante. Repita el lavado del tampón de permeabilización un total de 3 veces.
- Preparación de los controles de flujo: Divida el volumen de las celdas de cada muestra para los controles de flujo requeridos (10.000-30.000 celdas por pocillo de control es suficiente).
- Para preparar el control sin tinción, fije las células sin tinción del tipo o las células sin tinción alícuotas en un pocillo separado que no recibirá ningún anticuerpo.
- Para preparar el control de fluorescencia menos uno (FMO), se deben hacer alícuotas de células para cada uno de los anticuerpos del panel, excepto el de ese canal.
- En el caso de los canales pertinentes, incluya el anticuerpo de control del isotipo en el FMO para la compuerta. Por ejemplo, en un panel que contiene P2RY12-APC y H3K27Ac-AlexaFluor568, debe haber dos FMOS: (1) el APC-FMO que contiene solo H3K27Ac-AlexaFluor568 y el anticuerpo de control de isotipo P2RY12 y (2) el 568-FMO que contiene solo P2RY12-APC y el primario de control de isotipo y el secundario 568.
NOTA: Este protocolo se presenta para probar un solo HPTM, sin embargo, se pueden establecer paneles que contengan muchos HPTM conjugados con diferentes fluoróforos.
- Tinción de anticuerpos primarios: Añadir 50 μL de tampón de permeabilización 1x con la concentración adecuada de anticuerpo primario a cada pocillo. Incubar durante 30 minutos a RT en la oscuridad. Lavar 2 veces con 200 μL de tampón de permeabilización 1x.
NOTA: La concentración de anticuerpos utilizada para cada HPTM se incluye en la Tabla de Materiales. La concentración se determina probando diferentes concentraciones de anticuerpos en células cultivadas tratadas con un estimulante que causaría un aumento dramático, por ejemplo, un inhibidor de HDAC para las marcas de acetilación y asegurándose de que tanto las células tratadas como las no tratadas estuvieran dentro del rango de detección (por encima del control de isotipo y por debajo del rango máximo de detección del citómetro). La concentración óptima de anticuerpos para las HPTM debe tener una mediana media de intensidad fluorescente en el canal de fluoróforos entre 5 x 104 y 1 x 105. - Tinción secundaria de anticuerpos: Bloquear con 200 μL de tampón de permeabilización 1x con suero de burro normal (NDS) al 2% durante 10 min en RT. Centrifugar durante 5 min a 500 x g en RT y deslizar para eliminar el sobrenadante.
- Añadir 50 μL de tampón de permeabilización 1x con NDS al 2% y la concentración adecuada de anticuerpo secundario e incubar durante 30 min a RT en la oscuridad. Agregue 200 μL de tampón de permeabilización 1x a los pocillos para diluir, centrifugue la placa durante 5 min a 500 x g en RT y agite para desechar el sobrenadante. Lavar las celdas 2x con 200 μL de tampón de permeabilización 1x.
NOTA: Si es necesario, suspenda el protocolo en este punto. Resuspender las células en 200 μL de tampón de almacenamiento a largo plazo para células inmunitarias con una pipeta P200 (consulte la tabla de materiales para obtener recomendaciones) y almacenar a 4 °C durante 12-24 h protegido de la luz. - Preparación para la citometría de flujo: Centrifugar la placa durante 5 min a 500 x g a RT y deslizar para desechar el sobrenadante. Resuspender las células en 200 μL de tampón FACS utilizando una pipeta P200 para citometría de flujo. Sellar con film transparente para su transporte al citómetro.
- Células teñidas extracelularmente alícuotas de la sección 1.5.2 en una placa de 96 pocillos (5 x 104- 1 x 106 células). Centrifugar las celdas durante 5 min a 500 x g a 4 °C y deslizar para eliminar el tampón FACS.
- Citometría de flujo
- Para analizar el panel de anticuerpos propuesto, asegúrese de que el citómetro esté equipado con al menos cuatro láseres, incluidos violeta (405 nm), azul (488 nm), amarillo (561 nm) y rojo (633 nm). El citómetro necesita filtros para detectar FITC (azul-525 nm), KRO (violeta-525 nm), PE (amarillo-585 nm) y APC (rojo-660 nm). Agregue anticuerpos adicionales según el citómetro elegido.
- Calibración y estandarización: Al comienzo de cada experimento, ejecute perlas fluorescentes arcoíris y ajuste el voltaje del tubo fotomultiplicador (PMT) hasta que los picos de perlas sean comparables a los valores objetivo ejecutados para experimentos anteriores. Este método de estandarización permite acomodar la deriva del equipo a lo largo del tiempo.
- Compensación: Después de que se haya establecido el voltaje y la ganancia de PMT para el experimento, use perlas de compensación capturadas por anticuerpos para establecer la matriz de compensación para el panel de anticuerpos. Este cálculo asegurará que los fluoróforos no contribuyan a los cambios de señal en otros canales. Esto es cada vez más necesario cuando se multiplexan múltiples anticuerpos.
- Tamaño de compuerta: En un diagrama de puntos, represente SSC-A en log frente a FSC-H en lineal. Cierre la barrera de residuos y seleccione el tamaño de celda con la puerta S1. Seleccione para celdas singlete en un diagrama de puntos de FSC-W frente a FSC-H y la puerta como S2. (Figura 4).
- Establecimiento de puertas de fluoróforo: Utilizando el FMO correspondiente para cada canal de fluoróforo, establezca las puertas para determinar qué es una señal positiva en cada canal utilizando histogramas de un solo parámetro (Figura 4).
- Medición de las muestras: Registre cuidadosamente las muestras utilizando la estrategia de compuerta establecida. Identifique la microglía utilizando la señal P2RY12+, determine la expresión de la proteína en los canales respectivos solo para la microglía.
- Análisis de datos de citometría de flujo
- Establecimiento de puertas de análisis: Siguiendo los pasos anteriores para el citómetro en la interfaz de usuario del software de análisis, utilice las mismas puertas utilizadas para el registro para el análisis.
- Obtenga los valores de MFI utilizando el software de análisis de citometría de flujo (consulte la Tabla de materiales para obtener recomendaciones): Recapitule la estrategia de activación del citómetro para el análisis de flujo. Con la función de agregar estadísticas, seleccione la mediana para la población de interés (por ejemplo, 568+) en la altura del canal compensado. Con el editor de tablas, exporte los valores medios de intensidad fluorescente (MFI) de los canales respectivos a una hoja de cálculo para continuar con el análisis estadístico (Tabla 2).
NOTA: El archivo suplementario S1 incluye datos de ejemplo de ratones inyectados con lipopolisacárido (LPS) y solución salina tamponada con fosfato (PBS) y un archivo de análisis de ejemplo con la estrategia de compuerta y los valores de MFI. - Análisis de los valores de MFI para el cambio de pliegue de la proteína: Después de obtener los valores de MFI, calcule el cambio de pliegue de la IMF en relación con la población de control o no tratada (Ecuación 1). El cambio de pliegue de MFI es un reflejo del cambio de pliegue en los niveles de proteínas. Utilizando los valores de cambio de plegamiento, evalúe el cambio en la expresión y calcule la significación estadística mediante una prueba t o ANOVA.
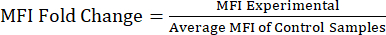 Ecuación 1
Ecuación 1
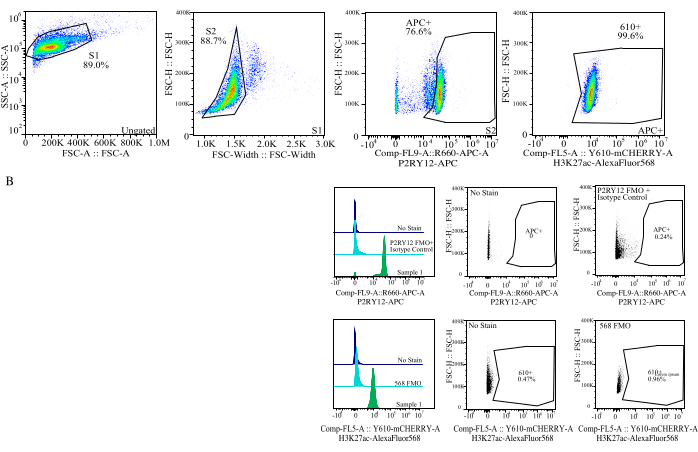
Figura 4: Estrategia de activación para la evaluación de IMF de proteínas. Los eventos se controlan primero para el tamaño de celda en SSC-A frente a FSC-H (S1). A continuación, las celdas se activan para singletes en FSC-H frente a FSC-W (S2). A continuación, las células singlete se identifican como microglía mediante la señal P2RY12-APC (APC+) y la puerta se establece en función de la fluorescencia en un control APC-FMO que contiene un anticuerpo de control de isotipo. A continuación, las celdas se activan para la señal H3K27Ac-AlexaFluor568 en Comp-FL5-A::Y610-mCherry. La intensidad fluorescente de las 610+ células se determina como un proxy de la expresión de proteínas. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
Los ratones adultos fueron perfundidos transcardialmente y sacrificados para el aislamiento de la microglía. Las microglías se aislaron en hielo y se tiñeron con P2RY12-APC y 525 anticuerpos vivos muertos violetas. Las células que se determinaron como positivas para P2RY12 y negativas para la tinción violeta 525 de muertos vivos se clasificaron como microglía viva. El rendimiento medio de la microglía de un cerebro de ratón disecado fue de 1,28 x 105 ± 0,05 (media ± error estándar de la media (SEM), N = 100). No hay diferencia en el rendimiento de microglía de ratones hembra (1,25 x 105 ± 0,09 [media ± SEM, N=46]) y machos (1,32 x 105 ± 0,07 [media ± SEM, N=54]) (t(98)=0,6365, p=0,526). Cuando se aísla de regiones cerebrales específicas, el rendimiento medio de la microglía de las cortezas de ratón es de 8,3 x 104 ± 0,08 (media ± SEM, N = 15) y del hipocampo de ratón es de 4,1 x 104 ± 0,02 (media ± SEM, N = 16). Como era de esperar, existe una diferencia significativa en el rendimiento de la microglía de cada región del cerebro (F(2, 128)=25.25, P<0.0001). Tras el aislamiento de la microglía, se extrajo el ARN de las células aisladas utilizando un kit de aislamiento de ARN de baja entrada. Consistentemente, la puntuación de integridad del ARN (RIN) fue superior a 9,0 (9,62 ± 0,05) y el rendimiento medio de ARN por célula fue de 0,25 ± 0,01 pg (media ± SEM, N=32; Expediente Complementario S2).
A los ratones adultos se les inyectó intraperitonealmente 1 mg/kg de lipopolisacárido (LPS) 24 h antes del sacrificio. Los ratones se perfundieron transcardíacamente con HBSS y se aisló la microglía de todo el cerebro de acuerdo con el protocolo descrito (Figura 5A). Para cada tinción, se asignaron entre 20.000 y 30.000 células a cada panel de anticuerpos. Los niveles globales de acetilación de la histona 3 lisina 27 (H3K27Ac) se evaluaron en microglía aislada mediante citometría de flujo. Para ratones machos y hembras, el tratamiento con LPS indujo un aumento de H3K27Ac cuando la IMF se normaliza dentro del sexo (t(6)=9.676, p<0.0001; Figura 5B). Al examinar los histogramas de las células teñidas, las poblaciones se distribuyen normalmente con una variación similar; sin embargo, las células han cambiado a un aumento de la fluorescencia, lo que resulta en el aumento de MFI (Figura 5C). Al examinar H3K9Ac en el mismo tratamiento, hay un aumento similar en H3K9Ac (t(6)=7,299, p=0,0003; Figura 5D, E), sin embargo, el cambio de pliegue de LPS en relación con PBS de la señal H3K9Ac es menor que la señal H3K27Ac.
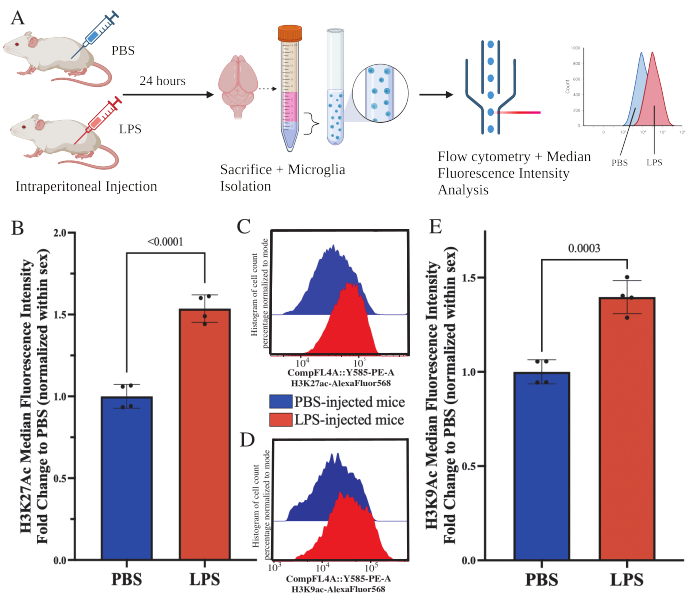
Figura 5: Cambios globales en la acetilación de histonas en microglía aislada. (A) A los ratones se les inyecta por vía intraperitoneal solución salina tamponada con fosfato (PBS) o 1 mg/kg de lipopolisacárido (LPS) 24 h antes del sacrificio. La microglía se recolecta de la fracción inmunoenriquecida y se fija para la citometría de flujo y la evaluación de la modificación postraduccional global de histonas. La mediana de la intensidad fluorescente se evalúa como un indicador de la expresión de proteínas. Creado con BioRender.com. (B) Los niveles globales de H3K27Ac aumentaron en respuesta al tratamiento con LPS. El cambio de pliegue a PBS se normalizó dentro del experimento y el sexo. Prueba t de dos colas no apareadas, t(6)=9.676, p<0.0001. El gráfico de barras representa la media ± SEM. N=8 animales; 2 por condición en 2 experimentos independientes. (C) Ejemplos de histogramas que representan el cambio de la intensidad fluorescente de H3K27Ac. El modal representa histogramas de ratones inyectados con PBS frente a ratones inyectados con LPS. (D) Ejemplos de histogramas que representan el cambio de la intensidad fluorescente de H3K9Ac. El modal representa histogramas de ratones inyectados con PBS frente a ratones inyectados con LPS. (E) Los niveles globales de H3K9Ac aumentaron en respuesta al tratamiento con LPS. El cambio de pliegue a PBS se normalizó dentro del experimento y el sexo. Prueba t de dos colas no apareadas, t(6)=7,299, p=0,0003. El gráfico de barras representa la media ± SEM. N=8 animales; 2 por condición en 2 experimentos independientes. Haga clic aquí para ver una versión más grande de esta figura.
Para confirmar que el método descrito era comparable a otros métodos utilizados anteriormente para la cuantificación global de la modificación de histonas, nos propusimos utilizar el inmunoblot como herramienta comparativa. Sin embargo, el rendimiento de la microglía aislada es simplemente demasiado bajo para permitir una evaluación razonable. Por lo tanto, utilizamos células BV2 cultivadas para comparar el método de citometría de flujo intracelular con un Western blot (WB). Las células BV2 se cultivaron en medios completos (DMEMF12, 10% FBS, 1x penicilina/estreptamicina y 1x L-glutamina) a 37 °C, 5% CO2. Las células se hicieron pasar con tripsina-EDTA al 0,25% y se sembraron a una densidad de 250.000 células/pocillo y se trataron en medios séricos reducidos (DMEM F12, 2% FBS, 1x penicilina/estreptamicina y 1x L-glutamina) y se dejaron recuperar durante 12 h a 37 °C, 5% CO2. Las células se trataron con 25 ng/mL de LPS durante 24 h antes de la fijación, como se ha descrito anteriormente, o con lisis con un tampón de lisis WB. La señal de H3K27Ac se realizó por ambos métodos con GAPDH utilizado como control de carga para WB. Para cada grupo se determinó el análisis de la intensidad fluorescente normalizada en comparación con el control PBS (Figura 6A). Al examinar el cambio en la señal H3K27Ac normalizada por WB, hubo un aumento de 1,527 veces en la condición tratada con LPS en relación con el control H2O, que se determinó como significativo mediante la prueba t no apareada (t = 3,024, df = 5; p = 0,0293). Al examinar el cambio mediante citometría de flujo, hubo un aumento de 1,482 veces en la condición tratada con LPS que se determinó como significativa (t = 7,843, df = 10; p<0,0001). Utilizando un ANOVA de 2 vías para comparar los métodos, se determinó que había un efecto significativo del tratamiento (F(1,15)=45,21,p<0,0001), pero no del método (F(1,15)=0,05545, p=0,8697) ni de la interacción (F(1,15)=0,02785, p=0,8697). Además, aquí verificamos que no hay cambios en los niveles de histonas H3 tanto por Western blot como por citometría de flujo, ya que el ANOVA de 2 vías no reveló ningún efecto significativo del tratamiento con LPS (F(1,7)=0,02170,p=0,8870), el método (F(1,7)=0,01191, p=0,9162) o la interacción (F(1,7=0,01191, p=0,9162; Figura 6B). También se muestran ejemplos de manchas y cambios de histograma para estos datos (Figura 6C,D).
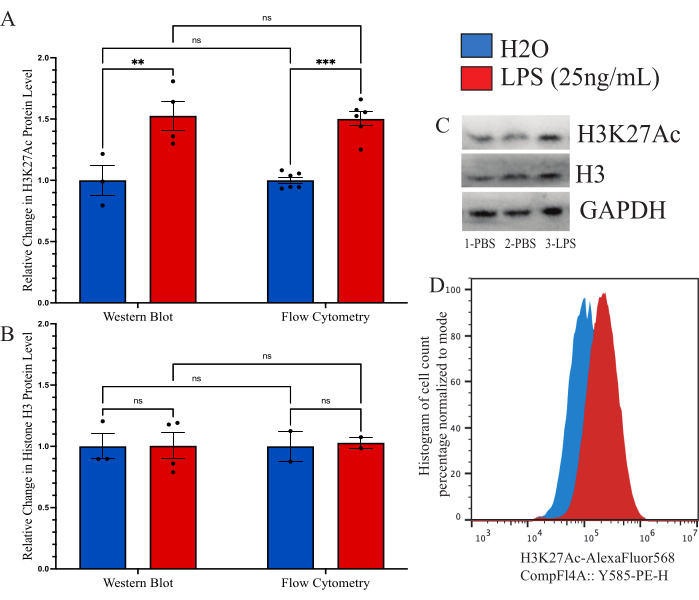
Figura 6: Comparación de métodos para la cuantificación del cambio global de modificación de histonas entre citometría de flujo y Western blot. (A) Las células BV2 se tratan con 25 ng/ml de lipopolisacárido (LPS) oH2O durante 24 h antes del análisis. La intensidad fluorescente de H3K27Ac se representa como un cambio de pliegue en el control del vehículo, solución salina tamponada con fosfato (PBS), tanto para la citometría de flujo como para la Western blot. El ANOVA de 2 vías reveló un efecto significativo del tratamiento con LPS (F(1,15)=45,21, p<0,0001), pero no del método (F(1,15)=0,05545, p=0,8697) ni de la interacción (F(1,15)=0,02785, p=0,8697). Para los residuos se aplicó la corrección de Tukey para la prueba de hipótesis múltiples. * presenta 0,0332, ** presenta 0,0021. (B) La intensidad fluorescente de la histona H3 se representa como un cambio de pliegue a PBS tanto para la citometría de flujo como para la Western blot. El ANOVA de 2 vías no reveló ningún efecto significativo del tratamiento con LPS (F(1,7)=0,02170, p=0,8870) ni del método (F(1,7)=0,01191, p=0,9162) ni de la interacción (F(1,7=0,01191, p=0,9162). (C) Se muestran ejemplos de transferencias y (D) cambios en la citometría de flujo. El tamaño del histograma se normaliza al porcentaje en función del número de células presentes en la intensidad fluorescente del modo. El gráfico de barras representa la media SEM. n=2 experimentos independientes, 2 por condición por experimento. Haga clic aquí para ver una versión más grande de esta figura.
En conjunto, estos resultados muestran que esta técnica se puede utilizar para evaluar cuantitativamente los niveles globales de HPTM en microglía aislada. Además, se demostró que el método era comparable a las técnicas anteriores, pero que requería entradas de células mucho más bajas. Además, aunque no se ha demostrado, con una compensación adecuada, la presente técnica se puede utilizar con múltiples anticuerpos en el mismo panel evaluando diferentes HPTM.
Archivo complementario S1: Archivos de análisis de ejemplo. Este archivo contiene un archivo de análisis wsp y 7 archivos fcs que incluyen el sin tinción, P2RY12FMO, 568FMO, dos animales tratados con PBS y dos animales tratados con LPS teñidos con H3K27Ac. El propósito de este archivo es demostrar el análisis y la activación de un experimento que podría representar cómo se veía un experimento exitoso. Haga clic aquí para descargar este archivo.
Fichero complementario S2: Datos de aislamiento. El archivo incluido contiene los datos relevantes después de la clasificación de la microglía que contiene el rendimiento de microglía y ARN del protocolo descrito. Haga clic aquí para descargar este archivo.
| POBLACIÓN CERRADA | Frecuencia de los padres | Frecuencia de Total | Contar |
| S1 | 89.00% | 89.00% | 25672 |
| S2>S1 | 88.73% | 78.97% | 22779 |
| APC+ > S2 > S1 | 76.61% | 60.50% | 17452 |
| 610+ > APC+ > S2 > S1 | 99.56% | 60.24% | 17376 |
Tabla 2: El gráfico de linaje de muestra de ejemplo muestra los números de porcentaje y eventos necesarios para una detección precisa de proteínas.
Discusión
El protocolo presentado permite la evaluación cuantitativa de los niveles globales de HPTM a través de la citometría de flujo. Si bien este protocolo presenta un método novedoso, estudios previos han realizado una evaluación cuantitativa de las proteínas utilizando un enfoque similar26. Los métodos anteriores utilizados para evaluar los niveles globales de HPTM incluyen inmunohistoquímica y Western blot 16,17,19,20. El método basado en citometría de flujo presentado es un método fácilmente cuantificable, mientras que el Western blot y la inmunohistoquímica son semicuantitativos y tienen un rendimiento más bajo. El Western blot se basa en la lisis celular y, por lo tanto, requiere tanto la normalización de la proteína como una proteína de control de carga que se supone que no ha cambiado en la condición experimental27. La inmunohistoquímica es semicuantitativa y de muy bajo rendimiento, ya que es difícil evaluar cuantitativamente la cantidad de proteína sin examinarla a nivel de una sola célula16. De manera similar, para la microglía aislada, existe un beneficio en el uso del método de citometría de flujo debido al rendimiento limitado, ya que el Western blot requiere un aporte de proteínas mucho mayor19. Los bajos requisitos de número de células permiten que se ejecuten varios paneles de tinción del mismo animal.
Sin embargo, al igual que con cualquier otro método, esta técnica tiene limitaciones, como el costo y la disponibilidad de anticuerpos, ya que no todos los anticuerpos funcionan bien en un entorno de citometría de flujo. Además, en comparación con el inmunoblot, la concentración de anticuerpos requerida es mucho mayor. Si bien la multiplexación permite el uso de múltiples anticuerpos en el mismo panel de células, las células no pueden ser despojadas del anticuerpo después del análisis, lo que limita el uso de células a una por especie de anticuerpo. Esto es diferente de la inmunotransferencia en la que se puede usar la misma transferencia repetidamente. Sin embargo, dependiendo de la disponibilidad de anticuerpos y del número de canales de detección en un citómetro, sería posible examinar hasta una docena de marcas simultáneamente.
El método actual captura solo los niveles globales de expresión de proteínas y no la ubicación genómica específica, y los cambios en los niveles globales pueden no reflejar los cambios en los loci genómicos individuales. Del mismo modo, la falta de cambios en los niveles globales puede no significar que no haya cambios en los loci genómicos, sino simplemente que los cambios globales no supongan diferencias entre los tratamientos. Como tal, esta técnica está destinada a ser utilizada como una pantalla para identificar HPTM de interés para el análisis genómico. Además, este método no permite la comparación entre diferentes marcas de proteínas, excepto cuando se evalúa como un cambio de pliegue para el control. Por lo tanto, esto es limitado en comparación con un método estándar basado en curvas, como ELISA, para la determinación de proteínas.
El protocolo presentado ofrece una estrategia para aislar la microglía cerebral viva. Este protocolo se basa en la expresión de la proteína P2RY12 para el aislamiento de la microglía. Sin embargo, P2RY12 es un marcador homeostático en la microglía y puede ser regulado a la baja en modelos de enfermedad, como 5XFAD22. Por lo tanto, cuando utilice un animal modelo de enfermedad, asegúrese de elegir otras proteínas marcadoras como TMEM119, CD11b o CD45 para ayudar en el aislamiento de la microglía23. Del mismo modo, presentamos este protocolo como aislamiento del hipocampo y/o de la corteza. Este protocolo funcionaría para aislar la microglía de otras regiones del cerebro, incluidas las regiones de la sustancia blanca, sin embargo, es posible que se requieran varios animales para obtener suficiente microglía dependiendo del tamaño de las regiones de interés.
El protocolo presentado puede aislar de forma robusta la microglía cerebral viva, pero hay varios pasos, que se describen a continuación, en la etapa de aislamiento que pueden disminuir el rendimiento celular si se realiza incorrectamente.
Las perfusiones para este protocolo dan como resultado un mayor porcentaje de microglía en el fragmento enriquecido inmunemente, lo que reducirá la cantidad de tiempo en el clasificador. Sin embargo, no se requiere perfusión, y se pueden usar otros métodos de eutanasia si es necesario.
Durante el aislamiento de la microglía, la mielina debe eliminarse por completo. Los citómetros de flujo dependen de que las células puedan viajar a través de tubos estrechos a un ritmo rápido. Debido a su viscosidad y tendencia a aglutinarse, la mielina causa problemas con los citómetros, a menudo causando obstrucciones que pueden dañar el equipo y destruir la muestra, reduciendo drásticamente el rendimiento. Tenga cuidado de eliminar toda la mielina durante la recolección de fragmentos enriquecidos con el sistema inmunológico para evitar tener problemas en el futuro.
Tinción en placa versus tinción con tubo: en este protocolo, describimos dos opciones para teñir células en tubos de 1,5 ml o en una placa de 96 pocillos. El caso de uso de cada uno depende del experimento; Sin embargo, en general, la tinción con tubos tiene un menor riesgo de afectar el rendimiento que la tinción con placas, ya que el flick corre el riesgo de perder células si se realiza incorrectamente. La tinción en placa es mucho más rápida, ya que aspirar el sobrenadante para cada tubo lleva mucho tiempo. Antes de la fijación (para clasificar, etc.), utilice la tinción del tubo para maximizar el rendimiento y reducir el riesgo de pérdida. Sin embargo, para el análisis HPTM, una vez que las células se fijan para la tinción intranuclear, el gránulo es más estable y se reduce el riesgo de pérdida con el parpadeo.
Establecimiento del gradiente de densidad discontinuo: A la hora de establecer las capas, la correcta disposición de las capas es fundamental para obtener la fracción inmunoenriquecida. Si las capas se alteran o se mezclan y parecen turbias, las células no se clasificarán en la ubicación deseada y habrá dificultades para obtener la fracción celular inmunoenriquecida. Si esto ocurre, centrifugar con el medio de densidad para eliminar la mielina y luego recolectar todas las fracciones restantes, diluir con 3 ml de tampón FACS a 1 ml de medio de densidad y mezclar bien (esto requerirá varios tubos). Girar a 500 x g durante 10 min con el freno en 0. Deseche el sobrenadante, dejando solo ~ 300 μL de solución. Recoja toda la muestra y la mancha. Esto producirá porcentajes de clasificación reducidos y una mayor cantidad de tiempo en el citómetro, pero el rendimiento aún puede ser comparable.
Cuando se utiliza el método de aislamiento, es beneficioso poder recolectar células para ARN y para la evaluación de HPTM del mismo cerebro de ratón. En esta situación, después de clasificar la microglía viva, las células se pueden dividir para asignar una parte a la evaluación del ARN (el número mínimo de células de entrada para obtener un rendimiento decente de ARN es de 75.000 células) y una parte para un análisis posterior de citometría de flujo (mínimo 10.000 células por pocillo para una buena determinación de MFI). En este caso, se requiere la clasificación por citómetro de flujo. Sin embargo, cuando solo se planea usar las células para el análisis de HPTM, no se requiere clasificación y la fracción inmune se puede teñir con el anticuerpo P2RY12 y el anticuerpo HPTM. A continuación, se puede configurar la compuerta del citómetro para la microglía P2RY12+, como se haría para la clasificación de flujo, para analizar solo la señal HPTM dentro de la microglía. La eliminación de la clasificación permite que el protocolo sea más rápido y rentable. Además, si se evalúan HPTM a partir de células cultivadas, basta con comenzar con el protocolo de tinción y no se requieren anticuerpos marcadores celulares, como se muestra en la Figura 6. El protocolo de evaluación HPTM se puede utilizar para muchos tipos de células, incluidas las células cultivadas, primarias y derivadas de IPSC.
Por último, aunque solo hemos presentado dos usos potenciales de la microglía después del aislamiento, hay muchos otros que incluyen técnicas epigenéticas como ChIP, CUT&Tag y CUT&RUN. En el caso de las técnicas epigenéticas genómicas, en las que la caracterización de los cambios en loci específicos es de interés, se deben elegir inhibidores específicos para los escritores y borradores de las marcas de cromatina11 adaptados a los experimentos, a fin de garantizar que las modificaciones epigenéticas microgliales perfiladas no sean artefactos técnicos de ninguna etapa del procedimiento de aislamiento, como la digestión enzimática. Al evaluar los cambios en los niveles globales de marcas epigenéticas, por ejemplo, mediante el uso de citometría de flujo cuantitativa, no se espera que los cambios inducidos por el procedimiento sean tan grandes como para que se detecten a nivel global.
En general, los métodos discutidos proporcionan un método novedoso de una sola célula para cuantificar los niveles globales de modificaciones de histonas y otros cambios epigenéticos mediante citometría de flujo. Demostramos que este método es lo suficientemente sensible como para detectar cambios globales en el marcador potenciador H3K27ac en microglía en respuesta a LPS in vivo. Esto es consistente con la secuenciación previa de ChIP de H3K27ac después de la estimulación de LPS que muestra una remodelación dramática de los potenciadores que responden a LPS28. Las aplicaciones de este método permitirán examinar los cambios epigenéticos globales en diferentes tipos de células cerebrales en desarrollo y enfermedad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Gracias a Yanyang Bai por ayudar con la inmunotransferencia en la Figura 5. Este trabajo contó con el apoyo de los Institutos Canadienses de Investigación en Salud [CRC-RS 950-232402 a AC]; Consejo de Investigación en Ciencias Naturales e Ingeniería de Canadá [RGPIN-2019-04450, DGECR-2019-00069 a AC]; la Fundación Benéfica del Rito Escocés [21103 a AC] y la Fundación Brain Canada [AWD-023132 a AC]; Beca de posgrado para aborígenes de la Universidad de Columbia Británica (6481 a MT); Beca de Posgrado de Columbia Británica (6768 a MT); Premio Estudiantil Académico de la Plataforma Abierta de Neurociencia Canadiense (10901 a JK); Beca doctoral de cuatro años de la Universidad de Columbia Británica (6569 a JK). Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y el análisis de datos, la decisión de publicar o la preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5M EDTA | Invitrogen | AM9260G | |
| 15 mL Falcon Centrifuge Tubes, Polypropylene, Sterile | Falcon | 352196 | |
| 24-well Clear Not Treated Plates | Costar | 3738 | |
| 2-Mercaptoethanol | Gibco | 21985023 | |
| 96 Well Clear Polystyrene Microplate, clear round bottom, non treated surface | Corning | 3788 | |
| Acetyl Histone 3 K9 (C5B11) | Cell Signalling Technology | 9649S | Dilution: 1:100 |
| Acetyl Histone H4 K8 (2594) | Cell Signalling Technology | 2594S | Dilution: 1:100 |
| Acetyl-Histone H3 K27 (D5E4) | Cell Signalling Technology | 8173S | Dilution: 1:100 |
| Acetyl-Histone H3 Lys27 (MA523516) | Invitrogen | MA523516 | Dilution: 1:100 |
| Actinomycin D | New England Biolabs | 15021S | |
| Anisomycin | New England Biolabs | 2222S | |
| Anti-Histone H3 (tri methyl K4) | Abcam | ab213224 | Dilution: 1:100 |
| Anti-Lactyl-Histone H4 (Lys 12) Rabbit mAb | PTM Biolabs | PTM-1411RM | Dilution: 1:250 |
| Anti-L-Lactyllysine Rabbit pAb | PRM Biolabs | PTM-1401RM | Dilution: 1:250 |
| Apc anti-P2RY12 Antibody, Clone: S16007D | BioLegend | 848006 | |
| BSA | Tocris | 5217 | |
| Cyto-Last Buffer | BioLegend | 422501 | |
| dimethylsulfoxide, sterile | Cell Signalling Technology | 12611S | |
| DNAse I | STEMCELL Technologies | 07900 | |
| Donkey Anti Mouse AlexaFluor488 | Jackson ImmunoResearch | 715-546-150 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor488 | ABclonal | AS035 | Dilution: 1:500 |
| Donkey Anti Rabbit AlexaFluor568 | Invitrogen | A10042 | Dilution: 1:500 |
| Donkey Anti Rabbit Brilliant Violet 421 | BioLegend | 406410 | Dilution: 1:500 |
| Fisherbrand Disposable Graduated Transfer Pipettes | Fisherbrand | 13-711-9AM | |
| Fisherbrand Disposable PES Filter Unit, 250mL | Fisherbrand | FB12566502 | |
| H3K18ac Polyclonal Antibody | Invitrogen | 720095 | Dilution: 1:100 |
| HBSS (10X), no calcium, no magnesium, no phenol red | Gibco | 14185052 | |
| HBSS, no calcium, no magnesium, no phenol red | Gibco | 14175103 | |
| Histone 3 Trimethyl K27 (ab6002) | Abcam | ab6002 | Dilution: 1:100 |
| KONTES Dounce Tissue Grinders 125mm 7mL | VWR | 885300-0007 | |
| Lactyl-Histone H3 (Lys 18) Rabbit mAb | PTM BIolabs | PTM-1406RM | Dilution: 1:250 |
| Lipopolysacharide | Sigma-Aldrich | L5418 | |
| Normal Donkey Serum | Jackson ImmunoResearch | 017-000-121 | |
| OneComp eBeads Compensation Beads | Invitrogen | 01-1111-41 | |
| PDS Kit, Papain Vial - Worthington Biochemical | Cedarlane | LK003178 | |
| Percoll | Sigma-Aldrich | GE17-0891-02 | |
| Phenol Red | VWR | RC57004 | |
| QIAshredder | Qiagen | 79656 | |
| Rainbow Fluorescent Particles, 1 peak (3.0-3.4 uM - Mid Range Intensity | BioLegend | 422905 | |
| RNase-free Microfuge Tubes, 1.5 mL | Invitrogen | AM12400 | |
| Rneasy Plus Micro Kit | Qiagen | 74034 | |
| Round Bottom Polypropylene Tubes with Caps, 5 mL | Corning | 352063 | |
| Triptolide | New England Biolabs | 97539 | |
| True Nuclear Transcription Factor Buffer Set | BioLegend | 424401 | |
| TruStain FcX PLUS (anti-mouse CD16/32) Antibody | BioLegend | 156604 | |
| Trypan Blue | VWR | 97063-702 | |
| Zombie Aqua Fixable Viability Kit | BioLegend | 423102 |
Referencias
- Miller, J. L., Grant, P. A. The Role of DNA Methylation and Histone Modifications in Transcriptional Regulation in Humans. Epigenetics: Development and Disease. 61, 289-317 (2013).
- Kouzarides, T. Chromatin Modifications and Their Function. Cell. 128 (4), 693-705 (2007).
- Bannister, A. J., Kouzarides, T. Regulation of chromatin by histone modifications. Cell Research. 21 (3), 381-395 (2011).
- Barski, A., et al. High-resolution profiling of histone methylations in the human genome. Cell. 129 (4), 823-837 (2007).
- Vogel Ciernia, A., LaSalle, J. The landscape of DNA methylation amid a perfect storm of autism aetiologies. Nature Reviews. Neuroscience. 17 (7), 411-423 (2016).
- Keiser, A. A., et al. Systemic HDAC3 inhibition ameliorates impairments in synaptic plasticity caused by simulated galactic cosmic radiation exposure in male mice. Neurobiology of Learning and Memory. 178, 107367 (2021).
- McQuown, S. C., et al. HDAC3 is a critical negative regulator of long-term memory formation. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31 (2), 764-774 (2011).
- Barrett, R. M., et al. Hippocampal Focal Knockout of CBP Affects Specific Histone Modifications, Long-Term Potentiation, and Long-Term Memory. Neuropsychopharmacology. 36 (8), 1545-1556 (2011).
- Datta, M., et al. Histone Deacetylases 1 and 2 Regulate Microglia Function during Development, Homeostasis, and Neurodegeneration in a Context-Dependent Manner. Immunity. 48 (3), 514.e6-529.e6 (2018).
- Belhocine, S., et al. Context-dependent transcriptional regulation of microglial proliferation. Glia. 70 (3), 572-589 (2022).
- Gosselin, D., et al. An environment-dependent transcriptional network specifies human microglia identity. Science (New York, N.Y.). 356 (6344), eaal3222 (2017).
- Kettenmann, H., Hanisch, U. -. K., Noda, M., Verkhratsky, A. Physiology of Microglia. Physiological Reviews. 91 (2), 461-553 (2011).
- Sullivan, O., Ciernia, A. V. Work hard, play hard: how sexually differentiated microglia work to shape social play and reproductive behavior. Frontiers in Behavioral Neuroscience. 16, 989011 (2022).
- Das, P. M., Ramachandran, K., vanWert, J., Singal, R. Chromatin immunoprecipitation assay. BioTechniques. 37 (6), 961-969 (2004).
- Mahmood, T., Yang, P. C. Western blot: technique, theory, and trouble shooting. North American Journal of Medical Sciences. 4 (9), 429-434 (2012).
- Crowe, A., Yue, W. Semi-quantitative Determination of Protein Expression Using Immunohistochemistry Staining and Analysis: An Integrated Protocol. BIO-PROTOCOL. 9 (24), (2019).
- Seligson, D. B., et al. Global histone modification patterns predict risk of prostate cancer recurrence. Nature. 435 (7046), 1262-1266 (2005).
- Liu, B., et al. Global Histone Modification Patterns as Prognostic Markers to Classify Glioma Patients. Cancer Epidemiology, Biomarkers & Prevention. 19 (11), 2888-2896 (2010).
- Pan, R. Y., et al. Positive feedback regulation of microglial glucose metabolism by histone H4 lysine 12 lactylation in Alzheimer's disease. Cell Metabolism. 34 (4), 634.e6-648.e6 (2022).
- Zhang, D., et al. Metabolic regulation of gene expression by histone lactylation. Nature. 574 (7779), 575-580 (2019).
- Pösel, C., Möller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), 53658 (2016).
- Oblak, A. L., et al. Comprehensive Evaluation of the 5XFAD Mouse Model for Preclinical Testing Applications: A MODEL-AD Study. Frontiers in Aging Neuroscience. 13, 713726 (2021).
- Bohlen, C. J., Bennett, F. C., Bennett, M. L. Isolation and Culture of Microglia. Current Protocols in Immunology. 125 (1), e70 (2019).
- McKinnon, K. M. Multiparameter Conventional Flow Cytometry. Flow Cytometry Protocols. 1678, 139-150 (2018).
- Marsh, S. E., et al. Dissection of artifactual and confounding glial signatures by single-cell sequencing of mouse and human brain. Nature Neuroscience. 25 (3), 306-316 (2022).
- Wang, L., Gaigalas, A. K., Marti, G., Abbasi, F., Hoffman, R. A. Toward quantitative fluorescence measurements with multicolor flow cytometry. Cytometry Part A. 73A (4), 279-288 (2008).
- Rumbaugh, G., Miller, C. A. Epigenetic changes in the brain: measuring global histone modifications. Methods in Molecular Biology (Clifton, N.J). 670, 263-274 (2011).
- Xavier, A. M., et al. Systematic delineation of signaling and epigenomic mechanisms underlying microglia inflammatory activity in acute and chronic brain pathologies. BioRvix. , (2022).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados