需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
改良尾静脉和静脉穿刺用于大鼠模型中的血液采样
* 这些作者具有相同的贡献
摘要
在这里,我们提出了一种协议,为大鼠模型提供快速,简单和可靠的血液采集替代方案。我们根据上下文描述了三种不同的血液采样方法:麻醉下或有意识的动物的尾静脉穿刺,以及麻醉下的背静脉穿刺。
摘要
大多数实验动物设计都需要血液样本来评估各种血液学参数。本文介绍了两种大鼠采血程序:侧尾静脉穿刺和背静脉穿刺,与其他先前描述的技术相比具有显着优势。该研究表明,这两种程序允许快速采样(10 分钟内)并为大多数测定(202 μL ± 67.7 μL)产生足够的血容量。背静脉穿刺必须在麻醉下进行,而侧尾静脉穿刺可以在有意识、约束的动物身上进行。
因此,交替使用这两种技术可以在任何情况下抽血。虽然始终建议在手术过程中协助操作员以确保动物福利,但这些技术只需要一名操作员,这与大多数需要两名血液采样方法不同。此外,虽然这些先前描述的方法(例如颈静脉棒,锁骨下静脉抽血)需要广泛的事先训练以避免动物的伤害或死亡,但尾静脉和背静脉穿刺很少是致命的。由于所有这些原因,并根据具体情况(例如,对于包括雄性大鼠的研究,在围手术期或术后立即,对于尾静脉细的动物),这两种技术可以交替使用以实现重复抽血。
引言
血液采样对于大多数动物研究都是必要的,无论是 体内 还是 体外。在大鼠中,由于血液采样的频率和数量可能很大,因此有不同的收集选择是有帮助的。在以前的研究中已经描述了各种方法。
最常用的技术是尾静脉穿刺和大隐静脉抽血。尾静脉取样适用于所有大鼠品系。通过适当的训练,该程序易于执行,并且对动物造成的痛苦最小1.同样,大隐静脉抽血,只要操作得当,也是一种快速简单的采集方法。这两种方法都不需要麻醉,并且都允许重复抽取少量血液。然而,大隐静脉穿刺通常产生较低的血容量1 ,并且需要两个人在场,留下一个后肢暴露进行穿刺2。
如果需要从单个动物收集大量血液,可以使用心脏穿刺或腔静脉穿刺(可以从心脏穿刺的 150 g 大鼠中抽取多达 10 mL 的血液2)。这些技术需要麻醉,并且是终末程序。在这两种技术中的任何一种之后,动物都必须被安乐死2.颈静脉棒是一种替代方案,如果在尚未达到终点的研究中需要收集大量血液,可以使用。然而,这种技术还需要大量的技术技能来避免对动物造成伤害;因此,应限制其使用3。
其他技术,如锁骨下静脉抽血,在采血前不需要使用麻醉剂,并允许对少量血液进行重复采样。然而,这种技术需要克制的处理和适当的针切口。操作不当可能导致动物疼痛甚至死亡,这种方法的培训可能很挑剔4.
其他轶事程序包括眼眶穿刺和舌下静脉穿刺,两者都需要麻醉剂,既不推荐也不广泛使用。尽管先前的研究表明,通过眼眶穿刺比尾静脉穿刺更快地采血,但发现在乙醚麻醉下进行眼眶穿刺的耐受性不如后一种方法(基于动物的兴奋评分和尿液产生)5。此外,这种方法在很大程度上受到执行该程序的人的技能的影响,并且主要由经验丰富的兽医执行。相比之下,舌下静脉穿刺的痛苦较小,建议重复采血6。然而,这种技术存在严重的不良反应,例如食物和水摄入量减少,这可能导致动物死亡7。
本研究描述了我们实验室用于重复血液采样的两种方法。尾静脉穿刺可以对有意识的动物进行,组织损伤和不良反应很小。在这项研究中,这项技术的修改包括用食指和中指稳定尾巴,这允许单个操作员进行采血。背静脉穿刺已被描述为简单的静脉注射。该技术在麻醉下进行,并在其他方法遇到困难的情况下(例如,在术后立即,与小动物一起,在麻醉下进行围手术期抽血时)允许可靠的血源。与尾静脉取样类似,与上述技术相比,穿刺部位的损伤对动物的整体影响较小8.该方法论文的目的是根据上下文为没有经验的研究人员提供简单可靠的血液采样替代方案(例如,对于在麻醉下进行的手术,对于包括雄性大鼠的研究,对于具有细尾静脉的动物)。
研究方案
该程序在3个月大的雄性刘易斯大鼠上进行,每只重300-400克。共纳入24只动物,具有3种穿刺条件:12只大鼠在无麻醉的情况下进行尾静脉穿刺(组TV无麻醉),另外12只大鼠被麻醉进行尾静脉穿刺(组TV麻醉)和静脉穿刺(组PV麻醉)。所有程序均已获得批准,并遵守机构动物护理和使用委员会(IACUC)的指导方针。所有动物在研究结束时(随访1个月后)通过二氧化碳过量被安乐死。有关与本协议中使用的所有材料和仪器有关的详细信息,请参阅 材料表 。
1. 一般准则
- 根据 IACUC 指南,确保每 2 周抽取的最大血容量不超过总血容量的 10%9。例如,一只 300 g 的大鼠的总血容量应约为 19.2 mL。对于仅在第一周(第 0 天、第 1 天、第 3 天、第 7 天)需要抽血四次的方案,请将每个样品的采集限制为最多 250 μL。
- 对于在麻醉下进行的手术,通过精密蒸发器 施 用异氟醚以麻醉动物。在剂量为3%-5%异氟醚的腔室中诱导麻醉5分钟,并在手术过程中通过鼻锥使用1%-3%异氟烷的剂量维持。根据呼吸频率的连续监测调整异氟烷水平。在开始手术之前,通过捏住脚趾来验证镇静是否足够。
- 在手术过程中或直到动物恢复足够的意识以维持胸骨卧位之前,不要让动物无人看管。
- 采血后,监测动物直到完全康复,然后再将其放回笼子,并且在完全恢复之前不要将其引入其他动物的陪伴下。
注意:与兽医服务达成协议,尾静脉或阴茎静脉穿刺后不需要术后止痛药。
2. 从静脉抽血
- 制备
- 准备以下设备:无菌纱布,手套,酒精湿巾,微毛细血管采血EDTA管(紫色帽)和30 G胰岛素注射器(30 U或50 U)。
- 将大鼠从笼子中取出,并将其放入室中,通过精密蒸发器(剂量:3%-5%) 用 异氟醚诱导。一旦动物被镇静,将其转移到手术台上,然后将动物仰卧,鼻子放在鼻锥中以维持麻醉。监测呼吸频率,并相应地调整异氟醚水平(维持剂量:1%-3%)。在开始手术之前,通过捏脚趾来验证动物是否有足够的镇静剂。
- 血液采样
- 在注射器中来回移动柱塞几次以平滑退出。通过拉动柱塞去除几微升,在注射器中产生负压。
- 在非惯用手的帮助下,将包皮从阴茎末端收回,并在食指和拇指之间握住龟头,轻轻拉动。背静脉将显示为浅表蓝带。请参见图 1 和 图 2。
- 针眼朝上,将胰岛素注射器以35°角插入静脉。一旦针头进入静脉,血液就会流入注射器。
- 以缓慢而稳定的速率缓慢抽出注射器的柱塞以收集所需的体积。
注意:不要太快地抽出柱塞,因为这会导致静脉塌陷并停止血流。 - 如果血流量减少,请顺时针或逆时针稍微旋转。
- 取出注射器。穿刺部位会形成血滴,在非无菌手术的情况下,抽吸将允许收集更多的微升血液。
- 如果第一次穿刺失败,请将针头重新插入静脉近端。
注意:与尾静脉取样不同,背静脉的迭代穿刺通常不成功。 - 对穿刺部位施加轻微压力以止血,并用新的酒精湿巾擦拭该区域。
- 将阴茎放回中性位置。
- 关闭异氟醚,并监测大鼠直到完全恢复。将老鼠放回笼子里。
3.尾静脉穿刺
- 制备
- 准备以下设备:塑料约束架,无菌纱布,手套,酒精湿巾,微毛细血管采血EDTA管(紫色帽)和28 G 1/2胰岛素注射器(30 U或50 U)。
- 将老鼠从笼子里拿出来,并迅速将其固定在塑料约束锥中。关闭尾巴底部周围的锥体大端。确保动物舒适,并且在整个过程中呼吸不受限制。
- 将尾巴浸入温水(37°C)中约1分钟以扩张静脉。用纸巾擦干尾巴。将动物(在其约束器中)面朝下放置,尾巴放在加热垫上。
- 通过将整个动物旋转到任一侧来选择右尾静脉或左尾静脉(蓝线)进行采样(这样可以避免尾巴扭曲)。使用尾巴的末端三分之一进行血管穿刺,因为血管在这个区域变得更加浅表。动脉为腹侧,两条静脉为外侧10。
- 在穿刺部位用70%乙醇湿巾擦拭尾巴。
- 将尾巴放在加热垫的边缘,在尾巴的末端三分之一处形成一个角度。这将静脉带到表面,并为取样创造更多空间。
- 血液采样
- 在注射器中来回移动柱塞几次以平滑退出。通过拉动柱塞去除几微升,在注射器中产生负压。
- 在非惯用食指和中指的帮助下,将尾巴平放在加热垫上。将中指放在近端,食指放在远端,穿刺部位在这两根手指之间。对中指施加比食指更大的压力以固定尾巴,仅在近端阻塞血管并让血液淤积。请参见图 1 和 图 3。
- 针眼朝上,将胰岛素注射器滑过食指,直到将其插入静脉(这在针头和尾部之间产生35°的角度)。一旦针头进入静脉,血液就会流入注射器。此时,释放食指和中指上的压力,以确保血流不被阻塞。
- 以稳定的速率缓慢抽出注射器的柱塞以收集所需的体积。
注意:不要太快地拔出柱塞;这将导致静脉塌陷并停止血液流动。 - 如果血流量减少,请向任一方向稍微旋转针头。
- 从尾部取出注射器。尾巴的穿刺部位会形成血滴。在非无菌手术的情况下,抽吸这种血液允许收集更多的微升血液。
- 如果第一次穿刺失败,请将针头重新插入静脉近端。
注意:静脉在接近尾基时逐渐变得更深。如果注射器中没有血流,请增加注射器和尾部之间的角度,或旋转针头。 - 对穿刺部位施加压力以止血,并用新的酒精湿巾擦拭该区域。将大鼠从塑料锥中取出,然后将其放回笼子中。
- 麻醉下尾静脉穿刺
- 执行步骤2.1.1和步骤2.1.2以诱导和维持麻醉。
- 执行步骤3.1.3-3.2.7进行采血;参见 图1。
- 执行步骤 2.2.10 以进行动物恢复。
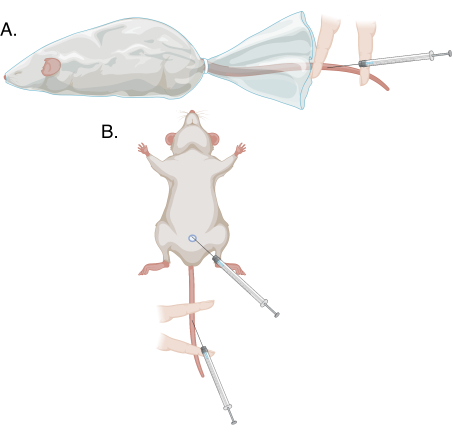
图1:本协议中不同穿刺方法的示意图。 (A)对有意识的、克制的动物进行改良的尾静脉穿刺;(二)麻醉下改良尾静脉穿刺和静脉穿刺。 请点击此处查看此图的大图。
结果
成功定义为抽血在 10 分钟内(从穿刺时间到采血结束)产生至少 100 μL 的血液,失败定义为抽血产生少于 100 μL 的血液或需要超过 10 分钟才能取回所需的血容量。每个样品最多允许 250 μL 血液。统计分析采用单因素方差分析检验进行多重比较和卡方检验。数据以平均值±标准差表示, p < 0.05 作为确定统计显著性的临界值。
比较成功率显示,清醒大鼠尾静脉穿刺(92%)...
讨论
尾静脉穿刺是从有意识的大鼠身上获取血液的有效方法。然而,当动物处于麻醉状态时,异氟醚的作用会导致血管痉挛,并使尾静脉穿刺不合适11。如本研究所示,在这种情况下的另一种选择是从静脉收集血液,这更成功,并且在更短的时间内产生显着更大的血液量。请务必记住,如果此方法在第一次尝试时失败,则后续尝试可能会失败。相比之下,尾静脉穿刺允许在第一次尝?...
披露声明
作者均无任何利益冲突需要声明。
致谢
这项工作由Shriners Children's Boston(B. E. U., K.U., C.L.C.)资助。L.C.由“La Bourse des Gueules Cassées”,“La Bourse Année Recherche”和“La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris”资助。Y.B.由“La Bourse des Gueules Cassées”资助。Y.B.和I.F.v.R.由Shriners儿童医院资助(奖学金ID分别为#84308-BOS-22 #84302-BOS-21)。本材料部分基于美国国家科学基金会根据资助号支持的工作。欧洲经济共同体1941543。非常感谢美国国立卫生研究院(R01EB028782、R56AI171958 和 R01DK114506)的部分支持。图 1 是使用 BioRender.com 创建的。
材料
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
参考文献
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。