Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Sıçan Modelinde Kan Örneklemesi için Modifiye Kuyruk Veni ve Penil Ven Delinmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada, sıçan modeli için hızlı, kolay ve güvenilir kan alma alternatifleri sunmak için bir protokol sunuyoruz. Bağlama göre üç farklı kan örnekleme yöntemini tanımlıyoruz: anestezi altında veya bilinçli bir hayvanda kuyruk damarı delinmesi ve anestezi altında dorsal penil ven delinmesi.
Özet
Çeşitli hematolojik parametreleri değerlendirmek için çoğu deneysel hayvan tasarımında kan örnekleri gereklidir. Bu yazıda sıçanlarda kan toplanması için iki prosedür sunulmaktadır: lateral kuyruk damarı delinmesi ve dorsal penil ven ponksiyonu, daha önce tarif edilen diğer tekniklere göre önemli avantajlar sunmaktadır. Bu çalışma, bu iki prosedürün hızlı örneklemeye (10 dakikadan az) izin verdiğini ve çoğu tahlil için yeterli kan hacmi verdiğini göstermektedir (202 μL ± 67.7 μL). Dorsal penil ven delinmesi anestezi altında yapılmalıdır, oysa lateral kuyruk damarı delinmesi bilinçli, kısıtlanmış bir hayvan üzerinde yapılabilir.
Bu nedenle, bu iki tekniğin değiştirilmesi, her durumda kan alımını sağlar. Hayvan refahını sağlamak için bir prosedür sırasında bir operatöre yardım edilmesi her zaman tavsiye edilirken, bu teknikler iki gerektiren çoğu kan örnekleme yönteminin aksine, yalnızca tek bir operatör gerektirir. Dahası, daha önce tarif edilen bu yöntemler (örneğin, juguler çubuk, subklaviyen ven kan alımı), hayvanın zarar görmesini veya ölümünü önlemek için kapsamlı bir ön eğitim gerektirirken, kuyruk damarı ve dorsal penil ven delinmesi nadiren ölümcüldür. Tüm bu nedenlerden dolayı ve bağlama göre (örneğin, erkek sıçanları içeren çalışmalar için, ameliyat öncesi veya hemen postoperatif dönemde, ince kuyruk damarları olan hayvanlar için), her iki teknik de tekrarlanan kan alımını sağlamak için dönüşümlü olarak kullanılabilir.
Giriş
Kan örneklemesi, hem in vivo hem de in vitro olarak çoğu hayvan çalışması için gereklidir. Sıçanlarda, kan örneklemesinin sıklığı ve miktarı önemli olabileceğinden, toplama için farklı alternatiflere sahip olmak yararlıdır. Önceki çalışmalarda çeşitli yöntemler tanımlanmıştır.
En sık kullanılan teknikler kuyruk veni ponksiyonu ve safen ven kan alımıdır. Kuyruk damarı örneklemesi tüm sıçan suşları için uygundur. Uygun eğitim ile, prosedürün gerçekleştirilmesi basittir ve hayvana minimum sıkıntıya neden olur1. Benzer şekilde, safen ven kan alımı, uygun şekilde yapılması şartıyla, hızlı ve basit bir toplama yöntemidir. Her iki yöntem de anestezi gerektirmez ve her ikisi de az miktarda kanın tekrar tekrar çekilmesine izin verir. Bununla birlikte, safen ven ponksiyonu genellikle daha düşük bir kan hacmi1 verir ve bir arka bacağı delinme2 için açıkta bırakmak için iki kişinin varlığını gerektirir.
Tek bir hayvandan büyük miktarda kan toplanması gerekiyorsa, vena kavanın kardiyak delinmesi veya delinmesi kullanılabilir (kardiyak ponksiyon2 olan 150 g'lık bir sıçandan 10 mL'ye kadar kan alınabilir). Bu teknikler anestezi gerektirir ve terminal prosedürlerdir. Hayvan, bu iki teknikten herhangi birinden sonra ötenazi yapılmalıdır2. Juguler çubuk, henüz son noktasına ulaşmamış bir çalışmada büyük miktarda kan toplanması gerektiğinde kullanılabilecek bir alternatiftir. Bununla birlikte, bu teknik aynı zamanda hayvana zarar vermemek için önemli teknik beceriler gerektirir; Bu nedenle, kullanımı sınırlı olmalıdır3.
Subklaviyen ven kan alımı gibi diğer teknikler, kan alımından önce anestezik kullanımına ihtiyaç duymaz ve küçük hacimli kanın tekrar tekrar örneklenmesine izin verir. Bununla birlikte, bu teknik için kısıtlı kullanım ve uygun iğne insizyonu gereklidir. Uygun olmayan bir operasyon hayvan ağrısına ve hatta ölümle sonuçlanabilir ve bu yöntem için eğitim titiz olabilir4.
Diğer anekdot prosedürleri, her ikisi de anestezi gerektiren orbital ponksiyon ve dil altı ven ponksiyonunu içerir ve ne tavsiye edilir ne de yaygın olarak kullanılır. Önceki çalışmalar, orbital ponksiyon ile kuyruk damarı delinmesinden daha hızlı kan toplanmasını göstermesine rağmen, dietil-eter anestezisi altında orbital ponksiyonun ikinci yöntemden daha az iyi tolere edildiği bulunmuştur (hayvanların uyarma skorlarına ve idrar üretimine dayanarak)5. Ayrıca, bu yöntem prosedürü gerçekleştiren kişinin becerisinden oldukça etkilenir ve esas olarak deneyimli veteriner hekimler tarafından gerçekleştirilir. Benzer şekilde, dil altı ven ponksiyonu daha az rahatsız edicidir ve tekrarlanan kan örneklemesi için önerilir6. Bununla birlikte, bu teknik, hayvanın ölümüne yol açabilecek yiyecek ve su alımının azalması gibi ciddi yan etkiler sunar7.
Bu çalışmada laboratuvarımızda tekrarlanan kan örneklemesi için kullanılan iki yöntem tanımlanmaktadır. Kuyruk damarı delinmesi bilinçli bir hayvan üzerinde yapılabilir ve doku hasarı ve yan etkiler minimumdur. Bu çalışmada bu tekniğin modifikasyonu, kuyruğun işaret ve orta parmak ile stabilize edilmesini içerir, bu da tek bir operatörün kan alımını gerçekleştirmesine izin verir. Dorsal penil ven ponksiyonu, basit intravenöz enjeksiyonlar için zaten tanımlanmıştır. Bu teknik anestezi altında gerçekleştirilir ve diğer yöntemlerle ilgili zorluklar durumunda güvenilir bir kan kaynağı sağlar (örneğin, ameliyat sonrası dönemde, küçük bir hayvanla, anestezi altında perioperatif kan alımı yapılırken). Kuyruk damarı örneklemesine benzer şekilde, delinme bölgesindeki yaralanma, yukarıda belirtilen tekniklere kıyasla hayvan üzerinde küçük bir genel etkiye sahip olacaktır. 8. Bu yöntem makalesinin amacı, deneyimsiz araştırmacılara bağlama göre basit ve güvenilir kan örnekleme alternatifleri sunmaktır (örneğin, anestezi altında yapılan prosedürler için, erkek sıçanları içeren çalışmalar için, ince kuyruk damarları olan hayvanlar için).
Protokol
İşlemler, her biri 300-400 g ağırlığındaki 3 aylık erkek Lewis sıçanları üzerinde gerçekleştirildi. Üç delinme koşulu ile toplam 24 hayvan dahil edildi: 12 sıçana anestezi olmadan kuyruk damarı delinmesi (anestezisiz grup TV) ve diğer 12 sıçan hem kuyruk damarı delinmesi (anestezi ile grup TV) hem de penil ven ponksiyonu (anestezi ile grup PV) için anestezi uygulandı. Tüm prosedürler onaylandı ve Kurumsal Hayvan Bakımı ve Kullanımı Komitesi (IACUC) yönergelerine uyuldu. Tüm hayvanlar, çalışmanın sonunda (1 aylık bir takipten sonra) aşırı dozda karbondioksit ile ötenazi yapıldı. Bu protokolde kullanılan tüm malzemeler ve aletlerle ilgili ayrıntılar için Malzeme Tablosuna bakınız.
1. Genel kurallar
- IACUC kılavuzlarına uygun olarak, alınan maksimum kan hacminin her 2 haftada bir toplam kan hacminin% 10'undan fazla olmadığından emin olun9. Örneğin, 300 g'lık bir sıçanın toplam kan hacmi yaklaşık 19.2 mL'dir. Sadece ilk haftada dört kan alımı gerektiren bir protokol durumunda (gün 0, gün 1, gün 3, gün 7), toplamayı numune başına maksimum 250 μL kan ile sınırlandırın.
- Anestezi altında gerçekleştirilen prosedürler için, hayvanı uyuşturmak için hassas bir buharlaştırıcı aracılığıyla izofluran uygulayın. 5 dakika boyunca% 3-5 izofluran dozunda bir odada anestezi indükleyin ve işlem sırasında bir burun konisinden % 1-3 izofluran dozu kullanmaya devam edin. Solunum hızının sürekli izlenmesine bağlı olarak izofluran seviyesini ayarlayın. İşleme başlamadan önce ayak parmağınızı sıkıştırarak sedasyonun yeterli olup olmadığını doğrulayın.
- İşlem sırasında veya sternal yatmayı sürdürmek için yeterli bilinci yeniden kazanana kadar hayvanı gözetimsiz bırakmayın.
- Kan toplanmasından sonra, hayvanı kafesine geri döndürmeden önce tamamen iyileşene kadar izleyin ve tamamen iyileşene kadar diğer hayvanların şirketine tanıtmayın.
NOT: Veteriner hizmetleri ile mutabık kalınarak, kuyruk damarı veya penis damarı delinmesinden sonra işlem sonrası ağrı kesici ilaç gerekli değildi.
2. Penis damarından kan alımı
- Hazırlık
- Aşağıdaki ekipmanı hazırlayın: steril gazlı bez, eldiven, alkollü mendil, mikrokapiller kan toplama EDTA tüpü (mor kapak) ve 30 G insülin şırıngası (30 U veya 50 U).
- Sıçanı kafesinden çıkarın ve hassas bir buharlaştırıcı aracılığıyla izofluran ile indüksiyon için bir odaya koyun (doz:% 3 -% 5). Hayvan sakinleştirildikten sonra, prosedür masasına aktarın ve anesteziyi korumak için burnunu burun konisine yerleştirerek hayvanı sırt üstü yatırın. Solunum hızını izleyin ve izofluran seviyesini buna göre ayarlayın (idame dozu:% 1 -% 3). Prosedüre başlamadan önce hayvanın ayak parmağı tutamağı ile yeterince sakinleştirildiğini doğrulayın.
- Kan örneklemesi
- Geri çekilmeyi yumuşatmak için pistonu şırıngada birkaç kez ileri geri hareket ettirin. Birkaç mikrolitreyi çıkarmak için pistonu çekerek şırıngada negatif basınç oluşturun.
- Baskın olmayan elin yardımıyla, sünnet derisini penisin ucundan geri çekin ve glansları işaret ile başparmak arasında tutarak yavaşça çekin. Dorsal penil ven yüzeysel mavi bir kordon olarak görünecektir. Bkz. Şekil 1 ve Şekil 2.
- İğnenin gözü yukarı bakacak şekilde, insülin şırıngasını damarın içine 35 ° 'lik bir açıyla yerleştirin. İğne damara girdikten sonra, kan şırıngaya akacaktır.
- İstenilen hacmi toplamak için şırınganın pistonunu yavaş ve sabit bir hızda yavaşça çekin.
NOT: Pistonu çok hızlı çekmeyin, çünkü bu damarın çökmesine ve kan akışının durmasına neden olur. - Kan akışı azalırsa, iğneyi saat yönünde veya saat yönünün tersine hafifçe döndürün.
- Şırıngayı çıkarın. Delinme bölgesinde, aspirasyonu steril olmayan bir prosedür durumunda birkaç mikrolitre daha kan toplanmasına izin verecek bir kan damlası oluşacaktır.
- İlk delinme başarısız olursa, iğneyi damar üzerine daha yakın bir şekilde tekrar yerleştirin.
NOT: Kuyruk damarı örneklemesinden farklı olarak, dorsal penil venin yinelemeli delinmesi genellikle başarısız olur. - Kanamayı durdurmak için delinme bölgesine hafif basınç uygulayın ve bölgeyi yeni bir alkollü mendille silin.
- Penisi tekrar nötr konumuna getirin.
- İzofluranı kapatın ve tamamen iyileşene kadar sıçanı izleyin. Sıçanı kafesine geri döndürün.
3. Kuyruk damarı delinmesi
- Hazırlık
- Aşağıdaki ekipmanı hazırlayın: plastik bir kısıtlayıcı tutucu, steril gazlı bez, eldivenler, alkollü mendiller, mikrokapiller kan toplama EDTA tüpü (mor kapak) ve 28 G 1/2 insülin şırıngası (30 U veya 50 U).
- Sıçanı kafesinden çıkarın ve hızla plastik bir kısıtlama konisine sabitleyin. Koninin büyük ucunu kuyruğun tabanının etrafına kapatın. Hayvanın rahat olduğundan ve tüm prosedür boyunca nefes almanın sınırsız olduğundan emin olun.
- Damarı genişletmek için kuyruğu yaklaşık 1 dakika ılık suya (37 ° C) batırın. Kuyruğu bir kağıt havluyla kurulayın. Hayvanı (süzgecine) yüzü aşağı bakacak şekilde, kuyruğu bir ısıtma yastığı üzerinde yatacak şekilde yerleştirin.
- Tüm hayvanı her iki tarafa da döndürerek örnekleme için sağ veya sol kuyruk damarını (mavi çizgi) seçin (bu, kuyruğun bükülmesini önler). Kan damarı delinmesi için kuyruğun terminal üçte birini kullanın, çünkü damarlar bu bölgede daha yüzeysel hale gelir. Arter ventraldir ve iki damar lateral10'dur.
- Kuyruğu delinme yerinde% 70 etanol mendille silin.
- Kuyruğun terminal üçte birinde bir açı oluşturmak için kuyruğu ısıtma yastığının kenarına yerleştirin. Bu, damarı yüzeye çıkarır ve numuneyi almak için daha fazla alan yaratır.
- Kan örneklemesi
- Geri çekilmeyi yumuşatmak için pistonu şırıngada birkaç kez ileri geri hareket ettirin. Birkaç mikrolitreyi çıkarmak için pistonu çekerek şırıngada negatif basınç oluşturun.
- Baskın olmayan işaret ve orta parmağın yardımıyla, kuyruğu ısıtma yastığına düz bir şekilde sabitleyin. Orta parmağı yakından, işaret parmağını ise delinme bölgesi bu iki parmağın arasına gelecek şekilde distal olarak yerleştirin. Kuyruğu sabitlemek için orta parmağa indeksten daha fazla baskı uygulayın, damarı sadece yakından tıkayın ve kanın birikmesine izin verin. Bkz. Şekil 1 ve Şekil 3.
- İğnenin gözü yukarı bakacak şekilde, insülin şırıngasını damar içine sokulana kadar işaret parmağına doğru kaydırın (bu, iğne ile kuyruk arasında 35 ° 'lik bir açı oluşturur). İğne damara girdikten sonra, kan şırıngaya akacaktır. Bu noktada, kan akışının tıkanmadığından emin olmak için işaret ve orta parmak üzerindeki basıncı serbest bırakın.
- İstenilen hacmi toplamak için şırınganın pistonunu sabit bir oranda yavaşça çekin.
NOT: Pistonu çok hızlı çekmeyin; Bu, damarın çökmesine ve kan akışının durmasına neden olur. - Kan akışı azalırsa, iğneyi her iki yönde de hafifçe döndürün.
- Şırıngayı kuyruktan çıkarın. Kuyruğun delinme bölgesinde bir kan damlası oluşacaktır. Bu kanın aspirasyonu, steril olmayan bir prosedür durumunda birkaç mikrolitre daha kan toplanmasına izin verir.
- İlk delinme başarısız olursa, iğneyi damar üzerine daha yakın bir şekilde tekrar yerleştirin.
NOT: Damar, kuyruk tabanına yaklaştıkça giderek daha derin hale gelir. Şırıngada kan akışı yoksa, şırınga ile kuyruk arasındaki açıyı artırın veya iğneyi döndürün. - Kanamayı durdurmak için delinme bölgesine basınç uygulayın ve bölgeyi yeni bir alkollü mendille silin. Sıçanı plastik koniden çıkarın ve kafesine geri koyun.
- Anestezi altında kuyruk damarı delinmesi
- Anesteziyi indüklemek ve sürdürmek için adım 2.1.1 ve adım 2.1.2'yi uygulayın.
- Kan alımı için 3.1.3-3.2.7 adımlarını uygulayın; bkz. Şekil 1.
- Hayvan kurtarma için adım 2.2.10'u gerçekleştirin.
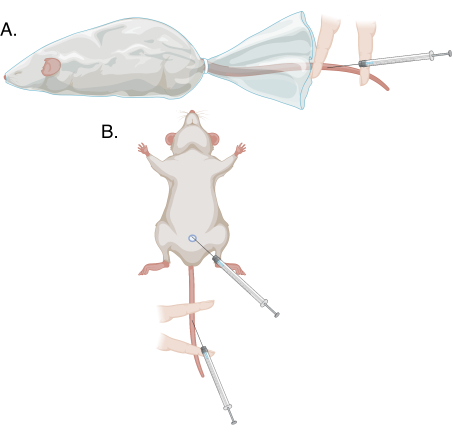
Şekil 1: Bu protokoldeki farklı delinme yöntemlerinin şemaları. (A) Bilinçli, kısıtlanmış bir hayvan üzerinde modifiye kuyruk damarı delinmesi; (B) Anestezi altında modifiye kuyruk damarı delinmesi ve penis veni delinmesi. Bu şeklin daha büyük bir versiyonunu görmek için lütfen buraya tıklayın.
Sonuçlar
Başarı, 10 dakikadan kısa bir sürede (delinme süresinden kan alımının sonuna kadar) en az 100 μL kan veren bir kan alımı olarak tanımlandı ve başarısızlık, 100 μL'den az kan veren veya gerekli kan hacmini elde etmek için 10 dakikadan fazla süren bir kan alımı olarak tanımlandı. Numune başına maksimum 250 μL kana izin verildi. İstatistiksel analizler, çoklu karşılaştırmalar için tek yönlü ANOVA testi ve ki-kare testi kullanılarak gerçekleştirilmiştir. Veriler ortalama değer ± stan...
Tartışmalar
Kuyruk damarı delinmesi, bilinçli bir sıçandan kan elde etmek için etkili bir yöntemdir. Bununla birlikte, bir hayvan anestezi altındayken, izofluranın etkisi damar spazmlarına yol açabilir ve kuyruk damarı delinmesini uygun olmayan hale getirebilir11. Bu çalışmada gösterildiği gibi, bu durumda bir alternatif, daha başarılı olan ve daha kısa sürede önemli ölçüde daha fazla kan hacmi veren penis damarından kan toplamaktır. İlk denemede bu yöntemle başarısızlık durum...
Açıklamalar
Yazarların hiçbirinin beyan edecek çıkar çatışması yoktur.
Teşekkürler
Bu çalışma Shriners Children's Boston (B. E. U., K.U., C.L.C.) tarafından finanse edilmiştir. L.C. "La Bourse des Gueules Cassées", "La Bourse Année Recherche" ve "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris" tarafından finanse edilmektedir. Y.B. "La Bourse des Gueules Cassées" tarafından finanse edilmektedir. Y.B. ve I.F.V.R., Shriners Çocuk Hastaneleri tarafından finanse edilmektedir (Burs Kimliği sırasıyla #84308-BOS-22, #84302-BOS-21'dir). Bu materyal kısmen Ulusal Bilim Vakfı tarafından Hibe No kapsamında desteklenen çalışmalara dayanmaktadır. AET 1941543. ABD Ulusal Sağlık Enstitüleri'nin (R01EB028782, R56AI171958 ve R01DK114506) kısmi desteği minnetle kabul edilmektedir. Şekil 1 BioRender.com ile oluşturulmuştur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referanslar
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır