Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Modifizierte Schwanzvenen- und Penisvenenpunktion zur Blutentnahme im Rattenmodell
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, das schnelle, einfache und zuverlässige Alternativen zur Blutentnahme für das Rattenmodell bietet. Je nach Kontext beschreiben wir drei verschiedene Methoden der Blutentnahme: Schwanzvenenpunktion unter Narkose oder bei bewusstem Bewusstsein und dorsale Penisvenenpunktion unter Narkose.
Zusammenfassung
In den meisten Versuchstierversuchen werden Blutproben benötigt, um verschiedene hämatologische Parameter zu beurteilen. In dieser Arbeit werden zwei Verfahren zur Blutentnahme bei Ratten vorgestellt: die laterale Schwanzvenenpunktion und die dorsale Penisvenenpunktion, die erhebliche Vorteile gegenüber anderen zuvor beschriebenen Techniken bieten. Diese Studie zeigt, dass diese beiden Verfahren eine schnelle Probenahme (unter 10 min) ermöglichen und ausreichende Blutvolumina für die meisten Assays (202 μl ± 67,7 μl) liefern. Die Punktion der dorsalen Penisvene muss unter Narkose durchgeführt werden, während die Punktion der lateralen Schwanzvene bei einem bewussten, zurückgehaltenen Tier durchgeführt werden kann.
Der Wechsel dieser beiden Techniken ermöglicht daher eine Blutentnahme in jeder Situation. Es wird zwar immer empfohlen, dass ein Bediener während eines Eingriffs unterstützt wird, um das Wohlergehen der Tiere zu gewährleisten, aber diese Techniken erfordern nur einen einzigen Bediener, im Gegensatz zu den meisten Blutentnahmemethoden, bei denen zwei erforderlich sind. Während diese zuvor beschriebenen Methoden (z. B. Halsstab, Blutabnahme der Schlüsselbeinvene) eine umfangreiche vorherige Schulung erfordern, um eine Schädigung oder den Tod des Tieres zu vermeiden, sind die Punktion der Schwanzvene und der dorsalen Penisvene selten tödlich. Aus all diesen Gründen und je nach Kontext (z. B. bei Studien mit männlichen Ratten, während der perioperativen oder unmittelbaren postoperativen Phase bei Tieren mit dünnen Schwanzvenen) können beide Techniken abwechselnd eingesetzt werden, um wiederholte Blutentnahmen zu ermöglichen.
Einleitung
Die Blutentnahme ist für die meisten Tierversuche sowohl in vivo als auch in vitro erforderlich. Da bei Ratten die Häufigkeit und Menge der Blutentnahme von Bedeutung sein kann, ist es hilfreich, verschiedene Alternativen für die Entnahme zu haben. In früheren Studien wurden verschiedene Methoden beschrieben.
Die am häufigsten verwendeten Techniken sind die Schwanzvenenpunktion und die Blutabnahme der Vena saphena. Die Schwanzvenenprobenahme ist für alle Rattenstämme geeignet. Mit der richtigen Ausbildung ist der Eingriff einfach durchzuführen und verursacht dem Tier nur minimalen Stress1. Ebenso ist die Blutabnahme der Vena saphena, sofern sie richtig durchgeführt wird, eine schnelle und einfache Entnahmemethode. Keine der beiden Methoden erfordert eine Anästhesie, und beide ermöglichen die wiederholte Entnahme kleiner Blutmengen. Die Punktion der Vena saphena führt jedoch in der Regel zu einem geringeren Blutvolumen1 und erfordert die Anwesenheit von zwei Personen, um eine Hintergliedmaße für die Punktion2 freizulegen.
Wenn große Mengen Blut von einem einzelnen Tier entnommen werden müssen, kann eine Herzpunktion oder Punktion der Hohlvene verwendet werden (einer 150-g-Ratte mit Herzpunktionkönnen bis zu 10 ml Blut entnommen werden 2). Diese Techniken erfordern eine Anästhesie und sind unheilbare Eingriffe. Das Tier muss nach einer dieser beiden Techniken eingeschläfert werden2. Der Halsstab ist eine Alternative, die eingesetzt werden kann, wenn in einer Studie, die ihren Endpunkt noch nicht erreicht hat, große Mengen Blut entnommen werden müssen. Diese Technik erfordert jedoch auch erhebliche technische Fähigkeiten, um Schäden für das Tier zu vermeiden. Daher sollte seine Verwendung eingeschränkt werden3.
Andere Techniken, wie z. B. die Blutabnahme der Schlüsselbeinvene, erfordern keine Anästhetika vor der Blutentnahme und ermöglichen die wiederholte Entnahme kleiner Blutmengen. Für diese Technik sind jedoch eine zurückhaltende Handhabung und ein entsprechender Nadelschnitt erforderlich. Eine unsachgemäße Operation kann zu Tierschmerzen oder sogar zum Tod führen, und das Training für diese Methode kann anspruchsvoll sein4.
Andere anekdotische Verfahren sind die Orbitapunktion und die sublinguale Venenpunktion, die beide eine Anästhesie erfordern und weder empfohlen noch weit verbreitet sind. Obwohl frühere Studien gezeigt haben, dass die Blutentnahme durch Orbitapunktion schneller ist als durch eine Schwanzvenenpunktion, wurde festgestellt, dass die Orbitapunktion unter Diethyletheranästhesie weniger gut vertragen wurde als die letztere Methode (basierend auf den Erregungswerten der Tiere und der Urinproduktion)5. Darüber hinaus wird diese Methode stark von den Fähigkeiten der Person beeinflusst, die den Eingriff durchführt, und wird hauptsächlich von erfahrenen Tierärzten durchgeführt. Im Vergleich dazu ist die sublinguale Venenpunktion weniger belastend und wird für wiederholte Blutentnahmen empfohlen6. Diese Technik hat jedoch schwerwiegende Nebenwirkungen, wie z. B. eine verminderte Futter- und Wasseraufnahme, die zum Tod des Tieres führen können7.
In dieser Studie werden zwei Methoden beschrieben, die in unserem Labor zur wiederholten Blutentnahme verwendet werden. Die Punktion der Schwanzvene kann bei einem bewussten Tier durchgeführt werden, und die Gewebeschäden und unerwünschten Auswirkungen sind minimal. Die Modifikation dieser Technik in dieser Studie umfasst die Stabilisierung des Schwanzes mit Zeige- und Mittelfinger, wodurch ein einzelner Bediener die Blutentnahme durchführen kann. Die dorsale Penisvenenpunktion wurde bereits für einfache intravenöse Injektionen beschrieben. Diese Technik wird unter Narkose durchgeführt und ermöglicht eine zuverlässige Blutquelle bei Schwierigkeiten mit anderen Methoden (z. B. in der unmittelbaren postoperativen Phase bei einem Kleintier, bei der perioperativen Blutentnahme unter Narkose). Ähnlich wie bei der Schwanzvenenentnahme hat die Verletzung an der Einstichstelle im Vergleich zu den oben genannten Techniken einen geringen Gesamteffekt auf das Tier8. Ziel dieser Methodenarbeit ist es, unerfahrenen Forschern je nach Kontext einfache und zuverlässige Alternativen zur Blutentnahme anzubieten (z.B. für Eingriffe unter Narkose, für Studien mit männlichen Ratten, für Tiere mit dünnen Schwanzvenen).
Protokoll
Die Eingriffe wurden an 3 Monate alten männlichen Lewis-Ratten mit einem Gewicht von jeweils 300-400 g durchgeführt. Insgesamt wurden 24 Tiere mit drei Punktionsbedingungen eingeschlossen: 12 Ratten unterzogen sich einer Schwanzvenenpunktion ohne Narkose (Gruppen-TV ohne Anästhesie), und weitere 12 Ratten wurden anästhesiert, um sich sowohl einer Schwanzvenenpunktion (Gruppen-TV mit Anästhesie) als auch einer Penisvenenpunktion (Gruppe PV mit Anästhesie) zu unterziehen. Alle Verfahren wurden genehmigt und entsprechen den Richtlinien des Institutional Animal Care and Use Committee (IACUC). Alle Tiere wurden am Ende der Studie (nach einer 1-monatigen Nachbeobachtung) durch eine Überdosis Kohlendioxid eingeschläfert. In der Materialtabelle finden Sie Einzelheiten zu allen Materialien und Instrumenten, die in diesem Protokoll verwendet werden.
1. Allgemeine Richtlinien
- Achten Sie in Übereinstimmung mit den IACUC-Richtlinien darauf, dass das maximal entnommene Blutvolumen nicht mehr als 10 % des Gesamtblutvolumens alle 2 Wochen beträgt9. Zum Beispiel sollte eine Ratte von 300 g ein Gesamtblutvolumen von etwa 19,2 ml haben. Im Falle eines Protokolls, das vier Blutentnahmen allein in der ersten Woche (Tag 0, Tag 1, Tag 3, Tag 7) vorsieht, beschränken Sie die Entnahme auf maximal 250 μl Blut pro Probe.
- Bei Eingriffen, die unter Narkose durchgeführt werden, verabreichen Sie Isofluran über einen Präzisionsverdampfer, um das Tier zu betäuben. Induzieren Sie die Anästhesie in einer Kammer mit einer Dosis von 3%-5% Isofluran für 5 Minuten und halten Sie die Einnahme einer Dosis von 1%-3% Isofluran durch einen Nasenkegel während des Eingriffs aufrecht. Passen Sie den Isofluranspiegel auf der Grundlage einer kontinuierlichen Überwachung der Atemfrequenz an. Prüfen Sie, ob eine Sedierung durch Zehenkneifen ausreicht, bevor Sie mit dem Eingriff beginnen.
- Lassen Sie das Tier während des Eingriffs nicht unbeaufsichtigt oder bis es wieder genügend Bewusstsein erlangt hat, um das Brustbein aufrecht zu erhalten.
- Überwachen Sie das Tier nach der Blutentnahme bis zur vollständigen Genesung, bevor Sie es in seinen Käfig zurückbringen, und führen Sie es nicht in die Gesellschaft anderer Tiere ein, bis es vollständig genesen ist.
HINWEIS: In Absprache mit dem Veterinärdienst waren nach einer Schwanzvenen- oder Penisvenenpunktion keine Schmerzmittel nach dem Eingriff erforderlich.
2. Blutentnahme aus der Penisvene
- Präparat
- Bereiten Sie die folgende Ausrüstung vor: sterile Mull, Handschuhe, Alkoholtücher, ein EDTA-Röhrchen zur mikrokapillaren Blutentnahme (violette Kappe) und eine 30-g-Insulinspritze (30 U oder 50 U).
- Nehmen Sie die Ratte aus ihrem Käfig und setzen Sie sie in eine Kammer zur Induktion mit Isofluran über einen Präzisionsverdampfer (Dosis: 3%-5%). Sobald das Tier sediert ist, legen Sie es auf den Behandlungstisch und legen Sie das Tier auf den Rücken, wobei die Nase in den Nasenkegel gelegt wird, um die Betäubung aufrechtzuerhalten. Überwachen Sie die Atemfrequenz und passen Sie den Isofluranspiegel entsprechend an (Erhaltungsdosis: 1%-3%). Vergewissern Sie sich, dass das Tier durch Zehenkneifen ausreichend sediert ist, bevor Sie mit dem Eingriff beginnen.
- Blutentnahme
- Bewegen Sie den Kolben in der Spritze mehrmals hin und her, um die Entnahme zu glätten. Erzeugen Sie Unterdruck in der Spritze, indem Sie am Kolben ziehen, um ein paar Mikroliter zu entfernen.
- Ziehen Sie mit Hilfe der nicht dominanten Hand die Vorhaut vom Ende des Penis zurück und halten Sie die Eichel zwischen Zeigefinger und Daumen, indem Sie sanft ziehen. Die dorsale Penisvene erscheint als oberflächlicher blauer Strang. Siehe Abbildung 1 und Abbildung 2.
- Führen Sie die Insulinspritze mit dem Nadelöhr nach oben in einem Winkel von 35° in die Vene ein. Sobald die Nadel in die Vene eingedrungen ist, fließt Blut in die Spritze.
- Ziehen Sie den Kolben der Spritze langsam und gleichmäßig heraus, um das gewünschte Volumen zu sammeln.
Anmerkungen: Ziehen Sie den Kolben nicht zu schnell heraus, da dies dazu führt, dass die Vene kollabiert und der Blutfluss gestoppt wird. - Wenn der Blutfluss nachlässt, drehen Sie die Nadel leicht im oder gegen den Uhrzeigersinn.
- Entfernen Sie die Spritze. An der Einstichstelle bildet sich ein Blutstropfen, dessen Absaugung im Falle eines unsterilen Eingriffs die Entnahme von einigen Mikrolitern Blut ermöglicht.
- Wenn die erste Punktion fehlschlägt, führen Sie die Nadel weiter proximal in die Vene ein.
HINWEIS: Anders als bei der Schwanzvenenentnahme ist die iterative Punktion der dorsalen Penisvene in der Regel erfolglos. - Üben Sie leichten Druck auf die Einstichstelle aus, um die Blutung zu stoppen, und wischen Sie den Bereich mit einem neuen Alkoholtuch ab.
- Bringen Sie den Penis wieder in seine neutrale Position.
- Schalten Sie Isofluran aus und beobachten Sie die Ratte bis zur vollständigen Genesung. Setze die Ratte in ihren Käfig zurück.
3. Punktion der Schwanzvene
- Präparat
- Bereiten Sie die folgende Ausrüstung vor: einen Rückhaltehalter aus Kunststoff, sterile Gaze, Handschuhe, Alkoholtücher, ein EDTA-Röhrchen zur mikrokapillaren Blutentnahme (violette Kappe) und eine 28 G 1/2 Insulinspritze (30 U oder 50 U).
- Nehmen Sie die Ratte aus ihrem Käfig und befestigen Sie sie schnell in einem Plastikkonus. Schließen Sie das große Ende des Kegels um die Basis des Schwanzes. Stellen Sie sicher, dass sich das Tier wohlfühlt und dass die Atmung während des gesamten Vorgangs uneingeschränkt ist.
- Tauchen Sie den Schwanz für ca. 1 Minute in warmes Wasser (37 °C), um die Vene zu erweitern. Trocknen Sie den Schwanz mit einem Papiertuch ab. Legen Sie das Tier (in sein Haltebecken) mit der Vorderseite nach unten, wobei der Schwanz auf einem Heizkissen liegt.
- Wählen Sie die rechte oder linke Schwanzvene (blaue Linie) für die Probenahme aus, indem Sie das gesamte Tier zu beiden Seiten drehen (dies vermeidet das Verdrehen des Schwanzes). Verwenden Sie das terminale Drittel des Schwanzes für die Punktion von Blutgefäßen, da die Gefäße in dieser Zone oberflächlicher werden. Die Arterie ist ventral und die beiden Venen sind lateral10.
- Wischen Sie den Schwanz an der Einstichstelle mit 70%igen Ethanoltüchern ab.
- Legen Sie den Schwanz auf den Rand des Heizkissens, um einen Winkel im letzten Drittel des Schwanzes zu erzeugen. Dadurch wird die Ader an die Oberfläche gebracht und es entsteht mehr Platz für die Entnahme der Probe.
- Blutentnahme
- Bewegen Sie den Kolben in der Spritze mehrmals hin und her, um die Entnahme zu glätten. Erzeugen Sie Unterdruck in der Spritze, indem Sie am Kolben ziehen, um ein paar Mikroliter zu entfernen.
- Befestigen Sie den Schwanz mit Hilfe des nicht dominanten Zeige- und Mittelfingers flach auf dem Heizkissen. Platzieren Sie den Mittelfinger proximal und den Zeigefinger distal, wobei die Einstichstelle zwischen diesen beiden Fingern liegt. Üben Sie mehr Druck auf den Mittelfinger als auf den Zeigefinger aus, um den Schwanz zu sichern, und schließen Sie das Gefäß nur proximal ab und lassen Sie das Blut ansammeln. Siehe Abbildung 1 und Abbildung 3.
- Schieben Sie die Insulinspritze mit dem Nadelöhr nach oben gegen den Zeigefinger, bis sie in die Vene eingeführt wird (dadurch entsteht ein Winkel von 35° zwischen Nadel und Schwanz). Sobald die Nadel in die Vene eingedrungen ist, fließt Blut in die Spritze. Lassen Sie an dieser Stelle den Druck auf Zeige- und Mittelfinger nach, um sicherzustellen, dass der Blutfluss nicht blockiert wird.
- Ziehen Sie den Kolben der Spritze langsam und gleichmäßig heraus, um das gewünschte Volumen zu gewinnen.
Anmerkungen: Ziehen Sie den Kolben nicht zu schnell heraus; Dies führt dazu, dass die Vene kollabiert und der Blutfluss gestoppt wird. - Wenn der Blutfluss nachlässt, drehen Sie die Nadel leicht in beide Richtungen.
- Entfernen Sie die Spritze vom Schwanz. An der Einstichstelle des Schwanzes bildet sich ein Blutstropfen. Die Aspiration dieses Blutes ermöglicht die Entnahme von einigen Mikrolitern mehr Blut im Falle eines unsterilen Verfahrens.
- Wenn die erste Punktion fehlschlägt, führen Sie die Nadel weiter proximal in die Vene ein.
HINWEIS: Die Vene wird immer tiefer, wenn sie sich der Schwanzbasis nähert. Wenn die Spritze nicht durchblutet wird, vergrößern Sie den Winkel zwischen Spritze und Schwanz oder drehen Sie die Nadel. - Üben Sie Druck auf die Einstichstelle aus, um die Blutung zu stoppen, und wischen Sie den Bereich mit einem neuen Alkoholtuch ab. Entferne die Ratte aus dem Plastikkegel und setze sie in ihren Käfig zurück.
- Schwanzvenenpunktion unter Narkose
- Führen Sie die Schritte 2.1.1 und 2.1.2 durch, um die Anästhesie einzuleiten und aufrechtzuerhalten.
- Führen Sie die Schritte 3.1.3-3.2.7 für die Blutentnahme aus. siehe Abbildung 1.
- Führen Sie Schritt 2.2.10 für die Tierbergung aus.
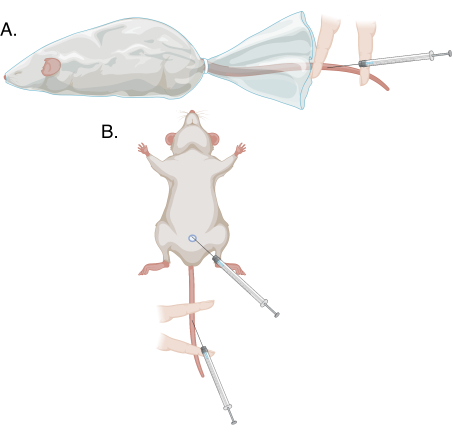
Abbildung 1: Schematische Darstellung der verschiedenen Punktionsmethoden in diesem Protokoll. (A) Modifizierte Schwanzvenenpunktion bei einem bewussten, gefesselten Tier; (B) modifizierte Schwanzvenenpunktion und Penisvenenpunktion unter Narkose. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
Ergebnisse
Erfolg wurde definiert als eine Blutabnahme, die mindestens 100 μl Blut in weniger als 10 Minuten (von der Einstichzeit bis zum Ende der Blutentnahme) lieferte, und ein Misserfolg wurde definiert als eine Blutabnahme, die weniger als 100 μl Blut ergab oder mehr als 10 Minuten benötigte, um das erforderliche Blutvolumen zu gewinnen. Pro Probe waren maximal 250 μl Blut erlaubt. Die statistischen Analysen wurden mit einem einfaktoriellen ANOVA-Test für Mehrfachvergleiche und dem Chi-Quadrat-Test durchgeführt. Die Date...
Diskussion
Die Schwanzvenenpunktion ist eine effiziente Methode, um Blut von einer bewussten Ratte zu gewinnen. Wenn ein Tier jedoch unter Narkose steht, kann die Wirkung von Isofluran zu Gefäßkrämpfen führen und eine Schwanzvenenpunktion ungeeignet machen11. Wie in dieser Studie gezeigt wurde, besteht eine Alternative in dieser Situation darin, Blut aus der Penisvene zu entnehmen, was erfolgreicher ist und in kürzerer Zeit ein deutlich größeres Blutvolumen liefert. Es ist wichtig, sich daran zu erinn...
Offenlegungen
Keiner der Autoren hat Interessenkonflikte zu erklären.
Danksagungen
Diese Arbeit wurde von Shriners Children's Boston (B. E. U., K.U., C.L.C.) finanziert. L.C. wird von "La Bourse des Gueules Cassées", "La Bourse Année Recherche" und "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris" finanziert. Y.B. wird von "La Bourse des Gueules Cassées" gefördert. Y.B. und I.F.V.R. werden von den Shriners Hospitals for Children finanziert (die Fellowships-ID lautet #84308-BOS-22 bzw. #84302-BOS-21). Dieses Material basiert teilweise auf Arbeiten, die von der National Science Foundation im Rahmen des Stipendiums Nr. EWG 1941543. Die teilweise Unterstützung durch die US-amerikanischen National Institutes of Health (R01EB028782, R56AI171958 und R01DK114506) wird dankbar gewürdigt. Abbildung 1 wurde mit BioRender.com erstellt.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referenzen
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten