Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Punción modificada de la vena de la cola y la vena del pene para el muestreo de sangre en el modelo de rata
* Estos autores han contribuido por igual
En este artículo
Resumen
Aquí, presentamos un protocolo para ofrecer alternativas de recolección de sangre rápidas, fáciles y confiables para el modelo de rata. Describimos tres métodos diferentes de muestreo de sangre según el contexto: punción de la vena de la cola bajo anestesia o en un animal consciente, y punción de la vena dorsal del pene bajo anestesia.
Resumen
Las muestras de sangre son necesarias en la mayoría de los diseños de animales experimentales para evaluar diversos parámetros hematológicos. Este trabajo presenta dos procedimientos para la recolección de sangre en ratas: la punción de la vena lateral de la cola y la punción de la vena dorsal del pene, que ofrecen ventajas significativas sobre otras técnicas descritas anteriormente. Este estudio muestra que estos dos procedimientos permiten un muestreo rápido (menos de 10 min) y producen volúmenes sanguíneos suficientes para la mayoría de los ensayos (202 μL ± 67,7 μL). La punción de la vena dorsal del pene debe realizarse bajo anestesia, mientras que la punción de la vena lateral de la cola se puede realizar en un animal consciente y restringido.
La alternancia de estas dos técnicas, por lo tanto, permite la extracción de sangre en cualquier situación. Si bien siempre se recomienda que un operador reciba asistencia durante un procedimiento para garantizar el bienestar animal, estas técnicas requieren un solo operador, a diferencia de la mayoría de los métodos de muestreo de sangre que requieren dos. Además, mientras que estos métodos descritos anteriormente (por ejemplo, palo yugular, extracción de sangre de la vena subclavia) requieren un entrenamiento previo extenso para evitar el daño o la muerte del animal, la punción de la vena de la cola y la vena dorsal del pene rara vez son fatales. Por todas estas razones, y de acuerdo con el contexto (por ejemplo, para estudios que incluyen ratas macho, durante el período perioperatorio o postoperatorio inmediato, para animales con venas delgadas de la cola), ambas técnicas se pueden usar alternativamente para permitir extracciones repetidas de sangre.
Introducción
El muestreo de sangre es necesario para la mayoría de los estudios en animales, tanto in vivo como in vitro. En ratas, como la frecuencia y la cantidad de muestreo de sangre pueden ser significativas, es útil tener diferentes alternativas para la recolección. Se han descrito varios métodos en estudios previos.
Las técnicas más utilizadas son la punción de la vena de la cola y la extracción de sangre de la vena safena. El muestreo de venas de la cola es adecuado para todas las cepas de ratas. Con el entrenamiento adecuado, el procedimiento es fácil de realizar y causa una angustia mínima al animal1. Del mismo modo, la extracción de sangre de la vena safena, siempre que se haga correctamente, también es un método de recolección rápido y simple. Ninguno de los métodos requiere anestesia, y ambos permiten extraer repetidamente pequeñas cantidades de sangre. Sin embargo, la punción de la vena safena generalmente produce un volumen sanguíneo más bajo1 y requiere la presencia de dos personas para dejar una extremidad posterior expuesta para la punción2.
Si es necesario recolectar grandes cantidades de sangre de un solo animal, se puede usar una punción cardíaca o punción de la vena cava (se pueden extraer hasta 10 ml de sangre de una rata de 150 g con punción cardíaca2). Estas técnicas requieren anestesia y son procedimientos terminales. El animal debe ser sacrificado después de cualquiera de estas dos técnicas2. El pinchazo yugular es una alternativa que se puede utilizar si es necesario recolectar grandes cantidades de sangre en un estudio que aún no ha alcanzado su punto final. Sin embargo, esta técnica también requiere habilidades técnicas significativas para evitar daños al animal; por lo tanto, su uso debe ser limitado3.
Otras técnicas, como la extracción de sangre de la vena subclavia, no necesitan el uso de anestésicos antes de la recolección de sangre y permiten el muestreo repetido de pequeños volúmenes de sangre. Sin embargo, se requiere un manejo restringido y una incisión de aguja adecuada para esta técnica. Una operación inadecuada puede provocar dolor en los animales o incluso la mortalidad, y el entrenamiento para este método puede ser exigente4.
Otros procedimientos anecdóticos incluyen la punción orbitaria y la punción venosa sublingual, las cuales requieren anestesia, y no son recomendadas ni ampliamente utilizadas. Aunque estudios previos han demostrado una recolección de sangre más rápida por punción orbitaria que por punción de la vena de la cola, se encontró que la punción orbitaria bajo anestesia dietil-éter fue menos tolerada que este último método (basado en las puntuaciones de excitación de los animales y la producción de orina)5. Además, este método está muy influenciado por la habilidad de la persona que realiza el procedimiento y es realizado principalmente por veterinarios experimentados. En comparación, la punción venosa sublingual es menos angustiante y se recomienda para el muestreo repetidode sangre 6. Sin embargo, esta técnica presenta efectos adversos severos como la reducción de la ingesta de alimentos y agua, que puede llevar a la muerte del animal7.
Este estudio describe dos métodos utilizados en nuestro laboratorio para el muestreo repetido de sangre. La punción de la vena de la cola se puede realizar en un animal consciente, y el daño tisular y los efectos adversos son mínimos. La modificación de esta técnica en este estudio incluye la estabilización de la cola con el dedo índice y medio, lo que permite que un solo operador realice la recolección de sangre. La punción de la vena dorsal del pene ya se ha descrito para inyecciones intravenosas simples. Esta técnica se realiza bajo anestesia y permite una fuente de sangre confiable en caso de dificultades con otros métodos (por ejemplo, durante el período postoperatorio inmediato, con un animal pequeño, cuando se realiza una extracción de sangre perioperatoria bajo anestesia). Similar al muestreo de venas de la cola, la lesión en el sitio de punción tendrá un efecto general menor en el animal en comparación con las técnicas mencionadas anteriormente8. El objetivo de este documento de métodos es ofrecer a los investigadores sin experiencia alternativas simples y confiables de muestreo de sangre de acuerdo con el contexto (por ejemplo, para procedimientos realizados bajo anestesia, para estudios que incluyen ratas macho, para animales con venas delgadas de la cola).
Protocolo
Los procedimientos se realizaron en ratas Lewis macho de 3 meses de edad, cada una con un peso de 300-400 g. Se incluyeron un total de 24 animales, con tres condiciones de punción: 12 ratas se sometieron a punción de vena de la cola sin anestesia (TV grupal sin anestesia), y otras 12 ratas fueron anestesiadas para someterse tanto a punción de vena de la cola (TV grupal con anestesia) como a punción de vena peneana (grupo PV con anestesia). Todos los procedimientos fueron aprobados y respetaron las directrices del Comité Institucional de Cuidado y Uso de Animales (IACUC). Todos los animales fueron sacrificados al final del estudio (después de un seguimiento de 1 mes) por sobredosis de dióxido de carbono. Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales e instrumentos utilizados en este protocolo.
1. Directrices generales
- De acuerdo con las directrices de IACUC, asegúrese de que el volumen sanguíneo máximo extraído no sea superior al 10% del volumen total de sangre cada 2 semanas9. Por ejemplo, una rata de 300 g debe tener un volumen sanguíneo total de aproximadamente 19,2 ml. En el caso de un protocolo que requiera cuatro extracciones de sangre solo en la primera semana (día 0, día 1, día 3, día 7), limite la recolección a un máximo de 250 μL de sangre por muestra.
- Para los procedimientos realizados bajo anestesia, administrar isoflurano a través de un vaporizador de precisión para anestesiar al animal. Inducir la anestesia en una cámara con una dosis de 3% -5% de isoflurano durante 5 min, y mantener usando una dosis de 1% -3% de isoflurano a través de un cono nasal durante el procedimiento. Ajustar el nivel de isoflurano en función de la monitorización continua de la frecuencia respiratoria. Verifique si la sedación es suficiente pellizcando el dedo del pie antes de comenzar el procedimiento.
- No deje al animal desatendido durante el procedimiento o hasta que haya recuperado la conciencia suficiente para mantener la decúbito esternal.
- Después de la recolección de sangre, controle al animal hasta la recuperación completa antes de devolverlo a su jaula, y no lo introduzca en compañía de otros animales hasta que esté completamente recuperado.
NOTA: De acuerdo con los servicios veterinarios, no fue necesario tomar analgésicos después del procedimiento después de la punción de la vena de la cola o la vena del pene.
2. Extracción de sangre de la vena del pene
- Preparación
- Prepare el siguiente equipo: gasa estéril, guantes, toallitas con alcohol, un tubo de EDTA de recolección de sangre microcapilar (gorro púrpura) y una jeringa de insulina de 30 G (30 U o 50 U).
- Saque a la rata de su jaula y póngala en una cámara para su inducción con isoflurano a través de un vaporizador de precisión (dosis: 3% -5%). Una vez que el animal esté sedado, transfiéralo a la mesa de procedimientos y coloque al animal boca arriba con la nariz colocada en el cono de la nariz para mantener la anestesia. Controle la frecuencia respiratoria y ajuste el nivel de isoflurano en consecuencia (dosis de mantenimiento: 1% -3%). Verifique que el animal esté suficientemente sedado por pellizco del dedo del pie antes de comenzar el procedimiento.
- Muestreo de sangre
- Mueva el émbolo hacia adelante y hacia atrás en la jeringa varias veces para suavizar la retirada. Cree presión negativa en la jeringa tirando del émbolo para eliminar un par de microlitros.
- Con la ayuda de la mano no dominante, retraiga el prepucio desde el extremo del pene y sostenga el glande entre el índice y el pulgar, tirando suavemente. La vena dorsal del pene aparecerá como un cordón azul superficial. Ver Figura 1 y Figura 2.
- Con el ojo de la aguja apuntando hacia arriba, inserte la jeringa de insulina en la vena en un ángulo de 35°. Una vez que la aguja ha entrado en la vena, la sangre fluirá hacia la jeringa.
- Extraiga lentamente el émbolo de la jeringa a un ritmo lento y constante para recoger el volumen deseado.
NOTA: No retire el émbolo demasiado rápido, ya que esto hará que la vena se colapse y detenga el flujo sanguíneo. - Si el flujo sanguíneo disminuye, gire la aguja ligeramente en el sentido de las agujas del reloj o en el sentido contrario a las agujas del reloj.
- Retire la jeringa. Se formará una gota de sangre en el sitio de punción, cuya aspiración permitirá la recolección de algunos microlitros más de sangre en el caso de un procedimiento no estéril.
- Si la primera punción falla, vuelva a insertar la aguja más proximalmente en la vena.
NOTA: A diferencia del muestreo de la vena de la cola, la punción iterativa de la vena dorsal del pene generalmente no tiene éxito. - Aplique una ligera presión en el sitio de punción para detener el sangrado y limpie el área con una toallita con alcohol nueva.
- Coloque el pene de nuevo en su posición neutral.
- Apague el isoflurano y controle a la rata hasta que se recupere por completo. Devuelve la rata a su jaula.
3. Punción de la vena de la cola
- Preparación
- Prepare el siguiente equipo: un soporte de sujeción de plástico, gasa estéril, guantes, toallitas con alcohol, un tubo de EDTA para recolección de sangre microcapilar (gorro púrpura) y una jeringa de insulina de 28 G 1/2 (30 U o 50 U).
- Saque a la rata de su jaula y asegúrela rápidamente en un cono de restricción de plástico. Cierre el extremo grande del cono alrededor de la base de la cola. Asegúrese de que el animal esté cómodo y que la respiración no esté restringida durante todo el procedimiento.
- Sumerja la cola en agua tibia (37 °C) durante aproximadamente 1 minuto para dilatar la vena. Seque la cola con una toalla de papel. Coloque al animal (en su retenedor) boca abajo, con la cola acostada sobre una almohadilla térmica.
- Seleccione la vena de la cola derecha o izquierda (línea azul) para el muestreo girando todo el animal hacia ambos lados (esto evita la torsión de la cola). Utilice el tercio terminal de la cola para la punción de los vasos sanguíneos, ya que los vasos se vuelven más superficiales en esta zona. La arteria es ventral, y las dos venas son laterales10.
- Limpie la cola con toallitas de etanol al 70% en el sitio de punción.
- Coloque la cola en el borde de la almohadilla térmica para crear un ángulo en el tercio terminal de la cola. Esto lleva la vena a la superficie y crea más espacio para tomar la muestra.
- Muestreo de sangre
- Mueva el émbolo hacia adelante y hacia atrás en la jeringa varias veces para suavizar la retirada. Cree presión negativa en la jeringa tirando del émbolo para eliminar un par de microlitros.
- Con la ayuda del dedo índice y medio no dominantes, asegure la cola plana en la almohadilla térmica. Coloque el dedo medio proximalmente y el dedo índice distalmente, con el sitio de punción entre estos dos dedos. Aplique más presión en el dedo medio que en el índice para asegurar la cola, ocluyendo el vaso solo proximalmente y permitiendo que la sangre se acumule. Consulte la figura 1 y la figura 3.
- Con el ojo de la aguja apuntando hacia arriba, deslice la jeringa de insulina contra el dedo índice hasta que se inserte en la vena (esto crea un ángulo de 35° entre la aguja y la cola). Una vez que la aguja ha entrado en la vena, la sangre fluirá hacia la jeringa. En este punto, libere la presión sobre el dedo índice y medio para asegurarse de que el flujo sanguíneo no esté ocluido.
- Extraiga lentamente el émbolo de la jeringa a una velocidad constante para recoger el volumen deseado.
NOTA: No retire el émbolo demasiado rápido; Esto hará que la vena se colapse y detenga el flujo sanguíneo. - Si el flujo sanguíneo disminuye, gire la aguja ligeramente en cualquier dirección.
- Retire la jeringa de la cola. Se formará una gota de sangre en el sitio de punción de la cola. La aspiración de esta sangre permite la recolección de algunos microlitros más de sangre en el caso de un procedimiento no estéril.
- Si la primera punción falla, vuelva a insertar la aguja más proximalmente en la vena.
NOTA: La vena se vuelve progresivamente más profunda a medida que se acerca a la base de la cola. Si no hay flujo sanguíneo en la jeringa, aumente el ángulo entre la jeringa y la cola, o gire la aguja. - Aplique presión en el sitio de punción para detener el sangrado y limpie el área con una toallita con alcohol nueva. Retire la rata del cono de plástico y devuélvala a su jaula.
- Punción de la vena de la cola bajo anestesia
- Realice los pasos 2.1.1 y 2.1.2 para inducir y mantener la anestesia.
- Realice los pasos 3.1.3-3.2.7 para la recolección de sangre; ver Figura 1.
- Realice el paso 2.2.10 para la recuperación del animal.
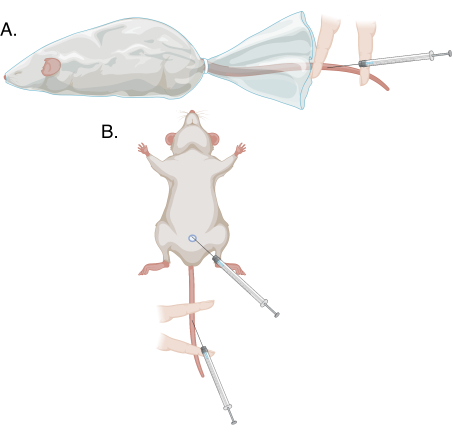
Figura 1: Esquemas de los diferentes métodos de punción en este protocolo. (A) Punción modificada de la vena de la cola en un animal consciente y restringido; (B) punción modificada de la vena de la cola y punción de la vena del pene bajo anestesia. Haga clic aquí para ver una versión más grande de esta figura.
Resultados
El éxito se definió como una extracción de sangre que produce al menos 100 μL de sangre en menos de 10 min (desde el momento de la punción hasta el final de la recolección de sangre), y el fracaso se definió como una extracción de sangre que produce menos de 100 μL de sangre o toma más de 10 minutos para recuperar el volumen de sangre requerido. Se permitió un máximo de 250 μL de sangre por muestra. Los análisis estadísticos se realizaron mediante una prueba ANOVA unidireccional para comparaciones múltipl...
Discusión
La punción de la vena de la cola es un método eficiente para obtener sangre de una rata consciente. Sin embargo, cuando un animal está bajo anestesia, el efecto del isoflurano puede provocar espasmos vasculares y hacer que la punción de la vena de la cola sea inadecuada11. Como se muestra en este estudio, una alternativa en esta situación es recolectar sangre de la vena del pene, que es más exitosa y produce un volumen significativamente mayor de sangre en menos tiempo. Es importante recorda...
Divulgaciones
Ninguno de los autores tiene ningún conflicto de intereses que declarar.
Agradecimientos
Este trabajo fue financiado por Shriners Children's Boston (B. E. U., K.U., C.L.C.). L.C. está financiado por "La Bourse des Gueules Cassées", "La Bourse Année Recherche" y "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris". Y.B. está financiado por "La Bourse des Gueules Cassées". Y.B. e I.F.v.R. son financiados por los Hospitales Shriners para Niños (la identificación de las becas es #84308-BOS-22 #84302-BOS-21 respectivamente). Este material se basa parcialmente en el trabajo apoyado por la National Science Foundation bajo la subvención No. CEE 1941543. Se agradece el apoyo parcial de los Institutos Nacionales de Salud de los Estados Unidos (R01EB028782, R56AI171958 y R01DK114506). La figura 1 se creó con BioRender.com.
Materiales
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Referencias
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados