JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐 모델에서 혈액 샘플링을 위한 수정된 꼬리 정맥 및 음경 정맥 천자
* 이 저자들은 동등하게 기여했습니다
요약
여기에서 우리는 쥐 모델에 대해 빠르고 쉽고 신뢰할 수 있는 채혈 대안을 제공하는 프로토콜을 제시합니다. 우리는 문맥에 따라 세 가지 다른 혈액 샘플링 방법을 설명합니다: 마취 또는 의식이 있는 동물에 대한 꼬리 정맥 천자, 마취 하에 등쪽 음경 정맥 천자.
초록
혈액 샘플은 다양한 혈액학적 매개변수를 평가하기 위해 대부분의 실험 동물 설계에서 필요합니다. 이 논문은 쥐의 채혈을 위한 두 가지 절차인 측면 꼬리 정맥 천자와 등쪽 음경 정맥 천자를 제시하며, 이는 이전에 설명한 다른 기술에 비해 상당한 이점을 제공합니다. 이 연구는 이 두 가지 절차가 빠른 샘플링(10분 미만)을 허용하고 대부분의 분석(202μL ± 67.7μL)에 충분한 혈액량을 산출한다는 것을 보여줍니다. 등쪽 음경 정맥 천자는 마취하에 이루어져야 하는 반면, 측면 꼬리 정맥 천자는 의식이 있고 억제된 동물에게 할 수 있습니다.
따라서 이 두 가지 기술을 번갈아 가며 사용하면 어떤 상황에서도 혈액을 채취할 수 있습니다. 동물 복지를 보장하기 위해 시술 중에 시술자의 도움을 받는 것이 항상 권장되지만, 이러한 기술은 두 명이 필요한 대부분의 혈액 샘플링 방법과 달리 한 명의 시술자만 필요합니다. 또한, 이전에 설명된 이러한 방법(예: 경정맥 스틱, 쇄골하 정맥 채혈)은 동물의 피해 또는 사망을 피하기 위해 광범위한 사전 훈련이 필요한 반면, 꼬리 정맥 및 등쪽 음경 정맥 천자는 거의 치명적이지 않습니다. 이러한 모든 이유와 상황에 따라(예: 수컷 쥐를 포함한 연구의 경우, 수술 전후 또는 수술 직후 기간, 꼬리 정맥이 얇은 동물의 경우) 두 기술을 번갈아 사용하여 반복적인 채혈을 가능하게 할 수 있습니다.
서문
혈액 샘플링은 생체 내 및 시험관 내 대부분의 동물 연구에 필요합니다. 쥐의 경우 혈액 샘플링의 빈도와 양이 중요할 수 있으므로 수집을 위한 다른 대안을 갖는 것이 도움이 됩니다. 이전 연구에서 다양한 방법이 설명되었습니다.
가장 일반적으로 사용되는 기술은 꼬리 정맥 천자와 복재 정맥 채혈입니다. 꼬리 정맥 샘플링은 모든 쥐 균주에 적합합니다. 적절한 훈련을 통해 절차는 수행하기 쉽고 동물에게 최소한의 고통을 유발합니다1. 마찬가지로, 복재 정맥 채혈은 제대로 수행된다면 빠르고 간단한 수집 방법입니다. 두 방법 모두 마취가 필요하지 않으며 둘 다 소량의 혈액을 반복적으로 채취 할 수 있습니다. 그러나, 복재정맥 천자는 일반적으로 혈액량이 더 적고1 한쪽 뒷다리가 펑크를 위해 노출된 채로 두기 위해 두 사람이 있어야 한다2.
단일 동물에서 많은 양의 혈액을 채취해야 하는 경우 심장 천자 또는 대정맥 천자를 사용할 수 있습니다(심장 천자2가 있는 150g 쥐에서 최대 10mL의 혈액을 채취할 수 있음). 이러한 기술은 마취가 필요하며 말기 절차입니다. 동물은 이 두 가지 방법 중 하나를 수행한 후 안락사시켜야 합니다2. 경정맥 스틱은 아직 종점에 도달하지 않은 연구에서 많은 양의 혈액을 수집해야 하는 경우 사용할 수 있는 대안입니다. 그러나 이 기술은 동물에게 해를 끼치지 않기 위해 상당한 기술이 필요합니다. 따라서 사용을 제한해야 합니다3.
쇄골하 정맥 채혈과 같은 다른 기술은 채혈 전에 마취제를 사용할 필요가 없으며 소량의 혈액을 반복적으로 샘플링할 수 있습니다. 그러나 이 기술에는 절제된 취급과 적절한 바늘 절개가 필요합니다. 부적절한 수술은 동물의 고통이나 사망을 초래할 수 있으며, 이 방법에 대한 훈련은 까다로울 수 있다4.
다른 일화적인 절차에는 안와 천자와 설하 정맥 천자가 포함되며 둘 다 마취가 필요하며 권장되거나 널리 사용되지 않습니다. 이전 연구에서는 꼬리 정맥 천자보다 안와 천자에 의한 혈액 수집이 더 빠른 것으로 나타났지만, 디에틸-에테르 마취 하에서 안와 천자는 후자의 방법보다 내약성이 떨어지는 것으로 나타났습니다(동물의 여기 점수 및 소변 생성 기준)5. 또한,이 방법은 절차를 수행하는 사람의 기술에 크게 영향을 받으며 주로 숙련 된 수의사가 수행합니다. 이에 비해, 설하 정맥 천자는 덜 고통스러우며 반복적인 혈액 샘플링에 권장된다6. 그러나 이 기술은 음식물 섭취 감소와 같은 심각한 부작용을 일으켜 동물의 죽음을 초래할 수 있다7.
이 연구는 반복적인 혈액 샘플링을 위해 실험실에서 사용되는 두 가지 방법을 설명합니다. 꼬리 정맥 천자는 의식이 있는 동물에게 시행할 수 있으며 조직 손상과 부작용은 최소화됩니다. 이 연구에서이 기술의 수정에는 검지와 가운데 손가락으로 꼬리를 안정화시키는 것이 포함되어있어 단일 작업자가 혈액 수집을 수행 할 수 있습니다. 등쪽 음경 정맥 천자는 이미 간단한 정맥 주사에 대해 설명되었습니다. 이 기술은 마취하에 수행되며 다른 방법에 어려움이있는 경우 (예 : 수술 직후 기간 동안 작은 동물과 함께 마취하에 수술 전후 채혈을 수행 할 때) 신뢰할 수있는 혈액 공급원을 허용합니다. 꼬리 정맥 샘플링과 유사하게, 천자 부위의 손상은 위에서 언급한 기술에 비해 동물에게 전반적으로 경미한 영향을 미칩니다8. 이 방법 논문의 목적은 경험이 없는 연구자에게 상황에 따라 간단하고 신뢰할 수 있는 혈액 샘플링 대안을 제공하는 것입니다(예: 마취 하에 수행되는 절차, 수컷 쥐를 포함한 연구, 얇은 꼬리 정맥을 가진 동물).
프로토콜
절차는 각각 무게가 300-400g인 3개월 된 수컷 루이스 쥐에서 수행되었습니다. 총 24마리의 동물이 포함되었으며, 3가지 천자 조건이 포함되었다: 12마리의 쥐는 마취 없이 꼬리 정맥 천자를 받았고(마취 없는 그룹 TV), 다른 12마리의 쥐는 꼬리 정맥 천자(마취가 있는 그룹 TV)와 음경 정맥 천자(마취가 있는 그룹 PV)를 모두 받기 위해 마취되었다. 모든 절차는 IACUC(Institutional Animal Care and Use Committee) 지침을 승인하고 존중했습니다. 모든 동물은 연구 종료 시(1개월 추적 관찰 후) 이산화탄소 과다 복용에 의해 안락사되었습니다. 이 프로토콜에 사용된 모든 재료 및 기기와 관련된 자세한 내용은 재료 표를 참조하십시오.
1. 일반 지침
- IACUC 가이드라인에 따라, 2주마다 최대 혈액량이 총 혈액량의 10%를 넘지 않도록 한다9. 예를 들어, 300g의 쥐는 약 19.2mL의 총 혈액량을 가져야합니다. 첫 주에만 4번의 채혈이 필요한 프로토콜의 경우(0일, 1일, 3일, 7일) 채혈을 제한하는 경우 샘플당 최대 250μL의 혈액으로 채취를 제한합니다.
- 마취하에 수행되는 절차의 경우 정밀 기화기를 통해 이소플루란을 투여하여 동물을 마취시킵니다. 3%-5% 이소플루란 용량으로 챔버에서 5분 동안 마취를 유도하고 시술 중 노즈콘을 통해 1%-3% 이소플루란을 사용하여 유지합니다. 호흡수의 지속적인 모니터링을 기반으로 이소플루란 수준을 조정합니다. 시술을 시작하기 전에 발가락을 꼬집어 진정이 충분한지 확인하십시오.
- 시술 중 또는 흉골 누운 자세를 유지하기에 충분한 의식을 회복 할 때까지 동물을 방치하지 마십시오.
- 혈액 채취 후 새장으로 돌려 보내기 전에 완전히 회복 될 때까지 동물을 모니터링하고 완전히 회복 될 때까지 다른 동물의 회사에 소개하지 마십시오.
참고: 수의학 서비스에 따라 꼬리 정맥 또는 음경 정맥 천자 후 시술 후 진통제가 필요하지 않았습니다.
2. 음경 정맥에서 채혈
- 준비
- 멸균 거즈, 장갑, 알코올 물티슈, 미세 모세 혈관 채혈 EDTA 튜브 (보라색 캡) 및 30G 인슐린 주사기 (30U 또는 50U)를 준비하십시오.
- 쥐를 새장에서 꺼내 정밀 기화기(용량: 3%-5%)를 통해 이소플루란으로 유도하기 위해 챔버에 넣습니다. 동물이 진정되면 시술 테이블로 옮기고 마취를 유지하기 위해 코를 코 콘에 대고 동물을 등을 대고 눕습니다. 호흡수를 모니터링하고 그에 따라 이소플루란 수준을 조정합니다(유지 용량: 1%-3%). 절차를 시작하기 전에 동물이 발가락 꼬집음으로 충분히 진정되었는지 확인하십시오.
- 혈액 샘플링
- 주사기에서 플런저를 앞뒤로 여러 번 움직여 인출을 부드럽게합니다. 플런저를 당겨 주사기에 음압을 만들어 몇 마이크로 리터를 제거하십시오.
- 비 지배적 인 손의 도움으로 음경 끝에서 포피를 집어 넣고 검지와 엄지 손가락 사이에 귀두를 잡고 부드럽게 당깁니다. 등쪽 음경 정맥은 표면의 파란색 코드로 나타납니다. 그림 1 및 그림 2를 참조하십시오.
- 바늘의 눈이 위쪽을 향하게 하여 인슐린 주사기를 35° 각도로 정맥에 삽입합니다. 바늘이 정맥에 들어가면 혈액이 주사기로 흘러 들어갑니다.
- 주사기의 플런저를 느리고 일정한 속도로 천천히 빼내어 원하는 부피를 수집합니다.
알림: 플런저를 너무 빨리 빼면 정맥이 무너지고 혈류가 멈출 수 있으므로 하지 마십시오. - 혈류가 감소하면 바늘을 시계 방향 또는 시계 반대 방향으로 약간 돌립니다.
- 주사기를 제거합니다. 펑크 부위에 혈액 방울이 형성되며, 그 흡인은 비 멸균 절차의 경우 몇 마이크로 리터의 혈액을 더 수집 할 수 있습니다.
- 첫 번째 천공이 실패하면 바늘을 정맥에 더 근위부로 다시 삽입하십시오.
참고: 꼬리 정맥 샘플링과 달리 등쪽 음경 정맥의 반복적인 천자는 일반적으로 성공하지 못합니다. - 천자 부위에 가벼운 압력을 가하여 출혈을 멈추고 새 알코올 물티슈로 해당 부위를 닦습니다.
- 음경을 중립 위치에 다시 놓습니다.
- 이소플루란을 끄고 완전히 회복될 때까지 쥐를 모니터링합니다. 쥐를 새장으로 되돌립니다.
3. 꼬리 정맥 천자
- 준비
- 플라스틱 구속 홀더, 멸균 거즈, 장갑, 알코올 물티슈, 미세 모세관 채혈 EDTA 튜브 (보라색 캡) 및 28G 1/2 인슐린 주사기 (30U 또는 50U)를 준비하십시오.
- 새장에서 쥐를 꺼내 플라스틱 구속 원뿔에 신속하게 고정하십시오. 꼬리 밑 부분 주위의 원뿔의 큰 끝을 닫습니다. 동물이 편안하고 전체 절차에서 호흡이 제한되지 않는지 확인하십시오.
- 꼬리를 따뜻한 물(37°C)에 약 1분 동안 담그면 정맥이 확장됩니다. 종이 타월로 꼬리를 말리십시오. 꼬리가 가열 패드에 놓이도록 동물 (구속 장치에)을 뒤집어 놓습니다.
- 전체 동물을 양쪽으로 회전시켜 샘플링을 위해 오른쪽 또는 왼쪽 꼬리 정맥(파란색 선)을 선택합니다(이렇게 하면 꼬리가 비틀리는 것을 방지할 수 있음). 꼬리의 말단 1/3은 혈관 천공을 위해 사용하는데, 이 구역에서 혈관이 더 표면적이 되기 때문입니다. 동맥은 복부이고 두 정맥은 측면10입니다.
- 펑크 부위에서 70 % 에탄올 물티슈로 꼬리를 닦으십시오.
- 꼬리를 가열 패드의 가장자리에 놓아 꼬리의 끝 세 번째에 각도를 만듭니다. 이렇게 하면 정맥이 표면으로 나오고 샘플을 채취할 수 있는 더 많은 공간이 생깁니다.
- 혈액 샘플링
- 주사기에서 플런저를 앞뒤로 여러 번 움직여 인출을 부드럽게합니다. 플런저를 당겨 주사기에 음압을 만들어 몇 마이크로 리터를 제거하십시오.
- 지배적이지 않은 집게 손가락과 가운데 손가락을 사용하여 꼬리를 가열 패드에 평평하게 고정하십시오. 가운데 손가락을 근위부로, 검지를 원위부에 놓고 이 두 손가락 사이에 천자 부위를 놓습니다. 꼬리를 고정하기 위해 검지보다 가운데 손가락에 더 많은 압력을 가하여 혈관을 근위부로만 막고 혈액이 고이도록 합니다. 그림 1 및 그림 3을 참조하십시오.
- 바늘의 눈이 위쪽을 향하게 하여 인슐린 주사기가 정맥에 삽입될 때까지 집게 손가락에 대고 밉니다(바늘과 꼬리 사이에 35° 각도가 생성됨). 바늘이 정맥에 들어가면 혈액이 주사기로 흘러 들어갑니다. 이 시점에서 검지와 중지에 가해지는 압력을 해제하여 혈류가 막히지 않도록 합니다.
- 주사기의 플런저를 일정한 속도로 천천히 빼내어 원하는 부피를 모으십시오.
알림: 플런저를 너무 빨리 빼지 마십시오. 이로 인해 정맥이 붕괴되어 혈류가 멈춥니다. - 혈류가 감소하면 바늘을 어느 방향으로든 약간 돌립니다.
- 꼬리에서 주사기를 제거하십시오. 꼬리의 펑크 부위에 혈액 방울이 형성됩니다. 이 혈액의 흡인은 비 멸균 절차의 경우 몇 마이크로 리터의 혈액을 더 수집 할 수 있습니다.
- 첫 번째 천공이 실패하면 바늘을 정맥에 더 근위부로 다시 삽입하십시오.
참고: 정맥은 꼬리 기저부에 접근함에 따라 점점 더 깊어집니다. 주사기에 혈류가 없으면 주사기와 꼬리 사이의 각도를 늘리거나 바늘을 돌립니다. - 천자 부위에 압력을 가하여 출혈을 멈추고 새 알코올 물티슈로 해당 부위를 닦습니다. 플라스틱 원뿔에서 쥐를 꺼내 새장으로 되돌립니다.
- 마취하에 꼬리 정맥 천자
- 마취 유도 및 유지를 위해 2.1.1 단계와 2.1.2 단계를 수행하십시오.
- 혈액 수집을 위해 3.1.3-3.2.7 단계를 수행하십시오. 그림 1을 참조하십시오.
- 동물 회수를 위해 2.2.10 단계를 수행하십시오.
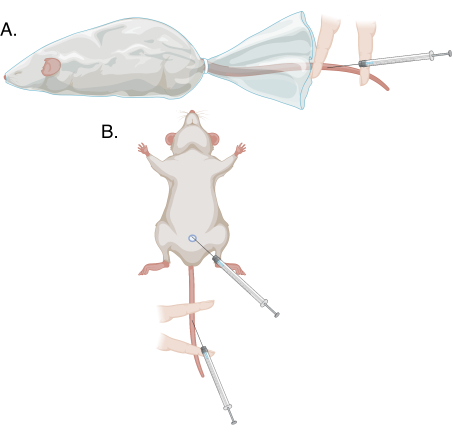
그림 1: 이 프로토콜의 다양한 천자 방법에 대한 개략도. (A) 의식이 있고 억제된 동물에 대한 수정된 꼬리 정맥 천자; (B) 마취 하에 수정된 꼬리 정맥 천자 및 음경 정맥 천자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
성공은 10분 이내(천자 시간부터 채혈 종료까지)에 최소 100μL의 혈액을 채취하는 것으로 정의되었으며, 실패는 100μL 미만의 혈액을 산출하거나 필요한 혈액량을 회수하는 데 10분 이상 걸리는 채혈로 정의되었습니다. 샘플당 최대 250μL의 혈액이 허용되었습니다. 통계 분석은 다중 비교를 위한 일원 분산 분석 검정과 카이 제곱 검정을 사용하여 수행되었습니다. 데이터는 표준편차± 평균값으로 제?...
토론
꼬리 정맥 천자는 의식이 있는 쥐에게서 혈액을 얻는 효율적인 방법입니다. 그러나, 동물이 마취 상태에 있을 때, 이소플루란의 효과는 혈관 경련을 일으키고 꼬리 정맥 천자를 부적절하게 만들 수 있다11. 이 연구에서 볼 수 있듯이 이 상황의 대안은 음경 정맥에서 혈액을 채취하는 것인데, 이는 더 성공적이고 더 짧은 시간에 훨씬 더 많은 양의 혈액을 생성합니다. 첫 번째 시도?...
공개
저자 중 누구도 선언할 이해 상충이 없습니다.
감사의 말
이 작업은 Shriners Children's Boston(B. E. U., K.U., C.L.C.)의 자금 지원을 받았습니다. LC는 "La Bourse des Gueules Cassées", "La Bourse Année Recherche" 및 "La Bourse de l'Amicale des Anciens Internes des Hôpitaux de Paris"에서 자금을 지원합니다. Y.B.는 "La Bourse des Gueules Cassées"에서 자금을 지원합니다. YB와 I.F.v.R.은 슈라이너 아동 병원에서 자금을 지원합니다(펠로우십 ID는 각각 #84308-BOS-22, #84302-BOS-21). 이 자료는 부분적으로 보조금 번호로 국립 과학 재단 (National Science Foundation)이 지원하는 작업을 기반으로합니다. EEC 1941543. 미국 국립 보건원 (R01EB028782, R56AI171958 및 R01DK114506)의 부분적인 지원에 감사드립니다. 그림 1 은 BioRender.com 사용하여 작성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
참고문헌
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유