Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Ponction modifiée de la veine de la queue et de la veine du pénis pour prélèvement sanguin dans le modèle du rat
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ici, nous présentons un protocole pour offrir des alternatives de prélèvement de sang rapides, faciles et fiables pour le modèle de rat. Nous décrivons trois méthodes différentes de prélèvement sanguin selon le contexte : ponction veineuse de la queue sous anesthésie ou sur un animal conscient, et ponction veineuse dorsale du pénis sous anesthésie.
Résumé
Des échantillons de sang sont nécessaires dans la plupart des modèles d’animaux expérimentaux pour évaluer divers paramètres hématologiques. Cet article présente deux procédures de prélèvement sanguin chez le rat: la ponction latérale de la veine de la queue et la ponction dorsale de la veine pénienne, qui offrent des avantages significatifs par rapport aux autres techniques décrites précédemment. Cette étude montre que ces deux procédures permettent un échantillonnage rapide (moins de 10 min) et donnent des volumes sanguins suffisants pour la plupart des tests (202 μL ± 67,7 μL). La ponction dorsale de la veine pénienne doit être effectuée sous anesthésie, tandis que la ponction latérale de la veine de la queue peut être effectuée sur un animal conscient et immobilisé.
L’alternance de ces deux techniques permet donc une prise de sang dans n’importe quelle situation. Bien qu’il soit toujours recommandé d’assister un opérateur lors d’une procédure visant à assurer le bien-être des animaux, ces techniques ne nécessitent qu’un seul opérateur, contrairement à la plupart des méthodes de prélèvement sanguin qui en nécessitent deux. De plus, alors que ces méthodes décrites précédemment (p. ex., bâton jugulaire, prélèvement sanguin dans la veine sous-clavière) nécessitent une formation préalable approfondie pour éviter de blesser ou de tuer l’animal, la ponction de la veine de la queue et de la veine dorsale du pénis est rarement mortelle. Pour toutes ces raisons, et selon le contexte (par exemple, pour les études incluant des rats mâles, pendant la période périopératoire ou postopératoire immédiate, pour les animaux ayant des veines caudales minces), les deux techniques peuvent être utilisées alternativement pour permettre des prises de sang répétées.
Introduction
Le prélèvement sanguin est nécessaire pour la plupart des études animales, tant in vivo qu’in vitro. Chez les rats, comme la fréquence et la quantité de prélèvement sanguin peuvent être importantes, il est utile d’avoir différentes alternatives pour le prélèvement. Diverses méthodes ont été décrites dans des études antérieures.
Les techniques les plus couramment utilisées sont la ponction de la veine de la queue et la prise de sang dans la veine saphène. L’échantillonnage des veines de la queue convient à toutes les souches de rats. Avec une formation appropriée, la procédure est simple à effectuer et cause une détresse minimale à l’animal1. De même, la prise de sang dans la veine saphène, à condition qu’elle soit effectuée correctement, est également une méthode de prélèvement rapide et simple. Aucune des deux méthodes ne nécessite d’anesthésie, et les deux permettent des prélèvements répétés de petites quantités de sang. Cependant, la ponction veineuse saphène donne généralement un volume sanguin inférieur1 et nécessite la présence de deux personnes pour laisser un membre postérieur exposé à la ponction2.
Si de grandes quantités de sang doivent être prélevées sur un seul animal, une ponction cardiaque ou une ponction de la veine cave peut être utilisée (jusqu’à 10 mL de sang peuvent être prélevés sur un rat de 150 g avec ponction cardiaque2). Ces techniques nécessitent une anesthésie et sont des procédures terminales. L’animal doit être euthanasié après l’une de ces deux techniques2. Le bâton jugulaire est une alternative qui peut être utilisée si de grandes quantités de sang doivent être prélevées dans une étude qui n’a pas encore atteint son point final. Cependant, cette technique nécessite également des compétences techniques importantes pour éviter de nuire à l’animal; par conséquent, son utilisation devrait être limitée3.
D’autres techniques, telles que la prise de sang dans la veine sous-clavière, ne nécessitent pas l’utilisation d’anesthésiques avant le prélèvement sanguin et permettent un prélèvement répété de petits volumes de sang. Cependant, une manipulation restreinte et une incision appropriée à l’aiguille sont nécessaires pour cette technique. Une mauvaise opération peut entraîner des douleurs animales ou même la mort, et l’entraînement à cette méthode peut être fastidieux4.
D’autres procédures anecdotiques comprennent la ponction orbitaire et la ponction veineuse sublinguale, qui nécessitent toutes deux un anesthésique et ne sont ni recommandées ni largement utilisées. Bien que des études antérieures aient montré une collecte de sang plus rapide par ponction orbitaire que par ponction veineuse de queue, il a été constaté que la ponction orbitaire sous anesthésie à l’éther diéthylique était moins bien tolérée que cette dernière méthode (basée sur les scores d’excitation des animaux et la production d’urine)5. De plus, cette méthode est fortement influencée par la compétence de la personne qui effectue la procédure et est principalement effectuée par des vétérinaires expérimentés. Comparativement, la ponction veineuse sublinguale est moins pénible et est recommandée pour des prélèvements sanguins répétés6. Cependant, cette technique présente des effets indésirables graves tels qu’une réduction de la consommation de nourriture et d’eau, ce qui peut entraîner la mort de l’animal7.
Cette étude décrit deux méthodes utilisées dans notre laboratoire pour les prélèvements sanguins répétés. La ponction des veines de la queue peut être effectuée sur un animal conscient, et les lésions tissulaires et les effets indésirables sont minimes. La modification de cette technique dans cette étude comprend la stabilisation de la queue avec l’index et le majeur, ce qui permet à un seul opérateur d’effectuer la collecte de sang. La ponction dorsale de la veine pénienne a déjà été décrite pour de simples injections intraveineuses. Cette technique est réalisée sous anesthésie et permet une source de sang fiable en cas de difficultés avec d’autres méthodes (par exemple, pendant la période postopératoire immédiate, avec un petit animal, lors de la prise de sang périopératoire sous anesthésie). Semblable à l’échantillonnage des veines de la queue, la blessure au site de ponction aura un effet global mineur sur l’animal par rapport aux techniques mentionnées ci-dessus8. L’objectif de cet article sur les méthodes est d’offrir aux chercheurs inexpérimentés des alternatives simples et fiables de prélèvement sanguin en fonction du contexte (par exemple, pour les procédures effectuées sous anesthésie, pour les études incluant des rats mâles, pour les animaux avec des veines de queue minces).
Protocole
Les procédures ont été effectuées sur des rats Lewis mâles âgés de 3 mois, pesant chacun de 300 à 400 g. Au total, 24 animaux ont été inclus, avec trois conditions de ponction : 12 rats ont subi une ponction de la veine de la queue sans anesthésie (groupe TV sans anesthésie), et 12 autres rats ont été anesthésiés pour subir à la fois une ponction de la veine de la queue (groupe TV avec anesthésie) et une ponction de la veine du pénis (PV de groupe avec anesthésie). Toutes les procédures ont été approuvées et respectées par les lignes directrices du Comité institutionnel de soin et d’utilisation des animaux (IACUC). Tous les animaux ont été euthanasiés à la fin de l’étude (après un suivi de 1 mois) par surdose de dioxyde de carbone. Voir le tableau des matériaux pour plus de détails sur tous les matériaux et instruments utilisés dans ce protocole.
1. Lignes directrices générales
- Conformément aux directives de l’IACUC, s’assurer que le volume sanguin maximal prélevé ne dépasse pas 10% du volume sanguin total toutes les 2 semaines9. Par exemple, un rat de 300 g devrait avoir un volume sanguin total d’environ 19,2 mL. Dans le cas d’un protocole exigeant quatre prises de sang au cours de la première semaine seulement (jour 0, jour 1, jour 3, jour 7), limiter le prélèvement à un maximum de 250 μL de sang par échantillon.
- Pour les procédures effectuées sous anesthésie, administrer de l’isoflurane via un vaporisateur de précision pour anesthésier l’animal. Induire l’anesthésie dans une chambre avec une dose de 3% -5% d’isoflurane pendant 5 min, et maintenir en utilisant une dose de 1% -3% d’isoflurane à travers un cône nasal pendant la procédure. Ajuster le taux d’isoflurane en fonction de la surveillance continue de la fréquence respiratoire. Vérifiez si la sédation est suffisante par pincement d’orteil avant de commencer la procédure.
- Ne laissez pas l’animal sans surveillance pendant l’intervention ou jusqu’à ce qu’il ait repris suffisamment conscience pour maintenir une position couchée sternale.
- Après la collecte de sang, surveillez l’animal jusqu’à son rétablissement complet avant de le remettre dans sa cage et ne le présentez pas à la compagnie d’autres animaux avant d’être complètement rétabli.
REMARQUE: En accord avec les services vétérinaires, aucun analgésique post-opératoire n’a été nécessaire après la ponction de la veine de la queue ou de la veine du pénis.
2. Prise de sang dans la veine du pénis
- Préparation
- Préparez l’équipement suivant : gaze stérile, gants, lingettes alcoolisées, tube EDTA de prélèvement sanguin microcapillaire (capuchon violet) et seringue à insuline de 30 G (30 U ou 50 U).
- Sortez le rat de sa cage et placez-le dans une chambre pour l’induction avec de l’isoflurane via un vaporisateur de précision (dose: 3%-5%). Une fois que l’animal est sous sédation, transférez-le sur la table d’intervention et allongez-le sur le dos avec son nez placé dans le cône nasal pour maintenir l’anesthésie. Surveillez la fréquence respiratoire et ajustez le taux d’isoflurane en conséquence (dose d’entretien: 1%-3%). Vérifiez que l’animal est suffisamment sous sédation avant de commencer l’intervention.
- Prélèvement sanguin
- Déplacez le piston d’avant en arrière dans la seringue plusieurs fois pour lisser le retrait. Créez une pression négative dans la seringue en tirant sur le piston pour retirer quelques microlitres.
- Avec l’aide de la main non dominante, rétractez le prépuce de l’extrémité du pénis et maintenez le gland entre l’index et le pouce, en tirant doucement. La veine dorsale du pénis apparaîtra comme un cordon bleu superficiel. Voir la figure 1 et la figure 2.
- Avec l’œil de l’aiguille pointé vers le haut, insérer la seringue d’insuline dans la veine à un angle de 35°. Une fois que l’aiguille est entrée dans la veine, le sang coule dans la seringue.
- Retirez lentement le piston de la seringue à un rythme lent et régulier pour recueillir le volume souhaité.
REMARQUE: Ne retirez pas le piston trop rapidement, car cela provoquerait l’affaissement de la veine et arrêterait le flux sanguin. - Si le flux sanguin diminue, tournez l’aiguille légèrement dans le sens des aiguilles d’une montre ou dans le sens inverse des aiguilles d’une montre.
- Retirez la seringue. Une goutte de sang se formera sur le site de ponction, dont l’aspiration permettra de recueillir quelques microlitres de sang supplémentaires dans le cas d’une procédure non stérile.
- Si la première ponction échoue, réinsérez l’aiguille plus près de la veine.
REMARQUE: Contrairement à l’échantillonnage de la veine de la queue, la ponction itérative de la veine dorsale du pénis est généralement infructueuse. - Appliquez une légère pression sur le site de ponction pour arrêter le saignement et essuyez la zone avec une nouvelle lingette imbibée d’alcool.
- Replacez le pénis dans sa position neutre.
- Éteignez l’isoflurane et surveillez le rat jusqu’à ce qu’il soit complètement rétabli. Remettez le rat dans sa cage.
3. Ponction veineuse de la queue
- Préparation
- Préparez l’équipement suivant : un support de contention en plastique, une gaze stérile, des gants, des lingettes alcoolisées, un tube EDTA de prélèvement sanguin microcapillaire (capuchon violet) et une seringue à insuline 28 G 1/2 (30 U ou 50 U).
- Sortez le rat de sa cage et fixez-le rapidement dans un cône de retenue en plastique. Fermez la grande extrémité du cône autour de la base de la queue. Assurez-vous que l’animal est à l’aise et que la respiration n’est pas restreinte tout au long de la procédure.
- Trempez la queue dans de l’eau tiède (37 °C) pendant environ 1 min pour dilater la veine. Sécher la queue avec une serviette en papier. Placez l’animal (dans sa contention) face vers le bas, la queue couchée sur un coussin chauffant.
- Sélectionnez la veine droite ou gauche de la queue (ligne bleue) pour l’échantillonnage en faisant pivoter l’animal entier de chaque côté (cela évite la torsion de la queue). Utilisez le tiers terminal de la queue pour la perforation des vaisseaux sanguins, car les vaisseaux deviennent plus superficiels dans cette zone. L’artère est ventrale et les deux veines sont latérales10.
- Essuyez la queue avec des lingettes à l’éthanol à 70% au site de perforation.
- Placez la queue sur le bord du coussin chauffant pour créer un angle dans le tiers terminal de la queue. Cela amène la veine à la surface et crée plus d’espace pour prélever l’échantillon.
- Prélèvement sanguin
- Déplacez le piston d’avant en arrière dans la seringue plusieurs fois pour lisser le retrait. Créez une pression négative dans la seringue en tirant sur le piston pour retirer quelques microlitres.
- À l’aide de l’index et du majeur non dominants, fixez la queue à plat sur le coussin chauffant. Placez le majeur à proximité et l’index distalement, avec le site de ponction entre ces deux doigts. Appliquez plus de pression sur le majeur que sur l’index pour sécuriser la queue, obstruant le vaisseau seulement de manière proximale et permettant au sang de s’accumuler. Voir la figure 1 et la figure 3.
- Avec l’œil de l’aiguille pointé vers le haut, faites glisser la seringue d’insuline contre l’index jusqu’à ce qu’elle soit insérée dans la veine (cela crée un angle de 35° entre l’aiguille et la queue). Une fois que l’aiguille est entrée dans la veine, le sang coule dans la seringue. À ce stade, relâchez la pression sur l’index et le majeur pour vous assurer que le flux sanguin n’est pas obstrué.
- Retirez lentement le piston de la seringue à un rythme régulier pour recueillir le volume souhaité.
REMARQUE: Ne retirez pas le piston trop rapidement; Cela provoquera l’effondrement de la veine et arrêtera le flux sanguin. - Si le flux sanguin diminue, tournez légèrement l’aiguille dans les deux sens.
- Retirez la seringue de la queue. Une goutte de sang se formera sur le site de ponction de la queue. L’aspiration de ce sang permet la collecte de quelques microlitres de sang supplémentaires dans le cas d’une procédure non stérile.
- Si la première ponction échoue, réinsérez l’aiguille plus près de la veine.
REMARQUE: La veine devient progressivement plus profonde à mesure qu’elle s’approche de la base de la queue. S’il n’y a pas de flux sanguin dans la seringue, augmentez l’angle entre la seringue et la queue ou faites pivoter l’aiguille. - Appliquez une pression sur le site de ponction pour arrêter le saignement et essuyez la zone avec une nouvelle lingette imbibée d’alcool. Retirez le rat du cône en plastique et remettez-le dans sa cage.
- Ponction de la veine de la queue sous anesthésie
- Effectuer les étapes 2.1.1 et 2.1.2 pour induire et maintenir l’anesthésie.
- Effectuer les étapes 3.1.3 à 3.2.7 pour le prélèvement sanguin; voir la figure 1.
- Effectuez l’étape 2.2.10 pour la récupération des animaux.
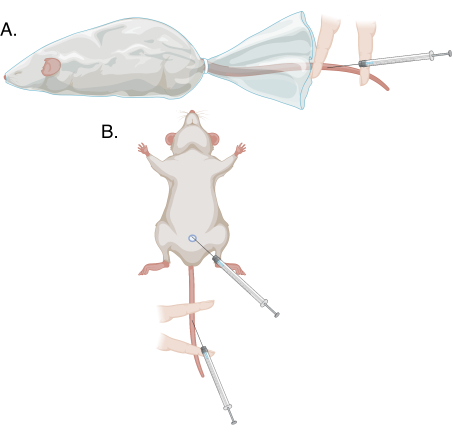
Figure 1 : Schéma des différentes méthodes de ponction dans ce protocole. (A) Ponction modifiée de la veine de la queue sur un animal conscient et immobilisé; (B) ponction modifiée de la veine de la queue et ponction de la veine du pénis sous anesthésie. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Résultats
Le succès a été défini comme une prise de sang produisant au moins 100 μL de sang en moins de 10 minutes (du temps de ponction à la fin du prélèvement sanguin), et l’échec a été défini comme une prise de sang produisant moins de 100 μL de sang ou prenant plus de 10 minutes pour récupérer le volume sanguin requis. Un maximum de 250 μL de sang par échantillon était autorisé. Les analyses statistiques ont été effectuées à l’aide d’un test ANOVA unidirectionnel pour des comparaisons multiples et ...
Discussion
La ponction de la veine de la queue est une méthode efficace pour obtenir du sang d’un rat conscient. Cependant, lorsqu’un animal est sous anesthésie, l’effet de l’isoflurane peut entraîner des spasmes vasculaires et rendre la ponction de la veine de la queue inappropriée11. Comme le montre cette étude, une alternative dans cette situation consiste à prélever du sang dans la veine pénienne, ce qui est plus efficace et produit un volume de sang significativement plus important en mo...
Déclarations de divulgation
Aucun des auteurs n’a de conflit d’intérêts à déclarer.
Remerciements
Ce travail a été financé par Shriners Children’s Boston (B. E. U., K.U., C.L.C.). L.C. est financé par « La Bourse des Gueules Cassées », « La Bourse Année Recherche », et « La Bourse de l’Amicale des Anciens Internes des Hôpitaux de Paris ». Y.B. est financé par « La Bourse des Gueules Cassées ». Y.B. et I.F.v.R. sont financés par les Hôpitaux Shriners pour enfants (l’ID de la bourse est #84308-BOS-22 #84302-BOS-21 respectivement). Ce matériel est partiellement basé sur des travaux soutenus par la National Science Foundation dans le cadre de la subvention No. CEE 1941543. Le soutien partiel des National Institutes of Health des États-Unis (R01EB028782, R56AI171958 et R01DK114506) est vivement apprécié. La figure 1 a été créée avec BioRender.com.
matériels
| Name | Company | Catalog Number | Comments |
| 0.5 mL | 28 G ½ Insulin Syringes | BD | 329424 | for tail vein puncture |
| 0.5 mL | 30 G x 5/16 Insulin Syringes | BD | 320468 | for penile vein puncture |
| 250 L Microtainer blood collection tubes with K2EDTA | BD | 365974 | |
| Gauze Sponges | Curity | 6939 | |
| Isoflurane Auto-Flow Anesthesia Machine | E-Z Systems | EZ-190F | for penile vein puncture |
| Isoflurane, USP | Patterson Veterinary | 1403-704-06 | for penile vein puncture |
| Nosecone for Anesthesia | World Precision Instruments | EZ-112 | for penile vein puncture |
| Rodent Restraint Cone | Harvard Apparatus | ST2 52-95-86 | for tail vein puncture |
| Small Animal Heated Operating Table (Adjustable) | Peco Services Ltd | 69023 | |
| Webcol Alcohol prep pads | Simply Medical | 5110 |
Références
- Lee, G., Goosens, K. A. Sampling blood from the lateral tail vein of the rat. Journal of Visualized Experiments. (99), e52766 (2015).
- Beeton, C., Garcia, A., Chandy, K. G. Drawing blood from rats through the saphenous vein and by cardiac puncture. Journal of Visualized Experiments. (7), 266 (2007).
- Luzzi, M., et al. Collecting blood from rodents: A discussion by the Laboratory Animal Refinement and Enrichment Forum. Animal Technology and Welfare. 4 (2), 99-102 (2005).
- Wang, L., et al. Repetitive blood sampling from the subclavian vein of conscious rat. Journal of Visualized Experiments. (180), e63439 (2022).
- Van Herck, H., et al. Blood sampling from the retro-orbital plexus, the saphenous vein and the tail vein in rats: Comparative effects on selected behavioural and blood variables. Laboratory Animals. 35 (2), 131-139 (2001).
- Harikrishnan, V. S., Hansen, A. K., Abelson, K. S., Sørensen, D. B. A comparison of various methods of blood sampling in mice and rats: Effects on animal welfare. Laboratory Animals. 52 (3), 253-264 (2018).
- Zeller, W., Weber, H., Panoussis, B., Bürge, T., Bergmann, R. Refinement of blood sampling from the sublingual vein of rats. Laboratory Animals. 32 (4), 369-376 (1998).
- Nightingale, C. H., Mouravieff, M. Reliable and simple method of intravenous injection into the laboratory rat. Journal of Pharmaceutical Sciences. 62 (5), 860-861 (1973).
- Blood collection: The rat. IACUC Guideline. UCSF Office of Research Institutional Animal Care and Use Program Available from: https://iacuc.ucsf.edu/sites/g/files/tkssra751/f/wysiwyg/guidelines%20-%20Blood%20Collection%20-%20Rat.pdf (2022)
- Staszyk, C., Bohnet, W., Gasse, H., Hackbarth, H. Blood vessels of the rat tail: A histological re-examination with respect to blood vessel puncture methods. Laboratory Animals. 37 (2), 121-125 (2003).
- Constantinides, C., Mean, R., Janssen, B. J. Effects of isoflurane anesthesia on the cardiovascular function of the C57BL/6 mouse. ILAR Journal. 52 (3), e21-e31 (2011).
- Hernaningsih, Y., Akualing, J. S. The effects of hemolysis on plasma prothrombin time and activated partial thromboplastin time tests using photo-optical method. Medicine. 96 (38), 7976 (2017).
- Powles-Glover, N., Kirk, S., Jardine, L., Clubb, S., Stewart, J. Assessment of haematological and clinical pathology effects of blood microsampling in suckling and weaned juvenile rats. Regulatory Toxicology and Pharmacology. 69 (3), 425-433 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon