需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
黑腹果蝇第三龄幼虫脑的活细胞成像
摘要
在这里,我们讨论了一种工作流程,用于准备、解剖、安装和成像来自黑 腹果蝇 第三龄幼虫的活外植体大脑,以观察生理条件下的细胞和亚细胞动力学。
摘要
果蝇 神经干细胞(神经母细胞,以下简称NBs)经历不对称分裂,再生自我更新的神经母细胞,同时还形成分化神经节母细胞(GMC),该母细胞将经历一次额外的分裂以产生两个神经元或神经胶质细胞。NBs的研究揭示了细胞极性,纺锤体取向,神经干细胞自我更新和分化的分子机制。这些不对称的细胞分裂很容易通过活细胞成像 观察到 ,使幼虫NB非常适合研究活组织中不对称细胞分裂的时空动力学。当在营养补充培养基中正确解剖和成像时,外植体大脑中的NBs强烈分裂12-20小时。前面描述的方法在技术上是困难的,对于那些刚进入该领域的人来说可能具有挑战性。在这里,描述了使用脂肪体补充剂制备、解剖、安装和成像活的三龄幼虫脑外植体的方案。还讨论了潜在的问题,并提供了如何使用这种技术的示例。
引言
不对称细胞分裂 (ACD) 是亚细胞成分(如 RNA、蛋白质和细胞器)在子细胞之间分配不均等的过程 1,2。这个过程在干细胞中很常见,干细胞经历ACD以产生具有不同发育命运的子细胞。果蝇NBs不对称地分裂以产生一个NB,保留其干性,以及一个神经节母细胞(GMC)。GMC经历进一步的分裂以产生分化的神经元或神经胶质细胞3。不对称分裂的NBs在三龄幼虫的发育大脑中很丰富,通过显微镜很容易观察到。在第三龄幼虫阶段,每个中枢脑叶中大约有100个NBs3,4,5,6。
不对称细胞分裂是一个高度动态的过程。活细胞成像方案已被用于测量和量化细胞极性7,8,9,10,纺锤体取向11,12,13,肌动肌蛋白皮层14,15,16,17,18,微管和中心体生物学19,20的动力学,21,22,23,24,25,26,27和膜10,28和染色质动力学29。ACD的定性和定量描述依赖于可靠的方法和协议来成像完整活体大脑中的NBs分割。以下协议概述了使用两种不同的安装方法制备,解剖和成像用于体内活细胞成像的第三龄幼虫大脑的方法。这些方法最适合对干细胞分裂以及其他脑细胞分裂的时空动力学感兴趣的研究人员,因为它们允许对细胞事件进行短期和长期观察。此外,这些技术对于该领域的新手来说很容易获得。我们证明了这种方法在表达荧光标记的微管和皮质融合蛋白的幼虫脑中的有效性和适应性。我们还讨论了分析方法和在其他研究中应用的注意事项。
研究方案
注意: 图1 显示了进行本研究所需的材料。
1. 实验的注意事项和准备
- 防止幼虫过度拥挤。
注意:外植体幼虫大脑的质量与解剖前幼虫的健康和质量直接相关。因过度拥挤而营养不良的幼虫通常会产生质量较低的大脑30。- 确保每个餐盖培养皿的幼虫不超过20-30只,以避免营养不良。这些示例如图 2 所示。
- 使用前过滤并等分施耐德培养基。
- 对于每次解剖,通过用1%牛生长血清(BGS)补充等分的施耐德昆虫培养基来制备新鲜的成像和解剖培养基。5 mL 的解剖和成像介质体积通常足以进行成像实验。
- 使用前将补充的培养基加热至室温 (RT)。
- 考虑要收集的短片的长度,并用它来考虑成像介质的补充、安装方法和显微镜的采集设置。
注意:在最佳条件下,仅补充BGS的大脑中的NB将强有力地分裂3小时以上。- 通过在成像介质中添加幼虫脂肪体组织来补充成像培养基,以支持在进行需要更长电影的实验时超过4小时的分裂。
注意:脂肪体分泌支持NB增殖的有丝分裂原31,来自10个幼虫的整个脂肪体足以支持4到5个大脑。此外,用膜结合载玻片成像的样品已被证明分裂超过10小时13,32,而用多孔载玻片成像的样品通常分裂的频率较低(未发表的观察结果)。 - 或者,为较长的电影实现更复杂的成像介质,如前所述33.通过调整曝光时间、激光功率和采样频率来最大程度地减少光损伤,以获得最佳效果。
- 通过在成像介质中添加幼虫脂肪体组织来补充成像培养基,以支持在进行需要更长电影的实验时超过4小时的分裂。
2. 幼虫分期和收集(图2)
- 将1-5日龄的雌性处女苍蝇与1-7日龄的成年雄性苍蝇杂交,以产生具有所需基因型的后代。为了获得最佳产量,将 10-15 个女性处女与 5-10 个男性杂交。将这些苍蝇放入带有餐盖的苍蝇笼中(图2A-C),并在25°C下孵育。
- 每天交换餐盖。这可以防止餐盖被幼虫过度拥挤,从而降低解剖大脑的质量。
- 如果餐盖被幼虫明显覆盖(即>30),请将该餐盖分成两半,并用同样切成两半的新鲜餐盖代替一半。或者,更频繁地交换餐盖(即每 12 小时而不是每 24 小时)。餐帽过多的示例如图2E,F所示。
- 将餐盖与幼虫在25°C孵育,直到幼虫达到所需年龄。
3.幼虫脂肪体解剖(图3)
注意:本协议描述了使用3孔解剖皿的解剖。
- 将 ~400 μL 解剖和成像培养基移液到 3 孔解剖皿的每个孔中。
- 用解剖钳轻轻握住十只 72-96 小时龄喂养良好的野生型幼虫,并将它们浸入和浸出最底部孔中的解剖溶液,直到所有食物颗粒都被洗掉。冲洗后,将干净的幼虫移到中间孔中。
- 使用一组镊子,用嘴钩握住幼虫。用另一组镊子,破坏幼虫角质层的一侧。
- 这种破裂会导致脂肪体从幼虫中溢出。脂肪体是灰白色和半透明的,将具有格子状结构(图3I)。肥胖的身体也倾向于粘在自己和解剖镊子上。一旦确定,从每个幼虫中收集尽可能多的脂肪体,并用镊子将其转移到带有 400 μL RT 解剖培养基的最顶层孔中。
4.幼虫脑解剖(图3)
- 如上所述在解剖和成像介质中清洗实验幼虫,以清除它们的食物残渣。为获得最佳效果,请避免将未解剖的幼虫存放在解剖溶液中。这将导致幼虫“淹死”,并对解剖大脑的质量产生负面影响。
- 使用一组镊子,用嘴钩握住幼虫。使用另一组镊子,从后侧轻轻切割/撕下大约 1/3 的幼虫(图 3A)。这将导致消化道,脂肪体,结缔组织和神经系统的元素从幼虫破裂的一侧“爆发”出来(图3B)。
- 使用一组镊子,用嘴钩握住幼虫。用另一组镊子,轻轻地将角质层刷向口钩,同时用镊子握住口钩向内“推动”,直到整个幼虫翻过来。这种运动类似于将袜子“从内到外”转动(图3C,D)。
- 将幼虫倒置,使中枢神经系统和其他组织朝外,同时仍与角质层相连。在此步骤中,找到中枢神经系统(CNS)以避免意外移除。使用镊子轻轻去除所有非CNS组织,仅留下附着在角质层上的CNS和大脑(图3E)。
- 大脑将通过轴突连接 附着 在角质层上。使用显微解剖剪刀,切断这些轴突连接,将大脑从角质层释放出来。为此,首先轻轻切开脑叶下方(图3F)。重复腹侧神经索下的连接。
注意:如果没有显微切割剪刀,则可以使用镊子完成此步骤。使用镊子时要特别小心,以确保脑组织在从角质层取出时不会过度拉伸,因为机械应力会对大脑健康产生负面影响。 - 将解剖的大脑转移到带有解剖和成像介质的孔中。对于超过3小时的成像实验,如上所述使用补充脂肪体的解剖和成像介质。分批解剖幼虫,以保持解剖时间在20分钟以下。
5. 安装和成像(图4)
- 对于使用膜结合玻片34成像:
- 在解剖盘的最后一口井中收集解剖的大脑和孤立的脂肪体。
- 通过在载玻片背面放置透气膜来组装载玻片的一半,然后将分体环压入中心,将其固定到位(图4A-C)。
- 使用 200 μL 微量移液器,将 ~130-140 μL 解剖和成像介质中的多达 10 个解剖大脑和尽可能多的脂肪体(见上文)转移到膜上。确保将培养基与样品沉积在透气膜的中心(图4D,E)。
- 针对要成像的NB群体和正在使用的显微镜类型定向大脑(图4E)。将样品放置在尽可能靠近显微镜物镜的位置。例如,要对中央脑叶中的NB进行成像,请调整大脑的方向,使脑叶最接近目标(图4H)。
- 一旦大脑定向,轻轻地将玻璃盖玻片放在膜上的溶液顶部。这将导致含有大脑和脂肪体的溶液扩散到整个膜上(图4F)。
- 通过将实验室组织靠近盖玻片边缘来吸干过量的溶液。当大脑接触盖玻片而不被压扁时,可以达到最佳溶液量。如果在此步骤中需要重新定向,请小心地移动盖玻片以移动大脑。
- 用画笔沿着盖玻片的边缘涂抹融化的凡士林来固定盖玻片。让果冻凝固(图4G)。
- 对于使用多孔成像载玻片成像(图4):
- 将 400 μL 成像培养基添加到多孔载玻片的孔中(在此处进行的实验中,使用腔室 8 孔微型 [μ] 载玻片; 图4I)。将先前解剖的脂肪体转移到该孔中(见步骤3.4)。
- 在孔中心附近的簇中沉积多达10个大脑(图4J)。
- 如步骤5.1.4(图4K)中所述,针对要成像的NB群体和正在使用的显微镜类型定向大脑。排列样本,使它们彼此靠近。这将最大限度地减少样品台在样品之间必须移动的距离,从而减少采集过程中的样品漂移。
- 一旦大脑在井中定向,让大脑沉淀2-5分钟。这增加了它们在运输/成像过程中的稳定性。在此期间准备显微镜以进行采集。
- 用载玻片盖盖住载玻片μ载玻片,然后将其转移到显微镜上。以尽可能低的激光功率和曝光时间开始采集,以最大限度地减少光漂白。
6. 数据处理和管理最佳实践
- 根据可用的分析软件根据需要处理数据。
- 对于此处显示的示例,使用幻灯片软件将采集的数据保存为幻灯片图像文件 (.sld)。
- 要使用 Imaris 文件转换器转换为 Imaris 的专有文件类型 (.ims),请在单独的窗口中打开 Imaris 文件转换器。单击并将.sld文件拖到Imaris文件转换器的“输入”部分。
- 确定转换后文件的所需输出位置,然后单击“全部启动”。
- 转换后,在Imaris软件中查看和注释数据。
注意:可以使用图像分析的替代方案代替Imaris,例如斐济(https://hpc.nih.gov/apps/Fiji.html),Aivia(https://www.aivia-software.com/),Volocity(https://www.volocity4d.com/)或其他。
- 保留尽可能多的原始数据,以便妥善保存记录。例如,如果采集软件保存为一种文件格式,但转换为另一种格式进行分析,请保留采集的数据版本。
- 对于数据分析,请尽可能多地记录有关样品和采集设置的详细信息。要保留的关键信息包括解剖幼虫的基因型、解剖前幼虫的年龄、饲养它们的餐盖状态、成像期间使用的激光功率、曝光时间、采集时间和时间分辨率。
7. 细胞周期长度定量示例(图5)
注意:在本例中,对表达极性标记针(Pins::EGFP16)和微管结合蛋白木星25 (樱桃::木星13)的幼虫进行成像。随后的分析是使用Imaris软件进行的。
- 使用所选的图像分析软件打开电影。滚动浏览电影的长度以识别划分的 NB,并标记它们以供将来参考。通过其不同的有丝分裂纺锤体识别分裂的NB(图5C-E)。
- 确定参考细胞周期阶段以确定细胞周期长度。在本例中,中期用作参考。
- 手动确定连续中期之间的帧数,并将其转换为分钟或小时以确定完成一个细胞周期所需的时间。
- 为此,请采用电影的时间分辨率并将其乘以中期之间的帧数。例如,如果电影的时间分辨率为每 5 分钟一帧,并且在第 13 帧和第 35 帧观察到中期,则这些中期之间的时间为 110 分钟([35 − 13] × 5)。
- 使用任何适当的软件绘制数据。此处显示的数据是使用PRISM软件绘制的。
8. 细胞纺锤对准的量化示例(图5)
注意:在本例中,使用 Imaris 软件执行分析。
- 在 Imaris 或其他所选软件中打开电影文件。滚动浏览电影的长度以识别划分的 NB,并标记它们以供将来参考。
- 使用顶端和基底中心体(用 m表示)确定纺锤体极形成的载体,如下所示:
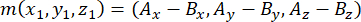
其中 Ax、 Ay 和 Az 是顶端中心体的坐标, Bx、 By 和 Bz 是基底中心体的坐标。类似地,分裂向量的轴(用 n表示)由顶端Pins::EGFP新月形和基底皮层的中点形成: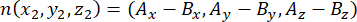
其中 Ax、 Ay 和 Az 是 Pins::EGFP 新月形中点的坐标, Bx、 By 和 Bz 是基底皮层中点的坐标。 - 确定向量 m 和 n 的大小:
m的星等: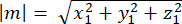
n 的大小: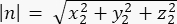
- 确定 m 和 n 的点积(用 k 表示):
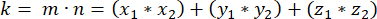
- 使用点积 k 和矢量幅度 m 和 n,确定矢量之间的角度:
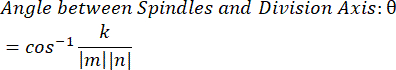
- 在所选软件中绘制数据。此处显示的数据是在 Excel Microsoft 中准备的,并在 PRISM 中可视化。
结果
中枢脑叶NBs的解剖和成像表达Pins::EGFP和樱桃::木星
为了展示这一协议,表达UAS驱动的樱桃::木星13和内源性标记的Pins::EGFP16(w; worGal4,UAS-cherry::jupiter/CyO;引脚::EGFP / TM6B,Tb)使用多孔成像载玻片使用所述方案成像4小时(图5C,D)。其他数据取自表达UAS驱动的樱桃::木星13的...
讨论
该协议概述了一种从 黑腹果蝇 幼虫对活外植体大脑进行成像的方法。这里描述的方案允许在正确的实验条件下观察外植体大脑12-20小时。必须特别考虑样品的制备和所需实验的设计。如上所述,决定解剖组织质量的最关键因素之一是幼虫的健康。为了达到尽可能高的质量,必须确保幼虫在采集前得到良好的喂养。不健康的幼虫最常见的原因是过度拥挤。为了解决这个问题,必须确保通过增...
披露声明
作者没有财务披露需要申报。
致谢
这项研究得到了R35GM148160(C.C.)和美国国立卫生研究院(NIH)培训补助金T32 GM007270(R.C.S)的支持。
材料
| Name | Company | Catalog Number | Comments |
| 0.22 µm polyethersulfone (PES) Membrane | Genesee | 25-231 | Vacuum-driven filters |
| Agar | Genesee | 20-248 | granulated agar |
| Analytical Computer | Dell | NA | Intel Xeon Gold 5222 CPU with two 3.80 GHz processors running Windows 10 on a 64-bit operating system |
| Bovine Growth Serum | HyClone | SH30541.02 | |
| Chambered Imaging Slides | Ibidi | 80826 | |
| Confocal Microscope | Nikon | NA | |
| Custom-machined metal slide | NA | NA | See Cabernard and Doe 2013 (Ref. 34) for specifications |
| Dissection Dishes | Fisher Scientific | 5024343 | 3-well porcelain micro spot plate |
| Dissection Forceps | World Precision Instruments | Dumont #5 | |
| Dissection Microscope | Leica | NA | |
| Dissection Scissors | Fine Science Tools (FST) | 15003-08 | |
| Embryo collection cage | Genesee | 59-100 | |
| Flypad with access to CO2 to anesthetize adult flies | Genesee | 59-172 | |
| Gas-permeable membrane | YSI | 98095 | Gas-permeable membrane |
| Glass Cover Slides | Electron Microscopy Sciences | 72204-03 | # 1.5; 22 mm x 40 mm glass coverslips |
| Imaris | Oxford Instruments | NA | Alternatives: Fiji, Volocity, Aivia |
| Imaris File Converter | Oxford Instruments | NA | |
| Instant Yeast | Saf-Instant | NA | |
| Molasses | Genesee | 62-117 | |
| Petri dish | Greiner Bio-One | 628161 | 60 mm x 15 mm Petri dish |
| Petroleum Jelly | Vaseline | NA | |
| Schneider's Insect Medium with L-glutamine and sodium bicarbonate liquid | Millipore Sigma | S0146 | |
| SlideBook acquisition software | 3i | NA | |
| Vacuum-Driven Filtration Unit with a 0.22 µµm PES membrane filter | Genesee Scientific, GenClone | 25-231 |
参考文献
- Delgado, M. K., Cabernard, C. Mechanical regulation of cell size, fate, and behavior during asymmetric cell division. Current Opinion in Cell Biology. 67, 9-16 (2020).
- Sunchu, B., Cabernard, C. Principles and mechanisms of asymmetric cell division. Development. 147 (13), (2020).
- Homem, C. C. F., Knoblich, J. A. Drosophila neuroblasts: A model for stem cell biology. Development. 139 (23), 4297-4310 (2012).
- Gallaud, E., Pham, T., Cabernard, C. Drosophila melanogaster neuroblasts: A model for asymmetric stem cell divisions. Results and Problems in Cell Differentiation. 61 (1489), 183-210 (2017).
- Loyer, N., Januschke, J. Where does asymmetry come from? Illustrating principles of polarity and asymmetry establishment in Drosophila neuroblasts. Current Opinion in Cell Biology. 62, 70-77 (2020).
- Pollington, H. Q., Seroka, A. Q., Doe, C. Q. From temporal patterning to neuronal connectivity in Drosophila type I neuroblast lineages. Seminars in Cell & Developmental Biology. 142, 4-12 (2023).
- Oon, C. H., Prehoda, K. Asymmetric recruitment and actin dependent cortical flows drive the neuroblast polarity cycle. eLife. 8, e45815 (2019).
- Ramat, A., Hannaford, M., Januschke, J. Maintenance of miranda localization in Drosophila neuroblasts involves interaction with the cognate mRNA. Current Biology. 27 (14), 2101-2111 (2017).
- Oon, C. H., Prehoda, K. E. Phases of cortical actomyosin dynamics coupled to the neuroblast polarity cycle. eLife. 10, e66574 (2021).
- LaFoya, B., Prehoda, K. E. Actin-dependent membrane polarization reveals the mechanical nature of the neuroblast polarity cycle. Cell Reports. 35 (7), 109146 (2021).
- Siller, K. H., Doe, C. Q. Lis1/dynactin regulates metaphase spindle orientation in Drosophila neuroblasts. Developmental Biology. 319 (1), 1-9 (2008).
- Siller, K. H., Cabernard, C., Doe, C. Q. The NuMA-related Mud protein binds Pins and regulates spindle orientation in Drosophila neuroblasts. Nature Cell Biology. 8 (6), 594-600 (2006).
- Cabernard, C., Doe, C. Q. Apical/basal spindle orientation is required for neuroblast homeostasis and neuronal differentiation in Drosophila. Developmental Cell. 17 (1), 134-141 (2009).
- Cabernard, C., Prehoda, K. E., Doe, C. Q. A spindle-independent cleavage furrow positioning pathway. Nature. 467 (7311), 91-94 (2010).
- Connell, M., Cabernard, C., Ricketson, D., Doe, C. Q., Prehoda, K. E. Asymmetric cortical extension shifts cleavage furrow position in Drosophila neuroblasts. Molecular Biology of the Cell. 22 (22), 4220-4226 (2011).
- Tsankova, A., Pham, T. T., Garcia, D. S., Otte, F., Cabernard, C. Cell polarity regulates biased myosin activity and dynamics during asymmetric cell division via Drosophila rho kinase and protein kinase N. Developmental Cell. 42 (2), 143-155 (2017).
- Montembault, E., et al. Myosin efflux promotes cell elongation to coordinate chromosome segregation with cell cleavage. Nature Communications. 8 (1), 326 (2017).
- Roubinet, C., et al. Spatio-temporally separated cortical flows and spindle geometry establish physical asymmetry in fly neural stem cells. Nature Communications. 8 (1), 1383 (2017).
- Januschke, J., et al. Centrobin controls mother-daughter centriole asymmetry in Drosophila neuroblasts. Nature Cell Biology. 15 (3), 241-248 (2013).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nature Communications. 2 (1), 243 (2011).
- Rebollo, E., et al. Functionally unequal centrosomes drive spindle orientation in asymmetrically dividing Drosophila neural stem cells. Developmental Cell. 12 (3), 467-474 (2007).
- Januschke, J., Gonzalez, C. The interphase microtubule aster is a determinant of asymmetric division orientation in Drosophila neuroblasts. The Journal of Cell Biology. 188 (5), 693-706 (2010).
- Rusan, N. M., Peifer, M. A role for a novel centrosome cycle in asymmetric cell division. The Journal of Cell Biology. 177 (1), 13-20 (2007).
- Lerit, D. A., et al. Interphase centrosome organization by the PLP-Cnn scaffold is required for centrosome function. Journal of Cell Biology. 210 (1), 79-97 (2015).
- Gallaud, E., et al. Dynamic centriolar localization of Polo and Centrobin in early mitosis primes centrosome asymmetry. PLoS Biology. 18 (8), e3000762 (2020).
- Ramdas Nair, A., et al. The microcephaly-associated protein Wdr62/CG7337 is required to maintain centrosome asymmetry in Drosophila neuroblasts. Cell Reports. 14 (5), 1100-1113 (2016).
- Singh, P., Nair, A. R., Cabernard, C. The centriolar protein Bld10/Cep135 is required to establish centrosome asymmetry in Drosophila neuroblasts. Current Biology. 24 (13), 1548-1555 (2014).
- LaFoya, B., Prehoda, K. E. Consumption of a polarized membrane reservoir drives asymmetric membrane expansion during the unequal divisions of neural stem cells. Developmental Cell. 1534 (23), 00159 (2023).
- Sunchu, B., et al. Asymmetric chromatin retention and nuclear envelopes separate chromosomes in fused cells in vivo. Communications Biology. 5 (1), 953 (2022).
- Oliveira, A. C., Rebelo, A. R., Homem, C. C. F. Integrating animal development: How hormones and metabolism regulate developmental transitions and brain formation. Developmental Biology. 475, 256-264 (2021).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125 (11), 2149-2158 (1998).
- Lee, C. -. Y., et al. Drosophila Aurora-A kinase inhibits neuroblast self-renewal by regulating aPKC/Numb cortical polarity and spindle orientation. Genes & Development. 20 (24), 3464-3474 (2006).
- Homem, C. C. F., Reichardt, I., Berger, C., Lendl, T., Knoblich, J. A. Long-term live cell imaging and automated 4D analysis of Drosophila neuroblast lineages. PLoS ONE. 8 (11), e79588 (2013).
- Cabernard, C., Doe, C. Q. Live imaging of neuroblast lineages within intact larval brains in Drosophila. Cold Spring Harbor Protocols. 2013 (10), 970-977 (2013).
- Karpova, N., Bobinnec, Y., Fouix, S., Huitorel, P., Debec, A. Jupiter, a new Drosophila protein associated with microtubules. Cell Motility and the Cytoskeleton. 63 (5), 301-312 (2006).
- Loyer, N., Januschke, J. The last-born daughter cell contributes to division orientation of Drosophila larval neuroblasts. Nature Communications. 9 (1), 3745 (2018).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted Drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。