Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Drosophila melanogaster Üçüncü Instar Larva Beyinlerinin Canlı Hücre Görüntülemesi
Bu Makalede
Özet
Burada, fizyolojik koşullar altında hücresel ve hücre altı dinamikleri gözlemlemek için Drosophila melanogaster üçüncü instar larvalarından canlı eksplant beyinlerini hazırlamak, parçalamak, monte etmek ve görüntülemek için bir iş akışını tartışıyoruz.
Özet
Drosophila nöral kök hücreleri (nöroblastlar, bundan sonra NB'ler) asimetrik bölünmelere uğrar, kendini yenileyen nöroblastı yenilerken, aynı zamanda iki nöron veya glia'ya yol açmak için ek bir bölünmeye uğrayacak olan farklılaştırıcı bir gangliyon ana hücresi (GMC) oluşturur. NB'lerde yapılan çalışmalar, hücre polaritesi, iğ oryantasyonu, nöral kök hücre kendini yenileme ve farklılaşmanın altında yatan moleküler mekanizmaları ortaya çıkarmıştır. Bu asimetrik hücre bölünmeleri, canlı hücre görüntüleme yoluyla kolayca gözlemlenebilir, bu da larva NB'leri canlı dokudaki asimetrik hücre bölünmesinin mekansal zamansal dinamiklerini araştırmak için ideal hale getirir. Besin takviyeli ortamda düzgün bir şekilde diseke edildiğinde ve görüntülendiğinde, eksplant beyinlerindeki NB'ler 12-20 saat boyunca sağlam bir şekilde bölünür. Daha önce açıklanan yöntemler teknik olarak zordur ve bu alanda yeni olanlar için zorlayıcı olabilir. Burada, yağ vücut takviyeleri kullanılarak canlı üçüncü instar larva beyin eksplantlarının hazırlanması, diseksiyonu, montajı ve görüntülenmesi için bir protokol açıklanmaktadır. Olası problemler de tartışılmakta ve bu tekniğin nasıl kullanılabileceğine dair örnekler verilmektedir.
Giriş
Asimetrik hücre bölünmesi (ACD), RNA, proteinler ve organeller gibi hücre altı bileşenlerinyavru hücreler 1,2 arasında eşit olmayan bir şekilde bölündüğü süreçtir. Bu süreç, farklı gelişimsel kaderlere sahip yavru hücrelere yol açmak için ACD'ye maruz kalan kök hücrelerde yaygın olarak görülür. Drosophila NB'ler, kökünü koruyan bir NB ve bir ganglion ana hücresi (GMC) üretmek için asimetrik olarak bölünür. GMC, farklılaştırıcı nöronlar veya glia3 üretmek için daha fazla bölünmeye uğrar. Asimetrik olarak bölünen NB'ler, mikroskopi ile kolayca gözlemlenen üçüncü instar larvalarının gelişmekte olan beyinlerinde bol miktarda bulunur. Üçüncü instar larva aşamasında, her bir merkezi beyin lobundayaklaşık 100 NB bulunur 3,4,5,6.
Asimetrik hücre bölünmesi oldukça dinamik bir süreçtir. Canlı hücre görüntüleme protokolleri, hücre polaritesi 7,8,9,10, iğ oryantasyonu11,12,13, aktomiyosin korteksdinamiği 14,15,16,17,18, mikrotübül ve sentrozom biyolojisi 19,20 dinamiklerini ölçmek ve ölçmek için kullanılmıştır,21,22,23,24,25,26,27 ve membran 10,28 ve kromatin dinamiği 29. ACD'nin nitel ve nicel açıklamaları, sağlam canlı beyinlerde NB'leri bölmek için sağlam yöntemlere ve protokollere dayanır. Aşağıdaki protokol, iki farklı montaj yaklaşımı kullanarak in vivo canlı hücre görüntüleme için üçüncü instar larva beyinlerini hazırlama, disseke etme ve görüntüleme yöntemlerini özetlemektedir. Bu yöntemler, kök hücre bölünmelerinin mekansal zamansal dinamiklerinin yanı sıra diğer beyin hücrelerindeki bölünmelerle ilgilenen araştırmacılar için en uygun olanıdır, çünkü hücresel olayların kısa ve uzun vadeli gözlemlerine izin verirler. Ek olarak, bu tekniklere alana yeni gelenler için kolayca erişilebilir. Bu yaklaşımın etkinliğini ve uyarlanabilirliğini, floresan olarak etiketlenmiş mikrotübül ve kortikal füzyon proteinlerini eksprese eden larva beyinleri ile gösteriyoruz. Ek olarak, analiz yöntemlerini ve diğer çalışmalarda uygulama için dikkat edilmesi gerekenleri tartışıyoruz.
Protokol
NOT: Şekil 1'de bu etüdü gerçekleştirmek için gerekli malzemeler gösterilmektedir.
1. Deney için dikkat edilmesi gereken noktalar ve hazırlıklar
- Larvaların aşırı kalabalıklaşmasını önleyin.
NOT: Eksplant larva beyinlerinin kalitesi, diseksiyon öncesi larvaların sağlığı ve kalitesi ile doğrudan ilişkilidir. Aşırı kalabalıktan yetersiz beslenen larvalar genellikle daha düşük kaliteli beyinler verir30.- Yetersiz beslenmeyi önlemek için yemek kapağı kabı başına 20-30'dan fazla larva bulunmadığından emin olun. Bunların örnekleri Şekil 2'de görülebilir.
- Kullanmadan önce Schneider'in ortamını filtreleyin ve aliquot edin.
- Her diseksiyon için, alıntılanan Schneider'in böcek besiyerini% 1 sığır büyüme serumu (BGS) ile destekleyerek taze görüntüleme ve diseksiyon ortamı hazırlayın. Bir görüntüleme deneyi için genellikle 5 mL'lik bir diseksiyon ve görüntüleme ortamı hacmi yeterlidir.
- Kullanmadan önce takviye edilen ortamı oda sıcaklığına (RT) ısıtın.
- Toplanacak filmin uzunluğunu düşünün ve görüntüleme ortamının takviyesini, montaj yaklaşımını ve mikroskobun edinme ayarlarını hesaba katmak için bunu kullanın.
NOT: En uygun koşullar altında, sadece BGS ile desteklenen beyinlerdeki NB'ler, 3 saate kadar sağlam bir şekilde bölünecektir.- Daha uzun filmler gerektiren deneyler yaparken 4 saatten önceki bölünmeleri desteklemek için görüntüleme ortamına larva yağlı vücut dokuları ekleyerek görüntüleme ortamını destekleyin.
NOT: Yağlı cisimler NB proliferasyonunu destekleyen mitojenler salgılar31 ve 10 larvadan gelen tüm yağlı vücutlar dört ila beş beyni desteklemek için yeterlidir. Ayrıca, membrana bağlı bir slaytla görüntülenen örneklerin 10 saat13,32'den fazla bölündüğü gösterilirken, çok kuyucuklu bir slaytla görüntülenen örnekler genellikle daha az bölünür (yayınlanmamış gözlemler). - Alternatif olarak, daha önce açıklandığı gibi daha uzun filmler için daha karmaşık bir görüntüleme ortamı uygulayın33. En iyi sonuçlar için pozlama süresini, lazer gücünü ve örnekleme frekansını ayarlayarak fotohasarı en aza indirin.
- Daha uzun filmler gerektiren deneyler yaparken 4 saatten önceki bölünmeleri desteklemek için görüntüleme ortamına larva yağlı vücut dokuları ekleyerek görüntüleme ortamını destekleyin.
2. Larva evrelemesi ve toplanması (Şekil 2)
- İstenilen genotipte döl üretmek için 1-5 günlük dişi bakire sinekleri 1-7 günlük yetişkin erkek sineklerle geçin. Optimum verim için, 10-15 dişi bakireyi 5-10 erkekle geçin. Bu sinekleri bir yemek kapağı olan bir sinek kafesine koyun (Şekil 2A-C) ve 25 ° C'de kuluçkaya yatırın.
- Yemek kapağını günlük olarak değiştirin. Bu, yemek kapaklarının larvalarla aşırı kalabalıklaşmasını önler, bu da disseke beyinlerin kalitesini düşürür.
- Yemek kapağı larvalarla önemli ölçüde kaplıysa (yani, >30), bu yemek kapağını ikiye bölün ve yarısını da ikiye kesilmiş taze bir yemek kapağıyla değiştirin. Alternatif olarak, yemek kapaklarını daha sık değiştirin (yani, her 24 saatte bir yerine her 12 saatte bir). Aşırı nüfuslu yemek kapaklarının örnekleri Şekil 2E, F'de görülebilir.
- Larvalar istenen yaşa ulaşana kadar yemek kapağını larvalarla 25 ° C'de inkübe edin.
3. Larva yağlı vücut diseksiyonu (Şekil 3)
NOT: Bu protokol, 3 kuyucuklu bir diseksiyon kabı kullanarak diseksiyonları açıklar.
- Pipet, 3 delikli bir diseksiyon kabının her bir kuyucuğuna ~ 400 μL diseksiyon ve görüntüleme ortamı.
- On adet 72-96 saatlik iyi beslenmiş vahşi tip larvaları, diseksiyon forsepsleri ile hafifçe tutarak ve tüm gıda partikülleri yıkanana kadar en alttaki kuyuya diseksiyon çözeltisinin içine ve dışına daldırarak yıkayın. Durulamadan sonra, temiz larvaları orta kuyuya taşıyın.
- Bir cımbız seti kullanarak, larvaları ağız kancalarından tutun. Diğer cımbız seti ile larvaların kütikülünün bir tarafını yırtın.
- Bu yırtılma, yağlı cisimlerin larvadan dökülmesine neden olacaktır. Yağ cisimleri kirli beyaz ve yarı yarı saydamdır ve kafes benzeri bir yapıya sahip olacaktır (Şekil 3I). Yağlı cisimler ayrıca kendilerine ve diseksiyon cımbızlarına yapışma eğiliminde olacaktır. Tanımlandıktan sonra, her larvadan mümkün olduğunca fazla yağ gövdesi toplayın ve forseps ile 400 μL RT diseksiyon ortamı ile en üstteki kuyuya aktarın.
4. Larva beyin diseksiyonu (Şekil 3)
- Deneysel larvaları yiyecek artıklarından arındırmak için yukarıdaki gibi diseksiyon ve görüntüleme ortamında yıkayın. En iyi sonuçlar için, disseke edilmemiş larvaları diseksiyon çözeltisinde saklamaktan kaçının. Bu, larvaların "boğulmasına" neden olacak ve disseke edilmiş beyinlerin kalitesini olumsuz yönde etkileyecektir.
- Bir cımbız seti kullanarak, larvaları ağız kancalarından tutun. Başka bir cımbız seti kullanarak, larvaların yaklaşık 1 / 3'ünü arka taraftan yavaşça kesin / sökün (Şekil 3A). Bu, sindirim sisteminin, yağ gövdelerinin, bağ dokusunun ve sinir sisteminin elemanlarının larvaların yırtılmış tarafından "patlamasına" neden olacaktır (Şekil 3B).
- Bir cımbız seti kullanarak, larvaları ağız kancalarından tutun. Diğer cımbız seti ile, kütikülü ağız kancalarına doğru nazikçe fırçalayın, tüm larva içten dışa dönene kadar ağız kancalarını tutan cımbızlarla içeri doğru "iterek". Bu hareket bir çorabı "içten dışa" çevirmeye benzer (Şekil 3C, D).
- Larvaları ters çevirin, böylece merkezi sinir sistemi ve diğer dokular hala kütiküle bağlıyken dışa doğru bakar. Bu adımda, yanlışlıkla çıkarılmasını önlemek için merkezi sinir sistemini (CNS) bulun. Cımbız kullanarak, CNS olmayan tüm dokuları nazikçe çıkarın, sadece CNS ve beyni kütiküle bağlı bırakın (Şekil 3E).
- Beyin, aksonal bağlantılar yoluyla kütiküle bağlanacaktır. Mikrodiseksiyon makası kullanarak, beyni kütikülden serbest bırakmak için bu aksonal bağlantıları kesin. Bunu yapmak için, önce beyin loblarının altını yavaşça kesin (Şekil 3F). Ventral sinir kordonunun altındaki bağlantılarla tekrarlayın.
NOT: Bu adım, mikrodiseksiyon makası mevcut değilse cımbızla yapılabilir. Cımbız kullanırken, kütikülden çıkarılırken beyin dokusunun aşırı gerilmediğinden emin olmak için özel dikkat gösterin, çünkü mekanik stres beyin sağlığını olumsuz yönde etkileyecektir. - Diseke edilen beyni diseksiyon ve görüntüleme ortamı ile bir kuyuya aktarın. 3 saatten daha uzun görüntüleme deneyleri için, yukarıda açıklandığı gibi yağlı cisimlerle desteklenmiş diseksiyon ve görüntüleme ortamı kullanın. Diseksiyon süresini 20 dakikanın altında tutmak için larvaları gruplar halinde diseke edin.
5. Montaj ve görüntüleme (Şekil 4)
- Membrana bağlı slayt34 ile görüntüleme için:
- Diseksiyon kabının son kuyusunda hem disseke edilmiş beyinleri hem de izole edilmiş yağ gövdelerini toplayın.
- Slaytın yarısını, slaytın arkasına gaz geçirgen bir membran yerleştirerek birleştirin ve bölünmüş halkayı yerinde tutarak merkeze bastırın (Şekil 4A-C).
- 200 μL'lik bir mikropipet kullanarak, ~ 130-140 μL diseksiyon ve görüntüleme ortamında 10 adede kadar disseke edilmiş beyni ve mümkün olduğunca fazla yağ gövdesini (yukarıya bakın) membrana aktarın. Ortamı, numunelerle birlikte gaz geçirgen membranın ortasına bıraktığınızdan emin olun (Şekil 4D, E).
- Beyinleri, görüntülenecek NB popülasyonu ve kullanılan mikroskop türü için yönlendirin (Şekil 4E). Numuneyi mikroskopun amacına mümkün olduğunca yakın konumlandırın. Örneğin, merkezi beyin loblarındaki NB'leri görüntülemek için, beyinleri beyin lobları hedefe en yakın olacak şekilde yönlendirin (Şekil 4H).
- Beyinler yönlendirildikten sonra, zardaki çözeltinin üzerine yavaşça bir cam örtü parçası yerleştirin. Bu, beyinleri ve yağ gövdelerini içeren çözeltinin zarın tamamına yayılmasına neden olacaktır (Şekil 4F).
- Bir laboratuvar dokusunu kapak kayma kenarına yakın tutarak aşırı çözeltiyi lekeleyin. En uygun çözüm miktarı, beyinler ezilmeden kapak kaymasına dokunduğunda elde edilir. Bu adımda yeniden yönlendirme gerekiyorsa, beyinleri hareket ettirmek için kapak kaymasını dikkatlice hareket ettirin.
- Bir boya fırçası ile kapak kaymasının kenarları boyunca erimiş petrol jölesi uygulayarak kapak kaymasını hareketsiz hale getirin. Jölenin katılaşmasına izin verin (Şekil 4G).
- Çok kuyulu görüntüleme slaytı ile görüntüleme için (Şekil 4):
- Çok kuyucuklu bir slaytın bir kuyucuğuna 400 μL görüntüleme ortamı ekleyin (burada yapılan deneyde, odacıklı 8 delikli bir mikro [μ] slayt kullanılmıştır; Şekil 4I). Daha önce disseke edilmiş yağ cisimleri bu kuyuya aktarın (bkz. adım 3.4).
- Kuyunun merkezine yakın bir kümede 10 adede kadar beyin biriktirin (Şekil 4J).
- Beyinleri, görüntülenecek NB popülasyonu ve kullanılan mikroskop türü için, adım 5.1.4'te açıklandığı gibi yönlendirin (Şekil 4K). Örnekleri birbirine yakın olacak şekilde düzenleyin. Bu, aşamanın numuneler arasında hareket etmesi gereken mesafeyi en aza indirecek ve bu da alım sırasında numune sürüklenmesini azaltacaktır.
- Beyinler kuyuya yönlendirildikten sonra, beyinlerin 2-5 dakika boyunca yerleşmesine izin verin. Bu, taşıma / görüntüleme sırasında stabilitelerini arttırır. Bu süre zarfında mikroskopu edinim için hazırlayın.
- μ slaytı slayt kapağıyla örtün ve mikroskopa aktarın. Fotobeyazlatmayı en aza indirmek için mümkün olan en düşük lazer gücü ve pozlama süresi ile edinmeye başlayın.
6. Veri işleme ve yönetimi için en iyi uygulamalar
- Verileri mevcut analiz yazılımına göre gerektiği gibi işleyin.
- Burada gösterilen örnek için, elde edilen verileri SlideBook yazılımıyla SlideBook Image File (.sld) olarak kaydedin.
- Imaris Dosya Dönüştürücüsü'nü kullanarak Imaris'in tescilli dosya türüne (.ims) dönüştürmek için, Imaris Dosya Dönüştürücüsü'nü ayrı bir pencerede açın. .sld dosyalarını tıklayın ve Imaris Dosya Dönüştürücüsü'nün " giriş" bölümüne sürükleyin.
- Dönüştürülen dosyalar için istediğiniz çıktı konumunu belirleyin ve "Tümünü başlat" ı tıklayın.
- Dönüştürmeden sonra, Imaris yazılımındaki verileri görüntüleyin ve bunlara açıklama ekleyin.
NOT: Görüntü analizi için Fiji (https://hpc.nih.gov/apps/Fiji.html), Aivia (https://www.aivia-software.com/), Volocity (https://www.volocity4d.com/) veya diğerleri gibi Imaris yerine alternatifler kullanılabilir.
- Doğru kayıt tutma için orijinal verilerin mümkün olduğunca çoğunu saklayın. Örneğin, edinme yazılımı bir dosya biçiminde kaydedilmiş, ancak analiz için farklı bir biçime dönüştürülmüşse, verilerin edinilen sürümünü koruyun.
- Veri analizi için, örnek ve edinme ayarları hakkında mümkün olduğunca çok ayrıntının kaydını tutun. Saklanacak anahtar bilgiler, disseke edilen larvaların genotipini, diseksiyondan önce larvaların yaşını, yetiştirildikleri yemek kapağının durumunu, görüntüleme sırasında kullanılan lazer gücünü, maruz kalma süresini, edinim uzunluğunu ve zamansal çözünürlüğü içerir.
7. Hücre döngüsü uzunluğunun örnek nicelleştirilmesi (Şekil 5)
NOT: Bu örnekte, polarite işaretleyici Pinleri (Pins::EGFP16) ve mikrotübül bağlayıcı protein Jüpiter25'i (cherry::Jüpiter13) ifade eden larvalar görüntülenmiştir. Sonraki analiz Imaris yazılımı kullanılarak gerçekleştirildi.
- Seçtiğiniz görüntü analiz yazılımını kullanarak filmi açın. Bölünen NB'leri tanımlamak için filmin uzunluğu boyunca ilerleyin ve ileride başvurmak üzere etiketleyin. Bölünen NB'leri farklı mitotik iğlerine göre tanımlayın (Şekil 5C-E).
- Hücre döngüsü uzunluğunu belirlemek için bir referans hücre döngüsü aşaması tanımlayın. Bu örnekte, metafaz başvuru olarak kullanılmıştır.
- Ardışık metafazlar arasındaki kare sayısını el ile belirleyin ve bir hücre döngüsünü tamamlamak için geçen süreyi belirlemek için bunu dakikalara veya saatlere dönüştürün.
- Bunu, filmin zamansal çözünürlüğünü alarak ve metafazlar arasındaki kare sayısıyla çarparak yapın. Örneğin, filmin zamansal çözünürlüğü her 5 dakikada bir kareyse ve metafazlar kare 13 ve kare 35'te gözlenirse, bu metafazlar arasındaki süre 110 dakika olacaktır ([35 − 13] × 5).
- Verileri uygun herhangi bir yazılımla çizin. Burada gösterilen veriler PRISM yazılımı kullanılarak çizilmiştir.
8. Hücre mili hizalamasının örnek nicelleştirilmesi (Şekil 5)
NOT: Bu örnekte, analiz Imaris yazılımı kullanılarak gerçekleştirilir.
- Film dosyasını Imaris'te veya tercih edilen başka bir yazılımda açın. Bölünen NB'leri tanımlamak için filmin uzunluğu boyunca ilerleyin ve ileride başvurmak üzere etiketleyin.
- Apikal ve bazal sentrozomları ( m ile temsil edilen) kullanarak iş mili kutupları tarafından oluşturulan vektörü aşağıdaki gibi belirleyin:
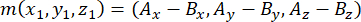
burada Ax, Ay ve Az , apikal sentrozomun koordinatlarıdır ve Bx, By ve Bz , bazal sentrozomun koordinatlarıdır. Benzer şekilde, bölünme vektörünün ekseni ( n ile temsil edilir) apikal Pinlerin orta noktası tarafından oluşturulur::EGFP hilali ve bazal korteks: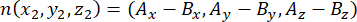
burada Ax, Ay ve Az , Pinlerin orta noktasının koordinatlarıdır::EGFP hilali ve Bx, By ve Bz , bazal korteksin orta noktasının koordinatlarıdır. - m ve n vektörlerinin büyüklüğünü belirleyin:
m büyüklüğü: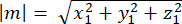
n'nin büyüklüğü: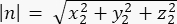
- m ve n'nin nokta ürününü (k ile temsil edilen) belirleyin:
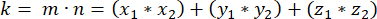
- Nokta çarpımı k ve vektör büyüklükleri m ve n'yi kullanarak, vektörler arasındaki açıyı belirleyin:
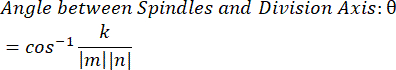
- Verileri tercih ettiğiniz yazılımda çizin. Burada gösterilen veriler Microsoft Excel'de hazırlanmış ve PRISM'de görselleştirilmiştir.
Sonuçlar
Pinleri ifade eden merkezi beyin lobu NB'lerinin diseksiyonu ve görüntülenmesi::EGFP ve Cherry::Jüpiter
Bu protokolü sergilemek için, UAS güdümlü Kiraz::Jüpiter13'ü ifade eden larvalar ve endojen olarak etiketlenmiş Pinler::EGFP16 (w; worGal4, UAS-cherry::jüpiter/CyO; Pinler::EGFP/TM6B, Tb) çok kuyulu görüntüleme slaytları kullanılarak tarif edilen protokol kullanılarak 4 saat boyunca görüntülendi (Şekil 5C,D<...
Tartışmalar
Bu protokol, Drosophila melanogaster larvalarından canlı eksplant beyinlerinin görüntülenmesi için bir yaklaşımı özetlemektedir. Burada açıklanan protokol, eksplant beyinlerinin doğru deneysel koşullar altında 12-20 saat boyunca gözlemlenmesini sağlar. Numunelerin hazırlanmasına ve istenen deneylerin tasarımına özel dikkat gösterilmelidir. Yukarıda belirtildiği gibi, disseke edilmiş dokunun kalitesini belirleyen en kritik faktörlerden biri larvaların sağlığıdır. Mümkün olan en ...
Açıklamalar
Yazarların beyan edecekleri herhangi bir finansal açıklama bulunmamaktadır.
Teşekkürler
Bu araştırma R35GM148160 (C. C.) ve Ulusal Sağlık Enstitüleri (NIH) Eğitim Hibesi T32 GM007270 (R. C. S) tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 0.22 µm polyethersulfone (PES) Membrane | Genesee | 25-231 | Vacuum-driven filters |
| Agar | Genesee | 20-248 | granulated agar |
| Analytical Computer | Dell | NA | Intel Xeon Gold 5222 CPU with two 3.80 GHz processors running Windows 10 on a 64-bit operating system |
| Bovine Growth Serum | HyClone | SH30541.02 | |
| Chambered Imaging Slides | Ibidi | 80826 | |
| Confocal Microscope | Nikon | NA | |
| Custom-machined metal slide | NA | NA | See Cabernard and Doe 2013 (Ref. 34) for specifications |
| Dissection Dishes | Fisher Scientific | 5024343 | 3-well porcelain micro spot plate |
| Dissection Forceps | World Precision Instruments | Dumont #5 | |
| Dissection Microscope | Leica | NA | |
| Dissection Scissors | Fine Science Tools (FST) | 15003-08 | |
| Embryo collection cage | Genesee | 59-100 | |
| Flypad with access to CO2 to anesthetize adult flies | Genesee | 59-172 | |
| Gas-permeable membrane | YSI | 98095 | Gas-permeable membrane |
| Glass Cover Slides | Electron Microscopy Sciences | 72204-03 | # 1.5; 22 mm x 40 mm glass coverslips |
| Imaris | Oxford Instruments | NA | Alternatives: Fiji, Volocity, Aivia |
| Imaris File Converter | Oxford Instruments | NA | |
| Instant Yeast | Saf-Instant | NA | |
| Molasses | Genesee | 62-117 | |
| Petri dish | Greiner Bio-One | 628161 | 60 mm x 15 mm Petri dish |
| Petroleum Jelly | Vaseline | NA | |
| Schneider's Insect Medium with L-glutamine and sodium bicarbonate liquid | Millipore Sigma | S0146 | |
| SlideBook acquisition software | 3i | NA | |
| Vacuum-Driven Filtration Unit with a 0.22 µµm PES membrane filter | Genesee Scientific, GenClone | 25-231 |
Referanslar
- Delgado, M. K., Cabernard, C. Mechanical regulation of cell size, fate, and behavior during asymmetric cell division. Current Opinion in Cell Biology. 67, 9-16 (2020).
- Sunchu, B., Cabernard, C. Principles and mechanisms of asymmetric cell division. Development. 147 (13), (2020).
- Homem, C. C. F., Knoblich, J. A. Drosophila neuroblasts: A model for stem cell biology. Development. 139 (23), 4297-4310 (2012).
- Gallaud, E., Pham, T., Cabernard, C. Drosophila melanogaster neuroblasts: A model for asymmetric stem cell divisions. Results and Problems in Cell Differentiation. 61 (1489), 183-210 (2017).
- Loyer, N., Januschke, J. Where does asymmetry come from? Illustrating principles of polarity and asymmetry establishment in Drosophila neuroblasts. Current Opinion in Cell Biology. 62, 70-77 (2020).
- Pollington, H. Q., Seroka, A. Q., Doe, C. Q. From temporal patterning to neuronal connectivity in Drosophila type I neuroblast lineages. Seminars in Cell & Developmental Biology. 142, 4-12 (2023).
- Oon, C. H., Prehoda, K. Asymmetric recruitment and actin dependent cortical flows drive the neuroblast polarity cycle. eLife. 8, e45815 (2019).
- Ramat, A., Hannaford, M., Januschke, J. Maintenance of miranda localization in Drosophila neuroblasts involves interaction with the cognate mRNA. Current Biology. 27 (14), 2101-2111 (2017).
- Oon, C. H., Prehoda, K. E. Phases of cortical actomyosin dynamics coupled to the neuroblast polarity cycle. eLife. 10, e66574 (2021).
- LaFoya, B., Prehoda, K. E. Actin-dependent membrane polarization reveals the mechanical nature of the neuroblast polarity cycle. Cell Reports. 35 (7), 109146 (2021).
- Siller, K. H., Doe, C. Q. Lis1/dynactin regulates metaphase spindle orientation in Drosophila neuroblasts. Developmental Biology. 319 (1), 1-9 (2008).
- Siller, K. H., Cabernard, C., Doe, C. Q. The NuMA-related Mud protein binds Pins and regulates spindle orientation in Drosophila neuroblasts. Nature Cell Biology. 8 (6), 594-600 (2006).
- Cabernard, C., Doe, C. Q. Apical/basal spindle orientation is required for neuroblast homeostasis and neuronal differentiation in Drosophila. Developmental Cell. 17 (1), 134-141 (2009).
- Cabernard, C., Prehoda, K. E., Doe, C. Q. A spindle-independent cleavage furrow positioning pathway. Nature. 467 (7311), 91-94 (2010).
- Connell, M., Cabernard, C., Ricketson, D., Doe, C. Q., Prehoda, K. E. Asymmetric cortical extension shifts cleavage furrow position in Drosophila neuroblasts. Molecular Biology of the Cell. 22 (22), 4220-4226 (2011).
- Tsankova, A., Pham, T. T., Garcia, D. S., Otte, F., Cabernard, C. Cell polarity regulates biased myosin activity and dynamics during asymmetric cell division via Drosophila rho kinase and protein kinase N. Developmental Cell. 42 (2), 143-155 (2017).
- Montembault, E., et al. Myosin efflux promotes cell elongation to coordinate chromosome segregation with cell cleavage. Nature Communications. 8 (1), 326 (2017).
- Roubinet, C., et al. Spatio-temporally separated cortical flows and spindle geometry establish physical asymmetry in fly neural stem cells. Nature Communications. 8 (1), 1383 (2017).
- Januschke, J., et al. Centrobin controls mother-daughter centriole asymmetry in Drosophila neuroblasts. Nature Cell Biology. 15 (3), 241-248 (2013).
- Januschke, J., Llamazares, S., Reina, J., Gonzalez, C. Drosophila neuroblasts retain the daughter centrosome. Nature Communications. 2 (1), 243 (2011).
- Rebollo, E., et al. Functionally unequal centrosomes drive spindle orientation in asymmetrically dividing Drosophila neural stem cells. Developmental Cell. 12 (3), 467-474 (2007).
- Januschke, J., Gonzalez, C. The interphase microtubule aster is a determinant of asymmetric division orientation in Drosophila neuroblasts. The Journal of Cell Biology. 188 (5), 693-706 (2010).
- Rusan, N. M., Peifer, M. A role for a novel centrosome cycle in asymmetric cell division. The Journal of Cell Biology. 177 (1), 13-20 (2007).
- Lerit, D. A., et al. Interphase centrosome organization by the PLP-Cnn scaffold is required for centrosome function. Journal of Cell Biology. 210 (1), 79-97 (2015).
- Gallaud, E., et al. Dynamic centriolar localization of Polo and Centrobin in early mitosis primes centrosome asymmetry. PLoS Biology. 18 (8), e3000762 (2020).
- Ramdas Nair, A., et al. The microcephaly-associated protein Wdr62/CG7337 is required to maintain centrosome asymmetry in Drosophila neuroblasts. Cell Reports. 14 (5), 1100-1113 (2016).
- Singh, P., Nair, A. R., Cabernard, C. The centriolar protein Bld10/Cep135 is required to establish centrosome asymmetry in Drosophila neuroblasts. Current Biology. 24 (13), 1548-1555 (2014).
- LaFoya, B., Prehoda, K. E. Consumption of a polarized membrane reservoir drives asymmetric membrane expansion during the unequal divisions of neural stem cells. Developmental Cell. 1534 (23), 00159 (2023).
- Sunchu, B., et al. Asymmetric chromatin retention and nuclear envelopes separate chromosomes in fused cells in vivo. Communications Biology. 5 (1), 953 (2022).
- Oliveira, A. C., Rebelo, A. R., Homem, C. C. F. Integrating animal development: How hormones and metabolism regulate developmental transitions and brain formation. Developmental Biology. 475, 256-264 (2021).
- Britton, J. S., Edgar, B. A. Environmental control of the cell cycle in Drosophila: nutrition activates mitotic and endoreplicative cells by distinct mechanisms. Development. 125 (11), 2149-2158 (1998).
- Lee, C. -. Y., et al. Drosophila Aurora-A kinase inhibits neuroblast self-renewal by regulating aPKC/Numb cortical polarity and spindle orientation. Genes & Development. 20 (24), 3464-3474 (2006).
- Homem, C. C. F., Reichardt, I., Berger, C., Lendl, T., Knoblich, J. A. Long-term live cell imaging and automated 4D analysis of Drosophila neuroblast lineages. PLoS ONE. 8 (11), e79588 (2013).
- Cabernard, C., Doe, C. Q. Live imaging of neuroblast lineages within intact larval brains in Drosophila. Cold Spring Harbor Protocols. 2013 (10), 970-977 (2013).
- Karpova, N., Bobinnec, Y., Fouix, S., Huitorel, P., Debec, A. Jupiter, a new Drosophila protein associated with microtubules. Cell Motility and the Cytoskeleton. 63 (5), 301-312 (2006).
- Loyer, N., Januschke, J. The last-born daughter cell contributes to division orientation of Drosophila larval neuroblasts. Nature Communications. 9 (1), 3745 (2018).
- Bostock, M. P., et al. An immobilization technique for long-term time-lapse imaging of explanted Drosophila tissues. Frontiers in Cell and Developmental Biology. 8, 590094 (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır