需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
精液中过氧化物酶阳性白细胞的检查
摘要
本文提出了一种经济有效的治疗精液中过氧化物酶阳性白细胞的方法。在计算机辅助精液分析(CASA)系统的辅助下,可以在总共60分钟内获得精液中过氧化物酶阳性白细胞的浓度,有效提高了男科实验室和男科医生的效率。
摘要
白细胞精子症可导致精子活力降低、精子形态异常增加、精子DNA片段化指数升高、精子顶体功能受损,甚至影响胚胎发育。它是临床实践中常见的男科疾病,也是男性不育的重要原因之一。在确定是否存在男性生殖道炎症时,男科医生通常选择检查精液中的圆形细胞或精浆弹性蛋白酶作为临床诊断依据。然而,圆形细胞的检查很容易受到脱落的生精细胞和生殖道上皮细胞的影响,这无助于减少抗生素的不分青红皂白和不必要的使用。同时,弹性蛋白酶的检测过程相对复杂、耗时、报告结果缓慢,不利于男性生殖道感染(MGTIs)等疾病的早期诊断和治疗。我们创新地将计算机辅助精液分析(CASA)系统辅助的精液中过氧化物酶阳性白细胞的检测作为白细胞精子症的诊断标准,成功解决了这些问题。该检查只需将四种试剂组成的操作液加入标本中,室温下的总反应时间可控制在20-30min以内。通过随后的涂片和显微镜检查,可以在总共60分钟内获得精液中过氧化物酶阳性白细胞的浓度,可用于诊断男性生殖道是否存在炎症。
引言
不孕不育已成为一个全球公共卫生问题,影响着大约15%的育龄夫妇。男性因素约占总不孕症病例的50%,近20%至30%可仅归因于男性因素1,2,3。男性生殖道感染 (MGTI) 是男性不育的重要原因之一,约占病例的 15% 4,5。
大多数人的精液中有白细胞,占非精子细胞的 13%,中性粒细胞占 12%,巨噬细胞占 0.9%,淋巴细胞占 0.1%6,7。根据世界卫生组织 (WHO) 人类精液检查和处理实验室手册(第 5 版),白细胞精子症通常定义为精液中存在 >1 × 106 个细胞/mL白细胞 8。这种情况可能由许多因素引起,例如环境毒素、药物滥用、精索静脉曲张、MGTI 等,所有这些都可能导致精液中白细胞浓度异常升高9.白细胞可提高精液中的活性氧 (ROS) 水平,导致脂质过氧化和蛋白质和 DNA 的氧化损伤,从而导致精子活力降低、精子形态异常增加、精子 DNA 片段化指数升高、精子顶体功能受损,甚至对胚胎发育产生负面影响10,11。
目前,男科医生在识别生殖道炎症时,通常选择检查精液中的圆形细胞或精浆中的弹性蛋白酶。然而,区分脱落的生精细胞和生殖道上皮细胞通常具有挑战性,它们无助于减少抗生素的不分青红皂白和不必要的使用6。后一种检查方法相对复杂、耗时长,结果报告速度慢,不利于MGTI等疾病的早期诊断和治疗。美国泌尿外科协会 (AUA) 建议,当精液分析中的圆形细胞浓度大于 1 ×10 6 个细胞/mL12 时,应进一步区分白细胞和生殖道脱落细胞。一些男科实验室利用流式细胞术13 或白细胞抗原(例如 CD45)免疫细胞化学14 来检查白细胞。虽然这些方法很精确,但它们既昂贵又耗时,使大规模临床实施变得困难,尤其是在发展中国家。
过氧化物酶广泛分布于各种类型的细胞中,在抵抗氧化应激损伤方面起着至关重要的作用。髓过氧化物酶 (MPO) 是过氧化物酶亚家族的成员,通常在免疫细胞中表达。它在中性粒细胞的嗜天青颗粒15,16 中表达最高,也在淋巴细胞17,18、单核细胞和巨噬细胞19 中表达。精液中白细胞(尤其是中性粒细胞)的浓度可以通过检查过氧化物酶阳性的圆形细胞来获得 7,20。为了使精液中白细胞的检查过程经济、方便、高效,我们重新设计了检查方法。在计算机辅助精液分析(CASA)系统的辅助下,可以在60分钟内获得白细胞的浓度。这种新方法降低了患者的检查成本和等待结果的时间,减轻了实验室技术人员的工作量,缩短了医生的诊疗等待时间。
研究方案
本研究已通过中山大学附属第三医院医学伦理委员会评审批准。
1.工作溶液的制备
- 收集以下制备工作溶液所必需的试剂 - 邻甲苯胺底物溶液、饱和氯化铵 (NH4Cl) 溶液、148 mmol/L 乙二胺四乙酸二钠盐 (Na2EDTA) 溶液和 6% (v/v) 过氧化氢溶液。将它们与必要的工具一起放在室温 (RT) 实验室工作台上,例如移液器(1000 μL、200 μL、10 μL)和试管架。
注意:在处理上述试剂之前,请阅读安全数据表 (SDS)。 - 准备一个不透明的棕色试剂瓶,以储存和保护制备的工作溶液免受光线照射。
- 按照以下指定的比例将试剂转移到不透明的棕色试剂瓶中:
- 使用 200 μL 移液器,转动旋钮将刻度调节至 100 μL。然后,将 100 μL NH4Cl 溶液转移到不透明的棕色试剂瓶中。
- 更换移液器吸头,并使用上述200 μL移液管将100 μL 148 mmol/L Na2EDTA溶液转移到不透明的棕色试剂瓶中。然后,用移液轻轻吹气,使溶液彻底均质化。
- 使用 1000 μL 移液管,转动旋钮将刻度调节至 900 μL。然后,将900μL邻甲苯胺底物溶液转移到不透明的棕色试剂瓶中,用移液轻轻吹气,并使溶液彻底匀浆。
- 使用 10 μL 移液器,转动旋钮将刻度调节至 5 μL。然后,将 5 μL 的 6% (v/v) 过氧化氢溶液转移到不透明的棕色试剂瓶中。
- 使用 1000 μL 移液管,转动旋钮将刻度调节至 1000 μL。更换移液器吸头,用移液器轻轻吹气,并在不透明的棕色试剂瓶中彻底均质化溶液。
- 将即用型工作溶液储存在不透明的棕色试剂瓶中,在室温下避光。工作溶液反应24小时。
- 每个精液样品需要 900 μL 的工作溶液。确保每天制备的工作溶液的数量与每天检查的样品数量相对应。
2. 精液样本的制备
- 在采集精液样本之前,请确保患者已按照世界卫生组织 (WHO) 检查和处理人类精液的实验室手册(第 5 版)的要求戒射精 2 至 7 天。8.手淫是获取精液样本的首选方法。为了提高检查的准确性,指导患者收集所有射出的精液。
- 打开恒温支架,提前加热至37°C,以便精液样品的后续液化能够顺利进行。
- 收到患者的精液样本后,在聚合物基容器的外壁上仔细记录详细信息,包括识别码、采集时间、禁欲持续时间和其他相关信息。
- 将装有精液样品的聚合物基容器放在预热至37°C的恒温支架上,这有利于精液液化。
- 将精液样品吸入聚合物基移液管中,每5分钟观察一次液化状态,直到精液样品完全液化。
- 如果精液样本在30分钟内未完全液化,则不要进行检查;继续等待 30 分钟。如果精液在60分钟后仍未完全液化,则加入等体积的磷酸盐缓冲溶液以1:1稀释并轻轻搅拌以促进液化。
- 在彻底搅拌和一致均质化后,保留完全液化的精液样本以备后续检查程序使用。
3. 对过氧化物酶阳性白细胞进行染色并分析原始精液样本
- 在取样之前,使用基于聚合物的移液器通过移液反复吹气,并彻底均质化被检查的精液样品。
- 使用 200 μL 移液器,转动旋钮将刻度调节至 100 μL。更换移液器吸头,然后将 100 μL 精液样品转移到离心管中。
- 使用 1000 μL 移液管,转动旋钮将刻度调节至 900 μL。更换移液器吸头,然后将 900 μL 上述工作溶液转移到离心管中。
- 使用1000μL移液管反复吹气并彻底均质化反应物,该反应物由精液样品和工作溶液组成。
- 将离心管放置在二维振荡器上的试管架中,并在室温下以200rpm连续搅拌30分钟。
- 在等待染色反应的同时,利用CASA系统分析精液样品,以确定聚合物基容器中原始精液样品中精子的浓度。
- 打开CASA系统的电源开关,双击SCA SCOPE图标打开应用软件。
- 取样前,用移液器反复吹气,并用聚合物基移液管再次将原始精液样品彻底均质化。
- 使用 10 μL 移液器,转动旋钮将刻度调整至 10 μL。更换移液器吸头,移取 10 μL 原始精液样品,并将其放入 SCA 计数室。等待 60 秒,让精液样本停止漂移。
- 将SCA计数室放置在CASA系统的样品架上,并在应用软件的对话框中设置患者信息,为正式检查做准备。
- 通过单击 “开始 ”按钮,使用CASA系统检查SCA计数室中的原始精液样本,并记录必要的数据,例如精子的浓度。
4.观察过氧化物酶阳性白细胞和精子
- 使用 1000 μL 移液管,转动旋钮将刻度调节至 1000 μL。更换移液器吸头,然后通过移液反复吹气,并在30分钟反应过程结束时再次在离心管中使反应物(由精液样品和工作溶液组成)彻底均质化。
- 使用 10 μL 移液器,转动旋钮将刻度调整至 10 μL。更换移液器吸头,移取10μL上述反应物,并将其放入精子计数室。最后,用专用的玻璃盖玻片盖住精子计数室。
- 将精子计数室放在显微载物台上,并用两个10倍目镜打开光学显微镜的电源开关。然后,等待 60 秒,让反应物样品停止漂移。
- 在等待时间内将显微转换器切换到 10 倍物镜。然后依次调整粗调旋钮和微调旋钮。最后,在10×10的放大倍率下观察精子和圆形细胞。
- 确定要分析的视场后,将显微转换器切换到40倍物镜,在10×40倍的放大倍率下观察精子和棕色过氧化物酶阳性白细胞。
- 利用电子计数器系统计数相应字段内至少 200 个精子和棕色过氧化物酶阳性白细胞的数量。
5.过氧化物酶阳性白细胞浓度的计算
- 使用以下公式计算过氧化物酶阳性白细胞的浓度:
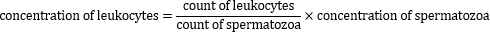
结果
在实施上述程序时,离心管中的反应物经常表现出半透明的乳白色外观(图1)。检测到明显的棕色可显示白细胞的潜在脱颗粒,这可能导致液体染色。因此,染色过程可能会失败,因此需要重新染色或收集新的精液样本进行重新测试21。
过氧化物酶阳性白细胞呈棕色,与未染色的普通圆形细胞形成鲜明对比(图2?...
讨论
邻甲苯胺和过氧化氢具有光敏性,暴露在光线下会分解。为确保测试试剂的有效性,建议将制备的工作液存放在黑暗的地方。
精液样本自然表现出异质性特征。在精液样品的制备过程中,正确判断精液的液化状态,并在每次取样前对精液样品进行彻底均质化,对于提高检测结果的可靠性至关重要。精液样品在15分钟内完全液化。如果它们在60分钟后仍未完全液化,则应考虑机...
披露声明
作者没有什么可透露的。
致谢
作者感谢中山大学第三附属医院生殖医学中心男科实验室为本研究提供设施。本文的编写没有涉及任何资金。
材料
| Name | Company | Catalog Number | Comments |
| 148 mmol/L ethylenediamine tetraacetic acid disodium (Na2EDTA) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia B |
| 6% (v/v) hydrogen peroxide solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia D |
| Automatic Sperm Class Analyzer – SCA SCOPE | Microptic S.L. | 1222996; Model type: SCA-SCOPE-H | Computer-Assisted Semen Analysis (CASA) equipment |
| Disposable centrifugal tube (1.5 mL) | Zhejiang Gongdong Medical Equipment Co., LTD | 2210009 | Centrifugal tube for Staining process |
| Disposable transfer pipette (3 mL) | Jiangsu Kangjian Medical Supplies Co., LTD | 20221101 | Polymer-based pipette |
| Electronic counter | None | None | A multichannel counter |
| Electronic scales | Shanghai Liangping Instrument Co., LTD | D9008084 | MAX = 100 g, e = 10 d, d = 0.01 g |
| Makler counting chamber | Makler | MQ30004 | 0.01 sq.mm, 10 μm deep |
| Optical microscope | Olympus | 3G41067201307 | CX31, 10×40 |
| Ortho-toluidine substrate solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia C |
| Pipet tips(1 mL) | Coming Life Sciences (Wujiang) Co.,Ltd | 02923205 | 1000 tips/unit, 5 units/case |
| Pipet tips(10 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 00323961 | 1000 tips/unit, 20 units/case |
| Pipet tips(200 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 32822810 | 1000 tips/unit, 20 units/case |
| Saturated ammonium chloride (NH4Cl) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia A |
| SCA counting chamber | Microptic S.L. | 102230608 | 10 µm, 2 Chambers |
| The container for semen sample | Jiangsu Kangjian Medical Supplies Co., LTD | 20230701 | Polymer-based receptacle for semen sample |
| Thermostatic table | Shenzhen MIAOQUAN Instrument Co., LTD | MQ30004 | MQ-300 |
| Transfer pipette (10 µL) | Eppendoff | 3121000.015 | |
| Transfer pipette (1000 µL) | Eppendoff | 3121000.12 | |
| Transfer pipette (200 µL) | Eppendoff | 3121000.082 | |
| Two-dimensional shaker | DragonLab | 822000010000 | VC5A002205 |
参考文献
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reprod Biol Endocrinol. 13, 37 (2015).
- Sharlip, I. D., et al. Best practice policies for male infertility. Fertil Steril. 77 (5), 873-882 (2002).
- Choy, J. T., Eisenberg, M. L. Male infertility as a window to health. Fertil Steril. 110 (5), 810-814 (2018).
- Pellati, D., et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 140 (1), 3-11 (2008).
- Rivero, M. J., Kulkarni, N., Thirumavalavan, N., Ramasamy, R. Evaluation and management of male genital tract infections in the setting of male infertility: an updated review. Curr Opin Urol. 33 (3), 180-186 (2023).
- Long, S., Kenworthy, S. Round cells in diagnostic semen analysis: A guide for laboratories and clinicians. Br J Biomed Sci. 79, 10129 (2022).
- Johanisson, E., Campana, A., Luthi, R., de Agostini, A. Evaluation of 'round cells' in semen analysis: a comparative study. Hum Reprod Update. 6 (4), 404-412 (2000).
- World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. World Health Organization. , (2010).
- Domes, T., et al. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril. 97 (5), 1050-1055 (2012).
- Aziz, N., Agarwal, A., Lewis-Jones, I., Sharma, R. K., Thomas, A. J. Novel associations between specific sperm morphological defects and leukocytospermia. Fertil Steril. 82 (3), 621-627 (2004).
- Alahmar, A. T. Role of oxidative stress in male infertility: An updated review. J Hum Reprod Sci. 12 (1), 4-18 (2019).
- Schlegel, P. N., et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline Part I. J Urol. 205 (1), 36-43 (2021).
- Ricci, G., Presani, G., Guaschino, S., Simeone, R., Perticarari, S. Leukocyte detection in human semen using flow cytometry. Hum Reprod. 15 (6), 1329-1337 (2000).
- Brunner, R. J., Demeter, J. H., Sindhwani, P. Review of guidelines for the evaluation and treatment of leukocytospermia in male infertility. World J Mens Health. 37 (2), 128-137 (2019).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annu Rev Immunol. 30, 459-489 (2012).
- Khan, A. A., Alsahli, M. A., Rahmani, A. H. Myeloperoxidase as an active disease biomarker: recent biochemical and pathological perspectives. Med Sci (Basel). 6 (2), 33 (2018).
- Khan, A. A., Rahmani, A. H., Aldebasi, Y. H., Aly, S. M. Biochemical and pathological studies on peroxidases -an updated review). Glob J Health Sci. 6 (5), 87-98 (2014).
- Liu, W. Q., et al. Myeloperoxidase-derived hypochlorous acid promotes ox-LDL-induced senescence of endothelial cells through a mechanism involving beta-catenin signaling in hyperlipidemia. Biochem Biophys Res Commun. 467 (4), 859-865 (2015).
- Nicholls, S. J., Hazen, S. L. Myeloperoxidase and cardiovascular disease. Arterioscler Thromb Vasc Biol. 25 (6), 1102-1111 (2005).
- Wolff, H. The biologic significance of white blood cells in semen. Fertil Steril. 63 (6), 1143-1157 (1995).
- Chen, Y., Hashiguchi, N., Yip, L., Junger, W. G. Hypertonic saline enhances neutrophil elastase release through activation of P2 and A3 receptors. Am J Physiol Cell Physiol. 290 (4), C1051-C1059 (2006).
- Weiss, S. J. Tissue destruction by neutrophils. N Engl J Med. 320 (6), 365-376 (1989).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。