Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Untersuchung von Peroxidase-positiven Leukozyten im Sperma
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
In dieser Arbeit wird ein wirtschaftliches und effizientes Protokoll zur Untersuchung von Peroxidase-positiven Leukozyten im Sperma vorgestellt. Mit Hilfe eines computergestützten Samenanalysesystems (CASA) kann die Konzentration von Peroxidase-positiven Leukozyten im Sperma innerhalb von insgesamt 60 Minuten ermittelt werden, wodurch die Effizienz des andrologischen Labors und der Andrologen effektiv verbessert wird.
Zusammenfassung
Leukozytospermie kann zu einer verminderten Beweglichkeit der Spermien, zu vermehrten morphologischen Anomalien der Spermien, zu einem erhöhten DNA-Fragmentierungsindex der Spermien, zu einer Beeinträchtigung der Funktion des Spermienakrosoms und sogar zu einer Beeinträchtigung der Embryonalentwicklung führen. Es ist eine häufige andrologische Erkrankung in der klinischen Praxis und eine der Hauptursachen für männliche Unfruchtbarkeit. Bei der Feststellung, ob eine Entzündung des männlichen Fortpflanzungstrakts vorliegt, entscheiden sich Andrologen häufig für die Untersuchung runder Zellen oder der Samenplasma-Elastase im Sperma als klinisch-diagnostische Grundlage. Die Untersuchung von runden Zellen wird jedoch leicht durch abgestreifte spermatogene Zellen und Epithelzellen des Fortpflanzungstrakts beeinflusst, die nicht dazu beitragen, den wahllosen und unnötigen Einsatz von Antibiotika zu reduzieren. Gleichzeitig ist der Nachweisprozess der Elastase relativ kompliziert, zeitaufwändig und langsam in der Berichterstattung über die Ergebnisse, was für die Frühdiagnose und Behandlung von Krankheiten wie Infektionen des männlichen Genitaltrakts (MGTIs) nicht von Vorteil ist. Wir haben die Untersuchung von Peroxidase-positiven Leukozyten im Sperma mit Hilfe eines computergestützten Samenanalysesystems (CASA) als diagnostisches Kriterium für Leukozytospermie innovativ angewendet und diese Probleme erfolgreich gelöst. Für diese Untersuchung muss nur die aus vier Reagenzien bestehende Betriebsflüssigkeit in die Probe gegeben werden, und die Gesamtreaktionszeit bei Raumtemperatur kann innerhalb von 20-30 min gesteuert werden. Mit dem anschließenden Abstrich und der mikroskopischen Untersuchung kann innerhalb von insgesamt 60 min die Konzentration von Peroxidase-positiven Leukozyten im Sperma ermittelt werden, anhand derer diagnostiziert werden kann, ob die Entzündung des männlichen Fortpflanzungstraktes vorlag.
Einleitung
Unfruchtbarkeit hat sich zu einem globalen Problem der öffentlichen Gesundheit entwickelt, von dem etwa 15 % der Paare im gebärfähigen Alter betroffen sind. Etwa 50 % der Fälle von Subfertilität sind auf männliche Faktoren zurückzuführen, und fast 20 % bis 30 % können ausschließlich auf männliche Faktoren zurückgeführt werden 1,2,3. Infektionen des männlichen Genitaltrakts (MGTIs) stellen eine der Hauptursachen für männliche Unfruchtbarkeit dar und machen etwa 15 % der Fälle aus 4,5.
Die meisten Menschen haben Leukozyten in ihrem Sperma, die 13 % der Nicht-Spermatozoenzellen ausmachen, wobei die unterschiedlichen Anteile 12 % der Neutrophilen, der Makrophagen 0,9 % und der Lymphozyten 0,1 % betragen6,7. Nach dem Laborhandbuch der Weltgesundheitsorganisation (WHO) für die Untersuchung und Verarbeitung von menschlichem Sperma (5. Auflage) wird Leukozytospermie in der Regel als das Vorhandensein von >1 ×10 6 Zellen/ml Leukozyten im Sperma8 definiert. Dieser Zustand kann durch zahlreiche Faktoren wie Umweltgifte, Drogenmissbrauch, Varikozelen, MGTIs usw. verursacht werden, die alle möglicherweise zu einem abnormalen Anstieg der Leukozytenkonzentration im Sperma führen9. Leukozyten können den Gehalt an reaktiven Sauerstoffspezies (ROS) im Sperma erhöhen, was zu einer Lipidperoxidation und oxidativen Schäden an Protein und DNA führt, was zu einer verminderten Beweglichkeit der Spermien, erhöhten morphologischen Anomalien der Spermien, einem erhöhten DNA-Fragmentierungsindex der Spermien, einer Beeinträchtigung der Spermien-Akrosomfunktion und sogar zu negativen Auswirkungen auf die Embryonalentwicklung führt10,11.
Derzeit entscheiden sich Andrologen häufig dafür, runde Zellen im Sperma oder Elastase im Samenplasma zu untersuchen, wenn sie eine Entzündung des Genitaltrakts feststellen. Es ist jedoch oft schwierig, abgestreifte spermatogene Zellen und Epithelzellen des Fortpflanzungstrakts zu unterscheiden, die nicht dazu beitragen, den wahllosen und unnötigen Einsatz von Antibiotika zu reduzieren6. Die letztgenannte Untersuchungsmethode ist relativ kompliziert und zeitaufwändig, mit langsamer Ergebnisberichterstattung, was für die Frühdiagnose und Behandlung von Krankheiten wie MGTIs nicht von Vorteil ist. Die American Urological Association (AUA) schlägt vor, dass eine weitere Unterscheidung zwischen Leukozyten und abgestreiften Zellen aus dem Genitaltrakt vorgenommen werden sollte, wenn die Konzentration der runden Zellen in der Samenanalyse größer als 1 × 106 Zellen/mlist 12. Einige Andrologielabore verwenden die Durchflusszytometrie13 oder die Immunzytozytochemie des Leukozytenantigens (z. B. CD45)14 , um Leukozyten zu untersuchen. Diese Methoden sind zwar präzise, aber teuer und zeitaufwändig, was eine großflächige klinische Implementierung erschwert, insbesondere in Entwicklungsländern.
Peroxidase ist in verschiedenen Zelltypen weit verbreitet und spielt eine entscheidende Rolle bei der Resistenz gegen Schäden durch oxidativen Stress. Die Myeloperoxidase (MPO) ist ein Mitglied der Peroxidase-Unterfamilie, die im Allgemeinen in Immunzellen exprimiert wird. Es wird am stärksten in den azurophilen Granula der Neutrophilenexprimiert 15,16 und wird auch in Lymphozyten17,18, Monozyten und Makrophagen19 exprimiert. Die Konzentration von Leukozyten, insbesondere Neutrophilen, im Sperma kann durch die Untersuchung von runden Zellen bestimmt werden, die Peroxidase-positiv sind 7,20. Um den Untersuchungsprozess von Leukozyten im Sperma wirtschaftlich, bequem und effizient zu gestalten, haben wir die Untersuchungsmethode überarbeitet. Mit Hilfe des computergestützten Samenanalysesystems (CASA) kann die Konzentration der Leukozyten innerhalb von 60 Minuten bestimmt werden. Diese neue Methode reduziert die Untersuchungskosten und die Wartezeit der Patienten auf die Ergebnisse, entlastet die Labortechniker und verkürzt die Wartezeit des Arztes auf Diagnose und Behandlung.
Protokoll
Diese Studie wurde von der medizinischen Ethikkommission des dritten angeschlossenen Krankenhauses der Sun Yat-sen Universität geprüft und genehmigt.
1. Vorbereitung der Arbeitslösung
- Sammeln Sie die folgenden Reagenzien, die für die Herstellung der Arbeitslösung unerlässlich sind: ortho-Toluidin-Substratlösung, gesättigte Ammoniumchloridlösung (NH4Cl), 148 mmol/L Ethylendiamintetraessigsäure-Dinatriumsalzlösung (Na2EDTA) und 6% (v/v) Wasserstoffperoxidlösung. Legen Sie sie zusammen mit den erforderlichen Werkzeugen wie Transferpipetten (1000 μl, 200 μl, 10 μl) und Reagenzglasgestellen auf einen Labortisch bei Raumtemperatur (RT).
VORSICHT: Lesen Sie das Sicherheitsdatenblatt (SDB), bevor Sie mit den oben genannten Reagenzien umgehen. - Bereiten Sie eine undurchsichtige braune Reagenzflasche vor, um die vorbereitete Arbeitslösung aufzubewahren und vor Lichteinwirkung zu schützen.
- Füllen Sie die Reagenzien in die undurchsichtige braune Reagenzflasche gemäß den unten angegebenen Verhältnissen:
- Verwenden Sie die 200-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 100 μl ein. Anschließend werden 100 μl der NH4Cl-Lösung in die undurchsichtige braune Reagenzflasche überführt.
- Setzen Sie die Pipettenspitze wieder auf und überführen Sie 100 μl der 148 mmol/lNa2-EDTA-Lösung mit der oben erwähnten 200-μl-Transferpipette in die undurchsichtige braune Reagenzflasche. Blasen Sie dann vorsichtig durch Pipettieren und homogenisieren Sie die Lösung gründlich.
- Verwenden Sie die 1000-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 900 μl ein. Anschließend werden 900 μl der ortho-Toluidin-Substratlösung in die undurchsichtige braune Reagenzflasche überführt, vorsichtig durch Pipettieren geblasen und die Lösung gründlich homogenisiert.
- Verwenden Sie die 10-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 5 μl ein. Anschließend werden 5 μl der 6%igen (v/v) Wasserstoffperoxidlösung in die undurchsichtige braune Reagenzflasche überführt.
- Verwenden Sie die 1000-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 1000 μl ein. Setzen Sie die Pipettenspitze wieder ein, blasen Sie vorsichtig durch Pipettieren und homogenisieren Sie die Lösung gründlich in der undurchsichtigen braunen Reagenzflasche.
- Bewahren Sie die gebrauchsfertige Arbeitslösung in der undurchsichtigen braunen Reagenzflasche bei RT lichtgeschützt auf. Die Arbeitslösung ist 24 h lang reaktiv.
- Für jede Samenprobe werden 900 μl der Arbeitslösung benötigt. Es ist darauf zu achten, dass die Menge der täglich zubereiteten Arbeitslösung der Anzahl der täglich untersuchten Proben entspricht.
2. Vorbereitung der Samenprobe
- Stellen Sie vor der Entnahme der Samenprobe sicher, dass der Patient 2 bis 7 Tage lang auf die Ejakulation verzichtet hat, wie es das Laborhandbuch der Weltgesundheitsorganisation (WHO) für die Untersuchung und Verarbeitung von menschlichem Sperma (5. Auflage) vorschreibt. 8. Masturbation ist die bevorzugte Methode zur Gewinnung von Samenproben. Um die Genauigkeit der Untersuchung zu verbessern, weisen Sie den Patienten an, das gesamte ejakulierte Sperma zu sammeln.
- Schalten Sie den Konstanttemperaturständer ein und erhitzen Sie ihn vorab auf 37 °C, damit die anschließende Verflüssigung der Samenprobe reibungslos ablaufen kann.
- Notieren Sie nach Erhalt der Samenprobe des Patienten akribisch detaillierte Informationen, einschließlich Identifikationscode, Entnahmezeitpunkt, Abstinenzdauer und andere relevante Informationen, an der Außenwand des Behälters auf Polymerbasis.
- Stellen Sie den Behälter auf Polymerbasis, in dem sich die Samenprobe befindet, auf den auf 37 °C vorgeheizten Ständer mit konstanter Temperatur, was für die Samenverflüssigung von Vorteil ist.
- Ziehen Sie die Samenprobe in eine Pipette auf Polymerbasis und beobachten Sie den Verflüssigungszustand alle 5 Minuten, bis die Samenprobe vollständig verflüssigt ist.
- Wenn die Samenprobe nicht innerhalb von 30 Minuten vollständig verflüssigt wurde, führen Sie die Untersuchung noch nicht durch. Warten Sie weitere 30 Minuten. Wenn das Sperma nach 60 Minuten immer noch nicht vollständig verflüssigt ist, fügen Sie ein gleiches Volumen Phosphatpufferlösung für eine 1:1-Verdünnung hinzu und rühren Sie vorsichtig, um die Verflüssigung zu fördern.
- Nach gründlichem Rühren und konsequenter Homogenisierung wird die vollständig verflüssigte Samenprobe für die nachfolgenden Untersuchungsverfahren aufbewahrt.
3. Färbung der Peroxidase-positiven Leukozyten und Analyse der ursprünglichen Samenprobe
- Verwenden Sie vor der Probenahme eine Pipette auf Polymerbasis, um wiederholt durch Pipettieren zu blasen und die zu untersuchende Samenprobe gründlich zu homogenisieren.
- Verwenden Sie die 200-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 100 μl ein. Setzen Sie die Pipettenspitze wieder auf und geben Sie dann 100 μl der Samenprobe in ein Zentrifugenröhrchen.
- Verwenden Sie die 1000-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 900 μl ein. Setzen Sie die Pipettenspitze wieder auf und geben Sie dann 900 μl der oben genannten Arbeitslösung in das Zentrifugenröhrchen um.
- Wiederholtes Blasen durch Pipettieren und gründliches Homogenisieren des Reaktanten, der aus der Samenprobe und der Arbeitslösung besteht, mit der 1000-μl-Transferpipette.
- Positionieren Sie das Zentrifugenröhrchen in einem Reagenzglasgestell auf einem zweidimensionalen Schüttler und setzen Sie es 30 Minuten lang bei RT einer kontinuierlichen Bewegung bei 200 U/min aus.
- Während Sie auf die Färbereaktion warten, analysieren Sie die Samenprobe mit dem CASA-System, um die Konzentration der Spermien in der ursprünglichen Samenprobe im polymerbasierten Gefäß zu bestimmen.
- Schalten Sie den Netzschalter des CASA-Systems ein und doppelklicken Sie auf das Symbol SCA SCOPE, um die Anwendungssoftware zu öffnen.
- Vor der Probenahme wird wiederholt durch Pipettieren geblasen und die ursprüngliche Samenprobe mit einer Pipette auf Polymerbasis erneut gründlich homogenisiert.
- Verwenden Sie die 10-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 10 μl ein. Setzen Sie die Pipettenspitze wieder ein, pipettieren Sie 10 μl der ursprünglichen Samenprobe und legen Sie sie in die SCA-Zählkammer. Warten Sie 60 Sekunden, bis die Samenprobe aufhört zu driften.
- Positionieren Sie die SCA-Zählkammer auf dem Probenhalter des CASA-Systems und stellen Sie die Patienteninformationen im Dialogfenster der Anwendungssoftware ein, um sich auf die formale Untersuchung vorzubereiten.
- Untersuchen Sie die ursprüngliche Samenprobe in der SCA-Zählkammer mit dem CASA-System, indem Sie auf die Schaltfläche Start klicken und die erforderlichen Daten, wie z. B. die Konzentration der Spermien, aufzeichnen.
4. Beobachtung der Peroxidase-positiven Leukozyten und Spermien
- Verwenden Sie die 1000-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 1000 μl ein. Setzen Sie die Pipettenspitze wieder auf, blasen Sie dann wiederholt durch Pipettieren und homogenisieren Sie den Reaktanten, der aus Samenprobe und Arbeitslösung besteht, am Ende des 30-minütigen Reaktionsprozesses wieder gründlich im Zentrifugenröhrchen.
- Verwenden Sie die 10-μl-Transferpipette und stellen Sie die Skala durch Drehen des Knopfes auf 10 μl ein. Setzen Sie die Pipettenspitze wieder ein, pipettieren Sie 10 μl des oben genannten Reaktanten und legen Sie ihn in die Spermienzählkammer. Zum Schluss wird die Spermienzählkammer mit einem speziellen Deckglas aus Glas abgedeckt.
- Platzieren Sie die Spermienzählkammer auf dem mikroskopischen Tisch und schalten Sie den Netzschalter des optischen Mikroskops mit zwei 10x-Okularen ein. Warten Sie dann 60 Sekunden, bis die Reaktantenprobe aufhört zu driften.
- Schalten Sie den Mikroskopkonverter während der Wartezeit auf das 10-fach-Objektiv um. Stellen Sie dann nacheinander den Grobeinstellknopf und den Feineinstellknopf ein. Zum Schluss werden die Spermien und runden Zellen unter einer Vergrößerung von 10×10 beobachtet.
- Schalten Sie den mikroskopischen Konverter auf das 40-fache Objektiv um, nachdem Sie das zu analysierende Gesichtsfeld bestimmt haben, und beobachten Sie die Spermien und braunen Peroxidase-positiven Leukozyten unter einer Vergrößerung von 10 × 40.
- Verwenden Sie das elektronische Zählsystem, um mindestens 200 Spermien und die Anzahl der braunen Peroxidase-positiven Leukozyten in den entsprechenden Feldern zu zählen.
5. Berechnung der Konzentration von Peroxidase-positiven Leukozyten
- Berechnen Sie die Konzentration von Peroxidase-positiven Leukozyten mit der folgenden Formel:
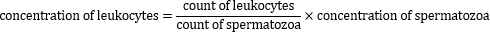
Ergebnisse
Bei der Durchführung des oben genannten Verfahrens zeigt der Reaktant im Zentrifugenröhrchen häufig ein subtransluzentes, opaleszierendes Erscheinungsbild (Abbildung 1). Der Nachweis einer offensichtlich braunen Farbe offenbart eine mögliche Degranulation von Leukozyten, was zu einer Flüssigkeitsfärbung führen kann. Folglich könnte der Färbeprozess fehlschlagen, so dass entweder eine erneute Färbung oder die Entnahme einer neuen Samenprobe für eine erneute Untersuchung erforderlic...
Diskussion
Ortho-Toluidin und Wasserstoffperoxid haben lichtempfindliche Eigenschaften und können sich unter Lichteinwirkung zersetzen. Um die Wirksamkeit der Testreagenzien zu gewährleisten, wird empfohlen, die vorbereitete Arbeitsflüssigkeit an einem dunklen Ort zu lagern.
Samenproben weisen naturgemäß heterogene Merkmale auf. Bei der Vorbereitung von Samenproben sind die korrekte Beurteilung des Verflüssigungszustands des Samens und die gründliche Homogenisierung der Samenproben vor jeder Prob...
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Die Autoren danken dem Andrologie-Labor des Zentrums für Reproduktionsmedizin, dem dritten angeschlossenen Krankenhaus der Sun Yat-sen Universität, für die Bereitstellung der Einrichtungen für diese Studie. Bei der Erstellung dieses Artikels waren keine finanziellen Mittel beteiligt.
Materialien
| Name | Company | Catalog Number | Comments |
| 148 mmol/L ethylenediamine tetraacetic acid disodium (Na2EDTA) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia B |
| 6% (v/v) hydrogen peroxide solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia D |
| Automatic Sperm Class Analyzer – SCA SCOPE | Microptic S.L. | 1222996; Model type: SCA-SCOPE-H | Computer-Assisted Semen Analysis (CASA) equipment |
| Disposable centrifugal tube (1.5 mL) | Zhejiang Gongdong Medical Equipment Co., LTD | 2210009 | Centrifugal tube for Staining process |
| Disposable transfer pipette (3 mL) | Jiangsu Kangjian Medical Supplies Co., LTD | 20221101 | Polymer-based pipette |
| Electronic counter | None | None | A multichannel counter |
| Electronic scales | Shanghai Liangping Instrument Co., LTD | D9008084 | MAX = 100 g, e = 10 d, d = 0.01 g |
| Makler counting chamber | Makler | MQ30004 | 0.01 sq.mm, 10 μm deep |
| Optical microscope | Olympus | 3G41067201307 | CX31, 10×40 |
| Ortho-toluidine substrate solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia C |
| Pipet tips(1 mL) | Coming Life Sciences (Wujiang) Co.,Ltd | 02923205 | 1000 tips/unit, 5 units/case |
| Pipet tips(10 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 00323961 | 1000 tips/unit, 20 units/case |
| Pipet tips(200 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 32822810 | 1000 tips/unit, 20 units/case |
| Saturated ammonium chloride (NH4Cl) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia A |
| SCA counting chamber | Microptic S.L. | 102230608 | 10 µm, 2 Chambers |
| The container for semen sample | Jiangsu Kangjian Medical Supplies Co., LTD | 20230701 | Polymer-based receptacle for semen sample |
| Thermostatic table | Shenzhen MIAOQUAN Instrument Co., LTD | MQ30004 | MQ-300 |
| Transfer pipette (10 µL) | Eppendoff | 3121000.015 | |
| Transfer pipette (1000 µL) | Eppendoff | 3121000.12 | |
| Transfer pipette (200 µL) | Eppendoff | 3121000.082 | |
| Two-dimensional shaker | DragonLab | 822000010000 | VC5A002205 |
Referenzen
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reprod Biol Endocrinol. 13, 37 (2015).
- Sharlip, I. D., et al. Best practice policies for male infertility. Fertil Steril. 77 (5), 873-882 (2002).
- Choy, J. T., Eisenberg, M. L. Male infertility as a window to health. Fertil Steril. 110 (5), 810-814 (2018).
- Pellati, D., et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 140 (1), 3-11 (2008).
- Rivero, M. J., Kulkarni, N., Thirumavalavan, N., Ramasamy, R. Evaluation and management of male genital tract infections in the setting of male infertility: an updated review. Curr Opin Urol. 33 (3), 180-186 (2023).
- Long, S., Kenworthy, S. Round cells in diagnostic semen analysis: A guide for laboratories and clinicians. Br J Biomed Sci. 79, 10129 (2022).
- Johanisson, E., Campana, A., Luthi, R., de Agostini, A. Evaluation of 'round cells' in semen analysis: a comparative study. Hum Reprod Update. 6 (4), 404-412 (2000).
- World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. World Health Organization. , (2010).
- Domes, T., et al. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril. 97 (5), 1050-1055 (2012).
- Aziz, N., Agarwal, A., Lewis-Jones, I., Sharma, R. K., Thomas, A. J. Novel associations between specific sperm morphological defects and leukocytospermia. Fertil Steril. 82 (3), 621-627 (2004).
- Alahmar, A. T. Role of oxidative stress in male infertility: An updated review. J Hum Reprod Sci. 12 (1), 4-18 (2019).
- Schlegel, P. N., et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline Part I. J Urol. 205 (1), 36-43 (2021).
- Ricci, G., Presani, G., Guaschino, S., Simeone, R., Perticarari, S. Leukocyte detection in human semen using flow cytometry. Hum Reprod. 15 (6), 1329-1337 (2000).
- Brunner, R. J., Demeter, J. H., Sindhwani, P. Review of guidelines for the evaluation and treatment of leukocytospermia in male infertility. World J Mens Health. 37 (2), 128-137 (2019).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annu Rev Immunol. 30, 459-489 (2012).
- Khan, A. A., Alsahli, M. A., Rahmani, A. H. Myeloperoxidase as an active disease biomarker: recent biochemical and pathological perspectives. Med Sci (Basel). 6 (2), 33 (2018).
- Khan, A. A., Rahmani, A. H., Aldebasi, Y. H., Aly, S. M. Biochemical and pathological studies on peroxidases -an updated review). Glob J Health Sci. 6 (5), 87-98 (2014).
- Liu, W. Q., et al. Myeloperoxidase-derived hypochlorous acid promotes ox-LDL-induced senescence of endothelial cells through a mechanism involving beta-catenin signaling in hyperlipidemia. Biochem Biophys Res Commun. 467 (4), 859-865 (2015).
- Nicholls, S. J., Hazen, S. L. Myeloperoxidase and cardiovascular disease. Arterioscler Thromb Vasc Biol. 25 (6), 1102-1111 (2005).
- Wolff, H. The biologic significance of white blood cells in semen. Fertil Steril. 63 (6), 1143-1157 (1995).
- Chen, Y., Hashiguchi, N., Yip, L., Junger, W. G. Hypertonic saline enhances neutrophil elastase release through activation of P2 and A3 receptors. Am J Physiol Cell Physiol. 290 (4), C1051-C1059 (2006).
- Weiss, S. J. Tissue destruction by neutrophils. N Engl J Med. 320 (6), 365-376 (1989).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten