È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
L'esame dei leucociti positivi alla perossidasi nel liquido seminale
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo documento presenta un protocollo economico ed efficiente per l'esame dei leucociti positivi alla perossidasi nello sperma. Con l'assistenza di un sistema di analisi dello sperma computerizzato (CASA), la concentrazione di leucociti positivi alla perossidasi nello sperma può essere ottenuta entro un totale di 60 minuti, migliorando efficacemente l'efficienza del laboratorio di andrologia e degli andrologi.
Abstract
La leucocitospermia può portare a una diminuzione della motilità degli spermatozoi, a un aumento delle anomalie morfologiche degli spermatozoi, a un aumento dell'indice di frammentazione del DNA degli spermatozoi, a una compromissione della funzione dell'acrosoma degli spermatozoi e persino a un aumento dello sviluppo embrionale. È una malattia andrologica comune nella pratica clinica e una delle principali cause di infertilità maschile. Nel determinare se esiste un'infiammazione del tratto riproduttivo maschile, gli andrologi spesso scelgono di esaminare le cellule rotonde o l'elastasi plasmatica seminale nello sperma come base diagnostica clinica. Tuttavia, l'esame delle cellule rotonde è facilmente influenzato dalle cellule spermatogene e dalle cellule epiteliali del tratto riproduttivo, che non contribuiscono a ridurre l'uso indiscriminato e non necessario di antibiotici. Allo stesso tempo, il processo di rilevamento dell'elastasi è relativamente complicato, richiede tempo e è lento nel riportare i risultati, il che non è vantaggioso per la diagnosi precoce e il trattamento di malattie come le infezioni del tratto genitale maschile (MGTI). Abbiamo applicato in modo innovativo l'esame dei leucociti perossidasi-positivi nel liquido seminale assistito da un sistema di analisi del seme computer-assistito (CASA) come criterio diagnostico per la leucocitospermia, risolvendo con successo questi problemi. Questo esame richiede solo l'aggiunta del fluido operativo costituito da quattro reagenti nel campione e il tempo di reazione totale a temperatura ambiente può essere controllato entro 20-30 minuti. Con il successivo striscio e l'esame microscopico, è possibile ottenere la concentrazione di leucociti positivi alla perossidasi nel liquido seminale entro un totale di 60 minuti, che può essere utilizzata per diagnosticare se l'infiammazione del tratto riproduttivo maschile esisteva.
Introduzione
L'infertilità è emersa come un problema di salute pubblica globale che colpisce circa il 15% delle coppie in età riproduttiva. I fattori maschili sono rappresentati da circa il 50% dei casi totali di subfertilità e quasi il 20-30% può essere attribuito esclusivamente ai fattori maschili 1,2,3. Le infezioni del tratto genitale maschile (MGTI) costituiscono una delle principali cause di infertilità maschile, rappresentando circa il 15% dei casi 4,5.
La maggior parte degli individui ha leucociti nel proprio sperma, costituendo il 13% delle cellule non spermatozoiche, con proporzioni differenziali che sono neutrofili 12%, macrofagi 0,9% e linfociti 0,1%6,7. Secondo il manuale di laboratorio dell'Organizzazione Mondiale della Sanità (OMS) per l'esame e il trattamento dello sperma umano (5a ed.), la leucocitospermia è solitamente definita come la presenza di leucociti >1 ×10 6 cellule/mL nel seme8. Questa condizione può essere causata da numerosi fattori come tossine ambientali, abuso di sostanze, varicocele, MGTI, ecc., che potenzialmente portano a un aumento anomalo della concentrazione di leucociti nello sperma9. I leucociti possono aumentare i livelli di specie reattive dell'ossigeno (ROS) nello sperma, causando perossidazione lipidica e danni ossidativi alle proteine e al DNA, che si traducono in una diminuzione della motilità degli spermatozoi, un aumento delle anomalie morfologiche degli spermatozoi, un elevato indice di frammentazione del DNA degli spermatozoi, una compromissione della funzione acrosomica degli spermatozoi e persino impatti negativi sullo sviluppo embrionale10,11.
Attualmente, gli andrologi scelgono comunemente di esaminare le cellule rotonde nello sperma o l'elastasi nel plasma seminale quando identificano l'infiammazione del tratto genitale. Tuttavia, è spesso difficile distinguere le cellule spermatogene e le cellule epiteliali del tratto riproduttivo, che non contribuiscono a ridurre l'uso indiscriminato e non necessario di antibiotici6. Quest'ultimo metodo di esame è relativamente complicato e richiede molto tempo, con una lenta refertazione dei risultati, il che non è vantaggioso per la diagnosi precoce e il trattamento di malattie come le MGTI. L'American Urological Association (AUA) suggerisce un'ulteriore differenziazione tra leucociti e cellule sloughed dal tratto genitale quando la concentrazione di cellule rotonde nell'analisi dello sperma è superiore a 1 ×10 6 cellule/mL12. Alcuni laboratori di andrologia utilizzano la citometria a flusso13 o l'immunocitochimica dell'antigene leucocitario (ad es. CD45)14 per esaminare i leucociti. Sebbene questi metodi siano precisi, sono costosi e richiedono molto tempo, rendendo difficile l'implementazione clinica su larga scala, soprattutto nei paesi in via di sviluppo.
La perossidasi è ampiamente distribuita in vari tipi di cellule e svolge un ruolo cruciale nella resistenza ai danni da stress ossidativo. La mieloperossidasi (MPO) è un membro della sottofamiglia delle perossidasi che è generalmente espressa nelle cellule immunitarie. È più altamente espresso nei granuli azurofili dei neutrofili15,16 ed è anche espresso nei linfociti17,18, nei monociti e nei macrofagi19. La concentrazione di leucociti, in particolare neutrofili, nel liquido seminale può essere ottenuta esaminando le cellule rotonde positive alla perossidasi 7,20. Per rendere il processo di esame dei leucociti nello sperma economico, conveniente ed efficiente, abbiamo riprogettato il metodo di esame. Con l'aiuto del sistema di analisi computerizzata dello sperma (CASA), la concentrazione di leucociti può essere ottenuta entro 60 minuti. Questo nuovo metodo riduce i costi degli esami dei pazienti e i tempi di attesa per ottenere i risultati, allevia il carico di lavoro dei tecnici di laboratorio e abbrevia il periodo di attesa per la diagnosi e il trattamento del medico.
Access restricted. Please log in or start a trial to view this content.
Protocollo
Questo studio è stato esaminato e approvato dal Comitato Etico Medico del Terzo Ospedale Affiliato dell'Università Sun Yat-sen.
1. Preparazione della soluzione di lavoro
- Raccogliere i seguenti reagenti essenziali per la preparazione della soluzione di lavoro: soluzione di substrato orto-toluidina, soluzione satura di cloruro di ammonio (NH4Cl), soluzione di sale disodico di acido etilendiamminotetraacetico (Na2EDTA) 148 mmol/L e soluzione di perossido di idrogeno al 6% (v/v). Posizionarli su un banco da laboratorio a temperatura ambiente (RT) insieme agli strumenti necessari, come pipette di trasferimento (1000 μL, 200 μL, 10 μL) e rack per provette.
ATTENZIONE: Leggere la scheda di dati di sicurezza (SDS) prima di maneggiare i reagenti sopra menzionati. - Preparare un flacone di reagente marrone opaco per conservare e proteggere la soluzione di lavoro preparata dall'esposizione alla luce.
- Trasferire i reagenti nel flacone di reagente marrone opaco secondo le proporzioni specificate di seguito:
- Utilizzare la pipetta di trasferimento da 200 μL e regolare la scala a 100 μL ruotando la manopola. Quindi, trasferire 100 μL della soluzione di NH4Cl nel flacone di reagente marrone opaco.
- Riposizionare il puntale della pipetta e trasferire 100 μL della soluzione di EDTA da 148 mmol/L di Na2nel flacone di reagente marrone opaco utilizzando la pipetta di trasferimento da 200 μL sopra menzionata. Quindi, soffiare delicatamente pipettando e omogeneizzare accuratamente la soluzione.
- Utilizzare la pipetta di trasferimento da 1000 μL e regolare la scala a 900 μL ruotando la manopola. Quindi, trasferire 900 μL della soluzione di substrato orto-toluidina nel flacone di reagente marrone opaco, soffiare delicatamente mediante pipettaggio e omogeneizzare accuratamente la soluzione.
- Utilizzare la pipetta di trasferimento da 10 μL e regolare la scala a 5 μL ruotando la manopola. Quindi, trasferire 5 μL della soluzione di perossido di idrogeno al 6% (v/v) nel flacone di reagente marrone opaco.
- Utilizzare la pipetta di trasferimento da 1000 μL e regolare la scala a 1000 μL ruotando la manopola. Riposizionare il puntale della pipetta, soffiare delicatamente pipettando e omogeneizzare accuratamente la soluzione nel flacone di reagente marrone opaco.
- Conservare la soluzione di lavoro pronta all'uso nel flacone di reagente marrone opaco a RT, al riparo dalla luce. La soluzione di lavoro è reattiva per 24 ore.
- Ogni campione di sperma richiede 900 μL di soluzione di lavoro. Assicurarsi che la quantità di soluzione di lavoro preparata ogni giorno corrisponda al numero di campioni esaminati giornalmente.
2. Preparazione del campione di sperma
- Prima di raccogliere il campione di sperma, assicurarsi che il paziente si sia astenuto dall'eiaculazione per 2-7 giorni come richiesto dal manuale di laboratorio dell'Organizzazione Mondiale della Sanità (OMS) per l'esame e il trattamento dello sperma umano (5a ed.) 8. La masturbazione è il metodo preferito per ottenere campioni di sperma. Per migliorare l'accuratezza dell'esame, istruire il paziente a raccogliere tutto lo sperma eiaculato.
- Accendere il supporto a temperatura costante e riscaldare fino a 37 °C in anticipo in modo che la successiva liquefazione del campione di sperma possa procedere senza intoppi.
- Al ricevimento del campione di sperma del paziente, registrare meticolosamente informazioni dettagliate, tra cui il codice di identificazione, l'ora di raccolta, la durata dell'astinenza e altre informazioni pertinenti, sulla parete esterna del recipiente a base di polimero.
- Posizionare il recipiente a base di polimero che ospita il campione di sperma sul supporto a temperatura costante preriscaldato a 37 °C, il che è vantaggioso per la liquefazione dello sperma.
- Prelevare il campione di sperma in una pipetta a base polimerica e osservare lo stato di liquefazione ogni 5 minuti fino a quando il campione di sperma non è completamente liquefatto.
- Se il campione di sperma non è stato completamente liquefatto entro 30 minuti, non eseguire ancora l'esame; Continuare ad aspettare altri 30 minuti. Se lo sperma non è ancora completamente liquefatto dopo 60 minuti, aggiungere un volume uguale di soluzione tampone fosfato per una diluizione 1:1 e agitare delicatamente per favorire la liquefazione.
- Dopo un'accurata agitazione e un'omogeneizzazione costante, conservare il campione di sperma completamente liquefatto per le successive procedure di esame.
3. Colorazione dei leucociti positivi alla perossidasi e analisi del campione di sperma originale
- Prima del campionamento, utilizzare una pipetta a base polimerica per soffiare ripetutamente mediante pipettaggio e omogeneizzare accuratamente il campione di sperma in esame.
- Utilizzare la pipetta di trasferimento da 200 μL e regolare la scala a 100 μL ruotando la manopola. Riposizionare il puntale della pipetta, quindi trasferire 100 μL del campione di sperma in una provetta da centrifuga.
- Utilizzare la pipetta di trasferimento da 1000 μL e regolare la scala a 900 μL ruotando la manopola. Riposizionare il puntale della pipetta, quindi trasferire 900 μL della soluzione di lavoro sopra menzionata nella provetta da centrifuga.
- Soffiare ripetutamente mediante pipettaggio e omogeneizzare accuratamente il reagente, costituito dal campione di sperma e dalla soluzione di lavoro, utilizzando la pipetta di trasferimento da 1000 μL.
- Posizionare la provetta da centrifuga in un rack per provette su un agitatore bidimensionale e sottoporla ad agitazione continua a 200 giri/min per 30 minuti a RT.
- In attesa della reazione di colorazione, analizzare il campione di sperma utilizzando il sistema CASA per determinare la concentrazione di spermatozoi nel campione di sperma originale nel recipiente a base polimerica.
- Accendere l'interruttore di alimentazione del sistema CASA e fare doppio clic sull'icona SCA SCOPE per aprire l'applicazione software.
- Prima del campionamento, soffiare ripetutamente mediante pipettaggio e omogeneizzare accuratamente il campione di sperma originale con una pipetta a base polimerica.
- Utilizzare la pipetta di trasferimento da 10 μL e regolare la scala a 10 μL ruotando la manopola. Riposizionare il puntale della pipetta, pipettare fino a 10 μL del campione di sperma originale e inserirlo nella camera di conteggio SCA. Attendere 60 secondi affinché il campione di sperma smetta di andare alla deriva.
- Posizionare la camera di conteggio SCA sul portacampioni del sistema CASA e impostare le informazioni del paziente nella finestra di dialogo del software applicativo per prepararsi all'esame formale.
- Esaminare il campione di sperma originale nella camera di conteggio SCA con il sistema CASA facendo clic sul pulsante Start e registrare i dati necessari, come la concentrazione di spermatozoi.
4. Osservazione dei leucociti e degli spermatozoi perossidasi-positivi
- Utilizzare la pipetta di trasferimento da 1000 μL e regolare la scala a 1000 μL ruotando la manopola. Sostituire il puntale della pipetta, quindi soffiare ripetutamente pipettando e omogeneizzare accuratamente il reagente, che consiste di campione di sperma e soluzione di lavoro nella provetta da centrifuga alla fine del processo di reazione di 30 minuti.
- Utilizzare la pipetta di trasferimento da 10 μL e regolare la scala a 10 μL ruotando la manopola. Riposizionare il puntale della pipetta, pipettare fino a 10 μL del reagente sopra menzionato e inserirlo nella camera contaspermatozoi. Infine, coprire la camera di conteggio degli spermatozoi con un vetrino coprioggetti dedicato.
- Posizionare la camera di conteggio degli spermatozoi sul tavolino microscopico e accendere l'interruttore di alimentazione del microscopio ottico con due oculari 10x. Quindi, attendere 60 secondi affinché il campione di reagente smetta di andare alla deriva.
- Passare dal convertitore microscopico all'obiettivo 10x durante il tempo di attesa. Quindi regolare la manopola di regolazione grossolana e la manopola di regolazione fine in sequenza. Infine, osserva gli spermatozoi e le cellule rotonde con un ingrandimento di 10×10.
- Passare il convertitore microscopico alla lente dell'obiettivo 40x dopo aver determinato il campo visivo da analizzare e osservare gli spermatozoi e i leucociti positivi alla perossidasi bruna con un ingrandimento di 10 × 40.
- Utilizzare il sistema di conteggio elettronico per contare almeno 200 spermatozoi e il numero di leucociti positivi alla perossidasi bruna all'interno dei campi corrispondenti.
5. Calcolo della concentrazione di leucociti perossidasi-positivi
- Calcolare la concentrazione di leucociti positivi alla perossidasi utilizzando la seguente formula:
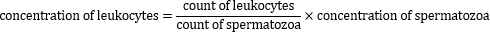
Access restricted. Please log in or start a trial to view this content.
Risultati
Dopo aver implementato la procedura di cui sopra, il reagente nella provetta da centrifuga manifesta spesso un aspetto opalescente subtraslucido (Figura 1). Il rilevamento di un colore ovviamente marrone rivela la potenziale degranulazione dei leucociti, che può provocare la colorazione del liquido. Di conseguenza, il processo di colorazione potrebbe fallire, rendendo necessaria una nuova colorazione o la raccolta di un nuovo campione di sperma per ripetere il test21...
Access restricted. Please log in or start a trial to view this content.
Discussione
L'orto-toluidina e il perossido di idrogeno hanno proprietà fotosensibili e possono decomporsi se esposti alla luce. Per garantire l'efficacia dei reagenti in esame, si consiglia di conservare il fluido di lavoro preparato in un luogo buio.
I campioni di sperma presentano naturalmente caratteristiche eterogenee. Nel processo di preparazione dei campioni di sperma, giudicare correttamente lo stato di liquefazione dello sperma e omogeneizzare accuratamente i campioni di sperma prima di ogni ca...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Gli autori sono grati al Laboratorio di Andrologia del Centro di Medicina Riproduttiva, il Terzo Ospedale Affiliato dell'Università Sun Yat-sen, per aver fornito le strutture per questo studio. Nessun finanziamento è stato coinvolto nella preparazione di questo articolo.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| 148 mmol/L ethylenediamine tetraacetic acid disodium (Na2EDTA) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia B |
| 6% (v/v) hydrogen peroxide solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia D |
| Automatic Sperm Class Analyzer – SCA SCOPE | Microptic S.L. | 1222996; Model type: SCA-SCOPE-H | Computer-Assisted Semen Analysis (CASA) equipment |
| Disposable centrifugal tube (1.5 mL) | Zhejiang Gongdong Medical Equipment Co., LTD | 2210009 | Centrifugal tube for Staining process |
| Disposable transfer pipette (3 mL) | Jiangsu Kangjian Medical Supplies Co., LTD | 20221101 | Polymer-based pipette |
| Electronic counter | None | None | A multichannel counter |
| Electronic scales | Shanghai Liangping Instrument Co., LTD | D9008084 | MAX = 100 g, e = 10 d, d = 0.01 g |
| Makler counting chamber | Makler | MQ30004 | 0.01 sq.mm, 10 μm deep |
| Optical microscope | Olympus | 3G41067201307 | CX31, 10×40 |
| Ortho-toluidine substrate solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia C |
| Pipet tips(1 mL) | Coming Life Sciences (Wujiang) Co.,Ltd | 02923205 | 1000 tips/unit, 5 units/case |
| Pipet tips(10 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 00323961 | 1000 tips/unit, 20 units/case |
| Pipet tips(200 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 32822810 | 1000 tips/unit, 20 units/case |
| Saturated ammonium chloride (NH4Cl) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia A |
| SCA counting chamber | Microptic S.L. | 102230608 | 10 µm, 2 Chambers |
| The container for semen sample | Jiangsu Kangjian Medical Supplies Co., LTD | 20230701 | Polymer-based receptacle for semen sample |
| Thermostatic table | Shenzhen MIAOQUAN Instrument Co., LTD | MQ30004 | MQ-300 |
| Transfer pipette (10 µL) | Eppendoff | 3121000.015 | |
| Transfer pipette (1000 µL) | Eppendoff | 3121000.12 | |
| Transfer pipette (200 µL) | Eppendoff | 3121000.082 | |
| Two-dimensional shaker | DragonLab | 822000010000 | VC5A002205 |
Riferimenti
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reprod Biol Endocrinol. 13, 37(2015).
- Sharlip, I. D., et al. Best practice policies for male infertility. Fertil Steril. 77 (5), 873-882 (2002).
- Choy, J. T., Eisenberg, M. L. Male infertility as a window to health. Fertil Steril. 110 (5), 810-814 (2018).
- Pellati, D., et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 140 (1), 3-11 (2008).
- Rivero, M. J., Kulkarni, N., Thirumavalavan, N., Ramasamy, R. Evaluation and management of male genital tract infections in the setting of male infertility: an updated review. Curr Opin Urol. 33 (3), 180-186 (2023).
- Long, S., Kenworthy, S. Round cells in diagnostic semen analysis: A guide for laboratories and clinicians. Br J Biomed Sci. 79, 10129(2022).
- Johanisson, E., Campana, A., Luthi, R., de Agostini, A. Evaluation of 'round cells' in semen analysis: a comparative study. Hum Reprod Update. 6 (4), 404-412 (2000).
- World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. World Health Organization. , (2010).
- Domes, T., et al. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril. 97 (5), 1050-1055 (2012).
- Aziz, N., Agarwal, A., Lewis-Jones, I., Sharma, R. K., Thomas, A. J. Novel associations between specific sperm morphological defects and leukocytospermia. Fertil Steril. 82 (3), 621-627 (2004).
- Alahmar, A. T. Role of oxidative stress in male infertility: An updated review. J Hum Reprod Sci. 12 (1), 4-18 (2019).
- Schlegel, P. N., et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline Part I. J Urol. 205 (1), 36-43 (2021).
- Ricci, G., Presani, G., Guaschino, S., Simeone, R., Perticarari, S. Leukocyte detection in human semen using flow cytometry. Hum Reprod. 15 (6), 1329-1337 (2000).
- Brunner, R. J., Demeter, J. H., Sindhwani, P. Review of guidelines for the evaluation and treatment of leukocytospermia in male infertility. World J Mens Health. 37 (2), 128-137 (2019).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annu Rev Immunol. 30, 459-489 (2012).
- Khan, A. A., Alsahli, M. A., Rahmani, A. H. Myeloperoxidase as an active disease biomarker: recent biochemical and pathological perspectives. Med Sci (Basel). 6 (2), 33(2018).
- Khan, A. A., Rahmani, A. H., Aldebasi, Y. H., Aly, S. M. Biochemical and pathological studies on peroxidases -an updated review). Glob J Health Sci. 6 (5), 87-98 (2014).
- Liu, W. Q., et al. Myeloperoxidase-derived hypochlorous acid promotes ox-LDL-induced senescence of endothelial cells through a mechanism involving beta-catenin signaling in hyperlipidemia. Biochem Biophys Res Commun. 467 (4), 859-865 (2015).
- Nicholls, S. J., Hazen, S. L. Myeloperoxidase and cardiovascular disease. Arterioscler Thromb Vasc Biol. 25 (6), 1102-1111 (2005).
- Wolff, H. The biologic significance of white blood cells in semen. Fertil Steril. 63 (6), 1143-1157 (1995).
- Chen, Y., Hashiguchi, N., Yip, L., Junger, W. G. Hypertonic saline enhances neutrophil elastase release through activation of P2 and A3 receptors. Am J Physiol Cell Physiol. 290 (4), C1051-C1059 (2006).
- Weiss, S. J. Tissue destruction by neutrophils. N Engl J Med. 320 (6), 365-376 (1989).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon