このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
精液中のペルオキシダーゼ陽性白血球の検査
要約
この論文では、精液中のペルオキシダーゼ陽性白血球を調べるための経済的で効率的なプロトコルを紹介します。コンピューター支援精液分析(CASA)システムの助けを借りて、精液中のペルオキシダーゼ陽性白血球の濃度を合計60分以内に取得でき、アンドロロジーラボとアンドロロジストの効率を効果的に向上させます。
要約
白血球精子症は、精子の運動性の低下、精子の形態学的異常の増加、精子DNA断片化指数の上昇、精子先体機能の障害、さらには胚発生に影響を与える可能性があります。これは、臨床診療における一般的な男性性疾患であり、男性不妊症の重要な原因の1つです。男性の生殖器系炎症が存在するかどうかを判断する場合、アンドロロジストは、臨床診断の基礎として精液中の丸い細胞または精漿エラスターゼを調べることを選択することがよくあります。しかし、丸い細胞の検査は、剥がれた精子形成細胞および生殖管上皮細胞の影響を受けやすく、抗生物質の無差別かつ不必要な使用の減少に寄与しない。同時に、エラスターゼの検出プロセスは比較的複雑で時間がかかり、結果の報告に時間がかかるため、男性生殖器感染症(MGTI)などの疾患の早期診断や治療には有益ではありません。私たちは、コンピュータ支援精液分析(CASA)システムによる精液中のペルオキシダーゼ陽性白血球の検査を白血球精子症の診断基準として革新的に適用し、これらの問題を解決することに成功しました。この検査は、4つの試薬からなる作動流体を検体に添加するだけで、室温での総反応時間は20〜30分以内に制御できます。その後の塗抹標本および顕微鏡検査により、精液中のペルオキシダーゼ陽性白血球の濃度が合計60分以内に得られ、男性の生殖管の炎症が存在するかどうかを診断するために使用することができます。
概要
不妊症は、生殖年齢のカップルの約15%に影響を与える世界的な公衆衛生問題として浮上しています。男性要因は、不妊症全体の症例の約50%に寄与しており、ほぼ20%から30%は男性要因のみに起因する可能性があります1,2,3。男性生殖器感染症(MGTI)は、男性不妊症の重大な原因の1つであり、症例の約15%を占めています4,5。
ほとんどの個体は精液中に白血球を持ち、非精子細胞の13%を占め、好中球12%、マクロファージ0.9%、リンパ球0.1%の割合が異なります6,7。世界保健機関(WHO)のヒト精液の検査と処理に関する実験マニュアル(第5版)によると、白血球精子症は通常、精液中の>1×106細胞/ mLの白血球の存在として定義されます8。この状態は、環境毒素、薬物乱用、精索静脈瘤、MGTIなどの多くの要因によって引き起こされる可能性があり、すべてが精液中の白血球濃度の異常な増加につながる可能性があります9。白血球は精液中の活性酸素種(ROS)レベルを上昇させ、脂質過酸化とタンパク質とDNAへの酸化的損傷を引き起こし、精子の運動性の低下、精子の形態学的異常の増加、精子のDNA断片化指数の上昇、精子の先体機能の障害、さらには胚の発達への悪影響をもたらす可能性があります10,11。
現在、アンドロロジストは一般的に、生殖器の炎症を特定する際に、精液中の丸い細胞または精液中のエラスターゼを調べることを選択します。しかし、剥がれた精子形成細胞と生殖管上皮細胞を区別することはしばしば困難であり、抗生物質の無差別で不必要な使用を減らすことには寄与しません6。後者の検査方法は、比較的複雑で時間がかかり、結果の報告が遅いため、MGTIなどの疾患の早期診断と治療には有益ではありません。米国泌尿器科学会(AUA)は、精液分析における円形細胞濃度が1 ×10 6 細胞/mLを超える場合は、白血球と生殖管から剥がれた細胞をさらに分化する必要があると提案しています12。一部のアンドロロジーラボでは、フローサイトメトリー13 または白血球抗原(CD45など)免疫細胞化学14 を利用して白血球を検査しています。これらの方法は正確ですが、費用と時間がかかるため、特に発展途上国では大規模な臨床実装が困難です。
ペルオキシダーゼは様々な種類の細胞に広く分布しており、酸化ストレス損傷に対する耐性に重要な役割を果たしています。ミエロペルオキシダーゼ(MPO)は、一般的に免疫細胞に発現するペルオキシダーゼサブファミリーのメンバーです。好中球のアズロフィリック顆粒15,16で最も高発現し、リンパ球17,18、単球、マクロファージ19にも発現する。精液中の白血球、特に好中球の濃度は、ペルオキシダーゼ陽性の丸い細胞を調べることによって得ることができます7,20。精液中の白血球の検査プロセスを経済的、便利、かつ効率的にするために、検査方法を再設計しました。コンピューター支援精液分析(CASA)システムの助けを借りて、白血球の濃度を60分以内に取得できます。これにより、患者さんの検査費用や結果が出るまでの待ち時間が短縮され、検査技師の負担軽減や医師の診断・治療待ち時間の短縮が期待できます。
Access restricted. Please log in or start a trial to view this content.
プロトコル
この研究は、中山大学第三附属病院の医療倫理委員会によって審査され、承認されています。
1.作業溶液の調製
- 作業溶液の調製に不可欠な次の試薬(オルトトルイジン基質溶液、飽和塩化アンモニウム(NH4Cl)溶液、148 mmol/L エチレンジアミン四酢酸二ナトリウム塩(Na2EDTA)溶液、および 6% (v/v) 過酸化水素溶液。トランスファーピペット(1000 μL、200 μL、10 μL)や試験管ラックなどの必要なツールとともに、室温(RT)のラボベンチに置いてください。
注意:上記の試薬を取り扱う前に、安全データシート(SDS)をお読みください。 - 調製した作業溶液を保管し、光への暴露から保護するために、不透明な茶色の試薬ボトルを準備します。
- 以下に指定された比率に従って、試薬を不透明な茶色の試薬ボトルに移します。
- 200 μLのトランスファーピペットを使用し、ノブを回してスケールを100 μLに調整します。次に、NH4Cl溶液100μLを不透明な茶色の試薬ボトルに移します。
- ピペットチップを交換し、上記の200 μLのトランスファーピペットを使用して、148 mmol/L Na2EDTA溶液100 μLを不透明な茶色の試薬ボトルに移します。次に、ピペッティングで静かに吹き付け、溶液を完全に均質化します。
- 1000 μLのトランスファーピペットを使用し、ノブを回してスケールを900 μLに調整します。次に、900μLのオルトトルイジン基質溶液を不透明な茶色の試薬ボトルに移し、ピペッティングで静かに吹き付け、溶液を完全に均質化します。
- 10 μLのトランスファーピペットを使用し、ノブを回してスケールを5 μLに調整します。次に、6%(v/v)過酸化水素溶液5 μLを不透明な茶色の試薬ボトルに移します。
- 1000μLのトランスファーピペットを使用し、ノブを回してスケールを1000μLに調整します。ピペットチップを元に戻し、ピペッティングで静かに吹き飛ばし、不透明な茶色の試薬ボトル内の溶液を完全に均質化します。
- すぐに使用できる作業溶液は、RTの不透明な茶色の試薬ボトルに光を避けて保管してください。作業溶液は24時間反応性です。
- 各精液サンプルには、900μLの作業溶液が必要です。毎日調製する作業溶液の量が、毎日検査されるサンプルの数に対応していることを確認してください。
2.精液サンプルの調製
- 精液サンプルを採取する前に、ヒト精液の検査と処理に関する世界保健機関(WHO)の検査マニュアル(第5版)で義務付けられているように、患者が2〜7日間射精を控えていることを確認してください。8.マスターベーションは、精液サンプルを取得するための好ましい方法です。検査の精度を向上させるために、射精したすべての精液を採取するように患者に指示します。
- 恒温スタンドの電源を入れ、事前に37°Cまで加熱して、その後の精液サンプルの液化をスムーズに進めます。
- 患者の精液サンプルを受け取ったら、識別コード、採取時間、禁欲期間、およびその他の関連情報を含む詳細情報をポリマーベースのレセプタクルの外壁に細心の注意を払って記録します。
- 精液サンプルを収容するポリマーベースのレセプタクルを、精液化に有益な37°Cに予熱した恒温スタンドに置きます。
- 精液サンプルをポリマーベースのピペットに吸い込み、精液サンプルが完全に液化するまで5分ごとに液化状態を観察します。
- 精液サンプルが30分以内に完全に液化されていない場合は、まだ検査を行わないでください。さらに30分待ちます。60分経っても精液が完全に液化しない場合は、等量のリン酸緩衝液を1:1に希釈し、静かに攪拌して液化を促進します。
- 徹底的な攪拌と一貫した均質化の後、その後の検査手順のために完全に液化した精液サンプルを保持します。
3. ペルオキシダーゼ陽性白血球の染色と原精液サンプルの分析
- サンプリングの前に、ポリマーベースのピペットを使用してピペッティングで繰り返しブローし、検査中の精液サンプルを完全に均質化します。
- 200 μLのトランスファーピペットを使用し、ノブを回してスケールを100 μLに調整します。ピペットチップを交換し、精液サンプル100μLを遠心分離チューブに移します。
- 1000 μLのトランスファーピペットを使用し、ノブを回してスケールを900 μLに調整します。ピペットチップを交換し、上記の作業溶液900μLを遠心チューブに移します。
- 1000μLのトランスファーピペットを用いて、精液サンプルと作業液からなる反応物をピペッティングで繰り返しブローし、十分に均質化します。
- 遠心分離管を2次元加振機上の試験管ラックに置き、室温で200rpmで30分間連続撹拌します。
- 染色反応を待っている間に、CASAシステムを利用して精液サンプルを分析し、ポリマーベースのレセプタクル内の元の精液サンプル中の精子の濃度を決定します。
- CASAシステムの電源スイッチをオンにし、SCA SCOPEアイコンをダブルクリックしてアプリケーションソフトウェアを開きます。
- サンプリングする前に、ピペッティングで繰り返しブローし、元の精液サンプルをポリマーベースのピペットで再度完全に均質化します。
- 10 μLのトランスファーピペットを使用し、ノブを回してスケールを10 μLに調整します。ピペットチップを交換し、元の精液サンプルを10 μLまでピペットで移し、SCA計数チャンバーに入れます。精液サンプルの漂流が止まるまで60秒待ちます。
- SCA計数チャンバーをCASAシステムのサンプルホルダーに配置し、アプリケーションソフトウェアのダイアログボックスに患者の情報を設定して、正式な検査の準備をします。
- 開始ボタンをクリックして、CASAシステムを使用してSCA計数チャンバー内の元の精液サンプルを調べ、精子の濃度などの必要なデータを記録します。
4. ペルオキシダーゼ陽性白血球と精子の観察
- 1000μLのトランスファーピペットを使用し、ノブを回してスケールを1000μLに調整します。ピペットチップを交換し、ピペッティングで繰り返しブローし、30分間の反応プロセスの最後に、遠心分離管内の精液サンプルと作業溶液からなる反応物を完全に均質化します。
- 10 μLのトランスファーピペットを使用し、ノブを回してスケールを10 μLに調整します。ピペットチップを元に戻し、上記の反応物10μLをピペットで採取し、精子計数室に入れます。最後に、精子計数室を専用のガラスカバースリップで覆います。
- 精子計数室を顕微鏡ステージに置き、2つの10倍接眼レンズで光学顕微鏡の電源スイッチをオンにします。次に、反応物サンプルのドリフトが止まるまで60秒待ちます。
- 待ち時間中に顕微鏡コンバーターを10倍対物レンズに切り替えます。次に、粗調整つまみと微調整つまみを順番に調整します。最後に、精子と丸い細胞を10×10の倍率で観察します。
- 分析する視野が決まったら、顕微鏡コンバーターを40倍の対物レンズに切り替え、精子と褐色ペルオキシダーゼ陽性白血球を10×40の倍率で観察します。
- 電子カウンターシステムを利用して、少なくとも200個の精子と、対応するフィールド内の褐色ペルオキシダーゼ陽性白血球の数をカウントします。
5.ペルオキシダーゼ陽性白血球の濃度の計算
- ペルオキシダーゼ陽性白血球の濃度は、次の式を使用して計算します。
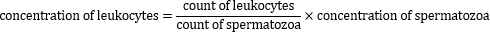
Access restricted. Please log in or start a trial to view this content.
結果
前述の手順を実施すると、遠心分離管内の反応物はしばしば半透明の乳白色の外観を示します(図1)。明らかに褐色を検出すると、白血球の脱顆粒の可能性が明らかになり、液体染色が生じる可能性があります。その結果、染色プロセスが失敗する可能性があり、再染色するか、再検査のために新しい精液サンプルを採取する必要があります21。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
オルトトルイジンと過酸化水素には感光性があり、光にさらされると分解する可能性があります。試験試薬の有効性を確保するために、調製した作動流体は暗い場所に保管することをお勧めします。
精液サンプルは自然に不均一な特性を示します。精液サンプルの調製プロセスでは、精液の液化状態を正しく判断し、各サンプリングの前に精液サンプルを完全に均質化?...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示していません。
謝辞
著者らは、本研究のための施設を提供してくれた中山大学第三附属病院生殖医療センターアンドロロジー研究室に感謝する。この記事の作成には資金は含まれていません。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 148 mmol/L ethylenediamine tetraacetic acid disodium (Na2EDTA) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia B |
| 6% (v/v) hydrogen peroxide solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia D |
| Automatic Sperm Class Analyzer – SCA SCOPE | Microptic S.L. | 1222996; Model type: SCA-SCOPE-H | Computer-Assisted Semen Analysis (CASA) equipment |
| Disposable centrifugal tube (1.5 mL) | Zhejiang Gongdong Medical Equipment Co., LTD | 2210009 | Centrifugal tube for Staining process |
| Disposable transfer pipette (3 mL) | Jiangsu Kangjian Medical Supplies Co., LTD | 20221101 | Polymer-based pipette |
| Electronic counter | None | None | A multichannel counter |
| Electronic scales | Shanghai Liangping Instrument Co., LTD | D9008084 | MAX = 100 g, e = 10 d, d = 0.01 g |
| Makler counting chamber | Makler | MQ30004 | 0.01 sq.mm, 10 μm deep |
| Optical microscope | Olympus | 3G41067201307 | CX31, 10×40 |
| Ortho-toluidine substrate solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia C |
| Pipet tips(1 mL) | Coming Life Sciences (Wujiang) Co.,Ltd | 02923205 | 1000 tips/unit, 5 units/case |
| Pipet tips(10 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 00323961 | 1000 tips/unit, 20 units/case |
| Pipet tips(200 µL) | Coming Life Sciences (Wujiang) Co.,Ltd | 32822810 | 1000 tips/unit, 20 units/case |
| Saturated ammonium chloride (NH4Cl) solution | ShenZhen HuaKang Biomedical Engineering Co.,LTD | 20230301 | Agentia A |
| SCA counting chamber | Microptic S.L. | 102230608 | 10 µm, 2 Chambers |
| The container for semen sample | Jiangsu Kangjian Medical Supplies Co., LTD | 20230701 | Polymer-based receptacle for semen sample |
| Thermostatic table | Shenzhen MIAOQUAN Instrument Co., LTD | MQ30004 | MQ-300 |
| Transfer pipette (10 µL) | Eppendoff | 3121000.015 | |
| Transfer pipette (1000 µL) | Eppendoff | 3121000.12 | |
| Transfer pipette (200 µL) | Eppendoff | 3121000.082 | |
| Two-dimensional shaker | DragonLab | 822000010000 | VC5A002205 |
参考文献
- Agarwal, A., Mulgund, A., Hamada, A., Chyatte, M. R. A unique view on male infertility around the globe. Reprod Biol Endocrinol. 13, 37(2015).
- Sharlip, I. D., et al. Best practice policies for male infertility. Fertil Steril. 77 (5), 873-882 (2002).
- Choy, J. T., Eisenberg, M. L. Male infertility as a window to health. Fertil Steril. 110 (5), 810-814 (2018).
- Pellati, D., et al. Genital tract infections and infertility. Eur J Obstet Gynecol Reprod Biol. 140 (1), 3-11 (2008).
- Rivero, M. J., Kulkarni, N., Thirumavalavan, N., Ramasamy, R. Evaluation and management of male genital tract infections in the setting of male infertility: an updated review. Curr Opin Urol. 33 (3), 180-186 (2023).
- Long, S., Kenworthy, S. Round cells in diagnostic semen analysis: A guide for laboratories and clinicians. Br J Biomed Sci. 79, 10129(2022).
- Johanisson, E., Campana, A., Luthi, R., de Agostini, A. Evaluation of 'round cells' in semen analysis: a comparative study. Hum Reprod Update. 6 (4), 404-412 (2000).
- World Health Organization. WHO Laboratory Manual for the Examination and Processing of Human Semen. 5th edn. World Health Organization. , (2010).
- Domes, T., et al. The incidence and effect of bacteriospermia and elevated seminal leukocytes on semen parameters. Fertil Steril. 97 (5), 1050-1055 (2012).
- Aziz, N., Agarwal, A., Lewis-Jones, I., Sharma, R. K., Thomas, A. J. Novel associations between specific sperm morphological defects and leukocytospermia. Fertil Steril. 82 (3), 621-627 (2004).
- Alahmar, A. T. Role of oxidative stress in male infertility: An updated review. J Hum Reprod Sci. 12 (1), 4-18 (2019).
- Schlegel, P. N., et al. Diagnosis and treatment of infertility in men: AUA/ASRM guideline Part I. J Urol. 205 (1), 36-43 (2021).
- Ricci, G., Presani, G., Guaschino, S., Simeone, R., Perticarari, S. Leukocyte detection in human semen using flow cytometry. Hum Reprod. 15 (6), 1329-1337 (2000).
- Brunner, R. J., Demeter, J. H., Sindhwani, P. Review of guidelines for the evaluation and treatment of leukocytospermia in male infertility. World J Mens Health. 37 (2), 128-137 (2019).
- Amulic, B., Cazalet, C., Hayes, G. L., Metzler, K. D., Zychlinsky, A. Neutrophil function: from mechanisms to disease. Annu Rev Immunol. 30, 459-489 (2012).
- Khan, A. A., Alsahli, M. A., Rahmani, A. H. Myeloperoxidase as an active disease biomarker: recent biochemical and pathological perspectives. Med Sci (Basel). 6 (2), 33(2018).
- Khan, A. A., Rahmani, A. H., Aldebasi, Y. H., Aly, S. M. Biochemical and pathological studies on peroxidases -an updated review). Glob J Health Sci. 6 (5), 87-98 (2014).
- Liu, W. Q., et al. Myeloperoxidase-derived hypochlorous acid promotes ox-LDL-induced senescence of endothelial cells through a mechanism involving beta-catenin signaling in hyperlipidemia. Biochem Biophys Res Commun. 467 (4), 859-865 (2015).
- Nicholls, S. J., Hazen, S. L. Myeloperoxidase and cardiovascular disease. Arterioscler Thromb Vasc Biol. 25 (6), 1102-1111 (2005).
- Wolff, H. The biologic significance of white blood cells in semen. Fertil Steril. 63 (6), 1143-1157 (1995).
- Chen, Y., Hashiguchi, N., Yip, L., Junger, W. G. Hypertonic saline enhances neutrophil elastase release through activation of P2 and A3 receptors. Am J Physiol Cell Physiol. 290 (4), C1051-C1059 (2006).
- Weiss, S. J. Tissue destruction by neutrophils. N Engl J Med. 320 (6), 365-376 (1989).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved