Method Article
通过使用较长电极的电声刺激增强高频听力损失中的耳蜗覆盖率和听力保护
摘要
在高频听力损失的情况下,具有较长电极的电声刺激 (EAS) 可以提供更宽的耳蜗覆盖范围和各种类型的地图。结合微创手术、灵活的侧壁电极和类固醇给药,可以在很少或没有手术创伤的情况下进行更深的插入,从而很好地保护听力。
摘要
电声刺激 (EAS) 是一种很有前途的治疗方法,可以提高高频听力损失 (HL) 患者的听力。在 EAS 手术中,首选较短的电极,以避免电极覆盖残余听力区域。然而,我们早期的研究表明,电极较长 (28 mm) 的 EAS 可以保留听觉。此外,我们报告了听力保护 (HP) 评分与插入电极的长度无关,这与系统评价一致。由于 HL 的自然病程,大多数 EAS 患者会随着时间的推移逐渐失去残余听力,在这些情况下,使用更长的电极提供更宽的人工耳蜗覆盖范围有利于更好的位置间距匹配。除了为将来听力恶化做准备外,具有较长电极的 EAS 还可以提供各种类型的地图策略。在本文中,我们展示了 EAS 手术的手术前、手术中和手术后。适当的术前评估、微创手术、灵活的侧壁电极和类固醇给药导致 EAS 后电极较长,HP良好。
引言
传统人工耳蜗植入术 (CI) 是改善重度至极重度听力损失 (HL) 患者听力能力的标准治疗方法。随后,电声刺激 (EAS) 用于治疗患有严重高频听力损失和残余低频听力的患者1。对于此类患者,保留残余的听觉对于在噪声中实现更好的语音感知、声音定位和在听音乐时提高音质非常重要2。为了解决这个问题,EAS 患者首选使用较短的电极,以避免干扰耳蜗声学区域的残余功能。然而,我们早期的研究 3,4,5,6 记录了即使在 EAS 病例中,侵入性较小的 CI 手术结合薄、直和灵活的"较长"电极也能保留残余听力。此外,我们报告说,听力保留与插入的人工耳蜗电极的长度7 无关,这与系统评价8 一致。
在接受常规 CI 的患者中,较长的电极导致更好的言语感知 9,10,11,因为较长的电极提供更宽的耳蜗覆盖范围和更好的位置间距匹配。同样,据报道,更深的插入角 (AID) 与更好的听力之间存在相关性12,13。在大多数 EAS 患者中,残余听力会随着时间的推移逐渐恶化14。确定 HL 的致病基因可以预测未来的听力。当预计他们将来会在所有频率上失去听力时,具有较长电极而不是较短电极的 EAS 是提供更高人工耳蜗覆盖率的理想选择15。最佳 AID 被认为范围为 630° 至 720°16,17,18,对应于人耳蜗中螺旋神经节神经元的分布。然而,由于每个耳蜗导管长度 (CDL) 都有很大的变化范围19,因此需要在每种情况下测量 CDL 以实现适当的 AID,即使在 EAS 患者中也是如此。最近,市售软件(见材料表)允许根据计算机断层扫描 (CT) 数据轻松测量每个 CDL,这在临床上是可行的。
该方案描述以下内容:(1) 术前评估,包括遗传分析以确定 HL 的病因和耳蜗管长度测量以确定最佳电极长度,(2) 通过 外窥镜检查和内窥镜检查进行的微创外科手术,以及 (3) 术后听力结果和标测策略接受 EAS 的高频 HL 患者使用较长的电极。
研究方案
所述程序经信州大学医学院机构审查委员会批准(批准号:4133)。患者在参与研究前提供了书面知情同意书。用于本研究的试剂、设备和软件列在 材料表中。
1. 术前评估
- 回顾残余听力患者的一系列纯音听力图,以确定每种病例的 HL 进展。
- 对从患者及其家庭成员那里获得的血液样本进行基因检测。
- 建议对一组与 HL 相关的基因进行下一代测序 6,7。
- 进行影像学检查,例如 CT 和/或磁共振成像 (MRI)。建议 CT 切片厚度为 0.6 mm 或更小。对于 MRI,1.5 特斯拉的强度被认为就足够了。
- 在收集6 系列听力图并通过影像学检查和/或基因分析确定病因后,尽可能地预测未来的残余听觉。
- 将术前 CT 图像中的 DICOM 数据导入 OTOPLAN 软件。在每种情况下,软件都会自动测量 CDL。
- 选择合适的 CI 阵列长度,以覆盖预计未来残余听力会恶化的区域。仅使用细、直和柔性电极。
- 手术前 2 天开始以 0.5-1.0 mg/kg/天的剂量口服泼尼松龙。
2. 外科手术
- 将患者置于仰卧位。
- 使用静脉注射芬太尼 (1-2 μg/kg)、异丙酚 (1-2 mg/kg) 和罗库溴铵 (0.6 mg/kg) 诱导麻醉。用丙泊酚 (3-8 mg/kg/h)、瑞芬太尼 (0.1-0.2 μg/kg/min) 和芬太尼(总计:300-500 μg)维持麻醉,不含维库溴铵,以促进神经肌肉监测。
- 切开前 30 分钟静脉输注 8 mg 地塞米松。
- 在手术过程中将患者的头部旋转 45 度。
- 耳后注射局部麻醉剂(皮下注射 0.5% 利多卡因和 1:1,00,000 肾上腺素)。
- 进行 5-6 厘米(懒惰 S 形)的耳后切口,用 6.0-4.0 毫米的切割杆进行乳突切除术,直到到达胃窦包括外侧半规管和砧6 短突的点。
- 使用 1.5-2.0 毫米金刚石条在预期的面神经和鼓索之间进行鼓室后切开术。
- 使用带有 1.0-1.5 毫米金刚石棒的低速钻头观察圆窗壁龛并去除圆窗的骨质悬垂,露出圆形窗膜。
- 用镐子充分打开圆形窗膜,然后小心地缓慢插入电极 3 分钟以上。
- 完成电极插入后进行 X 线检查和听力图检查。
3. 术后评估
- 手术后 3 天以 8 毫克/天、4 毫克/天和 4 毫克/天的剂量静脉注射地塞米松。
- 在初始激活后 6 个月测量独立听觉阈值,并使用 Skarzynski 等人提供的分类评估 HP 率20。
- 使用软件工具根据术后听力图的结果和患者的偏好优化地图设置。
结果
对 10 例符合 EAS 听力标准的患者 (11 只耳朵) 进行了 EAS 检查(参见表 1)。纳入标准包括以下内容: 双侧纯音听力水平 ≤65 dBHL,125 Hz、250 Hz 和 500 Hz;≥80 Hz时为2000 dBHL;和 ≥85 dBHL 在 4000 Hz 和 8000 Hz。此外,传统助听器需要的最小益处,定义为即使在最佳辅助条件下,单音节分数也低于 60%。所有参与者都使用较长的电极接受了 EAS(参见材料表)。图 1 显示了 EAS 手术后术前和术后 6 个月的听力图,表明在所有病例中残余的低频听力都得到了很好的保留。根据 Skarzynski 等人报告的听力保留 (HP) 分类系统20,36.4%(11 例中的 4 例)显示完全 HP,63.6%(11 例中的 7 例)显示部分 HP。没有听力严重恶化的病例。
案例介绍 (案例 #8)
5 岁时,在一次例行的小学健康检查中,一名未接受新生儿听力筛查的 14 岁女孩被标记为疑似听力损失 (HL)。随后被诊断出患有高频 HL,她开始使用助听器。鉴于观察到的听力恶化,她在 13 岁时在我们部门寻求评估。
通过基因检测鉴定 CDH23 基因的致病性变异6。由于 CDH23 相关的 HL 可能会使残余听力恶化,因此选择了更长的电极来覆盖声学区域。她在 14 岁时接受了左耳 EAS 手术。术后 6 个月残余听力完全保留。她更喜欢"仅电刺激 (ES) 映射",激活的根尖电极在当时穿过残余听力区域(图 2)。患者对使用 ES 在低频下获得的声学放大感到满意。
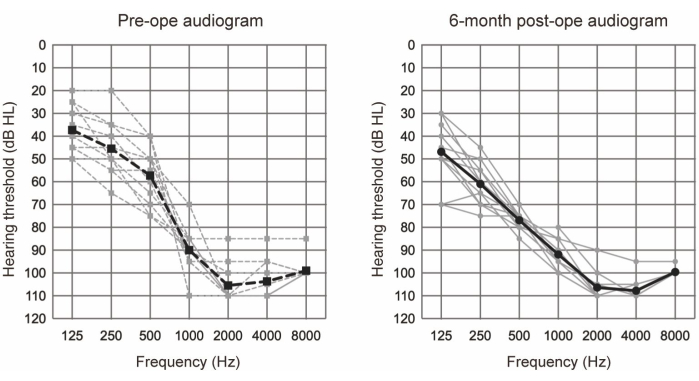
图 1:平均气导听力阈值。 虚线和实线分别表示术前和术后 6 个月的测量值。灰线和黑线分别显示单个数据和平均值。该图改编自 Yoshimura 等人 6。 请单击此处查看此图的较大版本。
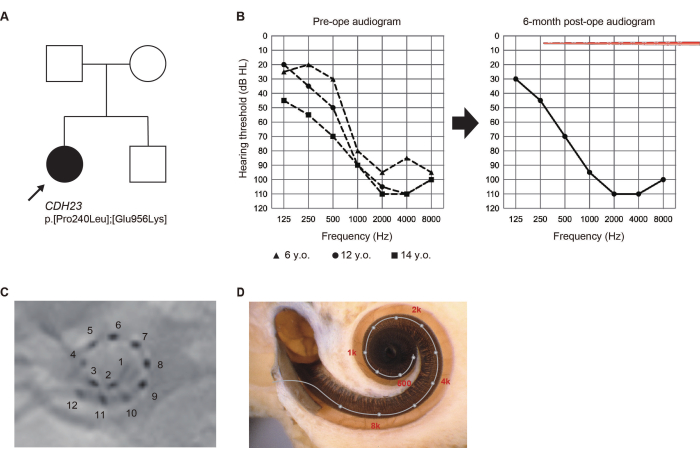
图 2:病例 #8 的临床发现。 (A) 患者的家谱。(B) 术前和术后 6 个月的听力图。电极阵列图示表示插入深度。(C) 术后 X 射线结果,数字对应于各个通道。(D) 每个电极位置的成像和参考音调图。该图改编自 Yoshimura 等人 6。 请单击此处查看此图的较大版本。
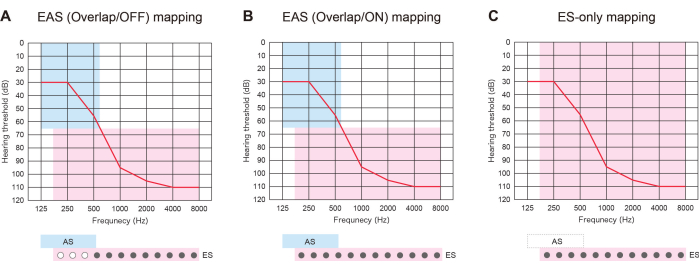
图 3:使用较长电极的 EAS 患者的三种标测策略。 (A) EAS(重叠/关闭)图。一些根尖接触被停用,而声刺激 (AS) 被激活。(B) EAS (重叠/ON) 地图。人工耳蜗植入 (CI) 默认设置中的电刺激 (ES) 和 AS 均被使用。(C) 仅限 ES 的地图。在 ES 设置中,频率范围设置为 70-8,500 Hz。 请单击此处查看此图的较大版本。
| 病人 | 植入 | 植入 | 负责 | 术前 | 术后 6M | HP 数值 | 惠普 | |
| 不。 | 性 | 年龄 (岁) | 边 | 基因 | 低频 (dB) | 低频 (dB) | 比例 (%) | 分类 |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | 部分 |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | 部分 |
| 3 | M | 50 | L | CDH23 | 50 | 56.7 | 78.6 | 完成 |
| 4 | F | 31 | L | 未知 | 45 | 61.7 | 67.7 | 部分 |
| 31 | R | 46.7 | 56.7 | 75.9 | 完成 | |||
| 5 | F | 57 | R | 未知 | 38.3 | 65 | 59 | 部分 |
| 6 | F | 55 | R | 未知 | 26.7 | 55 | 68.4 | 部分 |
| 7 | M | 21 | R | LOXHD1 系列 | 33.3 | 66.7 | 37.2 | 部分 |
| 8 | F | 14 | R | CDH23 | 56.7 | 48.3 | 100 | 完成 |
| 9 | M | 20 | L | 未知 | 51.7 | 73.3 | 48.1 | 部分 |
| 10 | M | 64 | R | 未知 | 51.7 | 58.3 | 82.1 | 完成 |
表 1:受试者特征和听力保留结果总结。 此表改编自 Yoshimura 等人 6。
讨论
在术前评估中确定 HL 的病因对于预测每个病例的未来听力图至关重要。在我们早期的研究中,在高频 HL7 患者中经常发现 CDH23 、 ACTG1 、 Mit1555A>G 、 MYO7A 、 MYO15A 、 SLC26A4 和 TMPRSS3 基因的致病性变异。在这些患者中,大多数患者的残余听力逐渐恶化(参见 图 2 中 CDH23 相关的 HL 病例)。在这些情况下,在选择 CI 电极以获得更广泛的人工耳蜗覆盖时,会考虑 HL 的自然病程。
确定 CI 阵列的长度需要测量耳蜗导管长度 (CDL)。为了促进这一过程,OTOPLAN 软件被证明在临床上是可行的21。在早期版本(例如 OTOPLAN 3.0)中,需要手动测量 CDL 以绘制每个耳蜗的直径、宽度和高度。然而,使用 OTOPLAN 4.0,CDL 的自动测量成为可能,为外科医生提供了更大的便利,并最大限度地减少了测量变化。值得注意的是,切片厚度为 0.6 mm 或更小的 CT 图像适用于 OTOPLAN 提供的自动分析。随后,应选择 CI 阵列的长度,以在每种情况下实现最佳插入深度角 (AID)。
为了进行侵入性较小的 EAS 手术,需要在类固醇给药前、内和后给药,以尽量减少可能升高听力阈值的急性炎症22。在不久的将来,为了最大限度地减少 CI 和 EAS 手术后的急性和慢性反应,使用地塞米松洗脱电极将是可取的。除了类固醇给药外,柔性侧壁电极对于最大限度地减少耳蜗创伤也是必不可少的。使用圆窗方法小心而缓慢地将此类电极插入耳蜗,从而产生最小的侵入性。为了帮助解决这个问题,使用外窥镜和内窥镜进行手术有助于产生更清晰的视野并确认中耳的微小组件。为了防止在耳蜗中诱导广泛的纤维骨组织形成,必须避免延长圆窗入路和耳蜗造口术23.
具有较长电极的 EAS 不仅有助于为 HL 的未来恶化做准备,而且还提供了三种类型的图谱策略。如果插入的电极与残余听觉区域重叠,EAS 患者可以使用带或不带 AS的 ES:"EAS (Overlap/ON) map" 或 "ES-only map"。或者,他们可以关闭一些根尖触点并激活 AS:"EAS (Overlap/OFF) map"。如果听力恶化,可以稍后打开所有触点以提供更好的音高匹配(图 3)。所有这些发现都表明,电极较长的 EAS 允许用户优化地图以获得更自然的听觉。
本文表明,术前准备和先进的手术技术对于最大限度地减少手术创伤至关重要。执行上述一系列术前和术中手术使患者能够从具有更长电极的 EAS 中受益。
局限性
尽管上述微创外科手术取得了进展,但 CI 后一定数量的患者的残余听力仍然恶化。术中监测,例如人工耳蜗颤噪 (CM),在临床上可以测量电极插入过程中的耳蜗损伤24。然而,迄今为止,如何评估具有较长电极的 EAS 以及在某些 CM 反应(例如振幅降低)的情况下该怎么办,仍不清楚。需要在这方面进行进一步研究。
披露声明
作者声明没有利益冲突。
致谢
这项研究由日本厚生劳动省的罕见和疑难杂病研究以及残疾健康和福利综合研究的健康和劳动科学研究补助金 (S.U. 20FC1048, 23FC10149) 和日本医学研究与开发机构 (AMED) 的援助补助金 (SU 19ek0109363h0002, 21ek0109542h003) 资助。
材料
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
参考文献
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。