Method Article
Улучшенное покрытие улитки и сохранение слуха при высокочастотной тугоухости с помощью электроакустической стимуляции с более длинным электродом
В этой статье
Резюме
Электроакустическая стимуляция (ЭАС) с более длинными электродами может обеспечить более широкое покрытие улитки и различные типы карт в случаях высокочастотной тугоухости. Сочетание менее инвазивной хирургии, гибких электродов боковой стенки и введения стероидов позволяет проводить более глубокое введение с небольшой хирургической травмой или без нее, что приводит к хорошему сохранению слуха.
Аннотация
Электроакустическая стимуляция (ЭАС) является перспективным методом лечения для улучшения слуха у пациентов с высокочастотной тугоухостью (ЛХ). При операциях EAS предпочтение отдавалось более коротким электродам, чтобы избежать присутствия электрода, закрывающего остаточную область слуха. Тем не менее, наши более ранние исследования показали, что ЭАС с более длинными электродами (28 мм) могут сохранять акустический слух. Кроме того, мы сообщили, что показатели сохранения слуха (HP) не зависели от длины вставленных электродов, что согласуется с систематическим обзором. Поскольку большинство пациентов с ЭАС постепенно теряют остаточный слух с течением времени из-за естественного течения ЛХ, в этих случаях обеспечение более широкого охвата улитки с использованием более длинных электродов было полезным для лучшего согласования места и шага. В дополнение к подготовке к ухудшению слуха в будущем, ЭАС с более длинными электродами может предложить различные типы стратегий картирования. В этой статье мы показываем до, интра- и пост-процедуры операции EAS. Надлежащая предоперационная оценка, менее инвазивная хирургия, гибкие электроды боковой стенки и введение стероидов привели к хорошему НР после ЭАС с более длинными электродами.
Введение
Традиционная кохлеарная имплантация (КИ) является стандартным методом лечения для улучшения слухоспособности у пациентов с тяжелой и глубокой тугоухостью (ЛХ). В дальнейшем электроакустическая стимуляция (ЭАС) используется для лечения пациентов с тяжелой высокочастотной тугоухостью и остаточным низкочастотным слухом1. У таких пациентов сохранение остаточного акустического слуха важно для достижения лучшего восприятия речи в шуме, локализации звука и улучшения качества звука при прослушивании музыки2. Для решения этой проблемы предпочтение отдается использованию более коротких электродов у пациентов с ЭАС, чтобы избежать вмешательства в остаточную функцию в акустической области улитки. Тем не менее, наши более ранние исследования 3,4,5,6 документально подтвердили, что даже в случаях EAS менее инвазивная хирургия КИ в сочетании с тонкими, прямыми и гибкими «более длинными» электродами позволила сохранить остаточный слух. Кроме того, мы сообщили, что сохранение слуха не было связано с длиной вставленного электрода кохлеарного имплантата7, что согласуется с систематическим обзором8.
У пациентов, перенесших традиционную КИ, более длинные электроды приводили к лучшему восприятию речи 9,10,11, поскольку более длинные электроды обеспечивали более широкий охват улитки и лучшее согласование высоты тона. Аналогичным образом, сообщалось о корреляции между более глубоким углом введения (AID) и улучшением слуха 12,13. У большинства пациентов с ЭАС остаточный слух постепенно ухудшается с течениемвремени14. Определение гена, ответственного за ЛХ, позволяет предсказать будущий слух. Когда ожидается, что в будущем они потеряют слух на всех частотах, EAS с более длинными электродами, а не с более короткими электродами, идеально подходит для обеспечения более высокого процента покрытияулитки15. Считалось, что оптимальный AID находится в диапазоне от 630° до 720°16,17,18, что соответствует распределению спиральных ганглиозных нейронов в улитке человека. Однако, поскольку длина каждого кохлеарного протока (CDL) имеет широкий диапазон вариаций19, измерение CDL в каждом случае требовалось для достижения соответствующего AID, даже у пациентов с EAS. В последнее время коммерчески доступное программное обеспечение (см. Таблицу материалов) позволило легко измерить каждый CDL на основе данных компьютерной томографии (КТ), что было клинически осуществимо.
Этот протокол описывает следующее: (1) предоперационная оценка, которая включала генетический анализ для определения этиологии ЛХ и измерение длины кохлеарного протока для определения оптимальной длины электрода, (2) менее инвазивная хирургическая процедура с помощью экзоскопии и эндоскопии, и (3) послеоперационный исход слуха и стратегия картирования у пациентов с высокочастотной ЛХ, которым был выполнен EAS с более длинным электродом.
протокол
Описанные процедуры были одобрены Институциональным наблюдательным советом Медицинской школы Университета Синшу (Одобрение No 4133). Перед участием в исследовании пациенты давали письменное информированное согласие. Реагенты, оборудование и программное обеспечение, использованные для этого исследования, перечислены в Таблице материалов.
1. Предоперационная оценка
- Просмотрите серию аудиограмм в чистых тонах у пациентов с остаточным слухом, чтобы выяснить прогрессирование ЛХ в каждом случае.
- Провести генетическое тестирование образцов крови, полученных как от пациентов, так и от членов их семей.
- Рекомендуется провести секвенирование нового поколения на панели генов, ассоциированных с HL 6,7.
- Проведите визуализирующие исследования, такие как КТ и/или магнитно-резонансная томография (МРТ). Было рекомендовано, чтобы толщина среза КТ была не более 0,6 мм. Для МРТ было признано достаточным усилие в 1,5 Тесла.
- Делайте прогнозы относительно будущего остаточного акустического слуха в максимально возможной степени после сбора аудиограммы серии6 и определения этиологии с помощью визуализации и/или генетического анализа.
- Импортируйте данные DICOM с предоперационных снимков компьютерной томографии в программное обеспечение OTOPLAN. Программное обеспечение автоматически измеряет CDL в каждом случае.
- Выберите подходящую длину матрицы КИ, чтобы охватить область, в которой ожидается ухудшение остаточного слуха в будущем. Используйте только тонкие, прямые и гибкие электроды.
- Применяют преднизолон перорально в дозировке 0,5-1,0 мг/кг/сут, начиная за 2 суток до операции.
2. Хирургическое вмешательство
- Уложите пациента в положение лежа на спине.
- Вызвать анестезию с помощью внутривенного введения фентанила (1-2 мкг/кг), пропофола (1-2 мг/кг) и рокурония (0,6 мг/кг). Поддерживайте анестезию пропофолом (3-8 мг/кг/ч), ремифентанилом (0,1-0,2 мкг/кг/мин) и фентанилом (всего: 300-500 мкг) без векурония, чтобы облегчить нервно-мышечный мониторинг.
- Введите внутривенную инфузию 8 мг дексаметазона за 30 минут до разреза.
- Поворачивайте голову пациента на 45 градусов во время операции.
- Ввести местную анестезию (подкожно 0,5% лидокаин с 1:1 00 000 адреналина) постаурикулярно.
- Выполнить постаурикулярный разрез 5-6 см (ленивый S-образный) и мастоидэктомию режущими брусьями 6,0-4,0 мм до достижения точки, где антральный отдел включает латеральный полукружный канал и короткий отросток инкуса6.
- Выполните заднюю тимпанотомию между предполагаемым лицевым нервом и хордой тимпанов с использованием алмазных стержней диаметром 1,5-2,0 мм.
- Визуализируйте круглую оконную нишу и удалите костный свес круглого окна с помощью низкоскоростного сверла с алмазным стержнем 1,0-1,5 мм, обнажив мембрану круглого окна.
- Достаточно раскройте круглую оконную мембрану с помощью медиатора и осторожно медленно вставьте электрод более чем на 3 минуты.
- Проведите рентгенографию и аудиограмму после завершения введения электрода.
3. Послеоперационная оценка
- Вводите дексаметазон внутривенно в дозах 8 мг/сут, 4 мг/сут и 4 мг/сут в течение 3 дней после операции.
- Измерьте слуховые пороги без посторонней помощи через 6 месяцев после первоначальной активации и оцените уровень HP, используя классификацию, предоставленную Skarzynski et al.20.
- Оптимизируйте настройки карты с помощью программного инструмента на основе результатов послеоперационной аудиограммы и предпочтений пациента.
Результаты
ЭАС была проведена у 10 пациентов (11 ушей), которые соответствовали аудиологическим критериям ЭАС (см. таблицу 1). Критерии включения включали следующее: двусторонние уровни чистого тона ≤65 дBHL для 125 Гц, 250 Гц и 500 Гц; ≥80 дBHL при 2000 Гц; и ≥85 дBHL при частотах 4000 Гц и 8000 Гц. Кроме того, требовалась минимальная польза от обычных слуховых аппаратов, определяемая как односложные баллы в тишине ниже 60% даже в оптимальном состоянии. Всем участникам проводили ЭАС с использованием более длинных электродов (см. таблицу материалов). На рисунке 1 представлены предоперационные и 6-месячные послеоперационные аудиограммы после операции по коррекции ЭАС, что свидетельствует о том, что остаточный низкочастотный слух был хорошо сохранен во всех случаях. Согласно системе классификации сохранения слуха (НР), представленной Skarzynski et al.20, 36,4% (4 из 11 случаев) показали полное НР, а 63,6% (7 из 11 случаев) — частичное. Случаев значительного ухудшения слуха не было.
Презентация кейса (Кейс #8)
В возрасте 5 лет, во время планового профилактического осмотра в начальной школе, 14-летняя девочка, которая не проходила скрининг слуха новорожденных, была отмечена как подозреваемая потеря слуха (ЛХ). Впоследствии ей поставили диагноз высокочастотная ЛХ, и она начала пользоваться слуховыми аппаратами. Учитывая наблюдаемое ухудшение слуха, в возрасте 13 лет она обратилась за обследованием в наше отделение.
Патогенные варианты гена CDH23 были идентифицированы с помощью генетического тестирования6. Поскольку остаточный слух мог ухудшиться из-за связанного с CDH23 HL, был выбран более длинный электрод для покрытия акустической области. В возрасте 14 лет она перенесла операцию EAS на левом ухе. Остаточный слух был полностью сохранен через 6 месяцев после операции. Она предпочитала «картирование только с помощью электростимуляции (ЭС)» с активированными апикальными электродами, проходящими через область остаточного слуха в то время (рис. 2). Пациент остался доволен акустическим усилением, полученным с помощью ЭС на низких частотах.
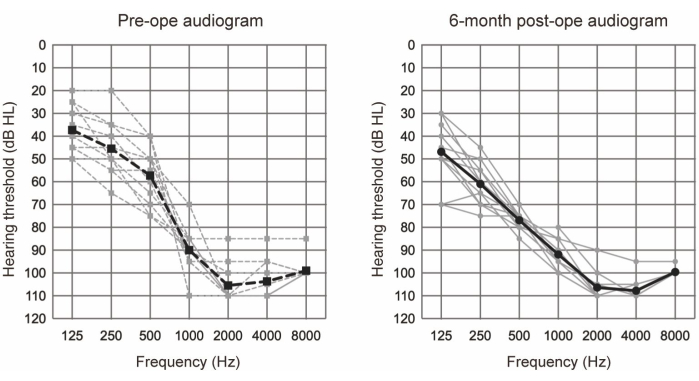
Рисунок 1: Средние пороги слышимости воздушной проводимости. Пунктирная и сплошная линии указывают на предоперационные и 6-месячные послеоперационные измерения соответственно. Серые и черные линии показывают отдельные данные и среднее значение соответственно. Этот рисунок был адаптирован из Yoshimura et al.6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
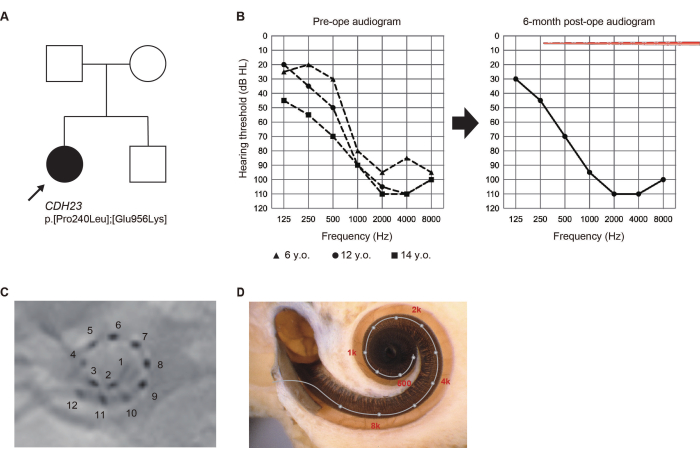
Рисунок 2: Клинические данные Случая #8. (А) Родословная пациента. (B) Предоперационные и 6-месячные послеоперационные аудиограммы. На иллюстрациях электродной матрицы показана глубина введения. (C) Послеоперационные рентгенологические данные, с номерами, соответствующими отдельным каналам. (D) Визуализация для каждого расположения электродов и справочная тонотопическая карта. Этот рисунок был адаптирован из Yoshimura et al.6. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
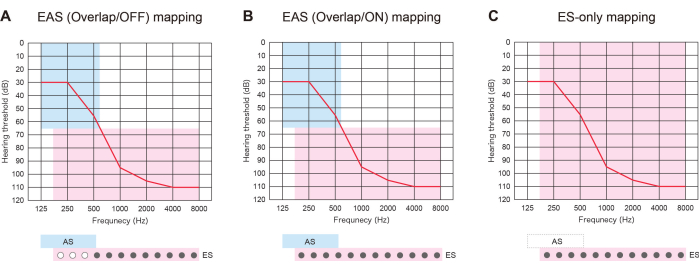
Рисунок 3: Три типа стратегии картирования у пациентов с EAS с использованием более длинных электродов. (A) Карта EAS (Overlap/OFF). Некоторые из апикальных контактов были дезактивированы, в то время как акустическая стимуляция (АС) была активирована. (B) Карта EAS (Overlap/ON). Применяли как электростимуляцию (ЭС) в стандартной настройке кохлеарной имплантации (КИ), так и АС. (C) Карта только для ES. В настройке ЧС диапазон частот был установлен в пределах 70-8 500 Гц. АС была отключена. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Терпеливый | Имплантирован | Имплантирован | Ответственный | Предоперационная подготовка | 6 месяцев после операции | Числовое значение HP | Л.С | |
| Нет. | Род | Возраст (лет) | сторона | Ген | LFA (дБ) | LFA (дБ) | Масштаб (%) | классификация |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | Частичный |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | Частичный |
| 3 | M | 50 | L | КДХ23 | 50 | 56.7 | 78.6 | Полный |
| 4 | F | 31 | L | Неизвестный | 45 | 61.7 | 67.7 | Частичный |
| 31 | R | 46.7 | 56.7 | 75.9 | Полный | |||
| 5 | F | 57 | R | Неизвестный | 38.3 | 65 | 59 | Частичный |
| 6 | F | 55 | R | Неизвестный | 26.7 | 55 | 68.4 | Частичный |
| 7 | M | 21 | R | LOXHD1 | 33.3 | 66.7 | 37.2 | Частичный |
| 8 | F | 14 | R | КДХ23 | 56.7 | 48.3 | 100 | Полный |
| 9 | M | 20 | L | Неизвестный | 51.7 | 73.3 | 48.1 | Частичный |
| 10 | M | 64 | R | Неизвестный | 51.7 | 58.3 | 82.1 | Полный |
Таблица 1: Краткая информация о характеристиках субъекта и результатах сохранения слуха. Эта таблица была адаптирована из Yoshimura et al.6.
Обсуждение
Определение этиологии ЛХ в предоперационной оценке имеет решающее значение для прогнозирования будущей аудиограммы в каждом конкретном случае. В нашем более раннем исследовании патогенные варианты в генах CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 и TMPRSS3 часто выявлялись у пациентов с высокочастотным HL7. У большинства из этих пациентов остаточный слух постепенно ухудшался (см. случай ЛХ, связанный с CDH23, на рисунке 2). В этих случаях при выборе КИ-электрода для более широкого покрытия улитки учитывалось естественное течение ЛХ.
Для определения длины решетки CI потребовалось измерить длину кохлеарного канала (CDL). Для облегчения этого процесса оказалось клинически возможным программное обеспечение OTOPLAN21. В более ранних версиях, таких как OTOPLAN 3.0, CDL измерялся вручную для построения графика диаметра, ширины и высоты каждой улитки. Однако с появлением OTOPLAN 4.0 стало возможным автоматическое измерение CDL, что повысило удобство для хирургов и свело к минимуму вариации измерений. Примечательно, что для автоматического анализа, предоставленного компанией OTOPLAN, подходили КТ-изображения с толщиной среза 0,6 мм и менее. Впоследствии следует выбрать длину матрицы CI для достижения оптимального угла глубины вставки (AID) в каждом конкретном случае.
Для проведения менее инвазивной операции ЭАС требовалось пред-, интра- и пост-введение стероидов, чтобы свести к минимуму острое воспаление, которое могло повысить порог слуха22. В ближайшем будущем, чтобы свести к минимуму не только острые, но и хронические реакции после операции по КИ и ЭАС, будет желательно использование электродов с покрытием дексаметазоном. В дополнение к введению стероидов, гибкие электроды боковой стенки были необходимы для минимизации травматизации улитки. Аккуратное и медленное введение таких электродов в улитку с использованием круглого окна привело к минимальной инвазивности. Чтобы помочь в этом, проведение хирургических операций с использованием экзоскопов и эндоскопов было полезно для создания более четкого поля зрения и подтверждения крошечных компонентов среднего уха. Чтобы предотвратить образование обширной фиброзно-костной ткани в улитке, следует избегать расширенного круглого окна и кохлеостомии23.
ЭАС с более длинными электродами была полезна не только для подготовки к будущему ухудшению состояния ЛХ, но и для предложения трех типов стратегий картирования. Если вставленные электроды перекрываются с остаточной областью слуха, пациенты с ЭАС могут использовать ЭС с АС или без нее: «Карта EAS (Overlap/ON)» или «Карта только ES». В качестве альтернативы они могут отключить некоторые апикальные контакты и активировать карту AS: "EAS (Overlap/OFF)". Если слух ухудшается, все контакты могут быть позже включены для лучшего согласования высоты звука (Рисунок 3). Все эти результаты показывают, что EAS с более длинными электродами позволяет пользователям оптимизировать карты для более естественного слуха.
В данной работе показано, что предоперационная подготовка и передовые хирургические методы имеют важное значение для минимизации хирургической травмы. Выполнение вышеназванного ряда предоперационных и интраоперационных процедур позволило пациентам получить пользу от ЭАС с более длинными электродами.
Ограничения
Несмотря на достижения в вышеупомянутых менее инвазивных хирургических процедурах, остаточный слух все еще ухудшается у определенного числа пациентов после КИ. Интраоперационный мониторинг, такой как кохлеарная микрофония (КМ), был бы клинически осуществим для измерения повреждения улитки во время введения электрода24. Однако как оценить ЭАС с более длинными электродами и что делать в случае определенных реакций КМ, таких как снижение амплитуды, до сих пор остается неясным. Необходимы дальнейшие исследования в этой области.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Это исследование финансировалось за счет гранта на исследования в области здравоохранения и труда для исследований редких и трудноизлечимых заболеваний и комплексных исследований здоровья и благополучия инвалидов от Министерства здравоохранения, труда и социального обеспечения Японии (S.U. 20FC1048, 23FC10149) и грантов от Японского агентства медицинских исследований и разработок (AMED) (S.U. 19ek0109363h0002, 21ek0109542h003).
Материалы
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
Ссылки
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены