Method Article
Verbesserte Cochlea-Abdeckung und Gehörerhaltung bei hochfrequentem Hörverlust durch elektrisch-akustische Stimulation mit längerer Elektrode
In diesem Artikel
Zusammenfassung
Die elektrisch-akustische Stimulation (EAS) mit längeren Elektroden kann eine breitere Cochlea-Abdeckung und verschiedene Arten von Karten bei hochfrequentem Hörverlust bieten. Die Kombination von weniger invasiver Chirurgie, flexiblen Seitenwandelektroden und Steroidverabreichung ermöglicht eine tiefere Einführung mit wenig oder keinem chirurgischen Trauma, was zu einer guten Erhaltung des Gehörs führt.
Zusammenfassung
Die elektrisch-akustische Stimulation (EAS) ist eine vielversprechende Behandlung zur Verbesserung des Hörvermögens von Patienten mit hochfrequentem Hörverlust (HL). Bei EAS-Operationen wurden kürzere Elektroden bevorzugt, um das Vorhandensein einer Elektrode zu vermeiden, die den verbleibenden Hörbereich abdeckt. Unsere früheren Studien zeigten jedoch, dass EAS mit längeren Elektroden (28 mm) das akustische Hören erhalten konnte. Darüber hinaus berichteten wir, dass die Werte für die Gehörerhaltung (HP) unabhängig von der Länge der eingeführten Elektroden waren, was mit der systematischen Überprüfung übereinstimmte. Da die meisten EAS-Patienten aufgrund des natürlichen Verlaufs von HL im Laufe der Zeit allmählich an Restgehör verlieren, war in diesen Fällen eine breitere Cochlea-Abdeckung mit längeren Elektroden für eine bessere Orts-Tonhöhen-Anpassung von Vorteil. Neben der Vorbereitung auf die Verschlechterung des Hörvermögens in der Zukunft könnten EAS mit längeren Elektroden verschiedene Arten von Map-Strategien bieten. Darin zeigen wir die prä-, intra- und postoperativen Eingriffe bei der EAS-Operation. Eine angemessene präoperative Untersuchung, weniger invasive Operationen, flexible Seitenwandelektroden und Steroidverabreichung führten zu einer guten HP nach EAS mit längeren Elektroden.
Einleitung
Die konventionelle Cochlea-Implantation (CI) ist eine Standardbehandlung zur Verbesserung des Hörvermögens bei Patienten mit schwerem bis hochgradigem Hörverlust (HL). Anschließend wird die elektrisch-akustische Stimulation (EAS) zur Behandlung von Patienten mit schwerem hochfrequentem Hörverlust und restlichem niederfrequentem Gehöreingesetzt 1. Bei solchen Patienten ist der Erhalt des verbleibenden akustischen Gehörs wichtig, um eine bessere Sprachwahrnehmung bei Lärm, eine bessere Klanglokalisierung und eine verbesserte Klangqualität beim Musikhörenzu erreichen 2. Um dies zu beheben, wurde die Verwendung kürzerer Elektroden bei EAS-Patienten bevorzugt, um eine Beeinträchtigung der Restfunktion im akustischen Bereich der Cochlea zu vermeiden. Unsere früheren Studien 3,4,5,6 dokumentierten jedoch, dass auch in EAS-Fällen eine weniger invasive CI-Chirurgie in Kombination mit dünnen, geraden und flexiblen "längeren" Elektroden den Erhalt des Restgehörs ermöglichte. Darüber hinaus berichteten wir, dass der Erhalt des Gehörs in keinem Zusammenhang mit der Länge der eingesetzten Cochlea-Implantat-Elektrode7 stand, was mit der systematischen Übersichtsarbeitübereinstimmt 8.
Bei Patienten, die sich einer konventionellen CI unterzogen, führten längere Elektroden zu einer besseren Sprachwahrnehmung 9,10,11, da längere Elektroden eine breitere Cochlea-Abdeckung und eine bessere Orts-Tonhöhen-Übereinstimmung bieten. In ähnlicher Weise wurde über eine Korrelation zwischen einem tieferen Einführwinkel (AID) und besserem Hören berichtet12,13. Bei den meisten EAS-Patienten verschlechtert sich das Restgehör im Laufe der Zeit allmählich14. Die Identifizierung des verantwortlichen Gens für HL ermöglicht es, das zukünftige Hören vorherzusagen. Wenn davon auszugehen ist, dass das Gehör in Zukunft über alle Frequenzen hinweg verloren gehen wird, ist EAS mit längeren Elektroden und nicht mit kürzeren Elektroden ideal, um einen höheren Prozentsatz der Cochlea-Abdeckung zu erreichen15. Es wurde angenommen, dass die optimale AID zwischen 630° und 720°16,17,18 liegt, was der Verteilung der Neuronen der Spiralganglien in der menschlichen Cochlea entspricht. Da jedoch jede Länge des Cochlea-Gangs (CDL) eine große Bandbreite an Variationen aufweist19, war die Messung der CDL in jedem Fall erforderlich, um die geeignete AID zu erreichen, auch bei EAS-Patienten. In jüngster Zeit ermöglichte eine kommerziell erhältliche Software (siehe Materialtabelle) die Messung jeder CDL auf der Grundlage von Computertomographie (CT)-Daten, was klinisch machbar war.
Dieses Protokoll beschreibt Folgendes: (1) eine präoperative Untersuchung, die eine genetische Analyse zur Identifizierung der Ätiologie von HL und eine Messung der Länge des Cochlea-Gangs zur Bestimmung der optimalen Elektrodenlänge umfasste, (2) ein weniger invasiver chirurgischer Eingriff mittels Exoskopie und Endoskopie und (3) das postoperative Hörergebnis und die Mapping-Strategie bei Patienten mit hochfrequentem HL, die sich einer EAS mit einer längeren Elektrode unterzogen haben.
Protokoll
Die beschriebenen Verfahren wurden vom Institutional Review Board der Shinshu University School of Medicine genehmigt (Zulassungsnummer 4133). Die Patienten gaben vor der Teilnahme an der Studie eine schriftliche Einverständniserklärung ab. Die für diese Studie verwendeten Reagenzien, Geräte und Software sind in der Materialtabelle aufgeführt.
1. Präoperative Bewertung
- Überprüfen Sie die Reihe der Reintonaudiogramme bei Patienten mit Restgehör, um das Fortschreiten der HL in jedem Fall zu ermitteln.
- Führen Sie genetische Tests an Blutproben durch, die sowohl von Patienten als auch von ihren Familienmitgliedern entnommen wurden.
- Es wird empfohlen, eine Next-Generation-Sequenzierung an einer Reihe von Genen durchzuführen, die mit HL 6,7 assoziiert sind.
- Führen Sie bildgebende Tests wie CT und/oder Magnetresonanztomographie (MRT) durch. Es wurde empfohlen, die Dicke der CT-Schicht 0,6 mm oder weniger zu betragen. Für die MRT wurde eine Stärke von 1,5 Tesla als ausreichend erachtet.
- Machen Sie nach der Entnahme des Audiogramms Serie6 und der Identifizierung der Ätiologie durch Bildgebung und/oder genetische Analyse so weit wie möglich Vorhersagen über das zukünftige akustische Resthören.
- Importieren Sie DICOM-Daten aus präoperativen CT-Bildern in die OTOPLAN-Software. Die Software misst die CDL jeweils automatisch.
- Wählen Sie die geeignete Länge des CI-Arrays aus, um den Bereich abzudecken, in dem sich das Restgehör in Zukunft voraussichtlich verschlechtern wird. Verwenden Sie nur dünne, gerade und flexible Elektroden.
- Verabreichen Sie Prednisolon oral in einer Dosierung von 0,5-1,0 mg/kg/Tag, beginnend 2 Tage vor der Operation.
2. Chirurgischer Eingriff
- Bringen Sie den Patienten in Rückenlage.
- Induzieren Sie eine Anästhesie mit intravenösem Fentanyl (1-2 μg/kg), Propofol (1-2 mg/kg) und Rocuronium (0,6 mg/kg). Halten Sie die Anästhesie mit Propofol (3-8 mg/kg/h), Remifentanil (0,1-0,2 μg/kg/min) und Fentanyl (insgesamt: 300-500 μg) ohne Vecuronium aufrecht, um die neuromuskuläre Überwachung zu erleichtern.
- Verabreichen Sie eine intravenöse Infusion von 8 mg Dexamethason 30 Minuten vor dem Einschnitt.
- Drehen Sie den Kopf des Patienten während der Operation um 45 Grad.
- Injizieren Sie postaurikulär eine Lokalanästhesie (subkutan 0,5% Lidocain mit 1:1,00,000 Adrenalin).
- Führen Sie einen postaurikulären Schnitt von 5-6 cm (Lazy S-förmig) und eine Mastoidektomie mit 6,0-4,0 mm Schneidestäben durch, bis Sie den Punkt erreichen, an dem das Antrum den lateralen Bogengang und den kurzen Fortsatz des Incus6 umfasst.
- Führen Sie eine posteriore Tympanotomie zwischen dem erwarteten Nervus facialis und der Chorda tympani mit 1,5-2,0 mm Diamantbarren durch.
- Visualisieren Sie die runde Fensternische und entfernen Sie den knöchernen Überstand des runden Fensters mit einem langsam laufenden Bohrer mit einer Diamantstange von 1,0 bis 1,5 mm, wodurch die runde Fenstermembran freigelegt wird.
- Öffnen Sie die runde Fenstermembran mit einem Plektrum ausreichend und führen Sie die Elektrode vorsichtig über 3 Minuten lang langsam ein.
- Führen Sie Röntgen- und Audiogramme durch, nachdem Sie die Elektrode eingeführt haben.
3. Postoperative Bewertung
- Verabreichen Sie intravenös Dexamethason in einer Dosierung von 8 mg/Tag, 4 mg/Tag und 4 mg/Tag für 3 Tage nach der Operation.
- Messen Sie die auditiven Schwellenwerte 6 Monate nach der ersten Aktivierung und beurteilen Sie die HP-Rate anhand der von Skarzynski et al.20 bereitgestellten Klassifikation.
- Optimieren Sie die Karteneinstellungen mit einem Softwaretool, das auf den Ergebnissen des postoperativen Audiogramms und den Patientenpräferenzen basiert.
Ergebnisse
Die EAS wurde an 10 Patienten (11 Ohren) durchgeführt, die die audiologischen Kriterien für eine EAS erfüllten (siehe Tabelle 1). Die Einschlusskriterien umfassten Folgendes: bilaterale Reinton-Hörpegel ≤65 dBHL für 125 Hz, 250 Hz und 500 Hz; ≥80 dBHL bei 2000 Hz; und ≥85 dBHL bei 4000 Hz und 8000 Hz. Zusätzlich war ein minimaler Nutzen von herkömmlichen Hörgeräten erforderlich, definiert als einsilbige Werte in leise unter 60% selbst im optimal unterstützten Zustand. Alle Teilnehmer unterzogen sich einer EAS mit längeren Elektroden (siehe Materialtabelle). Abbildung 1 zeigt die präoperativen und 6 Monate postoperativen Audiogramme nach der EAS-Operation, was darauf hindeutet, dass das verbleibende niederfrequente Gehör in allen Fällen gut erhalten blieb. Nach dem von Skarzynski et al.20 berichteten Klassifikationssystem für die Erhaltung des Gehörs (HP) wiesen 36,4 % (4 von 11 Fällen) eine vollständige HP und 63,6 % (7 von 11 Fällen) eine partielle HP auf. Es gab keine Fälle von signifikanter Verschlechterung des Hörvermögens.
Präsentation des Falles (Fall #8)
Im Alter von 5 Jahren wurde ein 14-jähriges Mädchen, das sich keinem Neugeborenen-Hörscreening unterzogen hatte, während eines routinemäßigen Gesundheitschecks in der Grundschule wegen Verdachts auf Hörverlust (HL) gekennzeichnet. Als später Hochfrequenz-HL diagnostiziert wurde, begann sie, Hörgeräte zu benutzen. Angesichts der festgestellten Verschlechterung ihres Hörvermögens suchte sie im Alter von 13 Jahren eine Untersuchung in unserer Abteilung.
Pathogene Varianten des CDH23-Gens wurden mittels Gentests identifiziert6. Da sich das Restgehör aufgrund des CDH23-bedingten HL wahrscheinlich verschlechterte, wurde eine längere Elektrode gewählt, um den akustischen Bereich abzudecken. Im Alter von 14 Jahren unterzog sie sich einer EAS-Operation am linken Ohr. Das Restgehör blieb 6 Monate nach der Operation vollständig erhalten. Sie bevorzugte ein "Nur-Elektrostimulations-Mapping (ES)" mit aktivierten apikalen Elektroden, die den Bereich des damaligen Restgehörs durchquerten (Abbildung 2). Der Patient war mit der akustischen Verstärkung zufrieden, die mit ES bei niedrigen Frequenzen erzielt wurde.
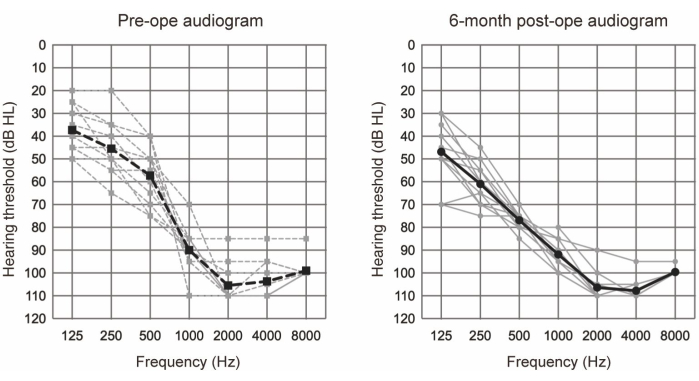
Abbildung 1: Durchschnittliche Hörschwellen für die Luftleitung. Die gestrichelten und durchgezogenen Linien zeigen präoperative bzw. 6-monatige postoperative Messungen an. Graue und schwarze Linien zeigen die einzelnen Daten bzw. den Mittelwert. Diese Abbildung wurde von Yoshimura et al.6 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
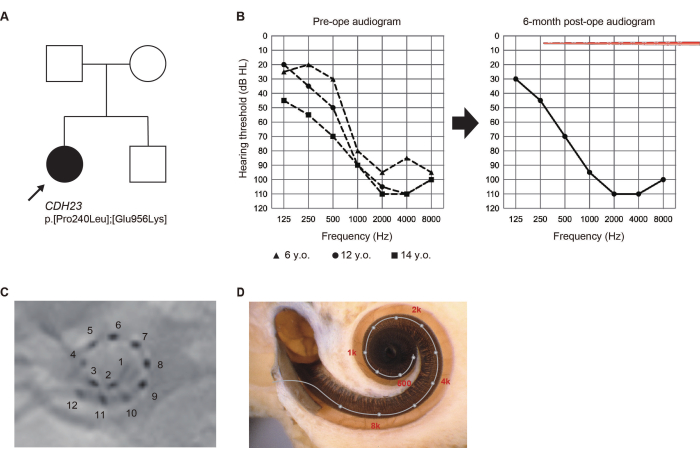
Abbildung 2: Klinische Befunde von Fall #8. (A) Stammbaum des Patienten. (B) Präoperative und 6 Monate postoperative Audiogramme. Die Abbildungen der Elektrodenarrays stellen die Einführtiefe dar. (C) Postoperative Röntgenbefunde mit Nummern, die den einzelnen Kanälen entsprechen. (D) Bildgebung für jede Elektrodenposition und die Referenz-tonotopische Karte. Diese Abbildung wurde von Yoshimura et al.6 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
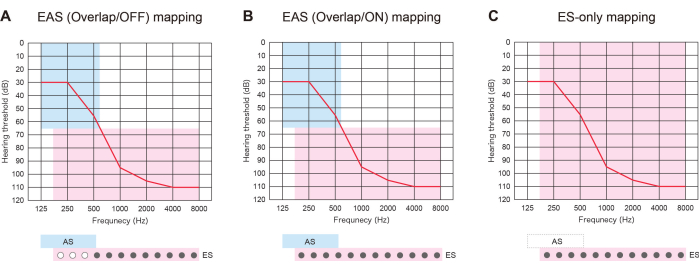
Abbildung 3: Drei Arten von Mapping-Strategien bei Patienten mit EAS unter Verwendung längerer Elektroden. (A) EAS-Karte (Overlap/OFF). Einige der apikalen Kontakte wurden deaktiviert, während die akustische Stimulation (AS) aktiviert wurde. (B) EAS-Karte (Überlappung/ON). Es wurden sowohl die Elektrostimulation (ES) in der Standardeinstellung für die Cochlea-Implantation (CI) als auch die AS verwendet. (C) Nur ES-Karte. In der ES-Einstellung wurde der Frequenzbereich von 70-8.500 Hz eingestellt, AS war deaktiviert. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Geduldig | Implantiert | Implantiert | Verantwortlich | Vor der Operation | 6M postoperativ | HP numerisch | PS | |
| Nein. | Geschlecht | Alter (Jahre) | Seite | Gen | LFA (dB) | LFA (dB) | Skala (%) | Klassifikation |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | Teilweise |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | Teilweise |
| 3 | M | 50 | L | CDH23 | 50 | 56.7 | 78.6 | Vollständig |
| 4 | F | 31 | L | Unbekannt | 45 | 61.7 | 67.7 | Teilweise |
| 31 | R | 46.7 | 56.7 | 75.9 | Vollständig | |||
| 5 | F | 57 | R | Unbekannt | 38.3 | 65 | 59 | Teilweise |
| 6 | F | 55 | R | Unbekannt | 26.7 | 55 | 68.4 | Teilweise |
| 7 | M | 21 | R | LOXHD1 | 33.3 | 66.7 | 37.2 | Teilweise |
| 8 | F | 14 | R | CDH23 | 56.7 | 48.3 | 100 | Vollständig |
| 9 | M | 20 | L | Unbekannt | 51.7 | 73.3 | 48.1 | Teilweise |
| 10 | M | 64 | R | Unbekannt | 51.7 | 58.3 | 82.1 | Vollständig |
Tabelle 1: Zusammenfassung der Merkmale der Probanden und der Ergebnisse zur Erhaltung des Gehörs. Diese Tabelle wurde von Yoshimura et al.6 übernommen.
Diskussion
Die Identifizierung der Ätiologie von HL in der präoperativen Bewertung ist entscheidend für die Vorhersage des zukünftigen Audiogramms in jedem Fall. In unserer früheren Studie wurden pathogene Varianten in den Genen CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 und TMPRSS3 häufig bei Patienten mit hochfrequentem HL7 identifiziert. Bei den meisten dieser Patienten verschlechterte sich das Restgehör allmählich (siehe CDH23-bezogener HL-Fall in Abbildung 2). In diesen Fällen wurde der natürliche Verlauf der HL bei der Auswahl der CI-Elektrode für eine breitere Cochlea-Abdeckung berücksichtigt.
Um die Länge des CI-Arrays zu bestimmen, musste die Länge des Cochlea-Ductus (CDL) gemessen werden. Um diesen Prozess zu erleichtern, erwies sich die Software OTOPLAN als klinisch machbar21. In früheren Versionen, wie z. B. OTOPLAN 3.0, wurde die CDL manuell gemessen, um den Durchmesser, die Breite und die Höhe jeder Cochlea darzustellen. Mit OTOPLAN 4.0 wurde jedoch die automatische Messung der CDL möglich, was den Chirurgen mehr Komfort bietet und die Messabweichung minimiert. Insbesondere CT-Bilder mit einer Schichtdicke von 0,6 mm oder weniger waren für die automatische Analyse von OTOPLAN geeignet. Anschließend sollte die Länge des CI-Arrays gewählt werden, um den jeweils optimalen Einführwinkel (AID) zu erreichen.
Um eine weniger invasive EAS-Operation durchzuführen, war eine prä-, intra- und poststeroidale Verabreichung erforderlich, um die akute Entzündung zu minimieren, die die Hörschwelle erhöhen könnte22. Um nicht nur akute, sondern auch chronische Reaktionen nach CI- und EAS-Operationen zu minimieren, wird in naher Zukunft der Einsatz von Dexamethason-freisetzenden Elektroden wünschenswert sein. Neben der Verabreichung von Steroiden waren flexible Seitenwandelektroden unerlässlich, um das Trauma der Cochlea zu minimieren. Das vorsichtige und langsame Einführen solcher Elektroden in die Cochlea mit dem Rundfensterzugang führte zu einer minimalen Invasivität. Um dies zu unterstützen, war die Durchführung von Operationen mit Exoskopen und Endoskopen nützlich, um ein klareres Sichtfeld zu erzeugen und die winzigen Bestandteile des Mittelohrs zu bestätigen. Um eine extensive Bildung von fibroossärem Gewebe in der Cochlea zu verhindern, müssen der erweiterte Rundfensterzugang und die Cochleostomie vermieden werden23.
EAS mit längeren Elektroden war nicht nur nützlich, um sich auf die zukünftige Verschlechterung von HL vorzubereiten, sondern auch, um drei Arten von Kartenstrategien anzubieten. Wenn sich die eingesetzten Elektroden mit dem Resthörbereich überlappen, können Patienten mit EAS ES mit oder ohne AS verwenden: "EAS (Overlap/ON) map" oder "ES-only map". Alternativ können sie einige der apikalen Kontakte ausschalten und die AS: "EAS (Overlap/OFF) Map" aktivieren. Wenn sich das Gehör verschlechtert, können alle Kontakte nachträglich eingeschaltet werden, um eine bessere Tonhöhenanpassung zu ermöglichen (Abbildung 3). All diese Ergebnisse zeigen, dass EAS mit längeren Elektroden es den Benutzern ermöglicht, Karten für ein natürlicheres Hören zu optimieren.
Hier wird gezeigt, dass die präoperative Vorbereitung und fortschrittliche Operationstechniken unerlässlich sind, um das chirurgische Trauma zu minimieren. Die Durchführung der oben genannten Reihe von prä- und intraoperativen Eingriffen ermöglichte es den Patienten, von EAS mit längeren Elektroden zu profitieren.
Begrenzungen
Trotz der Fortschritte bei den oben genannten weniger invasiven chirurgischen Verfahren verschlechtert sich das Restgehör bei einer bestimmten Anzahl von Patienten nach CI immer noch. Eine intraoperative Überwachung, wie z. B. die Cochlea-Mikrofonie (CM), wäre klinisch durchführbar, um Cochlea-Schäden während des Elektrodeneinführenszu messen 24. Wie man EAS mit längeren Elektroden auswerten kann und was bei bestimmten CM-Reaktionen, wie z.B. einer Abnahme der Amplitude, zu tun ist, ist jedoch bis heute unklar. Weitere Studien in diesem Bereich sind erforderlich.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Forschung wurde durch ein Forschungsstipendium für Gesundheits- und Arbeitswissenschaften für die Erforschung seltener und hartnäckiger Krankheiten und eine umfassende Forschung zu Gesundheit und Wohlfahrt von Behinderungen des japanischen Ministeriums für Gesundheit, Arbeit und Soziales (S.U. 20FC1048, 23FC10149) und Zuschüsse der Japan Agency for Medical Research and Development (AMED) (S.U. 19ek0109363h0002, 21ek0109542h003) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
Referenzen
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten