Method Article
Migliore copertura cocleare e preservazione dell'udito nell'ipoacusia ad alta frequenza grazie alla stimolazione elettroacustica con elettrodo più lungo
In questo articolo
Riepilogo
La stimolazione elettroacustica (EAS) con elettrodi più lunghi può offrire una copertura cocleare più ampia e vari tipi di mappe nei casi di perdita dell'udito ad alta frequenza. La combinazione di chirurgia meno invasiva, elettrodi flessibili della parete laterale e somministrazione di steroidi consente un inserimento più profondo con un trauma chirurgico minimo o nullo, con conseguente buona conservazione dell'udito.
Abstract
La stimolazione elettroacustica (EAS) è un trattamento promettente per migliorare la capacità uditiva nei pazienti con ipoacusia ad alta frequenza (HL). Negli interventi chirurgici EAS, sono stati preferiti elettrodi più corti per evitare la presenza di un elettrodo che copre la regione uditiva residua. Tuttavia, i nostri studi precedenti hanno dimostrato che l'EAS con elettrodi più lunghi (28 mm) potrebbe preservare l'udito acustico. Inoltre, abbiamo riportato che i punteggi di conservazione dell'udito (HP) erano indipendenti dalla lunghezza degli elettrodi inseriti, in linea con la revisione sistematica. Poiché la maggior parte dei pazienti con EAS perde gradualmente l'udito residuo nel tempo a causa del decorso naturale dell'HL, in questi casi, fornire una copertura cocleare più ampia utilizzando elettrodi più lunghi è stato vantaggioso per una migliore corrispondenza luogo-tono. Oltre a prepararsi al deterioramento dell'udito in futuro, l'EAS con elettrodi più lunghi potrebbe offrire vari tipi di strategie di mappatura. Qui mostriamo le procedure pre, intra e post per la chirurgia EAS. Un'appropriata valutazione preoperatoria, un intervento chirurgico meno invasivo, elettrodi flessibili sulla parete laterale e la somministrazione di steroidi hanno portato a una buona HP dopo l'EAS con elettrodi più lunghi.
Introduzione
L'impianto cocleare convenzionale (CI) è un trattamento standard per migliorare la capacità uditiva nei pazienti con ipoacusia (HL) da grave a profonda. Successivamente, la stimolazione elettroacustica (EAS) viene utilizzata per trattare pazienti con grave perdita dell'udito ad alta frequenza e udito residuoa bassa frequenza 1. In tali pazienti, preservare l'udito acustico residuo è importante per ottenere una migliore percezione del parlato nel rumore, la localizzazione del suono e una migliore qualità del suono durante l'ascolto della musica2. Per risolvere questo problema, è stato preferito l'uso di elettrodi più corti nei pazienti con EAS per evitare di interferire con la funzione residua nella regione acustica della coclea. Tuttavia, i nostri studi precedenti 3,4,5,6 hanno documentato che anche nei casi di EAS, la chirurgia IC meno invasiva combinata con elettrodi "più lunghi" sottili, dritti e flessibili ha permesso la conservazione dell'udito residuo. Inoltre, abbiamo riportato che la conservazione dell'udito non era correlata alla lunghezza dell'elettrodo7 dell'impianto cocleare inserito, in linea con la revisione sistematica8.
Nei pazienti sottoposti a IC convenzionale, elettrodi più lunghi hanno portato a una migliore percezione del parlato 9,10,11 poiché elettrodi più lunghi forniscono una copertura cocleare più ampia e una migliore corrispondenza luogo-tono. Allo stesso modo, è stata riportata una correlazione tra un angolo di inserzione più profondo (AID) e un udito migliore12,13. Nella maggior parte dei pazienti con EAS, l'udito residuo si deteriora gradualmente nel tempo14. L'identificazione del gene responsabile dell'HL consente di prevedere l'udito futuro. Quando si prevede che in futuro l'udito andrà perso su tutte le frequenze, l'EAS con elettrodi più lunghi, non con elettrodi più corti, è l'ideale per fornire una percentuale più elevata di copertura cocleare15. Si pensava che l'AID ottimale variasse da 630° a 720°16,17,18, corrispondente alla distribuzione dei neuroni gangliari spirali nella coclea umana. Tuttavia, poiché ogni lunghezza del dotto cocleare (CDL) ha un ampio intervallo di variazione19, la misurazione del CDL in ogni caso è stata necessaria per ottenere l'AID appropriato, anche nei pazienti con EAS. Recentemente, il software disponibile in commercio (vedi Tabella dei materiali) ha permesso di misurare facilmente ogni CDL sulla base dei dati della tomografia computerizzata (TC), il che era clinicamente fattibile.
Questo protocollo descrive quanto segue: (1) una valutazione preoperatoria che includeva l'analisi genetica per identificare l'eziologia dell'HL e la misurazione della lunghezza del dotto cocleare per determinare la lunghezza ottimale dell'elettrodo, (2) una procedura chirurgica meno invasiva tramite esoscopia ed endoscopia e (3) l'esito dell'udito postoperatorio e la strategia di mappatura nei pazienti con HL ad alta frequenza sottoposti a EAS con un elettrodo più lungo.
Protocollo
Le procedure descritte sono state approvate dall'Institutional Review Board della Shinshu University School of Medicine (approvazione n. 4133). I pazienti hanno fornito il consenso informato scritto prima di partecipare allo studio. I reagenti, le apparecchiature e il software utilizzati per questo studio sono elencati nella Tabella dei materiali.
1. Valutazione preoperatoria
- Esaminare la serie di audiogrammi a toni puri in pazienti con udito residuo per accertare la progressione dell'HL in ciascun caso.
- Condurre test genetici su campioni di sangue ottenuti sia dai pazienti che dai loro familiari.
- Si consiglia di eseguire il sequenziamento di nuova generazione su un pannello di geni associati a HL 6,7.
- Condurre test di imaging, come la TC e/o la risonanza magnetica (MRI). Si raccomandava che lo spessore della fetta CT fosse di 0,6 mm o inferiore. Per la risonanza magnetica, è stata ritenuta sufficiente una forza di 1,5 Tesla.
- Effettuare previsioni sul futuro udito acustico residuo nella migliore misura possibile dopo la raccolta dell'audiogrammaserie 6 e l'identificazione dell'eziologia attraverso l'imaging e/o l'analisi genetica.
- Importazione dei dati DICOM dalle immagini TC preoperatorie nel software OTOPLAN. Il software misura automaticamente il CDL in ogni caso.
- Selezionare la lunghezza appropriata dell'array CI per coprire la regione in cui si prevede che l'udito residuo si deteriori in futuro. Utilizzare solo elettrodi sottili, dritti e flessibili.
- Somministrare prednisolone per via orale alla dose di 0,5-1,0 mg/kg/die a partire da 2 giorni prima dell'intervento chirurgico.
2. Procedura chirurgica
- Posizionare il paziente in posizione supina.
- Indurre l'anestesia utilizzando fentanil per via endovenosa (1-2 μg/kg), propofol (1-2 mg/kg) e rocuronio (0,6 mg/kg). Mantenere l'anestesia con propofol (3-8 mg/kg/h), remifentanil (0,1-0,2 μg/kg/min) e fentanil (totale: 300-500 μg), senza vecuronio, per facilitare il monitoraggio neuromuscolare.
- Somministrare un'infusione endovenosa di 8 mg di desametasone 30 minuti prima di praticare l'incisione.
- Ruotare la testa del paziente di 45 gradi durante l'intervento chirurgico.
- Iniettare l'anestesia locale (lidocaina sottocutanea allo 0,5% con 1:1,00,000 di epinefrina) postauricolare.
- Eseguire un'incisione postauricolare di 5-6 cm (a forma di S pigra) e mastoidectomia con barre di taglio da 6,0-4,0 mm fino a raggiungere il punto in cui l'antro include il canale semicircolare laterale e il breve processo dell'incudine6.
- Eseguire una timpanotomia posteriore tra il nervo facciale previsto e la corda del timpano utilizzando barre diamantate da 1,5-2,0 mm.
- Visualizza la nicchia della finestra rotonda e rimuovi la sporgenza ossea della finestra rotonda utilizzando un trapano a bassa velocità con una barra diamantata da 1,0-1,5 mm, esponendo la membrana della finestra rotonda.
- Aprire a sufficienza la membrana rotonda della finestra utilizzando un plettro e inserire con cautela l'elettrodo lentamente per oltre 3 minuti.
- Eseguire radiografie e audiogrammi dopo aver completato l'inserimento dell'elettrodo.
3. Valutazione postoperatoria
- Somministrare desametasone per via endovenosa a 8 mg/die, 4 mg/die e 4 mg/die per 3 giorni dopo l'intervento chirurgico.
- Misurare le soglie uditive senza aiuto 6 mesi dopo l'attivazione iniziale e valutare il tasso di HP utilizzando la classificazione fornita da Skarzynski et al.20.
- Ottimizza le impostazioni della mappa utilizzando uno strumento software basato sui risultati dell'audiogramma postoperatorio e sulle preferenze del paziente.
Risultati
L'EAS è stata condotta su 10 pazienti (11 orecchie) che soddisfacevano i criteri audiologici per l'EAS (fare riferimento alla Tabella 1). I criteri di inclusione comprendevano i seguenti: livelli uditivi bilaterali di tono puro ≤65 dBHL per 125 Hz, 250 Hz e 500 Hz; ≥80 dBHL a 2000 Hz; e ≥85 dBHL a 4000 Hz e 8000 Hz. Inoltre, era richiesto un beneficio minimo dagli apparecchi acustici convenzionali, definiti come punteggi di monosillabi in quiete inferiori al 60% anche nella condizione ottimale di assistenza. Tutti i partecipanti sono stati sottoposti a EAS utilizzando elettrodi più lunghi (vedi Tabella dei materiali). La Figura 1 mostra gli audiogrammi preoperatori e postoperatori a 6 mesi dopo l'intervento chirurgico di EAS, suggerendo che l'udito residuo a bassa frequenza era ben conservato in tutti i casi. Secondo il sistema di classificazione per la conservazione dell'udito (HP) riportato da Skarzynski et al.20, il 36,4% (4 casi su 11) ha mostrato HP completo e il 63,6% (7 casi su 11) ha mostrato HP parziale. Non ci sono stati casi di deterioramento significativo dell'udito.
Presentazione del caso (Caso #8)
All'età di 5 anni, durante un controllo di routine del benessere della scuola elementare, una ragazza di 14 anni che non si era sottoposta a screening dell'udito neonatale è stata segnalata per sospetta perdita dell'udito (HL). Successivamente le è stata diagnosticata l'HL ad alta frequenza, ha iniziato a usare apparecchi acustici. Dato il deterioramento osservato nel suo udito, ha chiesto una valutazione al nostro dipartimento all'età di 13 anni.
Le varianti patogene del gene CDH23 sono state identificate tramite test genetici6. Poiché era probabile che l'udito residuo si deteriorasse a causa dell'HL correlato a CDH23, è stato scelto un elettrodo più lungo per coprire la regione acustica. Ha subito un intervento chirurgico all'orecchio sinistro all'età di 14 anni. L'udito residuo è stato completamente conservato 6 mesi dopo l'intervento chirurgico. Ha preferito la "mappatura della sola stimolazione elettrica (ES)" con elettrodi apicali attivati che attraversano la regione dell'udito residuo in quel momento (Figura 2). Il paziente è risultato soddisfatto dell'amplificazione acustica ottenuta utilizzando l'ES alle basse frequenze.
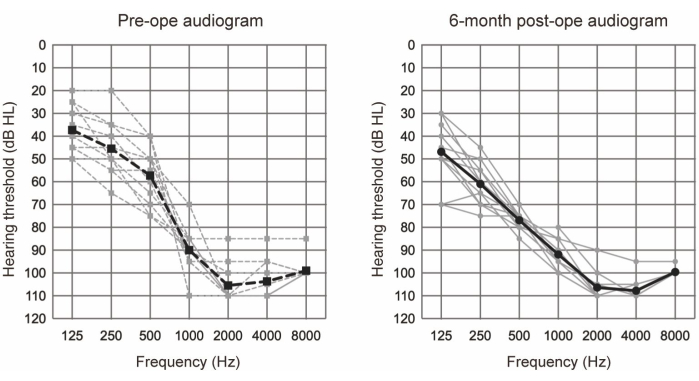
Figura 1: Soglie uditive medie a conduzione aerea. Le linee tratteggiate e continue indicano rispettivamente le misurazioni preoperatorie e postoperatorie a 6 mesi. Le linee grigie e nere mostrano rispettivamente i singoli dati e la media. Questa figura è stata adattata da Yoshimura et al.6. Clicca qui per visualizzare una versione più grande di questa figura.
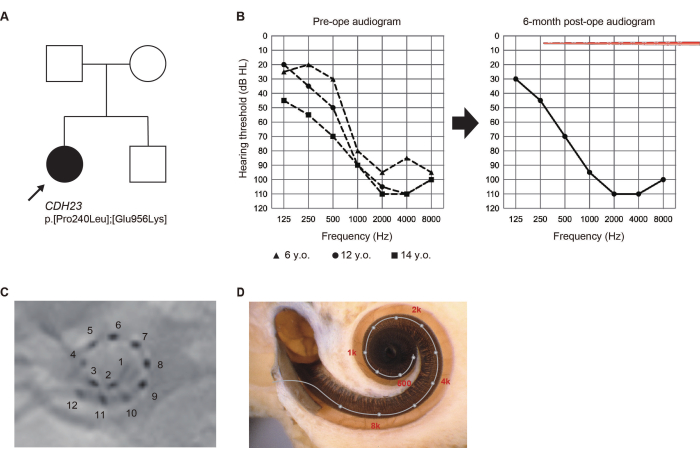
Figura 2: Risultati clinici del Caso #8. (A) Pedigree del paziente. (B) Audiogrammi preoperatori e postoperatori a 6 mesi. Le illustrazioni dell'array di elettrodi rappresentano la profondità di inserimento. (C) Risultati radiografici postoperatori, con numeri corrispondenti ai singoli canali. (D) Imaging per ogni posizione dell'elettrodo e la mappa tonotopica di riferimento. Questa figura è stata adattata da Yoshimura et al.6. Clicca qui per visualizzare una versione più grande di questa figura.
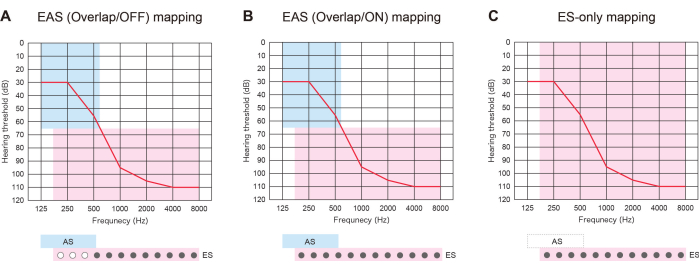
Figura 3: Tre tipi di strategia di mappatura nei pazienti con EAS che utilizzano elettrodi più lunghi. (A) Mappa EAS (Overlap/OFF). Alcuni dei contatti apicali sono stati disattivati, mentre è stata attivata la stimolazione acustica (AS). (B) Mappa EAS (Overlap/ON). Sono state utilizzate sia la stimolazione elettrica (ES) nell'impostazione predefinita dell'impianto cocleare (CI) che l'AS. (C) Mappa solo ES. Nell'impostazione ES, la gamma di frequenza è stata impostata da 70 a 8.500 Hz. AS è stato disattivato. Clicca qui per visualizzare una versione più grande di questa figura.
| Paziente | Impiantato | Impiantato | Responsabile | Pre-operatorio | 6M post-operatorio | HP numerico | CV | |
| No. | Genere | età (anni) | lato | Gene | LFA (dB) | LFA (dB) | scala (%) | classificazione |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | Parziale |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | Parziale |
| 3 | M | 50 | L | CDH23 | 50 | 56.7 | 78.6 | Completo |
| 4 | F | 31 | L | Sconosciuto | 45 | 61.7 | 67.7 | Parziale |
| 31 | R | 46.7 | 56.7 | 75.9 | Completo | |||
| 5 | F | 57 | R | Sconosciuto | 38.3 | 65 | 59 | Parziale |
| 6 | F | 55 | R | Sconosciuto | 26.7 | 55 | 68.4 | Parziale |
| 7 | M | 21 | R | LOXHD1 | 33.3 | 66.7 | 37.2 | Parziale |
| 8 | F | 14 | R | CDH23 | 56.7 | 48.3 | 100 | Completo |
| 9 | M | 20 | L | Sconosciuto | 51.7 | 73.3 | 48.1 | Parziale |
| 10 | M | 64 | R | Sconosciuto | 51.7 | 58.3 | 82.1 | Completo |
Tabella 1: Riepilogo delle caratteristiche del soggetto e dei risultati della conservazione dell'udito. Questa tabella è stata adattata da Yoshimura et al.6.
Discussione
Identificare l'eziologia dell'HL nella valutazione preoperatoria è fondamentale per prevedere il futuro audiogramma in ogni caso. Nel nostro studio precedente, varianti patogene nei geni CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 e TMPRSS3 sono state frequentemente identificate in pazienti con HL7 ad alta frequenza. Nella maggior parte di questi pazienti, l'udito residuo si è gradualmente deteriorato (vedere il caso di HL correlato a CDH23 nella Figura 2). In questi casi, il decorso naturale dell'HL è stato preso in considerazione nella scelta dell'elettrodo CI per una copertura cocleare più ampia.
La determinazione della lunghezza dell'array CI richiedeva la misurazione della lunghezza del dotto cocleare (CDL). Per facilitare questo processo, il software OTOPLAN si è dimostrato clinicamente fattibile21. Nelle versioni precedenti, come OTOPLAN 3.0, il CDL veniva misurato manualmente per tracciare il diametro, la larghezza e l'altezza di ciascuna coclea. Tuttavia, con OTOPLAN 4.0, la misurazione automatica del CDL è diventata possibile, offrendo una maggiore comodità per i chirurghi e riducendo al minimo la variazione della misurazione. In particolare, le immagini TC con uno spessore della fetta di 0,6 mm o inferiore erano adatte per l'analisi automatica fornita da OTOPLAN. Successivamente, la lunghezza dell'array CI deve essere selezionata per ottenere l'angolo di profondità di inserimento (AID) ottimale in ogni caso.
Per eseguire un intervento chirurgico EAS meno invasivo, è stata necessaria la somministrazione pre, intra e post-steroidea per ridurre al minimo l'infiammazione acuta che potrebbe elevare la soglia uditiva22. Nel prossimo futuro, per ridurre al minimo le reazioni non solo acute ma anche croniche a seguito di interventi chirurgici di CI ed EAS, sarà auspicabile l'uso di elettrodi a rilascio di desametasone. Oltre alla somministrazione di steroidi, gli elettrodi flessibili della parete laterale erano essenziali per ridurre al minimo il trauma alla coclea. L'inserimento di tali elettrodi nella coclea con attenzione e lentamente utilizzando l'approccio a finestra rotonda ha portato a un'invasività minima. Per aiutare in questo, l'esecuzione di interventi chirurgici con esoscopi ed endoscopi è stata utile per generare un campo visivo più chiaro e confermare i minuscoli componenti dell'orecchio medio. Per evitare l'induzione di un'estesa formazione di tessuto fibro-osseo nella coclea, è necessario evitare l'approccio esteso della finestra rotonda e la cocleostomia23.
L'EAS con elettrodi più lunghi è stato utile non solo per prepararsi al futuro deterioramento dell'HL, ma anche per offrire tre tipi di strategie di mappatura. Se gli elettrodi inseriti si sovrappongono alla regione uditiva residua, i pazienti con EAS possono utilizzare ES con o senza AS: "Mappa EAS (Overlap/ON)" o "Mappa solo ES". In alternativa, possono disattivare alcuni dei contatti apicali e attivare l'AS: "Mappa EAS (Overlap/OFF)". Se l'udito si deteriora, tutti i contatti possono essere riattivati in un secondo momento per fornire una migliore corrispondenza dell'intonazione (Figura 3). Tutti questi risultati mostrano che l'EAS con elettrodi più lunghi consente agli utenti di ottimizzare le mappe per un udito più naturale.
In questo caso, viene dimostrato che la preparazione preoperatoria e le tecniche chirurgiche avanzate sono essenziali per ridurre al minimo il trauma chirurgico. L'esecuzione della serie di procedure pre e intraoperatorie sopra menzionate ha permesso ai pazienti di beneficiare dell'EAS con elettrodi più lunghi.
Limitazioni
Nonostante i progressi nelle suddette procedure chirurgiche meno invasive, l'udito residuo si deteriora ancora in un certo numero di pazienti dopo IC. Il monitoraggio intraoperatorio, come la microfonica cocleare (CM), sarebbe clinicamente fattibile per misurare il danno cocleare durante l'inserimento dell'elettrodo24. Tuttavia, ad oggi non è chiaro come valutare l'EAS con elettrodi più lunghi e cosa fare nel caso di determinate risposte CM, come una diminuzione dell'ampiezza. Sono necessari ulteriori studi in questo settore.
Divulgazioni
Gli autori dichiarano di non avere conflitti di interesse.
Riconoscimenti
Questa ricerca è stata finanziata da una borsa di ricerca per la salute e le scienze del lavoro per la ricerca sulle malattie rare e intrattabili e la ricerca completa sulla salute e il benessere della disabilità dal Ministero della Salute, del Lavoro e del Welfare del Giappone (S.U. 20FC1048, 23FC10149) e da sovvenzioni dell'Agenzia giapponese per la ricerca e lo sviluppo medico (AMED) (S.U. 19ek0109363h0002, 21ek0109542h003).
Materiali
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
Riferimenti
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon