Method Article
Amélioration de la couverture cochléaire et de la préservation de l’audition dans les hautes fréquences grâce à la stimulation électroacoustique avec une électrode plus longue
Dans cet article
Résumé
La stimulation électro-acoustique (EAS) avec des électrodes plus longues peut offrir une couverture cochléaire plus large et divers types de cartes en cas de perte auditive à haute fréquence. La combinaison d’une chirurgie moins invasive, d’électrodes flexibles de la paroi latérale et de l’administration de stéroïdes permet une insertion plus profonde avec peu ou pas de traumatisme chirurgical, ce qui permet une bonne préservation de l’audition.
Résumé
La stimulation électro-acoustique (EAS) est un traitement prometteur pour améliorer la capacité auditive chez les patients atteints de perte auditive à haute fréquence (LH). Dans les chirurgies EAS, des électrodes plus courtes ont été préférées pour éviter la présence d’une électrode couvrant la région auditive résiduelle. Cependant, nos études antérieures ont montré que l’EAS avec des électrodes plus longues (28 mm) pouvait préserver l’audition acoustique. De plus, nous avons rapporté que les scores de préservation de l’audition (HP) étaient indépendants de la longueur des électrodes insérées, conformément à la revue systématique. Comme la plupart des patients atteints d’EAS perdent progressivement leur audition résiduelle au fil du temps en raison de l’évolution naturelle du LH, dans ces cas, la fourniture d’une couverture cochléaire plus large à l’aide d’électrodes plus longues a été bénéfique pour une meilleure correspondance place-pas. En plus de se préparer à la détérioration de l’audition à l’avenir, les EAS avec des électrodes plus longues pourraient offrir divers types de stratégies de cartographie. Ici, nous montrons les pré-, intra et post-procédures pour la chirurgie EAS. Une évaluation préopératoire appropriée, une chirurgie moins invasive, des électrodes flexibles de la paroi latérale et l’administration de stéroïdes ont permis d’obtenir une bonne HP après EAS avec des électrodes plus longues.
Introduction
L’implantation cochléaire conventionnelle (IC) est un traitement standard pour améliorer la capacité auditive chez les patients atteints de perte auditive (LH) sévère à profonde. Par la suite, la stimulation électro-acoustique (EAS) est utilisée pour traiter les patients atteints de perte auditive sévère dans les hautes fréquences et d’audition résiduelle dans les basses fréquences1. Chez ces patients, la préservation de l’audition acoustique résiduelle est importante pour obtenir une meilleure perception de la parole dans le bruit, une localisation du son et une meilleure qualité sonore lors de l’écoute de la musique2. Pour résoudre ce problème, l’utilisation d’électrodes plus courtes chez les patients atteints d’EAS a été préférée pour éviter d’interférer avec la fonction résiduelle dans la région acoustique de la cochlée. Cependant, nos études antérieures 3,4,5,6 ont documenté que même dans les cas d’EAS, la chirurgie IC moins invasive combinée à des électrodes « plus longues » minces, droites et flexibles permettait de préserver l’audition résiduelle. De plus, nous avons rapporté que la préservation de l’audition n’était pas liée à la longueur de l’électrode7 de l’implant cochléaire insérée, conformément à la revue systématique8.
Chez les patients ayant subi une IC conventionnelle, des électrodes plus longues ont permis une meilleure perception de la parole 9,10,11, car des électrodes plus longues offrent une couverture cochléaire plus large et une meilleure correspondance place-pas. De même, une corrélation entre un angle d’insertion plus profond (AID) et une meilleure audition a été rapportée12,13. Chez la plupart des patients atteints d’EAS, l’audition résiduelle se détériore progressivement au fil du temps14. L’identification du gène responsable du LH permet de prédire l’audition future. Lorsqu’il est prévu que leur audition sera perdue sur toutes les fréquences à l’avenir, l’EAS avec des électrodes plus longues, et non des électrodes plus courtes, est idéal pour fournir un pourcentage plus élevé de couverture cochléaire15. On pensait que l’AID optimale se situait entre 630° et 720°16,17,18, ce qui correspond à la distribution des neurones du ganglion spiral dans la cochlée humaine. Cependant, comme chaque longueur de canal cochléaire (CDL) présente une large gamme de variations19, la mesure du CDL dans chaque cas était nécessaire pour obtenir le AID approprié, même chez les patients atteints d’EAS. Récemment, des logiciels disponibles dans le commerce (voir la table des matériaux) ont permis de mesurer facilement chaque CDL sur la base de données de tomodensitométrie (TDM), ce qui était cliniquement faisable.
Ce protocole décrit ce qui suit : (1) une évaluation préopératoire comprenant une analyse génétique pour identifier l’étiologie du LH et la mesure de la longueur du canal cochléaire afin de déterminer la longueur optimale de l’électrode, (2) une intervention chirurgicale moins invasive par exoscopie et endoscopie, et (3) le résultat auditif postopératoire et la stratégie de cartographie chez les patients atteints de LH à haute fréquence qui ont subi un EAS avec une électrode plus longue.
Protocole
Les procédures décrites ont été approuvées par le Conseil d’examen institutionnel de la faculté de médecine de l’Université de Shinshu (approbation n° 4133). Les patients ont fourni un consentement éclairé écrit avant de participer à l’étude. Les réactifs, l’équipement et les logiciels utilisés pour cette étude sont répertoriés dans la table des matériaux.
1. Évaluation préopératoire
- Examiner la série d’audiogrammes à tons purs chez les patients ayant une audition résiduelle afin de déterminer la progression du LH dans chaque cas.
- Effectuer des tests génétiques sur des échantillons de sang prélevés sur les patients et les membres de leur famille.
- Il est recommandé d’effectuer un séquençage de nouvelle génération sur un panel de gènes associés au HL 6,7.
- Effectuer des tests d’imagerie, tels que la tomodensitométrie et/ou l’imagerie par résonance magnétique (IRM). Il a été recommandé que l’épaisseur de la tranche TC soit de 0,6 mm ou moins. Pour l’IRM, une force de 1,5 Tesla a été jugée suffisante.
- Faire des prédictions concernant l’audition acoustique résiduelle future dans la meilleure mesure possible après la collecte de l’audiogramme de la série6 et l’identification de l’étiologie par imagerie et/ou analyse génétique.
- Importez les données DICOM des images CT préopératoires dans le logiciel OTOPLAN. Dans chaque cas, le logiciel mesure automatiquement le CDL.
- Sélectionnez la longueur appropriée de la matrice d’IC pour couvrir la région où l’audition résiduelle devrait se détériorer à l’avenir. N’utilisez que des électrodes minces, droites et flexibles.
- Administrer la prednisolone par voie orale à une dose de 0,5 à 1,0 mg/kg/jour en commençant 2 jours avant la chirurgie.
2. Intervention chirurgicale
- Placez le patient en position couchée.
- Induire une anesthésie à l’aide de fentanyl (1-2 μg/kg), de propofol (1-2 mg/kg) et de rocuronium (0,6 mg/kg) par voie intraveineuse. Maintenir l’anesthésie avec du propofol (3-8 mg/kg/h), du rémifentanil (0,1-0,2 μg/kg/min) et du fentanyl (total : 300-500 μg), sans vecuronium, pour faciliter la surveillance neuromusculaire.
- Administrer une perfusion intraveineuse de 8 mg de dexaméthasone 30 minutes avant de faire l’incision.
- Faites pivoter la tête du patient à 45 degrés pendant l’opération.
- Injecter une anesthésie locale (lidocaïne sous-cutanée à 0,5 % avec de l’épinéphrine 1:1,00,000) post-auriculaire.
- Effectuez une incision postauriculaire de 5-6 cm (en forme de S paresseux) et une mastoïdectomie avec des barres de coupe de 6,0-4,0 mm jusqu’à ce que vous atteigniez le point où l’antre comprend le canal semi-circulaire latéral et le processus court de l’incus6.
- Effectuez une tympanotomie postérieure entre le nerf facial attendu et la corde tympanique à l’aide de barres de diamant de 1,5 à 2,0 mm.
- Visualisez la niche de la fenêtre ronde et retirez le surplomb osseux de la fenêtre ronde à l’aide d’une perceuse à basse vitesse avec une barre diamantée de 1,0 à 1,5 mm, exposant la membrane de la fenêtre ronde.
- Ouvrez suffisamment la membrane de la fenêtre ronde à l’aide d’un pic et insérez soigneusement l’électrode lentement pendant plus de 3 min.
- Effectuez des radiographies et des audiogrammes après avoir terminé l’insertion de l’électrode.
3. Évaluation postopératoire
- Administrer de la dexaméthasone par voie intraveineuse à raison de 8 mg/jour, 4 mg/jour et 4 mg/jour pendant 3 jours après la chirurgie.
- Mesurer les seuils auditifs non assistés 6 mois après l’activation initiale, et évaluer le taux de HP à l’aide de la classification fournie par Skarzynski et al.20.
- Optimisez les paramètres de la carte à l’aide d’un outil logiciel basé sur les résultats de l’audiogramme postopératoire et les préférences du patient.
Résultats
L’EAS a été réalisée sur 10 patients (11 oreilles) qui remplissaient les critères audiologiques de l’EAS (voir le tableau 1). Les critères d’inclusion comprenaient les éléments suivants : des niveaux d’audition bilatéraux de tons purs ≤65 dBHL pour 125 Hz, 250 Hz et 500 Hz ; ≥80 dBHL à 2000 Hz ; et ≥85 dBHL à 4000 Hz et 8000 Hz. De plus, un bénéfice minimal des appareils auditifs conventionnels était requis, défini comme des scores monosyllabiques dans un silence inférieur à 60%, même dans la condition assistée optimale. Tous les participants ont subi une EAS en utilisant des électrodes plus longues (voir le tableau des matériaux). La figure 1 montre les audiogrammes préopératoires et les audiogrammes postopératoires de 6 mois après une chirurgie EAS, ce qui suggère que l’audition résiduelle des basses fréquences était bien préservée dans tous les cas. Selon le système de classification de la préservation de l’audition (HP) rapporté par Skarzynski et al.20, 36,4 % (4 cas sur 11) présentaient une HP complète, et 63,6 % (7 cas sur 11) présentaient une HP partielle. Il n’y a eu aucun cas de détérioration significative de l’audition.
Présentation de cas (Cas #8)
À l’âge de 5 ans, lors d’un examen de santé de routine à l’école primaire, une jeune fille de 14 ans qui n’avait pas subi de dépistage auditif néonatal a été signalée comme soupçonnée d’une perte auditive (LH). Ayant par la suite reçu un diagnostic de LH à haute fréquence, elle a commencé à utiliser des appareils auditifs. Compte tenu de la détérioration observée de son audition, elle a demandé une évaluation à notre service à l’âge de 13 ans.
Des variants pathogènes du gène CDH23 ont été identifiés par des tests génétiques6. Étant donné que l’audition résiduelle était susceptible de se détériorer en raison du LH lié à CDH23, une électrode plus longue a été choisie pour couvrir la région acoustique. Elle a subi une opération de l’EAS à l’oreille gauche à l’âge de 14 ans. L’audition résiduelle a été complètement préservée 6 mois après l’intervention. Elle préférait une « cartographie par stimulation électrique (ES) uniquement » avec des électrodes apicales activées traversant la région de l’audition résiduelle à ce moment-là (Figure 2). Le patient a été satisfait de l’amplification acoustique obtenue à l’aide de l’ES à basse fréquence.
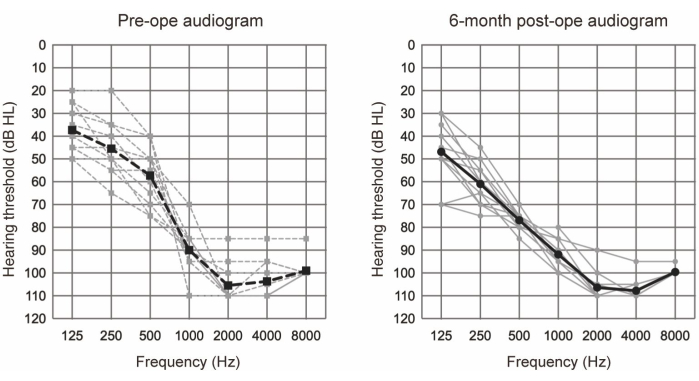
Figure 1 : Seuils moyens d’audition par conduction aérienne. Les lignes pointillées et continues indiquent respectivement les mesures préopératoires et les mesures postopératoires à 6 mois. Les lignes grises et noires indiquent respectivement les données individuelles et la moyenne. Cette figure a été adaptée de Yoshimura et al.6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
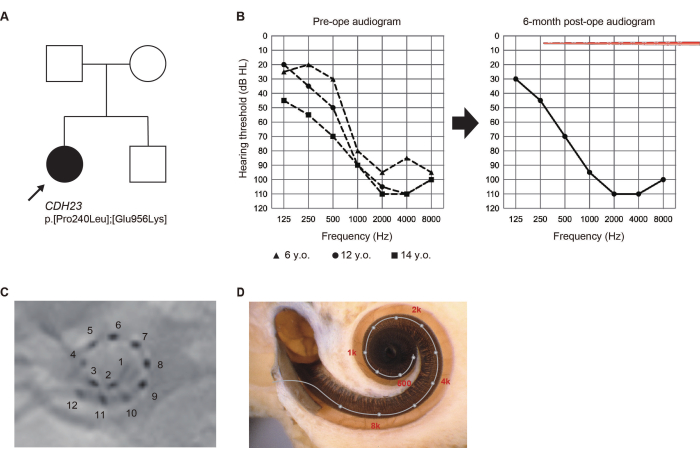
Figure 2 : Signes cliniques du cas #8. (A) Généalogie du patient. (B) Audiogrammes préopératoires et postopératoires à 6 mois. Les illustrations du réseau d’électrodes représentent la profondeur d’insertion. (C) Résultats radiologiques postopératoires, avec des numéros correspondant à des canaux individuels. (D) Imagerie pour chaque emplacement d’électrode et la carte tonotopique de référence. Cette figure a été adaptée de Yoshimura et al.6. Veuillez cliquer ici pour voir une version agrandie de cette figure.
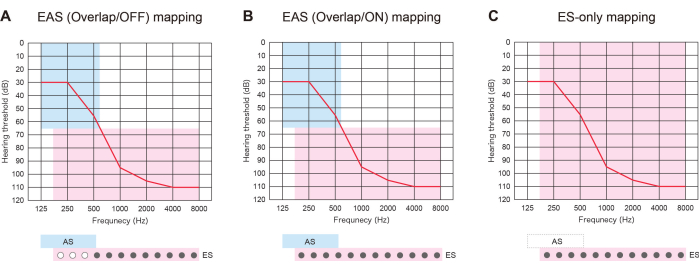
Figure 3 : Trois types de stratégies de cartographie chez les patients atteints d’EAS utilisant des électrodes plus longues. (A) Carte EAS (Overlap/OFF). Certains contacts apicaux ont été désactivés, tandis que la stimulation acoustique (SA) a été activée. (B) Carte EAS (Overlap/ON). La stimulation électrique (ES) dans le réglage par défaut de l’implantation cochléaire (IC) et l’AS ont été utilisées. (C) Carte ES-only. Dans le réglage ES, la gamme de fréquences a été réglée de 70 à 8 500 Hz. AS a été désactivé. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Patient | Implanté | Implanté | Responsable | Pré-opératoire | 6M post-opératoire | Numérique HP | CV | |
| Non. | Genre | Âge (années) | côté | Gène | Zone de pêche du homard (dB) | Zone de pêche du homard (dB) | Échelle (%) | classification |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | Partiel |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | Partiel |
| 3 | M | 50 | L | CDH23 | 50 | 56.7 | 78.6 | Complet |
| 4 | F | 31 | L | Inconnu | 45 | 61.7 | 67.7 | Partiel |
| 31 | R | 46.7 | 56.7 | 75.9 | Complet | |||
| 5 | F | 57 | R | Inconnu | 38.3 | 65 | 59 | Partiel |
| 6 | F | 55 | R | Inconnu | 26.7 | 55 | 68.4 | Partiel |
| 7 | M | 21 | R | LOXHD1 | 33.3 | 66.7 | 37.2 | Partiel |
| 8 | F | 14 | R | CDH23 | 56.7 | 48.3 | 100 | Complet |
| 9 | M | 20 | L | Inconnu | 51.7 | 73.3 | 48.1 | Partiel |
| 10 | M | 64 | R | Inconnu | 51.7 | 58.3 | 82.1 | Complet |
Tableau 1 : Résumé des caractéristiques du sujet et des résultats de préservation de l’audition. Ce tableau a été adapté de Yoshimura et al.6.
Discussion
L’identification de l’étiologie du LH dans l’évaluation préopératoire est cruciale pour prédire le futur audiogramme dans chaque cas. Dans notre étude antérieure, des variants pathogènes des gènes CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 et TMPRSS3 ont été fréquemment identifiés chez les patients atteints de HL7 à haute fréquence. Chez la plupart de ces patients, l’audition résiduelle s’est progressivement détériorée (voir cas de LH lié à CDH23 sur la figure 2). Dans ces cas, l’évolution naturelle du LH a été prise en compte lors du choix de l’électrode IC pour une couverture cochléaire plus large.
Pour déterminer la longueur de la matrice d’IC, il a fallu mesurer la longueur du canal cochléaire (CDL). Pour faciliter ce processus, le logiciel OTOPLAN s’est avéré cliniquement réalisable21. Dans les versions antérieures, telles que OTOPLAN 3.0, le CDL était mesuré manuellement pour tracer le diamètre, la largeur et la hauteur de chaque cochlée. Cependant, avec OTOPLAN 4.0, la mesure automatique du CDL est devenue possible, offrant un confort accru aux chirurgiens et minimisant les variations de mesure. Notamment, les images CT d’une épaisseur de coupe de 0,6 mm ou moins étaient adaptées à l’analyse automatique fournie par OTOPLAN. Par la suite, la longueur de la matrice d’IC doit être sélectionnée pour obtenir l’angle de profondeur d’insertion (AID) optimal dans chaque cas.
Pour effectuer une chirurgie EAS moins invasive, l’administration pré-, intra et post-stéroïde a été nécessaire pour minimiser l’inflammation aiguë qui pourrait élever le seuil auditif22. Dans un avenir proche, afin de minimiser les réactions non seulement aiguës mais aussi chroniques après une chirurgie IC et EAS, l’utilisation d’électrodes à élution de dexaméthasone sera souhaitable. En plus de l’administration de stéroïdes, des électrodes flexibles de la paroi latérale étaient essentielles pour minimiser le traumatisme de la cochlée. L’insertion de ces électrodes dans la cochlée avec précaution et lentement en utilisant l’approche de la fenêtre ronde a entraîné un caractère invasif minimal. Pour y parvenir, la chirurgie à l’aide d’exoscopes et d’endoscopes s’est avérée utile pour générer un champ de vision plus clair et confirmer les minuscules composants de l’oreille moyenne. Pour éviter d’induire une formation importante de tissu fibro-osseux dans la cochlée, l’approche de la fenêtre ronde allongée et la cochléostomie doivent être évitées23.
L’EAS avec des électrodes plus longues s’est avérée utile non seulement pour se préparer à la détérioration future du LH, mais aussi pour proposer trois types de stratégies cartographiques. Si les électrodes insérées chevauchent la région auditive résiduelle, les patients atteints d’EAS peuvent utiliser l’ES avec ou sans AS : « EAS (Overlap/ON) map » ou « ES-only map ». Alternativement, ils peuvent désactiver certains des contacts apicaux et activer la carte AS : « EAS (Overlap/OFF) ». Si l’audition se détériore, tous les contacts peuvent être activés ultérieurement pour fournir une meilleure adaptation de la hauteur (Figure 3). Tous ces résultats montrent que l’EAS avec des électrodes plus longues permet aux utilisateurs d’optimiser les cartes pour une audition plus naturelle.
Ici, il est démontré que la préparation préopératoire et les techniques chirurgicales avancées sont essentielles pour minimiser les traumatismes chirurgicaux. La réalisation de la série susmentionnée de procédures préopératoires et peropératoires a permis aux patients de bénéficier de l’EAS avec des électrodes plus longues.
Limitations
Malgré les progrès réalisés dans les procédures chirurgicales moins invasives susmentionnées, l’audition résiduelle se détériore encore chez un certain nombre de patients après IC. La surveillance peropératoire, telle que la microphonie cochléaire (CM), serait cliniquement réalisable pour mesurer les lésions cochléaires lors de l’insertion de l’électrode24. Cependant, la manière d’évaluer l’EAS avec des électrodes plus longues et ce qu’il faut faire dans le cas de certaines réponses CM, telles qu’une diminution de l’amplitude, reste incertaine à ce jour. D’autres études dans ce domaine sont nécessaires.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Cette recherche a été financée par une subvention de recherche en sciences de la santé et du travail pour la recherche sur les maladies rares et incurables et la recherche approfondie sur la santé et le bien-être des personnes handicapées du ministère de la Santé, du Travail et du Bien-être du Japon (S.U. 20FC1048, 23FC10149) et des subventions de l’Agence japonaise pour la recherche et le développement médicaux (AMED) (S.U. 19ek0109363h0002, 21ek0109542h003).
matériels
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
Références
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon