Method Article
Cobertura coclear mejorada y preservación de la audición en la pérdida auditiva de alta frecuencia mediante estimulación electroacústica con electrodo más largo
En este artículo
Resumen
La estimulación electroacústica (EAS) con electrodos más largos puede ofrecer una cobertura coclear más amplia y varios tipos de mapas en casos de pérdida auditiva de alta frecuencia. La combinación de cirugía menos invasiva, electrodos flexibles de pared lateral y administración de esteroides permite una inserción más profunda con poco o ningún trauma quirúrgico, lo que resulta en una buena preservación de la audición.
Resumen
La estimulación electroacústica (EAS) es un tratamiento prometedor para mejorar la capacidad auditiva en pacientes con pérdida auditiva de alta frecuencia (LH). En las cirugías de EAS, se han preferido electrodos más cortos para evitar la presencia de un electrodo que cubra la región auditiva residual. Sin embargo, nuestros estudios anteriores demostraron que los EAS con electrodos más largos (28 mm) podían preservar la audición acústica. Además, informamos que las puntuaciones de preservación de la audición (HP) fueron independientes de la longitud de los electrodos insertados, lo que concuerda con la revisión sistemática. Dado que la mayoría de los pacientes con EAS pierden gradualmente la audición residual con el tiempo debido al curso natural del LH, en estos casos, proporcionar una cobertura coclear más amplia utilizando electrodos más largos fue beneficioso para una mejor adaptación del tono de posición. Además de prepararse para el deterioro de la audición en el futuro, los EAS con electrodos más largos podrían ofrecer varios tipos de estrategias de mapeo. En este artículo, mostramos los procedimientos previos, intra y posteriores para la cirugía EAS. La evaluación preoperatoria adecuada, la cirugía menos invasiva, los electrodos flexibles de la pared lateral y la administración de esteroides dieron como resultado una buena HP después de la EAS con electrodos más largos.
Introducción
El implante coclear (IC) convencional es un tratamiento estándar para mejorar la capacidad auditiva en pacientes con pérdida auditiva (HL) de severa a profunda. Posteriormente, la estimulación electroacústica (EAS) se utiliza para tratar a pacientes con pérdida auditiva severa de alta frecuencia y audición residual de baja frecuencia1. En estos pacientes, la preservación de la audición acústica residual es importante para lograr una mejor percepción del habla en el ruido, la localización del sonido y una mejor calidad del sonido al escuchar música2. Para abordar esto, se ha preferido el uso de electrodos más cortos en pacientes con EAS para evitar interferir con la función residual en la región acústica de la cóclea. Sin embargo, nuestros estudios anteriores 3,4,5,6 documentaron que incluso en los casos de EAS, la cirugía de IC menos invasiva combinada con electrodos "más largos" delgados, rectos y flexibles permitieron la preservación de la audición residual. Además, informamos que la preservación de la audición no se relacionó con la longitud del electrodo de implante coclearinsertado 7, lo que concuerda con la revisión sistemática8.
En los pacientes que se sometieron a IC convencional, los electrodos más largos condujeron a una mejor percepción del habla 9,10,11, ya que los electrodos más largos proporcionan una cobertura coclear más amplia y una mejor adaptación del lugar y el paso. Del mismo modo, se reportó una correlación entre un ángulo de inserción (AID) más profundo y una mejor audición12,13. En la mayoría de los pacientes con EAS, la audición residual se deteriora gradualmente con el tiempo14. La identificación del gen responsable del linfoma de Hodgkin permite predecir la audición futura. Cuando se prevé que su audición se perderá en todas las frecuencias en el futuro, el EAS con electrodos más largos, no electrodos más cortos, es ideal para proporcionar un mayor porcentaje de cobertura coclear15. Se pensó que el AID óptimo oscilaba entre 630° y 720°16,17,18, correspondiente a la distribución de las neuronas ganglionares espirales en la cóclea humana. Sin embargo, dado que cada longitud del conducto coclear (CDL) tiene un amplio rango de variación19, fue necesario medir la CDL en cada caso para lograr la IAD adecuada, incluso en pacientes con EAS. Recientemente, el software disponible comercialmente (ver Tabla de Materiales) permitió la medición de cada CDL fácilmente basada en datos de tomografía computarizada (TC), lo cual fue clínicamente factible.
Este protocolo describe lo siguiente: (1) una evaluación preoperatoria que incluyó análisis genético para identificar la etiología del linfoma de Hodgkin y la medición de la longitud del conducto coclear para determinar la longitud óptima del electrodo, (2) un procedimiento quirúrgico menos invasivo mediante exoscopia y endoscopia, y (3) el resultado auditivo postoperatorio y la estrategia de mapeo en pacientes con LH de alta frecuencia que se sometieron a EAS con un electrodo más largo.
Protocolo
Los procedimientos descritos fueron aprobados por la Junta de Revisión Institucional de la Facultad de Medicina de la Universidad de Shinshu (Aprobación n.º 4133). Los pacientes dieron su consentimiento informado por escrito antes de participar en el estudio. Los reactivos, el equipo y el software utilizados para este estudio se enumeran en la Tabla de Materiales.
1. Evaluación preoperatoria
- Revisar la serie de audiogramas de tonos puros en pacientes con audición residual para determinar la progresión del linfoma de Hodgkin en cada caso.
- Realizar pruebas genéticas en muestras de sangre obtenidas tanto de los pacientes como de sus familiares.
- Se recomienda realizar la secuenciación de nueva generación en un panel de genes asociados con HL 6,7.
- Realizar pruebas de diagnóstico por imágenes, como tomografía computarizada y/o resonancia magnética nuclear (RMN). Se recomendó que el grosor del corte de la TC fuera de 0,6 mm o menos. Para la resonancia magnética, se consideró suficiente una potencia de 1,5 Tesla.
- Hacer predicciones sobre la audición acústica residual futura en la mejor medida posible después de la recolección de la serie de audiogramas6 y la identificación de la etiología a través de imágenes y/o análisis genéticos.
- Importe datos DICOM de imágenes de TC preoperatorias en el software OTOPLAN. El software mide automáticamente la CDL en cada caso.
- Seleccione la longitud adecuada de la matriz de CI para cubrir la región en la que se prevé que la audición residual se deteriore en el futuro. Utilice únicamente electrodos finos, rectos y flexibles.
- Administrar prednisolona por vía oral a una dosis de 0,5-1,0 mg/kg/día a partir de 2 días antes de la cirugía.
2. Procedimiento quirúrgico
- Coloque al paciente en posición supina.
- Inducir la anestesia con fentanilo intravenoso (1-2 μg/kg), propofol (1-2 mg/kg) y rocuronio (0,6 mg/kg). Mantener la anestesia con propofol (3-8 mg/kg/h), remifentanilo (0,1-0,2 μg/kg/min) y fentanilo (total: 300-500 μg), sin vecuronio, para facilitar la monitorización neuromuscular.
- Administrar una infusión intravenosa de 8 mg de dexametasona 30 min antes de realizar la incisión.
- Gire la cabeza del paciente a 45 grados durante la cirugía.
- Inyectar anestesia local (lidocaína subcutánea al 0,5% con epinefrina 1:1,00,000) después de la auricular.
- Realizar una incisión postauricular de 5-6 cm (S perezosa) y mastoidectomía con barras de corte de 6,0-4,0 mm hasta llegar al punto donde el antro incluye el canal semicircular lateral y la apófisis corta del yunque6.
- Realizar una timpanotomía posterior entre el nervio facial esperado y la cuerda timpánica utilizando barras de diamante de 1,5-2,0 mm.
- Visualice el nicho de la ventana redonda y elimine el saliente óseo de la ventana redonda con un taladro de baja velocidad con una barra de diamante de 1,0-1,5 mm, exponiendo la membrana de la ventana redonda.
- Abra suficientemente la membrana de la ventana redonda con una púa e inserte con cuidado el electrodo lentamente durante más de 3 minutos.
- Realice radiografías y audiogramas después de completar la inserción del electrodo.
3. Evaluación postoperatoria
- Administrar dexametasona intravenosa a dosis de 8 mg/día, 4 mg/día y 4 mg/día durante 3 días después de la cirugía.
- Medir los umbrales auditivos sin ayuda a los 6 meses de la activación inicial y evaluar la tasa de HP utilizando la clasificación proporcionada por Skarzynski et al.20.
- Optimice la configuración del mapa utilizando una herramienta de software basada en los resultados del audiograma postoperatorio y las preferencias del paciente.
Resultados
El EAS se llevó a cabo en 10 pacientes (11 oídos) que cumplían con los criterios audiológicos para el EAS (consultar el Cuadro 1). Los criterios de inclusión fueron los siguientes: niveles de audición pura bilateral ≤65 dBHL para 125 Hz, 250 Hz y 500 Hz; ≥80 dBHL a 2000 Hz; y ≥85 dBHL a 4000 Hz y 8000 Hz. Además, se requirió un beneficio mínimo de los audífonos convencionales, definido como puntuaciones monosílabas en silencio por debajo del 60% incluso en la condición óptima asistida. Todos los participantes se sometieron a EAS utilizando electrodos más largos (ver Tabla de Materiales). En la figura 1 se muestran los audiogramas preoperatorios y postoperatorios a los 6 meses después de la cirugía de EAS, lo que sugiere que la audición residual de baja frecuencia se conservó bien en todos los casos. De acuerdo con el sistema de clasificación de la preservación de la audición (HP) reportado por Skarzynski et al.20, el 36,4% (4 de 11 casos) presentó HP completa, y el 63,6% (7 de 11 casos) presentó HP parcial. No hubo casos de deterioro auditivo significativo.
Presentación del caso (Caso #8)
A la edad de 5 años, durante un chequeo de bienestar de rutina en la escuela primaria, una niña de 14 años que no se había sometido a una prueba de audición neonatal fue señalada por sospecha de pérdida auditiva (LH). Posteriormente diagnosticada con LH de alta frecuencia, comenzó a usar audífonos. Dado el deterioro observado en su audición, buscó una evaluación en nuestro departamento a la edad de 13 años.
Las variantes patógenas del gen CDH23 se identificaron mediante pruebas genéticas6. Dado que era probable que la audición residual se deteriorara debido al LH relacionado con CDH23, se seleccionó un electrodo más largo para cubrir la región acústica. Se sometió a una cirugía EAS en la oreja izquierda a la edad de 14 años. La audición residual se conservó por completo 6 meses después de la cirugía. En ese momento, prefería el "mapeo solo de estimulación eléctrica (SE)" con electrodos apicales activados que atravesaban la región de la audición residual (Figura 2). El paciente se mostró satisfecho con la amplificación acústica obtenida mediante ES a bajas frecuencias.
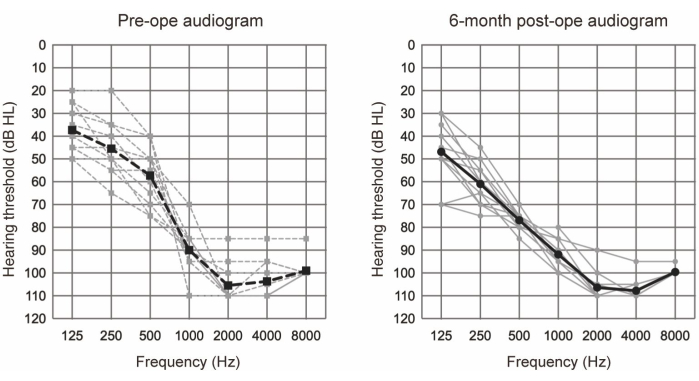
Figura 1: Umbrales promedio de audición por conducción aérea. Las líneas discontinuas y continuas indican las mediciones preoperatorias y postoperatorias a los 6 meses, respectivamente. Las líneas grises y negras muestran los datos individuales y la media, respectivamente. Esta figura ha sido adaptada de Yoshimura et al.6. Haga clic aquí para ver una versión más grande de esta figura.
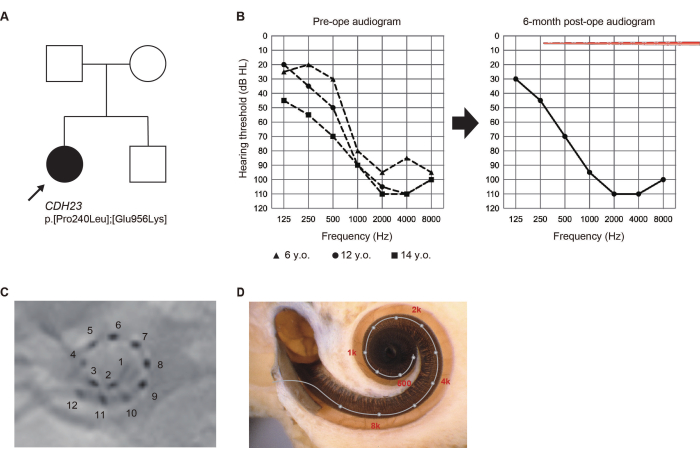
Figura 2: Hallazgos clínicos del Caso #8. (A) Pedigrí del paciente. (B) Audiogramas preoperatorios y postoperatorios a los 6 meses. Las ilustraciones de la guía de electrodos representan la profundidad de inserción. (C) Hallazgos radiológicos postoperatorios, con números correspondientes a canales individuales. (D) Imágenes para cada ubicación del electrodo y el mapa tonotópico de referencia. Esta figura ha sido adaptada de Yoshimura et al.6. Haga clic aquí para ver una versión más grande de esta figura.
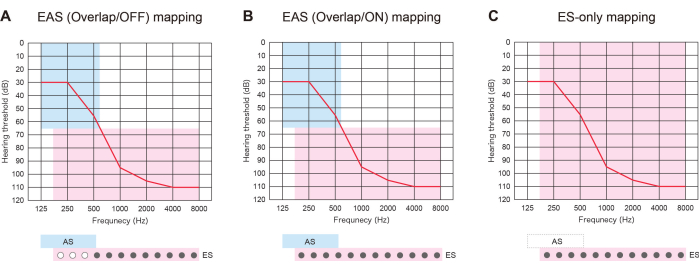
Figura 3: Tres tipos de estrategia de mapeo en pacientes con EAS utilizando electrodos más largos. (A) Mapa EAS (Overlap/OFF). Se desactivaron algunos de los contactos apicales, mientras que la estimulación acústica (EA) se activó. (B) Mapa EAS (Superposición/ON). Se utilizaron tanto la estimulación eléctrica (SE) en la configuración predeterminada de implante coclear (IC) como la EA. (C) Mapa solo ES. En la configuración ES, el rango de frecuencia se estableció de 70 a 8.500 Hz. AS se desactivó. Haga clic aquí para ver una versión más grande de esta figura.
| Paciente | Implantado | Implantado | Responsable | Preoperatorio | Postoperatorio de 6M | HP numérico | HP | |
| No. | Género | Edad (años) | lado | Gen | LFA (dB) | LFA (dB) | Escala (%) | clasificación |
| 1 | F | 12 | L | SLC26A4 | 63.3 | 70 | 70.8 | Parcial |
| 2 | F | 9 | L | SLC26A4 | 50 | 65 | 62.5 | Parcial |
| 3 | M | 50 | L | CDH23 | 50 | 56.7 | 78.6 | Íntegro |
| 4 | F | 31 | L | Desconocido | 45 | 61.7 | 67.7 | Parcial |
| 31 | R | 46.7 | 56.7 | 75.9 | Íntegro | |||
| 5 | F | 57 | R | Desconocido | 38.3 | 65 | 59 | Parcial |
| 6 | F | 55 | R | Desconocido | 26.7 | 55 | 68.4 | Parcial |
| 7 | M | 21 | R | LOXHD1 | 33.3 | 66.7 | 37.2 | Parcial |
| 8 | F | 14 | R | CDH23 | 56.7 | 48.3 | 100 | Íntegro |
| 9 | M | 20 | L | Desconocido | 51.7 | 73.3 | 48.1 | Parcial |
| 10 | M | 64 | R | Desconocido | 51.7 | 58.3 | 82.1 | Íntegro |
Tabla 1: Resumen de las características del sujeto y los resultados de la preservación de la audición. Esta tabla ha sido adaptada de Yoshimura et al.6.
Discusión
La identificación de la etiología del linfoma de Hodgkin en la evaluación preoperatoria es crucial para predecir el futuro audiograma en cada caso. En nuestro estudio anterior, las variantes patogénicas en los genes CDH23, ACTG1, Mit1555A>G, MYO7A, MYO15A, SLC26A4 y TMPRSS3 se identificaron con frecuencia en pacientes con HL7 de alta frecuencia. En la mayoría de estos pacientes, la audición residual se deterioró gradualmente (ver Caso de LH relacionado con CDH23 en la Figura 2). En estos casos, se tuvo en cuenta el curso natural del linfoma de Hodgkin a la hora de seleccionar el electrodo CI para una cobertura coclear más amplia.
La determinación de la longitud de la matriz de CI requirió medir la longitud del conducto coclear (CDL). Para facilitar este proceso, el software OTOPLAN demostró ser clínicamente factible21. En versiones anteriores, como OTOPLAN 3.0, la CDL se medía manualmente para trazar el diámetro, la anchura y la altura de cada cóclea. Sin embargo, con OTOPLAN 4.0, se hizo posible la medición automática de la CDL, lo que ofreció una mayor comodidad para los cirujanos y minimizó la variación de la medición. En particular, las imágenes de TC con un grosor de corte de 0,6 mm o menos fueron adecuadas para el análisis automático proporcionado por OTOPLAN. Posteriormente, se debe seleccionar la longitud de la matriz de CI para lograr el ángulo óptimo de profundidad de inserción (AID) en cada caso.
Para realizar una cirugía EAS menos invasiva, se requirió la administración pre, intra y post-esteroide para minimizar la inflamación aguda que podría elevar el umbral auditivo22. En un futuro próximo, para minimizar no solo las reacciones agudas sino también las crónicas después de la cirugía de IC y EAS, será deseable el uso de electrodos liberadores de dexametasona. Además de la administración de esteroides, los electrodos flexibles de la pared lateral fueron esenciales para minimizar el traumatismo en la cóclea. La inserción cuidadosa y lenta de estos electrodos en la cóclea mediante el enfoque de ventana redonda resultó en una invasividad mínima. Para ayudar en esto, realizar la cirugía con exoscopios y endoscopios fue útil para generar un campo de visión más claro y confirmar los pequeños componentes del oído medio. Para prevenir la inducción de una extensa formación de tejido fibroóseo en la cóclea, se debe evitar el abordaje de ventana redonda extendida y la cocleostomía23.
El EAS con electrodos más largos fue útil no solo para prepararse para el futuro deterioro del HL, sino también para ofrecer tres tipos de estrategias de mapas. Si los electrodos insertados se superponen con la región auditiva residual, los pacientes con EAS pueden usar ES con o sin AS: "Mapa EAS (Overlap/ON)" o "Mapa solo ES". Alternativamente, pueden apagar algunos de los contactos apicales y activar el AS: "Mapa EAS (Overlap/OFF)". Si la audición se deteriora, todos los contactos se pueden conectar posteriormente para proporcionar una mejor adaptación del tono (Figura 3). Todos estos hallazgos muestran que EAS con electrodos más largos permite a los usuarios optimizar los mapas para una audición más natural.
En este trabajo se demuestra que la preparación preoperatoria y las técnicas quirúrgicas avanzadas son esenciales para minimizar el trauma quirúrgico. La realización de la serie de procedimientos preoperatorios e intraoperatorios mencionada anteriormente permitió a los pacientes beneficiarse de EAS con electrodos más largos.
Limitaciones
A pesar de los avances en los procedimientos quirúrgicos menos invasivos antes mencionados, la audición residual aún se deteriora en un cierto número de pacientes después de la IC. La monitorización intraoperatoria, como la microfonía coclear (MC), sería clínicamente factible para medir el daño coclear durante la inserción del electrodo24. Sin embargo, hasta la fecha no está claro cómo evaluar el EAS con electrodos más largos y qué hacer en el caso de ciertas respuestas de CM, como una disminución de la amplitud. Se requieren más estudios en esta área.
Divulgaciones
Los autores declaran no tener conflictos de intereses.
Agradecimientos
Esta investigación fue financiada por una beca de investigación en ciencias de la salud y el trabajo para la investigación sobre enfermedades raras e intratables y una investigación integral sobre la salud y el bienestar de la discapacidad del Ministerio de Salud, Trabajo y Bienestar de Japón (S.U. 20FC1048, 23FC10149) y subvenciones de ayuda de la Agencia Japonesa para la Investigación y el Desarrollo Médico (AMED) (S.U. 19ek0109363h0002, 21ek0109542h003).
Materiales
| Name | Company | Catalog Number | Comments |
| DEXART 3.3 mg | Fuji Pharma | 22100AMX01404 | equal to dexamethasone sodium phosphate (4 mg) |
| DEXART 6.6 mg | Fuji Pharma | 22100AMX01402 | equal to dexamethasone sodium phosphate (8 mg) |
| Fentanyl injection 0.1 mg | TERUMO | 22100AMX00009 | |
| MAESTRO 7.0 | MED-EL | 4582290238456 | fitting software for map settings |
| Midas Rex MR8 | Medtronic | 301ADBZX00046000 | high speed drill |
| OTOPLAN software | Cascination / MED-EL | REF 20125 | for measuring cochlear duct length (CDL) |
| Predonine tablets | Shionogi | 16000AMZ01740000 | |
| Propofol 1% 50 mL | Maruishi Pharmaceutical Co.,Ltd | 30100AMX00158 | |
| Remifentanil 2 mg | Daiichi-Sankyo | 22800AMX00090 | |
| Rocuronium bromide 50 mg/50 mL | Maruishi Pharmaceutical Co.,Ltd | 22800AMX00534 | |
| SONNET2 EAS | MED-EL | 4582290241807 | processor |
| Synchrony2 FLEX28 | MED-EL | 4571573943026 | cochlear implant (electrode) |
| Xylocaine 0.5% with epinephrine | Sandoz Pharma | 4KUZ13127 |
Referencias
- Von Ilberg, C., et al. Electric-acoustic stimulation of the auditory system. New technology for severe hearing loss. ORL J Otorhinolaryngol Relat Spec. 61 (6), 334-340 (1999).
- Gstoettner, W., et al. A new electrode for residual hearing preservation in cochlear implantation: First clinical results. Acta Otolaryngol. 129 (4), 372-379 (2009).
- Moteki, H., et al. Feasibility of hearing preservation for residual hearing with longer cochlear implant electrodes. Acta Otolaryngol. 138 (12), 1080-1085 (2018).
- Usami, S., et al. Achievement of hearing preservation in the presence of an electrode covering the residual hearing region. Acta Otolaryngol. 131 (4), 405-412 (2011).
- Usami, S., et al. Hearing preservation and clinical outcome of 32 consecutive electric acoustic stimulation (EAS) surgeries. Acta Otolaryngol. 134 (7), 717-727 (2014).
- Yoshimura, H., Moteki, H., Nishio, S. Y., Usami, S. I. Electric-acoustic stimulation with longer electrodes for potential deterioration in low-frequency hearing. Acta Otolaryngol. 140 (8), 632-638 (2020).
- Yoshimura, H., et al. Genetic testing has the potential to impact hearing preservation following cochlear implantation. Acta Otolaryngol. 140 (6), 438-444 (2020).
- Van de Heyning, P. H., et al. Systematic literature review of hearing preservation rates in cochlear implantation associated with medium- and longer-length flexible lateral wall electrode arrays. Front Surg. 9, 893839 (2022).
- Buchman, C. A., et al. Influence of cochlear implant insertion depth on performance: A prospective randomized trial. Otol Neurotol. 35 (10), 1773-1779 (2014).
- Buchner, A., Illg, A., Majdani, O., Lenarz, T. Investigation of the effect of cochlear implant electrode length on speech comprehension in quiet and noise compared with the results with users of electro-acoustic-stimulation, a retrospective analysis. PLoS One. 12 (5), e0174900 (2017).
- Canfarotta, M. W., et al. Long-term influence of electrode array length on speech recognition in cochlear implant users. Laryngoscope. 131 (4), 892-897 (2021).
- Nassiri, A. M., et al. Hearing preservation outcomes using a precurved electrode array inserted with an external sheath. Otol Neurotol. 41 (1), 33-38 (2020).
- O'Connell, B. P., et al. Electrode location and angular insertion depth are predictors of audiologic outcomes in cochlear implantation. Otol Neurotol. 37 (8), 1016-1023 (2016).
- Moteki, H., et al. Long-term results of hearing preservation cochlear implant surgery in patients with residual low frequency hearing. Acta Otolaryngol. 137 (5), 516-521 (2017).
- Von Ilberg, C. A., Baumann, U., Kiefer, J., Tillein, J., Adunka, O. F. Electric-acoustic stimulation of the auditory system: A review of the first decade. Audiol Neurootol. 16, 1-30 (2011).
- Ariyasu, L., Galey, F. R., Hilsinger, R., Byl, F. M. Computer-generated three-dimensional reconstruction of the cochlea. Otolaryngol Head Neck Surg. 100 (2), 87-91 (1989).
- Danielian, A., Ishiyama, G., Lopez, I. A., Ishiyama, A. Morphometric linear and angular measurements of the human cochlea in implant patients using 3-dimensional reconstruction. Hear Res. 386, 107874 (2020).
- Kawano, A., Seldon, H. L., Clark, G. M. Computer-aided three-dimensional reconstruction in human cochlear maps: Measurement of the lengths of organ of Corti, outer wall, inner wall, and Rosenthal's canal. Ann Otol Rhinol Laryngol. 105 (9), 701-709 (1996).
- Rask-Andersen, H., et al. Human cochlea: Anatomical characteristics and their relevance for cochlear implantation. Anat Rec (Hoboken). 295 (11), 1791-1811 (2012).
- Skarzynski, H., et al. Towards a consensus on a hearing preservation classification system. Acta Otolaryngol Suppl. 564, 3-13 (2013).
- Yoshimura, H., Watanabe, K., Nishio, S. Y., Takumi, Y., Usami, S. I. Determining optimal cochlear implant electrode array with OTOPLAN. Acta Otolaryngol. 143 (9), 748-752 (2023).
- Skarzynska, M. B., et al. Preservation of hearing following cochlear implantation using different steroid therapy regimens: a prospective clinical study. Med Sci Monit. 24, 2437-2445 (2018).
- Geerardyn, A., et al. Human histology after structure preservation cochlear implantation via round window insertion. Laryngoscope. 134 (2), 945-953 (2023).
- Campbell, L., et al. Intraoperative real-time cochlear response telemetry predicts hearing preservation in cochlear implantation. Otol Neurotol. 37 (4), 332-338 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados