Method Article
血清中视黄醇氘富集的 GC-MS 分析和维生素 A 全身储存的估计
摘要
该方法包括从血清中提取视黄醇,使用 HPLC 分离,并使用 GC-MS 测定标记和未标记的视黄醇同位素。标记与未标记的视黄醇的比率用于估计维生素 A 的体内总储存量。
摘要
该方法描述了血清中视黄醇氘富集的测定和体内维生素 A 储存量的估计。该过程包括使用 0.5 mL 0.85% 盐水溶液、100 μL 内标溶液和 5 mL 氯仿-甲醇 (2:1 v/v) 溶液从 0.4 mL 血清中提取视黄醇。离心并去除下层氯仿后,将混合物在氮气下干燥并重悬于 0.1 mL 乙醇中,并使用配备 PE C18 色谱柱的 HPLC 系统将视黄醇馏分与其他成分分离。视黄醇馏分可以手动收集,也可以使用馏分收集器收集。随后,将视黄醇馏分在氮气下干燥,并用含有 10% 三甲基氯硅烷的 O-双(三甲基硅烷基)三氟乙酰胺 (BSTFA) 衍生化。最后,使用配备 19091z-431 HP-1 甲基硅氧烷毛细管柱的 GC-MS 系统定量标记和未标记的视黄醇同位素,该系统采用氦气作为载气,甲烷作为电离剂的电子捕获负化学电离。然后在 Olson、Green 或质量平衡方程中使用标记与未标记的视黄醇的比率来估计维生素 A 的储存。
引言
维生素 A 是视觉系统和维持细胞生长、上皮完整性、红细胞生成、免疫力和生殖功能所需的必需营养素1。维生素 A 缺乏症是世界范围内的一个严重公共卫生问题,影响到 100 多个国家。它对低收入国家的幼儿和孕妇的影响尤为严重。全球约有 1.9 亿儿童患有维生素 A 缺乏症,这使其成为公共卫生和儿童发展的关键问题2。
为应对这种情况,许多低收入国家已经实施了几十年的多项计划,包括补充维生素 A,每年两次向 5 岁以下儿童分发高剂量维生素 A,以及在某些食品中强化维生素 A。然而,这些干预措施经常重叠,使一些人群无意中暴露于慢性过量维生素 A 摄入 3,4。这种缺乏和过量的双重风险凸显了对生物标志物的需求,该生物标志物可以准确评估从缺乏到毒性的全谱维生素 A 状态,以指导计划评估。
维生素 A 生物标志物对于评估营养状况至关重要。最常用的生物标志物是血清中视黄醇和视黄醇结合蛋白 (RBP) 的浓度。然而,重要的是要注意,这些生物标志物可以被感染和炎症暂时抑制,这可能会降低某些人群中维生素 A 评估的特异性 5,6,7。
虽然肝活检或尸检样本被认为是评估维生素 A 状况的金标准,但肝脏维生素 A 总储备最敏感的间接指标是视黄醇同位素稀释 (RID) 方法8。RID 提供了对维生素 A 状态的全谱定量估计,范围从缺乏到过度储存9。在大多数研究应用中,RID 方法包括口服剂量的氘 (2H) 或 13C 标记的视黄酯乙酸酯,然后在 14 至 21 天内与体内储存物混合。在此期间后,收集血样,并将血清储存在 -80 °C。 然后使用质谱法分析标记视黄醇与总视黄醇的比率,以估计维生素 A 储存10,采用 Olson 方程11、质量平衡方程12 或 Green 方程13。本文中提出的方案适用于氘 (2H) 或 13C 标记的视黄酯乙酸酯的给药,并且基于 Tang 等人的工作 14。该方法的总体目标是准确评估和监测体内维生素 A 状态11。这是一种强大的方法,可以定量估计从缺乏到过量15 的广泛状态下的维生素 A 浓度。它比其他方法更准确、更精确,因为其他方法通常依赖于间接测量9(indirect measures)。
研究方案
该方案已获得公共卫生部伦理委员会的批准(编号 2015/02/550/CE/CNERSH/SP),并获得了父母/监护人的知情同意。
注意:由于维生素 A 对光敏感,因此所有程序都必须在昏暗的光线或金色荧光灯下进行16。材料 表中详细介绍了使用的材料。
1. 试剂的制备
- 氯化钠 (0.85% w/v):将 0.85 g NaCl 溶于 100 mL 容量瓶中的蒸馏水中。用蒸馏水填充至刻度标记并混合。
- 氯仿-甲醇 (2:1 v/v):将 300 mL 氯仿转移至带量筒的 500 mL 容量瓶中。加入 150 mL 甲醇并混合。
- HPLC流动相A:乙腈/四氢呋喃/超纯水(50/20/30,v/v/v):将500 mL乙腈转移至1000 mL容量瓶中。加入 200 mL 四氢呋喃和 300 mL 水。混合溶液,使用孔径为 0.45 μm 的膜过滤器过滤,然后超声处理(振幅 100%,频率 40 kHz,持续时间 15 分钟)。
- HPLC流动相B:乙腈/四氢呋喃/超纯水(50/44/6,v/v/v):将500 mL乙腈转移至1000 mL容量瓶中。加入 440 mL 四氢呋喃和 60 mL 水。混合溶液,使用孔径为 0.45 μm 的膜过滤器过滤,然后超声处理。
2. 标准溶液的制备
- 将 40 mg 标准品溶于乙醇中,放入 100 mL 容量瓶中,制备储备液,如 表 1 所示。用溶剂填充至刻度标记,并充分混合。
- 稀释的储备液:将 1 mL 储备液转移到 50 mL 容量瓶中,制备稀释的储备液,如 表 2 所示。用适当的溶剂填充至刻度标记,并充分混合。
- 稀释储备溶液浓度的测定:将等分试样 (1 mL) 的稀释溶液放入石英管中,并在分光光度计中以指定波长(表 3)使用乙醇作为空白测量其吸光度。使用 Lambert-Beer 定律17 计算。确保分光光度计在分析前经过校准,方法是将仪器预热 15-30 分钟,选择所需的波长,然后将空白物放入样品架中将仪器归零。使用以下公式计算浓度:
浓度 = (吸光度/吸收系数) x 106 (μg/dL)
注:要将值从常规单位 (μg/dL) 转换为 SI 单位 (μmol/L),请将常规值乘以以下转换因子:乙酸视黄酯为 0.0304,视黄醇18 为 0.0349。 - 工作标准品的制备:使用容量移液管,将 2 mL 稀释的储备液转移至 100 mL 锥形瓶中。用乙醇将培养瓶装满至刻度标记处,充分混合,然后用塞子关闭。
- 为了确定每种溶液的确切浓度,使用配备 C18 色谱柱和设置为 340 nm 的二极管阵列检测器的 HPLC 评估每种组分的纯度。根据 表 4 所示的时间表,对泵进行编程,使其使用流动相 A 和流动相 B。通过验证各种组件(如泵、检测器、自动进样器和整个系统的性能),确保在分析前校准 HPLC 系统。
- 将 1 mL 稀释的储备液转移到钳口样品瓶中,然后根据正常程序将样品注入 HPLC 系统。使用以下公式确定纯度:
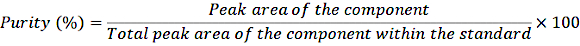
方程 1
通过对纯度进行这种校正,计算标准溶液中不同组分的精确浓度。
- 内标的制备(乙酸视黄酯 OD ~ 0.2):使用容量移液管,将 30 mL 乙酸视黄酯工作标准品转移到 100 mL 锥形瓶中。用乙醇将培养瓶装满至刻度标记处,充分混合,然后用塞子关闭。
- 工作溶液的制备:将 20 μg 非标记视黄醇添加到 10.00、3.33、1.00、0.33 和 0.00 μg 标记视黄醇中,得到 0.500、0.167、0.050、0.0167 和 0.00 的标记和非标记视黄醇比例。
3. 样品分析
注意:本研究中使用的血清样本是在第 14 天从接受口服剂量(2 毫克视黄醇当量)D8-视黄醇的儿童那里收集的,作为旨在监测和评估喀麦隆儿童维生素 A 状况的研究的一部分。
- 血清中类视黄醇的提取:该提取基于 Folch 等人 19 的工作,并经 Tang 等人 14 修改。请按照以下步骤作。
- 分析前,让冷冻血清样品在室温 (20-25 °C) 下轻轻解冻。将 400 μL 血清分装到 16 x 100 mm 一次性培养管中。加入 500 μL 0.85% 盐水、100 μL 内标和 5 mL 氯仿-甲醇 (2:1 v/v) 溶液。
- 涡旋 30 秒,并在 4 °C 下以 1157 x g 离心 10 分钟。 使用玻璃巴斯德移液器,小心地将氯仿下层去除到 13 x 100 mm 的一次性培养管中。在氮气下水浴 (40 °C) 中干燥,并将残留物重悬于 100 μL 乙醇中。涡旋并超声处理 30 秒。将样品转移到带有插件的钳口样品瓶中,关闭孔并标记。样品已准备好用于 HPLC 视黄醇采集。
- 如下所述进行 HPLC 视黄醇收集。
- 将每种血清样品 70 μL 注入配备 C18 色谱柱和设置为 340 nm 的二极管阵列检测器的 HPLC 系统中。按照 表 4 所示的时间表,对泵进行编程,使其以 1 mL/min 的恒定流速输送流动相 A 和 B。
- 在注射血清样品之前,将 70 μL 视黄醇工作液注入 HPLC 系统,并记录视黄醇峰的保留时间。然后,设置馏分收集器,将洗脱的视黄醇馏分收集在带有毛玻璃塞的 5 mL 试管中。在这种情况下,在 7.5-10.5 分钟的间隔 3 分钟内收集视黄醇组分。
注:在此步骤中,也可以使用视黄醇标准品的校准曲线和从内标获得的回收率来计算视黄醇的浓度。
- 如下所述进行视黄醇衍生化。
- 将 HPLC 收集的视黄醇馏分在 40 °C 的水浴中在氮气下干燥至少 3 小时。添加乙醇以促进干燥过程中的水分蒸发(样品应完全干燥,因为衍生化对水分敏感)。向试管中加入 20 μL 含 10% TMCS 的 BSTFA。
- 将试管放入设置为 70 °C 的干块加热器中并孵育 30 分钟。使用玻璃巴斯德移液器,将反应混合物转移到带有插件的钳口小瓶中,使用瓶盖钳口盖紧密封,并贴上标签。样品现在已准备好进行 GC/MS 分析,并且可以储存在 4 °C 的干燥器中直至分析。
- 此外,干燥 100 μL 一组工作标准溶液,并如上所述进行衍生化以校准 GC/MS。
注:使用 BSTFA 衍生化视黄醇涉及化学反应,其中视黄醇的羟基 (-OH) 被三甲基硅烷基 (-Si(CH3)3) 取代,形成视黄醇三甲基硅烷醚。该工艺增强了视黄醇的挥发性和稳定性,使其更适合 GC/MS 分析20。
- GC/MS 分析:使用 Tang 等人 14 描述的程序进行 GC/MS 分析。请按照以下步骤作。
- 使用自动进样器将 3 μL 衍生化视黄醇样品注入 GC 中,并通过零死体积连接器将冷却柱上进样器连接到内径为 15 m x 0.25 mm 的熔融石英毛细管柱,该色谱柱涂有膜厚为 0.25 μm 的 DB-1 固定相。
- 对柱温箱和柱上进样器温度进行编程,使其以 15 °C/min 的速率从 50 °C 升高至 285 °C,并将 GC/MS 接口温度设置为 285 °C。 使用氦气作为载气,在大约 12 分钟内洗脱视黄醇的三甲基硅烷基衍生物。
- 使用四极杆质谱仪使用 0.5 torr 甲烷负离子化学电离检测 GC 洗脱液,离子源温度设置为 150 °C。 将质谱仪设置为在 260 到 280 道尔顿之间扫描。
4. 数据分析
- 使用 GC/MS 数据分析软件。
- 根据质荷比 (m/z) 提取所有需要的离子,积分峰面积(使用手动积分调整峰的起点和终点)并将结果传输到电子表格文件。
注:根据所使用的同位素,所需的离子如下:天然视黄醇为 268-270 m/z;271-274 m/z 对于 [2H4] - 视黄醇;278-280 m/z 用于 [13C] - 视黄醇;和 276-280 m/z 用于 [2H8] - 视黄醇。 - 通过在 m/z 274、275、276、277 和 278 处添加峰面积来计算标记的视黄醇 (ΣD) 的峰总和。通过在 m/z 268、269 和 270 处添加峰面积来计算未标记视黄醇 (ΣH) 的峰总和。
- 使用以下公式计算标记视黄醇 (D) 的富集度:D = ΣD/(ΣH + ΣD)。使用以下等式计算未标记的视黄醇 (H) 的量:H = 1 - D。
注:视黄醇三甲基甲硅烷基醚的气相色谱电子捕获负化学电离质谱法在未标记的视黄醇在 m/z 268 至 271、D4-视黄醇的 m/z 272 至 275 和 D8-视黄醇14 的 m/z 276 至 280 处没有分子离子,而会产生一个主要碎片离子。 - 为了控制系统,计算校准标准品的重量比与标记的视黄醇和未标记的视黄醇的积分面积之间的线性回归方程。
5. 维生素 A 储存量的估计
注意:此步骤允许评估个人的维生素 A 状况。
- 使用 Olson 方程11 计算维生素 A 总肝脏储存量
维生素 A 总肝脏储存量 = F x 剂量 x [S x a x (H/D - 1)]
其中 F 是口服剂量的吸收和储存效率的一个因素 (F = 0.50),剂量是口服标记的维生素 A 的量 (μmol),S 是校正标记与未标记视黄醇的肝脏比率不相等的因子 (S = 0.65),a 是校正混合期间标记维生素 A 不可逆损失的因子;具体来说,a = e-kt,其中 k 是估计的系统分解代谢分数率(k = 儿童 ln 2/32 天),t 是时间,表示为自给药以来的天数;D/H 是标记与未标记视黄醇的血清同位素比,-1 校正标记维生素 A 剂量对全身维生素 A 库的贡献。 - 要计算维生素 A 总体储备 (TBS),请使用绿色方程13
TBS = Fa × S × (1/SAp)
其中 Fa 是在时间 t 时在身体的可交换储存池中吸收和发现的口服标记剂量的 VA 的分数,S 是血清中视黄醇特异性活性与时间 t 时储存的视黄醇特异性活性的比率(对于儿童,Fa × S = 0.642 在 14 天时)21。SAp 是血清中每 μmol 剂量的剂量分数(即 [标记的视黄醇] / ([未标记的视黄醇] 在血清中)/ 标记的视黄醇的口服剂量 (μmol))。
结果
将 3 μL 含有约 50 pM/μL 校准品(视黄醇和 D8-视黄醇)的干燥溶液衍生化样品注入 GC/MS 中,没有显示分子离子,但在视黄醇的 m/z 268 处(图 1)和 D8-视黄醇的 m/z 278处(图 2)处表现出主碎片离子。这表明视黄醇和 D8-视黄醇衍生化过程中形成的视黄基三甲基硅烷醚的分子离子在 GC/MS 中使用的电离条件下不稳定。它们主要通过 α 切割分解成更小的片段。这种常见的碎裂模式涉及与三甲基硅烷基醚基相邻的键断裂。α 裂解导致三甲基硅烷基团(TMS,质量为 73 Da)和氢原子的丢失,导致视黄醇质量为 268 Da,D8-视黄醇 278 Da 的碎裂离子22。这种机制有助于通过分析质谱过程中产生的特定碎片离子来识别和确认样品中视黄醇及其衍生物的存在。注射视黄醇和 D8-视黄醇的混合物后,视黄醇的 m/z 268 和 D8-视黄醇的 m/z 276 处出现两个主要的碎片离子(图 3),表明样品中存在这些化合物。校准曲线表现出优异的线性度,如高相关系数所示(图 4),表明峰比和重量比之间的关系具有非常直接且可预测的模式。
注射血清样品获得的 GC/MS 反应(来自口服剂量为 2 mg 视黄醇当量的 D8-视黄醇的儿童的血清; 图 5)显示视黄醇和 D8-视黄醇的存在,在 m/z 268 和 m/z 274 处观察到两个主要碎片离子。 表 5 列出了 D8-视黄醇在 m/z 274、275、276、277 和 278 以及未标记视黄醇在 m/z 268、269 和 270 处提取离子并积分峰面积后获得的结果。这些结果将被整合到 Olson 方程11 或 Green 方程13 中,以计算体内维生素 A 的储存量。
稳定同位素稀释技术可提供其他方法无法获得的维生素 A 水平测量值,从而能够准确评估维生素 A 状态。该方法对于营养研究、临床诊断和流行病学研究很有价值。
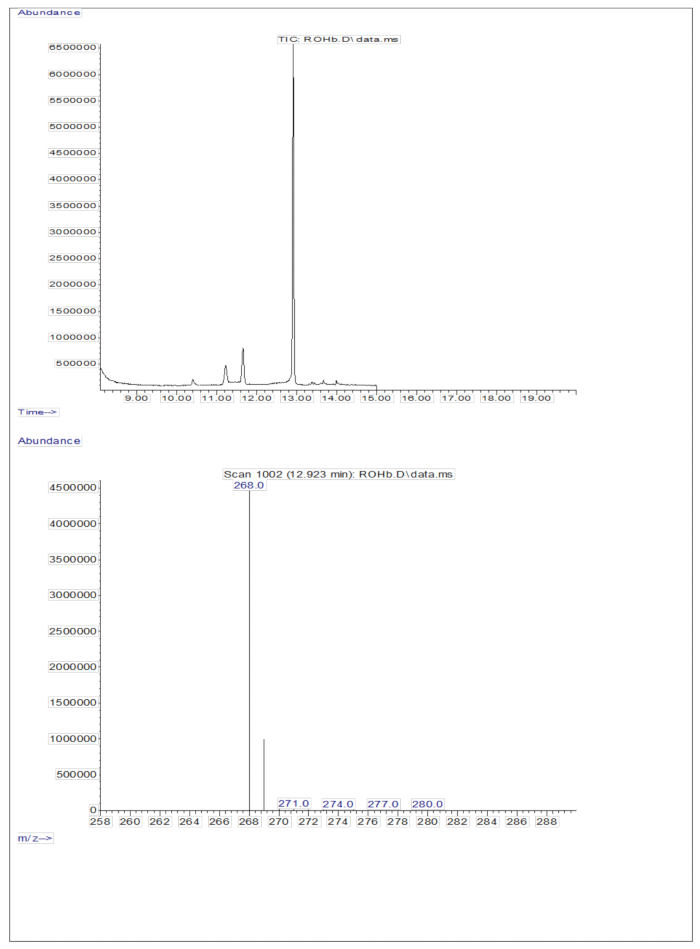
图 1:视黄醇的色谱图和质谱图。 该图显示了衍生化视黄醇标准品分析得到的气相色谱/甲烷电子捕获负化学电离-质谱色谱图(上图)。下图是显示视黄醇的 m/z 268 的质谱图。 请单击此处查看此图的较大版本。

图 2:D8-视黄醇的色谱图和质谱图。 该图显示了衍生化 D8-视黄醇标准品分析得到的气相色谱/甲烷电子捕获负化学电离-质谱色谱图(上图)。下图是显示 D8-视黄醇的 m/z 278 的质谱图。 请单击此处查看此图的较大版本。

图 3:视黄醇和 D8-视黄醇混合物的色谱图和质谱图。 该图显示了对视黄醇和 D8-视黄醇衍生混合物进行分析得到的气相色谱/甲烷电子捕获负离子电离-质谱色谱图(上图)。下图是质谱图,显示视黄醇的 m/z 268 和 D8-视黄醇的 m/z 276。 请单击此处查看此图的较大版本。
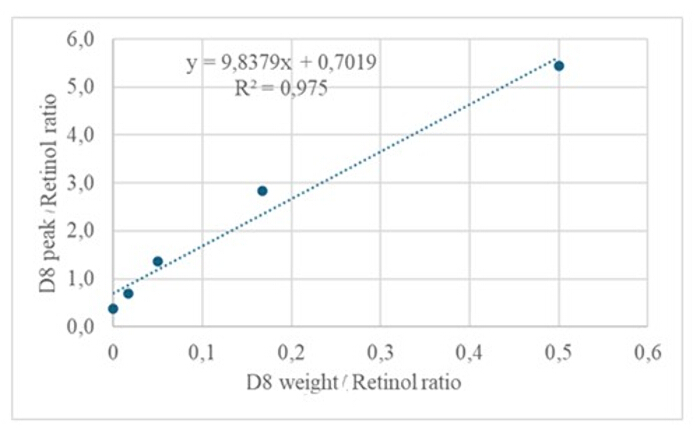
图 4:校准曲线。 该图说明了 GC/MS 响应与未标记和标记视黄醇浓度之间的关系。它由方程 y = 9.8379x + 0.7019 描述,其中 y(面积比)表示仪器响应,9.8379 是灵敏度,x(权重比)表示分析物浓度,0.7019 是背景信号。 请单击此处查看此图的较大版本。
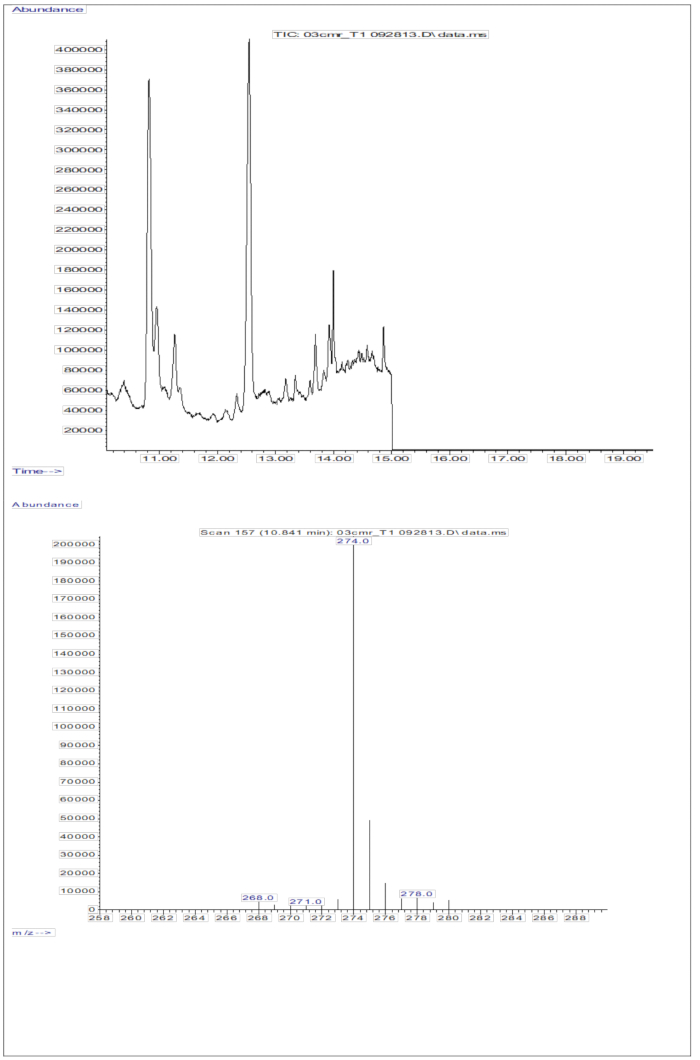
图 5:血清样品的色谱图和质谱图。 该图说明了从血清衍生化视黄醇组分分析得出的气相色谱/甲烷电子捕获负化学电离-质谱色谱图(上图)。下图是显示 D8-视黄醇的 m/z 274 的质谱图。 请单击此处查看此图的较大版本。
| 标准 | 重量 (mg) | 容量瓶 (mL) | 溶剂 |
| 视黄醇 | 40 | 100 | 乙醇 |
| Retinyl acetate 乙酸 | 40 | 100 | 乙醇 |
| 氘标记的视黄酯乙酸酯 | 40 | 100 | 乙醇 |
表 1:储备液的制备。 下表演示了如何制备视黄醇和氘标记的视黄醇乙酸酯的浓缩溶液,然后将其稀释至较低浓度以备将来实验使用。
| 标准 | 储备溶液 (mL) | 容量瓶 (mL) | 溶剂 |
| 视黄醇 | 1 | 50 | 乙醇 |
| Retinyl acetate 乙酸 | 1 | 50 | 乙醇 |
| 氘标记的视黄酯乙酸酯 | 1 | 50 | 乙醇 |
表 2:稀释储备液的制备。 下表演示了如何制备视黄醇和氘标记的视黄酯乙酸酯的即用型溶液。
| 标准 | 波长 (nm) | E1%1 厘米 |
| 视黄醇 | 325 | 1850 |
| Retinyl acetate 乙酸 | 326 | 1550 |
表 3:波长和 E1% 1 cm(吸收系数)。
| 时间 (min) | 流速 (mL/min) | 流动相 A (%) | 流动相 B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
表 4:HPLC 流动相的时间表。 下表说明了 HPLC 色谱运行期间不同固定相的计划顺序和持续时间。
| 上海 | 标清 | D | H | |
| 实验体 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| 实验体 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| 实验体 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| 实验体 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| 实验体 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| 实验体 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| 实验体 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| 实验体 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| 实验体 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| 实验体 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH:m/z 268、269 和 270 处的峰面积总和 | ||||
| SD:m/z 274、275、276、277 和 278 处的峰面积总和 | ||||
| D:标记视黄醇的富集 | ||||
| H:未标记视黄醇水平 |
表 5:血清衍生化视黄醇组分的 GC/MS 结果。 下表报告了计算维生素 A 全身储存所需的 GC/MS 输出。H 是 m/z 处峰面积之和 268、269 和 270;D 是 m/z 处峰面积之和 274、275、276、277 和 278;D 是标记视黄醇的富集;H 是未标记的视黄醇水平;TBS 是维生素 A Total Body Store。
讨论
该协议的成功实施取决于每个步骤的有效执行。正确制备溶液和标准品对于确保收集的数据准确可靠至关重要。方案中描述的程序在各种设置中进行了测试,适用于获得满足样品分析目标的解决方案和标准品。
样品分析从提取和分离血清中的视黄醇开始。将血清样品储存在 -80 °C 直至分析对于防止维生素 A 降解至关重要。此外,必须在昏暗的光线下工作16.用于收集视黄醇组分的 HPLC 程序旨在将视黄醇与其他脂溶性成分分离,以避免干扰衍生化过程。它还允许在不冲洗色谱柱的情况下运行数百个样品。
将从HPLC收集的视黄醇级分在70°C下用BSTFA衍生化30分钟。衍生化步骤对于提高视黄醇的挥发性及其在 GC-MS 中的可检测性至关重要。由于它对水敏感,因此在衍生化之前完全干燥样品并在 GC-MS 分析之前留出足够的时间进行衍生化反应至关重要。值得注意的是,与使用 N-甲基-N-(叔丁基二甲基甲硅烷基)三氟乙酰胺 (MTBSTFA) 相比,使用 BSTFA 的衍生化过程非常温和和有效23,24,并且为衍生化视黄醇提供了非常尖锐的峰,在扫描质量范围内没有拖尾或背景峰14。密封小瓶中的衍生化视黄醇可在干燥器中于 4 °C 保存 1 个月而不会降解14。
对于 GC-MS 分析,确保正确校准和维护色谱柱,并优化进样体积、温度和流速至关重要。此处使用的柱上进样条件显示出良好且可靠的结果14。在对氘代和未标记的视黄醇进行 GC-MS 分析期间,Tang 等人14 观察到氘代视黄醇的峰值同时出现在给药剂量和接受该剂量的受试者的血清中。这种模式在未标记的视黄醇中没有出现。因此,他们得出结论,氘代视黄醇的峰是在剂量中预先形成的,而不是质谱仪中碎裂的结果,这表明氘代视黄醇在代谢过程中保持其结构,为生物学研究中追踪视黄醇提供了可靠的标志物。学龄前儿童服用 2 mg D8-视黄醇后血清中氘代视黄醇的富集在 7 h 开始增加,并在 14 d 达到峰值,这是较短的最佳采样时间25。在 200 μL 人血清中,视黄醇的最小可检测富集百分比为 0.01%,表明该方法足够灵敏,可以分析从具有多种维生素 A 状态的受试者身上收集的血清样品14。
虽然这里介绍的稳定同位素稀释技术为评估维生素 A 状况提供了显着优势,但应该注意的是,这种方法需要复杂的设备和技术专长,使其成本高昂且在许多情况下难以常规使用26。因此,在计划使用此技术时,必须考虑此限制。
披露声明
本手稿是原子能机构支持的题为“利用视黄醇同位素稀释法评估维生素 A 体内储存和肝脏维生素 A 浓度”系列的一部分。
致谢
在美国波士顿塔夫茨大学 Jean Mayer 美国农业部人类营养老龄化研究中心类胡萝卜素与健康实验室的奖学金中,在 Guangwen Tang 的监督和国际原子能机构 (IAEA) 的财政支持下,我们学习了该协议。
材料
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
参考文献
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。