Method Article
Analyse GC-MS de l’enrichissement en deutérium du rétinol dans le sérum et estimation des réserves totales de vitamine A pour l’organisme
Dans cet article
Résumé
Cette méthode consiste à extraire le rétinol du sérum, à le séparer à l’aide de la CLHP et à déterminer les isotopes du rétinol marqués et non marqués à l’aide de la GC-MS. Le rapport entre le rétinol étiqueté et le rétinol non étiqueté est utilisé pour estimer les réserves totales de vitamine A du corps.
Résumé
Cette méthode décrit la détermination de l’enrichissement en deutérium du rétinol dans le sérum et l’estimation des réserves de vitamine A dans l’organisme. Le procédé consiste à extraire le rétinol de 0,4 mL de sérum à l’aide de 0,5 mL de solution saline à 0,85 %, de 100 μL de solution étalon interne et de 5 mL de solution de chloroforme-méthanol (2:1 v/v). Après centrifugation et élimination de la couche inférieure de chloroforme, le mélange est séché sous l’azote et remis en suspension dans 0,1 mL d’éthanol, et la fraction de rétinol est séparée des autres constituants à l’aide d’un système HPLC équipé d’une colonne PE C18. La fraction de rétinol peut être collectée manuellement ou à l’aide d’un collecteur de fractions. Par la suite, la fraction de rétinol est séchée sous azote et dérivée avec de l’O-bis(triméthylsilyl)trifluoroacétamide (BSTFA) contenant 10 % de triméthylchlorosilane. Enfin, les isotopes du rétinol marqués et non marqués sont quantifiés à l’aide d’un système GC-MS équipé d’une colonne capillaire de méthylsiloxane 19091z-431 HP-1, utilisant une ionisation chimique négative par capture d’électrons avec de l’hélium comme gaz porteur et du méthane comme agent d’ionisation. Le rapport entre le rétinol étiqueté et le rétinol non étiqueté est ensuite utilisé dans les équations d’Olson, de Green ou du bilan massique pour estimer les réserves de vitamine A.
Introduction
La vitamine A est un nutriment essentiel nécessaire au système visuel et au maintien de la fonction cellulaire pour la croissance, l’intégrité épithéliale, la production de globules rouges, l’immunité et la reproduction1. La carence en vitamine A est un grave problème de santé publique dans le monde entier, affectant plus de 100 pays. Elle touche de manière disproportionnée les jeunes enfants et les femmes enceintes dans les pays à faible revenu. Environ 190 millions d’enfants dans le monde souffrent d’une carence en vitamine A, ce qui en fait un problème critique pour la santé publique et le développement de l’enfant2.
En réponse à cette situation, plusieurs programmes, notamment la supplémentation en vitamine A avec distribution semestrielle de fortes doses de vitamine A aux enfants de moins de 5 ans et l’enrichissement en vitamine A de certains produits alimentaires, ont été mis en œuvre depuis des décennies dans de nombreux pays à faible revenu. Cependant, ces interventions se chevauchent souvent, exposant certaines populations à un apport chronique excessif en vitamine A par inadvertance 3,4. Ce double risque de carence et d’excès souligne la nécessité de disposer d’un biomarqueur capable d’évaluer avec précision le statut en vitamine A sur l’ensemble du spectre, de la carence à la toxicité, afin d’orienter l’évaluation du programme.
Les biomarqueurs de la vitamine A sont essentiels pour évaluer l’état nutritionnel. Les biomarqueurs les plus couramment utilisés sont les concentrations sériques de rétinol et de protéine de liaison au rétinol (RBP). Cependant, il est important de noter que ces biomarqueurs peuvent être temporairement supprimés par les infections et l’inflammation, ce qui peut réduire la spécificité des évaluations de la vitamine A dans certaines populations 5,6,7.
Alors que les échantillons de biopsie ou d’autopsie du foie sont considérés comme l’étalon-or pour évaluer le statut en vitamine A, l’indicateur indirect le plus sensible des réserves totales de vitamine A du foie est la méthode de dilution isotopique du rétinol (RID)8. Le RID fournit une estimation quantitative de l’état de la vitamine A sur l’ensemble du spectre, allant des réserves déficientes aux réserves excessives9. Dans la plupart des applications de recherche, la méthode RID consiste à administrer une dose orale de deutérium (2H) ou d’acétate de rétinyle marqué au 13C, qui se mélange ensuite aux réserves corporelles sur une période de 14 à 21 jours. Après cette période, un échantillon de sang est prélevé et le sérum est stocké à -80 °C. Le rapport entre le rétinol marqué et le rétinol total est ensuite analysé à l’aide de la spectrométrie de masse pour estimer les réserves de vitamine A10, en utilisant l’équationd’Olson 11, l’équation du bilan massique12 ou l’équation de Green13. Le protocole présenté dans cet article est valable pour l’administration d’acétate de rétinyle marqué au deutérium (2H) ou au 13C et est basé sur les travaux de Tang et al.14. L’objectif global de cette méthode est d’évaluer et de surveiller avec précision le statut de la vitamine A dans le corps11. Il s’agit d’une méthode puissante qui fournit une estimation quantitative des concentrations de vitamine A à travers un large éventail de statuts, de la carence à l’excèsde 15. Elle est plus exacte et plus précise que les autres méthodes, qui reposent souvent sur des mesures indirectes9.
Protocole
Le protocole a été approuvé par la Commission d’éthique du ministère de la Santé publique (n° 2015/02/550/CE/CNERSH/SP), et le consentement éclairé a été obtenu des parents/tuteurs.
REMARQUE : Parce que la vitamine A est sensible à la lumière, il est crucial que toutes les procédures soient effectuées dans la pénombre ou sous un éclairage fluorescent doré16. Les matériaux utilisés sont détaillés dans la table des matériaux.
1. Préparation des réactifs
- Chlorure de sodium (0,85 % p/v) : Dissoudre 0,85 g de NaCl dans de l’eau distillée dans une fiole jaugée de 100 mL. Remplissez jusqu’à la graduation avec de l’eau distillée et mélangez.
- Chloroforme-méthanol (2:1 v/v) : Transvaser 300 mL de chloroforme dans une fiole jaugée de 500 mL à l’aide d’un cylindre mesureur. Ajouter 150 ml de méthanol et mélanger.
- Phase A mobile pour HPLC : Acétonitrile/Tétrahydrofurane/eau ultrapure (50/20/30, v/v/v) : Transférer 500 mL d’acétonitrile dans une fiole jaugée de 1000 mL. Ajouter 200 mL de tétrahydrofurane et 300 mL d’eau. Mélangez la solution, filtrez-la à l’aide d’un filtre à membrane avec une taille de pores de 0,45 μm et du sonicate (amplitude 100 %, fréquence 40 kHz et durée 15 min).
- Phase B mobile pour HPLC : Acétonitrile/Tétrahydrofurane/eau ultrapure (50/44/6, v/v/v) : Transférer 500 mL d’acétonitrile dans une fiole jaugée de 1000 mL. Ajouter 440 ml de tétrahydrofurane et 60 ml d’eau. Mélangez la solution, filtrez-la à l’aide d’un filtre à membrane avec une taille de pores de 0,45 μm et soniquez.
2. Préparation des solutions étalons
- Préparez la solution mère en dissolvant 40 mg de l’étalon dans de l’éthanol dans une fiole jaugée de 100 ml, comme l’illustre le tableau 1. Remplissez jusqu’à la graduation avec le solvant et mélangez soigneusement.
- Solutions mères diluées : Préparez la solution mère diluée en transférant 1 mL de la solution mère dans une fiole jaugée de 50 mL, comme l’indique le tableau 2. Remplissez jusqu’à la marque de graduation avec le solvant approprié et mélangez soigneusement.
- Détermination de la concentration des solutions mères diluées : Placer une aliquote (1 mL) de la solution diluée dans un tube de quartz et mesurer son absorbance dans le spectrophotomètre à la longueur d’onde spécifiée (tableau 3) en utilisant de l’éthanol comme blanc. Calculez le à l’aide de la loi Lambert-Beer17. Assurez-vous que le spectrophotomètre est étalonné avant l’analyse en réchauffant l’instrument pendant 15 à 30 minutes, en sélectionnant la longueur d’onde souhaitée et en mettant l’instrument à zéro en plaçant le blanc dans le porte-échantillon. Calculez la concentration à l’aide de la formule suivante :
Concentration = (absorbance/coefficient d’absorption) x 106 (μg/dL)
REMARQUE : Pour convertir les valeurs des unités conventionnelles (μg/dL) en unités S.I. (μmol/L), multipliez la valeur conventionnelle par les facteurs de conversion suivants : 0,0304 pour l’acétate de rétinyle et 0,0349 pour le rétinol18. - Préparation des étalons de travail : À l’aide d’une pipette volumétrique, transvaser 2 mL des solutions mères diluées dans une fiole conique de 100 mL. Remplissez le ballon jusqu’à la graduation avec de l’éthanol, mélangez bien et fermez avec un bouchon.
- Pour déterminer la concentration exacte de chaque solution, évaluez la pureté de chaque composant à l’aide d’une HPLC équipée d’une colonne C18 et d’un détecteur à barrettes de diodes réglé sur 340 nm. Programmez la pompe pour qu’elle utilise la phase mobile A et la phase mobile B selon le calendrier indiqué dans le tableau 4. Assurez-vous que le système HPLC est calibré avant l’analyse en validant les différents composants tels que la pompe, le détecteur, l’échantillonneur automatique et les performances de l’ensemble du système.
- Transférez 1 mL des solutions mères diluées dans des flacons à sertir et injectez les échantillons dans le système HPLC selon la procédure normale. Déterminez la pureté à l’aide de l’équation suivante :
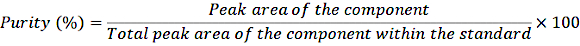
ÉQUATION 1
Avec cette correction de pureté, calculez la concentration exacte des différents composants dans la solution étalon.
- Préparation de l’étalon interne (acétate de rétinyle DO ~ 0,2) : À l’aide d’une pipette volumétrique, transvaser 30 ml de l’étalon de travail en acétate de rétinyle dans une fiole conique de 100 ml. Remplissez le ballon jusqu’à la graduation avec de l’éthanol, mélangez bien et fermez avec un bouchon.
- Préparation des solutions de travail : Ajouter 20 μg de rétinol non étiqueté à 10,00, 3,33, 1,00, 0,33 et 0,00 μg de rétinol étiqueté pour obtenir des rapports de rétinol étiqueté et non étiqueté de 0,500, 0,167, 0,050, 0,0167 et 0,00.
3. Analyse de l’échantillon
REMARQUE : Les échantillons de sérum utilisés dans cette étude ont été prélevés le 14e jour chez des enfants ayant reçu une dose orale (2 mg d’équivalents rétinol) de D8-rétinol dans le cadre d’une étude conçue pour surveiller et évaluer le statut en vitamine A des enfants au Cameroun.
- Extraction de rétinoïdes dans le sérum : Cette extraction est basée sur les travaux de Folch et al.19 tels que modifiés par Tang et al.14. Suivez les étapes décrites ci-dessous.
- Laisser décongeler doucement les échantillons de sérum congelés à température ambiante (20-25 °C) avant l’analyse. Aliquote 400 μL de sérum dans un tube de culture jetable de 16 x 100 mm. Ajouter 500 μL de solution saline à 0,85 %, 100 μL d’étalon interne et 5 mL de solution de chloroforme-méthanol (2:1 v/v).
- Vortex pendant 30 s et centrifugeuse à 1157 x g pendant 10 min à 4 °C. À l’aide d’une pipette Pasteur en verre, prélever délicatement la couche inférieure du chloroforme dans un tube de culture jetable de 13 x 100 mm. Sécher sous azote gazeux dans un bain-marie (40 °C) et remettre en suspension le résidu dans 100 μL d’éthanol. Vortex et sonicate pendant 30 s. Transférez l’échantillon dans un flacon à sertir avec un insert, fermez le puits et étiquetez. L’échantillon est prêt pour la collecte de rétinol HPLC.
- Effectuez la collecte de rétinol HPLC comme décrit ci-dessous.
- Injectez 70 μL de chaque échantillon de sérum dans un système HPLC équipé d’une colonne C18 et d’un détecteur à barrettes de diodes réglé à 340 nm. Programmez la pompe pour qu’elle fournisse les phases mobiles A et B à un débit constant de 1 mL/min, en suivant le calendrier indiqué dans le tableau 4.
- Avant d’injecter les échantillons de sérum, injectez 70 μL de la solution de travail de rétinol dans le système HPLC et enregistrez le temps de rétention du pic de rétinol. Ensuite, installez le collecteur de fractions pour recueillir la fraction de rétinol éluée dans une plage spécifiée dans un tube de 5 mL avec un bouchon en verre rodé. Dans ce cas, la fraction de rétinol a été collectée sur un intervalle de 3 minutes, de 7,5 à 10,5 minutes.
REMARQUE : La concentration de rétinol peut également être calculée au cours de cette étape à l’aide d’une courbe d’étalonnage des étalons de rétinol et du taux de récupération obtenu à partir de l’étalon interne.
- Effectuez la dérivation du rétinol comme décrit ci-dessous.
- Faites sécher la fraction de rétinol recueillie par HPLC sous azote gazeux dans un bain-marie à 40 °C pendant au moins 3 h. Ajouter de l’éthanol pour faciliter l’évaporation de l’humidité pendant le séchage (les échantillons doivent être complètement secs, car la dérivation est sensible à l’humidité). Ajouter 20 μL de BSTFA avec 10 % de TMCS dans le tube.
- Placez le tube dans un chauffe-moteur sec réglé à 70 °C et incubez pendant 30 min. À l’aide d’une pipette Pasteur en verre, transférez le mélange réactionnel dans un flacon à sertir avec un insert, fermez hermétiquement avec un capuchon à sertir à l’aide d’une pince à sertir et étiquetez. L’échantillon est maintenant prêt pour l’analyse GC/MS et peut être stocké dans un dessiccateur à 4 °C jusqu’à l’analyse.
- De plus, séchez un ensemble de 100 μL de solutions étalons de travail et dérivez comme décrit ci-dessus pour calibrer la GC/MS.
REMARQUE : La dérivation du rétinol à l’aide de BSTFA implique une réaction chimique où le groupe hydroxyle (-OH) du rétinol est remplacé par le groupe triméthylsilyle (-Si(CH3)3), formant ainsi du rétinyl triméthylsilyl éther. Ce processus améliore la volatilité et la stabilité du rétinol, ce qui le rend plus adapté à l’analyse GC/MS20.
- Analyse GC/MS : L’analyse GC/MS est effectuée à l’aide de la procédure décrite par Tang et al.14. Suivez les étapes décrites ci-dessous.
- Injecter 3 μL de l’échantillon de rétinol dérivé à l’aide d’un échantillonneur automatique dans le GC avec un injecteur froid sur colonne connecté par un connecteur à volume mort zéro à une colonne capillaire en silice fondue de 15 m x 0,25 mm de diamètre intérieur recouverte d’une phase stationnaire DB-1 d’une épaisseur de film de 0,25 μm.
- Programmez les températures du four à colonne et de l’injecteur sur colonne pour qu’elles passent de 50 °C à 285 °C à une vitesse de 15 °C/min, et réglez la température de l’interface GC/MS à 285 °C. Utilisez l’hélium comme gaz porteur pour éluer le dérivé triméthylsilyle du rétinol pendant environ 12 minutes.
- Détectez l’éluat de GC à l’aide d’un spectromètre de masse quadripolaire à l’aide d’une ionisation chimique d’ions négatifs de méthane de 0,5 torr, avec la température de la source d’ions réglée à 150 °C. Réglez le spectromètre de masse pour qu’il scanne entre 260 et 280 daltons.
4. Analyse des données
- Utilisez le logiciel d’analyse de données GC/MS.
- Extrayez tous les ions souhaités en fonction de leur rapport masse/charge (m/z), intégrez la surface du pic (utilisez l’intégration manuelle pour ajuster les points de début et de fin du pic) et transférez les résultats dans un fichier de tableur.
REMARQUE : Selon l’isotope utilisé, les ions souhaités seront les suivants : 268-270 m/z pour le rétinol natif ; 271-274 m/z pour le [2H4]-rétinol ; 278-280 m/z pour le [13C]-rétinol ; et 276-280 m/z pour le [2H8]-rétinol. - Calculez la somme des pics pour le rétinol marqué (ΣD) en ajoutant l’aire des pics à m/z 274, 275, 276, 277 et 278. Calculez la somme des pics pour le rétinol non marqué (ΣH) en ajoutant l’aire des pics à m/z 268, 269 et 270.
- Calculez l’enrichissement en rétinol marqué (D) à l’aide de l’équation suivante : D = ΣD/(ΣH + ΣD). Calculez la quantité de rétinol non étiqueté (H) à l’aide de l’équation suivante : H = 1 - D.
REMARQUE : La spectrométrie de masse par chromatographie en phase gazeuse à ionisation chimique négative de l’éther de rétinyle triméthylsilyle ne donne pas d’ion moléculaire mais un ion fragment majeur à m/z 268 à 271 pour le rétinol non marqué, à m/z 272 à 275 pour le D4-rétinol et à m/z 276 à 280 pour le D8-rétinol14. - Pour contrôler le système, calculez une équation de régression linéaire entre les rapports de poids des étalons d’étalonnage et les zones intégrées pour le rétinol marqué et le rétinol non marqué.
5. Estimation des réserves de vitamine A
REMARQUE : Cette étape permet d’évaluer le statut en vitamine A d’un individu.
- Calculer les réserves totales de vitamine A dans le foie à l’aide de l’équationd’Olson 11
Vitamine A Réserves totales du foie = F x Dose x [S x a x (H/D - 1)]
où F est un facteur de l’efficacité de l’absorption et du stockage de la dose administrée par voie orale (F = 0,50), La dose est la quantité de vitamine A marquée administrée par voie orale (μmol), S est un facteur qui corrige l’inégalité du rapport plasma/foie du rétinol marqué au rétinol non marqué (S = 0,65), a est un facteur qui corrige la perte irréversible de vitamine A marquée pendant la période de mélange ; Plus précisément, a = E-kt, où k est le taux catabolique fractionnel estimé du système (k = LN 2/32 jours pour les enfants), et t est le temps, exprimé en jours depuis la dose ; D/H est le rapport isotopique sérique du rétinol marqué et du rétinol non marqué, -1 corrige la contribution de la dose de vitamine A marquée au pool de vitamine A du corps entier. - Pour calculer les réserves totales de vitamine A (TBS), utilisez l’équation de Green13
SCT = Fa × S × (1/SAp)
où Fa est la fraction de la dose de VA marquée par voie orale absorbée et trouvée dans les réserves interchangeables de l’organisme au temps t, et S est le rapport entre l’activité spécifique du rétinol dans le sérum et celle dans les réserves au temps t (pour les enfants, Fa × S = 0,642 à 14 jours)21. SAp est la fraction de la dose sérique par dose molaire (c.-à-d. [rétinol marqué] / ([rétinol non marqué + rétinol marqué] dans le sérum) / dose orale de rétinol marqué (μmol)).
Résultats
L’injection de 3 μL d’un échantillon dérivé d’une solution séchée contenant environ 50 pM/μL d’étalons (rétinol et D 8-rétinol) dans la GC/MS n’a révélé aucun ion moléculaire mais a montré un ion fragmentaire majeur à m/z 268 pour le rétinol (figure 1) et à m/z 278 pour le D8-rétinol (figure 2). Cela indique que les ions moléculaires du rétinyltriméthylsilyléther formés, formés lors de la dérivation du rétinol et du D 8-rétinol, ne sont pas stables dans les conditions d’ionisation utilisées en GC/MS. Ils se décomposent en fragments plus petits, principalement par clivage alpha. Ce modèle de fragmentation commun implique la rupture de la liaison adjacente au groupe triméthylsilyléther. Le clivage alpha entraîne la perte du groupe triméthylsilyle (TMS, qui a une masse de 73 Da) et d’un atome d’hydrogène, conduisant à un ion fragmentaire d’une masse de 268 Da pour le rétinol et de 278 Da pour le D 8-rétinol22. Ce mécanisme permet d’identifier et de confirmer la présence de rétinol et de ses dérivés dans l’échantillon en analysant les ions de fragments spécifiques produits lors de la spectrométrie de masse. L’injection de mélanges de rétinol et de D8-rétinol a montré deux ions fragments majeurs à m/z 268 pour le rétinol et m/z 276 pour le D8-rétinol (Figure 3), indiquant la présence de ces composés dans l’échantillon. La courbe d’étalonnage a montré une excellente linéarité, comme l’indique un coefficient de corrélation élevé (Figure 4), montrant que la relation entre le rapport de crête et le rapport de poids a un modèle très droit et prévisible.
La réponse GC/MS obtenue à partir des injections d’échantillons de sérum (sérum d’enfants ayant reçu une dose orale de 2 mg d’équivalents rétinol de D8-rétinol ; Graphique 5) montre la présence de rétinol et de D8-rétinol, les deux principaux ions fragmentaires étant observés à m/z 268 et m/z 274. Les résultats obtenus après extraction des ions et intégration des zones de pics à m/z 274, 275, 276, 277 et 278 pour le D8-rétinol et à m/z 268, 269 et 270 pour le rétinol non marqué sont présentés dans le tableau 5. Ces résultats sont à intégrer dans l’équationd’Olson 11 ou l’équation de Green13 pour calculer les réserves de vitamine A dans l’organisme.
La technique de dilution des isotopes stables permet de mesurer les niveaux de vitamine A qui ne peuvent pas être obtenus par d’autres méthodes, ce qui permet d’évaluer avec précision le statut de la vitamine A. Cette méthode est précieuse pour les études nutritionnelles, les diagnostics cliniques et la recherche épidémiologique.
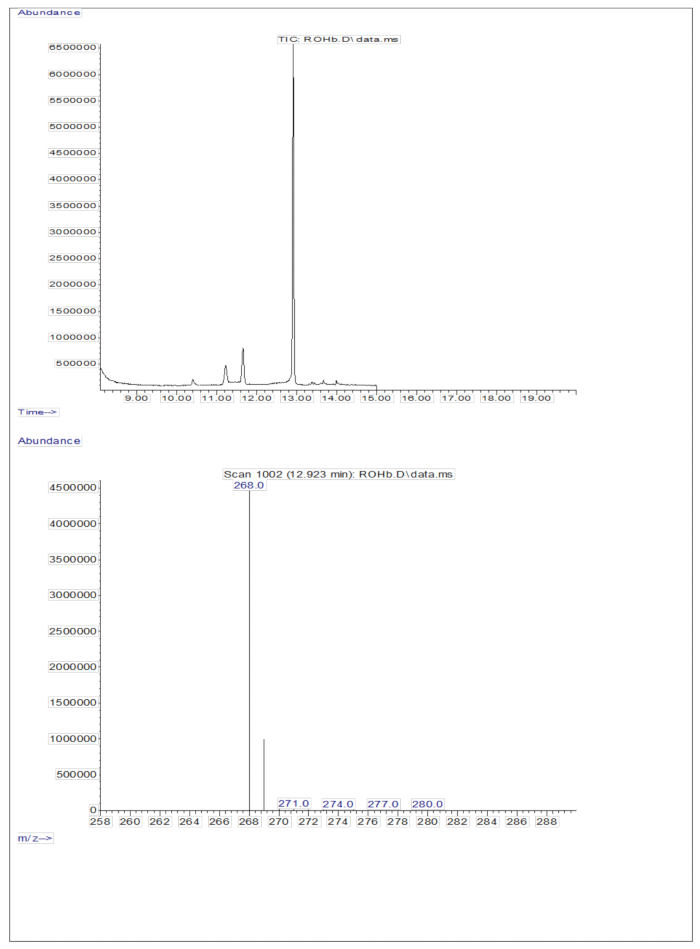
Figure 1 : Chromatogramme et spectre de masse du rétinol. La figure montre le chromatogramme de chromatographie en phase gazeuse/capture d’électrons de méthane par ionisation chimique négative et spectrométrie de masse (panneau supérieur) à partir de l’analyse de l’étalon de rétinol dérivé. Le panneau inférieur est un spectre de masse montrant m/z 268 pour le rétinol. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 2 : Chromatogramme et spectre de masse du D8-rétinol. La figure montre le chromatogramme de chromatographie en phase gazeuse/capture d’électrons de méthane par ionisation chimique négative et spectrométrie de masse (panneau du haut) à partir de l’analyse de l’étalon de rétinol D8 dérivé. Le panneau inférieur est un spectre de masse montrant m/z 278 pour le D8-rétinol. Veuillez cliquer ici pour voir une version agrandie de cette figure.

Figure 3 : Chromatogramme et spectre de masse d’un mélange de rétinol et de D8-rétinol. La figure montre le chromatogramme de chromatographie en phase gazeuse/capture d’électrons de méthane par ionisation chimique négative et spectrométrie de masse (panneau du haut) à partir de l’analyse d’un mélange dérivé d’étalons de rétinol et de D8-rétinol. Le panneau inférieur est un spectre de masse montrant m/z 268 pour le rétinol et m/z 276 pour le D8-rétinol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
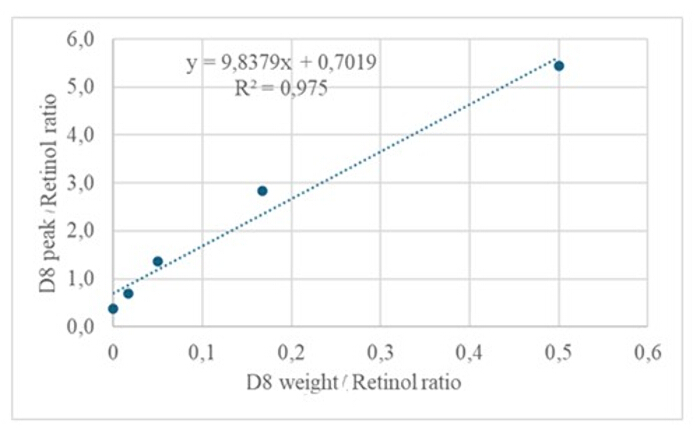
Figure 4 : Courbe d’étalonnage. Cette figure illustre la relation entre la réponse GC/MS et la concentration de rétinol non marqué et marqué. Il est décrit par l’équation y = 9,8379x + 0,7019, où y (les rapports de surface) représente la réponse de l’instrument, 9,8379 est la sensibilité, x (les rapports de poids) représente la concentration de l’analyte et 0,7019 est le signal de fond. Veuillez cliquer ici pour voir une version agrandie de cette figure.
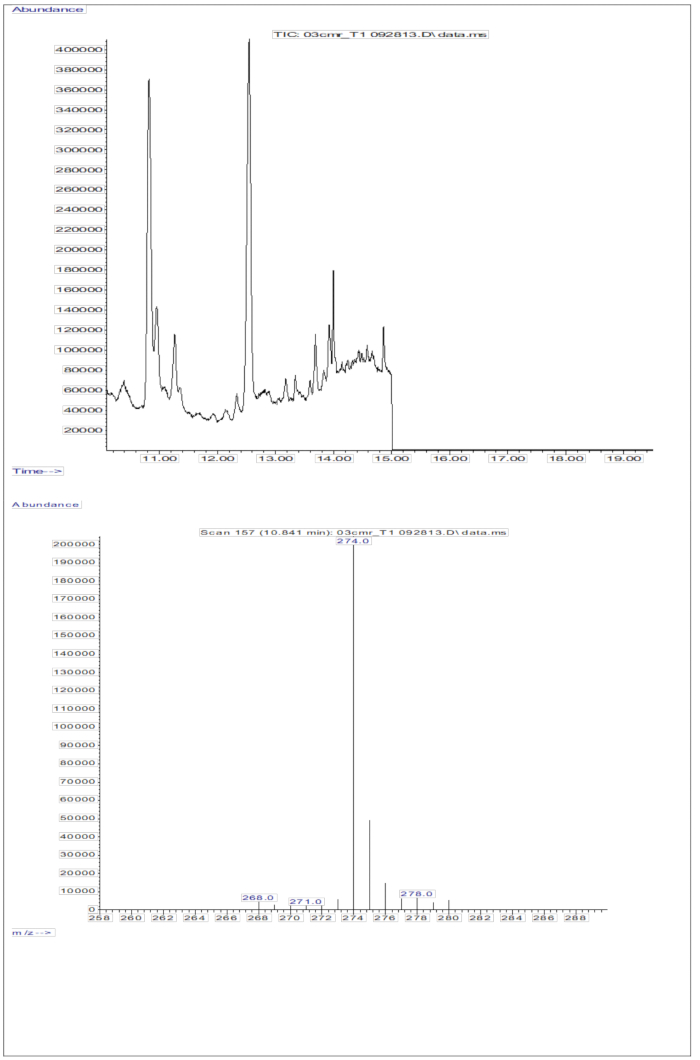
Figure 5 : Chromatogramme et spectre de masse de l’échantillon de sérum. Cette figure illustre la chromatographie par chromatographie en phase gazeuse/capture d’électrons de méthane, chromatogramme négatif par ionisation chimique-spectrométrie de masse (panneau du haut) à partir de l’analyse de la fraction de rétinol dérivé du sérum. Le panneau inférieur est un spectre de masse montrant m/z 274 pour le D8-rétinol. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Standard | Poids (mg) | Fiole jaugée (mL) | Solvant |
| Rétinol | 40 | 100 | Éthanol |
| Acétate de rétinyle | 40 | 100 | Éthanol |
| Acétate de rétinyle marqué au deutérium | 40 | 100 | Éthanol |
Tableau 1 : Préparation de la solution mère. Ce tableau montre comment préparer des solutions concentrées de rétinol et d’acétate de rétinyle marqué au deutérium, qui peuvent ensuite être diluées à des concentrations plus faibles pour de futures expériences.
| Standard | Solution mère (mL) | Fiole jaugée (mL) | Solvant |
| Rétinol | 1 | 50 | Éthanol |
| Acétate de rétinyle | 1 | 50 | Éthanol |
| Acétate de rétinyle marqué au deutérium | 1 | 50 | Éthanol |
Tableau 2 : Préparation des solutions mères diluées. Ce tableau montre comment préparer des solutions prêtes à l’emploi de rétinol et d’acétate de rétinyle marqué au deutérium.
| Standard | Longueur d’onde (nm) | E1%1 cm |
| Rétinol | 325 | 1850 |
| Acétate de rétinyle | 326 | 1550 |
Tableau 3 : Longueur d’onde et E1 % 1 cm (coefficient d’absorption).
| Temps (min) | Débit (mL/min) | Phase A mobile ( %) | Phase B mobile ( %) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Tableau 4 : Calendrier des phases mobiles HPLC. Ce tableau illustre la séquence et la durée prévues des différentes phases au cours de l’exécution chromatographique HPLC.
| SH | SD | D | H | |
| Sujet 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Sujet 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Sujet 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Sujet 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Sujet 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Sujet 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Sujet 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Sujet 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Sujet 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Sujet 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH : somme de l’aire de crête à m/z 268, 269 et 270 | ||||
| SD : somme de l’aire de crête à m/z 274, 275, 276, 277 et 278 | ||||
| D : enrichissement en rétinol marqué | ||||
| H : taux de rétinol non étiqueté |
Tableau 5 : Résultats de la GC/MS de la fraction sérique de rétinol dérivé. Ce tableau présente les résultats GC/MS nécessaires au calcul de la réserve corporelle totale de vitamine A. H est la somme de l’aire du pic à m/z 268, 269 et 270 ; D est la somme de l’aire du pic à m/z 274, 275, 276, 277 et 278 ; D est l’enrichissement en rétinol marqué ; H est le niveau de rétinol non marqué ; TBS est un magasin de vitamine A pour tout le corps.
Discussion
La mise en œuvre réussie de ce protocole repose sur l’exécution efficace de chaque étape. Une bonne préparation des solutions et des normes est cruciale pour garantir l’exactitude et la fiabilité des données collectées. Les procédures décrites dans le protocole ont été testées dans divers contextes et conviennent à l’obtention de solutions et de normes qui répondent aux objectifs de l’analyse des échantillons.
L’analyse des échantillons commence par l’extraction et la séparation du rétinol dans le sérum. Il est essentiel de stocker les échantillons de sérum à -80 °C jusqu’à l’analyse pour prévenir la dégradation de la vitamine A. De plus, il est nécessaire de travailler dans la pénombre16. La procédure HPLC utilisée pour collecter la fraction de rétinol est conçue pour séparer le rétinol des autres composants liposolubles afin d’éviter toute interférence dans le processus de dérivatisation. Il permet également d’exécuter des centaines d’échantillons sans vider la colonne.
La fraction de rétinol recueillie à partir de la HPLC est dérivée avec du BSTFA à 70 °C pendant 30 min. L’étape de dérivatisation est essentielle pour améliorer la volatilité du rétinol et sa détectabilité dans les GC-MS. Comme il est sensible à l’eau, il est crucial de sécher complètement l’échantillon avant la dérivatisation et de laisser suffisamment de temps pour que la réaction de dérivatisation se produise avant l’analyse GC-MS. Il a été remarqué que le processus de dérivatisation avec BSTFA est très doux et efficace par rapport à celui utilisé avec le N-méthyl-N-(tert-butyldiméthylsilyl) trifluoroacétamide (MTBSTFA)23,24 et fournit un pic très net pour le rétinol dérivé, sans résidus ni pics de fond dans la plage de masse balayée14. Le rétinol dérivé dans un flacon scellé peut être conservé dans un dessiccateur à 4 °C pendant 1 mois sans dégradation14.
Pour l’analyse GC-MS, il est essentiel d’assurer un étalonnage et une maintenance corrects de la colonne, et d’optimiser le volume d’injection, la température et les débits. Les conditions utilisées ici avec l’injection sur colonne ont montré des résultats bons et fiables14. Au cours de l’analyse GC-MS du rétinol deutéré et non marqué, Tang et coll.14 ont observé que les pics de rétinol deutéré apparaissaient à la fois dans la dose administrée et dans le sérum des sujets ayant reçu la dose. Cette tendance n’a pas été observée avec le rétinol non marqué. Par conséquent, ils ont conclu que les pics de rétinol deutéré sont préformés dans la dose et ne résultent pas d’une fragmentation dans le spectromètre de masse, suggérant que le rétinol deutéré conserve sa structure tout au long du processus métabolique, fournissant un marqueur fiable pour le suivi du rétinol dans les études biologiques. L’enrichissement en rétinol deutéré dans le sérum après l’administration de 2 mg de rétinol D8 chez les enfants d’âge préscolaire a commencé à augmenter à 7 h et a atteint son pic à 14 jours, ce qui correspond au temps de prélèvement optimal plus court25. Dans 200 μL de sérum humain, le pourcentage minimum détectable d’enrichissement en rétinol est de 0,01 %, ce qui démontre que la méthode est suffisamment sensible pour analyser des échantillons de sérum prélevés sur des sujets présentant un large éventail de statuts en vitamine A14.
Bien que la technique de dilution des isotopes stables présentée ici offre des avantages significatifs pour évaluer le statut en vitamine A, il convient de noter que cette méthode nécessite un équipement sophistiqué et une expertise technique, ce qui la rend coûteuse et moins accessible pour une utilisation courante dans de nombreux contextes26. Par conséquent, il est essentiel de tenir compte de cette limitation lors de la planification de l’utilisation de cette technique.
Déclarations de divulgation
Ce manuscrit fait partie d’une série intitulée Utilisation de la méthode de dilution des isotopes du rétinol pour évaluer les réserves corporelles de vitamine A et la concentration hépatique de vitamine A, soutenue par l’AIEA.
Remerciements
Nous avons appris ce protocole lors d’une bourse au Laboratoire des caroténoïdes et de la santé, Jean Mayer USDA Human Nutrition Research Center on Aging, Tufts University, Boston, États-Unis, sous la supervision de Guangwen Tang et avec le soutien financier de l’Agence internationale de l’énergie atomique (AIEA).
matériels
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Références
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon