Method Article
ניתוח GC-MS של העשרת דאוטריום של רטינול בסרום והערכת סך מאגרי הגוף של ויטמין A
In This Article
Summary
שיטה זו כוללת מיצוי רטינול מסרום, הפרדתו באמצעות HPLC וקביעת איזוטופים של רטינול מסומנים ולא מסומנים באמצעות GC-MS. היחס בין רטינול מסומן ללא תווית משמש להערכת סך מאגרי ויטמין A בגוף.
Abstract
שיטה זו מתארת את קביעת העשרת הרטינול בסרום והערכת מאגרי ויטמין A בגוף. התהליך כולל מיצוי רטינול מ-0.4 מ"ל של סרום באמצעות 0.5 מ"ל של תמיסת מלח 0.85%, 100 מיקרוליטר של תמיסה סטנדרטית פנימית ו-5 מ"ל של תמיסת כלורופורם-מתנול (2:1 v/v). לאחר צנטריפוגה והסרת שכבת הכלורופורם התחתונה, התערובת מיובשת תחת חנקן ומשעה מחדש ב-0.1 מ"ל אתנול, ושבר הרטינול מופרד ממרכיבים אחרים באמצעות מערכת HPLC המצוידת בעמודת PE C18. ניתן לאסוף את שבר הרטינול באופן ידני או עם אספן שברים. לאחר מכן, חלק הרטינול מיובש תחת חנקן ונגזר עם O-bis (trimethylsilyl) trifluoroacetamide (BSTFA) המכיל 10% trimethylchlorosilane. לבסוף, איזוטופים של רטינול מסומנים ולא מסומנים מכומתים באמצעות מערכת GC-MS המצוידת בעמודה נימית מתיל סילוקסן 19091z-431 HP-1, המשתמשת ביינון כימי שלילי ללכידת אלקטרונים עם הליום כגז הנשא ומתאן כחומר היינון. לאחר מכן משתמשים ביחס בין רטינול מסומן ללא תווית במשוואות אולסון, גרין או מאזן מסה כדי להעריך את מאגרי ויטמין A.
Introduction
ויטמין A הוא חומר מזין חיוני הדרוש למערכת הראייה ולשמירה על תפקוד התאים לגדילה, שלמות האפיתל, ייצור תאי דם אדומים, חסינות ורבייה1. מחסור בוויטמין A הוא בעיה חמורה של בריאות הציבור בכל רחבי העולם, המשפיעה על יותר מ-100 מדינות. זה משפיע באופן לא פרופורציונלי על ילדים צעירים ונשים בהריון במדינות בעלות הכנסה נמוכה. כ-190 מיליון ילדים ברחבי העולם סובלים ממחסור בוויטמין A, מה שהופך אותו לנושא קריטי לבריאות הציבור והתפתחות הילד2.
בתגובה למצב זה, מספר תוכניות, כולל תוספת ויטמין A עם חלוקה דו-שנתית של מינונים גבוהים של ויטמין A לילדים מתחת לגיל 5 והעשרת ויטמין A של מוצרי מזון מסוימים, יושמו במשך עשרות שנים במדינות רבות בעלות הכנסה נמוכה. עם זאת, התערבויות אלה חופפות לעתים קרובות, וחושפות אוכלוסיות מסוימות לצריכה מוגזמת של ויטמין A כרוניבשוגג 3,4. הסיכון הכפול הזה למחסור ועודף מדגיש את הצורך בסמן ביולוגי שיכול להעריך במדויק את מצב ויטמין A על פני כל הספקטרום, ממחסור ועד רעילות, כדי להנחות את הערכת התוכנית.
סמנים ביולוגיים של ויטמין A חיוניים להערכת המצב התזונתי. הסמנים הביולוגיים הנפוצים ביותר הם ריכוזי רטינול וחלבון קושר רטינול (RBP) בסרום. עם זאת, חשוב לציין כי ניתן לדכא את הסמנים הביולוגיים הללו באופן זמני על ידי זיהומים ודלקות, מה שעלול להפחית את הספציפיות של הערכות ויטמין A באוכלוסיות מסוימות 5,6,7.
אמנם ביופסיית כבד או נתיחה שלאחר המוות נחשבות לסטנדרט הזהב להערכת מצב ויטמין A, אבל האינדיקטור העקיף הרגיש ביותר לסך מאגרי ויטמין A בכבדהוא שיטת דילול איזוטופים של רטינול (RID). RID מספק הערכה כמותית של מצב ויטמין A על פני כל הספקטרום, החל ממחסור ועד לעודף מאגרים9. ברוב יישומי המחקר, שיטת RID כוללת מתן מנה פומית של דאוטריום (2H) או 13רטיניל אצטט עם תווית C, אשר לאחר מכן מתערבב עם מאגרי הגוף במשך תקופה של 14 עד 21 יום. לאחר תקופה זו נאספת דגימת דם, והסרום מאוחסן בטמפרטורה של -80 מעלות צלזיוס. לאחר מכן מנותח היחס בין המסומן לסך הרטינול באמצעות ספקטרומטריית מסה כדי להעריך את מאגרי ויטמין A10, תוך שימוש במשוואת אולסון11, משוואת מאזן המסה12 או משוואת גרין13. הפרוטוקול המוצג במאמר זה תקף למתן רטיניל אצטט עם תווית C (2H) או 13C ומבוסס על עבודתם של Tang et al.14. המטרה הכוללת של שיטה זו היא להעריך ולנטר במדויק את מצב ויטמין A בגוף11. זוהי שיטה רבת עוצמה המספקת הערכה כמותית של ריכוזי ויטמין A על פני ספקטרום רחב של מצבים, ממחסור ועד עודף15. זה מדויק ומדויק יותר משיטות אחרות, שלעתים קרובות מסתמכות על אמצעים עקיפים9.
Protocol
הפרוטוקול אושר על ידי ועדת האתיקה של משרד הבריאות (מס' 2015/02/550/CE/CNERSH/SP), והתקבלה הסכמה מדעת מההורים/אפוטרופוסים.
הערה: מכיוון שוויטמין A רגיש לאור, חיוני שכל ההליכים יבוצעו באור עמום או בתאורת פלורסנט זהב16. החומרים המשמשים מפורטים בטבלת החומרים.
1. הכנת ריאגנטים
- נתרן כלורי (0.85% w/v): ממיסים 0.85 גרם NaCl במים מזוקקים בבקבוק נפח של 100 מ"ל. ממלאים עד לסיום הלימודים במים מזוקקים ומערבבים.
- כלורופורם-מתנול (2:1 v/v): מעבירים 300 מ"ל של כלורופורם לבקבוק נפחי של 500 מ"ל עם גליל מדידה. מוסיפים 150 מ"ל מתנול ומערבבים.
- שלב נייד A ל-HPLC: אצטוניטריל/טטרהידרופורן/מים אולטרה-טהורים (50/20/30, v/v/v): העברת 500 מ"ל אצטוניטריל לבקבוק נפח של 1000 מ"ל. הוסף 200 מ"ל טטרהידרופורן ו -300 מ"ל מים. מערבבים את התמיסה, מסננים אותה באמצעות מסנן ממברנה בגודל נקבוביות של 0.45 מיקרומטר, וסוניקט (משרעת 100%, תדר 40 קילוהרץ ומשך 15 דקות).
- שלב ב' נייד ל-HPLC: אצטוניטריל/טטרהידרופורן/מים טהורים במיוחד (50/44/6, v/v/v): העברת 500 מ"ל אצטוניטריל לבקבוק נפח של 1000 מ"ל. הוסף 440 מ"ל טטרהידרופוראן ו -60 מ"ל מים. מערבבים את התמיסה, מסננים אותה באמצעות פילטר ממברנה בגודל נקבוביות של 0.45 מיקרומטר וסוניקט.
2. הכנת פתרונות סטנדרטיים
- הכן את תמיסת המלאי על ידי המסת 40 מ"ג מהתקן באתנול בבקבוק נפח של 100 מ"ל, כפי שמוצג בטבלה 1. ממלאים עד לסימון הסיום בממס ומערבבים היטב.
- פתרונות מלאי מדולל: הכן את תמיסת המלאי המדולל על ידי העברת 1 מ"ל מתמיסת המלאי לבקבוק נפח של 50 מ"ל, כפי שמוצג בטבלה 2. ממלאים עד לסימון הסיום בממס המתאים ומערבבים היטב.
- קביעת ריכוז תמיסות מלאי מדוללות: הנח אליקוט (1 מ"ל) של התמיסה המדוללת בצינור קוורץ ומדוד את ספיגתו בספקטרופוטומטר באורך הגל שצוין (טבלה 3) באמצעות אתנול כריק. חשב את השימוש בחוק למברט-ביר17. ודא שהספקטרופוטומטר מכויל לפני הניתוח על ידי חימום המכשיר למשך 15-30 דקות, בחירת אורך הגל הרצוי ואיפוס המכשיר על ידי הנחת הריק במחזיק הדגימה. חשב את הריכוז באמצעות הנוסחה הבאה:
ריכוז = (מקדם ספיגה/ספיגה) x 106 (מיקרוגרם/ד"ל)
הערה: כדי להמיר ערכים מיחידות קונבנציונליות (μg/dL) ליחידות SI (μmol/L), הכפל את הערך המקובל בגורמי ההמרה הבאים: 0.0304 עבור רטיניל אצטט ו-0.0349 עבור רטינול18. - הכנת תקני עבודה: בעזרת פיפטה נפחית מעבירים 2 מ"ל מתמיסות המלאי המדוללות לבקבוק חרוטי של 100 מ"ל. ממלאים את הבקבוק עד לסימן הסיום באתנול, מערבבים היטב וסוגרים עם פקק.
- כדי לקבוע את הריכוז המדויק של כל תמיסה, הערך את הטוהר של כל רכיב באמצעות HPLC המצויד בעמודת C18 וגלאי מערך דיודות המוגדר ל-340 ננומטר. תכנת את המשאבה לשימוש בשלב נייד A ושלב B נייד בהתאם ללוח הזמנים המוצג בטבלה 4. ודא שמערכת ה-HPLC מכוילת לפני הניתוח על ידי אימות רכיבים שונים כגון המשאבה, הגלאי, הדגימה האוטומטית וביצועי המערכת כולה.
- העבירו 1 מ"ל מתמיסות המלאי המדוללות לבקבוקוני לחיצה והזריקו את הדגימות למערכת HPLC בהתאם לנוהל הרגיל. קבע את הטוהר באמצעות המשוואה הבאה:
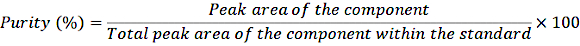
משוואה 1
עם תיקון זה לטוהר, חשב את הריכוז המדויק של הרכיבים השונים בתמיסה הסטנדרטית.
- הכנת תקן פנימי (רטיניל אצטט OD ~ 0.2): בעזרת פיפטה נפחית מעבירים 30 מ"ל מתקן העבודה רטיניל אצטט לבקבוק חרוטי של 100 מ"ל. ממלאים את הבקבוק עד לסימן הסיום באתנול, מערבבים היטב וסוגרים עם פקק.
- הכנת פתרונות עבודה: הוסף 20 מיקרוגרם של רטינול ללא תווית ל-10.00, 3.33, 1.00, 0.33 ו-0.00 מיקרוגרם של רטינול מתויג כדי לספק יחסי רטינול מסומנים ולא מסומנים של 0.500, 0.167, 0.050, 0.0167 ו-0.00.
3. ניתוח מדגם
הערה: דגימות הסרום ששימשו במחקר זה נאספו ביוםה-14 מילדים שקיבלו מינון פומי (שווה ערך ל-2 מ"ג רטינול) של D8-רטינול כחלק ממחקר שנועד לנטר ולהעריך את מצב ויטמין A של ילדים בקמרון.
- מיצוי רטינואידים בסרום: מיצוי זה מבוסס על עבודתם של Folch et al.19 כפי ששונה על ידי Tang et al.14. בצע את השלבים המתוארים להלן.
- אפשר לדגימות סרום קפואות להפשיר בעדינות בטמפרטורת החדר (20-25 מעלות צלזיוס) לפני הניתוח. הכניסו 400 מיקרוליטר של סרום לתוך צינור תרבית חד פעמי בגודל 16 x 100 מ"מ. הוסף 500 מיקרוליטר של 0.85% מי מלח בתוספת 100 מיקרוליטר של תקן פנימי ו-5 מ"ל של תמיסת כלורופורם-מתנול (2:1 v/v).
- מערבולת למשך 30 שניות וצנטריפוגה ב-1157 x גרם למשך 10 דקות ב-4 מעלות צלזיוס. בעזרת פיפטת פסטר מזכוכית, הסר בזהירות את השכבה התחתונה של הכלורופורם לצינור תרבית חד פעמי בגודל 13 על 100 מ"מ. יבש תחת גז חנקן באמבט מים (40 מעלות צלזיוס) והשהה מחדש את השאריות ב-100 מיקרוליטר אתנול. מערבולת וסוניקט למשך 30 שניות. העבירו את הדגימה לבקבוקון לחיצה עם תוספת, סגרו את הבאר ותווית. המדגם מוכן לאיסוף רטינול HPLC.
- בצע איסוף רטינול HPLC כמתואר להלן.
- הזרקת 70 מיקרוליטר מכל דגימת סרום למערכת HPLC המצוידת בעמודת C18 וגלאי מערך דיודות המוגדר ל-340 ננומטר. תכנת את המשאבה לספק שלבים ניידים A ו-B בקצב זרימה קבוע של 1 מ"ל לדקה, בהתאם ללוח הזמנים המוצג בטבלה 4.
- לפני הזרקת דגימות הסרום, יש להזריק 70 מיקרוליטר מתמיסת העבודה של הרטינול למערכת HPLC ולרשום את זמן השמירה של שיא הרטינול. לאחר מכן, הגדר את אספן השברים כדי לאסוף את שבר הרטינול המופק בטווח מוגדר בצינור של 5 מ"ל עם פקק זכוכית קרקע. במקרה זה, חלק הרטינול נאסף במרווח של 3 דקות, בין 7.5-10.5 דקות.
הערה: ניתן לחשב את ריכוז הרטינול גם בשלב זה באמצעות עקומת כיול של תקני רטינול וקצב ההתאוששות המתקבל מהתקן הפנימי.
- בצע נגזרת של רטינול כמתואר להלן.
- יבש את חלק הרטינול שנאסף מ-HPLC תחת גז חנקן באמבט מים ב-40 מעלות צלזיוס למשך 3 שעות לפחות. הוסף אתנול כדי להקל על אידוי הלחות במהלך הייבוש (הדגימות צריכות להיות יבשות לחלוטין, מכיוון שהנגזרת רגישה ללחות). הוסף 20 מיקרוליטר של BSTFA עם 10% TMCS לשפופרת.
- הנח את הצינור בתנור בלוק יבש המוגדר ל-70 מעלות צלזיוס ודגר למשך 30 דקות. בעזרת פיפטת פסטר מזכוכית, העבירו את תערובת התגובה לבקבוקון מלחץ עם תוספת, אטמו היטב עם מכסה לחיצה בעזרת מלחץ כובע ותווית. הדגימה מוכנה כעת לניתוח GC/MS, וניתן לאחסן אותה בחומר ייבוש בטמפרטורה של 4 מעלות צלזיוס עד לניתוח.
- בנוסף, יבש סט של 100 μL של תמיסות סטנדרטיות עובדות ונגזר כמתואר לעיל כדי לכייל את ה-GC/MS.
הערה: הנגזרת של רטינול באמצעות BSTFA כרוכה בתגובה כימית שבה קבוצת ההידרוקסיל (-OH) של הרטינול מוחלפת בקבוצת טרימתילסיליל (-Si(CH3)3), ויוצרת אתר רטיניל טרימתילסיליל. תהליך זה משפר את התנודתיות והיציבות של הרטינול, מה שהופך אותו למתאים יותר לניתוח GC/MS20.
- ניתוח GC/MS: ניתוח GC/MS מבוצע באמצעות ההליך המתואר על ידי Tang et al.14. בצע את השלבים המתוארים להלן.
- הזרקו 3 μL של דגימת הרטינול הנגזרת באמצעות דגימה אוטומטית לתוך ה-GC עם מזרק קריר על העמודה המחובר דרך מחבר נפח מת אפס לעמוד נימי סיליקה מותכים בקוטר פנימי של 15 מ' x 0.25 מ"מ המצופה בשלב נייח DB-1 בעובי סרט של 0.25 מיקרומטר.
- תכנת את תנור העמודה ואת טמפרטורות המזרק על העמודה כך שיגדלו מ-50 מעלות צלזיוס ל-285 מעלות צלזיוס בקצב של 15 מעלות צלזיוס/דקה, והגדר את טמפרטורת ממשק ה-GC/MS ל-285 מעלות צלזיוס. השתמש בהליום כגז הנשא כדי לסלק את נגזרת הטרימתיל-סיליל של רטינול במשך כ-12 דקות.
- זהה את ה-GC עם ספקטרומטר מסה מרובע באמצעות יינון כימי של יונים שליליים של 0.5 טור, כאשר טמפרטורת מקור היונים מוגדרת ל-150 מעלות צלזיוס. הגדר את ספקטרומטר המסה לסרוק בין 260 ל-280 דלטונים.
4. ניתוח נתונים
- השתמש בתוכנת ניתוח הנתונים GC/MS.
- חלץ את כל היונים הרצויים על סמך יחסי המסה למטען (m/z) שלהם, שלב את שטח השיא (השתמש באינטגרציה ידנית כדי להתאים את נקודות ההתחלה והסיום של השיא) והעביר את התוצאות לקובץ גיליון אלקטרוני.
הערה: בהתאם לאיזוטופ המשמש, היונים הרצויים יהיו כדלקמן: 268-270 m/z עבור רטינול מקורי; 271-274 m/z עבור [2H4]-רטינול; 278-280 m/z עבור [13C]-רטינול; ו-276-280 m/z עבור [2H8]-רטינול. - חשב את סכום הפסגות עבור רטינול מסומן (ΣD) על ידי הוספת שטח שיא ב-m/z 274, 275, 276, 277 ו-278. חשב את סכום הפסגות עבור רטינול לא מסומן (ΣH) על ידי הוספת שטח שיא ב-m/z 268, 269 ו-270.
- חשב את ההעשרה של רטינול מסומן (D) באמצעות המשוואה הבאה: D = ΣD/(ΣH + ΣD). חשב את כמות הרטינול הלא מסומן (H) באמצעות המשוואה הבאה: H = 1 - D.
הערה: כרומטוגרפיה של גז לכידת אלקטרונים ספקטרומטריית מסה של יינון כימי שלילי של אתר רטיניל טרימתיל-סיליל אינה נותנת יון מולקולרי אלא יון שבר עיקרי ב-m/z 268 עד 271 עבור רטינול לא מסומן, ב-m/z 272 עד 275 עבור D4-רטינול, וב-m/z 276 עד 280 עבור D8-רטינול14. - כדי לשלוט במערכת, חשב משוואת רגרסיה ליניארית בין יחסי המשקל של תקני הכיול לבין האזורים המשולבים עבור רטינול מסומן ורטינול לא מסומן.
5. הערכת מאגרי ויטמין A
הערה: שלב זה מאפשר להעריך את מצב ויטמין A של האדם.
- חישוב סך מאגרי הכבד של ויטמין A באמצעות משוואת אולסון11
מאגרי הכבד הכוללים של ויטמין A = F x מינון x [S x a x (H/D - 1)]
כאשר F הוא גורם ליעילות הספיגה והאחסון של המינון הניתן דרך הפה (F = 0.50), המינון הוא כמות ויטמין A המסומן הניתן דרך הפה (μmol), S הוא גורם המתקן את אי השוויון בין הפלזמה לכבד היחס בין רטינול מסומן לרטינול ללא תווית (S = 0.65), a הוא גורם המתקן אובדן בלתי הפיך של ויטמין A המסומן במהלך תקופת הערבוב; באופן ספציפי, A = E-kt, כאשר K הוא הקצב הקטבולי החלקי המשוער של המערכת (k = ln 2/32 ימים לילדים), ו-t הוא זמן, מבוטא כימים מאז המינון; D/H הוא היחס האיזוטופי בסרום בין רטינול מסומן לרטינול שאינו מסומן, -1 מתקן את תרומת המינון של ויטמין A המסומן למאגר ויטמין A הכולל בגוף. - לחישוב סך מאגרי הגוף של ויטמין A (TBS) השתמשו במשוואה הירוקה13
TBS = Fa × S × (1/SAp)
כאשר Fa הוא החלק של המינון המסומן דרך הפה של VA הנספג ונמצא במאגרי האחסון הניתנים להחלפה של הגוף בזמן t, ו-S הוא היחס בין הפעילות הספציפית לרטינול בסרום לזו שבמאגרים בזמן t (לילדים, Fa × S = 0.642 ב-14 ימים)21. SAp הוא חלק המינון בסרום למינון מיקרומול (כלומר, [רטינול מסומן] / ([ללא תווית + רטינול מסומן] בסרום) / מינון אוראלי של רטינול מסומן (μmol)).
תוצאות
הזרקת 3 מיקרוליטר של דגימה נגזרת של תמיסה מיובשת המכילה כ-50 pM/μL של קליברנטים (רטינול ו-D 8-רטינול) לתוך ה-GC/MS לא הראתה יון מולקולרי אך הציגה יון מקטע עיקרי ב-m/z 268 עבור רטינול (איור 1) ו-m/z 278 עבור D8-רטינול (איור 2). זה מצביע על כך שהיונים המולקולריים של אתר רטיניל טרימתילסיליל, שנוצרו במהלך הנגזרת של רטינול ו-D 8-רטינול, אינם יציבים בתנאי היינון המשמשים ב-GC/MS. הם מתפרקים לשברים קטנים יותר, בעיקר באמצעות מחשוף אלפא. דפוס פיצול נפוץ זה כרוך בשבירת הקשר הסמוך לקבוצת האתר trimethylsilyl. מחשוף האלפא מביא לאובדן קבוצת הטרימתילסיליל (TMS, בעלת מסה של 73 Da) ואטום מימן, מה שמוביל לשבר יון עם מסה של 268 Da לרטינול ו-278 Da ל-D 8-רטינול 22. מנגנון זה מסייע בזיהוי ואישור נוכחותו של רטינול ונגזרותיו בדגימה על ידי ניתוח יוני השבר הספציפיים המיוצרים במהלך ספקטרומטריית מסה. הזרקת תערובות של רטינול ו-D8-רטינול הראתה שני יוני שבר עיקריים ב-m/z 268 עבור רטינול ו-m/z 276 עבור D8-רטינול (איור 3), מה שמצביע על נוכחות של תרכובות אלה בדגימה. עקומת הכיול הציגה ליניאריות מצוינת, כפי שמצוין על ידי מקדם מתאם גבוה (איור 4), המראה כי לקשר בין יחס שיא ליחס משקל יש דפוס ישר וצפוי מאוד.
תגובת GC/MS שהתקבלה מהזרקות של דגימות סרום (סרום מילדים שקיבלו מינון פומי של 2 מ"ג רטינול שווה ערך ל-D8-רטינול; איור 5) מראה נוכחות של רטינול ו-D8-רטינול, כאשר שני יוני השבר העיקריים נצפו ב-m/z 268 ו-m/z 274. תוצאות שהתקבלו לאחר מיצוי יונים ואינטגרציה של אזורי שיא ב-m/z 274, 275, 276, 277 ו-278 עבור D8-רטינול וב-m/z 268, 269 ו-270 עבור רטינול לא מסומן מוצגות בטבלה 5. תוצאות אלה אמורות להיות משולבות במשוואת אולסון11 או במשוואה הירוקה13 כדי לחשב את מאגרי ויטמין A בגוף.
טכניקת דילול האיזוטופים היציבה מספקת מדידות של רמות ויטמין A שלא ניתן להשיג בשיטות אחרות, ומאפשרת הערכות מדויקות של מצב ויטמין A. שיטה זו חשובה למחקרים תזונתיים, אבחון קליני ומחקר אפידמיולוגי.
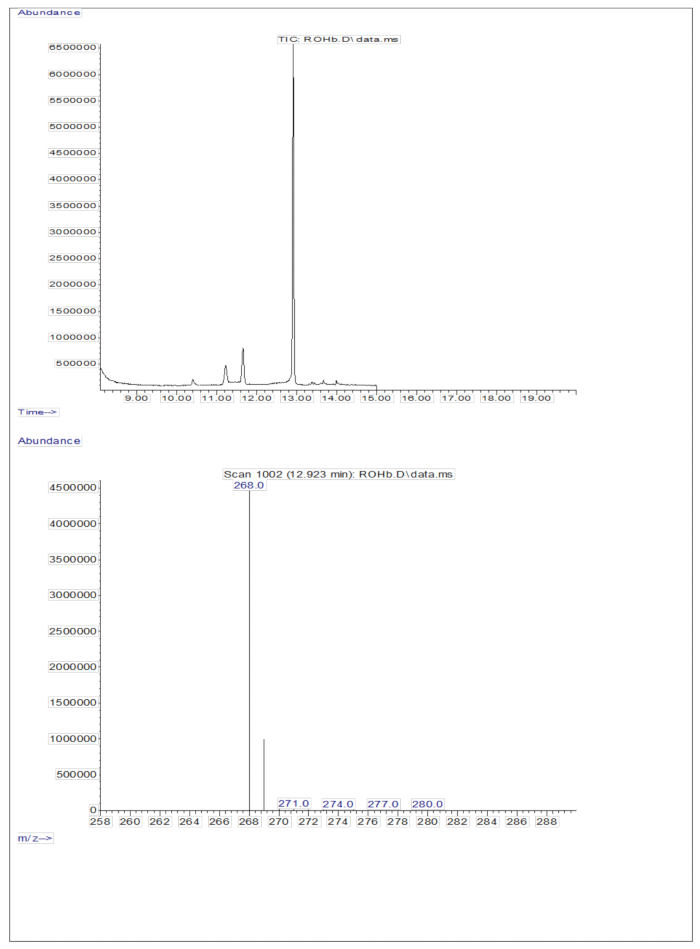
איור 1: כרומטוגרמה וספקטרום מסה של רטינול. האיור מציג את כרומטוגרפיית הגז/אלקטרון מתאן לוכד כרומטוגרמה של ספקטרומטריית מסה כימית שלילית (פאנל עליון) מניתוח תקן הרטינול הנגזר. הפאנל התחתון הוא ספקטרום מסה המציג m/z 268 לרטינול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 2: כרומטוגרמה וספקטרום מסה של D8-רטינול. האיור מציג את כרומטוגרפיית הגז/אלקטרון מתאן לוכד כרומטוגרמה של ספקטרומטריית מסה כימית שלילית (פאנל עליון) מניתוח תקן D8-רטינול הנגזר. הפאנל התחתון הוא ספקטרום מסה המציג m/z 278 עבור D8-רטינול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.

איור 3: כרומטוגרמה וספקטרום מסה של תערובת רטינול ו-D8-רטינול. האיור מציג את כרומטוגרפיית הגז / אלקטרון מתאן לוכד כרומטוגרמה שלילית של יינון כימי - ספקטרומטריית מסה (פאנל עליון) מניתוח של תערובת נגזרת של תקני רטינול ו-D8-רטינול. הפאנל התחתון הוא ספקטרום מסה המציג m/z 268 עבור רטינול ו-m/z 276 עבור D8-רטינול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
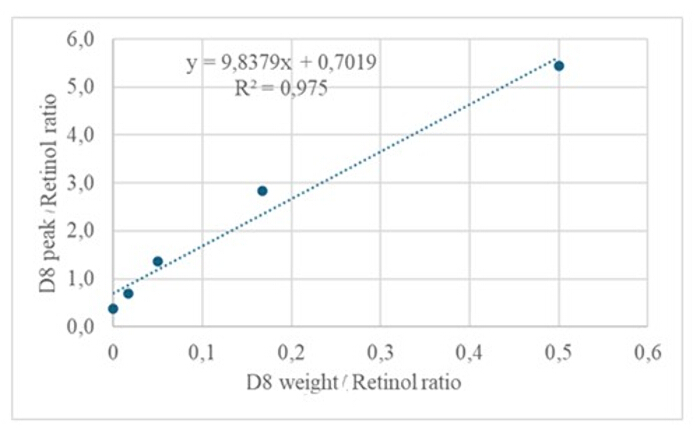
איור 4: עקומת כיול. איור זה ממחיש את הקשר בין תגובת GC/MS לבין ריכוז הרטינול הלא מסומן והמסומן. הוא מתואר על ידי המשוואה y = 9.8379x + 0.7019, כאשר y (יחסי השטח) מייצג את תגובת המכשיר, 9.8379 הוא הרגישות, x (יחסי המשקל) מייצג את ריכוז האנליטים, ו-0.7019 הוא אות הרקע. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
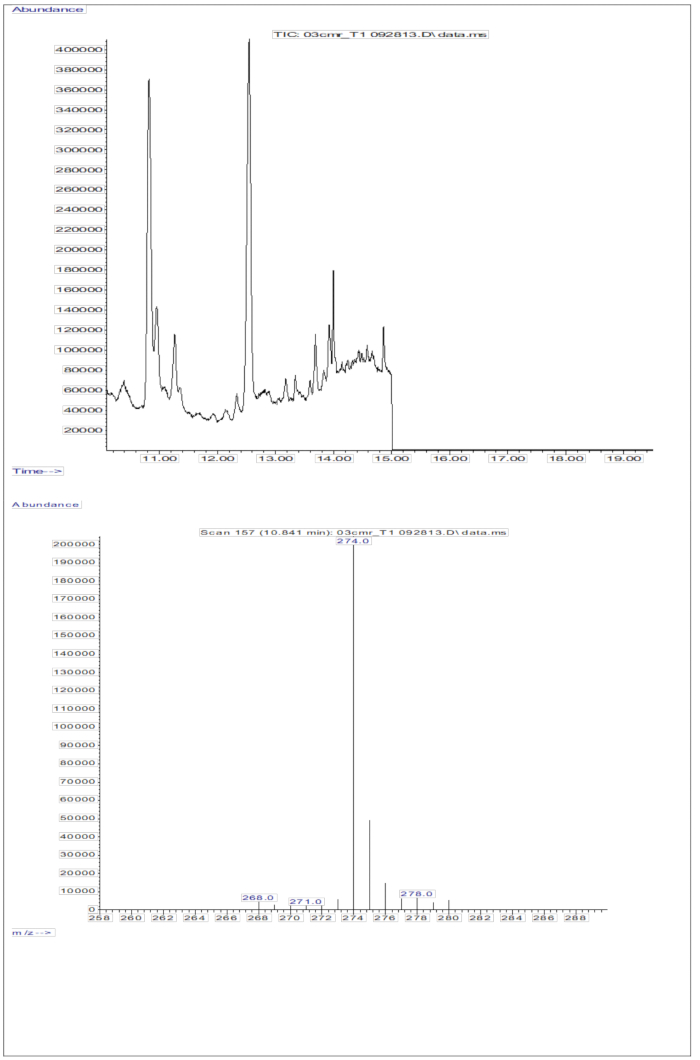
איור 5: כרומטוגרמה וספקטרום מסה של דגימת סרום. איור זה ממחיש את כרומטוגרפיית הגז / אלקטרון מתאן לוכד כרומטוגרמה של ספקטרומטריית מסה כימית שלילית (פאנל עליון) מניתוח חלק הרטינול הנגזר של הסרום. הפאנל התחתון הוא ספקטרום מסה המציג m/z 274 עבור D8-רטינול. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
| תקן | משקל (מ"ג) | בקבוק נפחי (מ"ל) | הממס |
| רטינול | 40 | 100 | אתנול |
| רטיניל אצטט | 40 | 100 | אתנול |
| רטיניל אצטט עם תווית דאוטריום | 40 | 100 | אתנול |
טבלה 1: הכנת תמיסת מלאי. טבלה זו מדגימה כיצד להכין תמיסות מרוכזות של רטינול ורטיניל אצטט עם תווית דאוטריום, אשר לאחר מכן ניתן לדלל לריכוזים נמוכים יותר לניסויים עתידיים.
| תקן | פתרון מלאי (מ"ל) | בקבוק נפחי (מ"ל) | הממס |
| רטינול | 1 | 50 | אתנול |
| רטיניל אצטט | 1 | 50 | אתנול |
| רטיניל אצטט עם תווית דאוטריום | 1 | 50 | אתנול |
טבלה 2: הכנת תמיסות מלאי מדוללות. טבלה זו מדגימה כיצד להכין תמיסות מוכנות לשימוש של רטינול ורטיניל אצטט עם תווית דאוטריום.
| תקן | אורך גל (ננומטר) | E1%1 ס"מ |
| רטינול | 325 | 1850 |
| רטיניל אצטט | 326 | 1550 |
טבלה 3: אורך גל ו-E1% 1 ס"מ (מקדם ספיגה).
| זמן (דקות) | זרימה (מ"ל/דקה) | מובייל שלב א' (%) | שלב ב' נייד (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
טבלה 4: לוח זמנים לשלבי HPLC ניידים. טבלה זו ממחישה את הרצף ומשך הזמן המתוכננים של שלבים שונים במהלך הריצה הכרומטוגרפית של HPLC.
| ש | ס"ד | D | H | |
| נושא 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| נושא 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| נושא 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| נושא 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| נושא 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| נושא 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| נושא 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| נושא 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| נושא 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| נושא 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: סכום שטח השיא ב-m/z 268, 269 ו-270 | ||||
| SD: סכום שטח השיא ב-m/z 274, 275, 276, 277 ו-278 | ||||
| D: העשרה של רטינול מסומן | ||||
| H: רמת רטינול ללא תווית |
טבלה 5: תוצאות GC/MS של חלק רטינול נגזר של סרום. טבלה זו מדווחת על תפוקות GC/MS הדרושות לחישוב מאגר הגוף הכולל של ויטמין A. H הוא סכום שטח השיא ב-m/z 268, 269 ו-270; D הוא סכום שטח השיא ב-m/z 274, 275, 276, 277 ו-278; D הוא העשרה של רטינול מסומן; H היא רמת הרטינול הלא מסומן; TBS הוא ויטמין A מאגר גוף כולל.
Discussion
היישום המוצלח של פרוטוקול זה מסתמך על ביצוע יעיל של כל שלב. הכנה נכונה של פתרונות ותקנים היא חיונית כדי להבטיח שהנתונים שנאספו מדויקים ואמינים. הנהלים המתוארים בפרוטוקול נבדקו במסגרות שונות ומתאימים להשגת פתרונות ותקנים העונים על יעדי ניתוח הדגימות.
ניתוח הדגימות מתחיל במיצוי והפרדה של רטינול בסרום. אחסון דגימות סרום בטמפרטורה של -80 מעלות צלזיוס עד לניתוח חיוני למניעת פירוק ויטמין A. בנוסף, יש צורך בעבודה באור עמום16. הליך ה-HPLC המשמש לאיסוף מקטע הרטינול נועד להפריד רטינול מרכיבים מסיסים בשומן אחרים כדי למנוע הפרעה בתהליך הנגזרת. זה גם מאפשר להריץ מאות דוגמאות מבלי לשטוף את העמודה.
חלק הרטינול שנאסף מ-HPLC נגזר עם BSTFA ב-70 מעלות צלזיוס למשך 30 דקות. שלב הנגזרת הוא קריטי לשיפור התנודתיות של הרטינול ויכולת הזיהוי שלו ב-GC-MS. מכיוון שהוא רגיש למים, חיוני לייבש לחלוטין את הדגימה לפני הנגזרת ולאפשר מספיק זמן לתגובת הנגזרת להתרחש לפני ניתוח GC-MS. הבחינו כי תהליך הנגזרת עם BSTFA הוא מתון ויעיל מאוד בהשוואה לזה המשתמש ב-N-methyl-N-(tert-butyldimethylsilyl) trifluoroacetamide (MTBSTFA)23,24 ומספק שיא חד מאוד לרטינול נגזר, ללא זנב או שיאי רקע בטווח המסה הסרוק14. ניתן לשמור רטינול נגזר בבקבוקון אטום בחומר ייבוש בטמפרטורה של 4 מעלות צלזיוס למשך חודש ללא השפלה14.
עבור ניתוח GC-MS, זה קריטי להבטיח כיול ותחזוקה נאותים של העמודה, ולייעל את נפח ההזרקה, הטמפרטורה וקצבי הזרימה. התנאים המשמשים כאן עם הזרקה על העמודה הראו תוצאות טובות ואמינות14. במהלך ניתוח GC-MS של רטינול דוטראט וללא תווית, טאנג ואחרים הבחינו כי השיאים של רטינול דוטראט הופיעו הן במינון הניתן והן בסרום של הנבדקים שקיבלו את המנה. דפוס זה לא נראה עם רטינול ללא תווית. לכן, הם הגיעו למסקנה כי הפסגות של רטינול דוטראט נוצרות מראש במינון ולא כתוצאה מפיצול בספקטרומטר המסה, מה שמרמז על כך שהרטינול הנטול שומר על מבנהו בתהליך חילוף החומרים, ומספק סמן אמין למעקב אחר רטינול במחקרים ביולוגיים. העשרת הרטינול דאוטראט בסרום לאחר מתן 2 מ"ג של D8-רטינול בילדים בגיל הגן החלה לעלות לאחר 7 שעות והגיעה לשיאה לאחר 14 יום, שהוא זמן הדגימה האופטימלי הקצר יותר25. ב-200 מיקרוליטר של סרום אנושי, אחוז ההעשרה המינימלי הניתן לזיהוי של רטינול הוא 0.01%, מה שמוכיח שהשיטה רגישה מספיק כדי לנתח דגימות סרום שנאספו מנבדקים עם מגוון רחב של סטטוסים של ויטמין A14.
בעוד שטכניקת דילול האיזוטופים היציבה המוצגת כאן מציעה יתרונות משמעותיים להערכת מצב ויטמין A, יש לציין כי שיטה זו דורשת ציוד מתוחכם ומומחיות טכנית, מה שהופך אותה ליקרה ופחות נגישה לשימוש שגרתי במסגרות רבות26. לכן, חיוני לקחת בחשבון מגבלה זו כאשר מתכננים להשתמש בטכניקה זו.
Disclosures
כתב יד זה הוא חלק מסדרה שכותרתה שימוש בשיטת דילול איזוטופ רטינול להערכת מאגרי ויטמין A בגוף וריכוז ויטמין A בכבד הנתמכת על ידי סבא"א.
Acknowledgements
למדנו את הפרוטוקול הזה במהלך מלגה במעבדה לקרוטנואידים ובריאות, מרכז המחקר לתזונה אנושית על הזדקנות ע"ש ז'אן מאייר, אוניברסיטת טאפטס, בוסטון, ארה"ב, בפיקוחו של גואנגוון טאנג ובתמיכתה הכספית של הסוכנות הבינלאומית לאנרגיה אטומית (סבא"א).
Materials
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
References
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved