Method Article
ГХ-МС анализ обогащения дейтерием ретинола в сыворотке крови и оценка общих запасов витамина А в организме
В этой статье
Резюме
Этот метод включает в себя экстракцию ретинола из сыворотки крови, его разделение с помощью ВЭЖХ и определение меченых и немеченых изотопов ретинола с помощью ГХ-МС. Соотношение меченого и немеченого ретинола используется для оценки общих запасов витамина А в организме.
Аннотация
Данный метод описывает определение обогащения дейтерием ретинола в сыворотке крови и оценку запасов витамина А в организме. Процесс включает экстракцию ретинола из 0,4 мл сыворотки с использованием 0,5 мл 0,85% физиологического раствора, 100 мкл внутреннего стандартного раствора и 5 мл раствора хлороформа-метанола (2:1 v/v). После центрифугирования и удаления нижнего слоя хлороформа смесь высушивают под азотом и ресуспендируют в 0,1 мл этанола, а фракцию ретинола отделяют от других составляющих с помощью системы ВЭЖХ, оснащенной колонной из ПЭ С18. Фракция ретинола может быть собрана вручную или с помощью фракционного коллектора. Затем фракцию ретинола сушат в азоте и дериватизируют О-бис(триметилсилил)трифторацетамидом (BSTFA), содержащим 10% триметилхлорсилана. Наконец, меченые и немеченые изотопы ретинола количественно определяют с помощью системы GC-MS, оснащенной метилсилоксановой капиллярной колонкой 19091z-431 HP-1, с использованием отрицательной химической ионизации с захватом электронов гелием в качестве газа-носителя и метаном в качестве ионизирующего агента. Соотношение меченого и немеченого ретинола затем используется в уравнениях Олсона, Грина или балансе массы для оценки запасов витамина А.
Введение
Витамин А является важным питательным веществом, необходимым для зрительной системы и поддержания функции клеток для роста, целостности эпителия, производства эритроцитов, иммунитета и репродуктивной функции1. Дефицит витамина А является серьезной проблемой общественного здравоохранения во всем мире, затрагивающей более 100 стран. Он непропорционально сильно влияет на детей младшего возраста и беременных женщин в странах с низким уровнем дохода. Около 190 миллионов детей во всем мире страдают от дефицита витамина А, что делает его критически важной проблемой для общественного здравоохранения и развития детей2.
В ответ на эту ситуацию во многих странах с низким уровнем дохода в течение десятилетий осуществлялось несколько программ, включая добавки витамина А с распределением высоких доз витамина А два раза в год среди детей в возрасте до 5 лет и обогащение витамином А некоторых продуктов питания. Тем не менее, эти вмешательства часто накладываются друг на друга, подвергая некоторые группы населения непреднамеренному хроническому чрезмерному потреблению витамина А 3,4. Этот двойной риск дефицита и избытка подчеркивает потребность в биомаркере, который может точно оценить статус витамина А по всему спектру, от дефицита до токсичности, для оценки программы.
Биомаркеры витамина А имеют решающее значение для оценки нутритивного статуса. Наиболее часто используемыми биомаркерами являются сывороточные концентрации ретинола и ретинол-связывающего белка (RBP). Тем не менее, важно отметить, что эти биомаркеры могут быть временно подавлены инфекциями и воспалениями, что может снизить специфичность оценки витамина А в определенныхгруппах населения.
В то время как образцы биопсии или аутопсии печени считаются золотым стандартом для оценки статуса витамина А, наиболее чувствительным косвенным показателем общих запасов витамина А в печени является метод разведения изотопов ретинола (РИД)8. RID дает количественную оценку уровня витамина А по всему спектру, начиная от дефицита и заканчивая чрезмерными запасами9. В большинстве исследовательских применений метод RID включает пероральное введение дозы дейтерия (2H) или 13меченного С ретинилацетата, который затем смешивается с запасами организма в течение 14–21 дня. По истечении этого срока берут образец крови, а сыворотку хранят при температуре -80 °C. Затем с помощью масс-спектрометрии анализируют соотношение меченого и общего ретинола для оценки запасов витамина А10 с использованием уравнения Олсона11, уравнения балансамасс 12 или уравненияГрина 13. Протокол, представленный в данной статье, действителен для введения ретинилацетата дейтерия (2H)- или 13C-меченного и основан на работе Tang et al.14. Общая цель этого метода заключается в точной оценке и мониторинге уровня витамина А в организме11. Это мощный метод, который обеспечивает количественную оценку концентраций витамина А по широкому спектру состояний, от дефицита до избытка15. Он более точен и точен, чем другие методы, которые часто опираются на косвенные измерения9.
протокол
Протокол был одобрен Комитетом по этике Министерства здравоохранения (No 2015/02/550/CE/CNERSH/SP), и было получено информированное согласие родителей/опекунов.
ПРИМЕЧАНИЕ: Поскольку витамин А является светочувствительным, крайне важно, чтобы все процедуры проводились при тусклом свете или при золотом флуоресцентномосвещении. Используемые материалы подробно описаны в Таблице материалов.
1. Приготовление реагентов
- Хлорид натрия (0,85% по массе): 0,85 г NaCl растворить в дистиллированной воде в мерной колбе объемом 100 мл. Залейте до отметки градуировку дистиллированной водой и перемешайте.
- Хлороформ-метанол (2:1 v/v): Перелейте 300 мл хлороформа в мерную колбу объемом 500 мл с мерным цилиндром. Добавьте 150 мл метанола и перемешайте.
- Мобильная фаза А для ВЭЖХ: ацетонитрил/тетрагидрофуран/сверхчистая вода (50/20/30, v/v/v): Перелейте 500 мл ацетонитрила в мерную колбу объемом 1000 мл. Добавьте 200 мл тетрагидрофурана и 300 мл воды. Перемешайте раствор, отфильтруйте его с помощью мембранного фильтра с размером пор 0,45 мкм, и обработайте ультразвуком (амплитуда 100%, частота 40 кГц и продолжительность 15 мин).
- Мобильная фаза B для ВЭЖХ: ацетонитрил/тетрагидрофуран/сверхчистая вода (50/44/6, v/v/v): Перелейте 500 мл ацетонитрила в мерную колбу объемом 1000 мл. Добавьте 440 мл тетрагидрофурана и 60 мл воды. Перемешайте раствор, отфильтруйте его с помощью мембранного фильтра с размером пор 0,45 мкм, и обработайте ультразвуком.
2. Приготовление типовых растворов
- Приготовьте исходный раствор, растворив 40 мг стандарта в этаноле в мерной колбе объемом 100 мл, как показано в таблице 1. Заполните растворителем до градуировочной отметки и тщательно перемешайте.
- Разбавленные стоковые растворы: Приготовьте разведенный стоковый раствор, перелив 1 мл стокового раствора в мерную колбу объемом 50 мл, как показано в таблице 2. Заполните до отметки градуировки соответствующим растворителем и тщательно перемешайте.
- Определение концентрации разбавленных исходных растворов: Поместите аликвоту (1 мл) разбавленного раствора в кварцевую трубку и измерьте его поглощение в спектрофотометре на заданной длине волны (табл. 3), используя этанол в качестве заготовки. Рассчитайте, используя закон Ламберта-Бира17. Убедитесь, что спектрофотометр откалиброван перед анализом, нагрев прибор в течение 15-30 минут, выбрав желаемую длину волны и обнулив прибор, поместив заготовку в держатель образца. Рассчитайте концентрацию по следующей формуле:
Концентрация = (коэффициент поглощения/поглощения) x 106 (мкг/дл)
ПРИМЕЧАНИЕ: Чтобы перевести значения из условных единиц (мкг/дл) в единицы S.I. (моль/л), умножьте условную величину на следующие коэффициенты пересчета: 0,0304 для ретинилацетата и 0,0349 для ретинола18. - Приготовление рабочих стандартов: С помощью объемной пипетки переложите 2 мл разведенных исходных растворов в коническую колбу объемом 100 мл. Наполните колбу до градуировочной отметки этанолом, тщательно перемешайте, и закройте пробкой.
- Чтобы определить точную концентрацию каждого раствора, оцените чистоту каждого компонента с помощью ВЭЖХ, оснащенной колонкой C18 и детектором с диодной матрицей, настроенной на 340 нм. Запрограммируйте насос на использование Mobile Phase A и Mobile Phase B в соответствии с графиком, приведенным в таблице 4. Убедитесь, что система ВЭЖХ откалибрована перед анализом, проверив различные компоненты, такие как насос, детектор, автосамплер и производительность всей системы.
- Перелейте 1 мл разбавленных исходных растворов в обжимные флаконы и введите образцы в систему ВЭЖХ в соответствии с обычной процедурой. Определите чистоту с помощью следующего уравнения:
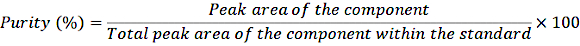
УРАВНЕНИЕ 1
С помощью этой поправки на чистоту рассчитайте точную концентрацию различных компонентов в стандартном растворе.
- Приготовление внутреннего стандарта (ретинилацетат OD ~ 0,2): С помощью объемной пипетки переложите 30 мл рабочего стандарта ретинилацетата в коническую колбу объемом 100 мл. Наполните колбу до градуировочной отметки этанолом, тщательно перемешайте, и закройте пробкой.
- Приготовление рабочих растворов: Добавьте 20 мкг немеченого ретинола к 10,00, 3,33, 1,00, 0,33 и 0,00 мкг меченого ретинола для получения соотношений меченого и немеченого ретинола 0,500, 0,167, 0,050, 0,0167 и 0,00.
3. Анализ проб
Примечание: Образцы сыворотки, использованные в этом исследовании, были собраны на14-й день у детей, получавших пероральную дозу (эквивалент ретинола 2 мг) D8-ретинола в рамках исследования, предназначенного для мониторинга и оценки статуса витамина А у детей в Камеруне.
- Экстракция ретиноидов в сыворотке крови: Эта экстракция основана на работе Folch et al.19 с изменениями Tang et al.14. Выполните действия, описанные ниже.
- Дайте замороженным образцам сыворотки мягко оттаять при комнатной температуре (20-25 °C) перед анализом. Аликвота 400 мкл сыворотки в одноразовую пробирку для культивирования 16 x 100 мм. Добавьте 500 мкл 0,85% физиологического раствора плюс 100 мкл внутреннего стандарта и 5 мл раствора хлороформа-метанола (2:1 v/v).
- Вортекс в течение 30 с и центрифуга при 1157 x g в течение 10 мин при 4 °C. С помощью стеклянной пастеровской пипетки осторожно удалите нижний слой хлороформа в одноразовую пробирку для культивирования размером 13 х 100 мм. Высушите под газообразным азотом на водяной бане (40 °C) и повторно суспендируйте остатки в 100 μл этанола. Вихревая и ультразвуковая обработка в течение 30 с. Переложите образец в обжимной флакон с помощью вкладыша, закройте лунку и наклейте этикетку. Образец готов к сбору ретинола ВЭЖХ.
- Выполните сбор ретинола ВЭЖХ, как описано ниже.
- Введите 70 мкл каждого образца сыворотки в систему ВЭЖХ, оснащенную колонкой C18 и детектором с диодной матрицей, настроенной на 340 нм. Запрограммируйте насос на подачу подвижных фаз A и B с постоянным расходом 1 мл/мин в соответствии с графиком, показанным в таблице 4.
- Перед введением образцов сыворотки введите 70 мкл рабочего раствора ретинола в систему ВЭЖХ и зарегистрируйте время удержания пика ретинола. Затем настройте коллектор фракций для сбора элюированной фракции ретинола в указанном диапазоне в пробирке объемом 5 мл с пробкой из матового стекла. В этом случае фракцию ретинола собирали с интервалом в 3 мин, от 7,5-10,5 мин.
ПРИМЕЧАНИЕ: Концентрация ретинола также может быть рассчитана на этом этапе с помощью калибровочной кривой стандартов ретинола и скорости восстановления, полученной из внутреннего стандарта.
- Проводят дериватизацию ретинола так, как описано ниже.
- Фракцию ретинола, собранную из ВЭЖХ, высушить в условиях газообразного азота на водяной бане при температуре 40 °С в течение не менее 3 ч. Добавьте этанол для облегчения испарения влаги во время сушки (образцы должны быть полностью сухими, так как дериватизация чувствительна к влаге). Добавьте в пробирку 20 μL BSTFA с 10% TMCS.
- Поместите трубку в нагреватель сухого блока, установленный на 70 °C, и выдерживайте в течение 30 минут. С помощью стеклянной пастеровской пипетки переложите реакционную смесь в обжимной флакон с вкладышем, плотно закройте обжимным колпачком с помощью обжимного колпачка и наклейте этикетку. Теперь образец готов для анализа ГХ/МС и может храниться в эксикаторе при температуре 4 °C до проведения анализа.
- Кроме того, высушите набор рабочих стандартных растворов объемом 100 мкл и дериватизируйте, как описано выше, для калибровки ГХ/МС.
ПРИМЕЧАНИЕ: Дериватизация ретинола с использованием BSTFA включает в себя химическую реакцию, в которой гидроксильная группа (-OH) ретинола заменяется триметилсилиловой группой (-Si(CH3)3), образуя ретинилтриметилсилиловый эфир. Этот процесс повышает летучесть и стабильность ретинола, делая его более подходящим для анализа ГХ/МС20.
- Анализ ГХ/МС: Анализ ГХ/МС выполняется с использованием процедуры, описанной Tang et al.14. Выполните действия, описанные ниже.
- Введите 3 мкл образца дериватизированного ретинола с помощью автосамплера в ГХ с холодным инжектором на колонке, соединенным через разъем с нулевым мертвым пространством к капиллярной колонке с внутренним диаметром 15 м x 0,25 мм, покрытой стационарной фазой DB-1 толщиной пленки 0,25 мкм.
- Запрограммируйте температуру колонной печи и инжектора на колонне на увеличение от 50 °C до 285 °C со скоростью 15 °C/мин, а также установите температуру интерфейса GC/MS на 285 °C. Используйте гелий в качестве газа-носителя для элюирования триметилсилилового производного ретинола в течение приблизительно 12 минут.
- Определение элюата ГХ с помощью квадрупольного масс-спектрометра с использованием химической ионизации отрицательных ионов метана со скоростью 0,5 торр при температуре источника ионов 150 °C. Установите масс-спектрометр на сканирование в диапазоне от 260 до 280 дальтон.
4. Анализ данных
- Используйте программное обеспечение для анализа данных GC/MS.
- Извлеките все нужные ионы на основе их отношения массы к заряду (м/з), интегрируйте площадь пика (используйте ручную интеграцию для настройки начальной и конечной точек пика) и перенесите результаты в файл электронной таблицы.
ПРИМЕЧАНИЕ: В зависимости от используемого изотопа, желаемые ионы будут следующими: 268-270 м/з для нативного ретинола; 271-274 м/з для [2H4]-ретинола; 278-280 м/з для [13С]-ретинола; и 276-280 м/з для [2H8]-ретинола. - Рассчитайте сумму пиков для меченого ретинола (ΣD), добавив площадь пика в m/z 274, 275, 276, 277 и 278. Рассчитайте сумму пиков для немеченого ретинола (ΣH), добавив площадь пика в m/z 268, 269 и 270.
- Рассчитайте обогащение меченого ретинола (D) с помощью следующего уравнения: D = ΣD/(ΣH + ΣD). Рассчитайте количество немеченого ретинола (H) по следующей формуле: H = 1 - D.
ПРИМЕЧАНИЕ: Масс-спектрометрия ретинилтриметилсилилового эфира с захватом электронов с захватом электронов дает не молекулярный ион, а основной ион фрагмента при m/z 268-271 для немеченого ретинола, при m/z 272-275 для D4-ретинола и при m/z от 276 до 280 для D8-ретинола14. - Для управления системой необходимо рассчитать уравнение линейной регрессии между весовыми соотношениями калибровочных стандартов и интегрированными областями для меченого ретинола и немеченого ретинола.
5. Оценка запасов витамина А
ПРИМЕЧАНИЕ: Этот шаг позволяет оценить индивидуальный уровень витамина А.
- Рассчитайте общие запасы витамина А в печени с помощью уравнения Олсона11
Общее количество запасов витамина А в печени = F x Доза x [S x a x (H/D - 1)]
где F – фактор эффективности абсорбции и хранения перорально введенной дозы (F = 0,50), Доза – количество меченого витамина А, вводимого перорально (мкмоль), S – коэффициент, корректирующий неравномерность соотношения меченого и немеченого ретинола в плазме и печени (S = 0,65), а – фактор, корректирующий необратимую потерю меченого витамина А в период смешивания; в частности, a = e-kt, где k – оцененная системная дробная катаболическая скорость (k = ln 2/32 дня для детей), а t – время, выраженное в днях с момента приема дозы; D/H – сывороточное изотопное соотношение меченого и немеченого ретинола, -1 корректирует вклад дозы меченого витамина А в общий объем витамина А в организме. - Для расчета общих запасов витамина А в организме (TBS) используйте уравнение Грина13
TBS = Fa × S × (1/SAp)
где Fa — доля перорально меченной дозы VA, поглощенной и обнаруженной в обменных пулах накопления организма в момент t, а S — отношение специфической активности ретинола в сыворотке к активности в запасах в момент t (для детей Fa × S = 0,642 через 14 дней)21. SAp – это доля дозы в сыворотке крови на μмоль дозы (т.е. [меченый ретинол] / ([немеченый + меченый ретинол] в сыворотке) / пероральная доза меченого ретинола (μмоль)).
Результаты
При введении 3 мкл дериватизированного образца высушенного раствора, содержащего приблизительно 50 пМ/мкл калибрантов (ретинола иD8-ретинола), в ГХ/МС не было обнаружено молекулярного иона, но был обнаружен основной ион фрагмента в m/z 268 для ретинола (рис. 1) и m/z 278 дляD-8-ретинола (рис. 2). Это указывает на то, что молекулярные ионы ретинилтриметилсилилового эфира, образующиеся при дериватизации ретинола иD8-ретинола, не стабильны в условиях ионизации, используемых в ГХ/МС. Они распадаются на более мелкие фрагменты, в первую очередь за счет альфа-расщепления. Этот распространенный паттерн фрагментации включает в себя разрыв связи, прилегающей к группе триметилсилилового эфира. Альфа-расщепление приводит к потере триметилсилильной группы (ТМС, которая имеет массу 73 Да) и атома водорода, что приводит к образованию фрагмент-иона с массой 268 Да для ретинола и 278 Да для D 8-ретинола22. Этот механизм помогает идентифицировать и подтвердить присутствие ретинола и его производных в образце путем анализа специфических фрагментов ионов, полученных в ходе масс-спектрометрии. При введении смесей ретинола и D8-ретинола были обнаружены два основных иона фрагментов в m/z 268 для ретинола и m/z 276 для D8-ретинола (рис. 3), что указывает на присутствие этих соединений в образце. Калибровочная кривая продемонстрировала превосходную линейность, о чем свидетельствует высокий коэффициент корреляции (рис. 4), показывающий, что связь между пиковым отношением и отношением весов имеет очень прямую и предсказуемую закономерность.
Ответ на ГК/МС, полученный при введении образцов сыворотки (сыворотка от детей, получавших пероральную дозу 2 мг ретинола в эквиваленте D8-ретинола; Рисунок 5) показывает присутствие ретинола и D8-ретинола, причем два основных иона фрагмента наблюдаются на m/z 268 и m/z 274. Результаты, полученные после экстракции ионов и интегрирования пиковых областей на m/z 274, 275, 276, 277 и 278 для D8-ретинола и на m/z 268, 269 и 270 для немеченого ретинола, представлены в таблице 5. Эти результаты должны быть интегрированы в уравнение Олсона11 или уравнениеГрина 13 для расчета запасов витамина А в организме.
Метод разбавления стабильных изотопов позволяет измерять уровни витамина А, которые не могут быть получены другими методами, что позволяет точно оценить статус витамина А. Этот метод ценен для исследований питания, клинической диагностики и эпидемиологических исследований.
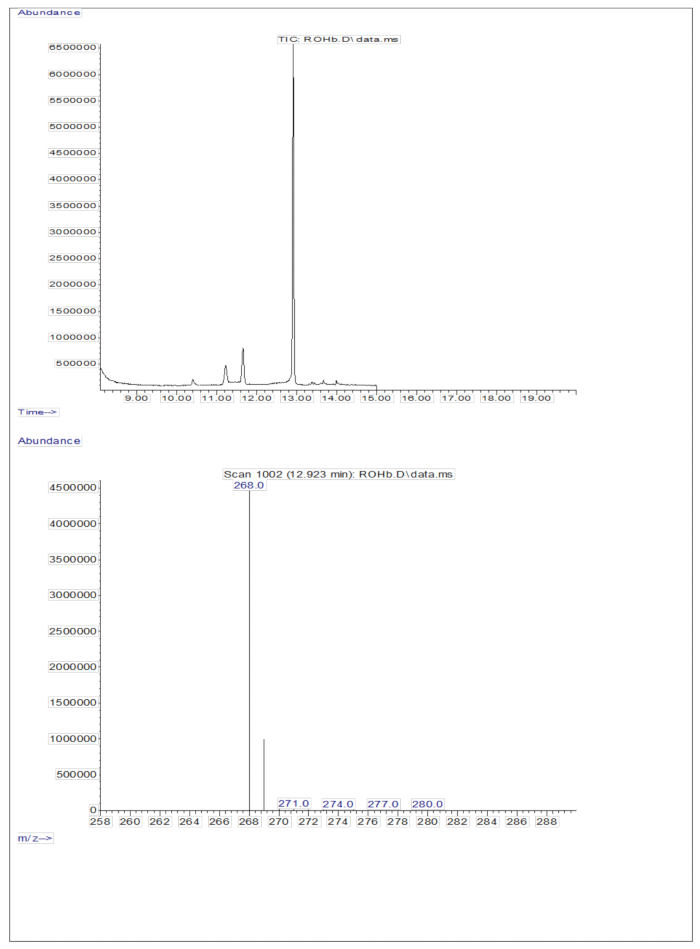
Рисунок 1: Хроматограмма и масс-спектр ретинола. На рисунке показана газовая хроматография/отрицательная химическая ионизационно-масс-спектрометрическая хроматограмма с захватом электронов метана (верхняя панель) из анализа стандарта дериватизированного ретинола. Нижняя панель представляет собой масс-спектр, показывающий m/z 268 для ретинола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Хроматограмма и масс-спектр D8-ретинола. На рисунке показана хроматограмма газовой хроматографии/захвата электронов метана с отрицательным химическим ионизационным масс-спектрометрическим спектрометрическим анализом (верхняя панель) из анализа дериватизированного стандарта D8-ретинола. Нижняя панель представляет собой масс-спектр, показывающий m/z 278 для D8-ретинола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 3: Хроматограмма и масс-спектр смеси ретинола и D8-ретинола. На рисунке показана хроматограмма газовой хроматографии/захвата электронов метана с отрицательным химическим ионизационным масс-спектрометрическим хроматометрическим методом (верхняя панель) из анализа дериватизированной смеси стандартов ретинола и D8-ретинола. Нижняя панель представляет собой масс-спектр, показывающий m/z 268 для ретинола и m/z 276 для D8-ретинола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
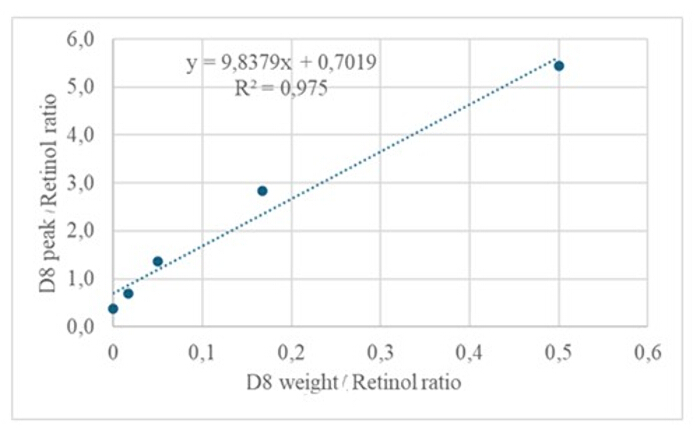
Рисунок 4: Калибровочная кривая. На этом рисунке показана взаимосвязь между ответом на ГХ/МС и концентрацией немеченного и меченого ретинола. Он описывается уравнением y = 9,8379x + 0,7019, где y (отношение площадей) представляет отклик прибора, 9,8379 — чувствительность, x (отношение весов) — концентрацию аналита, а 0,7019 — фоновый сигнал. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
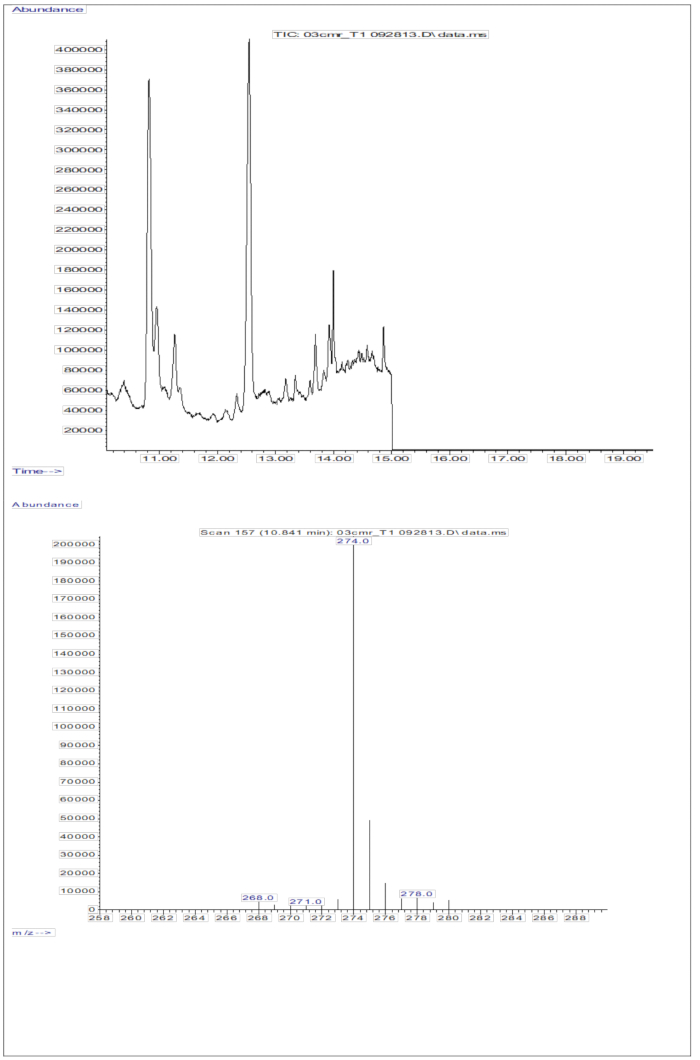
Рисунок 5: Хроматограмма и масс-спектр образца сыворотки. На этом рисунке показана хроматограмма газовой хроматографии/захвата электронов метана с отрицательным химическим ионизационным масс-спектрометрией (верхняя панель) из анализа дериватизированной ретинолевой фракции сыворотки. Нижняя панель представляет собой масс-спектр, показывающий m/z 274 для D8-ретинола. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Стандарт | Вес (мг) | Мерная колба (мл) | Растворитель |
| Ретинол | 40 | 100 | Этанол |
| Ретинилацетат | 40 | 100 | Этанол |
| Меченый дейтерием ретинилацетат | 40 | 100 | Этанол |
Таблица 1: Приготовление исходного раствора. В этой таблице показано, как готовить концентрированные растворы ретинола и меченого дейтерием ретинилацетата, которые затем можно разбавить до более низких концентраций для будущих экспериментов.
| Стандарт | Стоковый раствор (мл) | Мерная колба (мл) | Растворитель |
| Ретинол | 1 | 50 | Этанол |
| Ретинилацетат | 1 | 50 | Этанол |
| Меченый дейтерием ретинилацетат | 1 | 50 | Этанол |
Таблица 2: Приготовление разбавленных исходных растворов. В этой таблице показано, как готовить готовые к применению растворы ретинола и меченого дейтерием ретинилацетата.
| Стандарт | Длина волны (нм) | Е1%1 см |
| Ретинол | 325 | 1850 |
| Ретинилацетат | 326 | 1550 |
Таблица 3: Длина волны и E1% 1 см (коэффициент поглощения).
| Время (мин) | Расход (мл/мин) | Мобильная Фаза А (%) | Подвижная фаза B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Таблица 4: График проведения мобильных этапов ВЭЖХ. В этой таблице показана запланированная последовательность и продолжительность различных фаз во время хроматографической обработки ВЭЖХ.
| Ш | СД | D | H | |
| Тема 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Тема 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Тема 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Предмет 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Предмет 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Предмет 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Предмет 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Предмет 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Тема 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Предмет 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: сумма площадей пика на м/з 268, 269 и 270 | ||||
| SD: сумма площадей пика на м/з 274, 275, 276, 277 и 278 | ||||
| D: обогащение меченым ретинолом | ||||
| H: уровень немеченого ретинола |
Таблица 5: Результаты ГХ/МС дериватизированной ретиноловой фракции сыворотки. В этой таблице приведены выходы ГХ/МС, необходимые для расчета общих запасов витамина А в организме. H — сумма площадей пика на m/z 268, 269 и 270; D — сумма площади пика на м/з 274, 275, 276, 277 и 278; D – обогащение меченого ретинола; H — уровень немеченного ретинола; TBS — это витамин А Total Body Store.
Обсуждение
Успешная реализация этого протокола зависит от эффективного выполнения каждого этапа. Надлежащая подготовка решений и стандартов имеет решающее значение для обеспечения точности и надежности собираемых данных. Описанные в протоколе процедуры были протестированы в различных условиях и подходят для получения решений и стандартов, отвечающих целям анализа проб.
Анализ образцов начинается с экстракции и отделения ретинола в сыворотке. Хранение образцов сыворотки при температуре -80 °C до проведения анализа необходимо для предотвращения деградации витамина А. Кроме того, необходимо работать при слабом освещении16. Процедура ВЭЖХ, используемая для сбора фракции ретинола, предназначена для отделения ретинола от других жирорастворимых компонентов во избежание вмешательства в процесс дериватизации. Это также позволяет запускать сотни образцов без промывки колонки.
Фракцию ретинола, собранную из ВЭЖХ, дериватизируют BSTFA при 70 °C в течение 30 мин. Стадия дериватизации имеет решающее значение для улучшения летучести ретинола и его обнаруживаемости в ГХ-МС. Поскольку он чувствителен к воде, крайне важно полностью высушить образец перед дериватизацией и дать достаточно времени для проведения реакции дериватизации перед анализом GC-MS. Было замечено, что процесс дериватизации с помощью BSTFA является очень мягким и эффективным по сравнению с процессом с использованием N-метил-N-(трет-бутилдиметилсилил) трифторацетамида (MTBSTFA)23,24 и обеспечивает очень резкий пик для дериватизированного ретинола без хвостовых или фоновых пиков в сканируемом диапазоне масс14. Дериватизированный ретинол в герметичном флаконе можно хранить в эксикаторе при температуре 4 °С в течение 1 месяца без деградации14.
Для анализа ГХ-МС крайне важно обеспечить надлежащую калибровку и техническое обслуживание колонны, а также оптимизировать объем впрыскиваемой жидкости, температуру и скорость потока. Условия, использованные здесь при впрыске в колонку, показали хорошие и надежные результаты14. Во время анализа ГХ-МС дейтерированного и немеченого ретинола Tang et al.14 отметили, что пики дейтерированного ретинола проявлялись как во введенной дозе, так и в сыворотке крови пациентов, получавших дозу. Эта картина не наблюдалась при использовании немаркированного ретинола. Таким образом, они пришли к выводу, что пики дейтерированного ретинола предварительно формируются в дозе, а не являются результатом фрагментации в масс-спектрометре, предполагая, что дейтерированный ретинол сохраняет свою структуру в течение метаболического процесса, обеспечивая надежный маркер для отслеживания ретинола в биологических исследованиях. Обогащение дейтерированным ретинолом сыворотки крови после введения 2 мг D8-ретинола у детей дошкольного возраста начинало увеличиваться через 7 ч и достигало своего пика через 14 дней, что является более коротким оптимальным временем забора25. В 200 мкл сыворотки крови человека минимально обнаруживаемый процент обогащения ретинолом составляет 0,01%, что свидетельствует о достаточной чувствительности метода для анализа образцов сыворотки, собранных у субъектов с широким диапазономстатусов витамина А.
Несмотря на то, что представленный здесь метод разбавления стабильных изотопов дает значительные преимущества для оценки уровня витамина А, следует отметить, что этот метод требует сложного оборудования и технических знаний, что делает его дорогим и менее доступным для рутинного использования вомногих условиях. Поэтому важно учитывать это ограничение при планировании использования данной методики.
Раскрытие информации
Данная рукопись входит в серию публикаций под названием «Использование метода разбавления изотопов ретинола для оценки запасов витамина А в организме и концентрации витамина А в печени» при поддержке МАГАТЭ.
Благодарности
Мы узнали об этом протоколе во время стажировки в Лаборатории каротиноидов и здоровья Исследовательского центра по проблемам старения Министерства сельского хозяйства США им. Жана Майера Университета Тафтса, Бостон, США, под руководством Гуанвэнь Тан и при финансовой поддержке Международного агентства по атомной энергии (МАГАТЭ).
Материалы
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Ссылки
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены