Method Article
Análise GC-MS do enriquecimento de deutério de retinol no soro e estimativa dos estoques corporais totais de vitamina A
Neste Artigo
Resumo
Este método envolve a extração de retinol do soro, separando-o usando HPLC e determinando isótopos de retinol marcados e não marcados usando GC-MS. A proporção de retinol rotulado para não rotulado é usada para estimar os estoques corporais totais de vitamina A.
Resumo
Este método descreve a determinação do enriquecimento de deutério do retinol no soro e a estimativa dos estoques de vitamina A no corpo. O processo envolve a extração de retinol de 0,4 mL de soro usando 0,5 mL de solução salina a 0,85%, 100 μL de solução de padrão interno e 5 mL de solução de clorofórmio-metanol (2:1 v/v). Após centrifugação e remoção da camada inferior de clorofórmio, a mistura é seca sob nitrogênio e ressuspensa em 0,1 mL de etanol, e a fração de retinol é separada dos demais constituintes por meio de um sistema de HPLC equipado com uma coluna de PE C18. A fração de retinol pode ser coletada manualmente ou com um coletor de frações. Posteriormente, a fração retinol é seca sob nitrogênio e derivatizada com O-bis(trimetilsilil)trifluoroacetamida (BSTFA) contendo 10% de trimetilclorossilano. Finalmente, os isótopos de retinol marcados e não marcados são quantificados usando um sistema GC-MS equipado com uma coluna capilar de metil siloxano 19091z-431 HP-1, empregando ionização química negativa de captura de elétrons com hélio como gás transportador e metano como agente de ionização. A proporção de retinol marcado para não marcado é então usada nas equações de Olson, Green ou balanço de massa para estimar os estoques de vitamina A.
Introdução
A vitamina A é um nutriente essencial necessário para o sistema visual e manutenção da função celular para o crescimento, integridade epitelial, produção de glóbulos vermelhos, imunidade e reprodução1. A deficiência de vitamina A é um grave problema de saúde pública em todo o mundo, afetando mais de 100 países. Afeta desproporcionalmente crianças pequenas e mulheres grávidas em países de baixa renda. Aproximadamente 190 milhões de crianças em todo o mundo sofrem de deficiência de vitamina A, tornando-se uma questão crítica para a saúde pública e o desenvolvimento infantil2.
Em resposta a essa situação, vários programas, incluindo suplementação de vitamina A com distribuição semestral de altas doses de vitamina A para crianças menores de 5 anos de idade e fortificação de vitamina A de certos produtos alimentares, foram implementados há décadas em muitos países de baixa renda. No entanto, essas intervenções muitas vezes se sobrepõem, expondo algumas populações à ingestão excessiva crônica inadvertida de vitamina A 3,4. Esse risco duplo de deficiência e excesso destaca a necessidade de um biomarcador que possa avaliar com precisão o status da vitamina A em todo o espectro, da deficiência à toxicidade, para orientar a avaliação do programa.
Os biomarcadores de vitamina A são cruciais para avaliar o estado nutricional. Os biomarcadores mais comumente usados são as concentrações séricas de retinol e proteína de ligação ao retinol (RBP). No entanto, é importante notar que esses biomarcadores podem ser temporariamente suprimidos por infecções e inflamações, o que pode diminuir a especificidade das avaliações de vitamina A em certas populações 5,6,7.
Embora as amostras de biópsia ou autópsia hepática sejam consideradas o padrão-ouro para avaliar o status de vitamina A, o indicador indireto mais sensível das reservas totais de vitamina A do fígado é o método de diluição de isótopos de retinol (RID)8. O RID fornece uma estimativa quantitativa do status de vitamina A em todo o espectro, variando de estoques deficientes a excessivos9. Na maioria das aplicações de pesquisa, o método RID envolve a administração de uma dose oral de deutério (2H) ou acetato de retinila marcado com 13C, que então se mistura com os estoques corporais por um período de 14 a 21 dias. Após este período, é recolhida uma amostra de sangue e o soro é armazenado a -80 °C. A proporção de retinol marcado para total é então analisada usando espectrometria de massa para estimar os estoques de vitamina A10, empregando a equação de Olson11, a equação de balanço de massa12 ou a equação de Green13. O protocolo apresentado neste trabalho é válido para a administração de acetato de retinonila marcado com deutério (2H) ou 13C e é baseado no trabalho de Tang et al.14. O objetivo geral desse método é avaliar e monitorar com precisão o status de vitamina A no corpo11. É um método poderoso que fornece uma estimativa quantitativa das concentrações de vitamina A em um amplo espectro de status, da deficiência ao excesso15. É mais exato e preciso do que outros métodos, que muitas vezes dependem de medidas indiretas9.
Protocolo
O protocolo foi aprovado pelo Comitê de Ética do Ministério da Saúde Pública (nº 2015/02/550/CE/CNERSH/SP), e o consentimento informado foi obtido dos pais/responsáveis.
NOTA: Como a vitamina A é sensível à luz, é crucial que todos os procedimentos sejam realizados com pouca luz ou sob iluminação fluorescente dourada16. Os materiais utilizados são detalhados na Tabela de Materiais.
1. Preparação de reagentes
- Cloreto de sódio (0,85% p/v): Dissolver 0,85 g de NaCl em água destilada em balão volumétrico de 100 mL. Encha até a marca de graduação com água destilada e misture.
- Clorofórmio-metanol (2:1 v/v): Transferir 300 ml de clorofórmio para um balão volumétrico de 500 ml com uma proveta graduada. Adicione 150 mL de metanol e misture.
- Fase móvel A para HPLC: Acetonitrila/tetrahidrofurano/água ultrapura (50/20/30, v/v/v): Transferir 500 mL de acetonitrila para um balão volumétrico de 1000 mL. Adicione 200 mL de tetrahidrofurano e 300 mL de água. Misturar a solução, filtrá-la com um filtro de membrana com poros de 0,45 μm e sonicar (amplitude de 100%, frequência de 40 kHz e duração de 15 min).
- Fase móvel B para HPLC: Acetonitrila/tetrahidrofurano/água ultrapura (50/44/6, v/v/v): Transferir 500 mL de acetonitrila para um balão volumétrico de 1000 mL. Adicione 440 mL de tetrahidrofurano e 60 mL de água. Misturar a solução, filtrá-la com um filtro de membrana com poros de 0,45 μm e sonicate.
2. Preparação de soluções-padrão
- Preparar a solução-mãe dissolvendo 40 mg do padrão em etanol num balão volumétrico de 100 ml, conforme ilustrado no quadro 1. Encher até à marca de graduação com o solvente e homogeneizar.
- Soluções-mãe diluídas: Preparar a solução-mãe diluída transferindo 1 ml da solução-mãe para um balão volumétrico de 50 ml, como indicado no quadro 2. Encher até à marca de graduação com o solvente adequado e homogeneizar.
- Determinação da concentração das soluções-mãe diluídas: Colocar uma alíquota (1 ml) da solução diluída num tubo de quartzo e medir a sua absorvância no espectrofotómetro no comprimento de onda especificado (quadro 3) utilizando etanol como branco. Calcule o usando a Lei de Lambert-Beer17. Certifique-se de que o espectrofotômetro esteja calibrado antes da análise, aquecendo o instrumento por 15-30 min, selecionando o comprimento de onda desejado e zerando o instrumento colocando o branco no suporte de amostra. Calcular a concentração utilizando a seguinte fórmula:
Concentração = (coeficiente de absorbância/absorção) x10,6 (μg/dL)
NOTA: Para converter valores de unidades convencionais (μg/dL) em unidades SI (μmol/L), multiplique o valor convencional pelos seguintes fatores de conversão: 0,0304 para acetato de retinila e 0,0349 para retinol18. - Preparação dos padrões de trabalho: Com uma pipeta volumétrica, transferir 2 ml das soluções-mãe diluídas para um balão cónico de 100 ml. Encher o balão até à marca de graduação com etanol, homogeneizar e fechar com uma rolha.
- Para determinar a concentração exacta de cada solução, avaliar a pureza de cada componente utilizando HPLC equipada com uma coluna C18 e um detector de díodos regulado para 340 nm. Programe a bomba para usar a Fase Móvel A e a Fase Móvel B de acordo com o cronograma mostrado na Tabela 4. Certifique-se de que o sistema HPLC esteja calibrado antes da análise, validando vários componentes, como bomba, detector, amostrador automático e o desempenho de todo o sistema.
- Transferir 1 ml das soluções-mãe diluídas para frascos de crimpagem e injectar as amostras no sistema de HPLC de acordo com o procedimento normal. Determine a pureza usando a seguinte equação:
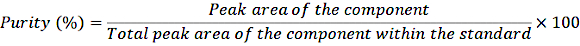
EQUAÇÃO 1
Com esta correção de pureza, calcular a concentração exata dos diferentes componentes na solução-padrão.
- Preparação do padrão interno (acetato de retinilo OD ~ 0,2): Usando uma pipeta volumétrica, transfira 30 mL do padrão de trabalho de acetato de retinila para um frasco cônico de 100 mL. Encher o balão até à marca de graduação com etanol, homogeneizar e fechar com uma rolha.
- Preparação de soluções de trabalho: Adicione 20 μg de retinol não marcado a 10,00, 3,33, 1,00, 0,33 e 0,00 μg de retinol marcado para fornecer proporções de retinol marcado e não marcado de 0,500, 0,167, 0,050, 0,0167 e 0,00.
3. Análise da amostra
NOTA: As amostras de soro utilizadas neste estudo foram coletadas no14º dia de crianças que receberam uma dose oral (2 mg equivalentes de retinol) de D8-retinol como parte de um estudo projetado para monitorar e avaliar o status de vitamina A de crianças em Camarões.
- Extração de retinóides no soro: Esta extração é baseada no trabalho de Folch et al.19 modificado por Tang et al.14. Siga as etapas descritas abaixo.
- Deixar as amostras de soro congeladas descongelarem suavemente à temperatura ambiente (20-25 °C) antes da análise. Alíquota de 400 μL de soro em um tubo de cultura descartável de 16 x 100 mm. Adicione 500 μL de solução salina a 0,85% mais 100 μL de padrão interno e 5 mL de solução de clorofórmio-metanol (2:1 v/v).
- Vórtice por 30 s e centrifugue a 1157 x g por 10 min a 4 °C. Usando uma pipeta Pasteur de vidro, remova cuidadosamente a camada inferior de clorofórmio para um tubo de cultura descartável de 13 x 100 mm. Secar em banho-maria em nitrogênio gasoso (40 °C) e ressuspender o resíduo em 100 μl de etanol. Vórtice e sonicar por 30 s. Transfira a amostra para um frasco de crimpagem com uma inserção, feche o poço e etiquete. A amostra está pronta para coleta de retinol por HPLC.
- Realize a coleta de retinol por HPLC conforme descrito abaixo.
- Injectar 70 μL de cada amostra de soro num sistema de HPLC equipado com uma coluna C18 e um detector de díodos regulado para 340 nm. Programe a bomba para fornecer as Fases Móveis A e B a uma vazão constante de 1 mL/min, seguindo o cronograma mostrado na Tabela 4.
- Antes de injetar as amostras de soro, injete 70 μL da solução de trabalho de retinol no sistema HPLC e registre o tempo de retenção do pico de retinol. Em seguida, configure o coletor de frações para coletar a fração de retinol eluída dentro de uma faixa especificada em um tubo de 5 mL com uma rolha de vidro fosco. Neste caso, a fração retinol foi coletada em um intervalo de 3 min, de 7,5 a 10,5 min.
NOTA: A concentração de retinol também pode ser calculada nesta etapa usando uma curva de calibração dos padrões de retinol e a taxa de recuperação obtida do padrão interno.
- Realize a derivatização do retinol conforme descrito abaixo.
- Secar a fracção de retinol recolhida da HPLC em azoto, em banho-maria, a 40 °C, durante, pelo menos, 3 h. Adicione etanol para facilitar a evaporação da umidade durante a secagem (as amostras devem estar completamente secas, pois a derivatização é sensível à umidade). Adicione 20 μL de BSTFA com 10% de TMCS ao tubo.
- Coloque o tubo em um aquecedor de bloco seco regulado para 70 °C e incube por 30 min. Usando uma pipeta Pasteur de vidro, transfira a mistura de reação para um frasco de crimpagem com uma inserção, feche bem com a tampa de crimpagem usando um crimpador de tampa e rotule. A amostra está agora pronta para análise GC/MS e pode ser armazenada em um dessecador a 4 °C até a análise.
- Além disso, seque um conjunto de 100 μL de soluções-padrão de trabalho e derivatize conforme descrito acima para calibrar o GC / MS.
NOTA: A derivatização do retinol usando BSTFA envolve uma reação química onde o grupo hidroxila (-OH) do retinol é substituído pelo grupo trimetilsilil (-Si(CH3)3), formando éter retinil trimetilsilílico. Esse processo aumenta a volatilidade e a estabilidade do retinol, tornando-o mais adequado para a análise de GC/MS20.
- Análise de GC/MS: A análise de GC/MS é realizada usando o procedimento descrito por Tang et al.14. Siga as etapas descritas abaixo.
- Injete 3 μL da amostra de retinol derivatizado usando um amostrador automático no GC com um injetor frio na coluna conectado através de um conector de volume morto zero a uma coluna capilar de sílica fundida de 15 m x 0,25 mm de diâmetro interno revestida com uma fase estacionária DB-1 de 0,25 μm de espessura de filme.
- Programe as temperaturas do forno de coluna e do injetor na coluna para aumentar de 50 °C para 285 °C a uma taxa de 15 °C/min e defina a temperatura da interface GC/MS para 285 °C. Use hélio como gás transportador para eluir o derivado trimetilsilil do retinol por aproximadamente 12 min.
- Detectar o eluído de GC com um espectrômetro de massa quadrupolo usando ionização química de íons negativos de metano de 0,5 torr, com a temperatura da fonte de íons ajustada para 150 °C. Configure o espectrômetro de massa para escanear entre 260 e 280 daltons.
4. Análise dos dados
- Use o software de análise de dados GC/MS.
- Extraia todos os íons desejados com base em suas proporções massa-carga (m/z), integre a área do pico (use a integração manual para ajustar os pontos inicial e final do pico) e transfira os resultados para um arquivo de planilha.
NOTA: Dependendo do isótopo utilizado, os íons desejados serão os seguintes: 268-270 m/z para retinol nativo; 271-274 m/z para [2H4]-retinol; 278-280 m/z para [13C]-retinol; e 276-280 m/z para [2H8]-retinol. - Calcule a soma dos picos para retinol marcado (ΣD) adicionando a área do pico em m / z 274, 275, 276, 277 e 278. Calcule a soma dos picos para retinol não marcado (ΣH) adicionando a área do pico em m / z 268, 269 e 270.
- Calcule o enriquecimento do retinol marcado (D) usando a seguinte equação: D = ΣD/(ΣH + ΣD). Calcule a quantidade de retinol não marcado (H) usando a seguinte equação: H = 1 - D.
NOTA: A espectrometria de massa de ionização química negativa de captura de elétrons por cromatografia gasosa do éter trimetilsilílico retinil não fornece nenhum íon molecular, mas um íon fragmento principal em m / z 268 a 271 para retinol não marcado, em m / z 272 a 275 para D4-retinol e em m / z 276 a 280 para D8-retinol14. - Para controlar o sistema, calcule uma equação de regressão linear entre as proporções de peso dos padrões de calibração e as áreas integradas para retinol marcado e retinol não marcado.
5. Estimativa de estoques de vitamina A
NOTA: Esta etapa permite a avaliação do status de vitamina A de um indivíduo.
- Calcule os estoques totais de vitamina A no fígado usando a equação de Olson11
Reservas Totais de Vitamina A no Fígado = F x Dose x [S x a x (H/D - 1)]
onde F é um fator para a eficiência de absorção e armazenamento da dose administrada por via oral (F = 0,50), Dose é a quantidade de vitamina A marcada administrada por via oral (μmol), S é um fator que corrige a desigualdade do plasma para a proporção hepática de retinol marcado para não marcado (S = 0,65), a é um fator que corrige a perda irreversível de vitamina A marcada durante o período de mistura; especificamente, a = e-kt, onde k é a taxa catabólica fracionária estimada do sistema (k = ln 2/32 dias para crianças) e t é o tempo, expresso em dias desde a dose; D/H é a razão isotópica sérica de retinol marcado para não marcado, -1 corrige a contribuição da dose de vitamina A marcada para o pool total de vitamina A do corpo. - Para calcular os estoques corporais totais de vitamina A (TBS), use a equação de Green13
TBS = Fa × S × (1/SAp)
onde Fa é a fração da dose de VA marcada por via oral absorvida e encontrada nos reservatórios de armazenamento trocáveis do corpo no tempo t, e S é a razão entre a atividade específica do retinol no soro e a dos estoques no tempo t (para crianças, Fa × S = 0,642 em 14 dias)21. SAp é a fração da dose no soro por dose de μmol (ou seja, [retinol marcado] / ([não marcado + retinol marcado] no soro) / dose oral de retinol marcado (μmol)).
Resultados
A injeção de 3 μL de uma amostra derivatizada de uma solução seca contendo aproximadamente 50 pM/μL de calibrantes (retinol e D8-retinol) no GC/MS não mostrou nenhum íon molecular, mas exibiu um íon fragmento maior em m/z 268 para retinol (Figura 1) e m/z 278 para D8-retinol (Figura 2). Isso indica que os íons moleculares do éter retinil trimetilsilílico, formados durante a derivatização do retinol e do D 8-retinol, não são estáveis nas condições de ionização usadas no GC/MS. Eles se decompõem em fragmentos menores, principalmente por meio da clivagem alfa. Este padrão de fragmentação comum envolve a quebra da ligação adjacente ao grupo éter trimetilsilílico. A clivagem alfa resulta na perda do grupo trimetilsilil (TMS, que tem massa de 73 Da) e um átomo de hidrogênio, levando a um íon fragmento com massa de 268 Da para retinol e 278 Da para D8-retinol 22. Esse mecanismo ajuda a identificar e confirmar a presença de retinol e seus derivados na amostra, analisando os íons de fragmentos específicos produzidos durante a espectrometria de massa. A injeção de misturas de retinol e D8-retinol mostrou dois íons fragmentos principais em m/z 268 para retinol e m/z 276 para D8-retinol (Figura 3), indicando a presença desses compostos na amostra. A curva de calibração apresentou excelente linearidade, conforme indicado por um alto coeficiente de correlação (Figura 4), mostrando que a relação entre a razão de pico e a razão de peso tem um padrão muito reto e previsível.
A resposta GC/MS obtida a partir das injeções de amostras de soro (soro de crianças que receberam uma dose oral de 2 mg de retinol equivalentes de D8-retinol; Figura 5) mostra a presença de retinol e D8-retinol, com os dois principais íons de fragmentos observados em m/z 268 e m/z 274. Os resultados obtidos após a extração de íons e integração das áreas de pico em m/z 274, 275, 276, 277 e 278 para D8-retinol e em m/z 268, 269 e 270 para retinol não marcado são apresentados na Tabela 5. Esses resultados devem ser integrados à equação de Olson11 ou à equação de Green13 para calcular os estoques de vitamina A no corpo.
A técnica de diluição de isótopos estáveis fornece medições dos níveis de vitamina A que não podem ser obtidas por outros métodos, permitindo avaliações precisas do status de vitamina A. Este método é valioso para estudos nutricionais, diagnósticos clínicos e pesquisas epidemiológicas.
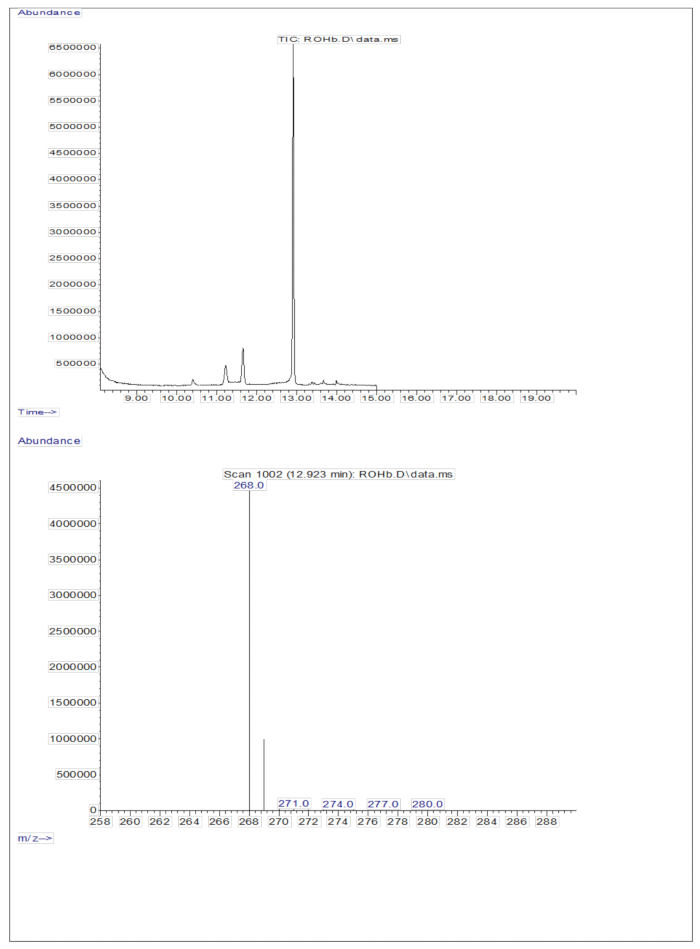
Figura 1: Cromatograma e espectro de massa do retinol. A figura mostra a cromatografia gasosa / captura de elétrons de metano cromatograma de ionização química negativa-espectrometria de massa (painel superior) a partir da análise do padrão de retinol derivatizado. O painel inferior é um espectro de massa mostrando m / z 268 para retinol. Clique aqui para ver uma versão maior desta figura.

Figura 2: Cromatograma e espectro de massa do D8-retinol. A figura mostra a cromatografia gasosa / captura de elétrons de metano cromatograma de ionização química negativa-espectrometria de massa (painel superior) a partir da análise do padrão D8-retinol derivatizado. O painel inferior é um espectro de massa mostrando m / z 278 para D8-retinol. Clique aqui para ver uma versão maior desta figura.

Figura 3: Cromatograma e espectro de massa de uma mistura de retinol e D8-retinol. A figura mostra a cromatografia gasosa / elétrons de metano capturam cromatograma de ionização química negativa-espectrometria de massa (painel superior) a partir da análise de uma mistura derivatizada de padrões de retinol e D8-retinol. O painel inferior é um espectro de massa mostrando m / z 268 para retinol e m / z 276 para D8-retinol. Clique aqui para ver uma versão maior desta figura.
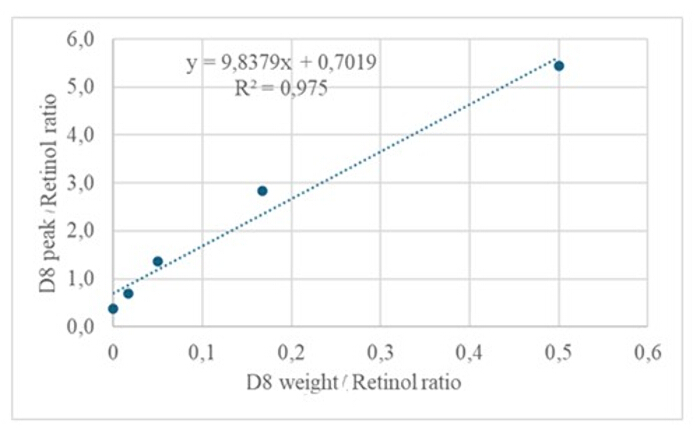
Figura 4: Curva de calibração. Esta figura ilustra a relação entre a resposta GC/MS e a concentração de retinol não marcado e marcado. É descrito pela equação y = 9,8379x + 0,7019, onde y (as razões de área) representa a resposta do instrumento, 9,8379 é a sensibilidade, x (as razões de peso) representa a concentração do analito e 0,7019 é o sinal de fundo. Clique aqui para ver uma versão maior desta figura.
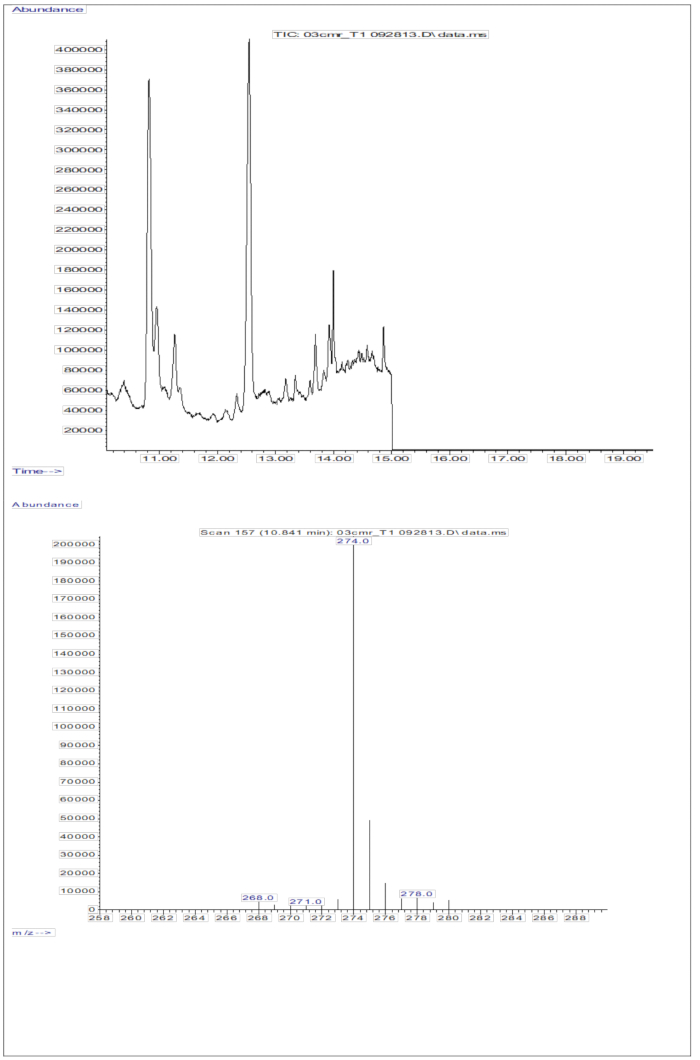
Figura 5: Cromatograma e espectro de massa da amostra de soro. Esta figura ilustra a cromatografia gasosa / captura de elétrons de metano cromatograma de ionização química negativa de espectrometria de massa (painel superior) a partir da análise da fração de retinol derivatizada do soro. O painel inferior é um espectro de massa mostrando m / z 274 para D8-retinol. Clique aqui para ver uma versão maior desta figura.
| Padrão | Peso (mg) | Balão volumétrico (ml) | Solvente |
| Retinol | 40 | 100 | Etanol |
| Acetato de retinilo | 40 | 100 | Etanol |
| Acetato de retinilo marcado com deutério | 40 | 100 | Etanol |
Tabela 1: Preparação da solução-mãe. Esta tabela demonstra como preparar soluções concentradas de retinol e acetato de retinila marcado com deutério, que podem ser diluídas em concentrações mais baixas para experimentos futuros.
| Padrão | Solução estoque (mL) | Balão volumétrico (ml) | Solvente |
| Retinol | 1 | 50 | Etanol |
| Acetato de retinilo | 1 | 50 | Etanol |
| Acetato de retinilo marcado com deutério | 1 | 50 | Etanol |
Tabela 2: Preparação de soluções de estoque diluídas. Esta tabela demonstra como preparar soluções prontas para uso de retinol e acetato de retinila marcado com deutério.
| Padrão | Comprimento de onda (nm) | E1%1 cm |
| Retinol | 325 | 1850 |
| Acetato de retinilo | 326 | 1550 |
Tabela 3: Comprimento de onda e E1% 1 cm (coeficiente de absorção).
| Tempo (min) | Fluxo (mL / min) | Móvel Fase A (%) | Móvel Fase B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Tabela 4: Cronograma para fases móveis de HPLC. Este quadro ilustra a sequência planeada e a duração das diferentes fases durante a execução cromatográfica por HPLC.
| SH | SD | D | H | |
| Assunto 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Assunto 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Assunto 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Assunto 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Assunto 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Assunto 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Assunto 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Assunto 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Assunto 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Assunto 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: soma da área do pico em m/z 268, 269 e 270 | ||||
| DP: soma da área do pico em m / z 274, 275, 276, 277 e 278 | ||||
| D: enriquecimento de retinol marcado | ||||
| H: nível de retinol não marcado |
Tabela 5: Resultados de GC/MS da fração de retinol derivatizada do soro. Esta tabela relata os resultados de GC/MS necessários para o cálculo do estoque corporal total de vitamina A. H é a soma da área do pico em m/z 268, 269 e 270; D é a soma da área do pico em m/z 274, 275, 276, 277 e 278; D é o enriquecimento do retinol marcado; H é o nível de retinol não marcado; TBS é vitamina A Total Body Store.
Discussão
A implementação bem-sucedida deste protocolo depende da execução efetiva de cada etapa. A preparação adequada de soluções e padrões é crucial para garantir que os dados coletados sejam precisos e confiáveis. Os procedimentos descritos no protocolo foram testados em vários cenários e são adequados para a obtenção de soluções e padrões que atendam aos objetivos da análise da amostra.
A análise das amostras começa com a extração e separação do retinol no soro. O armazenamento de amostras de soro a -80 °C até a análise é essencial para evitar a degradação da vitamina A. Além disso, é necessário trabalhar com pouca luz16. O procedimento de HPLC usado para coletar a fração de retinol é projetado para separar o retinol de outros componentes lipossolúveis para evitar interferência no processo de derivatização. Também permite executar centenas de amostras sem lavar a coluna.
A fração de retinol coletada da HPLC é derivatizada com BSTFA a 70 °C por 30 min. A etapa de derivatização é crítica para melhorar a volatilidade do retinol e sua detectabilidade em GC-MS. Por ser sensível à água, é crucial secar completamente a amostra antes da derivatização e permitir tempo suficiente para que a reação de derivatização ocorra antes da análise por GC-MS. Percebeu-se que o processo de derivatização com BSTFA é muito suave e eficiente em comparação com o que utiliza N-metil-N-(terc-butildimetilsilil) trifluoroacetamida (MTBSTFA)23,24 e fornece um pico muito acentuado para o retinol derivatizado, sem picos de cauda ou fundo na faixa de massaescaneada14. O retinol derivatizado em um frasco selado pode ser mantido em um dessecador a 4 ° C por 1 mês sem degradação14.
Para a análise GC-MS, é fundamental garantir a calibração e manutenção adequadas da coluna e otimizar o volume de injeção, temperatura e vazão. As condições aqui utilizadas com injeção na coluna mostraram resultados bons e confiáveis14. Durante a análise por CG-EM do retinol deuterado e não marcado, Tang et al.14 observaram que os picos de retinol deuterado apareceram tanto na dose administrada quanto no soro dos indivíduos que receberam a dose. Esse padrão não foi observado com retinol não marcado. Portanto, eles concluíram que os picos de retinol deuterado são pré-formados na dose e não resultado da fragmentação no espectrômetro de massa, sugerindo que o retinol deuterado mantém sua estrutura através do processo metabólico, fornecendo um marcador confiável para rastrear o retinol em estudos biológicos. O enriquecimento de retinol deuterado no soro após a administração de 2 mg de D8-retinol em crianças em idade pré-escolar começou a aumentar às 7 h e atingiu seu pico aos 14 dias, que é o menor tempo ideal de amostragem25. Em 200 μL de soro humano, o percentual mínimo detectável de enriquecimento de retinol é de 0,01%, demonstrando que o método é sensível o suficiente para analisar amostras de soro coletadas de indivíduos com uma ampla gama de status de vitamina A14.
Embora a técnica de diluição de isótopos estáveis apresentada aqui ofereça vantagens significativas para avaliar o status da vitamina A, deve-se notar que esse método requer equipamentos sofisticados e conhecimento técnico, tornando-o caro e menos acessível para uso rotineiro em muitos ambientes26. Portanto, é essencial considerar essa limitação ao planejar o uso dessa técnica.
Divulgações
Este manuscrito faz parte de uma série intitulada Utilizando o Método de Diluição de Isótopos de Retinol para Avaliação de Reservas Corporais de Vitamina A e Concentração de Vitamina A no Fígado apoiada pela AIEA.
Agradecimentos
Aprendemos este protocolo durante uma bolsa no Laboratório de Carotenóides e Saúde, Jean Mayer USDA Human Nutrition Research Center on Aging, Tufts University, Boston, EUA, sob a supervisão de Guangwen Tang e com o apoio financeiro da Agência Internacional de Energia Atômica (AIEA).
Materiais
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Referências
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados