Method Article
중수소, 혈청 내 레티놀 농축 및 비타민 A 전신 저장 추정에 대한 GC-MS 분석
요약
이 방법은 혈청에서 레티놀을 추출하고, HPLC를 사용하여 분리하고, GC-MS를 사용하여 표지된 레티놀 동위원소와 표지되지 않은 레티놀 동위원소를 측정하는 것입니다. 라벨링된 레티놀과 라벨링되지 않은 레티놀의 비율은 비타민 A의 전체 신체 저장량을 추정하는 데 사용됩니다.
초록
이 방법은 중수소, 혈청 내 레티놀 농축 측정 및 체내 비타민 A 저장 추정을 설명합니다. 이 공정에는 0.5mL의 0.85% 식염수, 100μL의 내부 표준물질 용액 및 5mL의 클로로포름-메탄올(2:1 v/v) 용액을 사용하여 0.4mL의 혈청에서 레티놀을 추출하는 작업이 포함됩니다. 원심분리 및 하부 클로로포름 층을 제거한 후 혼합물을 질소로 건조시키고 0.1mL의 에탄올에 재현탁시키고, PE C18 컬럼이 장착된 HPLC 시스템을 사용하여 레티놀 분획을 다른 성분과 분리합니다. 레티놀 분획은 수동으로 또는 분획 분취기를 사용하여 채취할 수 있습니다. 그 후, 레티놀 분획을 질소 하에서 건조시키고 10% 트리메틸클로로실란을 함유하는 O-bis(trimethylsilyl)trifluoroacetamide(BSTFA)로 유도체화합니다. 마지막으로, 헬륨을 운반 가스로, 메탄을 이온화제로 사용하는 전자 포획 음성 화학 이온화를 사용하여 19091z-431 HP-1 메틸 실록산 모세관 컬럼이 장착된 GC-MS 시스템을 사용하여 표지 및 표지되지 않은 레티놀 동위원소를 정량화합니다. 그런 다음 라벨링된 레티놀과 라벨링되지 않은 레티놀의 비율은 Olson, Green 또는 질량 균형 방정식에 사용되어 비타민 A 저장량을 추정합니다.
서문
비타민 A는 성장, 상피 무결성, 적혈구 생성, 면역 및 재생을 위한 시각 시스템과 세포 기능 유지에 필요한 필수 영양소입니다1. 비타민 A 결핍은 전 세계적으로 100개 이상의 국가에 영향을 미치는 심각한 공중 보건 문제입니다. 이는 저소득 국가의 어린 아이들과 임산부에게 불균형적으로 영향을 미칩니다. 전 세계적으로 약 1억 9,000만 명의 어린이가 비타민 A 결핍증을 앓고 있으며, 이는 공중 보건 및 아동 발달에 중요한 문제가 되고 있습니다2.
이러한 상황에 대응하기 위해 많은 저소득 국가에서 5세 미만 어린이에게 고용량의 비타민 A를 격년으로 분배하는 비타민 A 보충과 특정 식품의 비타민 A 강화를 포함한 여러 프로그램이 수십 년 동안 시행되어 왔습니다. 그러나 이러한 중재는 종종 중복되어 일부 인구 집단은 의도하지 않은 만성 비타민 A 과잉 섭취에 노출됩니다 3,4. 이러한 결핍과 과잉의 이중 위험은 결핍에서 독성에 이르기까지 전체 스펙트럼에 걸쳐 비타민 A 상태를 정확하게 평가하여 프로그램 평가를 안내할 수 있는 바이오마커의 필요성을 강조합니다.
비타민 A 바이오마커는 영양 상태를 평가하는 데 중요합니다. 가장 일반적으로 사용되는 바이오마커는 레티놀 및 레티놀 결합 단백질(RBP)의 혈청 농도입니다. 그러나 이러한 바이오마커는 감염 및 염증에 의해 일시적으로 억제될 수 있으며, 이로 인해 특정 인구 집단에서 비타민 A 평가의 특이성이 낮아질 수 있다는 점에 유의하는 것이 중요합니다 5,6,7.
간 생검 또는 부검 검체는 비타민 A 상태를 평가하기 위한 황금 표준으로 간주되지만, 총 간 비타민 A 보유량에 대한 가장 민감한 간접 지표는 레티놀 동위원소 희석법(RID)입니다8. RID는 비타민 A 결핍에서 과도한 저장에 이르기까지 전체 스펙트럼에 걸쳐 비타민 A 상태에 대한 정량적 추정치를 제공합니다9. 대부분의 연구 응용 분야에서 RID 방법은 중수소(2H) 또는 13C표지 레티닐 아세테이트를 경구 투여한 다음 14일에서 21일 동안 신체 저장소와 혼합하는 것입니다. 이 기간이 지나면 혈액 샘플을 채취하고 혈청을 -80°C에서 보관합니다. 그런 다음 질량 분석법을 사용하여 Olson 방정식11, 질량 균형 방정식12 또는 Green 방정식13을 사용하여 비타민 A 저장10을 추정하기 위해 라벨링된 총 레티놀의 비율을 분석합니다. 이 논문에 제시된 프로토콜은 중수소(2H) 또는 13C-표지 레티닐 아세테이트의 투여에 유효하며 Tang et al.14의 연구를 기반으로 합니다. 이 방법의 전반적인 목표는 신체의 비타민 A 상태를 정확하게 평가하고 모니터링하는 것입니다11. 이는 결핍에서초과 15에 이르기까지 광범위한 상태에 걸쳐 비타민 A 농도의 정량적 추정치를 제공하는 강력한 방법입니다. 이는 종종 간접 측정9에 의존하는 다른 방법보다 더 정확하고 정밀하다.
프로토콜
이 프로토콜은 보건부 윤리위원회(No. 2015/02/550/CE/CNERSH/SP)의 승인을 받았으며 부모/보호자로부터 사전 동의를 얻었습니다.
참고: 비타민 A는 빛에 민감하기 때문에 모든 시술은 어두운 곳이나 금색 형광등 아래에서 수행하는 것이 중요합니다16. 사용된 재료는 재료 표에 자세히 설명되어 있습니다.
1. 시약의 준비
- 염화나트륨 (0.85% w/v): 100 mL 용량 플라스크에 0.85 g의 NaCl을 증류수에 용해시킵니다. 눈금 표시까지 증류수를 채우고 섞습니다.
- 클로로포름-메탄올(2:1 v/v): 측정 실린더를 사용하여 300mL의 클로로포름을 500mL 용량 플라스크에 넣습니다. 메탄올 150mL를 넣고 섞습니다.
- HPLC용 이동상 A: 아세토니트릴/테트라하이드로퓨란/초순수(50/20/30, v/v/v): 아세토니트릴 500mL를 1000mL 용량 플라스크에 전달합니다. 테트라하이드로푸란 200mL와 물 300mL를 추가합니다. 용액을 혼합하고 공극 크기가 0.45μm인 멤브레인 필터를 사용하여 여과한 다음 초음파 처리합니다(진폭 100%, 주파수 40kHz 및 지속 시간 15분).
- HPLC용 이동상 B: 아세토니트릴/테트라하이드로푸란/초순수(50/44/6, v/v/v): 아세토니트릴 500mL를 1000mL 용량 플라스크에 전달합니다. 테트라하이드로푸란 440mL와 물 60mL를 추가합니다. 용액을 혼합하고 공극 크기가 0.45μm인 멤브레인 필터를 사용하여 여과한 다음 초음파 처리합니다.
2. 표준 용액의 준비
- 표 1과 같이 100mL 부피 플라스크에 표준물질 40mg을 에탄올에 용해시켜 원액을 준비합니다. 눈금 표시까지 솔벤트를 채우고 잘 섞습니다.
- 희석된 원액: 표 2와 같이 원액 1mL를 50mL 부피 플라스크에 옮겨 희석된 원액을 준비합니다. 눈금 표시까지 적절한 용제로 채우고 철저히 혼합합니다.
- 희석된 원액의 농도 측정: 희석된 용액의 부분 표본(1mL)을 석영 튜브에 넣고 에탄올을 블랭크로 사용하여 지정된 파장(표 3)에서 분광 광도계의 흡광도를 측정합니다. Lambert-Beer 법칙17을 사용하여 계산합니다. 15-30분 동안 기기를 예열하고 원하는 파장을 선택한 다음 샘플 홀더에 블랭크를 넣어 기기를 영점 조정하여 분석 전에 분광 광도계가 보정되었는지 확인합니다. 다음 공식을 사용하여 농도를 계산합니다.
농도 = (흡광도/흡수 계수) x 106 (μg/dL)
참고: 기존 단위(μg/dL)에서 SI 단위(μmol/L)로 값을 변환하려면 기존 값에 레티닐 아세테이트의 경우 0.0304, 레티놀18의 경우 0.0349의 변환 계수를 곱합니다. - 작업 표준 준비: 부피 측정 피펫을 사용하여 희석된 원액 2mL를 100mL 원뿔형 플라스크에 옮깁니다. 플라스크에 눈금 표시까지 에탄올을 채우고 철저히 섞은 다음 마개로 닫습니다.
- 각 용액의 정확한 농도를 측정하려면 C18 컬럼과 340nm로 설정된 다이오드 어레이 검출기가 장착된 HPLC를 사용하여 각 성분의 순도를 평가합니다. 표 4에 표시된 일정에 따라 모바일 위상 A와 모바일 위상 B를 사용하도록 펌프를 프로그래밍합니다. 펌프, 검출기, 자동 시료 주입기 및 전체 시스템 성능과 같은 다양한 구성 요소를 검증하여 분석 전에 HPLC 시스템이 보정되었는지 확인합니다.
- 희석된 원액 1mL를 크림프 바이알로 옮기고 정상적인 절차에 따라 샘플을 HPLC 시스템에 주입합니다. 다음 방정식을 사용하여 순도를 측정합니다.
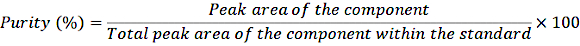
방정식 1
이러한 순도 보정을 통해 표준 용액에 있는 다양한 성분의 정확한 농도를 계산합니다.
- 내부 표준물 준비 (레티닐 아세테이트 OD ~ 0.2) : 부피 피펫을 사용하여 30mL의 레티 닐 아세테이트 작업 표준물을 100mL 원추형 플라스크로 옮깁니다. 플라스크에 눈금 표시까지 에탄올을 채우고 철저히 섞은 다음 마개로 닫습니다.
- 작업 용액의 준비: 10.00, 3.33, 1.00, 0.33 및 0.00 μg의 비라벨링 레티놀에 20 μg의 비라벨링 레티놀을 첨가하여 0.500, 0.167, 0.050, 0.0167 및 0.00의 라벨링 및 비라벨링 레티놀 비율을 제공합니다.
3. 시료 분석
참고: 이 연구에 사용된 혈청 샘플은 카메룬 어린이의 비타민 A 상태를 모니터링하고 평가하기 위해 고안된 연구의 일환으로 D8-레티놀의 경구 투여(2mg 레티놀 등가물)를 받은 어린이로부터 14일에 수집 되었습니다.
- 혈청 내 레티노이드 추출: 이 추출은 Tang et al.14에 의해 수정된 Folch et al.19의 연구를 기반으로 합니다. 아래 설명된 단계를 따르십시오.
- 분석하기 전에 냉동 혈청 샘플을 실온(20-25°C)에서 부드럽게 해동시킵니다. 400μL의 혈청을 16 x 100mm 일회용 배양 튜브에 분취합니다. 0.85% 식염수 500μL와 내부 표준물질 100μL 및 클로로포름-메탄올(2:1 v/v) 용액 5mL를 추가합니다.
- 30초 동안 볼텍스, 4°C에서 10분 동안 1157 x g에서 원심분리. 유리 파스퇴르 피펫을 사용하여 클로로포름 하층을 13 x 100mm 일회용 배양 튜브로 조심스럽게 제거합니다. 수조(40°C)에서 질소 가스로 건조하고 잔류물을 100μL의 에탄올에 재현탁합니다. 30 초 동안 소용돌이 및 초음파 처리. 인서트가 있는 크림프 바이알로 샘플을 옮기고 웰을 닫고 라벨을 붙입니다. 샘플은 HPLC 레티놀을 채취할 준비가 되었습니다.
- 아래 설명된 대로 HPLC 레티놀 채취를 수행합니다.
- 각 혈청 시료 70μL를 C18 컬럼과 340nm로 설정된 다이오드 어레이 검출기가 장착된 HPLC 시스템에 주입합니다. 표 4에 표시된 일정에 따라 이동상 A 및 B를 1mL/분의 일정한 유속으로 전달하도록 펌프를 프로그래밍합니다.
- 혈청 샘플을 주입하기 전에 70μL의 레티놀 작업 용액을 HPLC 시스템에 주입하고 레티놀 피크의 머무름 시간을 기록합니다. 그런 다음 분획 분취기를 설정하여 바닥 유리 마개가 있는 5mL 튜브에서 지정된 범위 내에서 용리된 레티놀 분획을 수집합니다. 이 경우, 레티놀 분획은 7.5-10.5분까지 3분 간격으로 수집되었습니다.
참고: 레티놀 농도는 레티놀 표준물질의 보정 곡선과 내부 표준물질에서 얻은 회수율을 사용하여 이 단계에서 계산할 수도 있습니다.
- 아래 설명된 대로 레티놀의 유도체화를 수행합니다.
- HPLC에서 수집된 레티놀 분획을 질소 가스에서 40°C의 수조에서 최소 3시간 동안 건조합니다. 건조 중 수분 증발을 용이하게 하기 위해 에탄올을 첨가합니다(유도체화는 수분에 민감하므로 샘플은 완전히 건조되어야 함). 튜브에 10% TMCS가 포함된 20μL의 BSTFA를 추가합니다.
- 튜브를 70°C로 설정된 드라이 블록 히터에 넣고 30분 동안 배양합니다. 유리 파스퇴르 피펫을 사용하여 인서트를 사용하여 반응 혼합물을 크림프 바이알로 옮기고 캡 크림퍼를 사용하여 크림프 캡으로 단단히 밀봉한 다음 라벨을 부착합니다. 이제 시료를 GC/MS 분석할 준비가 되었으며 분석할 때까지 4°C의 데시케이터에 보관할 수 있습니다.
- 또한 100μL 세트의 작업 표준 용액을 건조하고 위에서 설명한 대로 유도체화하여 GC/MS를 보정합니다.
참고: BSTFA를 사용한 레티놀의 유도체화는 레티놀의 수산기(-OH)가 트리메틸실릴기(-Si(CH3)3)로 대체되어 레티닐 트리메틸실릴 에테르를 형성하는 화학 반응을 포함합니다. 이 공정은 레티놀의 휘발성과 안정성을 향상시켜 GC/MS 분석20에 더욱 적합합니다.
- GC/MS 분석: GC/MS 분석은 Tang et al.14에 설명된 절차를 사용하여 수행됩니다. 아래 설명된 단계를 따르십시오.
- 0.25μm 필름 두께의 DB-1 고정상으로 코팅된 15m x 0.25mm 내경 용융 실리카 모세관 컬럼에 제로 데드 볼륨 커넥터를 통해 연결된 냉각 온 컬럼 주입기를 사용하여 자동 시료 주입기를 사용하여 유도체화된 레티놀 샘플 3μL를 GC에 주입합니다.
- 컬럼 오븐 및 컬럼 내 주입기 온도가 15°C/분의 속도로 50°C에서 285°C로 증가하도록 프로그래밍하고 GC/MS 인터페이스 온도를 285°C로 설정합니다. 헬륨을 운반 가스로 사용하여 약 12분에 걸쳐 레티놀의 트리메틸실릴 유도체를 용리시킵니다.
- 이온 소스 온도를 150°C로 설정하고 0.5torr 메탄 음이온 화학 이온화를 사용하는 사중극자 질량 분석기로 GC 용리액을 검출합니다. 질량분석기를 260 - 280 달톤 사이를 스캔하도록 설정합니다.
4. 데이터 분석
- GC/MS 데이터 분석 소프트웨어를 사용하십시오.
- 질량 대 전하(m/z) 비율을 기반으로 원하는 모든 이온을 추출하고, 피크의 면적을 통합하고(수동 통합을 사용하여 피크의 시작점과 끝점을 조정함) 결과를 스프레드시트 파일로 전송합니다.
참고: 사용된 동위원소에 따라 원하는 이온은 다음과 같습니다: 천연 레티놀의 경우 268-270m/z; [2H4]-레티놀의 경우 271-274 m / z; [13C]-레티놀의 경우 278-280 m/z; 및 [2H8]-레티놀의 경우 276-280 m / z. - m/z 274, 275, 276, 277 및 278에서 피크 면적을 추가하여 라벨링된 레티놀(ΣD)의 피크 합을 계산합니다. m/z 268, 269 및 270에서 피크 면적을 추가하여 표지되지 않은 레티놀(ΣH)에 대한 피크 합계를 계산합니다.
- 다음 방정식을 사용하여 라벨링된 레티놀(D)의 농축을 계산합니다: D = ΣD/(ΣH + ΣD). 다음 방정식을 사용하여 표지되지 않은 레티놀(H)의 양을 계산합니다: H = 1 - D.
참고 : 레티닐 트리메틸 실릴 에테르의 가스 크로마토 그래피 전자 포획 네거티브 화학 이온화 질량 분석법은 분자 이온을 제공하지 않지만 표지되지 않은 레티놀의 경우 m / z 268-271, D4-레티놀의 경우 m / z 272-275, D8-레티놀14의 경우 m / z 276-280에서 주요 단편 이온을 제공합니다. - 시스템을 제어하려면 검량 표준물질의 중량 비율과 라벨링된 레티놀 및 라벨링되지 않은 레티놀에 대한 통합 영역 사이의 선형 회귀 방정식을 계산합니다.
5. 비타민 A 저장량 추정
참고: 이 단계를 통해 개인의 비타민 A 상태를 평가할 수 있습니다.
- Olson 방정식11을 사용하여 간 총 비타민 A 저장 량을 계산합니다.
비타민 A 총 간 저장 = F x 용량 x [S x a x (H/D - 1)]
여기서, F는 경구 투여된 용량의 흡수 및 저장 효율에 대한 인자(F=0.50), 투여량은 경구로 투여된 표지된 비타민 A의 양(μmol), S는 표지된 레티놀과 비표지 레티놀의 간 비율에 대한 혈장의 불평등을 보정하는 인자(S = 0.65), a는 혼합 기간 동안 표지된 비타민 A의 비가역적 손실을 보정하는 인자이고; 구체적으로, a = e-kt, 여기서 k는 추정된 시스템 분수 이화율(k = 어린이의 경우 ln 2/32일)이고 t는 투여 후 일수로 표시되는 시간입니다. D/H는 라벨링된 레티놀과 라벨링되지 않은 레티놀의 혈청 동위원소 비율이며, -1은 전신 비타민 A 풀에 대한 라벨링된 비타민 A의 용량의 기여도를 보정합니다. - 비타민 A 전신 저장량(TBS)을 계산하려면 녹색 방정식13을 사용하십시오.
TBS = Fa × S × (1/SAp)
여기서 Fa는 t 시간에 신체의 교환 가능한 저장 풀에서 흡수되어 발견되는 VA의 경구 표지 용량의 비율이고, S는 t 시간에 저장된 활성에 대한 혈청 내 레티놀 특이적 활성의 비율입니다(어린이의 경우 Fa × S = 14일에 0.642)21. SAp는 μmol 용량당 혈청 내 용량의 분율입니다(즉, [라벨링된 레티놀] / (혈청 내 [라벨링되지 않은 + 라벨링된 레티놀]) / 라벨링된 레티놀의 경구 용량(μmol)).
결과
약 50pM/μL의 캘리브란트(레티놀 및 D8-레티놀)를 함유한 건조 용액의 유도체화된 샘플 3μL를 GC/MS에 주입한 결과 분자 이온은 나타나지 않았지만 레티놀의 경우 m/z 268(그림 1), D8-레티놀의 경우 m/z 278(그림 2)에서 주요 단편 이온이 나타났습니다. 이는 레티놀 및 D8-레티놀의 유도체화 과정에서 형성된 레티닐 트리메틸실릴 에테르의 분자 이온이 GC/MS에 사용되는 이온화 조건에서 안정적이지 않음을 나타냅니다. 그들은 주로 알파 분열을 통해 더 작은 조각으로 분해됩니다. 이 일반적인 단편화 패턴은 트리메틸실릴 에테르기에 인접한 결합의 파괴를 포함합니다. 알파 절단은 트리메틸실릴기(질량이 73Da인 TMS)와 수소 원자의 소실을 초래하여 레티놀의 경우 268Da, D의 경우 278Da의 단편 이온을 생성합니다 8-레티놀22. 이 메커니즘은 질량 분석 중에 생성된 특정 단편 이온을 분석하여 샘플에서 레티놀 및 그 유도체의 존재를 식별하고 확인하는 데 도움이 됩니다. 레티놀과 D8-레티놀의 혼합물을 주입한 결과, 레티놀의 경우 m/z 268, D8-레티놀의 경우 m/z 276에서 두 개의 주요 단편 이온이 나타났으며(그림 3), 이는 샘플에 이러한 화합물이 존재함을 나타냅니다. 검량선은 높은 상관 계수(그림 4)에서 알 수 있듯이 우수한 선형성을 보였으며, 이는 피크 비율과 중량 비율 간의 관계가 매우 직선적이고 예측 가능한 패턴을 가지고 있음을 보여줍니다.
혈청 샘플(D8-레티놀 등가물 2mg을 경구 투여한 어린이의 혈청; 그림 5) 레티놀과 D8-레티놀의 존재를 보여주며, m/z 268 및 m/z 274에서 관찰된 두 개의 주요 단편 이온이 있습니다. D8-레티놀의 경우 m/z 274, 275, 276, 277 및 278에서, 표지되지 않은 레티놀의 경우 m/z 268, 269 및 270에서 이온을 추출하고 피크 면적을 통합한 후 얻은 결과가 표 5에 제시되어 있습니다. 이러한 결과는 Olson 방정식11 또는 Green 방정식13 에 통합되어 체내에 저장된 비타민 A를 계산합니다.
안정 동위원소 희석 기법은 다른 방법으로는 얻을 수 없는 비타민 A 수치를 측정하여 비타민 A 상태를 정확하게 평가할 수 있습니다. 이 방법은 영양 연구, 임상 진단 및 역학 연구에 유용합니다.
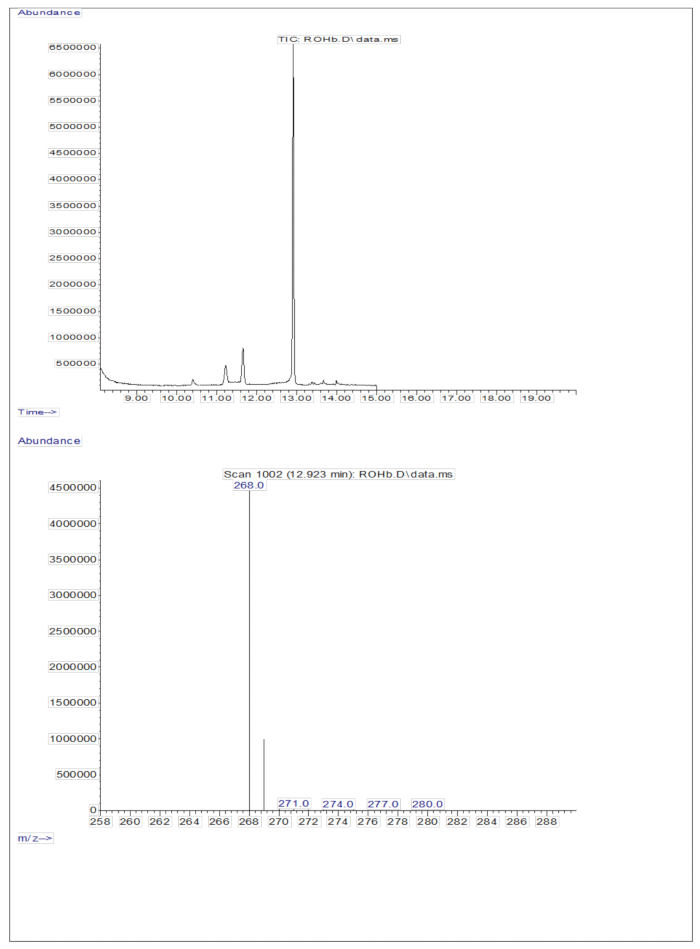
그림 1: 레티놀의 크로마토그램 및 질량 스펙트럼. 이 그림은 유도체화된 레티놀 표준물질 분석에서 얻은 가스 크로마토그래피/메탄 전자 포획 음성 화학 이온화-질량 분석 크로마토그램(상단 패널)을 보여줍니다. 하단 패널은 레티놀에 대한 m/z 268을 보여주는 질량 스펙트럼입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: D8-레티놀의 크로마토그램 및 질량 스펙트럼. 이 그림은 유도체화된 D8-레티놀 표준물질 분석에서 얻은 가스 크로마토그래피/메탄 전자 포획 네거티브 화학 이온화-질량 분석 크로마토그램(상단 패널)을 보여줍니다. 하단 패널은 D8-레티놀에 대한 m/z 278을 보여주는 질량 스펙트럼입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 레티놀과 D8-레티놀 혼합물의 크로마토그램 및 질량 스펙트럼. 이 그림은 레티놀과 D8-레티놀 표준물질의 유도체화된 혼합물 분석에서 얻은 가스 크로마토그래피/메탄 전자 포획 음성 화학 이온화-질량 분석 크로마토그램(상단 패널)을 보여줍니다. 하단 패널은 레티놀의 경우 m/z 268, D8-레티놀의 경우 m/z 276을 보여주는 질량 스펙트럼입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
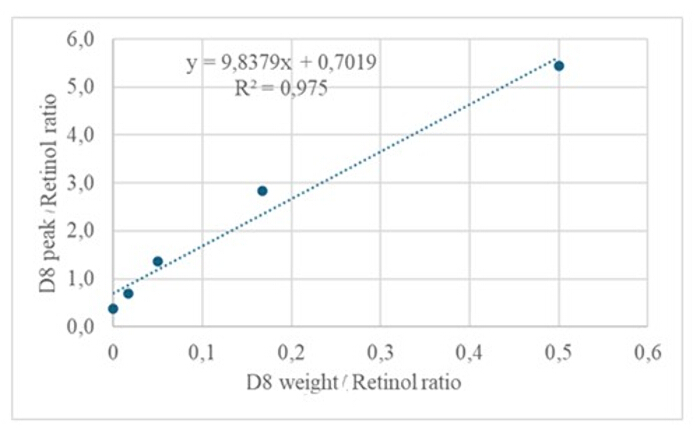
그림 4: 검량선. 이 그림은 GC/MS 반응과 비표지 및 표지된 레티놀의 농도 사이의 관계를 보여줍니다. 이는 방정식 y = 9.8379x + 0.7019로 설명되며, 여기서 y(면적 비율)는 기기 응답, 9.8379는 민감도, x(중량 비율)는 분석물 농도, 0.7019는 백그라운드 신호를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
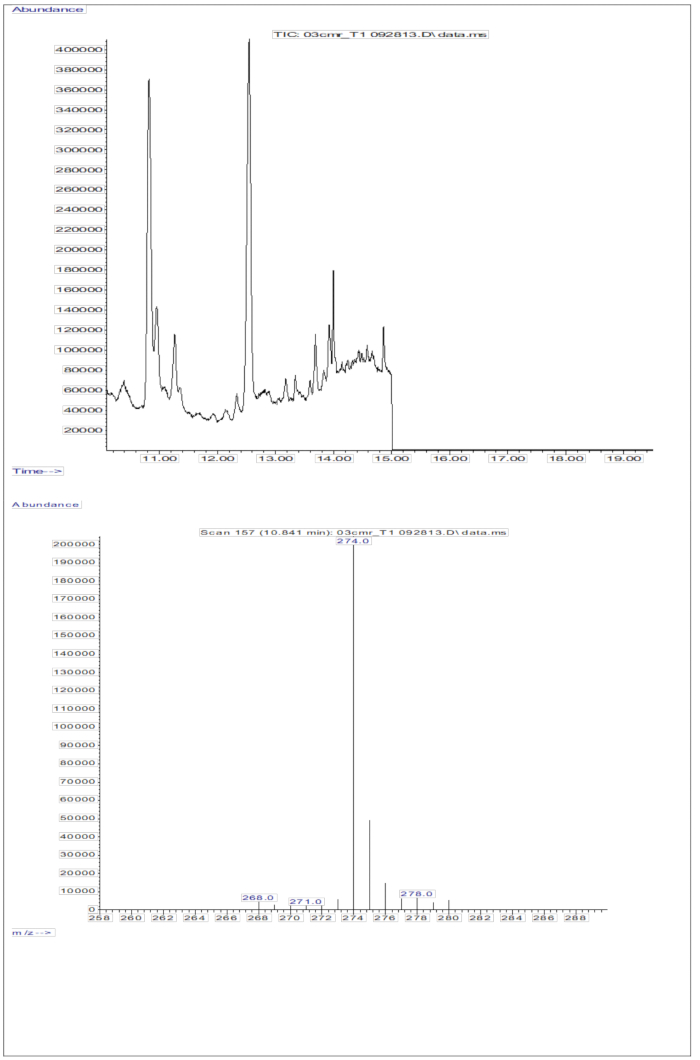
그림 5: 혈청 샘플의 크로마토그램 및 질량 스펙트럼. 이 그림은 혈청의 유도체화된 레티놀 분획 분석에서 얻은 가스 크로마토그래피/메탄 전자 포획 네거티브 화학 이온화-질량 분석 크로마토그램(상단 패널)을 보여줍니다. 하단 패널은 D8-레티놀에 대한 m/z 274를 보여주는 질량 스펙트럼입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 표준 | 무게 (mg) | 부피 플라스크(mL) | 용매 |
| 레티놀 | 40 | 100 | 에탄올 |
| 레티닐 아세테이트 | 40 | 100 | 에탄올 |
| 중수소 표지 레티닐 아세테이트 | 40 | 100 | 에탄올 |
표 1: 원액의 제조. 이 표는 레티놀 및 중수소 표지 레티닐 아세테이트의 농축 용액을 준비한 다음 향후 실험을 위해 더 낮은 농도로 희석할 수 있는 방법을 보여줍니다.
| 표준 | 원액(mL) | 부피 플라스크(mL) | 용매 |
| 레티놀 | 1 | 50 | 에탄올 |
| 레티닐 아세테이트 | 1 | 50 | 에탄올 |
| 중수소 표지 레티닐 아세테이트 | 1 | 50 | 에탄올 |
표 2: 희석된 원액의 제조. 이 표는 레티놀 및 중수소 표지 레티닐 아세테이트의 즉시 사용 가능한 용액을 준비하는 방법을 보여줍니다.
| 표준 | 파장 (nm) | E1%1 cm |
| 레티놀 | 325 | 1850 |
| 레티닐 아세테이트 | 326 | 1550 |
표 3: 파장 및 E1% 1cm(흡수 계수).
| 시간(분) | 유량(mL/분) | 이동상 A(%) | 이동상 B(%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
표 4: HPLC 이동상에 대한 시간표. 이 표는 HPLC 크로마토그래피 실행 중 여러 단계의 계획된 순서와 기간을 보여줍니다.
| 쉬쉬 | 증권 시세 표시기 | D | H | |
| 주제 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| 주제 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| 주제 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| 주제 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| 주제 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| 주제 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| 주제 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| 주제 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| 주제 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| 주제 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: m/z에서 피크 면적의 합 268, 269 및 270 | ||||
| SD: m/z에서 피크 면적의 합 274, 275, 276, 277 및 278 | ||||
| D: 표지된 레티놀의 농축 | ||||
| H: 라벨링되지 않은 레티놀 수준 |
표 5: 혈청의 유도체화된 레티놀 분획의 GC/MS 결과. 이 표는 비타민 A 전신 저장량 계산에 필요한 GC/MS 출력을 보고합니다. H는 m/z 268, 269 및 270에서 피크 면적의 합입니다. D는 m/z 274, 275, 276, 277 및 278에서 피크 면적의 합입니다. D는 표지된 레티놀의 농축입니다. H는 표지되지 않은 레티놀의 수준입니다. TBS는 비타민 A 토탈 바디 스토어입니다.
토론
이 프로토콜의 성공적인 구현은 각 단계의 효과적인 실행에 달려 있습니다. 솔루션 및 표준의 적절한 준비는 수집된 데이터가 정확하고 신뢰할 수 있도록 하는 데 중요합니다. 프로토콜에 설명된 절차는 다양한 환경에서 테스트되었으며 샘플 분석의 목적을 충족하는 솔루션 및 표준을 얻는 데 적합합니다.
샘플 분석은 혈청에서 레티놀을 추출하고 분리하는 것으로 시작됩니다. 혈청 샘플은 비타민 A의 분해를 방지하기 위해 분석이 필수적일 때까지 -80°C에서 보관해야 합니다. 또한 어두운 곳에서 작업해야 합니다16. 레티놀 분획을 수집하는 데 사용되는 HPLC 절차는 유도체화 공정의 간섭을 피하기 위해 다른 지용성 성분에서 레티놀을 분리하도록 설계되었습니다. 또한 컬럼을 세척하지 않고 수백 개의 샘플을 실행할 수 있습니다.
HPLC에서 수집된 레티놀 분획은 BSTFA로 70°C에서 30분 동안 유도체화됩니다. 유도체화 단계는 레티놀의 휘발성과 GC-MS에서 검출 가능성을 개선하는 데 중요합니다. 물에 민감하기 때문에 유도체화 전에 시료를 완전히 건조시키고 GC-MS 분석 전에 유도체화 반응이 발생할 수 있도록 충분한 시간을 허용하는 것이 중요합니다. BSTFA를 사용한 유도체화 공정은 N-메틸-N-(tert-부틸디메틸실릴) 트리플루오로아세트아미드(MTBSTFA)23,24를 사용한 것과 비교하여 매우 가볍고 효율적이며 스캔된 질량 범위14에서 테일링 또는 배경 피크가 없는 유도체화된 레티놀에 대해 매우 날카로운 피크를 제공하는 것으로 나타났습니다. 밀봉된 바이알에 담긴 유도체화된 레티놀은 분해 없이 4°C의 건조제에서 1개월 동안 보관할 수 있습니다14.
GC-MS 분석의 경우 컬럼의 적절한 보정 및 유지 관리를 보장하고 주입량, 온도 및 유속을 최적화하는 것이 중요합니다. 여기에 온-컬럼(on-column) 주입과 함께 사용된 조건은 우수하고 신뢰할 수 있는 결과를 보여주었다14. 중수소화 및 비표지 레티놀에 대한 GC-MS 분석 동안, Tang 등[14 ]은 투여된 용량과 투여된 피험자의 혈청 모두에서 중수소화 레티놀의 피크가 나타나는 것을 관찰했습니다. 이 패턴은 표지되지 않은 레티놀에서는 나타나지 않았습니다. 따라서 연구진은 중수소화 레티놀의 피크가 질량 분석기의 단편화의 결과가 아니라 용량에서 미리 형성된 것이라고 결론지었으며, 이는 중수소화 레티놀이 대사 과정을 통해 구조를 유지하여 생물학적 연구에서 레티놀을 추적하기 위한 신뢰할 수 있는 마커를 제공한다는 것을 시사합니다. 미취학 연령 소아에서 2mg의 D8-레티놀을 투여한 후 혈청 내 중수소화 레티놀의 농축은 7시간에 증가하기 시작하여 14일에 최고점에 도달했으며, 이는 최적의 샘플링 시간이 더 짧습니다25. 200μL의 인간 혈청에서 레티놀의 최소 검출 가능 농도는 0.01%이며, 이는 이 방법이 광범위한 비타민 A 상태를 가진 피험자로부터 수집한 혈청 샘플을 분석할 수 있을 만큼 민감하다는 것을 보여줍니다14.
여기에 제시된 안정 동위원소 희석 기법은 비타민 A 상태를 평가하는 데 상당한 이점을 제공하지만, 이 방법은 정교한 장비와 기술 전문 지식이 필요하여 비용이 많이 들고 많은 환경에서 일상적으로 사용하기에는 접근하기 어렵다는 점에 유의해야 합니다26. 따라서 이 기술을 사용할 계획일 때 이 제한 사항을 고려해야 합니다.
공개
이 원고는 IAEA에서 지원하는 Leveraging the Retinol Isotope Dilution Method for Assessing Vitamin A Body Stores and Liver Vitamin A Concentration(비타민 A 체내 저장 및 간 비타민 A 농도 평가를 위한 레티놀 동위원소 희석 방법 활용)이라는 제목의 시리즈의 일부입니다.
감사의 말
우리는 미국 보스턴 터프츠 대학교(Tufts University)의 카로티노이드 및 건강 연구소(Carotenoids and Health Laboratory)의 진 메이어(Jean Mayer) USDA 노화 인간 영양 연구 센터(Human Nutrition Research Center on Aging)에서 Guangwen Tang의 감독과 국제원자력기구(IAEA)의 재정 지원을 받는 펠로우십을 통해 이 프로토콜을 배웠습니다.
자료
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
참고문헌
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유