Method Article
GC-MSによる血清中のレチノールの重水素濃縮の分析とビタミンAの全身貯蔵量の推定
要約
この分析法では、血清からレチノールを抽出し、HPLCを用いてレチノールを分離し、GC-MSを用いて標識レチノール同位体と非標識レチノール同位体を決定します。標識レチノールと非標識レチノールの比率は、ビタミンAの総体貯蔵量を推定するために使用されます。
要約
この方法は、血清中のレチノールの重水素濃縮の測定と、体内のビタミンA貯蔵の推定を説明しています。このプロセスでは、0.5 mLの0.85%生理食塩水、100 μLの内部標準液、および5 mLのクロロホルムメタノール(2:1 v / v)溶液を使用して、0.4 mLの血清からレチノールを抽出します。遠心分離を行い、下部クロロホルム層を除去した後、混合物を窒素下で乾燥し、0.1 mLのエタノールに再懸濁し、PE C18カラムを備えたHPLCシステムを使用してレチノール画分を他の成分から分離します。レチノールフラクションは、手動で、またはフラクションコレクターを使用して回収できます。続いて、レチノール画分を窒素下で乾燥し、10%トリメチルクロロシランを含有するO-ビス(トリメチルシリル)トリフルオロアセトアミド(BSTFA)で誘導体化します。最後に、19091z-431 HP-1 メチルシロキサンキャピラリーカラムを搭載した GC-MS システムを使用して、ヘリウムをキャリアガスとし、メタンをイオン化剤とする電子捕獲ネガティブ化学イオン化を使用して、標識レチノール同位体および非標識レチノール同位体を定量します。次に、標識レチノールと非標識レチノールの比率をOlson、Green、または物質収支の式で使用して、ビタミンAの貯蔵量を推定します。
概要
ビタミンAは、視覚系と成長、上皮の完全性、赤血球の産生、免疫、および生殖のための細胞機能の維持に必要な必須栄養素です1。ビタミンA欠乏症は、世界中で深刻な公衆衛生問題であり、100か国以上が罹患しています。低所得国の幼児や妊婦に不釣り合いなほどの影響を与えています。ビタミンA欠乏症は、世界で約1億9,000万人の子どもが苦しんでおり、公衆衛生と子どもの発達にとって重大な問題となっています2。
このような状況に対応して、5歳未満の子供に高用量のビタミンAを半年ごとに配布するビタミンA補給や、特定の食品のビタミンA強化など、いくつかのプログラムが多くの低所得国で何十年にもわたって実施されてきました。しかし、これらの介入はしばしば重複し、一部の集団は不注意による慢性的なビタミンAの過剰摂取にさらされます3,4。この欠乏症と過剰の二重のリスクは、欠乏症から毒性まで、全スペクトルにわたってビタミンAの状態を正確に評価できるバイオマーカーの必要性を浮き彫りにしています。
ビタミンAバイオマーカーは、栄養状態を評価するために重要です。最も一般的に使用されるバイオマーカーは、レチノールおよびレチノール結合タンパク質(RBP)の血清濃度です。ただし、これらのバイオマーカーは感染症や炎症によって一時的に抑制される可能性があり、特定の集団ではビタミンA評価の特異性が低下する可能性があることに注意することが重要です5,6,7。
肝生検または剖検サンプルはビタミンAの状態を評価するためのゴールドスタンダードと考えられていますが、総肝臓ビタミンA埋蔵量の最も感度の高い間接的な指標はレチノール同位体希釈(RID)法です8。RIDは、欠乏状態から過剰貯蔵まで、全スペクトルにわたるビタミンAの状態を定量的に推定します9。ほとんどの研究アプリケーションでは、RID法では、重水素(2H)または13C標識酢酸レチニルを経口投与し、その後、14〜21日間にわたって体内貯蔵と混合します。この期間の後、血液サンプルを採取し、血清を-80°Cで保存します。 次いで、標識レチノールと総レチノールの比を質量分析を用いて分析し、オルソン式11、質量均衡式12、またはグリーン式13を用いて、ビタミンA貯蔵量10を推定する。この論文で提示されたプロトコルは、重水素(2H)または13C標識酢酸レチニルの投与に有効であり、Tang et al.14の研究に基づいています。この方法の全体的な目標は、体内のビタミンAの状態を正確に評価し、監視することです11。これは、欠乏症から過剰まで、幅広い状態にわたるビタミンA濃度を定量的に推定する強力な方法です15。これは、間接的な手段に頼ることが多い他の方法よりも正確で正確です9。
プロトコル
このプロトコルは、公衆衛生省の倫理委員会(No.2015/02/550/CE/CNERSH/SP)によって承認され、親/保護者からインフォームドコンセントが得られました。
注:ビタミンAは光に敏感であるため、すべての処置は薄暗い光または金色の蛍光灯の下で行うことが重要です16。使用した材料については 、資料表に詳しく記載されています。
1. 試薬の調製
- 塩化ナトリウム(0.85%w / v):0.85 gのNaClを蒸留水に溶解し、100 mLメスフラスコに入れます。目盛りまで蒸留水を入れて混ぜます。
- クロロホルム-メタノール(2:1 v / v):300 mLのクロロホルムを測定シリンダー付きの500 mLメスフラスコに移します。メタノール150mLを加えて混合します。
- HPLC用移動相A:アセトニトリル/テトラヒドロフラン/超純水(50/20/30、v/v/v):500 mLのアセトニトリルを1000 mLメスフラスコに移します。200mLのテトラヒドロフランと300mLの水を加えます。溶液を混合し、孔径0.45μmのメンブレンフィルターを用いて濾過し、超音波処理(振幅100%、周波数40kHz、持続時間15分)する。
- HPLC用移動相B:アセトニトリル/テトラヒドロフラン/超純水(50/44/6、v/v/v):500 mLのアセトニトリルを1000 mLメスフラスコに移します。440 mLのテトラヒドロフランと60 mLの水を加えます。.溶液を混合し、孔径0.45μmのメンブレンフィルターを用いて濾過し、超音波処理する。
2. 標準液の調製
- 表1に示すように、標準試料40 mgをエタノールに100 mLメスフラスコに溶解して、ストック溶液を調製します。目盛りのマークまで溶剤を充填し、よく混ぜます。
- 希釈したストック溶液: 表2に示すように、1 mLのストック溶液を50 mLのメスフラスコに移して、希釈したストック溶液を調製します。目盛りのマークまで適切な溶剤を充填し、十分に混合します。
- 希釈したストック溶液の濃度の測定:希釈した溶液のアリコート(1 mL)を石英管に入れ、エタノールをブランクとして使用して、分光光度計で指定の波長(表3)で吸光度を測定します。ランバート・ビールの法則17を使用して計算します。分析前に分光光度計が校正されていることを確認するには、装置を15〜30分間温め、目的の波長を選択し、ブランクをサンプルホルダーに置いて装置をゼロにします。次の式を使用して濃度を計算します。
濃度=(吸光度/吸収係数)×106 (μg/dL)
注:従来の単位(μg/dL)からSI単位(μmol/L)に値を変換するには、従来の値に次の変換係数を掛けます:酢酸レチニルの場合は0.0304、レチノール18の場合は0.0349です。 - 作業標準の調製:容量ピペットを使用して、希釈したストック溶液2 mLを100 mLのコニカルフラスコに移します。フラスコに目盛りまでエタノールを入れ、よく混ぜて栓で閉めます。
- 各溶液の正確な濃度を決定するには、C18 カラムと 340 nm に設定されたダイオードアレイ検出器を装備した HPLC を使用して、各成分の純度を評価します。 表4に示すスケジュールに従って、移動相Aと移動相Bを使用するようにポンプをプログラムします。分析前に、ポンプ、検出器、オートサンプラーなどのさまざまなコンポーネント、およびシステム全体の性能を検証することにより、HPLCシステムが校正されていることを確認してください。
- 希釈したストック溶液1 mLをクリンプバイアルに移し、通常の手順に従ってサンプルをHPLCシステムに注入します。次の式を使用して純度を決定します。
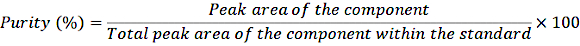
方程式 1
この純度の補正により、標準溶液中のさまざまな成分の正確な濃度を計算します。
- 内部標準品(酢酸レチニル OD ~ 0.2)の調製:メスピペットを使用して、酢酸レチニル作業用標準品 30 mL を 100 mL の円錐形フラスコに移します。フラスコに目盛りまでエタノールを入れ、よく混ぜて栓で閉めます。
- ワーキングソリューションの調製:10.00、3.33、1.00、0.33、および0.00 μgの標識レチノールに20 μgの非標識レチノールを加えて、0.500、0.167、0.050、0.0167、および0.00の標識レチノールおよび非標識レチノール比を提供します。
3. サンプル分析
注: この研究で使用された血清サンプルは、カメルーンの子供のビタミン A 状態を監視および評価するために設計された研究の一環として、D8-レチノールの経口投与 (2 mg レチノール相当) を受けた子供から 14日目 に収集されました。
- 血清中のレチノイドの抽出:この抽出は、Tang et al.14によって修正されたFolchら19の研究に基づいています。以下で説明する手順に従います。
- 凍結血清サンプルを室温(20-25°C)で穏やかに解凍してから分析してください。400 μL の血清を 16 x 100 mm のディスポーザブル培養チューブに分注します。500 μL の 0.85% 生理食塩水、100 μL の Internal Standard、5 mL のクロロホルム-メタノール (2:1 v/v) 溶液を添加します。
- ボルテックスで30秒間、1157 x gで4°Cで10分間遠心分離します。 ガラス製のパスツールピペットを使用して、クロロホルムの下層を13 x 100 mmの使い捨て培養チューブに慎重に取り除きます。窒素ガス下で水浴(40°C)で乾燥させ、残留物を100μLのエタノールに再懸濁します。ボルテックスし、30秒間超音波処理します。サンプルをインサート付きのクリンプバイアルに移し、ウェルを閉じてラベルします。サンプルはHPLCレチノールコレクションの準備ができています。
- 以下に説明するようにHPLCレチノール収集を行います。
- 各血清サンプルの70 μLを、C18カラムと340 nmに設定されたダイオードアレイ検出器を備えたHPLCシステムに注入します。 表 4 に示すスケジュールに従って、移動相 A および B を 1 mL/分の一定流量で送液するようにポンプをプログラムします。
- 血清サンプルを注入する前に、70 μL のレチノール作動溶液を HPLC システムに注入し、レチノールピークの保持時間を記録します。次に、フラクションコレクターをセットアップして、溶出されたレチノールフラクションを指定範囲内で5 mLチューブに収集し、すりガラスストッパー付きにします。この場合、レチノール画分を7.5〜10.5分という3分間隔で収集した。
注:レチノールの濃度は、レチノール標準の検量線と内部標準から得られた回収率を使用して、このステップで計算することもできます。
- 以下に説明するようにレチノールの誘導体化を行います。
- HPLCから回収したレチノール画分を窒素ガス下で40°Cの水浴中で少なくとも3時間乾燥させます。乾燥中の水分蒸発を促進するためにエタノールを添加します(誘導体化は水分に敏感であるため、サンプルは完全に乾燥させる必要があります)。20 μL の BSTFA と 10% TMCS をチューブに加えます。
- チューブを70°Cに設定したドライブロックヒーターに入れ、30分間インキュベートします。ガラスパスツールピペットを使用して、反応混合物をインサート付きのクリンプバイアルに移し、キャップクリンパーを使用してクリンプキャップでしっかりと密封し、ラベルを付けます。これでサンプルはGC/MS分析の準備ができており、分析まで4°Cのデシケーターに保存できます。
- さらに、100 μL の作業用標準溶液のセットを乾燥させ、上記のように誘導体化して GC/MS をキャリブレーションします。
注:BSTFAを用いたレチノールの誘導体化には、レチノールのヒドロキシル基(-OH)がトリメチルシリル基(-Si(CH3)3)で置換され、レチニルトリメチルシリルエーテルを形成する化学反応が含まれます。このプロセスにより、レチノールの揮発性と安定性が向上し、レチノールはGC/MS分析により適したものになります20。
- GC/MS分析:GC/MS分析は、Tang et al.14で説明されている手順を使用して実行されます。以下で説明する手順に従います。
- 0.25 μm の膜厚の DB-1 固定相でコーティングされた内径 15 m x 0.25 mm の溶融シリカキャピラリーカラムに、ゼロデッドボリュームコネクターを介して接続された冷却オンカラムインジェクターを使用して、オートサンプラーを使用して誘導体化レチノールサンプルの 3 μL を GC に注入します。
- カラムオーブンとオンカラムインジェクターの温度を 50 °C から 285 °C まで 15 °C/min の速度で上昇するようにプログラムし、GC/MS インターフェース温度を 285 °C に設定します。 キャリアガスとしてヘリウムを使用し、レチノールのトリメチルシリル誘導体を約12分間溶出します。
- イオン源温度を 150 °C に設定した 0.5 torr のメタン陰性イオン化学イオン化を使用して、四重極質量分析計で GC 溶出液を検出します。 質量分析計を260〜280ダルトンでスキャンするように設定します。
4. データ分析
- GC/MSデータ解析ソフトウェアを使用してください。
- 質量電荷比(m/z)に基づいて目的のイオンをすべて抽出し、ピークの面積を積分し(手動積分を使用してピークの開始点と終了点を調整します)、結果をスプレッドシートファイルに転送します。
注:使用する同位体に応じて、所望のイオンは次のようになります:天然レチノールの場合は268-270 m / z;[2H4]-レチノールの場合は271-274 m / z;[13C]-レチノールの場合は278-280 m / z;[2H8]-レチノールの場合は276-280 m / z。 - m/z 274、275、276、277、278 のピーク面積を加算して、標識レチノール(ΣD)のピーク和を計算します。m/z 268、269、270 にピーク面積を加算して、非標識レチノール(ΣH)のピーク和を計算します。
- 次の式を使用して、標識レチノール(D)の濃縮を計算します:D =ΣD/(ΣH+ΣD)。次の式を使用して、非標識レチノール(H)の量を計算します:H = 1 - D。
注:レチニルトリメチルシリルエーテルのガスクロマトグラフィー電子捕獲ネガティブ化学イオン化質量分析は、分子イオンではなく、非標識レチノールのm / z 268〜271、D 4-レチノールのm / z 272〜275、およびD 8-レチノール14のm / z 276〜280で主要なフラグメントイオンを提供します。 - システムを制御するには、キャリブレーション標準試料の重量比と、標識レチノールおよび非標識レチノールの積分領域との間の線形回帰方程式を計算します。
5. ビタミンAの貯蔵量の推定
注:このステップにより、個人のビタミンAの状態を評価できます。
- オルソン方程式11を使用してビタミンAの総肝臓貯蔵量を計算します
ビタミンA総肝臓貯蔵量 = F x 用量 x [S x a x (H/D - 1)]
ここで、Fは経口投与された用量(F = 0.50)の吸収および貯蔵の効率の因子であり、用量は経口投与された標識ビタミンAの量(μmol)であり、Sは標識されたレチノールと非標識レチノールの肝臓比に対する血漿の不等式を補正する因子(S = 0.65)、aは混合期間中の標識されたビタミンAの不可逆的な損失を補正する因子である。具体的には、a = e-kt、ここでkは推定されたシステム分数異化率(子供の場合k = ln 2/32日)、tは時間であり、投与からの日数で表されます。D/H は、標識レチノールと非標識レチノールの血清同位体比であり、-1 は、標識されたビタミン A の用量が全身のビタミン A プールに占める寄与を補正します。 - ビタミンAの全身貯蔵量(TBS)を計算するには、緑の方程式13を使用します
TBS=FA × S ×(1/SAp)
ここで、Faは、時間tで体内の交換可能な貯蔵プールに吸収され、発見されたVAの経口標識用量の割合であり、Sは、時間tにおける血清中のレチノール特異的活性と貯蔵中のレチノール特異的活性の比率である(小児の場合、14日でFa × S = 0.642)21。SApは、μmol用量あたりの血清中の用量の割合です(つまり、[標識レチノール]/([血清中の非標識+標識レチノール])/標識レチノール(μmol)の経口投与量)。
結果
約 50 pM/μL のキャリブラント(レチノールおよび D8-レチノール)を含む乾燥溶液の誘導体化サンプルの 3 μL を GC/MS に注入すると、分子イオンは示されませんでしたが、レチノールの m/z 268(図 1)と D8-レチノールの m/z 278(図 2)に主要なフラグメントイオンが示されました。このことは、レチノールおよびD8-レチノールの誘導体化中に形成されるレチニルトリメチルシリルエーテルの分子イオンが、GC/MSで使用されるイオン化条件下で安定しないことを示しています。それらは、主にアルファ切断を通じて、より小さな断片に分解されます。この一般的なフラグメンテーションパターンには、トリメチルシリルエーテル基に隣接する結合の切断が含まれます。アルファ切断は、トリメチルシリル基(TMS、質量73 Da)と水素原子の損失をもたらし、レチノールの質量が268 Da、D8-レチノールの質量が278 Daのフラグメントイオンにつながります22。このメカニズムは、質量分析中に生成される特定のフラグメントイオンを分析することにより、サンプル中のレチノールとその誘導体の存在を同定および確認するのに役立ちます。レチノールとD8-レチノールの混合物を注入すると、レチノールのm/z 268とD8-レチノールのm/z 276に2つの主要なフラグメントイオンが示され(図3)、サンプル中にこれらの化合物が存在することが示されました。検量線は、高い相関係数で示されるように優れた直線性を示し(図 4)、ピーク比と重量比の関係が非常に直線的で予測可能なパターンを持つことを示しています。
血清サンプルの注射から得られた GC/MS 反応 (D8-レチノール相当の 2 mg レチノール相当の経口投与を受けた小児の血清; 図5)は、レチノールとD8-レチノールの存在を示しており、m/z 268とm/z 274で2つの主要なフラグメントイオンが観察されました。イオンの抽出と、D8-レチノールの m/z 274、275、276、277、278 のピーク面積の波形解析、および非標識レチノールの m/z 268、269、270 のピーク面積の波形解析後に得られた結果を 表 5 に示します。これらの結果は、体内のビタミンA貯蔵を計算するために、オルソン方程式11 またはグリーン方程式13 に統合されます。
安定同位体希釈法は、他の方法では得られないビタミンA濃度の測定が可能となり、ビタミンAの状態を正確に評価することができます。この方法は、栄養学研究、臨床診断、疫学研究に有用です。
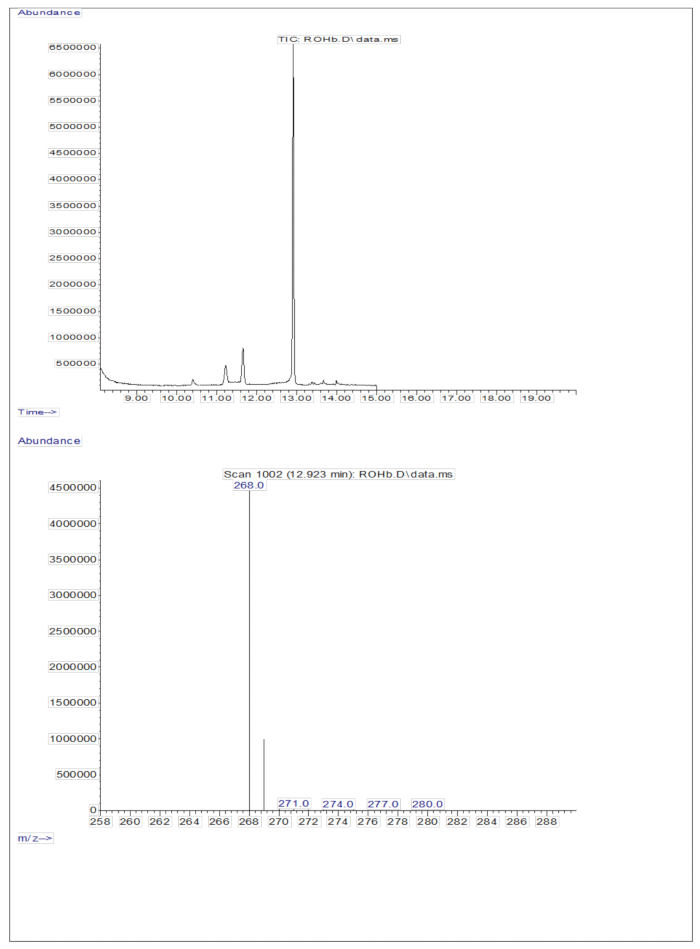
図1:レチノールのクロマトグラムと質量スペクトル。 図は、誘導体化されたレチノール標準試料の分析から得られたガスクロマトグラフィー/メタン電子捕獲ネガティブ化学イオン化質量分析クロマトグラム(上面)を示しています。底面パネルは、レチノールのm/z 268を示すマススペクトルです。 この図の拡大版を表示するには、ここをクリックしてください。

図2:D8-レチノールのクロマトグラムと質量スペクトル。 図は、誘導体化されたD8-レチノール標準試料の分析から得られたガスクロマトグラフィー/メタン電子捕獲ネガティブ化学イオン化質量分析クロマトグラム(上段)を示しています。底面パネルは、D8-レチノールのm/z 278を示すマススペクトルです。 この図の拡大版を表示するには、ここをクリックしてください。

図3:レチノールとD8-レチノール混合物のクロマトグラムと質量スペクトル。 図は、レチノール標準試料と D8-レチノール標準試料の誘導体化混合物の分析から得られたガスクロマトグラフィー/メタン電子捕獲ネガティブ化学イオン化質量分析クロマトグラム(上段)を示しています。底面パネルは、レチノールのm/z 268とD8-レチノールのm/z 276を示すマススペクトルです。 この図の拡大版を表示するには、ここをクリックしてください。
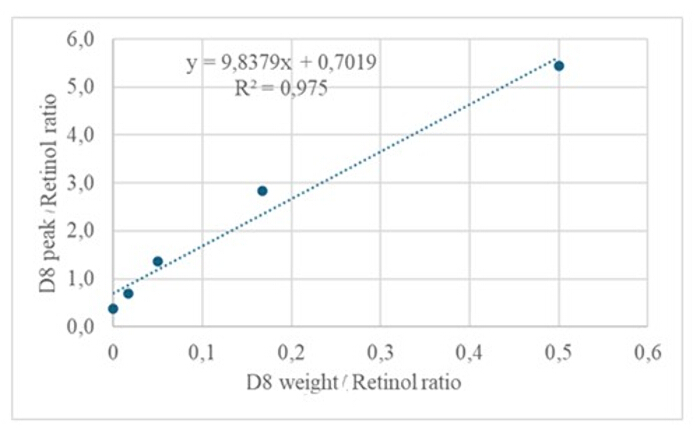
図4:検量線。 この図は、GC/MS レスポンスと非標識レチノールおよび標識レチノールの濃度との関係を示しています。これは、y = 9.8379x + 0.7019 という式で表され、y (面積比) は装置の応答、9.8379 は感度、x(重量比) は分析対象物の濃度、0.7019 はバックグラウンドシグナルです。 この図の拡大版を表示するには、ここをクリックしてください。
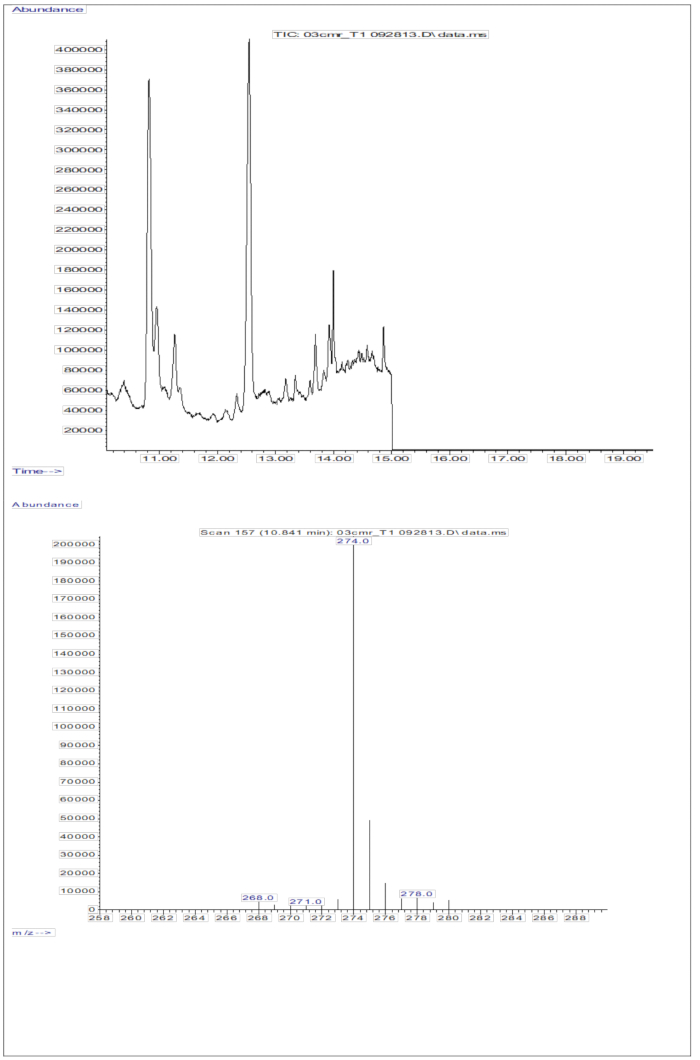
図5:血清サンプルのクロマトグラムと質量スペクトル。 この図は、血清の誘導体化レチノール画分の分析から得られたガスクロマトグラフィー/メタン電子捕獲ネガティブ化学イオン化質量分析クロマトグラム(上段)を示しています。底面パネルは、D8-レチノールのm/z 274を示すマススペクトルです。 この図の拡大版を表示するには、ここをクリックしてください。
| 標準 | 重量(mg) | メスフラスコ(mL) | 溶媒 |
| レチノール | 40 | 100 | エタノール |
| 酢酸レチニル | 40 | 100 | エタノール |
| 重水素標識酢酸レチニル | 40 | 100 | エタノール |
表1:原液の調製。 この表は、レチノールおよび重水素標識酢酸レチニルの濃縮溶液を調製し、将来の実験のために低濃度に希釈する方法を示しています。
| 標準 | 原液(mL) | メスフラスコ(mL) | 溶媒 |
| レチノール | 1 | 50 | エタノール |
| 酢酸レチニル | 1 | 50 | エタノール |
| 重水素標識酢酸レチニル | 1 | 50 | エタノール |
表2:希釈した原液の調製。 この表は、レチノールおよび重水素標識酢酸レチニルのすぐに使用できる溶液の調製方法を示しています。
| 標準 | 波長(nm) | Eサイズ1%1 cm |
| レチノール | 325 | 1850 |
| 酢酸レチニル | 326 | 1550 |
表3:波長とE1%1cm(吸収係数)。
| 時間 (分) | 流量 (mL/min) | 移動相 A (%) | 移動相 B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100→50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50→0 | 50→100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100→0 |
表4:HPLC移動相のタイムスケジュール。 この表は、HPLCクロマトグラフィー分析中のさまざまな相の計画されたシーケンスと期間を示しています。
| SHさん | SDの | D | H | |
| 課題1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| 課題2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| 課題3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| 課題4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| 課題5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| 課題6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| 課題7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| 課題8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| 課題9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| 課題10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH:m/z 268、269、270 におけるピーク面積の合計 | ||||
| SD:m/z 274、275、276、277、278 におけるピーク面積の合計 | ||||
| D:標識レチノールの濃縮 | ||||
| H:非標識レチノールのレベル |
表5:血清中の誘導体化レチノール画分のGC/MS結果。 この表は、ビタミンA全身貯蔵の計算に必要なGC/MS出力を示しています。H は、m/z 268、269、および 270 のピーク面積の合計です。D は、m/z 274、275、276、277、および 278 のピーク面積の合計です。Dは標識レチノールの濃縮です。Hは非標識レチノールのレベルです。TBSはビタミンAトータルボディストアです。
ディスカッション
このプロトコルが成功するかどうかは、各ステップの効果的な実行にかかっています。溶液と標準試料の適切な調製は、収集されたデータが正確で信頼性が高いことを保証するために重要です。プロトコールに記載されている手順は、さまざまな設定でテストされており、サンプル分析の目的を満たす溶液と標準を取得するのに適しています。
サンプルの分析は、血清中のレチノールの抽出と分離から始まります。ビタミンAの分解を防ぐためには、分析まで血清サンプルを-80°Cで保存することが不可欠であり、さらに薄暗い場所での作業も必要です16。レチノール画分の収集に使用されるHPLC手順は、誘導体化プロセスへの干渉を避けるために、レチノールを他の脂溶性成分から分離するように設計されています。また、カラムをフラッシュせずに数百のサンプルを実行することもできます。
HPLCから採取したレチノール画分をBSTFAで70°Cで30分間誘導体化します。誘導体化ステップは、GC-MSにおけるレチノールの揮発性とその検出可能性を改善するために重要です。水に弱いため、誘導体化前にサンプルを完全に乾燥させ、GC-MS分析の前に誘導体化反応が起こるのに十分な時間を確保することが重要です。BSTFAによる誘導体化プロセスは、N-メチル-N-(tert-ブチルジメチルシリル)トリフルオロアセトアミド(MTBSTFA)23,24を使用したものと比較して非常に穏やかで効率的であり、誘導体化されたレチノールに対して非常に鋭いピークを提供し、スキャンされた質量範囲14にテーリングまたはバックグラウンドピークがないことが注目されました。密封されたバイアル中の誘導体化レチノールは、デシケーターで4°Cで1ヶ月間、分解することなく保持することができる14。
GC-MS 分析では、カラムの適切なキャリブレーションとメンテナンスを確保し、注入量、温度、および流量を最適化することが重要です。ここでオンカラム注入に使用した条件では、良好で信頼性の高い結果が示されました14。重水素化レチノールおよび非標識レチノールのGC-MS分析中に、Tangら14は、重水素化レチノールのピークが投与された用量と用量を受けた被験者の血清の両方に現れることを観察しました。このパターンは、非標識レチノールでは見られませんでした。したがって、重水素化レチノールのピークは用量中に事前に形成されており、質量分析計での断片化の結果ではないと結論付け、重水素化レチノールが代謝過程を通じてその構造を維持していることを示唆しており、生物学的研究でレチノールを追跡するための信頼性の高いマーカーを提供していることが示唆されています。就学前の小児に2mgのD8-レチノールを投与した後の血清中の重水素化レチノールの濃縮は、7時間で増加し始め、14日でピークに達しました。200μLのヒト血清中、レチノールの最小検出可能濃縮率は0.01%であり、この分析法が広範囲のビタミンA状態の被験者から採取した血清サンプルを分析するのに十分な感度を持っていることを実証している14。
ここで紹介する安定同位体希釈技術は、ビタミンAの状態を評価するための大きな利点を提供するが、この方法は高度な機器と技術的な専門知識を必要とするため、高価で、多くの環境での日常的な使用にはアクセスしにくいことに注意する必要があります26。したがって、この手法の使用を計画するときは、この制限を考慮することが不可欠です。
開示事項
この原稿は、IAEAが支援する「Utilizing the Retinol Isotope Dilution Method for Assessing Vitamin A Body Stores and Liver Vitamin A Concentration」と題されたシリーズの一部です。
謝辞
このプロトコルは、米国ボストンのタフツ大学Jean Mayer USDA Human Nutrition Research Center on AgingのCarotenoids and Health Laboratoryでのフェローシップで、Guangwen Tangの監督と国際原子力機関(IAEA)の財政支援を受けて学びました。
資料
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto?injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
参考文献
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved