Method Article
Análisis GC-MS del enriquecimiento de deuterio de retinol en suero y estimación de las reservas totales de vitamina A en el cuerpo
En este artículo
Resumen
Este método consiste en extraer el retinol del suero, separarlo mediante HPLC y determinar los isótopos de retinol marcados y no marcados mediante GC-MS. La proporción de retinol marcado y no marcado se utiliza para estimar las reservas totales de vitamina A en el cuerpo.
Resumen
Este método describe la determinación del enriquecimiento de deuterio de retinol en suero y la estimación de las reservas de vitamina A en el cuerpo. El proceso consiste en extraer retinol de 0,4 mL de suero utilizando 0,5 mL de solución salina al 0,85%, 100 μL de solución estándar interna y 5 mL de solución de cloroformo-metanol (2:1 v/v). Después de la centrifugación y la eliminación de la capa inferior de cloroformo, la mezcla se seca bajo nitrógeno y se resuspende en 0,1 mL de etanol, y la fracción de retinol se separa de otros constituyentes mediante un sistema de HPLC equipado con una columna de PE C18. La fracción de retinol se puede recoger manualmente o con un colector de fracciones. Posteriormente, la fracción de retinol se seca bajo nitrógeno y se derivatiza con O-bis(trimetilsilil)trifluoroacetamida (BSTFA) que contiene un 10% de trimetilclorosilano. Finalmente, los isótopos de retinol marcados y no marcados se cuantifican utilizando un sistema GC-MS equipado con una columna capilar de metilsiloxano 19091z-431 HP-1, empleando ionización química negativa por captura de electrones con helio como gas portador y metano como agente de ionización. La proporción de retinol marcado y no etiquetado se utiliza en las ecuaciones de Olson, Green o balance de masa para estimar las reservas de vitamina A.
Introducción
La vitamina A es un nutriente esencial necesario para el sistema visual y el mantenimiento de la función celular para el crecimiento, la integridad epitelial, la producción de glóbulos rojos, la inmunidad yla reproducción. La deficiencia de vitamina A es un grave problema de salud pública en todo el mundo que afecta a más de 100 países. Afecta de manera desproporcionada a los niños pequeños y a las mujeres embarazadas en los países de bajos ingresos. Aproximadamente 190 millones de niños en todo el mundo sufren de deficiencia de vitamina A, lo que la convierte en un problema crítico para la salud pública y el desarrollo infantil2.
En respuesta a esta situación, en muchos países de bajos ingresos se han implementado varios programas, entre ellos la suplementación con suplementos de vitamina A con distribución semestral de altas dosis de vitamina A a niños menores de 5 años y el enriquecimiento con vitamina A de ciertos productos alimenticios. Sin embargo, estas intervenciones a menudo se superponen, exponiendo a algunas poblaciones a una ingesta excesiva crónica inadvertida de vitamina A 3,4. Este doble riesgo de deficiencia y exceso pone de manifiesto la necesidad de un biomarcador que pueda evaluar con precisión el estado de la vitamina A en todo el espectro, desde la deficiencia hasta la toxicidad, para guiar la evaluación del programa.
Los biomarcadores de vitamina A son cruciales para evaluar el estado nutricional. Los biomarcadores más utilizados son las concentraciones séricas de retinol y la proteína de unión al retinol (RBP). Sin embargo, es importante tener en cuenta que estos biomarcadores pueden ser suprimidos temporalmente por infecciones e inflamación, lo que puede disminuir la especificidad de las evaluaciones de vitamina A en ciertas poblaciones 5,6,7.
Si bien las muestras de biopsia o autopsia hepática se consideran el estándar de oro para evaluar el estado de vitamina A, el indicador indirecto más sensible de las reservas totales de vitamina A en el hígado es el método de dilución de isótopos de retinol (RID)8. El RID proporciona una estimación cuantitativa del estado de la vitamina A en todo el espectro, desde las reservas deficientes hasta las excesivas9. En la mayoría de las aplicaciones de investigación, el método RID implica la administración de una dosis oral de deuterio (2H) o acetato de retinilo marcado con 13C, que luego se mezcla con las reservas corporales durante un período de 14 a 21 días. Después de este período, se recoge una muestra de sangre y el suero se almacena a -80 °C. A continuación, se analiza la proporción de retinol marcado y total mediante espectrometría de masas para estimar las reservas de vitaminaA 10, empleando la ecuación11 de Olson, la ecuación12 del balance de masas o la ecuación13 de Green. El protocolo presentado en este trabajo es válido para la administración de acetato de retinilo marcado con deuterio (2H) o 13C y se basa en el trabajo de Tang et al.14. El objetivo general de este método es evaluar y controlar con precisión el estado de la vitamina A en el cuerpo11. Es un método poderoso que proporciona una estimación cuantitativa de las concentraciones de vitamina A en un amplio espectro de estados, desde la deficiencia hasta el exceso de15. Es más exacto y preciso que otros métodos, que a menudo se basan en medidas indirectas9.
Protocolo
El protocolo fue aprobado por el Comité de Ética del Ministerio de Salud Pública (nº 2015/02/550/CE/CNERSH/SP) y se obtuvo el consentimiento informado de los padres/tutores.
NOTA: Debido a que la vitamina A es sensible a la luz, es crucial que todos los procedimientos se realicen con luz tenue o bajo iluminación fluorescente dorada16. Los materiales utilizados se detallan en la Tabla de Materiales.
1. Preparación de reactivos
- Cloruro de sodio (0,85% p/v): Disolver 0,85 g de NaCl en agua destilada en un matraz aforado de 100 mL. Llene hasta la marca de graduación con agua destilada y mezcle.
- Cloroformo-metanol (2:1 v/v): Transfiera 300 mL de cloroformo a un matraz aforado de 500 mL con un cilindro de medición. Agregue 150 mL de metanol y mezcle.
- Fase A móvil para HPLC: Acetonitrilo/Tetrahidrofurano/agua ultrapura (50/20/30, v/v/v): Transfiera 500 mL de acetonitrilo a un matraz aforado de 1000 mL. Añadir 200 mL de tetrahidrofurano y 300 mL de agua. Mezclar la solución, filtrarla con un filtro de membrana con un tamaño de poro de 0,45 μm y sonicar (amplitud 100%, frecuencia 40 kHz y duración 15 min).
- Fase móvil B para HPLC: Acetonitrilo/Tetrahidrofurano/agua ultrapura (50/44/6, v/v/v): Transfiera 500 mL de acetonitrilo a un matraz aforado de 1000 mL. Añadir 440 mL de Tetrahidrofurano y 60 mL de agua. Mezclar la solución, filtrarla con un filtro de membrana con un tamaño de poro de 0,45 μm y sonicarla.
2. Preparación de soluciones estándar
- Prepare la solución madre disolviendo 40 mg del patrón en etanol en un matraz aforado de 100 mL, como se ilustra en la Tabla 1. Llene hasta la marca de graduación con el disolvente y mezcle bien.
- Soluciones madre diluidas: Prepare la solución madre diluida transfiriendo 1 mL de la solución madre a un matraz aforado de 50 mL, como se muestra en la Tabla 2. Llene hasta la marca de graduación con el disolvente adecuado y mezcle bien.
- Determinación de la concentración de soluciones madre diluidas: Colocar una alícuota (1 mL) de la solución diluida en un tubo de cuarzo y medir su absorbancia en el espectrofotómetro a la longitud de onda especificada (Tabla 3) utilizando etanol como blanco. Calcule el utilizando la Ley de Lambert-Beer17. Asegúrese de que el espectrofotómetro esté calibrado antes del análisis calentando el instrumento durante 15-30 minutos, seleccionando la longitud de onda deseada y poniendo a cero el instrumento colocando el blanco en el portamuestras. Calcule la concentración utilizando la siguiente fórmula:
Concentración = (coeficiente de absorbancia/absorción) x 106 (μg/dL)
NOTA: Para convertir valores de unidades convencionales (μg/dL) a unidades S.I. (μmol/L), multiplique el valor convencional por los siguientes factores de conversión: 0,0304 para el acetato de retinilo y 0,0349 para el retinol18. - Preparación de los patrones de trabajo: Con una pipeta volumétrica, trasvasar 2 mL de las soluciones madre diluidas a un matraz cónico de 100 mL. Llene el matraz hasta la marca de graduación con etanol, mezcle bien y cierre con un tapón.
- Para determinar la concentración exacta de cada solución, evalúe la pureza de cada componente utilizando HPLC equipado con una columna C18 y un detector de matriz de diodos configurado a 340 nm. Programe la bomba para usar la Fase A Móvil y la Fase B Móvil de acuerdo con el horario que se muestra en la Tabla 4. Asegúrese de que el sistema de HPLC esté calibrado antes del análisis validando varios componentes, como la bomba, el detector, el muestreador automático y el rendimiento de todo el sistema.
- Transfiera 1 ml de las soluciones madre diluidas a viales de engarce e inyecte las muestras en el sistema de HPLC de acuerdo con el procedimiento normal. Determine la pureza usando la siguiente ecuación:
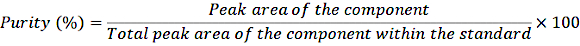
ECUACIÓN 1
Con esta corrección de pureza, calcule la concentración exacta de los diferentes componentes en la solución estándar.
- Preparación del patrón interno (acetato de retinilo OD ~ 0,2): Con una pipeta volumétrica, transfiera 30 mL del patrón de trabajo de acetato de retinilo a un matraz cónico de 100 mL. Llene el matraz hasta la marca de graduación con etanol, mezcle bien y cierre con un tapón.
- Preparación de soluciones de trabajo: Añadir 20 μg de retinol no marcado a 10,00, 3,33, 1,00, 0,33 y 0,00 μg de retinol etiquetado para proporcionar proporciones de retinol marcado y no marcado de 0,500, 0,167, 0,050, 0,0167 y 0,00.
3. Análisis de la muestra
NOTA: Las muestras de suero utilizadas en este estudio se recolectaron el día 14 de niños que recibieron una dosis oral (2 mg equivalentes de retinol) de D8-retinol como parte de un estudio diseñado para monitorear y evaluar el estado de vitamina A de los niños en Camerún.
- Extracción de retinoides en suero: Esta extracción se basa en el trabajo de Folch et al.19 modificado por Tang et al.14. Siga los pasos que se describen a continuación.
- Deje que las muestras de suero congeladas se descongelen suavemente a temperatura ambiente (20-25 °C) antes del análisis. Alícuota 400 μL de suero en un tubo de cultivo desechable de 16 x 100 mm. Añadir 500 μL de solución salina al 0,85% más 100 μL de patrón interno y 5 mL de solución de cloroformo-metanol (2:1 v/v).
- Vórtice durante 30 s y centrífuga a 1157 x g durante 10 min a 4 °C. Con una pipeta Pasteur de vidrio, retire con cuidado la capa inferior de cloroformo y colóquela en un tubo de cultivo desechable de 13 x 100 mm. Secar bajo gas nitrógeno en un baño de agua (40 °C) y resuspender el residuo en 100 μL de etanol. Vórtice y sonicate durante 30 s. Transfiera la muestra a un frasco de engarce con un inserto, cierre el pocillo y etiquete. La muestra está lista para la recolección de retinol por HPLC.
- Realice la recolección de retinol por HPLC como se describe a continuación.
- Inyecte 70 μL de cada muestra de suero en un sistema de HPLC equipado con una columna C18 y un detector de matriz de diodos configurado a 340 nm. Programe la bomba para suministrar las fases móviles A y B a un caudal constante de 1 mL/min, siguiendo el programa que se muestra en la Tabla 4.
- Antes de inyectar las muestras de suero, inyecte 70 μL de la solución de trabajo de retinol en el sistema de HPLC y registre el tiempo de retención del pico de retinol. A continuación, configure el colector de fracciones para recoger la fracción de retinol eluida dentro de un rango especificado en un tubo de 5 ml con un tapón de vidrio esmerilado. En este caso, la fracción de retinol se recogió en un intervalo de 3 min, de 7,5 a 10,5 min.
NOTA: La concentración de retinol también se puede calcular en este paso utilizando una curva de calibración de los patrones de retinol y la tasa de recuperación obtenida del patrón interno.
- Realice la derivatización del retinol como se describe a continuación.
- Secar la fracción de retinol recogida de la HPLC bajo gas nitrógeno en un baño de agua a 40 °C durante al menos 3 h. Agregue etanol para facilitar la evaporación de la humedad durante el secado (las muestras deben estar completamente secas, ya que la derivatización es sensible a la humedad). Añada 20 μL de BSTFA con un 10% de TMCS al tubo.
- Coloque el tubo en un calentador de bloque seco ajustado a 70 °C e incube durante 30 minutos. Con una pipeta Pasteur de vidrio, transfiera la mezcla de reacción a un vial de engarce con un inserto, selle herméticamente con la tapa de engarce con una engarzadora de tapas y etiquételo. La muestra ya está lista para el análisis GC/MS y puede almacenarse en un desecador a 4 °C hasta el análisis.
- Además, seque un conjunto de 100 μL de soluciones estándar de trabajo y derivítelas como se describe anteriormente para calibrar el GC/MS.
NOTA: La derivatización del retinol mediante BSTFA implica una reacción química en la que el grupo hidroxilo (-OH) del retinol se sustituye por el grupo trimetisilil (-Si(CH3)3), formando éter de trimetilsilil retinilo. Este proceso mejora la volatilidad y la estabilidad del retinol, lo que lo hace más adecuado para el análisis GC/MS20.
- Análisis GC/MS: El análisis GC/MS se realiza utilizando el procedimiento descrito por Tang et al.14. Siga los pasos que se describen a continuación.
- Inyecte 3 μL de la muestra de retinol derivatizada utilizando un muestreador automático en el GC con un inyector en columna frío conectado a través de un conector de volumen muerto cero a una columna capilar de sílice fundida de 15 m x 0,25 mm de diámetro interior recubierta con una fase estacionaria DB-1 de 0,25 μm de espesor de película.
- Programe las temperaturas del horno de columna y del inyector en columna para que aumenten de 50 °C a 285 °C a una velocidad de 15 °C/min, y ajuste la temperatura de la interfaz GC/MS a 285 °C. Utilice helio como gas portador para eluir el derivado trimetilsilil del retinol durante aproximadamente 12 minutos.
- Detecte el eluido de GC con un espectrómetro de masas cuadrupolar que utiliza ionización química de iones negativos de metano de 0,5 torr, con la temperatura de la fuente de iones ajustada a 150 °C. Configure el espectrómetro de masas para escanear entre 260 y 280 daltons.
4. Análisis de datos
- Utilice el software de análisis de datos GC/MS.
- Extraiga todos los iones deseados en función de sus relaciones masa-carga (m/z), integre el área del pico (utilice la integración manual para ajustar los puntos inicial y final del pico) y transfiera los resultados a un archivo de hoja de cálculo.
NOTA: Dependiendo del isótopo utilizado, los iones deseados serán los siguientes: 268-270 m/z para el retinol nativo; 271-274 m/z para [2H4]-retinol; 278-280 m/z para [13C]-retinol; y 276-280 m/z para [2H8]-retinol. - Calcule la suma de los picos para el retinol marcado (ΣD) agregando el área de pico en m/z 274, 275, 276, 277 y 278. Calcule la suma de los picos para el retinol no marcado (ΣH) agregando el área de pico a m/z 268, 269 y 270.
- Calcule el enriquecimiento de retinol (D) marcado utilizando la siguiente ecuación: D = ΣD/(ΣH + ΣD). Calcule la cantidad de retinol (H) sin etiquetar usando la siguiente ecuación: H = 1 - D.
NOTA: La espectrometría de masas de ionización química negativa por captura de electrones por cromatografía de gases del éter de retinil trimetilsilil no proporciona ningún ion molecular, sino un ion fragmento principal a m/z 268 a 271 para el retinol no marcado, a m/z 272 a 275 para el D4-retinol y a m/z 276 a 280 para el D8-retinol14. - Para controlar el sistema, calcule una ecuación de regresión lineal entre las proporciones de peso de los patrones de calibración y las áreas integradas para el retinol marcado y el retinol no marcado.
5. Estimación de las reservas de vitamina A
NOTA: Este paso permite evaluar el estado de vitamina A de una persona.
- Calcule las reservas totales de vitamina A del hígado utilizando la ecuación de Olson11
Reservas totales de vitamina A en el hígado = F x Dosis x [S x a x (H/D - 1)]
donde F es un factor para la eficiencia de la absorción y el almacenamiento de la dosis administrada por vía oral (F = 0,50), Dosis es la cantidad de vitamina A marcada administrada por vía oral (μmol), S es un factor que corrige la desigualdad de la proporción entre el plasma y el hígado de retinol marcado y no marcado (S = 0,65), a es un factor que corrige la pérdida irreversible de vitamina A marcada durante el período de mezcla; Específicamente, A = E-KT, donde K es la tasa catabólica fraccional estimada del sistema (K = LN 2/32 días para niños), y T es el tiempo, expresado como días desde la dosis; D/H es la proporción isotópica sérica de retinol marcado y no marcado, -1 corrige la contribución de la dosis de vitamina A marcada a la reserva total de vitamina A del cuerpo. - Para calcular las reservas totales de vitamina A (TBS, por sus siglas en inglés), utilice la ecuación de Green13
TBS = Fa × S × (1/SAp)
donde Fa es la fracción de la dosis de VA marcada por vía oral absorbida y encontrada en las reservas de almacenamiento intercambiables del cuerpo en el momento t, y S es la relación entre la actividad específica del retinol en el suero y la almacenada en el momento t (para los niños, Fa × S = 0,642 a los 14 días)21. La SAp es la fracción de la dosis en suero por dosis de μmol (es decir, [retinol marcado] / ([retinol no marcado + retinol marcado] en suero) / dosis oral de retinol marcado (μmol)).
Resultados
La inyección de 3 μL de una muestra derivatizada de una solución seca que contenía aproximadamente 50 pM/μL de calibrantes (retinol y D 8-retinol) en el GC/MS no mostró ningún ion molecular, pero exhibió un ion de fragmento principal a m/z 268 para el retinol (Figura 1) y m/z 278 para el D8-retinol (Figura 2). Esto indica que los iones moleculares del éter de retinilo trimetisililo, formados durante la derivatización del retinol y el D8-retinol, no son estables en las condiciones de ionización utilizadas en GC/MS. Se descomponen en fragmentos más pequeños, principalmente a través de la escisión alfa. Este patrón de fragmentación común implica la ruptura del enlace adyacente al grupo éter trimetilsililo. La escisión alfa da como resultado la pérdida del grupo trimetilesililo (TMS, que tiene una masa de 73 Da) y un átomo de hidrógeno, lo que conduce a un ion fragmento con una masa de 268 Da para el retinol y 278 Da para el D8-retinol22. Este mecanismo ayuda a identificar y confirmar la presencia de retinol y sus derivados en la muestra mediante el análisis de los iones de fragmentos específicos producidos durante la espectrometría de masas. La inyección de mezclas de retinol y D8-retinol mostró dos iones de fragmento principales a m/z 268 para el retinol y m/z 276 para el D8-retinol (Figura 3), lo que indica la presencia de estos compuestos en la muestra. La curva de calibración exhibió una excelente linealidad, como lo indica un alto coeficiente de correlación (Figura 4), lo que muestra que la relación entre la relación de pico y la relación de peso tiene un patrón muy recto y predecible.
La respuesta de GC/MS obtenida de las inyecciones de muestras de suero (suero de niños que recibieron una dosis oral de 2 mg de retinol equivalentes de D8-retinol; Figura 5) muestra la presencia de retinol y D8-retinol, con los dos iones de fragmento principales observados en m/z 268 y m/z 274. En la Tabla 5 se presentan los resultados obtenidos después de la extracción de iones y la integración de las áreas pico en m/z 274, 275, 276, 277 y 278 para D8-retinol y en m/z 268, 269 y 270 para el retinol no marcado. Estos resultados deben integrarse en la ecuación11 de Olson o en la ecuación13 de Green para calcular las reservas de vitamina A en el organismo.
La técnica de dilución de isótopos estables proporciona mediciones de los niveles de vitamina A que no se pueden obtener por otros métodos, lo que permite evaluaciones precisas del estado de la vitamina A. Este método es valioso para estudios nutricionales, diagnósticos clínicos e investigaciones epidemiológicas.
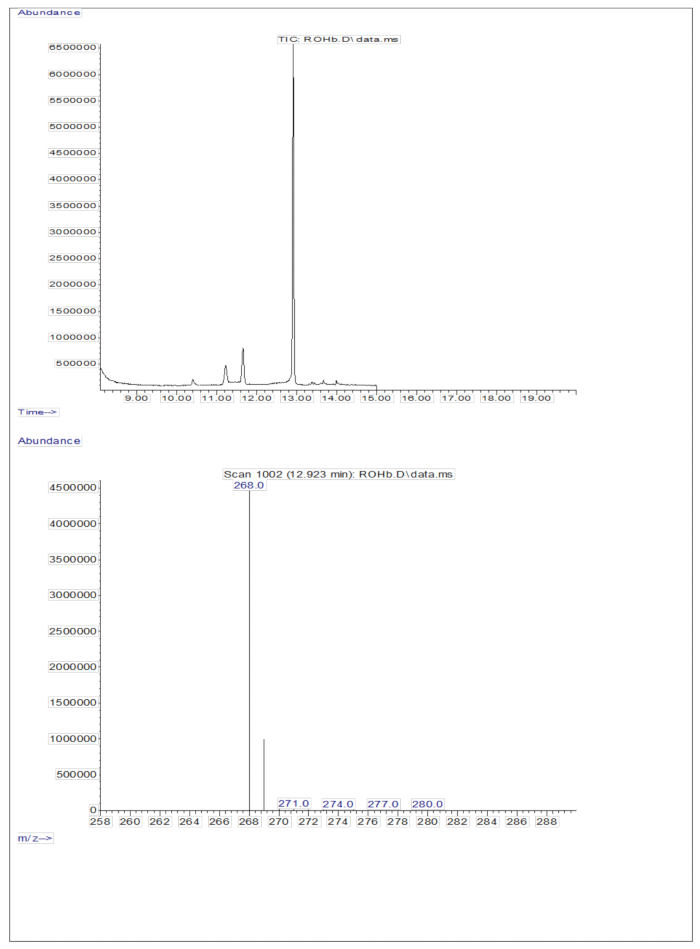
Figura 1: Cromatograma y espectro de masas de retinol. La figura muestra el cromatograma de cromatografía de gases/captura de electrones de metano por ionización química negativa-espectrometría de masas (panel superior) a partir del análisis del patrón de retinol derivatizado. El panel inferior es un espectro de masas que muestra m/z 268 para retinol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Cromatograma y espectro de masas de D8-retinol. La figura muestra el cromatograma de cromatografía de gases/captura de electrones de metano por ionización química negativa-espectrometría de masas (panel superior) del análisis del patrón D8-retinol derivatizado. El panel inferior es un espectro de masas que muestra m/z 278 para D8-retinol. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Cromatograma y espectro de masas de una mezcla de retinol y D8-retinol. La figura muestra el cromatograma de cromatografía de gases/captura de electrones de metano por ionización química negativa-espectrometría de masas (panel superior) a partir del análisis de una mezcla derivatizada de patrones de retinol y D8-retinol. El panel inferior es un espectro de masas que muestra m/z 268 para el retinol y m/z 276 para el D8-retinol. Haga clic aquí para ver una versión más grande de esta figura.
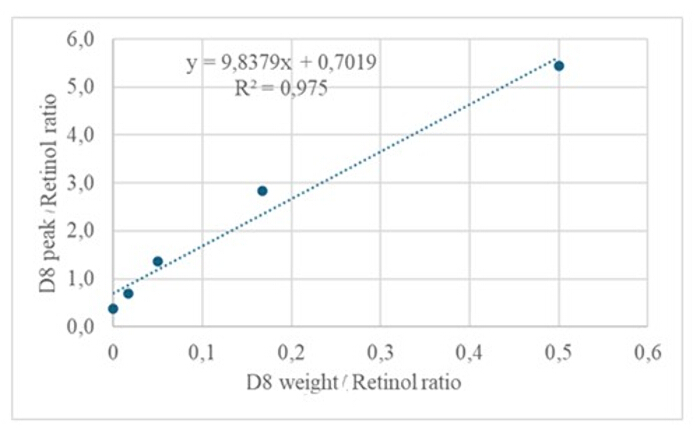
Figura 4: Curva de calibración. Esta figura ilustra la relación entre la respuesta de GC/MS y la concentración de retinol no marcado y marcado. Se describe mediante la ecuación y = 9,8379x + 0,7019, donde y (las relaciones de área) representa la respuesta del instrumento, 9,8379 es la sensibilidad, x (las relaciones de peso) representa la concentración de analito y 0,7019 es la señal de fondo. Haga clic aquí para ver una versión más grande de esta figura.
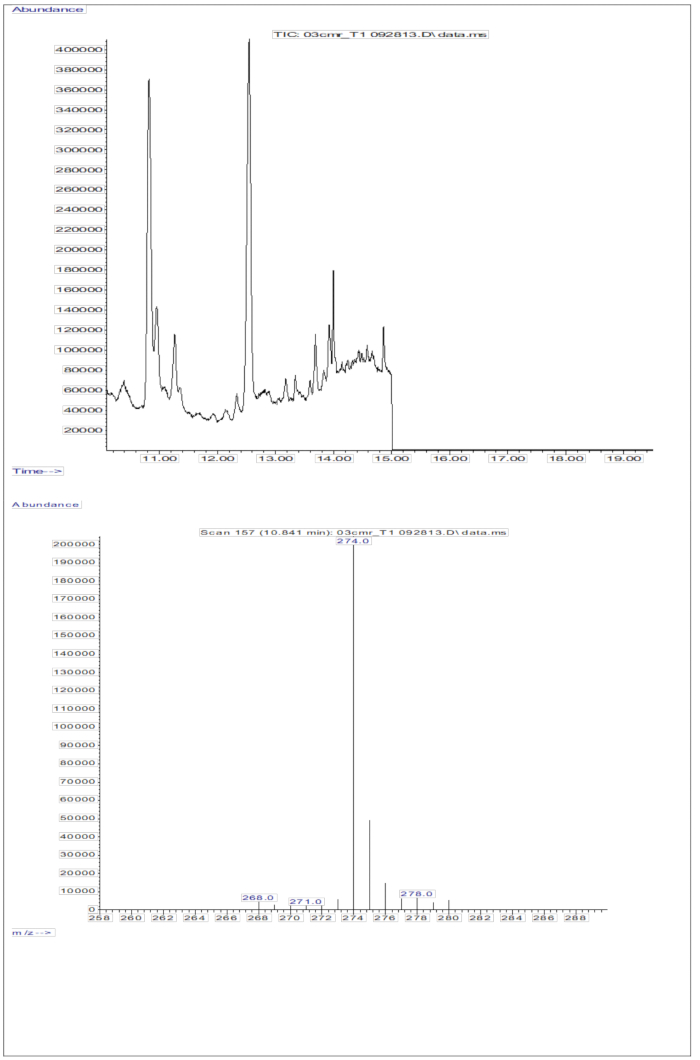
Figura 5: Cromatograma y espectro de masas de la muestra de suero. Esta figura ilustra el cromatograma de cromatografía de gases/captura de electrones de metano por ionización química negativa-espectrometría de masas (panel superior) a partir del análisis de la fracción de retinol derivatizada del suero. El panel inferior es un espectro de masas que muestra m/z 274 para D8-retinol. Haga clic aquí para ver una versión más grande de esta figura.
| Estándar | Peso (mg) | Matraz aforado (mL) | Solvente |
| Retinol | 40 | 100 | Etanol |
| Acetato de retinilo | 40 | 100 | Etanol |
| Acetato de retinilo marcado con deuterio | 40 | 100 | Etanol |
Tabla 1: Preparación de la solución madre. Esta tabla muestra cómo preparar soluciones concentradas de retinol y acetato de retinilo marcado con deuterio, que luego se pueden diluir a concentraciones más bajas para futuros experimentos.
| Estándar | Solución madre (mL) | Matraz aforado (mL) | Solvente |
| Retinol | 1 | 50 | Etanol |
| Acetato de retinilo | 1 | 50 | Etanol |
| Acetato de retinilo marcado con deuterio | 1 | 50 | Etanol |
Tabla 2: Preparación de soluciones madre diluidas. Esta tabla muestra cómo preparar soluciones listas para usar de retinol y acetato de retinilo marcado con deuterio.
| Estándar | Longitud de onda (nm) | E1%1 cm |
| Retinol | 325 | 1850 |
| Acetato de retinilo | 326 | 1550 |
Tabla 3: Longitud de onda y E1% 1 cm (Coeficiente de absorción).
| Tiempo (min) | Caudal (mL/min) | Fase móvil A (%) | Fase móvil B (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Tabla 4: Horario de las fases móviles de HPLC. Esta tabla ilustra la secuencia planificada y la duración de las diferentes fases durante la ejecución cromatográfica por HPLC.
| SH | SD | D | H | |
| Tema 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Tema 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Tema 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Tema 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Tema 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Tema 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Tema 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Tema 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Tema 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Tema 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: suma de la superficie de pico en m/z 268, 269 y 270 | ||||
| DE: suma de la superficie de cresta en m/z 274, 275, 276, 277 y 278 | ||||
| D: enriquecimiento de retinol marcado | ||||
| H: nivel de retinol no etiquetado |
Tabla 5: Resultados de GC/MS de la fracción de retinol derivatizado del suero. En esta tabla se indican las salidas de GC/MS necesarias para el cálculo de las reservas corporales totales de vitamina A. H es la suma del área del pico en m/z 268, 269 y 270; D es la suma del área del pico en m/z 274, 275, 276, 277 y 278; D es el enriquecimiento del retinol etiquetado; H es el nivel de retinol no etiquetado; TBS es vitamina A Total Body Store.
Discusión
La implementación exitosa de este protocolo depende de la ejecución efectiva de cada paso. La preparación adecuada de soluciones y estándares es crucial para garantizar que los datos recopilados sean precisos y confiables. Los procedimientos descritos en el protocolo se probaron en varios entornos y son adecuados para obtener soluciones y estándares que cumplan con los objetivos del análisis de muestras.
El análisis de las muestras comienza con la extracción y separación del retinol en el suero. El almacenamiento de las muestras de suero a -80 °C hasta el análisis es esencial para evitar la degradación de la vitamina A. Además, es necesario trabajar con poca luz16. El procedimiento de HPLC utilizado para recoger la fracción de retinol está diseñado para separar el retinol de otros componentes liposolubles para evitar interferencias en el proceso de derivatización. También permite ejecutar cientos de muestras sin vaciar la columna.
La fracción de retinol recogida de la HPLC se derivatiza con BSTFA a 70 °C durante 30 min. El paso de derivatización es crítico para mejorar la volatilidad del retinol y su detectabilidad en GC-MS. Dado que es sensible al agua, es crucial secar completamente la muestra antes de la derivatización y dejar tiempo suficiente para que ocurra la reacción de derivatización antes del análisis GC-MS. Se observó que el proceso de derivatización con BSTFA es muy leve y eficiente en comparación con el que utiliza N-metil-N-(terc-butildimetilsilil) trifluoroacetamida (MTBSTFA)23,24 y proporciona un pico muy agudo para el retinol derivatizado, sin relaves ni picos de fondo en el rango de masa escaneado14. El retinol derivatizado en un vial sellado puede conservarse en un desecador a 4 °C durante 1 mes sin degradación14.
Para el análisis GC-MS, es fundamental garantizar la calibración y el mantenimiento adecuados de la columna, y optimizar el volumen de inyección, la temperatura y los caudales. Las condiciones utilizadas aquí con inyección en columna mostraron resultados buenos y confiables14. Durante el análisis GC-MS de retinol deuterado y no marcado, Tang et al.14 observaron que los picos de retinol deuterado aparecieron tanto en la dosis administrada como en el suero de los sujetos que recibieron la dosis. Este patrón no se observó con el retinol no etiquetado. Por lo tanto, concluyeron que los picos de retinol deuterado están preformados en la dosis y no son el resultado de la fragmentación en el espectrómetro de masas, lo que sugiere que el retinol deuterado mantiene su estructura a través del proceso metabólico, proporcionando un marcador confiable para el seguimiento del retinol en estudios biológicos. El enriquecimiento de retinol deuterado en suero después de la administración de 2 mg de D8-retinol en niños en edad preescolar comenzó a aumentar a las 7 h y alcanzó su pico a los 14 días, que es el tiempo óptimo de muestreo más corto25. En 200 μL de suero humano, el porcentaje mínimo detectable de enriquecimiento de retinol es del 0,01%, lo que demuestra que el método es lo suficientemente sensible como para analizar muestras de suero recogidas de sujetos con una amplia gama de estados de vitamina A14.
Si bien la técnica de dilución de isótopos estables presentada aquí ofrece ventajas significativas para evaluar el estado de la vitamina A, debe tenerse en cuenta que este método requiere equipos sofisticados y experiencia técnica, lo que lo hace costoso y menos accesible para el uso rutinario en muchos entornos26. Por lo tanto, es fundamental tener en cuenta esta limitación a la hora de planificar el uso de esta técnica.
Divulgaciones
Este manuscrito forma parte de una serie titulada Utilización del método de dilución de isótopos de retinol para evaluar las reservas corporales de vitamina A y la concentración de vitamina A en el hígado, respaldada por el OIEA.
Agradecimientos
Aprendimos este protocolo durante una beca en el Laboratorio de Carotenoides y Salud, Centro de Investigación en Nutrición Humana sobre el Envejecimiento Jean Mayer USDA, Universidad de Tufts, Boston, EE.UU., bajo la supervisión de Guangwen Tang y con el apoyo financiero del Organismo Internacional de Energía Atómica (OIEA).
Materiales
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto‐injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Referencias
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados