Method Article
Analisi GC-MS dell'arricchimento di retinolo nel siero e stima delle riserve corporee totali di vitamina A
In questo articolo
Riepilogo
Questo metodo prevede l'estrazione del retinolo dal siero, la sua separazione mediante HPLC e la determinazione degli isotopi di retinolo marcati e non marcati mediante GC-MS. Il rapporto tra retinolo marcato e non marcato viene utilizzato per stimare le riserve corporee totali di vitamina A.
Abstract
Questo metodo descrive la determinazione dell'arricchimento di deuterio del retinolo nel siero e la stima delle riserve di vitamina A nel corpo. Il processo prevede l'estrazione del retinolo da 0,4 mL di siero utilizzando 0,5 mL di soluzione salina allo 0,85%, 100 μL di soluzione standard interna e 5 mL di soluzione di cloroformio-metanolo (2:1 v/v). Dopo la centrifugazione e la rimozione dello strato inferiore di cloroformio, la miscela viene essiccata sotto azoto e risospesa in 0,1 mL di etanolo, e la frazione di retinolo viene separata dagli altri costituenti utilizzando un sistema HPLC dotato di una colonna PE C18. La frazione di retinolo può essere raccolta manualmente o con un raccoglitore di frazioni. Successivamente, la frazione di retinolo viene essiccata sotto azoto e derivatizzata con O-bis(trimetilsilil)trifluoroacetammide (BSTFA) contenente il 10% di trimetilclorosilano. Infine, gli isotopi di retinolo marcati e non marcati vengono quantificati utilizzando un sistema GC-MS dotato di una colonna capillare 19091z-431 HP-1 metilsilossano, che impiega la ionizzazione chimica negativa a cattura elettronica con elio come gas vettore e metano come agente di ionizzazione. Il rapporto tra retinolo marcato e non marcato viene quindi utilizzato nelle equazioni di Olson, Green o del bilancio di massa per stimare le riserve di vitamina A.
Introduzione
La vitamina A è un nutriente essenziale necessario per il sistema visivo e il mantenimento della funzione cellulare per la crescita, l'integrità epiteliale, la produzione di globuli rossi, l'immunità e la riproduzione1. La carenza di vitamina A è un grave problema di salute pubblica in tutto il mondo, che colpisce più di 100 paesi. Colpisce in modo sproporzionato i bambini piccoli e le donne incinte nei paesi a basso reddito. Circa 190 milioni di bambini in tutto il mondo soffrono di carenza di vitamina A, il che la rende un problema critico per la salute pubblica e lo sviluppo del bambino2.
In risposta a questa situazione, in molti paesi a basso reddito sono stati implementati per decenni diversi programmi, tra cui l'integrazione di vitamina A con distribuzione biennale di alte dosi di vitamina A ai bambini di età inferiore ai 5 anni e la fortificazione con vitamina A di alcuni prodotti alimentari. Tuttavia, questi interventi spesso si sovrappongono, esponendo alcune popolazioni a un'eccessiva assunzione cronica involontaria di vitamina A 3,4. Questo doppio rischio di carenza ed eccesso evidenzia la necessità di un biomarcatore in grado di valutare con precisione lo stato della vitamina A nell'intero spettro, dalla carenza alla tossicità, per guidare la valutazione del programma.
I biomarcatori della vitamina A sono fondamentali per valutare lo stato nutrizionale. I biomarcatori più comunemente usati sono le concentrazioni sieriche di retinolo e la proteina legante il retinolo (RBP). Tuttavia, è importante notare che questi biomarcatori possono essere temporaneamente soppressi da infezioni e infiammazioni, il che può ridurre la specificità delle valutazioni della vitamina A in alcune popolazioni 5,6,7.
Mentre i campioni di biopsia o autopsia epatica sono considerati il gold standard per valutare lo stato della vitamina A, l'indicatore indiretto più sensibile delle riserve totali di vitamina A nel fegato è il metodo di diluizione degli isotopi del retinolo (RID)8. Il RID fornisce una stima quantitativa dello stato della vitamina A nell'intero spettro, che va da riserve carenti a eccessive9. Nella maggior parte delle applicazioni di ricerca, il metodo RID prevede la somministrazione di una dose orale di deuterio (2H) o 13acetato di retinile marcato con C, che poi si mescola con le riserve corporee per un periodo da 14 a 21 giorni. Trascorso questo periodo, viene prelevato un campione di sangue e il siero viene conservato a -80 °C. Il rapporto tra retinolo marcato e totale viene quindi analizzato utilizzando la spettrometria di massa per stimare le riserve di vitamina A10, impiegando l'equazione di Olson11, l'equazione del bilancio di massa12 o l'equazione di Green13. Il protocollo presentato in questo articolo è valido per la somministrazione di acetato di retinile marcato con deuterio (2H) o 13C e si basa sul lavoro di Tang et al.14. L'obiettivo generale di questo metodo è valutare e monitorare accuratamente lo stato della vitamina A nell'organismo11. Si tratta di un metodo potente che fornisce una stima quantitativa delle concentrazioni di vitamina A in un ampio spettro di stati, dalla carenza all'eccesso di15. È più accurato e preciso di altri metodi, che spesso si basano su misure indirette9.
Protocollo
Il protocollo è stato approvato dal Comitato Etico del Ministero della Salute Pubblica (n. 2015/02/550/CE/CNERSH/SP) ed è stato ottenuto il consenso informato dei genitori/tutori.
NOTA: Poiché la vitamina A è sensibile alla luce, è fondamentale che tutte le procedure siano condotte in condizioni di luce fioca o sotto un'illuminazione fluorescente dorata16. I materiali utilizzati sono dettagliati nella Tabella dei materiali.
1. Preparazione dei reagenti
- Cloruro di sodio (0,85% p/v): sciogliere 0,85 g di NaCl in acqua distillata in un matraccio tarato da 100 mL. Riempire fino al segno di graduazione con acqua distillata e mescolare.
- Cloroformio-metanolo (2:1 v/v): trasferire 300 mL di cloroformio in un matraccio tarato da 500 mL con un cilindro graduato. Aggiungere 150 ml di metanolo e mescolare.
- Fase mobile A per HPLC: acetonitrile/tetraidrofurano/acqua ultrapura (50/20/30, v/v/v): trasferire 500 mL di acetonitrile in un matraccio tarato da 1000 mL. Aggiungere 200 mL di tetraidrofurano e 300 mL di acqua. Miscelare la soluzione, filtrarla con un filtro a membrana con porosità di 0,45 μm e sonicare (ampiezza 100%, frequenza 40 kHz e durata 15 min).
- Fase mobile B per HPLC: acetonitrile/tetraidrofurano/acqua ultrapura (50/44/6, v/v/v): trasferire 500 mL di acetonitrile in un matraccio tarato da 1000 mL. Aggiungere 440 mL di Tetraidrofurano e 60 mL di acqua. Miscelare la soluzione, filtrarla con un filtro a membrana con una dimensione dei pori di 0,45 μm e sonicare.
2. Preparazione di soluzioni standard
- Preparare la soluzione madre sciogliendo 40 mg dello standard in etanolo in un matraccio tarato da 100 mL, come illustrato nella Tabella 1. Riempire fino al segno di graduazione con il solvente e mescolare accuratamente.
- Soluzioni madre diluite: Preparare la soluzione madre diluita trasferendo 1 mL della soluzione madre in un matraccio tarato da 50 mL, come mostrato nella Tabella 2. Riempire fino al segno di graduazione con il solvente appropriato e mescolare accuratamente.
- Determinazione della concentrazione delle soluzioni madre diluite: Porre un'aliquota (1 mL) della soluzione diluita in un tubo di quarzo e misurarne l'assorbanza nello spettrofotometro alla lunghezza d'onda specificata (Tabella 3) utilizzando l'etanolo come bianco. Calcola il utilizzando la legge Lambert-Beer17. Assicurarsi che lo spettrofotometro sia calibrato prima dell'analisi riscaldando lo strumento per 15-30 minuti, selezionando la lunghezza d'onda desiderata e azzerando lo strumento posizionando il bianco nel supporto del campione. Calcolare la concentrazione utilizzando la seguente formula:
Concentrazione = (assorbanza/coefficiente di assorbimento) x 106 (μg/dL)
NOTA: Per convertire i valori da unità convenzionali (μg/dL) a unità S.I. (μmol/L), moltiplicare il valore convenzionale per i seguenti fattori di conversione: 0,0304 per l'acetato di retinile e 0,0349 per il retinolo18. - Preparazione delle norme di lavoro: Utilizzando una pipetta volumetrica, trasferire 2 mL delle soluzioni madre diluite in un matraccio conico da 100 mL. Riempire il pallone fino al segno di graduazione con etanolo, mescolare accuratamente e chiudere con un tappo.
- Per determinare l'esatta concentrazione di ciascuna soluzione, valutare la purezza di ciascun componente utilizzando HPLC dotato di una colonna C18 e di un rivelatore a diodi impostato a 340 nm. Programmare la pompa per utilizzare la fase mobile A e la fase mobile B secondo lo schema mostrato nella tabella 4. Assicurarsi che il sistema HPLC sia calibrato prima dell'analisi convalidando vari componenti come la pompa, il rivelatore, l'autocampionatore e le prestazioni dell'intero sistema.
- Trasferire 1 mL delle soluzioni madre diluite in fiale a crimpare e iniettare i campioni nel sistema HPLC secondo la normale procedura. Determinare la purezza utilizzando la seguente equazione:
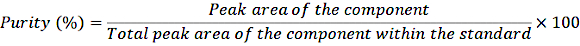
EQUAZIONE 1
Con questa correzione per la purezza, calcolare l'esatta concentrazione dei diversi componenti nella soluzione standard.
- Preparazione dello standard interno (acetato di retinile OD ~ 0,2): utilizzando una pipetta volumetrica, trasferire 30 mL dello standard di lavoro dell'acetato di retinile in un matraccio conico da 100 mL. Riempire il pallone fino al segno di graduazione con etanolo, mescolare accuratamente e chiudere con un tappo.
- Preparazione delle soluzioni di lavoro: aggiungere 20 μg di retinolo non marcato a 10,00, 3,33, 1,00, 0,33 e 0,00 μg di retinolo marcato per ottenere rapporti di retinolo marcati e non marcati di 0,500, 0,167, 0,050, 0,0167 e 0,00.
3. Analisi del campione
NOTA: I campioni di siero utilizzati in questo studio sono stati raccolti il 14° giorno da bambini che hanno ricevuto una dose orale (2 mg di retinolo equivalenti) di D8-retinolo come parte di uno studio progettato per monitorare e valutare lo stato della vitamina A dei bambini in Camerun.
- Estrazione di retinoidi nel siero: questa estrazione si basa sul lavoro di Folch et al.19 come modificato da Tang et al.14. Segui i passaggi descritti di seguito.
- Lasciare scongelare delicatamente i campioni di siero congelati a temperatura ambiente (20-25 °C) prima dell'analisi. Aliquotare 400 μL di siero in una provetta di coltura monouso da 16 x 100 mm. Aggiungere 500 μl di soluzione salina allo 0,85% più 100 μl di standard interno e 5 ml di soluzione di cloroformio-metanolo (2:1 v/v).
- Vortice per 30 s e centrifugare a 1157 x g per 10 min a 4 °C. Utilizzando una pipetta di vetro Pasteur, rimuovere con cautela lo strato inferiore di cloroformio in una provetta di coltura monouso da 13 x 100 mm. Asciugare in azoto gassoso a bagnomaria (40 °C) e risospendere il residuo in 100 μL di etanolo. Vortice e sonicazione per 30 s. Trasferire il campione in una fiala a crimpare con un inserto, chiudere il pozzetto ed etichettare. Il campione è pronto per la raccolta del retinolo HPLC.
- Eseguire la raccolta del retinolo HPLC come descritto di seguito.
- Iniettare 70 μl di ciascun campione di siero in un sistema HPLC dotato di una colonna C18 e di un rivelatore a diodi impostato a 340 nm. Programmare la pompa per erogare le fasi mobili A e B a una portata costante di 1 mL/min, seguendo lo schema mostrato nella Tabella 4.
- Prima di iniettare i campioni di siero, iniettare 70 μl della soluzione di lavoro del retinolo nel sistema HPLC e registrare il tempo di ritenzione del picco del retinolo. Quindi, impostare il collettore di frazioni per raccogliere la frazione di retinolo eluita entro un intervallo specificato in una provetta da 5 ml con un tappo di vetro smerigliato. In questo caso, la frazione di retinolo è stata raccolta in un intervallo di 3 minuti, da 7,5 a 10,5 minuti.
NOTA: La concentrazione di retinolo può anche essere calcolata in questa fase utilizzando una curva di calibrazione degli standard di retinolo e il tasso di recupero ottenuto dallo standard interno.
- Eseguire la derivatizzazione del retinolo come descritto di seguito.
- Essiccare la frazione di retinolo raccolta dall'HPLC sotto azoto gassoso in un bagno d'acqua a 40 °C per almeno 3 ore. Aggiungere etanolo per facilitare l'evaporazione dell'umidità durante l'essiccazione (i campioni devono essere completamente asciutti, poiché la derivatizzazione è sensibile all'umidità). Aggiungere 20 μl di BSTFA con il 10% di TMCS alla provetta.
- Posizionare la provetta in un riscaldatore a blocchi a secco impostato a 70 °C e incubare per 30 minuti. Utilizzando una pipetta di vetro Pasteur, trasferire la miscela di reazione in una fiala a crimpare con un inserto, sigillare ermeticamente con il tappo a crimpare utilizzando una crimpatrice per tappi ed etichettare. Il campione è ora pronto per l'analisi GC/MS e può essere conservato in un essiccatore a 4 °C fino all'analisi.
- Inoltre, essiccare un set da 100 μL di soluzioni standard di lavoro e derivatizzare come descritto sopra per calibrare il GC/MS.
NOTA: La derivatizzazione del retinolo utilizzando BSTFA comporta una reazione chimica in cui il gruppo ossidrile (-OH) del retinolo viene sostituito dal gruppo trimetilsililico (-Si(CH3)3), formando il retinile trimetilsilil etere. Questo processo migliora la volatilità e la stabilità del retinolo, rendendolo più adatto per l'analisi GC/MS20.
- Analisi GC/MS: l'analisi GC/MS viene eseguita utilizzando la procedura descritta da Tang et al.14. Segui i passaggi descritti di seguito.
- Iniettare 3 μl del campione di retinolo derivatizzato utilizzando un autocampionatore nel GC con un iniettore freddo su colonna collegato tramite un connettore a volume morto zero a una colonna capillare di silice fusa di diametro interno di 15 m x 0,25 mm rivestita con una fase stazionaria DB-1 di 0,25 μm di spessore del film.
- Programmare le temperature del forno a colonna e dell'iniettore in colonna in modo che aumentino da 50 °C a 285 °C a una velocità di 15 °C/min e impostare la temperatura dell'interfaccia GC/MS a 285 °C. Utilizzare l'elio come gas di trasporto per eluire il derivato trimetilsililico del retinolo per circa 12 minuti.
- Rilevare l'eluato GC con uno spettrometro di massa a quadrupolo utilizzando la ionizzazione chimica degli ioni negativi di metano da 0,5 torr, con la temperatura della sorgente ionica impostata a 150 °C. Imposta lo spettrometro di massa in modo che esegua una scansione compresa tra 260 e 280 dalton.
4. Analisi dei dati
- Utilizzare il software di analisi dei dati GC/MS.
- Estrai tutti gli ioni desiderati in base ai loro rapporti massa-carica (m/z), integra l'area del picco (usa l'integrazione manuale per regolare i punti di inizio e fine del picco) e trasferisci i risultati in un foglio di calcolo.
NOTA: A seconda dell'isotopo utilizzato, gli ioni desiderati saranno i seguenti: 268-270 m/z per il retinolo nativo; 271-274 m/z per [2H4]-retinolo; 278-280 m/z per [13C]-retinolo; e 276-280 m/z per [2H8]-retinolo. - Calcola la somma dei picchi per il retinolo marcato (ΣD) sommando l'area del picco a m/z 274, 275, 276, 277 e 278. Calcola la somma dei picchi per il retinolo non marcato (ΣH) sommando l'area del picco a m/z 268, 269 e 270.
- Calcola l'arricchimento del retinolo marcato (D) utilizzando la seguente equazione: D = ΣD/(ΣH + ΣD). Calcola la quantità di retinolo non marcato (H) utilizzando la seguente equazione: H = 1 - D.
NOTA: Gascromatografia Cattura elettronica Ionizzazione chimica negativa La spettrometria di massa del retinile trimetilsililetere non fornisce alcuno ione molecolare ma un frammento principale di ione a m/z da 268 a 271 per il retinolo non marcato, a m/z da 272 a 275 per il D4-retinolo e da m/z a 276 a 280 per il D8-retinolo14. - Per controllare il sistema, calcolare un'equazione di regressione lineare tra i rapporti di peso degli standard di calibrazione e le aree integrate per il retinolo marcato e il retinolo non marcato.
5. Stima delle riserve di vitamina A
NOTA: Questo passaggio consente di valutare lo stato di vitamina A di un individuo.
- Calcola le riserve totali di vitamina A nel fegato usando l'equazione di Olson11
Riserve totali di vitamina A nel fegato = F x Dose x [S x a x (H/D - 1)]
dove F è un fattore per l'efficienza dell'assorbimento e della conservazione della dose somministrata per via orale (F = 0,50), la dose è la quantità di vitamina A etichettata somministrata per via orale (μmol), S è un fattore che corregge la disuguaglianza del rapporto plasma/fegato tra retinolo marcato e non marcato (S = 0,65), a è un fattore che corregge la perdita irreversibile di vitamina A etichettata durante il periodo di miscelazione; In particolare, a = e-kt, dove k è il tasso catabolico frazionario del sistema stimato (k = ln 2/32 giorni per i bambini), e t è il tempo, espresso in giorni dalla dose; D/H è il rapporto isotopico sierico tra il retinolo marcato e quello non marcato, -1 corregge il contributo della dose di vitamina A marcata al pool di vitamina A totale del corpo. - Per calcolare le riserve corporee totali di vitamina A (TBS) utilizzare l'equazione di Green13
TBS = Fa × S × (1/SAp)
dove Fa è la frazione della dose marcata per via orale di VA assorbita e trovata nei pool di stoccaggio scambiabili dell'organismo al tempo t, e S è il rapporto tra l'attività specifica del retinolo nel siero e quella nei depositi al tempo t (per i bambini, Fa × S = 0,642 a 14 giorni)21. SAp è la frazione di dose nel siero per dose di μmol (ad esempio, [retinolo etichettato] / ([non etichettato + retinolo etichettato] nel siero) / dose orale di retinolo marcato (μmol)).
Risultati
L'iniezione di 3 μL di un campione derivatizzato di una soluzione essiccata contenente circa 50 pM/μL di calibranti (retinolo e D 8-retinolo) nel GC/MS non ha mostrato alcuno ione molecolare, ma ha mostrato un frammento maggiore di ione a m/z 268 per il retinolo (Figura 1) e m/z 278 per il D8-retinolo (Figura 2). Ciò indica che gli ioni molecolari del retinile trimetilsilil etere, formati durante la derivatizzazione del retinolo e del D 8-retinolo, non sono stabili nelle condizioni di ionizzazione utilizzate nella GC/MS. Si scompongono in frammenti più piccoli, principalmente attraverso la scissione alfa. Questo modello di frammentazione comune comporta la rottura del legame adiacente al gruppo etere trimetilsililico. La scissione alfa provoca la perdita del gruppo trimetilsilil (TMS, che ha una massa di 73 Da) e di un atomo di idrogeno, portando a un frammento di ione con una massa di 268 Da per il retinolo e 278 Da per il D 8-retinolo22. Questo meccanismo aiuta a identificare e confermare la presenza di retinolo e suoi derivati nel campione analizzando gli ioni frammento specifici prodotti durante la spettrometria di massa. L'iniezione di miscele di retinolo e D8-retinolo ha mostrato due frammenti principali di ioni a m/z 268 per il retinolo e m/z 276 per il D8-retinolo (Figura 3), indicando la presenza di questi composti nel campione. La curva di calibrazione ha mostrato un'eccellente linearità, come indicato da un elevato coefficiente di correlazione (Figura 4), dimostrando che la relazione tra il rapporto di picco e il rapporto di peso ha un andamento molto lineare e prevedibile.
La risposta GC/MS ottenuta dalle iniezioni di campioni di siero (siero di bambini che hanno ricevuto una dose orale di 2 mg di retinolo equivalenti di D8-retinolo; Figura 5) mostra la presenza di retinolo e D8-retinolo, con i due principali ioni frammento osservati a m/z 268 e m/z 274. I risultati ottenuti dopo l'estrazione degli ioni e l'integrazione delle aree di picco a m/z 274, 275, 276, 277 e 278 per il D8-retinolo e a m/z 268, 269 e 270 per il retinolo non marcato sono presentati nella Tabella 5. Questi risultati devono essere integrati nell'equazione di Olson11 o nell'equazione di Green13 per calcolare le riserve di vitamina A nel corpo.
La tecnica di diluizione degli isotopi stabili fornisce misurazioni dei livelli di vitamina A che non possono essere ottenute con altri metodi, consentendo valutazioni accurate dello stato della vitamina A. Questo metodo è prezioso per gli studi nutrizionali, la diagnostica clinica e la ricerca epidemiologica.
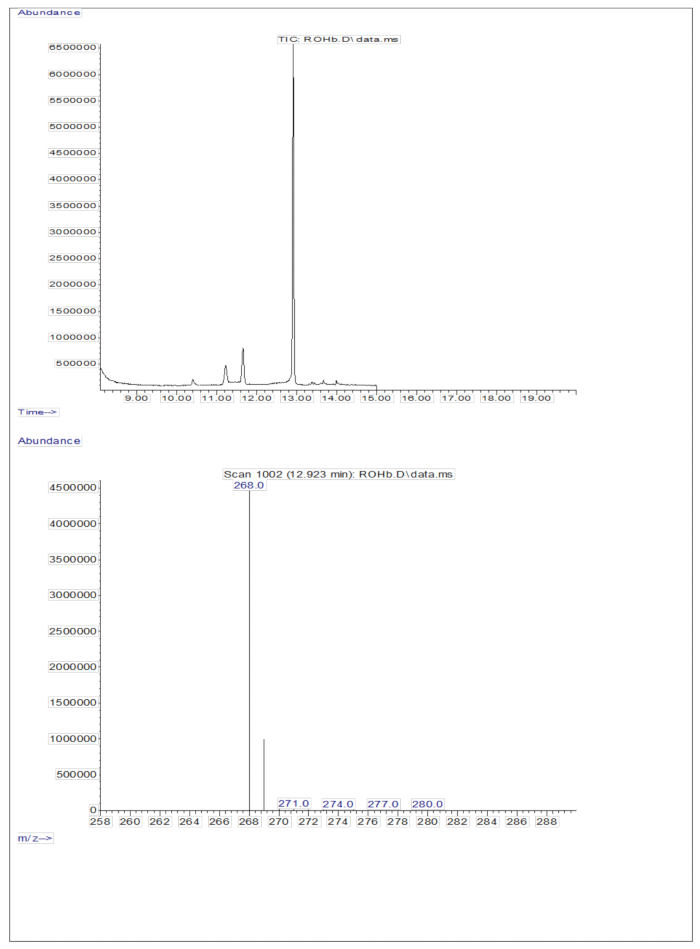
Figura 1: Cromatogramma e spettro di massa del retinolo. La figura mostra il cromatogramma negativo per spettrometria di massa a ionizzazione chimica a cattura di elettroni di metano (pannello superiore) dall'analisi dello standard del retinolo derivatizzato. Il pannello inferiore è uno spettro di massa che mostra m/z 268 per il retinolo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Cromatogramma e spettro di massa del D8-retinolo. La figura mostra il cromatogramma negativo per spettrometria di massa a ionizzazione chimica a cattura di elettroni a metano (pannello superiore) dall'analisi dello standard D8-retinolo derivatizzato. Il pannello inferiore è uno spettro di massa che mostra m/z 278 per il D8-retinolo. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Cromatogramma e spettro di massa di una miscela di retinolo e D8-retinolo. La figura mostra il cromatogramma di spettrometria di massa a ionizzazione chimica negativa per gascromatografia/metano (pannello superiore) dall'analisi di una miscela derivatizzata di standard di retinolo e D8-retinolo. Il pannello inferiore è uno spettro di massa che mostra m/z 268 per il retinolo e m/z 276 per il D8-retinolo. Clicca qui per visualizzare una versione più grande di questa figura.
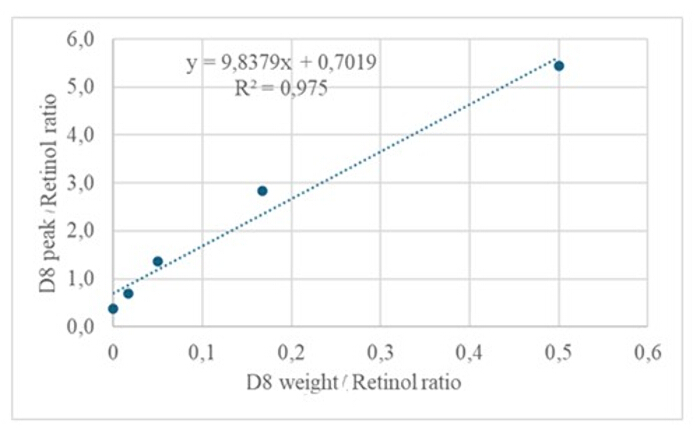
Figura 4: Curva di calibrazione. Questa figura illustra la relazione tra la risposta GC/MS e la concentrazione di retinolo non marcato ed etichettato. È descritto dall'equazione y = 9,8379x + 0,7019, dove y (i rapporti di area) rappresenta la risposta dello strumento, 9,8379 è la sensibilità, x (i rapporti di peso) rappresenta la concentrazione dell'analita e 0,7019 è il segnale di fondo. Clicca qui per visualizzare una versione più grande di questa figura.
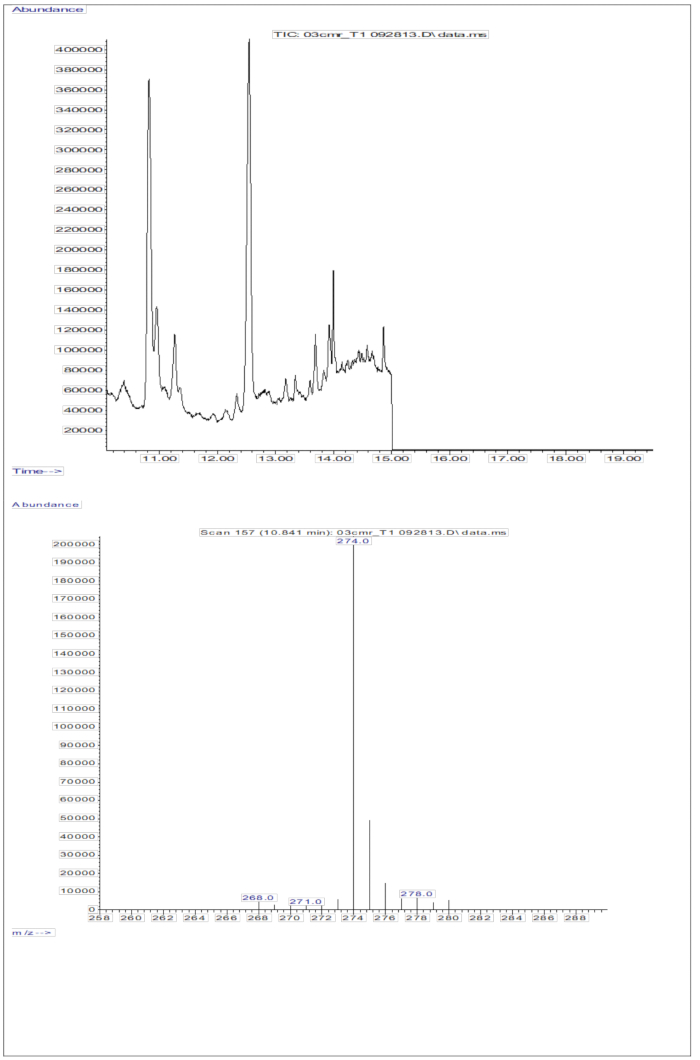
Figura 5: Cromatogramma e spettro di massa del campione di siero. Questa figura illustra il cromatogramma negativo per spettrometria di massa a ionizzazione chimica a cattura elettronica del metano (pannello superiore) dall'analisi della frazione di retinolo derivatizzato del siero. Il pannello inferiore è uno spettro di massa che mostra m/z 274 per il D8-retinolo. Clicca qui per visualizzare una versione più grande di questa figura.
| Standard | Peso (mg) | Pallone tarato (mL) | Solvente |
| Retinolo | 40 | 100 | Etanolo |
| Acetato di retinile | 40 | 100 | Etanolo |
| Acetato di retinile marcato con deuterio | 40 | 100 | Etanolo |
Tabella 1: Preparazione della soluzione madre. Questa tabella mostra come preparare soluzioni concentrate di retinolo e acetato di retinile marcato con deuterio, che possono quindi essere diluite a concentrazioni inferiori per esperimenti futuri.
| Standard | Soluzione madre (mL) | Pallone tarato (mL) | Solvente |
| Retinolo | 1 | 50 | Etanolo |
| Acetato di retinile | 1 | 50 | Etanolo |
| Acetato di retinile marcato con deuterio | 1 | 50 | Etanolo |
Tabella 2: Preparazione di soluzioni madre diluite. Questa tabella mostra come preparare soluzioni pronte all'uso di retinolo e acetato di retinile marcato con deuterio.
| Standard | Lunghezza d'onda (nm) | E1%1 cm |
| Retinolo | 325 | 1850 |
| Acetato di retinile | 326 | 1550 |
Tabella 3: Lunghezza d'onda ed E1% 1 cm (Coefficiente di assorbimento).
| Tempo (min) | Portata (mL/min) | Fase A per dispositivi mobili (%) | Fase B per dispositivi mobili (%) |
| 0 – 6 | 1 | 100 | 0 |
| 6 – 13 | 1 | 100 → 50 | 0 → 50 |
| 13 - 18 | 1 | 50 | 50 |
| 18 - 20 | 1 | 50 → 0 | 50 → 100 |
| 20 - 28 | 1 | 0 | 100 |
| 28 - 29 | 1 | 0 → 100 | 100 → 0 |
Tabella 4: Calendario per le fasi mobili HPLC. Questa tabella illustra la sequenza pianificata e la durata delle diverse fasi durante il ciclo cromatografico HPLC.
| ZITTO | SD | D | H | |
| Soggetto 1 | 64030809 | 566089.7 | 0.008763 | 0.991237 |
| Soggetto 2 | 194354 | 43861.39 | 0.184125 | 0.815875 |
| Soggetto 3 | 793490 | 80179.28 | 0.091773 | 0.908227 |
| Soggetto 4 | 2002063 | 45286.7 | 0.02212 | 0.97788 |
| Soggetto 5 | 80999193 | 355980.7 | 0.004376 | 0.995624 |
| Soggetto 6 | 32196717.7 | 216152.7 | 0.006669 | 0.993331 |
| Soggetto 7 | 40905724.5 | 334818.1 | 0.008119 | 0.991881 |
| Soggetto 8 | 28336711.5 | 218924.1 | 0.007667 | 0.992333 |
| Soggetto 9 | 8695135.5 | 542077 | 0.058684 | 0.941316 |
| Soggetto 10 | 103260212 | 1717728 | 0.016363 | 0.983637 |
| SH: somma dell'area di picco a m/z 268, 269 e 270 | ||||
| SD: somma dell'area di picco a m/z 274, 275, 276, 277 e 278 | ||||
| D: arricchimento del retinolo marcato | ||||
| H: livello di retinolo non marcato |
Tabella 5: Risultati della GC/MS della frazione di retinolo derivatizzata del siero. Questa tabella riporta gli output GC/MS necessari per il calcolo della riserva corporea totale di vitamina A. H è la somma dell'area del picco a m/z 268, 269 e 270; D è la somma dell'area del picco a m/z 274, 275, 276, 277 e 278; D è l'arricchimento del retinolo marcato; H è il livello di retinolo non marcato; TBS è la vitamina A Total Body Store.
Discussione
Il successo dell'implementazione di questo protocollo si basa sull'esecuzione efficace di ogni fase. Una corretta preparazione di soluzioni e standard è fondamentale per garantire che i dati raccolti siano accurati e affidabili. Le procedure descritte nel protocollo sono state testate in vari contesti e sono adatte per ottenere soluzioni e standard che soddisfano gli obiettivi dell'analisi dei campioni.
L'analisi dei campioni inizia con l'estrazione e la separazione del retinolo nel siero. La conservazione dei campioni di siero a -80 °C fino all'analisi è essenziale per prevenire la degradazione della vitamina A. Inoltre, è necessario lavorare in condizioni di scarsa illuminazione16. La procedura HPLC utilizzata per raccogliere la frazione di retinolo è progettata per separare il retinolo da altri componenti liposolubili per evitare interferenze nel processo di derivatizzazione. Consente inoltre di eseguire centinaia di campioni senza dover lavare la colonna.
La frazione di retinolo raccolta dall'HPLC viene derivatizzata con BSTFA a 70 °C per 30 min. La fase di derivatizzazione è fondamentale per migliorare la volatilità del retinolo e la sua rilevabilità nella GC-MS. Poiché è sensibile all'acqua, è fondamentale asciugare completamente il campione prima della derivatizzazione e lasciare un tempo sufficiente affinché la reazione di derivatizzazione avvenga prima dell'analisi GC-MS. Si è notato che il processo di derivatizzazione con BSTFA è molto lieve ed efficiente rispetto a quello che utilizza N-metil-N-(terz-butildimetilsilil) trifluoroacetammide (MTBSTFA)23,24 e fornisce un picco molto acuto per il retinolo derivatizzato, senza code o picchi di fondo nell'intervallo di massa scansionato14. Il retinolo derivatizzato in un flaconcino sigillato può essere conservato in un essiccatore a 4 °C per 1 mese senza degradazione14.
Per l'analisi GC-MS, è fondamentale garantire una corretta calibrazione e manutenzione della colonna e ottimizzare il volume di iniezione, la temperatura e le portate. Le condizioni utilizzate qui con l'iniezione su colonna hanno mostrato risultati buoni e affidabili14. Durante l'analisi GC-MS del retinolo deuterato e non marcato, Tang et al.14 hanno osservato che i picchi di retinolo deuterato apparivano sia nella dose somministrata che nel siero dei soggetti che avevano ricevuto la dose. Questo modello non è stato osservato con il retinolo non marcato. Pertanto, hanno concluso che i picchi di retinolo deuterato sono preformati nella dose e non sono il risultato della frammentazione nello spettrometro di massa, suggerendo che il retinolo deuterato mantiene la sua struttura attraverso il processo metabolico, fornendo un marcatore affidabile per il monitoraggio del retinolo negli studi biologici. L'arricchimento del retinolo deuterato nel siero dopo la somministrazione di 2 mg di D8-retinolo nei bambini in età prescolare ha iniziato ad aumentare a 7 ore e ha raggiunto il suo picco a 14 giorni, che è il tempo di campionamento ottimale più breve25. In 200 μL di siero umano, l'arricchimento percentuale minimo rilevabile di retinolo è dello 0,01%, dimostrando che il metodo è abbastanza sensibile per analizzare campioni di siero raccolti da soggetti con un'ampia gamma di stati di vitamina A14.
Sebbene la tecnica di diluizione degli isotopi stabili qui presentata offra vantaggi significativi per la valutazione dello stato della vitamina A, va notato che questo metodo richiede attrezzature sofisticate e competenze tecniche, il che lo rende costoso e meno accessibile per l'uso di routine in molti contesti26. Pertanto, è essenziale considerare questa limitazione quando si pianifica l'utilizzo di questa tecnica.
Divulgazioni
Questo manoscritto fa parte di una serie intitolata Utilizzo del metodo di diluizione degli isotopi del retinolo per la valutazione delle riserve corporee di vitamina A e della concentrazione di vitamina A nel fegato supportata dall'AIEA.
Riconoscimenti
Abbiamo appreso questo protocollo durante una borsa di studio presso il Carotenoids and Health Laboratory, Jean Mayer USDA Human Nutrition Research Center on Aging, Tufts University, Boston, USA, sotto la supervisione di Guangwen Tang e con il supporto finanziario dell'Agenzia Internazionale per l'Energia Atomica (AIEA).
Materiali
| Name | Company | Catalog Number | Comments |
| 13x100 mm disposable culture tubes | 99445-13 | PYREX Disposable Rimless Culture Tubes | |
| 16x100 mm disposable culture tubes | 99445-16 | PYREX Disposable Rimless Culture Tubes | |
| 24 Position N-EVAP Nitrogen Evaporator | Organomation Associates, Inc | 11250 | N-EVAP 112, Nitrogen Evaporator, with OA-SYS heating system |
| Acetonitrile | Sigma-Aldrich | 00687 | Acetonitrile, suitable for HPLC, gradient grade, ≥99.9% |
| Amber colored Crimp vials, 2 mL, | SU860033 | Short thread autosampler vial, amber vial 11.6 x 32 mm | |
| Analytical Balance | Mettler Toledo | 30133525 | Precision Balance MS303TS/00 |
| C18 column | Perkin-Elmer Inc | 2580195 | Brownlee Pecosphere RA C18 Cartridge Column - 33 mm x 4.6 mm I.D., Pkg. 5 |
| cap crimper | MilliporeSigma | Z114243 | Hand-operated aluminum cap crimper O.D. 20 mm |
| Capillary column | J & W Scientific | 122-1011 | 15 m × 0.25 mm i.d. fused silica capillary column coated with a DB-1 stationary phase of 0.25 mm film thickness |
| Centrifuge | Sigma 3-18KS | ||
| Chloroform | Sigma-Aldrich | 528730 | Chloroforme, HPLC grade, ≥ 99.9% |
| Conical Flasks: 100 mL, | 4980016 | Borosil Erlenmeyer Flasks Graduated Conical NM Borosilicate | |
| Crimp caps with PTFE seal | Supelco | 27455-U | Crimp seals with PTFE/silicone septa |
| D8-Retinyl acetate | Cambridge Isotope Laboratories Inc. | DLM-2244-PK | Vitamin A acetate 3-4% cis (10, 14, 19, 19, 19, 20, 20, 20-D8, 90%) |
| Dispenser for 1-10 mL | Gilson | F110103 | DISPENSMAN Bottle-top Dispenser |
| Dry Block Heater | Grant | Grant QBH2 High Performance Digital Dry Block Heater | |
| Ethanol | Sigma-Aldrich | 459844 | Ethyl alcohol, Pure, ≥ 99.5%, ACS reagent, 200 proof |
| GC-MS | Agilent | Agilent 7890 A Series Gas Chromatography with 5975C Mass Spectrometer System equipped with a 5975C inert XL EI/CI MSD/DS Turbo CI System, a 7693A Auto‐injector Includes transfer turret and a 7693 sample Tray | |
| Glass stoppered volumetric Flasks: 2000 mL | 956854 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 100 mL | 956849 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 1000 mL | 956853 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 25 mL | 956841 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 50 mL | 956847 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Glass stoppered volumetric Flasks: 500 mL | 956852 | BRAND BLAUBRAND volumetric flask, glass stopper, clear glass | |
| Helium (highest purity) | Air Liquide | UN 1046 Helium compressed, Class 2.2 | |
| HPLC | Varian | Varian 940LC HPLC with fraction collector | |
| Inserts for crimp vials, 5 mm, 175 μL, | AR0-4521-12 | Verex insert, 5 mm Dia, 175 µl, clear, conical bottom, w/bottom spring | |
| Measuring Cylinders: 100 mL | 213902402 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Measuring Cylinders: 250 mL | 213903604 | DURAN Measuring Cylinder, with Hexagonal Base, Class A | |
| Methane (highest purity) | Air Liquide | UN1971 Methane compressed, Class 2.1 | |
| Methanol | Sigma-Aldrich | 34860 | Methanol, suitable for HPLC, ≥ 99.9% |
| N, O-bis(trmethylsilyi)trifluoroacetamide (BSTFA) with 10% Trimethylchlorosilane (TMCS) | Thermo Scientific | 043939.22 | |
| Nitrogen | Produced by Parker Balston NitroVap Generator | ||
| Pasteur Pipettes, glass, | 13-678-20A | Fisherbrand Disposable Borosilicate Glass Pasteur Pipets | |
| Quartz glass Cuvettes | EW-83301-12 | Cole-Parmer Standard Single Quartz Cuvettes | |
| Retinol | Sigma-Aldrich | 17772 | ≥95.0% (HPLC), ~2700 U/mg |
| Retinyl acetate | Sigma-Aldrich | R0635 | analytical standard grade |
| Sodium chloride | Sigma-Aldrich | S9888 | Chlorure de sodium, ACS reagent, ≥ 99.0% |
| Spectrophotometer | Shimadzu | Uvmini-1240 UV-Vis Spectrophotometer | |
| Tetrahydrofuran | Sigma-Aldrich | 439215 | Tetrahydrofurane, HPLC grade, ≥ 99.9%, inhibitor-free |
| Ultrasonic cleaner | Bransonic | CPX-952-339R | Branson CPX Bransonic Ultrasonic Bath |
| Volumetric Pipettes: 100-1000 µL | 3123000063 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.1 | |
| Volumetric Pipettes: 20-200 µL | 3123000055 | Eppendorf 1-canal micropipette with T.I.P.S. Box 2.0 | |
| Vortex mixer | Ika | Vortx Genius 3 |
Riferimenti
- D'Ambrosio, D., Clugston, R., Blaner, W. Vitamin A metabolism: an update. Nutrients. 3 (1), 63-103 (2011).
- WHO. Global prevalence of vitamin A deficiency in populations at risk 1995-2005. WHO Global Database on Vitamin A Deficiency. , (2009).
- Kraemer, K., et al. Are low tolerable upper intake levels vitamin A undermining effective food fortification efforts. Nutr Rev. 66 (9), 517-525 (2008).
- Allen, L. H., Haskell, M. Estimating the potential for vitamin A toxicity in women and young children. J Nutr. 132 (9 Suppl), 2907S-2919S (2002).
- Filteau, S. M., et al. Influence of morbidity on serum retinol of children in a community-based study in northern Ghana. Am J Clin Nutr. 58 (2), 192-197 (1993).
- Rubin, L. P., Ross, A. C., Stephensen, C. B., Bohn, T., Tanumihardjo, S. A. Metabolic effects of inflammation on vitamin A and carotenoids in humans and animal models. Adv Nutr. 8 (2), 197-212 (2017).
- Suri, D. J., et al. Inflammation adjustments to serum retinol and retinol-binding protein improve specificity but reduce sensitivity when estimating vitamin A deficiency compared with the modified relative dose-response test in Ghanaian children. Curr Dev Nutr. 5 (8), nzab098 (2021).
- Tanumihardjo, S. A. Vitamin A: biomarkers of nutrition for development. Am J Clin Nutr. 94 (2), 658S-665S (2011).
- Furr, H. C., et al. Stable isotope dilution techniques for assessing vitamin A status and bioefficacy of provitamin A carotenoids in humans. Public Health Nutr. 8 (6), 596-607 (2005).
- Haskell, M. J., Ribaya-Mercado, J. D. the Vitamin A Tracer Task Force. Handbook on Vitamin A Tracer Dilution Methods to Assess Status and Evaluate Intervention Programs. Technical Monograph 5. , (2005).
- Furr, H. C., Amedee-Manesme, O., Bergen, H. R., Anderson, D. P., Olson, J. A. Vitamin A concentrations in liver determined by isotope dilution assay with tetradeuterated vitamin A and by biopsy in generally healthy adult humans. Am J Clin Nutr. 49 (4), 713-716 (1989).
- Gannon, B. M., Tanumihardjo, S. A. Comparisons among equations used for retinol isotope dilution in the assessment of total body stores and total liver reserves. J Nutr. 145 (5), 847-854 (2015).
- Green, M. H. Evaluation of the "Olson equation", an isotope dilution method for estimating vitamin A stores. Int J Vitam Nutr Res. 84 (Suppl 1), 9-15 (2014).
- Tang, G., Qin, J., Gregory, G., Dolnikowski, G. G. Deuterium enrichment of retinol in humans determined by gas chromatography electron capture negative chemical ionization mass spectrometry. J Nutr Biochem. 9 (7), 408-414 (1998).
- Tanumihardjo, S., et al. . Appropriate uses of vitamin A tracer (stable isotope) methodology. Vitamin A tracer task force. , (2004).
- Barua, A. B., Furr, H. C. Properties of retinoids: structure, handling, and preparation. Mol Biotechnol. 2 (2), 167-182 (1998).
- Swinehart, D. F. The Beer-Lambert Law. J Chem Edu. 39, 333-335 (1962).
- Barua, A. B., Furr, H. C. Properties of retinoids. Structure, handling, and preparation. Methods Mol Biol. 89, 3-28 (1998).
- Folch, J., Lees, M., Stanley, S. G. H. A simple method for the isolation and purification of total lipides from animal tissues. J Biol Chem. 226 (1), 497-509 (1957).
- Knapp, D. R. . Handbook of analytical derivatization reactions. , (1979).
- Green, M. H., Green, J. B. Use of model-based compartmental analysis and theoretical data to further explore choice of sampling time for assessing vitamin A status in groups and individual human subjects by the retinol isotope dilution method. J Nutr. 157 (7), 2068-2074 (2021).
- Todd, J. F. J. Recommendations for nomenclature and symbolism for mass spectroscopy (including an appendix of terms used in vacuum technology). (Recommendations 1991). Pure and Appl Chem. 63 (10), 1541-1566 (1991).
- Handelman, G. J., Haskell, M. J., Jones, A. D., Clifford, A. J. An improved protocol for determining ratios of retinol-d4 to retinol isolated from human plasma. Anal Chem. 65 (15), 2024-2028 (1993).
- Tang, G., Andrien, B. A., Dolnikowski, G., Russell, R. M. . Methods in Enzymology, Vitamins and Coenzymes. Part L. 282, 140-154 (1997).
- Haskell, M. J., et al. Population-based plasma kinetics of an oral dose of [2H4]retinyl acetate among preschool-age Peruvian children. Am J Clin Nutr. 77 (3), 681-686 (2003).
- Lopez-Teros, V., et al. International experiences in assessing vitamin A status and applying the vitamin A-labeled isotope dilution method. Int J Vitam Nutr Res. 84 (Suppl 1), 40-51 (2014).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon