Method Article
第二上磨牙尼龙结扎诱导晚期牙周炎的小鼠模型
摘要
本研究描述了一种改良的 6-0 尼龙结扎方法,用于诱导小鼠牙周炎,该方法具有高度可重复性,是研究人员研究牙周病从发展到病理后果的替代方案。
摘要
牙周病 (PD) 是一种影响牙齿支撑组织的炎症性疾病,是全球最普遍的疾病之一。其严重形式,牙周炎,导致软组织、牙齿和骨骼的破坏。牙周炎的动物模型是使用灵长类动物、狗、微型猪和小鼠开发的。其中,结扎诱导的小鼠模型具有疾病进展快、可重复性、可预测性和低成本等优势,同时有效复制了人类牙周炎的关键方面。使用结扎线的小鼠模型为牙周组织的微生物学和免疫学微环境提供了有价值的见解,突出了生物膜在免疫反应中的关键作用及其与全身性疾病的关联。本研究提出了一种改良的尼龙结扎法,用于诱导小鼠牙周炎。修改包括使用尼龙缝合线而不是丝缝线,并将其放置在邻面接触区域下方,而不是通过接触点。这种方法简化了技术,同时有效地诱发了牙周炎。以图形方式说明了缝合放置的详细方法,并通过组织学和组织学分析证明了牙周炎的进展。
引言
牙周病 (PD) 是牙齿支撑组织的炎症性疾病,是世界上最常见的疾病之一1;据报道,全球 PD 的发病率为 20%-50%2。PD 有不同程度的进展;其轻度形式称为牙龈炎,仅影响软组织,而其严重形式称为牙周炎 (PT),影响硬组织,例如骨骼3。由于PT是一种炎症性疾病,因此必须将其视为一种复杂的免疫反应,可以被几种可以改变疾病过程4的风险因素所改变,例如糖尿病5,心血管疾病6,激素相互作用,例如不良妊娠结果7 或先兆子痫8,炎症性疾病9,甚至眼部改变10 或痴呆11。
因此,要了解与 PT 的发展或流行相关的病因,测试新的或更有效的治疗策略,或确定全身性疾病与 PT 或牙周菌群之间的任何相关性,需要动物模型12。
选择有效的研究方法对于了解 PT 的发展和充分回答研究问题至关重要13.多年来,已经开发了不同的动物模型用于 PT 的研究;然而,灵长类动物、狗、兔子和微型猪等模型使用 14,15,16 既昂贵又复杂。PT 的小鼠模型,尤其是连接诱导的 PT 模型,具有许多优点,包括快速开发、可重复性、可预测性和低成本 17,18,19。
虽然有几种方法用于诱导 PT,例如口服细菌接种、脂多糖注射和结扎诱导 10,20,每种方法都有优点和缺点 17,尼龙结扎诱导的 PT 小鼠模型类似于其发展的人类机制 20,21,22,23.PT 是通过保留驻留微生物群而发生的,引起炎症并导致组织丢失。此外,可以对小鼠进行基因改造以研究不同的细胞群或感兴趣的分子,以研究 PT。
可以使用不同的材料进行牙齿结扎,例如正畸线、丝缝线24,25 或尼龙缝合线26。在小鼠中通过连接诱导 PT 的最常见材料是蚕丝;这种方法已经被不同的作者解释过,例如 Marchesan 等人 18、Abe 等人 27 和 Chadwick 等人 22,每个人都有自己的修改,所有这些方法都已被几位研究人员成功使用28。然而,在小鼠的上磨牙周围放置丝缝合线可能很复杂。Marchesan 等人建议使用“连字支架”;Abe 等人和 Chadwick 等人通过接触点放置缝合线,尽管 Chadwick 等人将其放置在磨牙 M1 和 M2 周围。
不同厚度的尼龙缝合线已用于不同动物模型的 PT 开发 29,30,31。Lima 等人31 使用了 5-0 尼龙缝合线;在以前的研究中,我们使用了 6-0 尼龙缝合线,结果相似28。
与多丝缝合线相比,尼龙缝合线是不可吸收的单丝合成线,表现出较低的炎症组织反应32;此外,尼龙缝合线还允许微生物积累33,34,并且有证据表明有核梭杆菌和中间卟啉单胞菌 35,36 以及尼龙缝合线中的兼性厌氧菌粘附 12,14,17,19,24,27,35,37 (表 1)。
这些特征可能使炎症反应主要集中在细菌积累而不是物质积累上。此外,尼龙具有比真丝38 更好的机械性能,例如拉伸强度。
因此,在本研究中,在邻面接触区域下放置在 M2 周围的 6-0 尼龙缝合线诱导小鼠晚期牙周炎的发展。这种方法允许使用常规镊子进行结扎放置,并且结果是一致的。30 天后,PT 的发展可以通过组织学和组织学分析来确认。
研究方案
所有涉及实验动物的程序均严格按照墨西哥官方标准 NOM-062-ZOO-1999 的“实验动物生物医学研究伦理框架”进行。这项研究由 Facultad de Estudios Superiores Iztacala (FES-Iztacala) 伦理委员会根据协议 CE/FESI/072024/1765 批准。小鼠被安置在 FES-Iztacala 动物设施的动物室中,在无病原体的环境中可以自由获取食物和水。该协议是对 Abe 等人 27 之前描述的方法的修改。将 6 至 8 周龄雌性 BALB/c 小鼠 (体重 16 g) 分为对照组 (CTL) 和牙周炎 (PT) 组。通过在第 0 天放置 6-0 尼龙缝合线来诱发牙周炎,以促进持续的细菌粘附并引发严重的慢性疾病进展。30 天后,对所有小鼠实施安乐死(遵循机构批准的方案),通过组织学分析评估组织损伤和附着丧失 (AL)(图 1)。所用试剂和设备的详细信息列在 材料表中。
1. 麻醉准备
- 用注射水(原液)制备甲苯噻嗪和氯胺酮 (1:10) 的稀释液。储存在 4 °C 并在 4 周内使用。
- 识别并称重每只老鼠。使用胰岛素注射器准备基于体重剂量的甲苯噻嗪 (1 mg/kg) 和氯胺酮 (2 mg/kg) 用于肌肉注射。
- 将麻醉溶液总剂量的 50% 注射到后躯中。在另一侧重复该过程。
- 将小鼠放入深盒子 (10 cm³) 中,让它们入睡,大约需要 3-5 分钟。
- 每15分钟向每只眼睛滴注羟丙甲纤维素,直到小鼠完全清醒并可以正常眨眼,以防止因麻醉而导致眼睛干燥和角膜损伤。
注意:小鼠必须观察 45 分钟,即麻醉的大致持续时间。如果鼠标在过程完成之前唤醒,则应暂停该过程并更换鼠标。
2. 动物体位
- 鼠标进入睡眠状态后,将其面朝上放在工作台上,头部朝向作员。轻轻拉动每条腿,不要紧张,并用微孔胶带固定,以防止突然的不自主运动。用毯子或纱布盖住鼠标以保持体温。
- 为了保持鼻子张开,将正畸松紧带的一端放在上切牙周围,并将另一端固定到上牙托上,不要拉紧。在下切牙周围放置第二个正畸松紧带,并用橡皮筋将其固定在下牙支架上。
- 放置脸颊分离器,小心地将舌头向一侧移动,以获得更好的可见度。
- 放置显微镜以允许充分观察上磨牙,从最低放大倍率的物镜开始。找到后,调整放大倍率以确保作员获得最佳舒适度和专注度。
3. 连字放置
- 图像清晰后,识别三颗上磨牙:最大的近端磨牙 (M1)、下一颗磨牙 (M2) 以及最小和远端磨牙 (M3)。放置 6-0 尼龙缝合线,因为其直径有助于结扎放置,并且比较宽的缝线对组织造成的机械损伤更小。
- 找到 M2 的远端,用镊子握住 6-0 尼龙缝合线的尖端,然后将尖端放在腭部的底部。通过邻面腭间隙的底部向颊面施加轻微的压力(图 2A)。
- 一旦 6-0 尼龙缝合线交叉,将其穿过邻间空间拉向颊侧(图 2B)。
- 将 6-0 尼龙缝合线的尖端从颊侧放在 M2 近中面的邻面底部。轻轻推动缝合线的尖端,使其穿过邻间间隙下方,然后将其穿过颊侧间隙回到腭部(图 2C)。
- 轻轻拉动 6-0 尼龙缝合线,用镊子握住尖端,围绕 M2 调整,然后用三个简单的结固定缝合线。
- 用细剪刀剪断 6-0 尼龙缝合线(图 2D)。
4. 动物恢复
- 要释放鼠标,请取下脸颊分离器、腿部的微孔胶带和正畸松紧带。首先,去除下门牙周围的松紧带,然后去除上门牙周围的松紧带。
- 从工作台上取下鼠标,用纱布或布包住,然后面朝上放置。保持舌头向一侧,以保持气道畅通并防止堵塞。
- 让动物保持温暖,用布或纱布盖住,并观察它们,直到它们完全清醒。然后,将它们放在普通的笼子里。
- 在每只眼睛上滴一滴羟丙甲纤维素,直到鼠标可以正常眨眼。
- 将动物保持在标准条件下。
5. 连字检查
- 每周检查尼龙结扎线的持久性(图 3A、B)。
- 拿着鼠标,牢牢握住头部和身体,用镊子打开鼻子。在灯的照射下观察 M2 周围的 6-0 尼龙缝合线。
- 根据生物膜积累和机械刺激确定牙周病的发展。通过组织学分析验证这一点。
6. 组织学
- 30 天后,在 CO2 室中对小鼠实施安乐死(遵循机构批准的方案)。如前所述收获上颌骨39.用 0.9% NaCl 溶液洗涤收获的组织,并将它们放入新的、标记的微量离心管中。
- 将样品在 4% 多聚甲醛溶液中搅拌固定 2 小时。
- 用自来水清洗样品 2 小时。
- 为了去除骨骼中的矿物质并制备高质量的石蜡切片,将样品在 20 体积的 4% EDTA (pH 7.3) 溶液中在微量离心管中脱钙 20 天,每 4 天更换一次EDTA 40。
- 将样品包埋在石蜡中。切下 M2 区域的 5 μm 切片,并用苏木精和伊红 (H&E) 染色41。
7. 数据分析
- 在光学显微镜下观察染色的组织学切片,以对沟上皮、牙龈纤维、牙周纤维、高度和牙槽嵴完整性的构型变化进行描述性分析。
- 通过测量牙骨质牙釉质交界处 (CEJ) 与骨嵴最高点之间的距离来确定附着损失 (AL)。使用数字编辑程序在这两点之间画一条线。根据 Semenoff 等人 42 描述的方法对颊面和腭表面进行组织学分析(图 4)。
8. 统计分析
- 使用 Mann-Whitney U 检验分析从 CTL 和 PT 组获得的数据。将 p < 0.05 视为统计显著性。使用统计和绘图软件进行分析。
结果
这种方法允许诱导小鼠从第 2 周开始发展为牙周炎 (PT)。每周监测小鼠以验证结扎线的存在。安乐死在第 30 天进行。评估各组患者的临床特征。随着时间的推移,对照组保持正常的特征,例如边缘牙龈的颜色和结构。与 CTL 组相比,PT 组组织表现出炎症、出血和牙周袋形成,在诱导小鼠的牙龈边缘观察到(图 5)。
通过对两组 M2 牙周组织的 AL 进行组织学和组织学分析来证实疾病的演变。CTL 组表现出类似于健康组织的组织学特征:边缘和牙龈沟的上皮、牙龈纤维(图 6A,CTL 蓝色箭头)、交界上皮和牙槽嵴(图 6A,CTL 绿色箭头);结缔组织纤维处于正常位置和高度;Sharpey 的纤维在插入牙槽骨和根牙骨质时完好无损;并观察到根部周围的对称厚度(图 6A,CTL 橙色箭头),特别是在颊侧和腭视图的附件处。牙周韧带 (PDL) 纤维中的细胞核、结缔组织和牙槽骨的骨细胞清晰可见 (40x)。在 PT 组中,牙周组织表现严重损伤,存在牙周袋,其特征是牙槽嵴丢失(图 6A,PT,绿色箭头),上皮顶端迁移和 Sharpey 纤维在牙根表面的分离(图 6A,PT,橙色箭头)。在结缔组织中,颊侧和腭侧的牙龈和骨骼缺乏细胞核(图 6A,PT,蓝色箭头),所有这些都是牙周病的特征。
组织学分析显示,对于 CTL 组,骨嵴的位置在两侧是恒定的:颊侧和腭部。此外,与 CTL 组相比,PT 组由于组织丢失,颊面 AL 深度显着增加 (p = 0.0001,117.5 nm ± 6 vs. 209.17 nm ± 10)。与 CTL 组相比,PT 组的腭比表面积显著更大 (p = 0.03,175.25 nm ± 8 vs. 254.03 nm ± 50)。尽管两侧都存在组织破坏,但在腭面上比在颊面上更明显,具有更大的深度和更大的附着损失(图 6B,C)。这些发现与我们之前发表的显示类似行为的结果一致28。
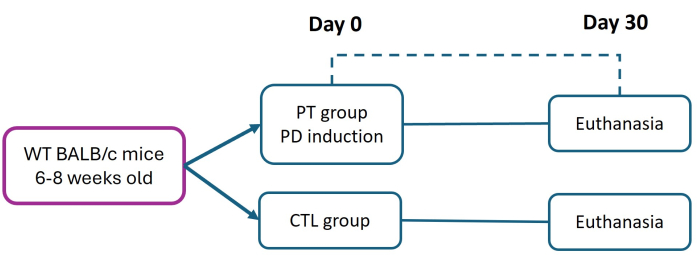
图 1:实验设计。 使用 6-0 尼龙结扎模型 (第 0 天) 在 6 至 8 周龄的 BALB/c 小鼠 (16 g) 中诱导牙周炎 (PT)。诱导后 30 天,对 PT 和健康 (CTL) 小鼠实施安乐死以进行牙周组织评估。进行了三个独立的实验;CTL 组和 PT 组的小鼠总数均为 n = 9。 请单击此处查看此图的较大版本。

图 2:结扎放置诱发牙周炎的分步程序。 用于在小鼠第二上磨牙中诱导牙周炎的步骤序列的代表性图像:(A) 显示了 6-0 尼龙缝合线如何从腭插入到颊侧的 M2 远端;(B) 显示应在接触区域下方轻轻施加压力;(C) 显示尼龙缝合线应如何穿过 M2 的近中部分,从腭部到颊部;(D) 显示了如何围绕 M2 调整尼龙缝合线并用三重结固定以充当结扎线。 请单击此处查看此图的较大版本。
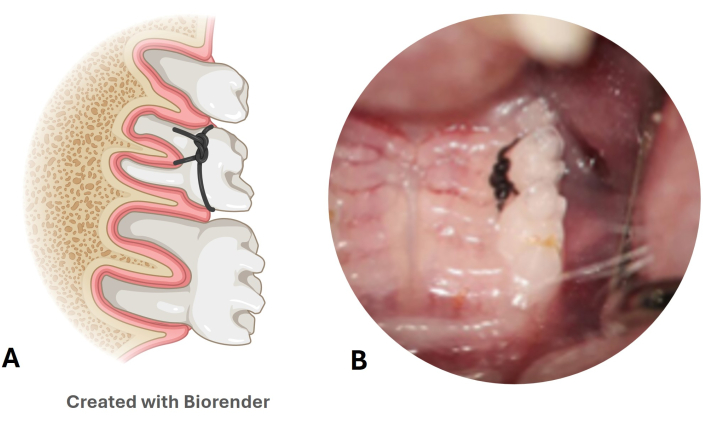
图 3:尼龙结扎牙周病模型。 (A) 结扎线在第二上磨牙中的位置图示。(B) 放置在小鼠模型中的尼龙结扎线的图像。 请单击此处查看此图的较大版本。

图 4:组织学分析。 结合损失 (AL) 是考虑牙骨质牙釉质交界处 (CEJ) 与牙槽嵴最近点之间的距离确定的,在颊面和腭面上的两点之间画一条线。供参考:V(B):颊部,P 腭。放大倍率:10 倍;比例尺 = 100 μm。 请点击此处查看此图的较大版本。

图 5:WT 小鼠牙周炎临床症状的发展。 牙周组织的代表性临床图像,CTL 控制;PT,放置尼龙 6-0 缝合线后第 1 天的牙周病;拆线后第 30 天。进行了三个独立实验的代表性图像;CTL 组和 PT 组的小鼠总数均为 n = 9。 请单击此处查看此图的较大版本。

图 6:牙周组织在尼龙诱导的牙周炎模型中显示附着丢失和组织损伤。 (A) 牙周组织 H&E 染色的代表性组织学图像,对照 (CTL);牙周炎 (PT),左图 10x,组织学分析显示,从牙骨质牙釉质交界处 (CEJ) 到牙槽嵴边缘的一条线,颊侧 (B),腭 (P),在蓝色框颊红框腭中表示。右面板颊侧和腭部在 40 倍放大时放大。蓝色箭头,结缔组织;橙色箭头,牙周韧带插入根状粘水泥;绿色箭头,骨冠。比例尺 = 100 μm。(B、C) CEJ 和牙槽嵴最高点的组织学分析。进行了三个独立实验的代表性图像;CTL 组和 PT 组的小鼠总数均为 n = 9。数据表示为 SEM ±均值,根据 Mann-Whitney U 检验,*p < 0.05 和 ****p < 0.0001 的值被认为具有统计学意义。 请单击此处查看此图的较大版本。
| 材料 | 感应 | 优势 | 弊 |
| 丝绸 | 穿过邻间间隙 | 高细菌粘附性 | 需要技巧才能插入 |
| 复丝缝合 | 容易撕裂 | ||
| 天然来源 | 连字丢失 | ||
| 正畸线 | 插入齿间区域 | 更容易放置 | 需要小心插入以避免组织损伤 |
| 耐 | |||
| 尼龙 | 插入触点下方 | 更容易放置 | 需要放大 |
| 材料不会对组织造成损伤 | 结可以移位 | ||
| 耐用且柔韧 | |||
| 牙周细菌粘附 |
表 1:用于通过结扎诱导小鼠牙周病的不同材料。
讨论
牙周炎的几种动物模型已被用于评估不同的方面,例如微生物学和免疫反应,并且与人类疾病有一些相似之处43。这些发现为牙周病的框架提供了证据,例如生物膜的作用、免疫反应以及与全身性疾病的相互作用44,45。
牙周炎的动物模型具有不同的复杂性和相似性;例如,非人灵长类动物、狗或微型猪与人类牙周病19 最相似,尽管处理和维护它们的费用和必要条件使这些模型不切实际。此外,牙周炎的小鼠模型更便宜且更易于处理。此外,小鼠可以进行基因改造以产生感兴趣的特定分子或细胞46,并且该方法已成熟47。
虽然小鼠不会自然发生 PT,但它可以通过不同的方法诱导;最常用的模型是结扎诱导模型,它具有高度可重复性22,23,因为已经使用了多种材料,例如正畸线、丝绸或尼龙等。
特别是,尼龙可能是诱导 PT 的可行选择;由于其一些特性,作为合成单丝,它具有最小的组织反应,并允许牙周细菌(如有核梭杆菌和中间卟啉单胞菌)粘附 35,36。这使得炎症反应导致“正常”细菌积累。
本研究提出了一种 通过使用 6-0 尼龙缝合线作为诱导模型来开发 PT 的替代方案,我们分析了 CTL 和 PT 小鼠的临床和组织学数据。我们确定了 PT 组存在的牙龈边缘的特征,例如出血、炎症和牙周袋形成。这些观察结果 通过 组织学分析得到了证实。特别是,PT 丢失的程度存在显著差异;虽然颊面和腭面都显示组织破坏,但腭面的破坏程度更大。这可能是因为小鼠的颊壁比人类宽。
Lima 等人31 报道尼龙结扎诱导 PT;尽管他们使用了 5-0 缝合线,但他们将结放在颊面上,并在 15 天后用 6 显微 CT 测量了线骨丢失。当使用 6-0 尼龙缝合线时,将结放在腭表面,并在 30 天后进行组织学分析以诱导严重的 PT。结果显示,围绕 M2 的 6-0 尼龙缝合线导致 PT。Liberman 等人报告用于评估骨质流失的方法之间没有差异48。
这些结果表明,所提出的模型是可重复的,并且具有几个优点。首先,它更易于使用,因为它类似于使用 threader;因此,它不一定会将缝合线推向邻间空间,由于空间有限,会增加小鼠口腔受伤的风险。其次,该模型允许通过生物膜以自然方式积累来发展 PT,并诱导牙周组织的慢性炎症。
该模型有几个限制,包括学习曲线、视觉辅助工具的必要性以及与使用显微镜或放大镜相关的挑战。此外,存在丢失结和结扎线的可能性,因此必须验证结扎线的持久性以确保刺激性刺激的持续存在。
总之,该协议描述了建立由 6-0 尼龙缝合线诱导的高级 PT 的稳健模型所需的步骤,这有助于结扎线放置。它还详细介绍了麻醉给药、放大和附着损失评估的方法。此外,该模型可用于研究 PT 引起的炎症性骨质流失所涉及的宿主特异性机制,以及 PT 在感染性、肿瘤性、自身免疫性或激素来源的疾病或病症发展中的作用。因此,使用该模型研究由生物膜积累和炎症引起的 PT 有可能产生具有治疗意义的基础知识并改善诊断。
披露声明
作者声明,本文的发布不存在利益冲突。
致谢
这项工作部分由墨西哥州科学技术委员会 (COMECYT) 资助号 [FICDTEM-2021-072] 和研究项目和技术创新支持计划 (PAPIIT)-UNAM,资助号 [IN-217021]。我们感谢牙周内膜学专业计划、FES Iztacala、UNAM 为制作本视频提供的设施,以及 Rosalba Yañez Ortiz,DDS,为制作本视频提供的支持。一些图是使用 Biorender 程序创建的(协议编号 ME282NWCI1)。
材料
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
参考文献
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。