Method Article
Modello murino di parodontite avanzata indotta da legatura di nylon nel secondo molare superiore
In questo articolo
Riepilogo
Questo studio descrive un metodo di legatura in nylon 6-0 modificato per indurre la parodontite nei topi, che è altamente riproducibile e rappresenta un'alternativa per i ricercatori per studiare la malattia parodontale dal suo sviluppo alle sue conseguenze patologiche.
Abstract
La malattia parodontale (PD) è una malattia infiammatoria che colpisce i tessuti di supporto dei denti ed è una delle malattie più diffuse in tutto il mondo. La sua forma grave, la parodontite, porta alla distruzione dei tessuti molli, dei denti e delle ossa. Modelli animali di parodontite sono stati sviluppati utilizzando primati, cani, maiali in miniatura e topi. Tra questi, il modello murino indotto dalla legatura offre vantaggi come la rapida progressione della malattia, la riproducibilità, la prevedibilità e il basso costo, replicando efficacemente gli aspetti chiave della parodontite umana. I modelli murini che utilizzano legature hanno fornito preziose informazioni sui microambienti microbiologici e immunologici del tessuto parodontale, evidenziando il ruolo critico dei biofilm nelle risposte immunitarie e la loro associazione con le malattie sistemiche. Questo studio presenta un metodo di legatura in nylon modificato per indurre la parodontite nei topi. La modifica prevede l'utilizzo di una sutura di nylon invece di una sutura di seta e il suo posizionamento sotto l'area di contatto interprossimale piuttosto che farla passare attraverso il punto di contatto. Questo approccio semplifica la tecnica inducendo efficacemente la parodontite. La metodologia dettagliata per il posizionamento della sutura è illustrata graficamente e la progressione della parodontite è dimostrata attraverso analisi istologiche e istometriche.
Introduzione
La malattia parodontale (PD) è un disturbo infiammatorio dei tessuti di sostegno dei denti ed è tra le malattie più diffuse al mondo1; è stato riportato che l'incidenza della malattia di Parkinson varia dal 20% al 50% in tutto il mondo2. La malattia di Parkinson ha diversi gradi di progressione; la sua forma lieve, chiamata gengivite, colpisce solo i tessuti molli e la sua forma grave, chiamata parodontite (PT), colpisce i tessuti duri come l'osso3. Poiché la PT è una malattia infiammatoria, deve essere considerata una risposta immunitaria complessa che può essere modificata da diversi fattori di rischio che possono alterare il processo della malattia4, come il diabete mellito5, le malattie cardiovascolari6, le interazioni ormonali come gli esiti avversi della gravidanza7 o la preeclampsia8, le malattie infiammatorie9 e persino le alterazioni oculari10 o la demenza11.
Pertanto, per comprendere l'eziologia associata allo sviluppo o alla prevalenza del PT, per testare nuove o più efficaci strategie terapeutiche, o per identificare qualsiasi correlazione tra malattie sistemiche e PT o il microbiota parodontale, sono necessari modelli animali12.
La scelta di un metodo di ricerca efficace è fondamentale per comprendere lo sviluppo del PT e rispondere adeguatamente alle domande di ricerca13. Nel corso degli anni sono stati sviluppati diversi modelli animali per lo studio del PT; Tuttavia, modelli come primati, cani, conigli e maiali in miniatura sono costosi e complessi da usare 14,15,16. I modelli murini di PT, in particolare il modello PT indotto dalla legatura, presentano numerosi vantaggi, tra cui rapido sviluppo, riproducibilità, prevedibilità e basso costo 17,18,19.
Sebbene vengano utilizzati diversi metodi per indurre il PT, come l'inoculazione batterica orale, l'iniezione di lipopolisaccaridi e l'induzione della legatura10,20, ognuno ha vantaggi e svantaggi17, il modello murino di PT indotto dalla legatura del nylon assomigliava al meccanismo umano per il suo sviluppo 20,21,22,23. La PT si verifica attraverso la ritenzione del microbiota residente, causando infiammazione e portando alla perdita di tessuto. Inoltre, i topi possono essere geneticamente modificati per studiare diverse popolazioni cellulari o molecole di interesse per lo studio del PT.
La legatura dentale può essere eseguita utilizzando diversi materiali, come fili ortodontici, suture di seta 24,25 o suture di nylon26. Il materiale più comune per indurre PT mediante legatura nei topi è la seta; questa metodologia è stata spiegata da diversi autori, come Marchesan et al.18, Abe et al.27 e Chadwick et al.22, ognuno con le proprie modifiche, e tutti questi metodi sono stati utilizzati con successo da diversi ricercatori28. Tuttavia, posizionare una sutura di seta attorno ai molari superiori nei topi può essere complesso. Marchesan et al. hanno suggerito l'uso di un "portalegature"; Abe et al. e Chadwick et al. hanno posizionato la sutura attraverso il punto di contatto, sebbene Chadwick et al. l'abbiano posizionata attorno ai molari M1 e M2.
Suture in nylon di diversi spessori sono state utilizzate per lo sviluppo di PT in diversi modelli animali 29,30,31. Lima et al.31 hanno utilizzato suture di nylon 5-0; In studi precedenti, abbiamo utilizzato suture di nylon 6-0 con risultati simili28.
Rispetto alle suture multifilamento, le suture in nylon sono sintetiche monofilamento non riassorbibili e presentano una risposta tissutale infiammatoria inferiore32; inoltre, le suture in nylon consentono anche l'accumulo microbico33,34 e ci sono prove dell'adesione di Fusobacterium nucleatum e Porphyromona intermedia35,36, insieme a batteri anaerobi facoltativi nelle suture in nylon 12,14,17,19,24,27,35,37 (Tabella 1).
Queste caratteristiche possono consentire che la risposta infiammatoria si concentri principalmente sull'accumulo batterico piuttosto che sull'accumulo di materiale. Inoltre, il nylon ha proprietà meccaniche migliori, come la resistenza alla trazione, rispetto alla seta38.
Pertanto, nel presente studio, la sutura in nylon 6-0 posizionata intorno a M2 sotto l'area di contatto interprossimale ha indotto lo sviluppo di parodontite in stadio avanzato nel topo. Questo approccio consente il posizionamento della legatura con pinzette normali e i risultati sono coerenti. Dopo 30 giorni, lo sviluppo del PT può essere confermato dall'analisi istometrica e istologica.
Protocollo
Tutte le procedure che coinvolgono animali da esperimento sono state condotte nel rigoroso rispetto del "Quadro etico per la ricerca biomedica sugli animali da laboratorio", seguendo lo standard ufficiale messicano NOM-062-ZOO-1999. Questo studio è stato approvato dal comitato etico della Facultad de Estudios Superiores Iztacala (FES-Iztacala) con protocollo CE/FESI/072024/1765. I topi sono stati alloggiati in camere per animali con libero accesso a cibo e acqua in un ambiente privo di agenti patogeni presso la struttura per animali FES-Iztacala. Questo protocollo è una modifica del metodo precedentemente descritto da Abe et al.27. Le femmine di topi BALB/c di sei-otto settimane (del peso di 16 g) sono state divise in gruppi di controllo (CTL) e parodontite (PT). La parodontite è stata indotta posizionando una sutura di nylon 6-0 il giorno 0 per promuovere un'adesione batterica sostenuta e innescare una progressione grave e cronica della malattia. Dopo 30 giorni, tutti i topi sono stati soppressi (seguendo protocolli istituzionalmente approvati) per valutare il danno tissutale e la perdita di attaccamento (AL) attraverso l'analisi istometrica (Figura 1). I dettagli dei reagenti e delle attrezzature utilizzate sono elencati nella Tabella dei materiali.
1. Preparazione dell'anestesia
- Preparare una diluizione di xilazina e ketamina (1:10) con acqua iniettabile (brodo). Conservare a 4 °C e consumare entro 4 settimane.
- Identifica e pesa ogni topo. Preparare una dose basata sul peso di xilazina (1 mg/kg) e ketamina (2 mg/kg) per l'applicazione intramuscolare utilizzando una siringa da insulina.
- Iniettare il 50% della dose totale della soluzione anestetica nel quarto posteriore. Ripetere la procedura sul lato opposto.
- Metti i topi in una scatola profonda (10 cm³) e lasciali addormentare, il che richiede circa 3-5 minuti.
- Prevenire la secchezza oculare e i danni alla cornea dovuti all'anestesia applicando una goccia di ipromellosa su ciascun occhio ogni 15 minuti fino a quando i topi non sono completamente svegli e possono sbattere le palpebre normalmente.
NOTA: I topi devono essere tenuti sotto osservazione per 45 minuti, la durata approssimativa dell'anestesia. Se un mouse si riattiva prima del completamento della procedura, la procedura deve essere sospesa e il mouse deve essere sostituito.
2. Posizionamento degli animali
- Una volta che il mouse è addormentato, posizionarlo su un tavolo da lavoro rivolto verso l'alto con la testa rivolta verso l'operatore. Tirare delicatamente ogni gamba senza tensione e fissarla con del nastro microporoso per evitare movimenti involontari improvvisi. Copri il topo con una coperta o una garza per mantenere il calore corporeo.
- Per mantenere il muso aperto, posizionare un'estremità di un elastico ortodontico attorno agli incisivi superiori e fissare l'altra estremità a un supporto superiore senza tensione. Posizionare un secondo elastico ortodontico attorno agli incisivi inferiori e fissarlo a un supporto inferiore con un elastico.
- Posizionare i separatori di guance e spostare con cautela la lingua da un lato per una migliore visibilità.
- Posizionare il microscopio in modo da consentire un'adeguata visualizzazione dei molari superiori, iniziando dall'obiettivo di ingrandimento più basso. Una volta individuato, regolare l'ingrandimento per garantire un comfort e una messa a fuoco ottimali per l'operatore.
3. Posizionamento della legatura
- Una volta che l'immagine è chiara, identifica i tre molari superiori: il molare più grande e prossimale (M1), il molare successivo (M2) e il molare più piccolo e distale (M3). Posizionare una sutura in nylon 6-0, poiché il suo diametro facilita il posizionamento della legatura e provoca meno danni meccanici ai tessuti rispetto alle suture più larghe.
- Individuare il lato distale di M2, tenere la punta della sutura di nylon 6-0 con una pinzetta e posizionare la punta alla base della papilla dal palatino. Applicare una leggera pressione attraverso la base dello spazio palatale interprossimale verso la superficie vestibolare (Figura 2A).
- Una volta che la sutura in nylon 6-0 si incrocia, tirarla attraverso lo spazio interprossimale verso il lato vestibolare (Figura 2B).
- Posizionare la punta della sutura di nylon 6-0 alla base dell'area interprossimale sulla superficie mesiale di M2 dal lato vestibolare. Spingere delicatamente la punta della sutura per attraversarla sotto lo spazio interprossimale e farla passare attraverso lo spazio vestibolare fino al palatino (Figura 2C).
- Tirare delicatamente la sutura in nylon 6-0, tenere la punta con una pinzetta, regolarla intorno a M2 e fissare la sutura con tre semplici nodi.
- Tagliare la sutura di nylon 6-0 con le forbici sottili (Figura 2D).
4. Recupero degli animali
- Per rilasciare il mouse, rimuovere i separatori delle guance, il nastro microporoso dalle gambe e gli elastici ortodontici. Per prima cosa, rimuovere l'elastico attorno agli incisivi inferiori, quindi rimuovere l'elastico attorno agli incisivi superiori.
- Rimuovi il mouse dal piano di lavoro, avvolgilo in una garza o in un panno e posizionalo a faccia in su. Mantenere la lingua di lato per mantenere aperte le vie aeree e prevenire l'ostruzione.
- Tenere l'animale al caldo, coperto con un panno o una garza, e sotto osservazione fino a quando non è completamente sveglio. Quindi, mettili nelle loro gabbie regolari.
- Applicare una goccia di ipromellosa in ciascun occhio fino a quando il mouse non può sbattere le palpebre normalmente.
- Tenere l'animale in condizioni standard.
5. Controllo della legatura
- Controllare la permanenza della legatura in nylon ogni settimana (Figura 3A, B).
- Prendi il mouse, tieni saldamente la testa e il corpo e usa una pinzetta per aprire il muso. Osservare la sutura di nylon 6-0 attorno a M2 sotto la luce di una lampada.
- Stabilire lo sviluppo della malattia parodontale in base all'accumulo di biofilm e all'irritazione meccanica. Verificalo attraverso l'analisi istologica.
6. Istologia
- Dopo 30 giorni, sopprimere i topi in una camera di CO2 (seguendo protocolli istituzionalmente approvati). Raccogliere le mascelle come precedentemente riportato39. Lavare i fazzoletti prelevati in una soluzione di NaCl allo 0,9% e metterli in nuove provette da microcentrifuga etichettate.
- Fissare i campioni in una soluzione di paraformaldeide al 4% per 2 ore agitando.
- Lavare i campioni con acqua di rubinetto per 2 ore.
- Per rimuovere i minerali dall'osso e preparare sezioni di paraffina di alta qualità, decalcificare i campioni in venti volumi di una soluzione di EDTA al 4% (pH 7,3) per 20 giorni in provette da microcentrifuga, cambiare l'EDTA ogni 4 giorni40.
- Incorporare i campioni nella paraffina. Tagliare sezioni di 5 μm dell'area M2 e colorarle con ematossilina ed eosina (H&E)41.
7. Analisi dei dati
- Osservare le sezioni istologiche colorate al microscopio ottico per eseguire un'analisi descrittiva dei cambiamenti nella configurazione dell'epitelio del solco, delle fibre gengivali, delle fibre parodontali, dell'altezza e dell'integrità della cresta alveolare.
- Determinare la perdita di attacco (AL) misurando la distanza tra la giunzione cemento-smalto (CEJ) e il punto più alto della cresta ossea. Traccia una linea tra questi due punti utilizzando un programma di editing digitale. Eseguire analisi istometriche sulle superfici buccale e palatale secondo la metodologia descritta da Semenoff et al.42 (Figura 4).
8. Analisi statistica
- Analizza i dati ottenuti dai gruppi CTL e PT utilizzando il test U di Mann-Whitney. Considera p < 0,05 come statisticamente significativo. Utilizza statistiche e software grafici per l'analisi.
Risultati
Questa metodologia consente ai topi indotti di sviluppare la parodontite (PT) dalla seconda settimana in poi. I topi sono stati monitorati settimanalmente per verificare la presenza della legatura. L'eutanasia è stata eseguita il giorno 30. Sono state valutate le caratteristiche cliniche di tutti i gruppi. Il gruppo di controllo ha mantenuto nel tempo caratteristiche normali, come il colore e la struttura della gengiva marginale. Rispetto a quelli del gruppo CTL, i tessuti del gruppo PT hanno mostrato infiammazione, sanguinamento e formazione di tasche parodontali, che sono stati osservati al margine gengivale nei topi indotti (Figura 5).
L'evoluzione della malattia è stata confermata eseguendo un'analisi istologica e istometrica dell'AL del tessuto parodontale di M2 in entrambi i gruppi. Il gruppo CTL presentava caratteristiche istologiche simili a quelle dei tessuti sani: l'epitelio della gengiva marginale e del solco, le fibre gengivali (Figura 6A, CTL freccia blu), l'epitelio giunzionale e la cresta alveolare (Figura 6A, CTL freccia verde); le fibre del tessuto connettivo erano in posizione e altezza normali; Le fibre di Sharpey erano intatte al momento del loro inserimento nell'osso alveolare e nel cemento radicolare; ed è stato osservato uno spessore simmetrico attorno alla radice (Figura 6A, CTL freccia arancione), in particolare all'attacco sia nella vista buccale che in quella palatina. I nuclei cellulari nelle fibre del legamento parodontale (PDL), nel tessuto connettivo e negli osteociti dell'osso alveolare erano chiaramente visibili (40x). Nel gruppo PT, i tessuti parodontali presentavano un grave danno, con presenza di tasche parodontali, caratterizzate da perdita della cresta alveolare (Figura 6A, PT, freccia verde), migrazione apicale dell'epitelio e distacco delle fibre di Sharpey sulla superficie della radice (Figura 6A, PT, freccia arancione). Nel tessuto connettivo, la gengiva e l'osso dei lati buccale e palatale mancavano di nuclei cellulari (Figura 6A, PT, freccia blu), tutti caratteristici della malattia parodontale.
L'analisi istometrica ha rivelato che, per il gruppo CTL, la posizione della cresta ossea era costante su entrambi i lati: buccale e palatino. Inoltre, rispetto al gruppo CTL, il gruppo PT ha presentato un aumento significativo della profondità AL della superficie buccale (p = 0,0001, 117,5 nm ± 6 vs. 209,17 nm ± 10) a causa della perdita di tessuto. Rispetto a quella del gruppo CTL, la superficie palatina del gruppo PT era significativamente maggiore (p = 0,03, 175,25 nm ± 8 vs. 254,03 nm ± 50). Sebbene entrambi i lati presentassero una distruzione tissutale, era più evidente sulla superficie palatale, con maggiore profondità e maggiore perdita di attaccamento, rispetto alla superficie buccale (Figura 6B, C). Questi risultati sono coerenti con i nostri risultati pubblicati in precedenza che hanno mostrato un comportamento simile28.
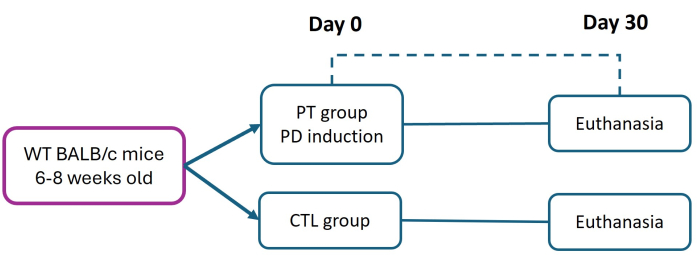
Figura 1: Disegno sperimentale. La parodontite (PT) è stata indotta in topi BALB/c di sei-otto settimane (16 g) utilizzando il modello di legatura in nylon 6-0 (giorno 0). Trenta giorni dopo l'induzione, i topi PT e i topi sani (CTL) sono stati soppressi per la valutazione del tessuto parodontale. Sono stati eseguiti tre esperimenti indipendenti; il numero totale di topi in entrambi i gruppi CTL e PT era n = 9. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Procedura passo dopo passo per il posizionamento della legatura per indurre la parodontite. Immagini rappresentative della sequenza di passaggi utilizzati per indurre la parodontite nel secondo molare superiore del topo: (A) mostra come la sutura in nylon 6-0 viene inserita distalmente a M2, dal palatino al buccale; (B) mostra come la pressione deve essere applicata delicatamente sotto l'area di contatto; (C) mostra come la sutura di nylon dovrebbe passare attraverso la parte mesiale di M2, dal palatino al buccale; e (D) mostra come la sutura di nylon è regolata attorno a M2 e fissata con un triplo nodo per fungere da legatura. Clicca qui per visualizzare una versione più grande di questa figura.
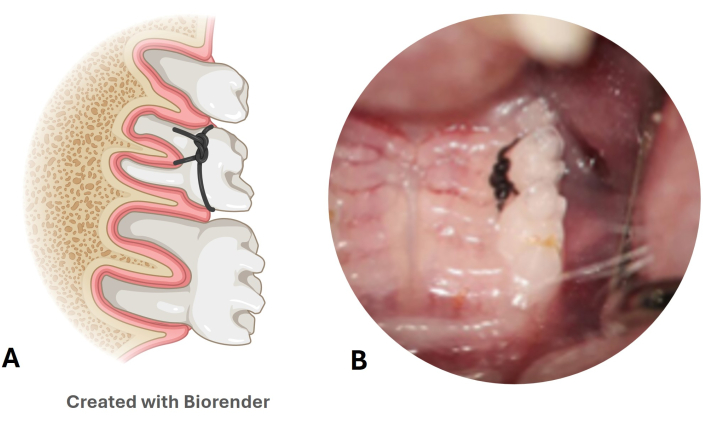
Figura 3: Modello di malattia parodontale con legatura in nylon. (A) Illustrazione della posizione della legatura nel secondo molare superiore. (B) Immagine della legatura di nylon collocata in un modello murino. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Analisi istometrica. La perdita di attacco (AL) è stata determinata considerando la distanza tra la giunzione cemento-smalto (CEJ) e il punto più vicino della cresta alveolare, tracciando una linea tra i due punti sulle superfici vestibolare e palatale. Per riferimento: V(B): buccale, P palatale. Ingrandimento: 10x; barra di scala = 100 μm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 5: Sviluppo di segni clinici di parodontite nei topi WT. Immagine clinica rappresentativa dei tessuti parodontali, controllo CTL; PT, malattia parodontale giorno 1 dopo il posizionamento della sutura in nylon 6-0; Giorno 30 dopo la rimozione della sutura. Sono state eseguite immagini rappresentative di tre esperimenti indipendenti; il numero totale di topi in entrambi i gruppi CTL e PT era n = 9. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 6: I tessuti parodontali hanno mostrato perdita di attaccamento e danno tissutale nel modello di parodontite indotto da nylon. (A) Immagini istologiche rappresentative con colorazione H&E dei tessuti parodontali, controllo (CTL); parodontite (PT), pannello sinistro 10x, è mostrata l'analisi istometrica, con una linea dalla giunzione cemento-smalto (CEJ) al bordo della cresta alveolare, buccale (B), palatino (P), indicata nel riquadro blu buccale rosso palatino. Pannelli destri buccali e palatini a ingrandimento ravvicinato a 40x. Freccia blu, tessuto connettivo; freccia arancione, inserzione del legamento parodontale in cemento radicolare; freccia verde, cresta ossea. Barre della scala = 100 μm. (B, C) Analisi istometrica della CEJ e del punto più alto della cresta alveolare. È stata eseguita un'immagine rappresentativa di tre esperimenti indipendenti; il numero totale di topi in entrambi i gruppi CTL e PT era n = 9. I dati sono espressi come medie ± SEM e valori di *p < 0,05 e ****p < 0,0001 sono stati considerati statisticamente significativi secondo il test U di Mann-Whitney. Clicca qui per visualizzare una versione più grande di questa figura.
| Materiale | Induzione | Vantaggi | Difetto |
| Seta | Passaggio attraverso lo spazio interprossimale | Elevata aderenza batterica | Richiede abilità per essere inserito |
| Sutura multifilamento | Facilmente strappabile | ||
| Origine naturale | Perdita di legatura | ||
| Filo ortodontico | Inserimento nell'area interdentale | Più facile da posizionare | Necessita di un inserimento accurato per evitare danni ai tessuti |
| Resistente | |||
| Nailon | Inserimento sotto il punto di contatto | Più facile da posizionare | Richiede ingrandimento |
| Nessun danno ai tessuti dovuto al materiale | Il nodo può essere spostato | ||
| Resistente e flessibile | |||
| Aderenza dei batteri parodontali |
Tabella 1: Diversi materiali utilizzati per indurre la malattia parodontale mediante legatura nei topi.
Discussione
Diversi modelli animali di parodontite sono stati utilizzati per valutare diversi aspetti, come le risposte microbiologiche e immunitarie, e presentano alcune somiglianze con la malattia umana43. Questi risultati forniscono prove del quadro della malattia parodontale, come il ruolo dei biofilm, la risposta immunitaria e le interazioni con le condizioni sistemiche44,45.
I modelli animali di parodontite hanno diverse complessità e somiglianze; Ad esempio, i primati, i cani o i maiali in miniatura non umani sono i più simili alla malattia parodontale umana19, sebbene la spesa e i requisiti per gestirli e mantenerli rendano questi modelli poco pratici. Inoltre, i modelli murini di parodontite sono meno costosi e più facili da maneggiare. Inoltre, i topi possono essere geneticamente modificati per generare una specifica molecola o cellula di interesse46 e la metodologia è ben consolidata47.
Sebbene i topi non sviluppino naturalmente il PT, può essere indotto da diverse metodologie; Il modello più comunemente usato è il modello indotto dalla legatura, che è altamente riproducibile22,23, poiché sono stati utilizzati diversi materiali, come il filo ortodontico, la seta o il nylon, tra gli altri.
In particolare, il nylon può essere una valida opzione per indurre PT; grazie ad alcune sue caratteristiche, come monofilamento sintetico, ha una risposta tissutale minima e permette l'adesione di batteri parodontali come Fusobacterium nucleatum e Porphyromona intermedia35,36. Ciò consente alla risposta infiammatoria di portare a un accumulo batterico "normale".
Questo studio propone un'alternativa per sviluppare PT attraverso l'uso di una sutura di nylon 6-0 come modello di induzione e abbiamo analizzato i dati clinici e istologici dei topi CTL e PT. Abbiamo identificato le caratteristiche dei margini gengivali presenti nel gruppo PT, come sanguinamento, infiammazione e formazione di tasche parodontali. Queste osservazioni sono state corroborate da un'analisi istometrica. In particolare, il grado di perdita di PT era significativamente diverso; Sebbene sia la superficie buccale che quella palatale mostrassero una distruzione tissutale, era maggiore sulla superficie palatale. Ciò è probabilmente dovuto al fatto che la parete buccale è più larga nei topi che negli esseri umani.
Lima et al.31 hanno riportato che le legature di nylon inducono PT; sebbene abbiano utilizzato una sutura 5-0, hanno posizionato il nodo sulla superficie buccale e hanno misurato la perdita ossea lineare 6 micro-CT dopo 15 giorni. Mentre sono state utilizzate suture di nylon 6-0, il nodo è stato posizionato sulla superficie palatale ed è stata eseguita un'analisi istometrica dopo 30 giorni per indurre un PT grave. I risultati hanno rivelato che le suture di nylon 6-0 intorno a M2 hanno portato a PT. Liberman et al. non hanno riportato differenze tra i metodi utilizzati per valutare la perdita ossea48.
Questi risultati mostrano che il modello proposto è riproducibile e presenta diversi vantaggi. Innanzitutto, è più facile da usare perché è simile all'utilizzo di un infilatore; Pertanto, non spinge necessariamente la sutura verso lo spazio interprossimale, aumentando il rischio di lesioni alla cavità orale del topo a causa dello spazio limitato. In secondo luogo, questo modello consente lo sviluppo di PT attraverso l'accumulo di biofilm in modo naturale e induce un'infiammazione cronica nei tessuti parodontali.
Questo modello presenta diverse limitazioni, tra cui la curva di apprendimento, la necessità di ausili visivi e le sfide associate all'uso di microscopi o lenti d'ingrandimento. Inoltre, esiste la possibilità di perdere i nodi e le legature, per cui è fondamentale verificare la permanenza della legatura per garantire la presenza continua dello stimolo irritante.
In sintesi, questo protocollo descrive i passaggi necessari per stabilire un modello robusto di PT avanzato indotto da una sutura in nylon 6-0, che facilita il posizionamento della legatura. Descrive inoltre in dettaglio la metodologia per la somministrazione dell'anestetico, l'ingrandimento e la valutazione della perdita di attaccamento. Inoltre, questo modello può essere utilizzato per studiare i meccanismi host-specifici coinvolti nella perdita ossea infiammatoria dovuta a PT, nonché il ruolo del PT nello sviluppo di malattie o disturbi di origine infettiva, neoplastica, autoimmune o ormonale. Pertanto, l'utilizzo di questo modello per studiare il PT causato dall'accumulo di biofilm e dall'infiammazione ha il potenziale per generare conoscenze fondamentali con implicazioni terapeutiche e migliorare la diagnosi.
Divulgazioni
Gli autori dichiarano che non vi sono conflitti di interesse in merito alla pubblicazione di questo articolo.
Riconoscimenti
Questo lavoro è stato finanziato in parte dal Consiglio per la Scienza e la Tecnologia dello Stato del Messico (COMECYT) numero di sovvenzione [FICDTEM-2021-072] e dal Programma di sostegno per i progetti di ricerca e l'innovazione tecnologica (PAPIIT)-UNAM, numero di sovvenzione [IN-217021]. Ringraziamo il programma di specializzazione in Endoperiodontología, FES Iztacala, UNAM per le strutture fornite per realizzare questo video e Rosalba Yañez Ortiz, DDS, per il suo supporto nella realizzazione di questo video. Alcune figure sono state create con il programma Biorender (Contratto numero ME282NWCI1).
Materiali
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
Riferimenti
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon