Method Article
Mausmodell der fortgeschrittenen Parodontitis, die durch eine Nylonligatur im zweiten oberen Molaren induziert wird
In diesem Artikel
Zusammenfassung
Diese Studie beschreibt eine modifizierte 6-0-Nylon-Ligaturmethode zur Induktion von Parodontitis bei Mäusen, die hochgradig reproduzierbar ist und eine Alternative für Forscher darstellt, um Parodontalerkrankungen von ihrer Entwicklung bis zu ihren pathologischen Folgen zu untersuchen.
Zusammenfassung
Die Parodontitis (PD) ist eine entzündliche Erkrankung, die das Stützgewebe der Zähne betrifft und eine der weltweit am weitesten verbreiteten Erkrankungen ist. Ihre schwere Form, die Parodontitis, führt zur Zerstörung von Weichgewebe, Zähnen und Knochen. Tiermodelle der Parodontitis wurden mit Primaten, Hunden, Miniaturschweinen und Mäusen entwickelt. Unter diesen bietet das ligaturinduzierte Mausmodell Vorteile wie schnelles Fortschreiten der Krankheit, Reproduzierbarkeit, Vorhersagbarkeit und niedrige Kosten bei gleichzeitiger effektiver Replikation wichtiger Aspekte der menschlichen Parodontitis. Mausmodelle, die Ligaturen verwenden, haben wertvolle Einblicke in die mikrobiologischen und immunologischen Mikroumgebungen von parodontalem Gewebe geliefert und die entscheidende Rolle von Biofilmen bei Immunantworten und ihre Assoziation mit systemischen Erkrankungen hervorgehoben. In dieser Studie wird eine modifizierte Nylon-Ligaturmethode zur Induktion von Parodontitis bei Mäusen vorgestellt. Bei der Modifikation wird eine Nylonnaht anstelle einer Seidennaht verwendet und unter der interproximalen Kontaktfläche platziert, anstatt sie durch den Kontaktpunkt zu führen. Dieser Ansatz vereinfacht die Technik und induziert effektiv Parodontitis. Die detaillierte Methodik zur Nahtplatzierung wird grafisch dargestellt und der Verlauf der Parodontitis durch histologische und histometrische Analysen dargestellt.
Einleitung
Die Parodontitis (PD) ist eine entzündliche Erkrankung des Stützgewebes der Zähne und gehört zu den weltweit am weitesten verbreiteten Erkrankungen1; Die Inzidenz von Parkinson liegt weltweit zwischen 20 % und 50 %2. Parkinson hat unterschiedliche Progressionsgrade; Seine milde Form, Gingivitis genannt, betrifft nur Weichteile, und seine schwere Form, Parodontitis (PT) genannt, betrifft Hartgewebe wie Knochen3. Da es sich bei PT um eine entzündliche Erkrankung handelt, muss sie als komplexe Immunantwort angesehen werden, die durch mehrere Risikofaktoren modifiziert werden kann, die den Krankheitsprozess verändern können4, wie z. B. Diabetes mellitus5, Herz-Kreislauf-Erkrankungen6, hormonelle Wechselwirkungen wie ungünstige Schwangerschaftsergebnisse7 oder Präeklampsie8, entzündliche Erkrankungen9 und sogar Augenveränderungen10 oder Demenz11.
Um die Ätiologie zu verstehen, die mit der Entwicklung oder Prävalenz von PT verbunden ist, um neue oder wirksamere therapeutische Strategien zu testen oder um einen Zusammenhang zwischen systemischen Erkrankungen und PT oder der parodontalen Mikrobiota zu identifizieren, sind Tiermodelle erforderlich12.
Die Wahl einer effektiven Forschungsmethode ist entscheidend, um die Entwicklung der PT zu verstehen und Forschungsfragen angemessen zu beantworten13. Im Laufe der Jahre wurden verschiedene Tiermodelle für die Erforschung der PT entwickelt; Modelle wie Primaten, Hunde, Kaninchen und Miniaturschweine sind jedoch teuer und komplex in der Anwendung 14,15,16. Mausmodelle der PT, insbesondere das Ligations-induzierte PT-Modell, haben zahlreiche Vorteile, darunter schnelle Entwicklung, Reproduzierbarkeit, Vorhersagbarkeit und niedrige Kosten 17,18,19.
Obwohl mehrere Methoden zur Induktion von PT verwendet werden, wie z. B. die orale bakterielle Inokulation, die Lipopolysaccharid-Injektion und die Ligaturinduktion10,20, hat jede Vor- und Nachteile17, ähnelte das Mausmodell der PT, das durch Nylonligatur induziert wurde, dem menschlichen Mechanismus für seine Entwicklung 20,21,22,23. PT tritt durch die Retention der residenten Mikrobiota auf, was zu Entzündungen und Gewebeverlust führt. Darüber hinaus können Mäuse genetisch verändert werden, um verschiedene Zellpopulationen oder Moleküle zu untersuchen, die für die Untersuchung von PT von Interesse sind.
Die Zahnligatur kann mit verschiedenen Materialien durchgeführt werden, wie z. B. kieferorthopädischen Drähten, Seidennähten24,25 oder Nylonnähten26. Das gebräuchlichste Material zur Induktion von PT durch Ligation bei Mäusen ist Seide; Diese Methodik wurde von verschiedenen Autoren wie Marchesan et al.18, Abe et al.27 und Chadwick et al.22 erklärt, jeder mit seinen eigenen Modifikationen, und alle diese Methoden wurden von mehreren Forschern erfolgreich eingesetzt28. Das Platzieren einer Seidennaht um die oberen Backenzähne bei Mäusen kann jedoch komplex sein. Marchesan et al. schlugen die Verwendung eines "Ligaturhalters" vor; Abe et al. und Chadwick et al. platzierten die Naht durch den Kontaktpunkt, obwohl Chadwick et al. sie um die Molaren M1 und M2 platzierten.
Nylonnähte unterschiedlicher Dicke wurden für die PT-Entwicklung in verschiedenen Tiermodellen verwendet 29,30,31. Lima et al.31 verwendeten 5-0 Nylonnähte; In früheren Studien haben wir 6-0 Nylon-Nähte mit ähnlichen Ergebnissen verwendet28.
Im Vergleich zu Multifilament-Nähten sind Nylon-Nähte nicht resorbierbare monofile synthetische Nähte und weisen eine geringere Entzündungsreaktion des Gewebes auf32; Darüber hinaus ermöglichen Nylonnähte auch eine mikrobielle Akkumulation33,34, und es gibt Hinweise auf die Adhäsion von Fusobacterium nucleatum und Porphyromona intermedia35,36 zusammen mit fakultativen anaeroben Bakterien in Nylonnähten 12,14,17,19,24,27,35,37 (Tabelle 1).
Diese Eigenschaften könnten es ermöglichen, dass sich die Entzündungsreaktion hauptsächlich auf die Bakterienakkumulation und nicht auf die Materialakkumulation konzentriert. Darüber hinaus hat Nylon bessere mechanische Eigenschaften, wie z. B. die Zugfestigkeit, als Seide38.
Daher induzierte in der vorliegenden Studie die 6-0-Nylonnaht, die um M2 unter der interproximalen Kontaktfläche platziert wurde, die Entwicklung einer Parodontitis im fortgeschrittenen Stadium bei der Maus. Dieser Ansatz ermöglicht die Platzierung der Ligatur mit einer normalen Pinzette, und die Ergebnisse sind konsistent. Nach 30 Tagen kann die Entwicklung der PT durch histometrische und histologische Analysen bestätigt werden.
Protokoll
Alle Verfahren mit Versuchstieren wurden in strikter Übereinstimmung mit dem "Ethischen Rahmenwerk für die biomedizinische Forschung an Labortieren" nach dem offiziellen mexikanischen Standard NOM-062-ZOO-1999 durchgeführt. Diese Studie wurde von der Ethikkommission der Facultad de Estudios Superiores Iztacala (FES-Iztacala) gemäß Protokoll CE/FESI/072024/1765 genehmigt. Die Mäuse wurden in Tierkammern mit freiem Zugang zu Futter und Wasser in einer pathogenfreien Umgebung in der Tieranlage FES-Iztacala untergebracht. Dieses Protokoll ist eine Modifikation der zuvor von Abe et al.27 beschriebenen Methode. Sechs bis acht Wochen alte weibliche BALB/c-Mäuse (mit einem Gewicht von 16 g) wurden in Kontroll- (CTL) und Parodontitis- (PT) Gruppen eingeteilt. Die Parodontitis wurde durch das Platzieren einer 6-0-Nylonnaht an Tag 0 induziert, um eine anhaltende bakterielle Adhäsion zu fördern und ein schweres, chronisches Fortschreiten der Krankheit auszulösen. Nach 30 Tagen wurden alle Mäuse eingeschläfert (gemäß institutionell anerkannten Protokollen), um Gewebeschäden und Attachmentverlust (AL) durch histometrische Analyse zu beurteilen (Abbildung 1). Einzelheiten zu den verwendeten Reagenzien und Geräten sind in der Materialtabelle aufgeführt.
1. Vorbereitung der Anästhesie
- Bereiten Sie eine Verdünnung von Xylazin und Ketamin (1:10) mit injizierbarem Wasser (Brühe) vor. Bei 4 °C lagern und innerhalb von 4 Wochen verbrauchen.
- Identifizieren und wiegen Sie jede Maus. Bereiten Sie eine gewichtsabhängige Dosis von Xylazin (1 mg/kg) und Ketamin (2 mg/kg) für die intramuskuläre Anwendung mit einer Insulinspritze vor.
- Injizieren Sie 50% der Gesamtdosis der Anästhesielösung in die Hinterhand. Wiederholen Sie den Vorgang auf der gegenüberliegenden Seite.
- Setzen Sie die Mäuse in eine tiefe Box (10 cm³) und lassen Sie sie einschlafen, was ca. 3-5 Minuten dauert.
- Beugen Sie Augentrockenheit und Hornhautschäden durch Anästhesie vor, indem Sie alle 15 Minuten einen Hypromellose-Tropfen auf jedes Auge auftragen, bis die Mäuse vollständig wach sind und normal blinzeln können.
HINWEIS: Die Mäuse müssen 45 Minuten lang unter Beobachtung gehalten werden, was der ungefähren Dauer der Anästhesie entspricht. Wenn eine Maus den Ruhezustand aktiviert, bevor der Vorgang abgeschlossen ist, sollte der Vorgang angehalten und die Maus ausgetauscht werden.
2. Positionierung der Tiere
- Sobald sich die Maus im Ruhezustand befindet, legen Sie sie mit dem Kopf nach oben auf einen Arbeitstisch und richten Sie den Kopf zum Bediener. Ziehen Sie vorsichtig und ohne Spannung an jedem Bein und sichern Sie sie mit Mikroporenband, um plötzliche unwillkürliche Bewegungen zu verhindern. Decken Sie die Maus mit einer Decke oder Gaze ab, um die Körperwärme zu erhalten.
- Um die Schnauze offen zu halten, legen Sie ein Ende eines kieferorthopädischen Gummibandes um die oberen Schneidezähne und befestigen Sie das andere Ende ohne Spannung an einer oberen Halterung. Legen Sie ein zweites kieferorthopädisches Gummiband um die unteren Schneidezähne und befestigen Sie es mit einem Gummiband an einer untergeordneten Halterung.
- Platzieren Sie die Wangentrenner und bewegen Sie die Zunge vorsichtig zur Seite, um eine bessere Sichtbarkeit zu gewährleisten.
- Positionieren Sie das Mikroskop so, dass eine angemessene Visualisierung der oberen Molaren möglich ist, beginnend mit dem Objektiv mit der niedrigsten Vergrößerung. Sobald Sie es gefunden haben, passen Sie die Vergrößerung an, um optimalen Komfort und Fokus für den Bediener zu gewährleisten.
3. Platzierung der Ligatur
- Sobald das Bild klar ist, identifizieren Sie die drei oberen Molaren: den größten und proximalen Molaren (M1), den nächsten Molaren (M2) und den kleinsten und distalen Molaren (M3). Legen Sie eine Naht aus 6-0 Nylon an, da ihr Durchmesser die Platzierung der Ligatur erleichtert und das Gewebe weniger mechanisch schädigt als breitere Nähte.
- Lokalisieren Sie die distale Seite von M2, halten Sie die Spitze der 6-0-Nylonnaht mit einer Pinzette fest und platzieren Sie die Spitze an der Basis der Papille vom Gaumen aus. Üben Sie leichten Druck durch die Basis des interproximalen Gaumenraums auf die bukkale Oberfläche aus (Abbildung 2A).
- Sobald sich die 6-0-Nylonnaht kreuzt, ziehen Sie sie durch den interproximalen Raum in Richtung der bukkalen Seite (Abbildung 2B).
- Platzieren Sie die Spitze der 6-0 Nylonnaht an der Basis des interproximalen Bereichs an der mesialen Oberfläche von M2 von der bukkalen Seite. Schieben Sie die Spitze der Naht vorsichtig unter den Interproximalraum und führen Sie sie durch den Wangenraum zurück zum Gaumen (Abbildung 2C).
- Ziehen Sie vorsichtig an der Naht 6-0 Nylon, halten Sie die Spitze mit einer Pinzette fest, stellen Sie sie um M2 ein und befestigen Sie die Naht mit drei einfachen Knoten.
- Schneiden Sie die Naht 6-0 Nylon mit einer feinen Schere ab (Abbildung 2D).
4. Bergung der Tiere
- Um die Maus zu lösen, entfernen Sie die Wangentrenner, das Mikroporenband von den Beinen und die kieferorthopädischen Gummibänder. Entfernen Sie zuerst das Gummiband um die unteren Schneidezähne und dann das Gummiband um die oberen Schneidezähne.
- Nehmen Sie die Maus vom Arbeitstisch, wickeln Sie sie in Gaze oder Tuch ein und legen Sie sie mit der Vorderseite nach oben. Halten Sie die Zunge zur Seite, um die Atemwege offen zu halten und eine Verstopfung zu vermeiden.
- Halten Sie das Tier warm, mit einem Tuch oder Gaze bedeckt und unter Beobachtung, bis es vollständig wach ist. Setzen Sie sie dann in ihre normalen Käfige.
- Tragen Sie einen Hypromellose-Tropfen in jedes Auge auf, bis die Maus normal blinzeln kann.
- Halten Sie das Tier unter normalen Bedingungen.
5. Ligatur-Prüfung
- Überprüfen Sie wöchentlich die Dauerhaftigkeit der Nylonligatur (Abbildung 3A,B).
- Nimm die Maus, halte den Kopf und den Körper fest und öffne die Schnauze mit einer Pinzette. Beobachten Sie die 6-0 Nylonnaht um M2 im Licht einer Lampe.
- Etablierung der Entwicklung von Parodontitis auf der Grundlage von Biofilmakkumulation und mechanischer Reizung. Überprüfen Sie dies durch histologische Analysen.
6. Histologie
- Nach 30 Tagen werden die Mäuse in einer CO2 - Kammer eingeschläfert (nach institutionell anerkannten Protokollen). Ernten Sie die Oberkiefer, wie bereits berichtet39. Waschen Sie das entnommene Gewebe in einer 0,9%igen NaCl-Lösung und legen Sie es in neue, markierte Mikrozentrifugenröhrchen.
- Die Proben werden 2 h lang unter Rühren in einer 4%igen Paraformaldehydlösung fixiert.
- Waschen Sie die Proben 2 h lang mit Leitungswasser.
- Um Mineralien aus den Knochen zu entfernen und hochwertige Paraffinschnitte herzustellen, entkalken Sie die Proben in zwanzig Volumina einer 4%igen EDTA-Lösung (pH 7,3) für 20 Tage in Mikrozentrifugenröhrchen, wechseln Sie die EDTA alle 4 Tage40.
- Betten Sie die Proben in Paraffin ein. Schneiden Sie 5-μm-Abschnitte des M2-Bereichs und färben Sie sie mit Hämatoxylin und Eosin (H&E)41.
7. Datenanalyse
- Betrachten Sie die gefärbten histologischen Schnitte unter einem optischen Mikroskop, um eine deskriptive Analyse der Veränderungen in der Konfiguration des Sulkusepithels, der Zahnfleischfasern, der Parodontalfasern, der Höhe und der Integrität des Alveolarkamms durchzuführen.
- Bestimmen Sie den Attachmentverlust (AL), indem Sie den Abstand zwischen dem Zementschmelzübergang (CEJ) und dem höchsten Punkt des Knochenkamms messen. Zeichnen Sie mit einem digitalen Bearbeitungsprogramm eine Linie zwischen diesen beiden Punkten. Führen Sie histometrische Analysen an der bukkalen und palatinalen Oberfläche gemäß der von Semenoff et al.42 beschriebenen Methodik durch (Abbildung 4).
8. Statistische Auswertung
- Analysieren Sie die Daten aus den CTL- und PT-Gruppen mit dem Mann-Whitney U-Test. Betrachten Sie p < 0,05 als statistisch signifikant. Verwenden Sie Statistik- und Grafiksoftware für die Analyse.
Ergebnisse
Diese Methode ermöglicht es induzierten Mäusen, ab der zweiten Woche eine Parodontitis (PT) zu entwickeln. Die Mäuse wurden wöchentlich überwacht, um das Vorhandensein der Ligatur zu überprüfen. Die Euthanasie wurde am 30. Tag durchgeführt. Die klinischen Merkmale aller Gruppen wurden beurteilt. Die Kontrollgruppe behielt im Laufe der Zeit normale Merkmale wie Farbe und Struktur der marginalen Gingiva bei. Im Vergleich zu denen in der CTL-Gruppe zeigten die Gewebe der PT-Gruppe Entzündungen, Blutungen und parodontale Taschenbildung, die bei den induzierten Mäusen am Zahnfleischrand beobachtet wurden (Abbildung 5).
Die Entwicklung der Erkrankung wurde durch eine histologische und histometrische Analyse der AL des parodontalen Gewebes von M2 in beiden Gruppen bestätigt. Die CTL-Gruppe wies histologische Merkmale auf, die denen gesunder Gewebe ähnelten: das Epithel der Marginal- und Sulcusgingiva, die Zahnfleischfasern (Abbildung 6A, CTL blauer Pfeil), das junktionale Epithel und der Alveolarkamm (Abbildung 6A, CTL grüner Pfeil); die Bindegewebsfasern befanden sich in einer normalen Position und Höhe; Die Sharpey-Fasern waren bei ihrer Insertion in den Alveolarknochen und den Wurzelzement intakt; und es wurde eine symmetrische Dicke um die Wurzel herum beobachtet (Abbildung 6A, orangefarbener CTL-Pfeil), insbesondere am Ansatz sowohl in der bukkalen als auch in der palatinischen Ansicht. Die Zellkerne in den Fasern des Parodontalbandes (PDL), des Bindegewebes und der Osteozyten des Alveolarknochens waren deutlich sichtbar (40x). In der PT-Gruppe wiesen die parodontalen Gewebe schwere Schäden auf, mit dem Vorhandensein von Parodontaltaschen, die durch den Verlust des Alveolarkamms (Abbildung 6A, PT, grüner Pfeil), apikale Migration des Epithels und Ablösung von Sharpey-Fasern auf der Oberfläche der Wurzel gekennzeichnet sind (Abbildung 6A, PT, oranger Pfeil). Im Bindegewebe fehlten in der Gingiva und im Knochen der bukkalen und palatinalen Seite Zellkerne (Abbildung 6A, PT, blauer Pfeil), die allesamt charakteristisch für Parodontalerkrankungen sind.
Die histometrische Analyse zeigte, dass für die CTL-Gruppe die Position des Knochenkamms auf beiden Seiten konstant war: bukkal und palatin. Darüber hinaus zeigte die PT-Gruppe im Vergleich zur CTL-Gruppe eine signifikante Zunahme der AL-Tiefe der bukkalen Oberfläche (p = 0,0001, 117,5 nm ± 6 vs. 209,17 nm ± 10) aufgrund von Gewebeverlust. Im Vergleich zu der der CTL-Gruppe war die Gaumenoberfläche der PT-Gruppe signifikant größer (p = 0,03, 175,25 nm ± 8 vs. 254,03 nm ± 50). Obwohl beide Seiten eine Gewebezerstörung aufwiesen, war diese auf der palatinalen Oberfläche deutlicher, mit größerer Tiefe und größerem Attachmentverlust, als auf der bukkalen Oberfläche (Abbildung 6B, C). Diese Ergebnisse stimmen mit unseren zuvor veröffentlichten Ergebnissen überein, die ein ähnliches Verhalten zeigten28.
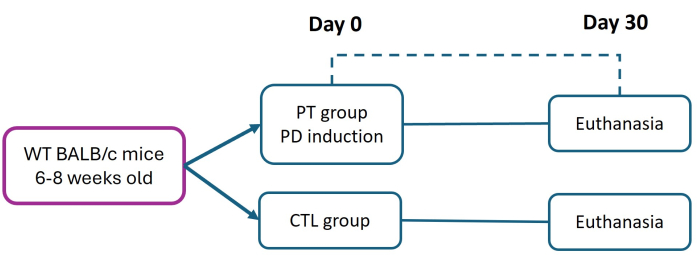
Abbildung 1: Versuchsaufbau. Parodontitis (PT) wurde bei sechs bis acht Wochen alten BALB/c-Mäusen (16 g) unter Verwendung des 6-0-Nylon-Ligaturmodells (Tag 0) induziert. Dreißig Tage nach der Induktion wurden PT und gesunde (CTL) Mäuse zur parodontalen Gewebeuntersuchung euthanasiert. Es wurden drei unabhängige Experimente durchgeführt; die Gesamtzahl der Mäuse sowohl in der CTL- als auch in der PT-Gruppe betrug n = 9. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Schritt-für-Schritt-Verfahren zur Platzierung der Ligatur zur Induktion einer Parodontitis. Repräsentative Bilder der Abfolge der Schritte, die zur Induktion einer Parodontitis im zweiten oberen Molaren der Maus verwendet werden: (A) zeigt, wie die 6-0-Nylonnaht distal von M2 eingeführt wird, vom Gaumen bis zur Bukkale; (B) zeigt, wie unter der Kontaktfläche sanft Druck ausgeübt werden sollte; (C) zeigt, wie die Nylonnaht durch den mesialen Teil von M2 verlaufen sollte, vom Gaumen bis zum Wangen; und (D) zeigt, wie die Nylonnaht um M2 angepasst und mit einem Dreifachknoten befestigt wird, um als Ligatur zu wirken. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
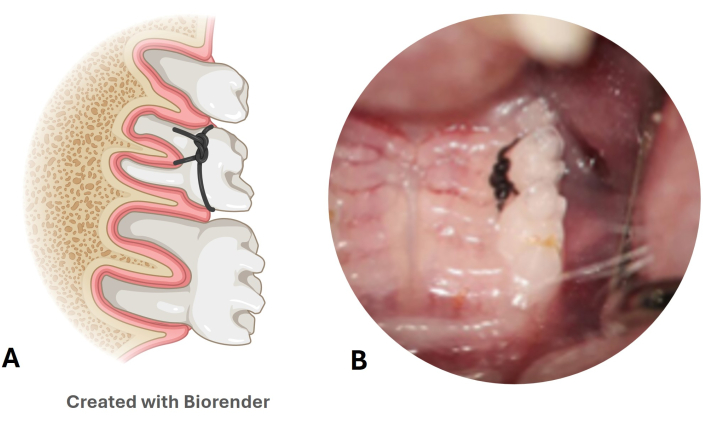
Abbildung 3: Modell der Parodontalerkrankung der Nylon-Ligatur. (A) Illustration der Position der Ligatur im zweiten oberen Molaren. (B) Bild der Nylon-Ligatur, die in einem Mausmodell platziert ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Histometrische Analyse. Der Attachmentverlust (AL) wurde unter Berücksichtigung des Abstands zwischen dem Zementschmelzübergang (CEJ) und dem nächstgelegenen Punkt des Alveolarkamms bestimmt, wobei eine Linie zwischen beiden Punkten auf der bukkalen und palatinalen Oberfläche gezogen wurde. Als Referenz: V(B): bukkal, P palatinal. Vergrößerung: 10x; Maßstabsleiste = 100 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Entwicklung klinischer Symptome einer Parodontitis bei WT-Mäusen. Repräsentatives klinisches Bild von parodontalem Gewebe, CTL-Kontrolle; PT, Parodontalerkrankung Tag 1 nach dem Platzieren der Nylon 6-0-Naht; Tag 30 nach der Nahtentfernung. Es wurden repräsentative Bilder von drei unabhängigen Experimenten durchgeführt; die Gesamtzahl der Mäuse sowohl in der CTL- als auch in der PT-Gruppe betrug n = 9. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Parodontalgewebe zeigten im Nylon-induzierten Modell der Parodontitis einen Attachmentverlust und eine Gewebeschädigung. (A) Repräsentative histologische Bilder mit H&E-Färbung von parodontalem Gewebe, Kontrolle (CTL); Parodontitis (PT), linkes Bild 10x, histometrische Analyse ist dargestellt, mit einer Linie vom Zementoschmelzübergang (CEJ) bis zum Rand des Alveolarkamms, bukkal (B), Gaumen (P), angezeigt in der blauen Box bukkal roter Boxpalatin. Rechte Tafeln bukkal und Gaumen bei enger Vergrößerung bei 40x. Blauer Pfeil, Bindegewebe; orangefarbener Pfeil, Ansatz des parodontalen Bandes in radikulärem Zement; grüner Pfeil, Knochenkamm. Maßstabsbalken = 100 μm. (B, C) Histometrische Analyse des CEJ und des höchsten Punktes des Alveolarkamms. Es wurde ein repräsentatives Bild von drei unabhängigen Experimenten durchgeführt; die Gesamtzahl der Mäuse sowohl in der CTL- als auch in der PT-Gruppe betrug n = 9. Die Daten werden als Mittelwerte ± SEMs ausgedrückt, und Werte von *p < 0,05 und ****p < 0,0001 wurden gemäß dem Mann-Whitney-U-Test als statistisch signifikant angesehen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Material | Induktion | Vorteile | Benachteiligungen |
| Seide | Passieren des Interproximalraums | Hohe bakterielle Adhärenz | Erfordert Geschicklichkeit zum Einfügen |
| Multifilament-Naht | Leicht zerrissen | ||
| Natürlicher Ursprung | Ligaturverlust | ||
| Kieferorthopädischer Draht | Insertion im Interdentalbereich | Einfacher zu platzieren | Vorsichtiges Einführen erforderlich, um Gewebeschäden zu vermeiden |
| Widerstandsfähig | |||
| Nylon | Einschub unter dem Kontaktpunkt | Einfacher zu platzieren | Erfordert Vergrößerung |
| Keine Gewebebeschädigung durch Material | Knoten kann verschoben werden | ||
| Widerstandsfähig und flexibel | |||
| Adhärenz von Parodontalbakterien |
Tabelle 1: Verschiedene Materialien, die zur Induktion von Parodontalerkrankungen durch Ligatur bei Mäusen verwendet werden.
Diskussion
Mehrere Tiermodelle der Parodontitis wurden verwendet, um verschiedene Aspekte, wie z. B. mikrobiologische und Immunreaktionen, zu bewerten, und weisen einige Ähnlichkeiten mit menschlichen Krankheitenauf 43. Diese Ergebnisse liefern Hinweise auf die Rahmenbedingungen von Parodontalerkrankungen, wie z. B. die Rolle von Biofilmen, die Immunantwort und Wechselwirkungen mit systemischen Erkrankungen44,45.
Die Tiermodelle der Parodontitis weisen unterschiedliche Komplexitäten und Ähnlichkeiten auf; Zum Beispiel sind nichtmenschliche Primaten, Hunde oder Miniaturschweine der Parodontitis beim Menschen am ähnlichsten19, obwohl die Kosten und die Erfordernisse für ihre Handhabung und Wartung diese Modelle unpraktisch machen. Darüber hinaus sind Mausmodelle der Parodontitis kostengünstiger und einfacher zu handhaben. Darüber hinaus können Mäuse genetisch verändert werden, um ein bestimmtes Molekül oder eine bestimmte Zelle von Interesse zu erzeugen46, und die Methodik ist gut etabliert47.
Obwohl Mäuse PT nicht von Natur aus entwickeln, kann es durch verschiedene Methoden induziert werden. Das am häufigsten verwendete Modell ist das ligaturinduzierte Modell, das sehr gut reproduzierbar ist22,23, da mehrere Materialien verwendet wurden, wie z. B. kieferorthopädischer Draht, Seide oder Nylon.
Insbesondere kann Nylon eine praktikable Option sein, um PT zu induzieren; Aufgrund einiger seiner Eigenschaften weist es als synthetisches Monofilament eine minimale Gewebereaktion auf und ermöglicht die Adhäsion von Parodontalbakterien wie Fusobacterium nucleatum und Porphyromona intermedia35,36. Dadurch kann die Entzündungsreaktion zu einer "normalen" Bakterienansammlung führen.
Diese Studie schlägt eine Alternative zur Entwicklung von PT durch die Verwendung einer 6-0-Nylonnaht als Induktionsmodell vor, und wir analysierten die klinischen und histologischen Daten von CTL- und PT-Mäusen. Wir identifizierten die Merkmale der in der PT-Gruppe vorhandenen Zahnfleischränder, wie Blutungen, Entzündungen und parodontale Taschenbildung. Diese Beobachtungen wurden durch eine histometrische Analyse bestätigt. Insbesondere war der Grad des PT-Verlusts signifikant unterschiedlich; Obwohl sowohl die bukkale als auch die palatinale Oberfläche eine Gewebezerstörung aufwiesen, war diese auf der palatinalen Oberfläche größer. Das liegt wahrscheinlich daran, dass die Wangenwand bei Mäusen breiter ist als beim Menschen.
Lima et al.31 berichteten, dass Nylon-Ligaturen PT induzierten; Obwohl sie eine 5-0-Naht verwendeten, platzierten sie den Knoten auf der bukkalen Oberfläche und maßen den linearen Knochenverlust 6 Mikro-CT nach 15 Tagen. Während 6-0-Nylonnähte verwendet wurden, wurde der Knoten auf der Gaumenoberfläche platziert und nach 30 Tagen eine histometrische Analyse durchgeführt, um eine schwere PT zu induzieren. Die Ergebnisse zeigten, dass 6-0 Nylonnähte um M2 zu PT führten. Liberman et al. berichteten über keine Unterschiede zwischen den Methoden zur Bewertung des Knochenverlusts48.
Diese Ergebnisse zeigen, dass das vorgeschlagene Modell reproduzierbar ist und mehrere Vorteile hat. Erstens ist es einfacher zu bedienen, da es der Verwendung eines Einfädlers ähnelt. Daher wird die Naht nicht unbedingt in Richtung des Interproximalraums gedrückt, was das Risiko einer Verletzung der Mundhöhle der Maus aufgrund des begrenzten Platzes erhöht. Zweitens ermöglicht dieses Modell die Entwicklung von PT durch die Akkumulation von Biofilmen auf natürliche Weise und induziert chronische Entzündungen im parodontalen Gewebe.
Dieses Modell weist mehrere Einschränkungen auf, darunter die Lernkurve, die Notwendigkeit von Sehhilfen und die Herausforderungen, die mit der Verwendung von Mikroskopen oder Lupen verbunden sind. Darüber hinaus besteht die Möglichkeit, die Knoten und Ligaturen zu verlieren, so dass es unerlässlich ist, die Dauerhaftigkeit der Ligatur zu überprüfen, um das anhaltende Vorhandensein des reizenden Reizes zu gewährleisten.
Zusammenfassend beschreibt dieses Protokoll die Schritte, die erforderlich sind, um ein robustes Modell der fortgeschrittenen PT zu etablieren, das durch eine 6-0-Nylonnaht induziert wird, die die Ligaturplatzierung erleichtert. Es wird auch die Methodik für die Verabreichung von Anästhetika, die Vergrößerung und die Bewertung des Attachmentverlusts beschrieben. Darüber hinaus kann dieses Modell verwendet werden, um wirtsspezifische Mechanismen zu untersuchen, die am entzündlichen Knochenverlust durch PT beteiligt sind, sowie die Rolle von PT bei der Entwicklung von Krankheiten oder Störungen infektiösen, neoplastischen, autoimmunen oder hormonellen Ursprungs. Daher hat die Verwendung dieses Modells zur Untersuchung von PT, die durch Biofilmakkumulation und Entzündung verursacht wird, das Potenzial, grundlegendes Wissen mit therapeutischen Implikationen zu generieren und die Diagnose zu verbessern.
Offenlegungen
Die Autoren erklären, dass es keine Interessenkonflikte bezüglich der Veröffentlichung dieser Arbeit gibt.
Danksagungen
Diese Arbeit wurde teilweise durch den Rat für Wissenschaft und Technologie des Bundesstaates Mexiko (COMECYT) mit der Fördernummer [FICDTEM-2021-072] und dem Förderprogramm für Forschungsprojekte und technologische Innovation (PAPIIT)-UNAM, Fördernummer [IN-217021] finanziert. Wir danken dem Spezialisierungsprogramm in Endoperiodontología, FES Iztacala, UNAM für die zur Verfügung gestellten Einrichtungen für die Erstellung dieses Videos und Rosalba Yañez Ortiz, DDS, für ihre Unterstützung bei der Erstellung dieses Videos. Einige Figuren wurden mit dem Biorender-Programm erstellt (Vertragsnummer ME282NWCI1).
Materialien
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
Referenzen
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten