Method Article
Мышиная модель прогрессирующего периодонтита, индуцированного нейлоновой лигатурой во втором верхнем моляре
В этой статье
Резюме
В этом исследовании описывается модифицированный метод лигирования нейлона 6-0 для индуцирования пародонтита у мышей, который обладает высокой воспроизводимостью и представляет собой альтернативу для исследователей для изучения заболеваний пародонта от их развития до патологических последствий.
Аннотация
Пародонтоз (БП) — это воспалительное заболевание, поражающее поддерживающие ткани зубов и являющееся одним из самых распространенных заболеваний во всем мире. Тяжелая его форма, пародонтит, приводит к разрушению мягких тканей, зубов, кости. Животные модели пародонтита были разработаны с использованием приматов, собак, миниатюрных свиней и мышей. Среди них мышиная модель, индуцированная лигатурой, предлагает такие преимущества, как быстрое прогрессирование заболевания, воспроизводимость, предсказуемость и низкая стоимость при эффективном воспроизведении ключевых аспектов пародонтита человека. Мышиные модели с использованием лигатур позволили получить ценную информацию о микробиологическом и иммунологическом микроокружении тканей пародонта, подчеркнув критическую роль биопленок в иммунных реакциях и их связь с системными заболеваниями. В этом исследовании представлен модифицированный метод лигирования нейлона для индуцирования пародонтита у мышей. Модификация включает в себя использование нейлонового шовного материала вместо шелкового шва и размещение его под межпроксимальной областью контакта, а не через точку контакта. Такой подход упрощает технику и при этом эффективно индуцирует пародонтит. Подробная методология наложения швов графически проиллюстрирована, а прогрессирование пародонтита демонстрируется с помощью гистологического и гистометрического анализов.
Введение
Пародонтоз (БП) — это воспалительное заболевание поддерживающих тканей зубов, которое является одним из самых распространенных заболеваний в мире1; сообщалось, что частота БП колеблется от 20% до 50% во всем мире2. БП имеет разную степень прогрессирования; Его легкая форма, называемая гингивитом, поражает только мягкие ткани, а тяжелая форма, называемая периодонтитом (ПТ), поражает твердые ткани, такие как кость3. Поскольку ПТ является воспалительным заболеванием, его следует рассматривать как комплексный иммунный ответ, который может быть изменен несколькими факторамириска, которые могут изменить процесс заболевания, такими как сахарный диабет5, сердечно-сосудистые заболевания6, гормональные взаимодействия, такие как неблагоприятные исходы беременности7 или преэклампсия8, воспалительные заболевания9 и даже изменения глаз10 или деменция11.
Таким образом, чтобы понять этиологию, связанную с развитием или распространенностью ПТ, протестировать новые или более эффективные терапевтические стратегии или выявить корреляцию между системными заболеваниями и ПТ или микробиотой пародонта, необходимы животные модели12.
Выбор эффективного метода исследования имеет решающее значение для понимания развития ФТ и адекватного ответа на исследовательские вопросы13. На протяжении многих лет для изучения ПТ были разработаны различные животные модели; Тем не менее, такие модели, как приматы, собаки, кролики и миниатюрные свиньи, дороги и сложны в использовании 14,15,16. Мышиные модели ПТ, в частности модель ПТ, индуцированная лигированием, имеют множество преимуществ, включая быструю разработку, воспроизводимость, предсказуемость инизкую стоимость.
Несмотря на то, что для индукции ПТ используются несколько методов, таких как пероральная бактериальная инокуляция, инъекция липополисахаридов и индукция лигатуры10,20, каждый из них имеет свои преимущества и недостатки17, мышиная модель ПТ, индуцированная нейлоновой лигатурой, напоминает человеческий механизм ее развития 20,21,22,23. ПТ происходит за счет удержания резидентной микробиоты, вызывая воспаление и приводя к потере тканей. Кроме того, мыши могут быть генетически модифицированы для изучения различных клеточных популяций или молекул, представляющих интерес для изучения ПТ.
Лигирование зубов может проводиться с использованием различных материалов, таких как ортодонтическая проволока, шелковые шовные нити24,25 или нейлоновые шовные нити26. Наиболее распространенным материалом для индуцирования ПТ путем лигирования у мышей является шелк; Эта методология была объяснена различными авторами, такими как Marchesan et al.18, Abe et al.27 и Chadwick et al.22, каждый со своими собственными модификациями, и все эти методы были успешно использованы несколькими исследователями28. Тем не менее, наложение шелкового шва вокруг верхних коренных зубов у мышей может быть сложным. Marchesan et al. предложили использовать «лигатурный держатель»; Abe et al. и Chadwick et al. поместили шов через точку контакта, хотя Chadwick et al. поместили его вокруг коренных зубов M1 и M2.
Нейлоновые шовные материалы разной толщины использовались для разработки PT на различных моделях животных 29,30,31. Lima et al.31 использовали нейлоновые шовные материалы 5-0; В предыдущих исследованиях мы использовали нейлоновые шовные материалы 6-0 с аналогичными результатами28.
По сравнению с мультифиламентными шовными нитями, нейлоновые шовные нити являются нерезорбируемыми монофиламентными синтетическими и демонстрируют более низкую воспалительную реакцию тканей32; кроме того, нейлоновые шовные материалы также допускают накопление микробов33,34, и имеются данные о адгезии Fusobacterium nucleatum и Porphyromona intermedia35,36, наряду с факультативными анаэробными бактериями в нейлоновых шовных материалах 12,14,17,19,24,27,35,37 (Таблица 1).
Эти характеристики могут позволить воспалительной реакции быть сфокусированной в основном на накоплении бактерий, а не на накоплении материалов. Кроме того, нейлон обладает лучшими механическими свойствами, такими как прочность на разрыв, чем шелк38.
Таким образом, в настоящем исследовании нейлоновый шов 6-0, размещенный вокруг M2 под межпроксимальной контактной зоной, индуцировал развитие периодонтита на поздней стадии у мышей. Такой подход позволяет применять лигатуру с помощью обычного пинцета, и результаты получаются стабильными. Через 30 дней развитие ПВ может быть подтверждено с помощью гистометрического и гистологического анализа.
протокол
Все процедуры с участием подопытных животных проводились в строгом соответствии с «Этическими рамками биомедицинских исследований на лабораторных животных» в соответствии с официальным мексиканским стандартом NOM-062-ZOO-1999. Это исследование было одобрено комитетом по этике Facultad de Estudios Superiores Iztacala (FES-Iztacala) в соответствии с протоколом CE/FESI/072024/1765. Мыши были размещены в камерах для животных со свободным доступом к пище и воде в свободной от патогенов среде в животноводческом центре FES-Iztacala. Этот протокол является модификацией метода, ранее описанного Abe et al.27. Самки мышей BALB/c в возрасте от 6 до 8 недель (массой 16 г) были разделены на контрольную (CTL) и периодонтитную (PT) группы. Пародонтит был вызван наложением нейлонового шва 6-0 на 0-й день, чтобы способствовать устойчивой бактериальной адгезии и вызвать тяжелое прогрессирование хронического заболевания. Через 30 дней всех мышей усыпляли (в соответствии с утвержденными в учреждении протоколами) для оценки повреждения тканей и потери прикрепления (AL) с помощью гистометрического анализа (рис. 1). Подробная информация об используемых реагентах и оборудовании приведена в Таблице материалов.
1. Подготовка к анестезии
- Готовят разведение ксилазина и кетамина (1:10) с инъекционной водой (запас). Хранить при температуре 4 °C и использовать в течение 4 недель.
- Определите и взвесьте каждую мышь. Приготовьте весовую дозу ксилазина (1 мг/кг) и кетамина (2 мг/кг) для внутримышечного введения с помощью инсулинового шприца.
- Введите 50% от общей дозы раствора анестетика в заднюю четвертину. Повторите процедуру с обратной стороны.
- Поместите мышей в глубокую коробку (10 см³) и дайте им заснуть, что займет примерно 3-5 минут.
- Предотвратите сухость глаз и повреждение роговицы из-за анестезии, нанося капли гипромеллозы на каждый глаз каждые 15 минут, пока мыши полностью не проснутся и не смогут нормально моргать.
ПРИМЕЧАНИЕ: Мыши должны находиться под наблюдением в течение 45 минут, приблизительной продолжительности анестезии. Если мышь просыпается до завершения процедуры, процедуру следует приостановить, а мышь следует заменить.
2. Позиционирование животного
- Когда мышь заснет, положите ее на рабочий стол лицевой стороной вверх головой к оператору. Аккуратно потяните каждую ногу без напряжения и закрепите их микропористой лентой, чтобы предотвратить резкие непроизвольные движения. Накройте мышь одеялом или марлей, чтобы сохранить тепло тела.
- Чтобы морда оставалась открытой, поместите один конец ортодонтической резинки вокруг верхних резцов, а другой конец закрепите на верхнем держателе без натяжения. Поместите вторую ортодонтическую резинку вокруг нижних резцов и закрепите ее на нижнем держателе с помощью резиновой ленты.
- Поместите разделители щек и осторожно сдвиньте язычок в сторону для лучшей видимости.
- Расположите микроскоп так, чтобы обеспечить адекватную визуализацию верхних моляров, начиная с объектива наименьшего увеличения. После этого отрегулируйте увеличение, чтобы обеспечить оптимальный комфорт и концентрацию внимания оператора.
3. Наложение лигатуры
- После того, как изображение станет четким, определите три верхних моляра: самый большой и проксимальный моляр (M1), следующий моляр (M2) и самый маленький и дистальный моляр (M3). Наложите нейлоновый шов 6-0, так как его диаметр облегчает наложение лигатуры и вызывает меньше механических повреждений тканей, чем более широкие швы.
- Найдите дистальную сторону M2, возьмитесь пинцетом за кончик нейлонового шовного материала 6-0 и поместите кончик у основания сосочка от нёба. Надавите светом через основание межпроксимального небного пространства по направлению к щечной поверхности (Рисунок 2A).
- Как только нейлоновый шов 6-0 пересечет, протяните его через межпроксимальное пространство к щечной стороне (Рисунок 2B).
- Поместите кончик нейлонового шовного материала 6-0 у основания межпроксимальной области на мезиальной поверхности M2 со стороны щеки. Осторожно надавите на кончик шва, чтобы пересечь его под межпроксимальным пространством, и проведите его через щечное пространство обратно к нёбу (рис. 2C).
- Осторожно натяните нейлоновый шов 6-0, удерживайте кончик пинцетом, отрегулируйте его вокруг M2 и закрепите шов тремя простыми узлами.
- Разрежьте нейлоновый шов 6-0 тонкими ножницами (Рисунок 2D).
4. Восстановление животных
- Чтобы освободить мышь, снимите с ног разделители щек, микропористую ленту и ортодонтические резинки. Сначала снимите резинку вокруг нижних резцов, затем снимите резинку вокруг верхних резцов.
- Снимите мышь с рабочего стола, заверните ее в марлю или ткань и положите лицевой стороной вверх. Держите язык в стороне, чтобы дыхательные пути оставались открытыми и предотвращали закупорку.
- Держите животное в тепле, накрыв тканью или марлей, и под наблюдением до полного пробуждения. Затем поместите их в обычные клетки.
- Нанесите каплю гипромеллозы на каждый глаз, пока мышь не сможет нормально моргать.
- Содержать животное следует в стандартных условиях.
5. Проверка лигатуры
- Проверяйте стойкость нейлоновой лигатуры каждую неделю (Рисунок 3A, B).
- Возьмите мышь, крепко держите голову и тело и с помощью пинцета откройте морду. Обратите внимание на нейлоновый шов 6-0 вокруг M2 при свете лампы.
- Устанавливают развитие пародонтоза на основе накопления биопленки и механического раздражения. Убедитесь в этом с помощью гистологического анализа.
6. Гистология
- Через 30 дней усыпьте мышей в камере сCO2 (в соответствии с утвержденными в учреждении протоколами). Соберите верхние челюсти, как сообщалось ранее39. Заготовленные ткани промойте в 0,9% растворе NaCl и поместите их в новые, маркированные микроцентрифужные пробирки.
- Зафиксируйте образцы в 4% растворе параформальдегида на 2 ч при перемешивании.
- Промойте образцы водопроводной водой в течение 2 часов.
- Для удаления минералов из кости и приготовления высококачественных парафиновых срезов декальцинируйте образцы в двадцати объемах 4% раствора ЭДТА (pH 7,3) в течение 20 дней в микроцентрифужных пробирках, меняйте ЭДТА каждые 4 дня40.
- Заделайте образцы в парафин. Разрежьте участки размером 5 мкм в области М2 и окрасьте их гематоксилином и эозином (H&E)41.
7. Анализ данных
- Рассмотрите окрашенные гистологические срезы под оптическим микроскопом для проведения описательного анализа изменений конфигурации эпителия борозды, десневых волокон, периодонтальных волокон, высоты и целостности альвеолярного гребня.
- Определите потерю прикрепления (AL), измерив расстояние между цементоэмалевым соединением (CEJ) и самой высокой точкой костного гребня. Проведите линию между этими двумя точками с помощью программы цифрового редактирования. Выполните гистометрический анализ щечной и нёбной поверхностей по методике, описанной Semenoff et al.42 (рис. 4).
8. Статистический анализ
- Проанализируйте данные, полученные из групп CTL и PT, с помощью U-критерия Манна-Уитни. Рассмотрим p < 0,05 как статистически значимый. Используйте программное обеспечение для статистики и построения графиков для анализа.
Результаты
Эта методология позволяет индуцированным мышам развивать пародонтит (ПТ) со второй недели. За мышами наблюдали еженедельно для проверки наличия лигатуры. Эвтаназия была проведена на 30-й день. Оценивались клинические характеристики всех групп. Контрольная группа сохраняла нормальные характеристики, такие как цвет и структура краевой десны, с течением времени. По сравнению с тканями в группе CTL, в тканях группы ПТ наблюдалось воспаление, кровотечение и образование пародонтальных карманов, которые наблюдались на десневом крае у индуцированных мышей (рис. 5).
Развитие заболевания было подтверждено проведением гистологического и гистометрического анализа AL пародонтальной ткани М2 в обеих группах. В группе CTL были представлены гистологические характеристики, сходные с таковыми у здоровых тканей: эпителий краевой и борозды десны, волокна десны (рис. 6A, синяя стрелка CTL), соединительный эпителий и альвеолярный гребень (рис. 6A, зеленая стрелка CTL); волокна соединительной ткани находились в нормальном положении и высоте; Волокна Шарпи были неповрежденными при их введении в альвеолярную кость и цемент корня; и наблюдалась симметричная толщина вокруг корня (рис. 6A, оранжевая стрелка CTL), особенно в месте крепления как на буккальном, так и на нёбном видах. Ядра клеток в волокнах периодонтальной связки (PDL), соединительной ткани и остеоцитах альвеолярной кости были хорошо видны (40x). В группе ПТ ткани пародонта имели тяжелые повреждения, с наличием пародонтальных карманов, характеризующиеся потерей альвеолярного гребня (рис. 6А, ПТ, зеленая стрелка), апикальной миграцией эпителия и отслоением волокон Шарпея на поверхности корня (рис. 6А, ПТ, оранжевая стрелка). В соединительной ткани, десне и кости щечной и нёбной сторон отсутствовали клеточные ядра (рис. 6A, PT, синяя стрелка), все из которых характерны для пародонтоза.
Гистометрический анализ показал, что в группе CTL положение костного гребня было постоянным с обеих сторон: щечной и нёбной. Более того, по сравнению с группой CTL, в группе ПТ наблюдалось достоверное увеличение глубины AL щечной поверхности (p = 0,0001, 117,5 нм ± 6 против 209,17 нм ± 10) из-за потери тканей. По сравнению с группой CTL, площадь небной поверхности группы PT была достоверно больше (p = 0,03, 175,25 нм ± 8 против 254,03 нм ± 50). Несмотря на то, что с обеих сторон наблюдалось разрушение тканей, оно было более заметным на нёбной поверхности, с большей глубиной и большей потерей прикрепления, чем на щечной поверхности (рис. 6B, C). Эти результаты согласуются с нашими ранее опубликованными результатами, которые показали аналогичное поведение28.
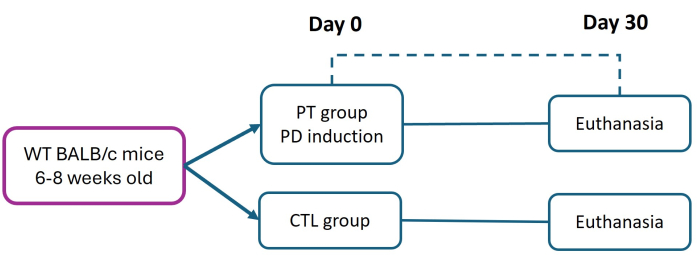
Рисунок 1: Экспериментальный дизайн. Пародонтит (ПТ) индуцировали у шести-восьминедельных мышей BALB/c (16 г) с использованием модели нейлоновой лигатуры 6-0 (день 0). Через тридцать дней после индукции мышей PT и здоровых (CTL) мышей усыпляли для оценки тканей пародонта. Были проведены три независимых эксперимента; общее количество мышей в группах CTL и PT составило n = 9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 2: Пошаговая процедура установки лигатуры для индукции пародонтита. Репрезентативные изображения последовательности шагов, используемых для индуцирования пародонтита во втором верхнем моляре мыши: (A) показано, как нейлоновый шов 6-0 вводится дистальнее M2, от нёбного к щечному; (В) показывает, как следует аккуратно прикладывать давление под зоной контакта; (C) показывает, как нейлоновый шов должен проходить через мезиальную часть M2, от нёбной до щечной; и (D) показано, как нейлоновый шов регулируется вокруг M2 и закрепляется тройным узлом, действуя как лигатура. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
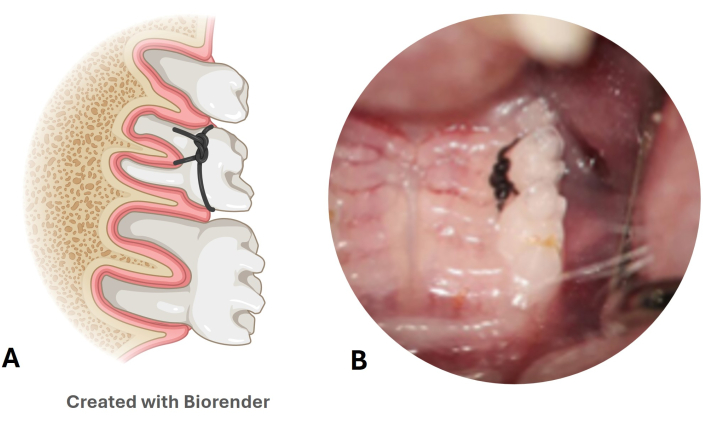
Рисунок 3: Модель заболевания пародонта с нейлоновой лигатурой. (A) Иллюстрация положения лигатуры во втором верхнем моляре. (B) Изображение нейлоновой лигатуры, помещенной в модель мыши. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 4: Гистометрический анализ. Потерю прикрепления (AL) определяли с учетом расстояния между цементоэмалевым соединением (CEJ) и ближайшей точкой альвеолярного гребня, проводя линию между обеими точками на щечной и небной поверхностях. Справочно: V(B): щечный, P нёбный. Увеличение: 10x; масштабная линейка = 100 μм. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 5: Развитие клинических признаков пародонтита у мышей WT. Репрезентативная клиническая картина тканей пародонта, контроль CTL; ПТ, пародонтоз на 1-й день после наложения нейлонового шва 6-0; 30 день после снятия швов. Были получены репрезентативные изображения трех независимых экспериментов; общее количество мышей в группах CTL и PT составило n = 9. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.

Рисунок 6: Ткани пародонта показали потерю прикрепления и повреждение тканей в нейлоновой модели пародонтита. (A) Репрезентативные гистологические изображения с H&E-окрашиванием тканей пародонта, контроль (CTL); периодонтит (ПТ), левая панель 10х, показан гистометрический анализ, с линией от цементоэмального соединения (CEJ) до края альвеолярного гребня, щечной (B), нёбной (P), обозначенной в синей коробке щечной красной коробкой нёбной. Правые панели щечные и палатинские при близком увеличении в 40x. Синяя стрелка, соединительная ткань; оранжевая стрелка, введение периодонтальной связки в корешковом цементе; зеленая стрелка, костяной гребень. Масштабные линейки = 100 мкм. (B, C) Гистометрический анализ CEJ и самой высокой точки альвеолярного гребня. Было выполнено репрезентативное изображение трех независимых экспериментов; общее количество мышей в группах CTL и PT составило n = 9. Данные выражены в виде средних ± SEM, а значения *p < 0,05 и ****p < 0,0001 были признаны статистически значимыми по U-критерию Манна-Уитни. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Материал | Индукция | Преимущества | Недостатки |
| Шёлк | Прохождение через межпроксимальное пространство | Высокая адгезия бактерий | Требует навыка для вставки |
| Мультифиламентный шов | Легко рвется | ||
| Природное происхождение | Потеря лигатуры | ||
| Ортодонтический провод | Установка в межзубную область | Проще в размещении | Необходимо осторожное введение, чтобы избежать повреждения тканей |
| Стойкий | |||
| Нейлон | Вставка под точку контакта | Проще в размещении | Требуется увеличение |
| Отсутствие повреждения тканей материалом | Узел можно смещать | ||
| Прочный и гибкий | |||
| Присоединение пародонтоза к бактериям |
Таблица 1: Различные материалы, используемые для индукции пародонтоза с помощью лигатуры у мышей.
Обсуждение
Несколько животных моделей пародонтита были использованы для оценки различных аспектов, таких как микробиологические и иммунные реакции, и имеют некоторое сходствос болезнью человека. Эти результаты свидетельствуют о структуре заболеваний пародонта, таких как роль биопленок, иммунный ответ и взаимодействие с системными заболеваниями44,45.
Животные модели пародонтита имеют различную сложность и сходство; Например, нечеловекообразные приматы, собаки или миниатюрные свиньи наиболее похожи на пародонтозчеловека, хотя затраты и требования для их обращения и обслуживания делают эти модели непрактичными. Кроме того, мышиные модели пародонтита дешевле и проще в обращении. Более того, мышей можно генетически модифицировать для получения конкретной молекулы или клетки, представляющей интерес46, и методология этого метода хорошоизвестна47.
Хотя у мышей ПТ не развивается естественным образом, она может быть вызвана различными методологиями; Наиболее часто используемой моделью является лигатурно-индуцированная модель, которая обладает высокой воспроизводимостью22,23, поскольку было использовано несколько материалов, таких как ортодонтическая проволока, шелк или нейлон, среди прочих.
В частности, нейлон может быть жизнеспособным вариантом для индуцирования PT; Благодаря некоторым своим характеристикам, как синтетическая мононить, он имеет минимальный тканевый ответ и обеспечивает адгезию пародонтальных бактерий, таких как Fusobacterium nucleatum и Porphyromona intermedia35,36. Это позволяет воспалительной реакции привести к «нормальному» накоплению бактерий.
В этом исследовании предлагается альтернатива развитию ПТ с использованием нейлонового шовного материала 6-0 в качестве индукционной модели, и мы проанализировали клинические и гистологические данные мышей CTL и PT. Мы идентифицировали характеристики десневых краев, присутствующих в группе ПТ, такие как кровотечение, воспаление и образование пародонтальных карманов. Эти наблюдения были подтверждены с помощью гистометрического анализа. В частности, степень потери ПТ существенно отличалась; Хотя как на щечной, так и на нёбной поверхности наблюдалось разрушение тканей, на нёбной поверхности оно было более значительным. Вероятно, это связано с тем, что щечная стенка у мышей шире, чем у людей.
Lima et al.31 сообщили, что нейлоновые лигатуры индуцируют ПТ; Несмотря на то, что они использовали шов 5-0, они поместили узел на поверхность щек и измерили линейную потерю костной ткани на 6 микро-КТ через 15 дней. В то время как использовались нейлоновые швы 6-0, узел помещали на небную поверхность, а через 30 дней проводили гистометрический анализ, чтобы вызвать тяжелую ПТ. Результаты показали, что 6-0 нейлоновых швов вокруг M2 привели к PT. Liberman et al. сообщили об отсутствии различий между методами, используемыми для оценки потери костной массы48.
Эти результаты показывают, что предложенная модель воспроизводима и имеет ряд преимуществ. Во-первых, он проще в использовании, потому что похож на использование нитевдевателя; Таким образом, он не обязательно проталкивает шов в сторону межпроксимального пространства, увеличивая риск травмирования ротовой полости мыши из-за ограниченного пространства. Во-вторых, эта модель позволяет развивать ПТ за счет накопления биопленок естественным путем и индуцирует хроническое воспаление в тканях пародонта.
Эта модель имеет несколько ограничений, в том числе кривую обучения, необходимость в визуальных средствах и проблемы, связанные с использованием микроскопов или увеличительных стекол. Кроме того, существует возможность потери узлов и лигатур, что делает необходимым проверку постоянства лигатуры, чтобы обеспечить постоянное присутствие раздражающего стимула.
В целом, этот протокол описывает шаги, необходимые для создания надежной модели продвинутой ПТ, индуцированной нейлоновым швом 6-0, которая облегчает установку лигатуры. В нем также подробно описана методология введения анестезии, увеличения и оценки потери прикрепления. Кроме того, эта модель может быть использована для исследования специфичных для хозяина механизмов, участвующих в воспалительной потере костной массы из-за ПТ, а также роли ПТ в развитии заболеваний или расстройств инфекционного, опухолевого, аутоиммунного или гормонального происхождения. Таким образом, использование этой модели для изучения ПТ, вызванной накоплением биопленки и воспалением, может привести к получению фундаментальных знаний с терапевтическими последствиями и улучшению диагностики.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов в связи с публикацией данной статьи.
Благодарности
Эта работа частично финансировалась за счет гранта Совета по науке и технологиям штата Мехико (COMECYT) номер гранта [FICDTEM-2021-072] и Программы поддержки исследовательских проектов и технологических инноваций (PAPIIT)-UNAM, номер гранта [IN-217021]. Мы выражаем признательность программе специализации в области эндопериодонтологии, FES Iztacala, UNAM за предоставленные возможности для создания этого видео, а также Розальбе Яньес Ортис, DDS, за ее поддержку в создании этого видео. Некоторые фигурки были созданы с помощью программы Biorender (Договор No ME282NWCI1).
Материалы
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
Ссылки
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены