Method Article
Modelo murino de periodontitis avanzada inducida por ligadura de nylon en el segundo molar superior
En este artículo
Resumen
Este estudio describe un método modificado de ligadura de nylon 6-0 para inducir periodontitis en ratones, que es altamente reproducible y representa una alternativa para que los investigadores estudien la enfermedad periodontal desde su desarrollo hasta sus consecuencias patológicas.
Resumen
La enfermedad periodontal (EP) es un trastorno inflamatorio que afecta a los tejidos de soporte de los dientes y es una de las enfermedades más prevalentes a nivel mundial. Su forma grave, la periodontitis, conduce a la destrucción de los tejidos blandos, los dientes y los huesos. Se han desarrollado modelos animales de periodontitis utilizando primates, perros, cerdos miniatura y ratones. Entre estos, el modelo de ratón inducido por ligadura ofrece ventajas como la rápida progresión de la enfermedad, la reproducibilidad, la previsibilidad y el bajo costo, al tiempo que replica de manera efectiva aspectos clave de la periodontitis humana. Los modelos de ratón que utilizan ligaduras han proporcionado información valiosa sobre los microentornos microbiológicos e inmunológicos del tejido periodontal, destacando el papel crítico de las biopelículas en las respuestas inmunitarias y su asociación con enfermedades sistémicas. Este estudio presenta un método modificado de ligadura de nylon para inducir periodontitis en ratones. La modificación implica el uso de una sutura de nailon en lugar de una sutura de seda y colocarla debajo del área de contacto interproximal en lugar de pasarla a través del punto de contacto. Este enfoque simplifica la técnica a la vez que induce eficazmente la periodontitis. La metodología detallada para la colocación de suturas se ilustra gráficamente, y la progresión de la periodontitis se demuestra a través de análisis histológicos e histométricos.
Introducción
La enfermedad periodontal (EP) es un trastorno inflamatorio de los tejidos de soporte de los dientes y se encuentra entre las enfermedades más prevalentes en el mundo1; se ha descrito que la incidencia de EP oscila entre el 20% y el 50% en todo el mundo2. La EP tiene diferentes grados de progresión; su forma leve, llamada gingivitis, afecta solo a los tejidos blandos, y su forma grave, llamada periodontitis (TP), afecta a los tejidos duros como el hueso3. Dado que la TP es una enfermedad inflamatoria, debe considerarse como una respuesta inmune compleja que puede ser modificada por varios factores de riesgo que pueden alterar el proceso de la enfermedad4, como la diabetes mellitus5, las enfermedades cardiovasculares6, las interacciones hormonales como los resultados adversos del embarazo7 o la preeclampsia8, las enfermedades inflamatorias9, e incluso las alteraciones oculares10 o la demencia11.
Por lo tanto, para comprender la etiología asociada al desarrollo o prevalencia de TP, para probar estrategias terapéuticas nuevas o más efectivas, o para identificar cualquier correlación entre las enfermedades sistémicas y el TP o la microbiota periodontal, se necesitan modelos animales12.
La elección de un método de investigación eficaz es crucial para comprender el desarrollo de la TP y responder adecuadamente a las preguntas de investigación13. A lo largo de los años, se han desarrollado diferentes modelos animales para el estudio de la TP; Sin embargo, modelos como primates, perros, conejos y cerdos miniatura son caros y complejos de usar 14,15,16. Los modelos murinos de TP, en particular el modelo de TP inducida por ligadura, tienen numerosas ventajas, entre ellas el rápido desarrollo, la reproducibilidad, la previsibilidad y el bajo costo 17,18,19.
A pesar de que se utilizan varios métodos para inducir TP, como la inoculación bacteriana oral, la inyección de lipopolisacáridos y la inducción de ligadura10,20, cada uno tiene ventajas y desventajas17, el modelo murino de TP inducido por ligadura de nylon se asemejó al mecanismo humano para su desarrollo 20,21,22,23. La TP se produce a través de la retención de la microbiota residente, causando inflamación y conduciendo a la pérdida de tejido. Además, los ratones pueden ser modificados genéticamente para estudiar diferentes poblaciones celulares o moléculas de interés para el estudio del TP.
La ligadura dental se puede realizar utilizando diferentes materiales, como alambres de ortodoncia, suturas de seda24,25 o suturas de nylon26. El material más común para inducir TP por ligadura en ratones es la seda; esta metodología ha sido explicada por diferentes autores, como Marchesan et al.18, Abe et al.27 y Chadwick et al.22, cada uno con sus propias modificaciones, y todos estos métodos han sido utilizados con éxito por varios investigadores28. Sin embargo, colocar una sutura de seda alrededor de los molares superiores en ratones puede ser complejo. Marchesan et al. sugirieron el uso de un "soporte de ligadura"; Abe et al. y Chadwick et al. colocaron la sutura a través del punto de contacto, aunque Chadwick et al. la colocaron alrededor de los molares M1 y M2.
Se han utilizado suturas de nylon de diferentes espesores para el desarrollo de TP en diferentes modelos animales 29,30,31. Lima et al.31 utilizaron suturas de nylon 5-0; En estudios previos, utilizamos suturas de nylon 6-0 con resultados similares28.
En comparación con las suturas multifilamento, las suturas de nailon son sintéticas monofilamento no reabsorbible y exhiben una menor respuesta tisular inflamatoria32; además, las suturas de nylon también permiten la acumulación microbiana33,34, y hay evidencias de la adhesión de Fusobacterium nucleatum y Porphyromona intermedia35,36, junto con bacterias anaerobias facultativas en las suturas de nylon 12,14,17,19,24,27,35,37 (Tabla 1).
Estas características pueden permitir que la respuesta inflamatoria se centre principalmente en la acumulación bacteriana más que en la acumulación de material. Además, el nailon tiene mejores propiedades mecánicas, como la resistencia a la tracción, que la seda38.
Por lo tanto, en el presente estudio, la sutura de nylon 6-0 colocada alrededor de M2 bajo el área de contacto interproximal indujo el desarrollo de periodontitis en etapa avanzada en el ratón. Este enfoque permite la colocación de ligaduras con pinzas normales y los resultados son consistentes. Después de 30 días, el desarrollo de TP puede confirmarse mediante análisis histométrico e histológico.
Protocolo
Todos los procedimientos con animales de experimentación se llevaron a cabo en estricto cumplimiento del "Marco Ético para la Investigación Biomédica en Animales de Laboratorio", siguiendo la norma oficial mexicana NOM-062-ZOO-1999. Este estudio fue aprobado por el comité de ética de la Facultad de Estudios Superiores Iztacala (FES-Iztacala) bajo el protocolo CE/FESI/072024/1765. Los ratones fueron alojados en cámaras de animales con libre acceso a comida y agua en un ambiente libre de patógenos en el animalario FES-Iztacala. Este protocolo es una modificación del método previamente descrito por Abe et al.27. Las hembras de ratón BALB/c de seis a ocho semanas de edad (con un peso de 16 g) se dividieron en grupos de control (CTL) y periodontitis (PT). La periodontitis se indujo colocando una sutura de nailon 6-0 en el día 0 para promover la adhesión bacteriana sostenida y desencadenar la progresión grave y crónica de la enfermedad. Después de 30 días, todos los ratones fueron sacrificados (siguiendo protocolos aprobados institucionalmente) para evaluar el daño tisular y la pérdida de inserción (AL) a través de un análisis histométrico (Figura 1). Los detalles de los reactivos y el equipo utilizado se enumeran en la Tabla de Materiales.
1. Preparación de la anestesia
- Prepare una dilución de xilacina y ketamina (1:10) con agua inyectable (caldo). Conservar a 4 °C y utilizar durante 4 semanas.
- Identifique y pese cada ratón. Prepare una dosis de xilacina (1 mg/kg) y ketamina (2 mg/kg) basada en el peso para su aplicación intramuscular utilizando una jeringa de insulina.
- Inyectar el 50% de la dosis total de la solución anestésica en el cuarto trasero. Repita el procedimiento en el lado opuesto.
- Coloque los ratones en una caja profunda (10 cm³) y deje que se duerman, lo que lleva aproximadamente de 3 a 5 minutos.
- Evite la sequedad ocular y el daño de la córnea debido a la anestesia aplicando una gota de hipromelosa en cada ojo cada 15 minutos hasta que los ratones estén completamente despiertos y puedan parpadear normalmente.
NOTA: Los ratones deben mantenerse en observación durante 45 min, la duración aproximada de la anestesia. Si un mouse se despierta antes de que se complete el procedimiento, se debe suspender el procedimiento y se debe reemplazar el mouse.
2. Posicionamiento de los animales
- Una vez que el mouse esté dormido, colóquelo en una mesa de trabajo boca arriba con la cabeza hacia el operador. Tire suavemente de cada pierna sin tensión y asegúrelas con cinta adhesiva de microporos para evitar movimientos bruscos e involuntarios. Cubra el ratón con una manta o gasa para mantener el calor corporal.
- Para mantener el hocico abierto, coloque un extremo de un elástico ortodóntico alrededor de los incisivos superiores y asegure el otro extremo a un soporte superior sin tensión. Coloque un segundo elástico ortodóntico alrededor de los incisivos inferiores y asegúrelo a un soporte inferior con una banda elástica.
- Coloque los separadores de mejillas y mueva con cuidado la lengua hacia un lado para una mejor visibilidad.
- Coloque el microscopio de manera que permita una visualización adecuada de los molares superiores, comenzando con el objetivo de aumento más bajo. Una vez ubicado, ajuste el aumento para garantizar una comodidad y concentración óptimas para el operador.
3. Colocación de la ligadura
- Una vez que la imagen esté clara, identifique los tres molares superiores: el molar más grande y proximal (M1), el molar siguiente (M2) y el molar más pequeño y distal (M3). Colocar una sutura de nylon 6-0, ya que su diámetro facilita la colocación de la ligadura y causa menos daño mecánico a los tejidos que las suturas más anchas.
- Localice el lado distal de M2, sujete la punta de la sutura de nylon 6-0 con pinzas y coloque la punta en la base de la papila desde el palatino. Aplique una ligera presión a través de la base del espacio palatino interproximal hacia la superficie bucal (Figura 2A).
- Una vez que la sutura de nylon 6-0 se cruza, tire de ella a través del espacio interproximal hacia el lado bucal (Figura 2B).
- Colocar la punta de la sutura de nylon 6-0 en la base de la zona interproximal en la superficie mesial de M2 desde el lado bucal. Empuje suavemente la punta de la sutura para cruzarla por debajo del espacio interproximal y pasarla a través del espacio bucal de vuelta al palatino (Figura 2C).
- Tire suavemente de la sutura de nailon 6-0, sujete la punta con pinzas, ajústela alrededor de M2 y asegure la sutura con tres nudos simples.
- Corte la sutura de nylon 6-0 con unas tijeras finas (Figura 2D).
4. Recuperación de animales
- Para soltar el ratón, retire los separadores de mejillas, la cinta de microporos de las piernas y los elásticos ortodónticos. Primero, retire el elástico alrededor de los incisivos inferiores, luego retire el elástico alrededor de los incisivos superiores.
- Retire el mouse de la mesa de trabajo, envuélvalo en una gasa o tela y colóquelo boca arriba. Mantenga la lengua hacia un lado para mantener las vías respiratorias abiertas y evitar la obstrucción.
- Mantenga al animal caliente, cubierto con un paño o gasa, y bajo observación hasta que esté completamente despierto. Luego, colócalos en sus jaulas regulares.
- Aplique una gota de hipromelosa en cada ojo hasta que el ratón pueda parpadear normalmente.
- Mantener al animal en condiciones estándar.
5. Comprobación de la ligadura
- Verifique la permanencia de la ligadura de nylon cada semana (Figura 3A,B).
- Tome el ratón, sostenga la cabeza y el cuerpo firmemente y use pinzas para abrir el hocico. Observe la sutura de nailon 6-0 alrededor de M2 bajo la luz de una lámpara.
- Establecer el desarrollo de la enfermedad periodontal basada en la acumulación de biofilm y la irritación mecánica. Compruébelo a través de un análisis histológico.
6. Histología
- Después de 30 días, eutanasiar a los ratones en una cámara de CO2 (siguiendo los protocolos aprobados institucionalmente). Coseche los maxilares como se informó anteriormente39. Lave los tejidos recolectados en una solución de NaCl al 0,9% y colóquelos en tubos de microcentrífuga nuevos etiquetados.
- Fijar las muestras en una solución de paraformaldehído al 4% durante 2 h con agitación.
- Lavar las muestras con agua del grifo durante 2 h.
- Para eliminar los minerales del hueso y preparar secciones de parafina de alta calidad, descalcifique las muestras en veinte volúmenes de una solución de EDTA al 4% (pH 7,3) durante 20 días en tubos de microcentrífuga, cambie el EDTA cada 4 días40.
- Incruste las muestras en parafina. Cortar secciones de 5 μm del área M2 y teñirlas con hematoxilina y eosina (H&E)41.
7. Análisis de datos
- Observar las secciones histológicas teñidas bajo un microscopio óptico para realizar un análisis descriptivo de los cambios en la configuración del epitelio del surco, las fibras gingivales, las fibras periodontales, la altura y la integridad de la cresta alveolar.
- Determine la pérdida de inserción (AL) midiendo la distancia entre la unión del cementoesmalte (CEJ) y el punto más alto de la cresta ósea. Dibuja una línea entre estos dos puntos usando un programa de edición digital. Realizar análisis histométricos de las superficies bucal y palatina, según la metodología descrita por Semenoff et al.42 (Figura 4).
8. Análisis estadístico
- Analizar los datos obtenidos de los grupos CTL y PT mediante la prueba U de Mann-Whitney. Considere p < 0,05 como estadísticamente significativo. Utilice software de estadísticas y gráficos para el análisis.
Resultados
Esta metodología permite que los ratones inducidos desarrollen periodontitis (TP) a partir de la segunda semana. Los ratones fueron monitoreados semanalmente para verificar la presencia de la ligadura. La eutanasia se realizó el día 30. Se evaluaron las características clínicas de todos los grupos. El grupo control mantuvo características normales, como el color y la estructura de la encía marginal, a lo largo del tiempo. En comparación con los del grupo CTL, los tejidos del grupo PT mostraron inflamación, sangrado y formación de bolsas periodontales, que se observaron en el margen gingival en los ratones inducidos (Figura 5).
La evolución de la enfermedad se confirmó mediante la realización de un análisis histológico e histométrico de la AL del tejido periodontal de M2 en ambos grupos. El grupo CTL presentó características histológicas similares a las de los tejidos sanos: el epitelio de la encía marginal y del surco, las fibras gingivales (Figura 6A, flecha azul CTL), el epitelio de unión y la cresta alveolar (Figura 6A, flecha verde CTL); las fibras del tejido conectivo estaban en una posición y altura normales; Las fibras de Sharkey estaban intactas en su inserción en el hueso alveolar y el cemento de la raíz; y se observó un grosor simétrico alrededor de la raíz (Figura 6A, flecha naranja CTL), particularmente en la unión tanto en la vista bucal como en la palatina. Los núcleos celulares de las fibras del ligamento periodontal (PDL), el tejido conectivo y los osteocitos del hueso alveolar eran claramente visibles (40x). En el grupo PT, los tejidos periodontales presentaron daño severo, con presencia de bolsas periodontales, caracterizadas por pérdida de la cresta alveolar (Figura 6A, PT, flecha verde), migración apical del epitelio y desprendimiento de fibras de Sharkey en la superficie de la raíz (Figura 6A, PT, flecha naranja). En el tejido conectivo, la encía y el hueso de los lados bucal y palatino carecían de núcleos celulares (Figura 6A, PT, flecha azul), todos los cuales son característicos de la enfermedad periodontal.
El análisis histométrico reveló que, para el grupo CTL, la posición de la cresta ósea era constante en ambos lados: bucal y palatino. Además, en comparación con el grupo CTL, el grupo PT presentó un aumento significativo en la profundidad AL de la superficie bucal (p = 0,0001, 117,5 nm ± 6 vs. 209,17 nm ± 10) debido a la pérdida de tejido. En comparación con la del grupo CTL, la superficie palatina del grupo PT fue significativamente mayor (p = 0,03, 175,25 nm ± 8 vs. 254,03 nm ± 50). Aunque ambos lados presentaron destrucción tisular, fue más evidente en la superficie palatina, con mayor profundidad y mayor pérdida de inserción, que en la superficie bucal (Figura 6B,C). Estos hallazgos son consistentes con nuestros resultados publicados previamente que mostraron un comportamiento similar28.
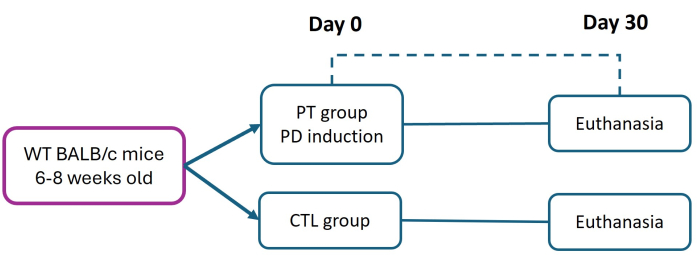
Figura 1: Diseño experimental. La periodontitis (TP) se indujo en ratones BALB/c de seis a ocho semanas de edad (16 g) utilizando el modelo de ligadura de nylon 6-0 (día 0). Treinta días después de la inducción, se sacrificó a ratones PT y sanos (CTL) para la evaluación del tejido periodontal. Se realizaron tres experimentos independientes; el número total de ratones en los grupos CTL y PT fue n = 9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Procedimiento paso a paso para la colocación de ligaduras para inducir periodontitis. Imágenes representativas de la secuencia de pasos utilizados para inducir la periodontitis en el segundo molar superior del ratón: (A) muestra cómo se inserta la sutura de nylon 6-0 distal a M2, desde el palatino hasta el bucal; (B) muestra cómo se debe aplicar suavemente la presión debajo del área de contacto; (C) muestra cómo la sutura de nylon debe pasar a través de la parte mesial de M2, desde el palatino hasta el bucal; y (D) muestra cómo se ajusta la sutura de nailon alrededor de M2 y se asegura con un nudo triple para que actúe como ligadura. Haga clic aquí para ver una versión más grande de esta figura.
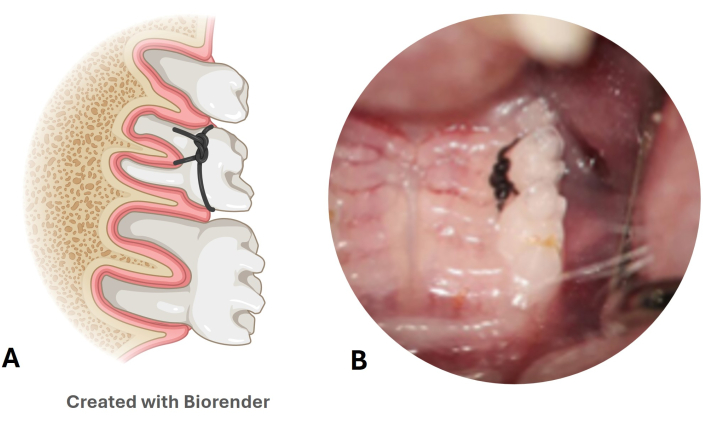
Figura 3: Modelo de enfermedad periodontal de ligadura de nylon. (A) Ilustración de la posición de la ligadura en el segundo molar superior. (B) Imagen de la ligadura de nylon colocada en un modelo de ratón. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Análisis histométrico. La pérdida de inserción (AL) se determinó considerando la distancia entre la unión cemento-esmalte (CEJ) y el punto más cercano de la cresta alveolar, trazando una línea entre ambos puntos en las superficies bucal y palatina. Para referencia: V(B): bucal, P palatino. Ampliación: 10x; barra de escala = 100 μm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Desarrollo de signos clínicos de periodontitis en ratones WT. Imagen clínica representativa de los tejidos periodontales, control CTL; PT, enfermedad periodontal día 1 después de la colocación de la sutura de nylon 6-0; Día 30 después de la retirada de la sutura. Se realizaron imágenes representativas de tres experimentos independientes; el número total de ratones en los grupos CTL y PT fue n = 9. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Los tejidos periodontales mostraron pérdida de inserción y daño tisular en el modelo de periodontitis inducida por nylon. (A) Imágenes histológicas representativas con tinción de H&E de tejidos periodontales, control (CTL); periodontitis (PT), panel izquierdo 10x, se muestra análisis histométrico, con una línea desde la unión cemento-esmalte (CEJ) hasta el borde de la cresta alveolar, bucal (B), palatina (P), indicada en la caja azul bucal roja caja palatina. Paneles derechos bucales y palatinos con un aumento cercano de 40x. Flecha azul, tejido conectivo; flecha naranja, inserción del ligamento periodontal en el cemento radicular; flecha verde, cresta de hueso. Barras de escala = 100 μm. (B, C) Análisis histométrico de la CEJ y el punto más alto de la cresta alveolar. Se realizó una imagen representativa de tres experimentos independientes; el número total de ratones en los grupos CTL y PT fue n = 9. Los datos se expresan como medias ± SEMs, y los valores de *p < 0,05 y ****p < 0,0001 se consideraron estadísticamente significativos según la prueba U de Mann-Whitney. Haga clic aquí para ver una versión más grande de esta figura.
| Material | Inducción | Ventajas | Desventajas |
| Seda | Pasando por el espacio interproximal | Alta adherencia bacteriana | Requiere habilidad para insertar |
| Sutura multifilamento | Se rompe fácilmente | ||
| Origen natural | Pérdida de ligadura | ||
| Alambre ortodóntico | Inserción en la zona interdental | Más fácil de colocar | Necesita una inserción cuidadosa para evitar daños en los tejidos. |
| Resistente | |||
| Nailon | Inserción bajo el punto de contacto | Más fácil de colocar | Requiere aumento |
| No hay daño tisular por el material | El nudo se puede desplazar | ||
| Resistente y flexible | |||
| Adherencia de las bacterias periodontales |
Tabla 1: Diferentes materiales utilizados para inducir la enfermedad periodontal por ligadura en ratones.
Discusión
Se han utilizado varios modelos animales de periodontitis para evaluar diferentes aspectos, como las respuestas microbiológicas e inmunitarias, y tienen algunas similitudes con la enfermedad humana43. Estos hallazgos proporcionan evidencia del marco de la enfermedad periodontal, como el papel de las biopelículas, la respuesta inmune y las interacciones con las condiciones sistémicas44,45.
Los modelos animales de periodontitis tienen diferentes complejidades y similitudes; Por ejemplo, los primates no humanos, los perros o los cerdos miniatura son los más parecidos a la enfermedad periodontal humana19, aunque el costo y los requisitos para manipularlos y mantenerlos hacen que estos modelos sean poco prácticos. Además, los modelos de ratón de periodontitis son menos costosos y más fáciles de manejar. Además, los ratones pueden ser modificados genéticamente para generar una molécula o célula específica de interés46, y la metodología está bien establecida47.
Aunque los ratones no desarrollan TP de forma natural, puede ser inducido por diferentes metodologías; El modelo más utilizado es el modelo inducido por ligadura, que es altamente reproducible 22,23, ya que se han utilizado varios materiales, como el alambre ortodóncico, la seda o el nylon, entre otros.
En particular, el nailon puede ser una opción viable para inducir la TP; debido a algunas de sus características, como monofilamento sintético, tiene una respuesta tisular mínima y permite la adhesión de bacterias periodontales como Fusobacterium nucleatum y Porphyromona intermedia35,36. Esto permite que la respuesta inflamatoria conduzca a una acumulación bacteriana "normal".
Este estudio propone una alternativa para desarrollar TP mediante el uso de una sutura de nylon 6-0 como modelo de inducción, y analizamos los datos clínicos e histológicos de ratones CTL y PT. Se identificaron las características de los márgenes gingivales presentes en el grupo de TP, como sangrado, inflamación y formación de bolsas periodontales. Estas observaciones fueron corroboradas a través de un análisis histométrico. En particular, el grado de pérdida de TP fue significativamente diferente; Aunque tanto la superficie bucal como la palatina mostraron destrucción tisular, fue mayor en la superficie palatina. Esto se debe probablemente a que la pared bucal es más ancha en los ratones que en los humanos.
Lima et al.31 reportaron que las ligaduras de nylon indujeron TP; aunque utilizaron una sutura 5-0, colocaron el nudo en la superficie bucal y midieron la pérdida ósea lineal 6 micro-CT a los 15 días. Si bien se utilizaron suturas de nylon 6-0, el nudo se colocó en la superficie palatina y se realizó un análisis histométrico a los 30 días para inducir TP severo. Los resultados revelaron que las suturas de nylon 6-0 alrededor de M2 dieron lugar a TP. Liberman et al. no informaron diferencias entre los métodos utilizados para evaluar la pérdida ósea48.
Estos resultados muestran que el modelo propuesto es reproducible y tiene varias ventajas. En primer lugar, es más fácil de usar porque es similar a usar un enhebrador; Por lo tanto, no necesariamente empuja la sutura hacia el espacio interproximal, lo que aumenta el riesgo de lesiones en la cavidad bucal del ratón debido al espacio limitado. En segundo lugar, este modelo permite el desarrollo de TP a través de la acumulación de biofilms de forma natural e induce inflamación crónica en los tejidos periodontales.
Este modelo tiene varias limitaciones, incluida la curva de aprendizaje, la necesidad de ayudas visuales y los desafíos asociados con el uso de microscopios o lupas. Además, existe la posibilidad de perder los nudos y ligaduras, por lo que es fundamental verificar la permanencia de la ligadura para asegurar la presencia continuada del estímulo irritante.
En resumen, este protocolo describe los pasos necesarios para establecer un modelo robusto de TP avanzado inducido por una sutura de nylon 6-0, que facilita la colocación de la ligadura. También se detalla la metodología para la administración de anestésicos, la magnificación y la evaluación de la pérdida de inserción. Además, este modelo se puede utilizar para investigar los mecanismos específicos del huésped implicados en la pérdida ósea inflamatoria por TP, así como el papel del TP en el desarrollo de enfermedades o trastornos de origen infeccioso, neoplásico, autoinmune u hormonal. Por lo tanto, el uso de este modelo para estudiar el TP causado por la acumulación de biofilm y la inflamación tiene el potencial de generar conocimiento fundamental con implicaciones terapéuticas y mejorar el diagnóstico.
Divulgaciones
Los autores declaran que no existen conflictos de intereses con respecto a la publicación de este artículo.
Agradecimientos
Este trabajo fue financiado en parte por el Consejo de Ciencia y Tecnología del Estado de México (COMECYT) número de subvención [FICDTEM-2021-072] y el Programa de Apoyo a Proyectos de Investigación e Innovación Tecnológica (PAPIIT)-UNAM, número de subvención [IN-217021]. Agradecemos al programa de especialización en Endoperiodoncia, FES Iztacala, UNAM por las facilidades brindadas para realizar este video y a Rosalba Yañez Ortiz, DDS, por su apoyo en la realización de este video. Algunas figuras fueron creadas con el programa Biorender (Acuerdo número ME282NWCI1).
Materiales
| Name | Company | Catalog Number | Comments |
| 0.9% NaCl solution | PiSA | Rinse maxillae | |
| 6-0 nylon suture | Atramat, Internacional Farmacéutica | PE1946-N | Ligature placement |
| Amscope 3.7 program for digital camera | Amscope | x64, 4.11.21973.20230107 | Data colection |
| EDTA solution | Sigma–Aldrich | E5134 | Decalcification |
| Fine scissors | generic | To cut the 6-0 nylon suture | |
| Fine tweezers | generic | 6-0 nylon suture | |
| Gauze pad | generic | To keep corporal tempature | |
| GraphPad Prism | GraphPad Prism | Version 8.3.0 | Data analysis |
| Hypromellose | generic | Eye lubricant | |
| Injectable water | Pisa | Dilution of anesthetic solution | |
| Ketamine | Anesket, Pisa | Anesthetic | |
| Micro centrifuge tubes | Cellpro | 801501 | To contain tissues durin decalcification |
| Micropore | 3M | 1533 | To fix mouse |
| Microscope digital camera | Amscope | MU1603 | Histology |
| Microtubes | Axygen | MCT-150-C | Store anesthetic dilution |
| Optical microscope | UNICO | Serie G380 | Histology |
| Orhodontic elastics | TP Orthodintics, Inc | blue | To keep the snout open |
| Paraformaldehyde solution | Sigma–Aldrich | 158127 | Tissue Fixation |
| Paraplast | Leica | 39601006 | Histology |
| Surgical microscope | Carl Zeiss GmbH Berlin | 6-0 nylon suture | |
| Ultra Fine Insulin Syringes 6mm U-100, 0.3 mL | BD | 326385 | To inject the anesthetic solution |
| Universal rubber bands | generic | To keep the snout open | |
| Worktable | Generic | Wooden base to support mice | |
| Xylazine | Porcin, Pisa | Preanesthetic |
Referencias
- Nazir, M., et al. Global prevalence of periodontal disease and lack of its surveillance. Sci World J. 2020 (1), 2146160(2020).
- Tonetti, M. S., Jepsen, S., Jin, L., Otomo-Corgel, J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 44 (5), 456-462 (2017).
- Caton, J. G., et al. A new classification scheme for periodontal and peri-implant diseases and conditions - introduction and key changes from the 1999 classification. J Clin Periodontol. 45 (Suppl 20), S1-S8 (2018).
- Harrel, S. K., Cobb, C. M., Sottosanti, J. S., Sheldon, L. N., Rethman, M. P. Clinical decisions based on the 2018 classification of periodontal diseases. Compend Contin Educ Dent. 43 (1), 52-56 (2022).
- Stöhr, J., Barbaresko, J., Neuenschwander, M., Schlesinger, S. Bidirectional association between periodontal disease and diabetes mellitus: A systematic review and meta-analysis of cohort studies. Sci Rep. 11 (1), 13686(2021).
- Sanz, M., et al. Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol. 47 (3), 268-288 (2020).
- Figuero, E., Han, Y. W., Furuichi, Y. Periodontal diseases and adverse pregnancy outcomes: Mechanisms. Periodontol 2000. 83 (1), 175-188 (2000).
- Jung, E., et al. The etiology of preeclampsia. Am J Obstet Gynecol. 226 (2s), S844-S866 (2022).
- Hajishengallis, G., Chavakis, T. Local and systemic mechanisms linking periodontal disease and inflammatory comorbidities. Nat Rev Immunol. 21 (7), 426-440 (2021).
- Arjunan, P., et al. Exacerbation of AMD phenotype in lasered CNV murine model by dysbiotic oral pathogens. Antioxidants. 10 (2), 309(2021).
- Ma, K. S., et al. Dementia and the risk of periodontitis: A population-based cohort study. J Dent Res. 101 (3), 270-277 (2022).
- Hajishengallis, G. Illuminating the oral microbiome and its host interactions: Animal models of disease. FEMS Microbiol Rev. 47 (3), fuad018(2023).
- Hajishengallis, G., Lamont, R. J., Graves, D. T. The enduring importance of animal models in understanding periodontal disease. Virulence. 6 (3), 229-235 (2015).
- Weinberg, M. A., Bral, M. Laboratory animal models in periodontology. J Clin Periodontol. 26 (6), 335-340 (1999).
- Shanbhag, S., et al. Peri-implant bone regeneration in pigs. Int J Implant Dent. 10 (1), 55(2024).
- Do, M. J., et al. Development of animal experimental periodontitis models. J Periodontal Implant Sci. 43 (4), 147-152 (2013).
- Khuda, F., Baharin, B., Anuar, N. N. M., Satimin, B. S. F., Nasruddin, N. S. Effective modalities of periodontitis induction in rat model. J Vet Dent. 41 (1), 49-57 (2024).
- Marchesan, J., et al. An experimental murine model to study periodontitis. Nat Protoc. 13 (10), 2247-2267 (2018).
- Martuscelli, G., Fiorellini, J. P., Crohin, C. C., Howell, T. H. The effect of interleukin-11 on the progression of ligature-induced periodontal disease in the beagle dog. J Periodontol. 71 (4), 573-578 (2000).
- Lin, P., et al. Application of ligature-induced periodontitis in mice to explore the molecular mechanism of periodontal disease. Int J Mol Sci. 22 (16), 8900(2021).
- Wong, R. L., et al. Comparing the healing potential of late-stage periodontitis and peri-implantitis. J Oral Implantol. 43 (6), 437-445 (2017).
- Chadwick, J. W., Glogauer, M. Robust ligature-induced model of murine periodontitis for the evaluation of oral neutrophils. J Vis Exp. (155), e59667(2020).
- De Almeida, K., et al. Identification of microRNAs expressed in an animal model of periodontal disease and their impact on pathological processes. Tissue Cell. 90, 102525(2024).
- Yoon, H., et al. Temporal changes of periodontal tissue pathology in a periodontitis animal model. J Periodontal Implant Sci. 53 (4), 248-258 (2023).
- Benzen, B. H., et al. A comparison of two models of experimental periodontitis in rats. Scand J Lab Anim Sci. 32 (2), 73-80 (2005).
- Franca, L. F. C., et al. Periodontitis changes renal structures by oxidative stress and lipid peroxidation. J Clin Periodontol. 44 (6), 568-576 (2017).
- Abe, T., Hajishengallis, G. Optimization of the ligature-induced periodontitis model in mice. J Immunol Methods. 394 (1-2), 49-54 (2013).
- Ortiz-Sánchez, B. J., et al. Periodontitis exacerbation during pregnancy in mice: Role of macrophage migration inhibitory factor as a key inductor. J Periodontal Res. 59 (2), 267-279 (2023).
- Lu, H., et al. Chronic stress accelerates ligature-induced periodontitis by suppressing glucocorticoid receptor-α signaling. Exp Mol Med. 48 (3), e223(2016).
- França, A. L. Q., et al. Molecular docking study and antireabsorptive activity of a semi-synthetic coumarin derivative from Platymiscium floribundum in the ligature-induced periodontitis in rats: The involvement of heme oxygenase-1. Clin Oral Investig. 26 (2), 1701-1711 (2022).
- Lima, M. L. S., et al. The receptor at1 appears to be important for the maintenance of bone mass, and at2 receptor function in periodontal bone loss appears to be regulated by at1 receptor. Int J Mol Sci. 22 (23), 12849(2021).
- Faris, A., et al. Characteristics of suture materials used in oral surgery: Systematic review. Int Dent J. 72 (3), 278-287 (2022).
- Nadafpour, N., Montazeri, M., Moradi, M., Ahmadzadeh, S., Etemadi, A. Bacterial colonization on different suture materials used in oral implantology: A randomized clinical trial. Front Dent. 18, 25(2021).
- Naghsh, N., Yaghini, J., Arab, A., Soltani, S. Comparison of the number of bacterial colonies among four types of suture threads using simple loop method following periodontal surgery in patients with periodontitis: A single-blind randomized clinical trial. Dent Res J (Isfahan). 20, 71(2023).
- De Castro Costa Neto, O., et al. Oral bacteria adherence to suture threads: An in vitro study. Oral Maxillofac Surg. 19 (3), 275-280 (2015).
- Asher, R., Chacartchi, T., Tandlich, M., Shapira, L., Polak, D. Microbial accumulation on different suture materials following oral surgery: A randomized controlled study. Clin Oral Investig. 23 (2), 559-565 (2019).
- Banche, G., et al. Microbial adherence on various intraoral suture materials in patients undergoing dental surgery. J Oral Maxillofac Surg. 65 (8), 1503-1507 (2007).
- Kaur Randhawa, R., et al. Assessment of the mechanical properties of different suture materials for oral surgery: An in vitro tensile strength study. Cureus. 16 (8), e65952(2024).
- Liu, Y., et al. Using inducible osteoblastic lineage-specific stat3 knockout mice to study alveolar bone remodeling during orthodontic tooth movement. J Vis Exp. (197), e65613(2023).
- Wang, S. K., et al. Itgb6 loss-of-function mutations cause autosomal recessive amelogenesis imperfecta. Hum Mol Genet. 23 (8), 2157-2163 (2014).
- Sadeghipour, A., Babaheidarian, P. Making formalin-fixed, paraffin-embedded blocks. Methods Mol Biol. 1897, 253-268 (2019).
- Semenoff, T. A., et al. Histometric analysis of ligature-induced periodontitis in rats: A comparison of histological section planes. J Appl Oral Sci. 16 (4), 251-256 (2008).
- Oz, H. S., Puleo, D. A. Animal models for periodontal disease. J Biomed Biotechnol. 2011, 754857(2011).
- Zhao, P., Xu, A., Leung, W. K. Obesity, bone loss, and periodontitis: The interlink. Biomolecules. 12 (7), 865(2022).
- Graves, D. T., Corrêa, J. D., Silva, T. A. The oral microbiota is modified by systemic diseases. J Dent Res. 98 (2), 148-156 (2019).
- Yoshimi, K., Mashimo, T. Application of genome editing technologies in rats for human disease models. J Hum Genet. 63 (2), 115-123 (2018).
- Vandamme, T. F. Rodent models for human diseases. Eur J Pharmacol. 759, 84-89 (2015).
- Liberman, D. N., Pilau, R. M., Orlandini, L. F., Gaio, E. J., Rösing, C. K. Comparison of two methods for alveolar bone loss measurement in an experimental periodontal disease model in rats. Braz Oral Res. 25 (1), 80-84 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados